Характеристика алюминия химия: Алюминий – общая характеристика элемента, химические свойства » HimEge.ru
alexxlab | 01.02.1985 | 0 | Разное
Алюминий: химические свойства и способность вступать в реакции с другими веществами
[Deposit Photos]Металлы относятся к удобным для обработки материалам, и лидером среди них является алюминий, химические свойства которого давно известны людям. Этот металл, благодаря своим характеристикам, широко применяется в быту, и отыскать у себя дома изделие из алюминия сможет почти каждый человек. Следует детально рассмотреть свойства этого металла как элемента и как простого вещества.
[Deposit Photos]Как был открыт алюминий
С давних времен люди использовали алюмокалиевые квасцы — соединение алюминия, способное придавать прочность и устойчивость тканям и коже. Такое свойство металла нашло свое применение в кожевничестве: с помощью алюмокалиевых квасцов скорняки выделывали кожу, придавая ей прочность и устойчивость. О том, что оксид алюминия присутствует в природе в чистом виде, люди узнали только во второй половине XVIII столетия, но получать чистое вещество в те времена еще не научились.
О том, что оксид алюминия присутствует в природе в чистом виде, люди узнали только во второй половине XVIII столетия, но получать чистое вещество в те времена еще не научились.
Впервые это удалось сделать Хансу Кристиану Эрстеду, который обработал соль амальгамой калия, выделив затем из полученной смеси порошок серого цвета. Таким образом, данная химическая реакция помогла добыть чистый алюминий. В то же время были установлены такие характеристики металла, как высокая восстановительная способность и сильная активность.
После открытия металла работу Эрстеда по получению алюминия продолжал Фридрих Вёлер: в 1827 году он получил алюминиевый порошок, а в 1845-м — шарики металла. А первый промышленно значимый эксперимент был поставлен французским ученым Девилем в 1854 году. Именно этот выдающийся химик предложил электрохимический способ получения алюминия и сумел изготовить первые слитки металла (данный способ сохранил свою актуальность и в наши дни).
В XX столетии началось промышленное производство алюминия, который сразу же стал высоко цениться за свои уникальные свойства. Этот металл в настоящее время активно применяется в быту и промышленности: машиностроении, авиации, приборостроении, электротехнической промышленности и многих других сферах жизнедеятельности человека. Здесь вы найдете увлекательные эксперименты с алюминием.
Этот металл в настоящее время активно применяется в быту и промышленности: машиностроении, авиации, приборостроении, электротехнической промышленности и многих других сферах жизнедеятельности человека. Здесь вы найдете увлекательные эксперименты с алюминием.
Атом алюминия и его общая характеристика
Чтобы понять, что из себя представляет атом алюминия, необходимо выделить из периодической системы Менделеева несколько его основных характеристик:
- порядковым номером металла является цифра 13;
- элемент расположен в третьем малом периоде, главной подгруппе, третьей группе;
- атомная масса элемента – 26,98;
- у элемента сильно выражены металлические свойства;
- алюминий имеет всего 27 изотопов с разными массовыми числами;
- элемент встречается в двух степенях окисления: 0 и +3.
Алюминий и его химические свойства
[Deposit Photos]Если рассматривать химические реакции, чистый алюминий — это сильный восстановитель, проявляющий высокую химическую активность в свободном виде. Чтобы многократно усилить его активность, необходимо убрать оксидную пленку. Алюминий способен вступать в реакции с серой, галогенами, кислотами и щелочами. В обычных условиях данный металл не способен взаимодействовать с водой, без нагревания может вступать в реакцию только с тремя галогенами: хлором, бромом и йодом. Важной химической характеристикой алюминия является способность металла восстанавливать некоторые другие элементы, а также их соединения.
Чтобы многократно усилить его активность, необходимо убрать оксидную пленку. Алюминий способен вступать в реакции с серой, галогенами, кислотами и щелочами. В обычных условиях данный металл не способен взаимодействовать с водой, без нагревания может вступать в реакцию только с тремя галогенами: хлором, бромом и йодом. Важной химической характеристикой алюминия является способность металла восстанавливать некоторые другие элементы, а также их соединения.
В какие реакции вступает алюминий
Взаимодействие с неметаллами: алюминий реагирует с углеродом, серой, азотом и остальными неметаллами (со многими – только после нагревания, без которого реакция не произойдет). В результате реакции происходит выделение большого количества тепла.
Взаимодействие с кислотами (например, с соляной): в результате выделяется водород.
via GIPHY
Взаимодействие с оксидами реакция замещения атомов металла в оксиде на алюминий позволяет получить большое количество теплоты и новый металл в свободном виде.
Взаимодействие с солями, а именно с растворами некоторых менее активных солей.
Взаимодействие со щелочами: по причине сильного взаимодействия с растворами щелочей, их растворы нельзя хранить в посуде из алюминия.
Алюминотермия — процесс восстановления металлов, сплавов и неметаллов посредством воздействия на их оксиды металлическим алюминием. Благодаря данной особенности алюминия, металлурги могут добывать такие тугоплавкие металлы, как молибден, вольфрам, цирконий, ванадий.
Физические свойства алюминия как простого вещества
В качестве простого вещества алюминий представляет собой металл серебристого цвета. Он способен окисляться на воздухе, покрываясь плотной оксидной пленкой.
Данная особенность металла обеспечивает его высокую стойкость к коррозии. Это свойство алюминия, наравне с другими характеристиками, делает его чрезвычайно популярным металлом, широко применяемым в быту. Кроме того, алюминий имеет легкий вес, сохраняя при этом высокую прочность и пластичность.
via GIPHY
Далеко не каждое известное людям вещество имеет совокупность подобных характеристик.
Физические свойства алюминия
Алюминий — пластичный и ковкий металл, применяется для изготовления тончайшей фольги, из алюминия прокатывают проволоку.
Температура кипения металла составляет 2518 °С.
Температура плавления алюминия составляет 660 °С.
Плотность алюминия составляет 2,7 г/см³.
Широкое применение алюминия в сферах жизнедеятельности обусловлено его химическими и физическими свойствами.
Характеристика алюминия. Алюминий: общая характеристика
Каждый химический элемент можно рассмотреть с точки зрения трех наук: физики, химии и биологии. И в этой статье мы постараемся как можно точнее дать характеристику алюминию. Это химический элемент, находящийся в третьей группе и третьем периоде, согласно таблице Менделеева. Алюминий – металл, который обладает средней химической активностью. Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Физическая характеристика алюминия
При нормальных условиях он представляет собой твердое вещество. Формула алюминия очень проста. Он состоит из атомов (не объединятся в молекулы), которые выстроены с помощью кристаллической решетки в сплошное вещество. Цвет алюминия – серебристо-белый. Кроме того, он обладает металлическим блеском, как и все другие вещества данной группы. Цвет алюминия, используемого в промышленности, может быть различным в связи с присутствием в сплаве примесей. Это достаточно легкий металл.
Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Плавление алюминия происходит при температуре всего в 660 градусов по шкале Цельсия. А закипает он при нагревании до температуры две тысячи четыреста пятьдесят два градуса по Цельсию. Это очень пластичный и легкоплавкий металл. На этом физическая характеристика алюминия не заканчивается. Еще хотелось бы отметить, что данный металл обладает самой лучшей после меди и серебра электропроводностью.
Распространенность в природе
Алюминий, технические характеристики которого мы только что рассмотрели, достаточно часто встречается в окружающей среде. Его можно наблюдать в составе многих минералов. Элемент алюминий – четвертый среди всех по распространенности в природе. Его массовая доля в земной коре составляет почти девять процентов. Основные минералы, в составе которых присутствуют его атомы, это боксит, корунд, криолит. Первый – это горная порода, которая состоит из оксидов железа, кремния и рассматриваемого металла, также в структуре присутствуют молекулы воды. Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы – алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.
Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы – алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.
Это оксид алюминия. Его химическая формула – Al2O3. Он может обладать красным, желтым, голубым либо коричневым цветом. Его твердость по шкале Мооса составляет девять единиц. К разновидностям корунда относятся всем известные сапфиры и рубины, лейкосапфиры, а также падпараджа (желтый сапфир).
Криолит – это минерал, имеющий более сложную химическую формулу. Он состоит из фторидов алюминия и натрия – AlF3•3NaF. Выглядит как бесцветный или сероватый камень, обладающий низкой твердостью – всего три по шкале Мооса. В современном мире его синтезируют искусственно в лабораторных условиях. Он применяется в металлургии.
Также алюминий можно встретить в природе в составе глин, основным компонентов которых являются оксиды кремния и рассматриваемого металла, связанные с молекулами воды. Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Получение
Характеристика алюминия предусматривает рассмотрение способов его синтеза. Существует несколько методов. Производство алюминия первым способом происходит в три этапа. Последним из них является процедура электролиза на катоде и угольном аноде. Для проведения подобного процесса необходим оксид алюминия, а также такие вспомогательные вещества, как криолит (формула – Na3AlF6) и фторид кальция (CaF2). Для того чтобы произошел процесс разложения растворенного в воде оксида алюминия, нужно его вместе с расплавленным криолитом и кальция фторидом нагреть до температуры минимум в девятьсот пятьдесят градусов по шкале Цельсия, а затем пропустить сквозь эти вещества ток силой в восемьдесят тысяч ампер и напряжением в пять-восемь вольт. Таким образом, вследствие данного процесса на катоде осядет алюминий, а на аноде будут собираться молекулы кислорода, которые, в свою очередь, окисляют анод и превращают его в углекислый газ. Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.
Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.
Производство алюминия способом, описанным выше, является очень распространенным в металлургии. Также существует метод, изобретенный в 1827 году Ф. Велером. Он заключается в том, что алюминий можно добыть с помощью химической реакции между его хлоридом и калием. Осуществить подобный процесс можно, только создав специальные условия в виде очень высокой температуры и вакуума. Так, из одного моль хлорида и такого же объема калия можно получить один моль алюминия и три моль хлорида калия как побочного продукта. Данную реакцию можно записать в виде такого уравнения: АІСІ3 + 3К = АІ + 3КСІ. Указанный метод не приобрел большой популярности в металлургии.
Характеристика алюминия с точки зрения химии
Как уже было сказано выше, это простое вещество, которое состоит из атомов, не объединенных в молекулы. Подобные структуры формируют почти все металлы. Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий и простые вещества
К таковым относится, в первую очередь, кислород – самое распространенное соединение на планете. Из него на двадцать один процент состоит атмосфера Земли. Реакции данного вещества с любыми другими называются окислением, или горением. Оно обычно происходит при высоких температурах. Но в случае с алюминием возможно окисление в нормальных условиях – так образуется пленка оксида. Если же данный металл измельчить, он будет гореть, выделяя при этом большое количество энергии в виде тепла. Для проведения реакции между алюминием и кислородом нужны эти компоненты в молярном соотношении 4:3, в результате чего получим две части оксида.
Данное химическое взаимодействие выражается в виде следующего уравнения: 4АІ + 3О2 = 2АІО3. Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Для примера приведем взаимодействие алюминия с хлором. Такого рода процесс может произойти только на холоде.
Так, взяв два моль алюминия и три моль хлора, получим в результате два моль хлорида рассматриваемого металла. Уравнение этой реакции выглядит следующим образом: 2АІ + 3СІ = 2АІСІ3. Таким же способом можно получить фторид алюминия, его бромид и йодид.
С серой рассматриваемое вещество реагирует только при нагревании. Для проведения взаимодействия между этими двумя соединениями нужно взять их в молярных пропорциях два к трем, и образуется одна часть сульфида алюминия. Уравнение реакции имеет такой вид: 2Al + 3S = Al2S3.
Кроме того, при высоких температурах алюминий взаимодействует и с карбоном, образуя карбид, и с азотом, образуя нитрид. Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Взаимодействие со сложными веществами
К ним относятся вода, соли, кислоты, основания, оксиды. Со всеми этими химическими соединениями алюминий реагирует по-разному. Давайте разберем подробнее каждый случай.
Реакция с водой
С самым распространенным на Земле сложным веществом алюминий взаимодействует при нагревании. Происходит это только в случае предварительного снятия пленки из оксида. В результате взаимодействия образуется амфотерный гидроксид, а также в воздух выделяется водород. Взяв две части алюминия и шесть частей воды, получим гидроксид и водород в молярных пропорциях два к трем. Записывается уравнение этой реакции так: 2АІ + 6Н2О = 2АІ(ОН)3 + 3Н2.
Взаимодействие с кислотами, основаниями и оксидами
Как и другие активные металлы, алюминий способен вступать в реакцию замещения. При этом он может вытеснить водород из кислоты либо катион более пассивного металла из его соли. В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
Примером взаимодействия алюминия с солью может служить его реакция с сульфатом меди. Взяв эти два компонента, в итоге мы получим сульфат алюминия и чистую медь, которая выпадет в виде осадка. С такими кислотами, как серная и азотная, алюминий реагирует своеобразно. К примеру, при добавлении алюминия в разбавленный раствор нитратной кислоты в молярном соотношении восемь частей к тридцати образуется восемь частей нитрата рассматриваемого металла, три части оксида азота и пятнадцать – воды. Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Если же смешать алюминий и слабый раствор сульфатной кислоты в молярных пропорциях два к трем, то получим сульфат рассматриваемого металла и водород в соотношении один к трем. То есть произойдет обыкновенная реакция замещения, как и в случае с другими кислотами. Для наглядности приведем уравнение: 2Al + 3h3SO4 = Al2(SO4)3 + 3h3. Однако с концентрированным раствором этой же кислоты все сложнее. Здесь так же, как и в случае с нитратной, образуется побочный продукт, но уже не в виде оксида, а в виде серы, и вода. Если мы возьмем два необходимых нам компонента в молярном соотношении два к четырем, то в результате получим по одной части соли рассматриваемого металла и серы, а также четыре – воды. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2Al + 4h3SO4 = Al2(SO4)3 + S + 4h3O.
Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
И последнее, что нужно рассмотреть, это закономерности взаимодействия алюминия с некоторыми оксидами. Самый распространенный и используемый случай – реакция Бекетова. Она, так же, как и многие другие из рассмотренных выше, происходит только при высоких температурах. Итак, для ее осуществления необходимо взять два моль алюминия и один моль оксида феррума. В результате взаимодействия этих двух веществ получим оксид алюминия и свободное железо в количестве один и два моль соответственно.
Использование рассматриваемого металла в промышленности
Отметим, что применение алюминия – очень частое явление. Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель – на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов.
Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель – на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов.
Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий – второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Роль в природе
Как уже было написано выше, алюминий в большом количестве содержится в земной коре. Он особенно важен для живых организмов. Алюминий участвует в регуляции процессов роста, формирует соединительные ткани, такие, как костная, связочная и другие. Благодаря данному микроэлементу быстрее осуществляются процессы регенерации тканей организма. Его нехватка характеризуется следующими симптомами: нарушения развития и роста у детей, у взрослых – хроническая усталость, пониженная работоспособность, нарушение координации движений, снижение темпов регенерации тканей, ослабевание мышц, особенно в конечностях. Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Однако более частой проблемой является избыток алюминия в организме. При этом нередко наблюдаются такие симптомы: нервозность, депрессия, нарушения сна, снижение памяти, стрессоустойчивости, размягчение опорно-двигательного аппарата, что может привести к частым переломам и растяжениям. При длительном избытке алюминия в организме часто возникают проблемы в работе практически каждой системы органов.
К такому явлению может привести целый ряд причин. В первую очередь это алюминиевая посуда. Учеными уже давно доказано, что посуда, изготовленная из рассматриваемого металла, непригодна для приготовления в ней пищи, так как при высокой температуре часть алюминия попадает в пищу, и вследствие этого вы употребляете намного больше этого микроэлемента, чем нужно организму.
Вторая причина – регулярное применение косметических средств с содержанием рассматриваемого металла или его солей.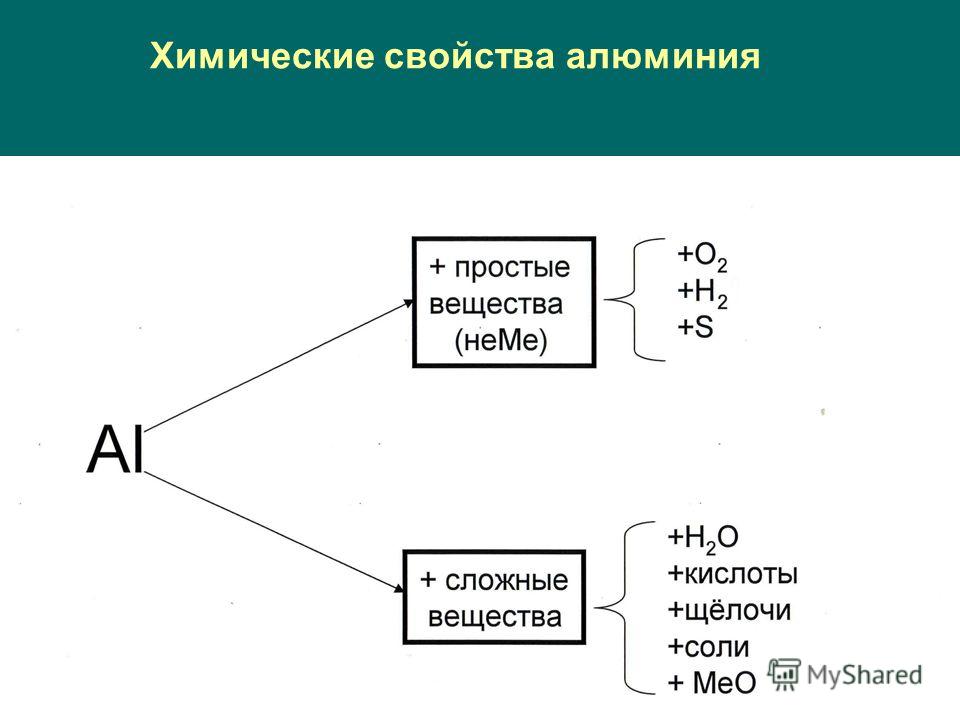 Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Третья причина – прием препаратов, в которых содержится много алюминия, на протяжении длительного времени. А также неправильное употребление витаминов и пищевых добавок, в состав которых входит данный микроэлемент.
Теперь давайте разберемся, в каких продуктах содержится алюминий, чтобы регулировать свой рацион и организовывать меню правильно. В первую очередь это морковь, плавленые сыры, пшеница, квасцы, картофель. Из фруктов рекомендуются авокадо и персики. Кроме того, богаты алюминием белокочанная капуста, рис, многие лечебные травы. Также катионы рассматриваемого металла могут содержаться в питьевой воде. Чтобы избежать повышенного или пониженного содержания алюминия в организме (впрочем, так же, как и любого другого микроэлемента), нужно тщательным образом следить за своим питанием и стараться сделать его как можно более сбалансированным.
Что такое алюминий
Лёгкий, прочный, стойкий к коррозии и функциональный – именно это сочетание качеств сделало алюминий главным конструкционным материалом нашего времени. Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
Ханс Кристиан Эрстед (1777–1851) – датский физик, почетный член Петербургской академии наук (1830). Родился в городе Рудкёрбинге в семье аптекаря. В 1797 году окончил Копенгагенский университет, в 1806 – стал профессором.
Но каким бы распространенным ни был алюминий, его открытие стало возможным только, когда в распоряжении ученых появился новый инструмент, позволяющий расщеплять сложные вещества на простые, – электрический ток.
И в 1824 году с помощью процесса электролиза датский физик Ханс Кристиан Эрстед получил алюминий. Он был загрязнен примесями калия и ртути, задействованных в химических реакциях, однако это был первый случай получения алюминия.
Используя электролиз, алюминий производят и в наши дни.
Сырьем для производства алюминия сегодня служит еще одна распространенная в природе алюминиевая руда – бокситы. Это глинистая горная порода, состоящая из разнообразных модификаций гидроксида алюминия с примесью оксидов железа, кремния, титана, серы, галлия, хрома, ванадия, карбонатных солей кальция, железа и магния – чуть ли не половины таблицы Менделеева. В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
Бокситы в 1821 году открыл геолог Пьер Бертье на юге Франции. Порода получила свое название в честь местности Ле-Бо (Les Baux), где была найдена. Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – в Гвинее, Австралии, Вьетнаме, Бразилии, Индии и на Ямайке.
Из бокситов получают глинозем. Это оксид алюминия Al2O3, который имеет форму белого порошка и из которого путем электролиза на алюминиевых заводах производят металл.
Производство алюминия требует огромного количества электроэнергии. Для производства одной тонны металла необходимо около 15 МВт*ч энергии – столько потребляет 100-квартирный дом в течение целого месяца.Поэтому разумнее всего строить алюминиевые заводы поблизости от мощных и возобновляемых источников энергии. Самое оптимальное решение – гидроэлектростанции, представляющие самый мощный из всех видов «зеленой энергетики».
Свойства алюминия
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
В три раза легче железа
Сравним по прочности со сталью
Поддается всем видам механической обработки
Тонкая оксидная пленка защищает от коррозии
Алюминий легко обрабатывается давлением, причем как в горячем, так и в холодном состоянии. Он поддается прокатке, волочению, штамповке. Алюминий не горит, не требует специальной окраски и не токсичен в отличие от пластика.
Очень высока ковкость алюминия: из него можно изготовить листы толщиной всего 4 микрона и тончайшую проволоку.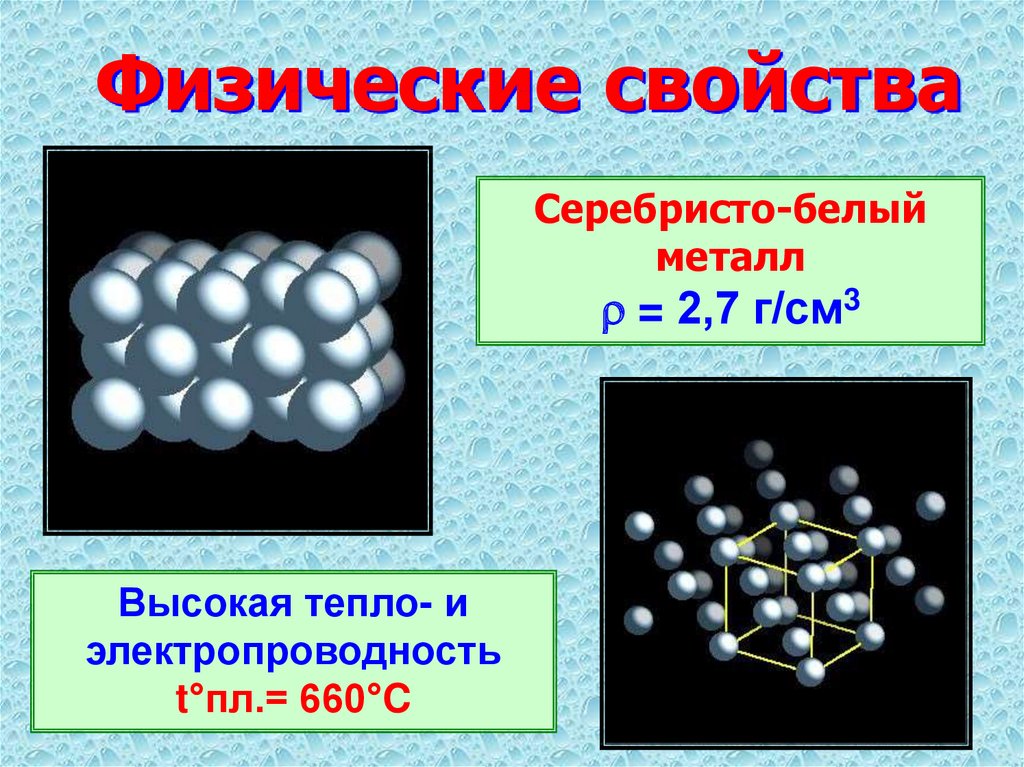 А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
Высокая способность к образованию соединений с различными химическими элементами породила множество сплавов алюминия. Даже незначительная доля примесей существенно меняет характеристики металла и открывает новые сферы для его применения. Например, сочетание алюминия с кремнием и магнием в повседневной жизни можно встретить буквально на дороге – в форме литых колесных дисков, двигателей, в элементах шасси и других частей современного автомобиля. А если добавить в алюминиевый сплав цинк, то, возможно, вы сейчас держите его в руках, ведь именно этот сплав используется при производстве корпусов мобильных телефонов и планшетов. Тем временем ученые продолжают изобретать новые и новые алюминиевые сплавы.
Сегодня существование строительной, автомобильной, авиационной, космической, электротехнической, энергетической, пищевой и других отраслей промышленности невозможно без алюминия.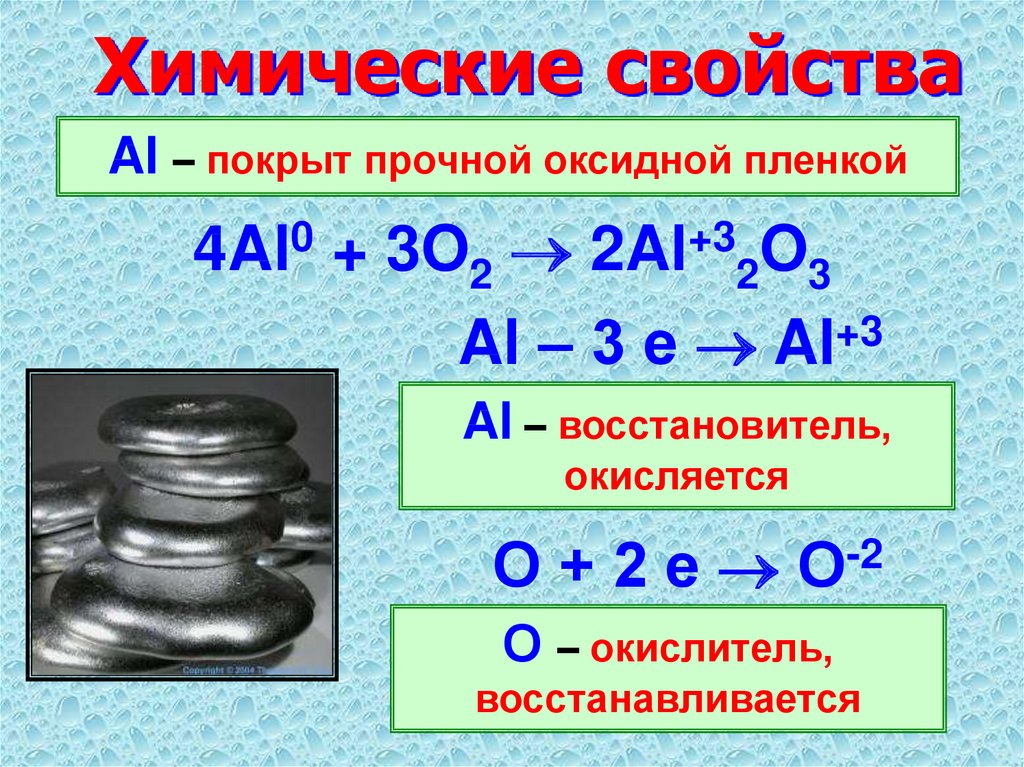 Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Если заменить всю медную проводку в автомобиле
на алюминиево-циркониевую, то его общий
вес уменьшится на 12 кг
По расчетам Международного института алюминия (IAI), в мире накопилось около 400 миллионов тонн алюминия в инфраструктуре, быту, транспорте.
Казалось бы, вышеперечисленный набор характеристик уже сам по себе достаточен для того, чтобы алюминий стал металлом приоритетного выбора в индустрии, однако есть еще одна, не менее значимая характеристика. Использование алюминия может быть бесконечно: этот металл и сплавы из него можно неоднократно переплавлять без утраты механических характеристик. Ученые подсчитали, что 1 кг собранных и сданных в переплавку алюминиевых банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии.
Около 75% алюминия, выпущенного за все время существования отрасли, используется до сих пор.
В статье использованы фотоматериалы © Shutterstock и © Rusal.
Характерные химические свойства алюминия. Характеристика алюминия
Главная > Утепление > Характерные химические свойства алюминия. Характеристика алюминия
Природный алюминий состоит из одного нуклида 27Al. Конфигурация внешнего электронного слоя 3s2p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III).
Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660°C, температура кипения около 2450°C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1 Стандартный электродный потенциал Al 3+/ Al — 1,663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al 2 О 3 , которая препятствует дальнейшему доступу кислорода (O) к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl 3 + 3H 2 ,
3Н 2 SO 4 + 2Al = Al 2 (SO 4) 3 + 3H 2 .
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al 2 О 3 + 2NaOH + 3H 2 O = 2Na.
Затем протекают реакции:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ,
NaOH + Al(OH) 3 = Na,
или суммарно:
2Al + 6H 2 O + 2NaOH = Na + 3Н 2 ,
и в результате образуются алюминаты: Na — алюминат натрия (Na) (тетрагидроксоалюминат натрия), К — алюминат калия (K) (терагидроксоалюминат калия) или др.
Na и К.
При нагревании алюминий реагирует с галогенами:
2Al + 3Cl 2 = 2AlCl 3 ,
2Al + 3 Br 2 = 2AlBr 3 .
Интересно, что реакция между порошками алюминия и иода (I) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:
2Al + 3I 2 = 2AlI 3 .
Взаимодействие алюминия с серой (S) при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al 2 S 3 ,
который легко разлагается водой:
Al 2 S 3 + 6Н 2 О = 2Al(ОН) 3 + 3Н 2 S.
С водородом (H) алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН 3) х — сильнейший восстановитель.
В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al 2 О 3 .
Высокая прочность связи в Al 2 О 3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe 3 O 4 + 8Al = 4Al 2 O 3 + 9Fe и даже
3СаО + 2Al = Al 2 О 3 + 3Са.
Такой способ получения металлов называют алюминотермией.
Амфотерному оксиду Al 2 О 3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl 2 O 3 ·yH 2 O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH) 3 .
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al 2 (SO 4) 3 + 6NaOH = 2Al(OH) 3 + 3Na 2 SO 4 ,
или за счет добавления соды к раствору соли алюминия:
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O = 2Al(OH) 3 + 6NaCl + 3CO 2 ,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl 3 + 3NH 3 ·h3O = Al(OH) 3 + 3H 2 O + 3NH 4 Cl.
Название и история открытия: латинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия (K) KAl(SO 4) 2 ·12H 2 O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия (K) со ртутью (Hg)) хлорид алюминия AlCl 3 , который можно было получить из глинозема, и после отгонки ртути (Hg) выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 году предложил использовать для получения алюминия металлический натрий (Na), и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20-ом веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Этот легкий металл с серебристо-белым оттенком в современной жизни встречается почти повсеместно. Физические и химические свойства алюминия позволяют широко использовать его в промышленности. Самые известные месторождения – в Африке, Южной Америке, в Карибском регионе. В России места добычи бокситов имеются на Урале. Мировыми лидерами по производству алюминия являются Китай, РФ, Канада, США.
Добыча Al
В природе этот серебристый металл в силу своей высокой химической активности встречается лишь в виде соединений. Наиболее известные геологические породы, содержащие алюминий, – это бокситы, глиноземы, корунды, полевые шпаты. Промышленное значение имеют бокситы и глиноземы, именно месторождения этих руд позволяют добывать алюминий в чистом виде.
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком. Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Внутреннее строение алюминия
Физические и химические свойства алюминия во многом зависят от его внутреннего строения. Кристаллическая решетка этого элемента является разновидностью гранецентрированного куба.
Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Легирование алюминия
Физические свойства меди и алюминия таковы, что при добавлении к алюминиевому сплаву некоторого количества меди его кристаллическая решетка искривляется, и прочность самого сплава повышается. На этом свойстве Al основано легирование легких сплавов для повышения их прочности и стойкости к воздействию агрессивной среды.
Объяснение процесса упрочнения лежит в поведении атомов меди в кристаллической решетке алюминия. Частицы Cu стремятся выпасть из кристаллической решетки Al, группируются на ее особых участках.
Частицы Cu стремятся выпасть из кристаллической решетки Al, группируются на ее особых участках.
Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl 2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl 2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Химические свойства
Известно взаимодействие алюминия с разбавленными серной и соляной кислотой. При нагревании этот металл в них легко растворяется. Холодная концентрированная или сильно разбавленная азотная кислота не растворяет этот элемент. Водные растворы щелочей активно воздействуют на вещество, в процессе реакции образуя алюминаты – соли, в составе которых имеются ионы алюминия. Например:
Al 2 O 3 +3h3O+2NaOH=2Na
Получившееся в результате реакции соединение носит название тетрагидроксоалюминат натрия.
Тонкая пленка на поверхности алюминиевых изделий защищает этот металл не только от воздуха, но и от воды. Если эту тонкую преграду убрать, элемент станет бурно взаимодействовать с водой, выделяя из нее водород.
2AL+6H 2 O= 2 AL (OH) 3 +3Н 2
Образовавшееся вещество называется гидроксидом алюминия.
AL (OH) 3 реагирует с щелочью, образуя кристаллы гидроксоалюмината:
Al(OH) 2 +NaOH=2Na
Если это химическое уравнение сложить с предыдущим, получим формулу растворения элемента в щелочном растворе.
Al(OH) 3 +2NaOH+6H 2 O=2Na +3H 2
Горение алюминия
Физические свойства алюминия позволяют ему вступать в реакцию с кислородом. Если порошок этого металла или алюминиевую фольгу нагреть, то она вспыхивает и горит белым ослепительным пламенем. В конце реакции образуется оксид алюминия Al 2 O 3.
Глинозем
Полученный оксид алюминия имеет геологическое название глинозем. В естественных условиях он встречается в виде корунда – твердых прозрачных кристаллов. Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Физические свойства оксида алюминия позволяют выращивать эти драгоценные камни в искусственных условиях. Технические драгоценные камни используются не только для ювелирных украшений, они применяются в точном приборостроении, для изготовления часов и прочего. Широко используются искусственные кристаллы рубина и в лазерных устройствах.
Мелкозернистая разновидность корунда с большим количеством примесей, нанесенная на специальную поверхность, известна всем как наждак. Физические свойства оксида алюминия объясняют высокие абразивные свойства корунда, а также его твердость и устойчивость к трению.
Гидроксид алюминия
Al 2 (OH) 3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.
Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al 2 (OH) 3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Промышленное использование
Алюминий был открыт в 1825 году. Поначалу данный металл ценился выше золота и серебра. Это объяснялось сложностью его извлечения из руды. Физические свойства алюминия и его способность быстро образовывать защитную пленку на своей поверхности затрудняли исследование этого элемента. Лишь в конце 19 века был открыт удобный способ плавки чистого элемента, пригодный для использования в промышленных масштабах.
Легкость и способность сопротивляться коррозии – уникальные физические свойства алюминия. Сплавы этого серебристого металла применяются в ракетной технике, в авто-, судо-, авиа- и приборостроении, в производстве столовых приборов и посуды.
Как чистый металл Al используется при изготовлении деталей для химической аппаратуры, электропроводов и конденсаторов. Физические свойства алюминия таковы, что его электропроводность не так высока, как у меди, но этот недостаток компенсируется легкостью рассматриваемого металла, что позволяет делать провода из алюминия более толстыми. Так, при одинаковой электропроводности алюминиевый провод весит в два раза меньше медного.
Не менее важным является применение Al в процессе алитирования. Так называется реакция насыщения поверхности чугунного или стального изделия алюминием с целью защиты основного металла от коррозии при нагревании.
В настоящее время изведанные запасы алюминиевых руд вполне сопоставимы с потребностями людей в этом серебристом металле.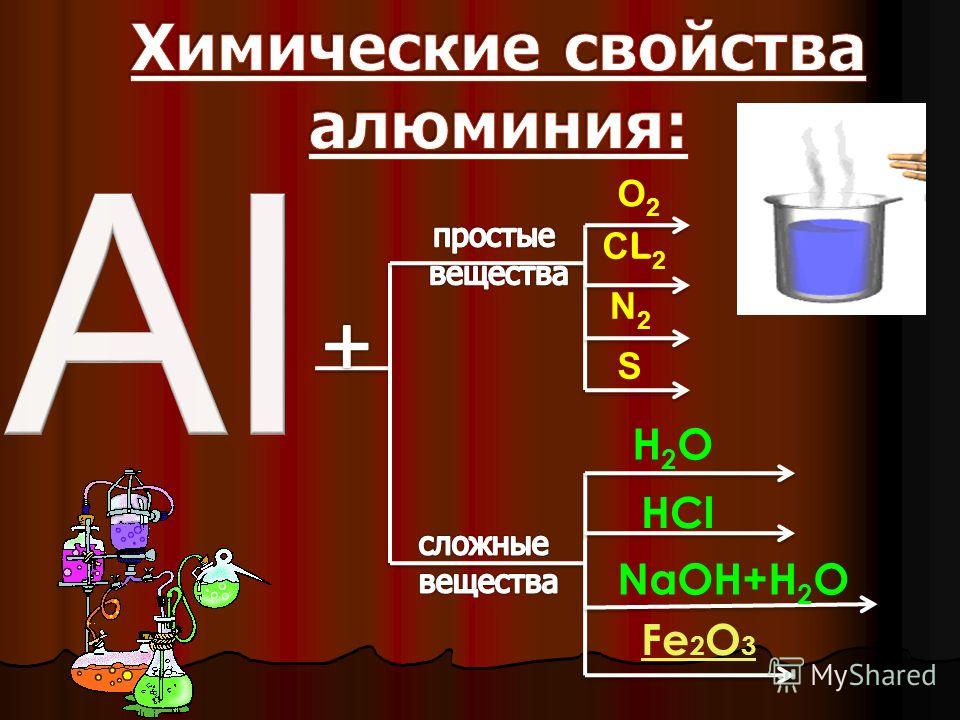 Физические свойства алюминия могут преподнести еще немало сюрпризов его исследователям, а сферы применения этого металла гораздо шире, чем можно представить.
Физические свойства алюминия могут преподнести еще немало сюрпризов его исследователям, а сферы применения этого металла гораздо шире, чем можно представить.
Тип урока . Комбинированный.
Задачи:
Образовательные:
1. Актуализировать знания учащихся о строении атома, физических смыслах порядкового номера, номера группы, номера периода на примере алюминия.
2. Сформировать у учащихся знания о том, что алюминию в свободном состоянии присущи особые, характерные физические и химические свойства.
Развивающие:
1. Возбудить интерес к изучению науки путем предоставления кратких исторических и научных сообщений о прошлом, настоящем и будущем алюминия.
2. Продолжить формирование исследовательских навыков учащихся при работе с литературой, выполнением лабораторной работы.
3. Расширить понятие амфотерности раскрытием электронного строения алюминия, химических свойств его соединений.
Воспитательные:
1. Воспитывать бережное отношение к
окружающей среде, предоставляя сведения
о возможном использовании алюминия
вчера, сегодня, завтра.
Воспитывать бережное отношение к
окружающей среде, предоставляя сведения
о возможном использовании алюминия
вчера, сегодня, завтра.
2. Формировать умения работать коллективом у каждого учащегося, считаться с мнением всей группы и отстаивать свое корректно, выполняя лабораторную работу.
3. Знакомить учащихся с научной этикой, честностью и порядочностью естествоиспытателей прошлого, предоставляя сведения о борьбе за право быть первооткрывателем алюминия.
ПОВТОРЕНИЕ ПРОЙДЕННОГО МАТЕРИАЛЛА по темам щелочные и щелочноземельные М (ПОВТОРЕНИЕ):
Какое количество электронов на внешнем энергетическом уровне щелочных и щелочноземельных М?
Какие продукты образуются при взаимодействии с кислородом натрия или калия? (пероксид), способен ли литий в реакции с кислородом давать пероксид? (нет, в результате реакции образуется оксид лития.)
Как
получают оксиды натрия и калия?
(прокаливанием пероксидов с соответствующими
Ме, Пр: 2Na+Na 2 O 2 =2Na 2 O).
Проявляют ли щелочные и щелочноземельные металлы отрицательные степени окисления? (нет, не имеют, так как являются сильными восстановителями.).
Как изменяется радиус атома в главных подгруппах (сверху вниз) Переодической системы? (увеличивается), с чем это связано? (с увеличением числа энергетических уровней).
Какие из изученных нами групп металлов легче воды? (у щелочных).
При каких условиях идет образование гидридов у щелочноземельных металлов? (при высоких температурах).
Какое вещество кальций или магний активнее реагирует с водой? (более активно реагирует кальций. Магний активно реагирует с водой только при нагревании ее до 100 0 С).
Как изменяется растворимость гидроксидов щелочноземельных металлов в воде, в ряду от кальция до бария? (растворимость в воде увеличивается).
Расскажите
про особенности хранения щелочных и
щелочноземельных металлов, почему их
хранят именно так? (т.к. данные металлы
очень реакциоспособны, то их хранят в
таре под слоем керосина).
КОНТРОЛЬНАЯ РАБОТА по темам щелочные и щелочноземельные М:
КОНСПЕКТ УРОКА (ИЗУЧЕНЕ НОВОГО МАТЕРИАЛА):
Учитель: Здравствуйте ребята, сегодня мы с вами переходим к изучению IIIА подгруппы. Перечислите элементы расположенные в IIIА подгруппе?
Обучаемые: Она включает в себя такие элементы как бор, алюминий, галлий, индий и таллий.
Учитель: Какое число электронов они содержат на внешнем энергетическом уровне, степени окисления?
Обучаемые: Три электрона, степень окисления +3, хотя для таллия более устойчивой является степень окисления +1.
Учитель: Металлические свойства элементов подгруппы бора выражены значительно слабее, чем у элементов подгруппы бериллия. Бор является неМ. В дальнейшем внутри подгруппы с возрастанием заряда ядра М свойства усиливаются. А l – уже М, но не типичный. Его гидроксид обладает амфотерными свойствами.
Из
М главной подгруппы III
группы наибольшее значение имеет
алюминий, свойства которого мы изучим
подробно. Он интересен нам потому, что
является переходным элементом.
Он интересен нам потому, что
является переходным элементом.
ОПРЕДЕЛЕНИЕ
Алюминий расположен в третьем периоде, III группе главной (A) подгруппе Периодической таблицы. Это первый p-элемент 3-го периода.
Металл. Обозначение – Al. Порядковый номер – 13. Относительная атомная масса – 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.
Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
13Al) 2) 8) 3 ;
1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d -орбитали. Однако распаривания электронов 3s -подуровня на деле не происходит.
Однако распаривания электронов 3s -подуровня на деле не происходит.
Примеры решения задач
ПРИМЕР 1
>> Химия: Алюминий
Строение и свойства атомов. Алюминий Аl – элемент главной подгруппы III группы Периодической системы Д. И. Менделеева. Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдает при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия – бора радиус атома меньше (у бора он равен 0,080 нм, у алюминия – 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектрон-ный слой (2е-; 8е-; Зе-), который препятствует притяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий – простое вещество. Серебристо-белый легкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами легкие и прочные сплавы.
Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами легкие и прочные сплавы.
Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
На каких физических и химических свойствах основано применение в технике алюминия и его сплавов?
Напишите в ионном виде уравнения реакций между растворами сульфата алюминия и гидроксида калия при недостатке и избытке последнего.
Напишите уравнения реакций следующих превращений: Аl -> АlСl3 -> Аl(0Н)3 -> Аl2O3 -> NаАl02 -> Аl2(SO4)3 -> Аl(ОН)3 ->АlСl3 ->NаАlO2
Реакции, идущие с участием электролитов, запишите в ионной форме. Первую реакцию рассмотрите как окислительно-восстановительный процесс.
Содержание урока
конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации
аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения
рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие
Совершенствование учебников и уроковисправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей
идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные уроки
Алюминий и его соединения
Цели урока:
Воспитывающая: создать условия для
воспитания активности и самостоятельности при
изучении данной темы, а также умения работать в
группе, умения слушать своих одноклассников.
Развивающая: развивать умение работать в атмосфере поиска, творчества, дать каждому учащемуся возможность достичь успеха; умение давать самооценку деятельности на уроке;
Обучающая: организовать деятельность учащихся на усвоение:
знаний: о переходных элементах; взаимосвязи между строением и свойствами алюминия, его применением; нахождение в природе;
умений: записывать уравнения химических реакций, характеризующих химические свойства алюминия и его соединений в ионном и окислительно-восстановительном виде; закрепить понятие амфотерности;
Тип урока: урок изучения нового материала.
Форма организации деятельности учащихся: групповая.
Средства обучения: лабораторное оборудование, вещества, коллекция “Алюминий”, инструкционная карта, ТСО.
В связи с поставленными целями выбираются методы обучения:
| Этапы урока | Основные дидактические задачи |
Формы организации деятельности учащихся | Методы обучения и приемы обучения | Средства обучения | Примерное время |
1. Организационный Организационный |
Психологический настрой учащихся на урок | Фронтальная | Словесный | 1 мин. | |
| 2. Актуализация | Организовать повторение основных понятий, которые потребуются на данном уроке | Индивидуальная | Частично-поисковый | Листы с дифференцированными заданиями, кодоскоп |
5 мин. |
| 3. Целеполагание | Постановка цели урока и доведения её до сознания учащихся | Фронтальная | Словесно-наглядный | Доска | 2 мин. |
4. Изучение нового материала Изучение нового материала |
Организовать деятельность учащихся на усвоение новых знаний и способов деятельности | Групповая | Частично-поисковый (словесно-наглядно-практический) |
Инструкционная карта, реактивы и лабораторное оборудование, информация по алюминию, тетрадь. | 25мин |
| 5. Самоконтроль и взаимоконтроль | Выявление качества знаний, установление причин недостатков, обеспечение способностей к оценочным действиям |
Групповая (работа в парах) |
Словесно-наглядно-практический | Карточки с Заданиями, кодоскоп |
7 мин |
| 6. Подведение итогов | Проверка степени усвоения знаний, выявление недостатков в их усвоении | Фронтальная | Словесно-наглядный; поощрение лучших учеников |
Оценочный лист | 3 мин |
7. Домашнее задание Домашнее задание |
Обеспечение понимания цели, содержания и способов выполнения заданий | Фронтальная | Словесно-наглядный | Учебник, доска | 2 мин |
ХОД УРОКА
I. Оргмомент.
II. Актуализация знаний.
Изучение нового материала пройдёт в форме самостоятельной индивидуальной и групповой работы с последующим представлением и обсуждением результатов.
Сегодня, ребята, мы продолжим путешествие по удивительному миру металлов. Для того, чтобы двигаться дальше, я предлагаю вам выполнить стартовое задание. У вас на столах лист с заданиями: А, В, С (Приложение 1)
Выполнение задания А оценивается одним баллом.
Выполнение задания В оценивается 2 баллами.
Выполнение задания С оценивается 3 баллами.
Определитесь с выбором задания и приступите к его выполнению.
Учащиеся выполняют стартовое задание, затем самостоятельно проверяют выполненное задание с верными ответами, выведенными на кодоскопе, оценивают себя.
Во многих популярных книгах по химии приводится легенда о том, что некий мастер, имя которого история не сохранила, принес римскому императору Тиберию чашу из металла, напоминающего серебро, но более легкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы.
На этом уроке мы с вами выясним, что это был за металл. Каковы его физические и химические свойства и где этот металл применяется в нашей жизни.
Сейчас вы посмотрите на этот химический
элемент, его строение атома и определите тему
нашего урока. Итак,
Итак,
Тема урока: “Алюминий и его соединения”
Подумайте и скажите, каким образом тема нашего урока связана с такими науками как: история, физика, география, биология и химия?
Учащиеся ставят вопросы об истории открытия алюминия, его физических свойствах, нахождении в природе, биологической роли алюминия, химических свойствах и способах получения.
III. Изучение нового материала.
1. Каждая группа получает задания части одного общего материала.
Класс делится на 5 групп. Учитель даёт задания группам по карточкам.
1-я группа. Характеристика алюминия как химического элемента.
Инструкционная карта:
- Положение в периодической системе.
- Строение атома алюминия.
- Степень окисления.
- Оксид и гидроксид, их характеристика.
- Нахождение в природе.
2-я группа. Характеристика простого вещества
алюминия.
Характеристика простого вещества
алюминия.
Инструкционная карта:
- Тип химической связи.
- Тип кристаллической решетки.
- Физические свойства алюминия.
- Способы получения.
3-я группа. Химические свойства алюминия.
Инструкционная карта:
- Предсказать химические свойства алюминия на основе положения в периодической системе и ряду напряжений металлов.
- Написать уравнения возможных реакций, характеризующих химические свойства алюминия.
- Объяснить, почему с некоторыми веществами реакции не идут.
- Разобрать с точки зрения ОВР.
Al + HNO3(k) —>
Al + H2SO4(k) —>
Al + Cr2O3 —>
Al + NaOH —>
Al + H2O —>
Al + O2 —>
Al + HCl —>
Al + Cl2 —>
4-я группа. Амфотерность алюминия.
Амфотерность алюминия.
Инструкционная карта:
Реактивы: хлорид алюминия, гидроксид натрия, соляная кислота.
5-я группа. Применение алюминия на основе его свойств.
Инструкционная карта:
- Используя информацию по алюминию (распечатка на столах, Приложение 2), предложите области применения алюминия на основе его свойств.
- Биогенная роль алюминия.
2. Отчет каждой группы перед классом.
Контроль ответов учащихся.
Ответы учащихся, фиксирование информации в тетради.
IV. Самоконтроль и взаимоконтроль.
Найдите соответствие между реагентами и
продуктами химической реакции.
| 1. | Al + O2 | А |
AlСl3 + H2 | ||||||
| 2. | Al + H2O | Б |
AlСl3 | ||||||
| 3. | Al + Сl2 | В |
AlСl3 + H2O | ||||||
| 4. | Al + HСl | Г |
AlСl3 + Hg | ||||||
5. |
Al + NaOH | Д |
AlСl3+ HgСl2 | ||||||
| 6. | Al + HgСl2 | Е |
NaAlO2 + H2 | ||||||
| 7. | Al + Fе3О4 | Ж |
Al(OH)3 + H2 | ||||||
З |
Al(OH)3 + Na | ||||||||
И |
Al2O3 + Fе | ||||||||
К |
Al2O3 | ||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|||
к |
ж |
б |
а |
е |
д |
и |
|||
Ответы для самопроверки:
(Выводятся на кодоскопе)
V.
 Рефлексия.
Рефлексия.
Ответьте на вопросы в таблице “Вопросы к ученику” (Приложение 3).
VI. Подведение итогов урока. Домашнее задание.
§ 42 стр.130 (учебник Г.Е. Рудзитис)
№ 1 – “3”.
№№ 1, 8 – “4”.
№№ 1, 6, 8 – “5”.
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Уроки химии (учимся дома) > Уроки в 9 классе > Химия 9 класс – 4 четверть > Урок №1 > УРОК №2 Химические свойства углерода. Адсорбция. > урок № 3 > урок № 4 > Урок № 5 > урок № 9 > Щёлочноземельные металлы > Кальций,стронций …. >
Кроссенс – это ассоциативная головоломка.
Название «кроссенс» переводится с английского языка как «пересечение смыслов»
и придумано по аналогии с словом «кроссворд», что означает «пересечение слов»…
Рассмотрите изображения. Как они связаны с темой этого урока?
Я начну с более сложных ассоциаций
1. Виктор Цой. В его репертуаре есть песня “Алюминиевые огурцы” 2.Обшивка космического челнока “Буран” была выполнена из сплава алюминия и скандия. 3. Экран смартфона. В его состав входит оксид алюминия, который по прочности уступает только алмазам.
А вы продолжайте ассоциации…
4. Наполеон III. 5. Рубиновые звёзды. 6. Хамелеон. 7. Пёрышко. 8. Audi 80
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3 , p – элемент,
Алюминий проявляет в соединениях степень окисления +3:
Al0 – 3 e– → Al+3
2. Физические свойства
Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
| Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3) | Нефелины — KNa3[AlSiO4]4 | Алуниты — KAl(SO4)2 • 2Al(OH)3 | Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3) | Корунд — Al2O3 |
| Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2 | Каолинит — Al2O3×2SiO2 × 2H2O | Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3 | Берилл — 3ВеО • Al2О3 • 6SiO2 | Рубин— Al2O3 |
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
4. Химические свойства алюминия и его соединений
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Алюминий |
ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора – воды:
2Аl + 3S = Аl2S3 (сульфид алюминия),
2Аl + N2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl4С3 (карбид алюминия).
2 Аl + 3 I2 = 2 AlI3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O2 = 2Аl2О3 + 1676 кДж.
ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ
Если Вы хорошо изучили эту часть урока,ответьте на 5 вопросов теста
II. Взаимодействие со сложными веществами
Взаимодействие с водой:
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
без оксидной пленки
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr2О3 + 2Аl = 2Сr + Аl2О3
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Обнаружение ионов алюминия в растворах:
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. Применение алюминия и его соединений
Применение алюминия и его соединений
РИСУНОК 1 РИСУНОК 2
- Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
- Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
- Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.

- Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
- Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
- Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия – электролитом.
2Al2O3 эл.ток→ 4Al + 3O2
ЭТО ИНТЕРЕСНО:
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
- К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции.
 В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
- При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета “Сатурн” сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф.
 А. Цандер.
А. Цандер.
Если Вы хорошо изучили эту часть урока,ответьте на 10 вопросов теста
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
ТРЕНАЖЁРЫ
Тренажёр №1 – Характеристика алюминия по положению в Периодической системе элементов Д. И. Менделеева
Тренажёр №2 – Уравнения реакций алюминия с простыми и сложными веществами
Тренажёр №3 – Химические свойства алюминия
Физические и химические свойства алюминия
Алюминий — мягкий и легкий металл. Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Алюминий используется во многих отраслях промышленности для производства миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию различных комбинаций своих доминирующих характеристик, таких как прочность, легкий вес, коррозионная стойкость, восстанавливаемость и формуемость, алюминий используется все чаще. Ассортимент продукции варьируется от конструкционных материалов до тонкой упаковочной пленки. Подробнее о применении алюминия вы можете просмотреть в этой статье: Кое-что, чего вы не знали об алюминиевой трубке
Благодаря использованию различных комбинаций своих доминирующих характеристик, таких как прочность, легкий вес, коррозионная стойкость, восстанавливаемость и формуемость, алюминий используется все чаще. Ассортимент продукции варьируется от конструкционных материалов до тонкой упаковочной пленки. Подробнее о применении алюминия вы можете просмотреть в этой статье: Кое-что, чего вы не знали об алюминиевой трубке
Каковы физические свойства алюминия? Физические свойства обычно являются характеристиками, которые можно наблюдать с помощью органов чувств, таких как цвет, плотность, твердость, коррозионная стойкость, теплопроводность, проводимость и т. д. Физические свойства алюминия следующие:
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет около одной трети плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Прочность на растяжение чистого алюминия невысокая. Однако легирующие элементы, такие как марганец, кремний, медь и магний, могут повысить прочность алюминия и получить сплав со свойствами, подходящими для конкретного применения. Алюминий очень подходит для холодных условий. По сравнению со сталью его преимущество заключается в том, что его прочность на растяжение увеличивается с понижением температуры при сохранении его ударной вязкости. С другой стороны, сталь становится хрупкой при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом поверхность алюминия почти сразу покрывается оксидом алюминия. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий становится важным материалом для систем охлаждения и обогрева (например, для теплообменников). В сочетании с его нетоксичностью эта особенность означает, что алюминий широко используется в кухонной посуде и кухонной утвари. В сочетании с его нетоксичностью эта особенность означает, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Электропроводность | Алюминий имеет достаточно высокую электропроводность и может использоваться в качестве электрических проводников. |
| Отражательная способность | От УФ до инфракрасного излучения алюминий является отличным отражателем энергии излучения. Те же самые характеристики отражения делают алюминий теплоизоляционным материалом, который предотвращает солнечный свет летом и предотвращает потери тепла зимой. |
Химические свойства относятся к тому, что вещество вступает в реакцию с другими веществами или изменяется от одного вещества к другому. В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
| Свойства | Описание |
| Окисление | Обычно алюминиевые металлы не реагируют на эрозию воздуха, поскольку воздух покрывает металл тонким слоем оксидов. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой он пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция со щелочью | Алюминий вступает в реакцию с основанием с образованием алюмината с выделением водорода. |
| Реакция с водой | Реакция с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря физическим и химическим свойствам алюминия его можно смешивать с другими металлами в алюминиевых сплавах, которые используются в различных алюминиевых сплавах. Алюминиевый сплав имеет характеристики, отличные от характеристик одного металла, и алюминиевый сплав классифицируется в соответствии с другими содержащимися элементами. Ниже приводится серия алюминиевого сплава и его основное использование:
| Series | Alloy Element | Application |
| 1xxx | Almost pure aluminum | Decoration, chemical equipment, heat reflector |
| 2xxx | Copper | Truck panel , детали самолетов |
| 3xxx | Марганец | Посуда, дорожный знак, холодильник |
| 4xxx | Silicon | Ship, bridge |
| 5xxx | Magnesium | Aircraft fuel tank |
| 6xxx | Magnesium + silicon | Low-pressure weapon, aircraft connector |
| 7xxx | Zinc | Aircraft structure |
| 8xxx | Другие элементы представляют собой элементы из основных сплавов | Алюминиевая фольга, радиатор |
Алюминий не потеряет своих характеристик после сильной деформации. Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и тому подобное. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и тому подобное. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
CHAL Aluminium Corporation специализируется на производстве и исследованиях композитных материалов из алюминия и алюминиевых сплавов, высокоточных алюминиевых труб, полос, фольги и пайки алюминиевых сплавов. Мы искренне приветствуем вас связаться с нами для любого делового сотрудничества! Мы более чем рады тесно сотрудничать с друзьями дома и за рубежом, чтобы создать лучшее будущее.
Похожие статьиалюминий | Использование, свойства и соединения
алюминий
Посмотреть все СМИ
- Ключевые люди:
- Ганс Кристиан Эрстед Эмиль Ратенау Фридрих Вёлер Чарльз Мартин Холл
- Похожие темы:
- химический элемент обработка алюминия элемент группы бора
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
алюминий (Al) , также пишется как алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы. Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0006 Апелюмен , используемый для описания квасцов для калия, или алюминиевого сульфата калия, Kal (SO 4 ) 2 ∙ 12H 2 O.
Алюминий является самым распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. В силу своей химической активности А. никогда не встречается в природе в металлическом виде, но его соединения в большей или меньшей степени присутствуют почти во всех горных породах, растительности и животных. Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; его превосходят по количеству только кислород и кремний. Название алюминия происходит от латинского слова 9.0006 Апелюмен , используемый для описания квасцов для калия, или алюминиевого сульфата калия, Kal (SO 4 ) 2 ∙ 12H 2 O.
| атомный вес | 26,9815384 |
|---|---|
| Плата | 660 ° C (1 220 ° F) |
| Кореект | 2,467 |
| .3 | 2.70 (at 20 °C [68 °F]) |
| valence | 3 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 S 2 3 P 1 |
История и история
Алуминиевые алюминиевые в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов. Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Бокситы, смесь гидратированных оксидов алюминия, являются основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), встречающийся в некоторых магматических породах, добывается как природный абразив или в виде его более тонких разновидностей, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других алюминиевых минералов алунит и криолит имеют некоторое коммерческое значение.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
До 5000 г. до н.э. люди в Месопотамии делали прекрасную керамику из глины, которая состояла в основном из соединения алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах. Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Плиний ссылается на квасцы, теперь известные как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. Во второй половине 18 века такие химики, как Антуан Лавуазье, признали глинозем потенциальным источником металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Христианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви приготовил (1809 г.) сплав железа с алюминием путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; слово позже было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, получил алюминиевый порошок (1827 г.) и небольшие глобулы металла (1845 г.), по которым он смог определить некоторые его свойства.
Новый металл был представлен публике (1855 г.) на Парижской выставке примерно в то же время, когда он стал доступен (в небольших количествах за большие деньги) путем восстановления натрием расплавленного хлорида алюминия в процессе Девиля. Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г.) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0279 2 O 3 ), растворенных в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Шарль Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г.) современный метод промышленного производства алюминия: электролиз очищенного оксида алюминия (Al 9).0279 2 O 3 ), растворенных в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. обработка алюминия.
Применение и свойства
Алюминий добавляют в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, потребительских товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Чистый алюминий (99,996%) довольно мягкий и непрочный; технический алюминий (чистота от 99 до 99,6%) с небольшими количествами кремния и железа отличается твердостью и прочностью. Ковкий и очень податливый алюминий можно вытягивать в проволоку или сворачивать в тонкую фольгу. Плотность металла составляет всего около одной трети плотности железа или меди. Несмотря на свою химическую активность, алюминий обладает высокой коррозионной стойкостью, так как на воздухе на его поверхности образуется прочная оксидная пленка.
Алюминий является отличным проводником тепла и электричества. Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным. Даже очень чистый алюминий подвергается энергичному воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и иона алюмината. Из-за большого сродства к кислороду мелкодисперсный алюминий при возгорании сгорает в монооксиде или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное азоторганического соединения 8-гидроксихинолина. Производное имеет молекулярную формулу Al(C 9 H 6 ON) 3 .
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 О, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например, в кристаллическом фториде алюминия [AlF 3 ] и хлориде алюминия [AlCl 3 ]) голый ион Al 3+ образован потеря этих электронов, как известно, происходит. Однако энергия, необходимая для образования иона Al 3+ , очень велика, и в большинстве случаев атому алюминия энергетически выгоднее образовывать ковалентные соединения путем sp 2 гибридизация, как это делает бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al(H 2 O) 6 ] 3+ встречается как в водном растворе, так и в некоторых солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия и изготовления изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Глинозем, встречающийся в природе в виде корунда, также производится в промышленных масштабах в больших количествах для использования в производстве металлического алюминия и изготовления изоляторов, свечей зажигания и различных других изделий. При нагревании оксид алюминия образует пористую структуру, которая позволяет ему поглощать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей. Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (ААО), обычно получаемый электрохимическим окислением алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые можно использовать для различных целей. Это термически и механически стабильное соединение, а также оптически прозрачное и электрическое изолятор. Размер пор и толщину AAO можно легко адаптировать для определенных приложений, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим важным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и в качестве поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl(SO 4 ) 2 ·12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; M может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов M 3+ , например галлия, индия, титана, ванадия, хрома, марганца. , железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, то есть в синтетических органических реакциях, связанных с получением самых разных соединений, включая ароматические кетоны, антрохинон и его производные. Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al(OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO − 2 . С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получают тетрагидроалюминаты (важные восстановители). Алюмогидрид лития (LiAlH 4 ), образующийся при взаимодействии хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Алюминиевый сплав | Химия сплавов и механические данные
Каковы преимущества алюминия?
- Алюминий — легкий металл, плотность которого составляет примерно треть плотности стали, меди и латуни. Алюминий
- обладает хорошей коррозионной стойкостью к обычным атмосферным и морским средам. Его коррозионная стойкость и устойчивость к царапинам могут быть улучшены путем анодирования. Алюминий
- обладает высокой отражательной способностью и может использоваться в декоративных целях.

- Некоторые алюминиевые сплавы могут соответствовать прочности обычной конструкционной стали или даже превосходить ее. Алюминий
- сохраняет свою ударную вязкость при очень низких температурах, не становясь хрупким, как углеродистая сталь.
- Алюминий является хорошим проводником тепла и электричества. При измерении равной площади поперечного сечения алюминий электротехнического класса имеет проводимость, которая составляет примерно 62% от отожженной меди электротехнического класса. Однако при сравнении с использованием равного веса проводимость алюминия составляет 204% от меди.
- Алюминий легко обрабатывается и формуется с использованием широкого спектра формовочных процессов, включая глубокую вытяжку и профилирование. Алюминий
- нетоксичен и обычно используется в контакте с пищевыми продуктами.
- Алюминий может быть легко переработан.
Свойства алюминия Содержание
Обозначения алюминиевых сплавов
Обозначения сплавов алюминия
Обозначения отпусков H-деформационного упрочнения
Отпуски термообработки
Пределы химического состава для алюминиевых сплавов
Алюминиевый лист и рулон Опубликованные допуски на размеры
Типичные механические свойства алюминия
Типичные физические свойства алюминиевой полосы в рулонах
Условия использования
Данные, содержащиеся на этом веб-сайте, были собраны United Aluminium. Данные должны быть тщательно оценены и протестированы технически квалифицированным персоналом, прежде чем они будут использованы. United Aluminium не несет никакой ответственности за любое использование этих данных, и United Aluminium не дает и не подразумевает никаких гарантий. Эту информацию нельзя копировать, использовать в качестве доказательства, публиковать или передавать третьей стороне без письменного разрешения United Aluminium.
Данные должны быть тщательно оценены и протестированы технически квалифицированным персоналом, прежде чем они будут использованы. United Aluminium не несет никакой ответственности за любое использование этих данных, и United Aluminium не дает и не подразумевает никаких гарантий. Эту информацию нельзя копировать, использовать в качестве доказательства, публиковать или передавать третьей стороне без письменного разрешения United Aluminium.
Заходя на этот веб-сайт или на любые его страницы, вы подтверждаете, что прочитали настоящее Соглашение, поняли его и согласны с его положениями и условиями.
ОБОЗНАЧЕНИЯ АЛЮМИНИЕВЫХ СПЛАВОВ
Система обозначения сплавов для изделий из кованого листа
Алюминиевые сплавы для изделий из листового металла обозначаются четырехзначной системой счисления, которая находится в ведении Алюминиевой ассоциации. Сплавы удобно разделить на восемь групп в зависимости от их основного легирующего элемента. Первая цифра обозначает группу сплава следующим образом:
ГРУППА СПЛАВОВ | ОСНОВНОЙ ЛЕГИРОВАННЫЙ ЭЛЕМЕНТ | |
|---|---|---|
1ххх | Нелегированный алюминий | Чистота 99,0% или выше |
2ххх | Медь | Термообрабатываемые сплавы |
3ххх | Марганец | |
4ххх | Кремний | Сплавы с низкой температурой плавления |
5ххх | Магний | |
6ххх | Магний и кремний | Термообрабатываемые сплавы |
7ххх | Цинк | Термообрабатываемые сплавы |
8ххх | Прочие элементы |
Последние две цифры в группе 1xxx соответствуют двум цифрам после запятой, обозначающим минимальное содержание алюминия. Например, содержание алюминия 1060 составляет минимум 99,60%, 1100 — минимум 99,00%, 1350 — минимум 99,50% и так далее.
Например, содержание алюминия 1060 составляет минимум 99,60%, 1100 — минимум 99,00%, 1350 — минимум 99,50% и так далее.
Последние две цифры других групп являются порядковыми номерами, присвоенными Алюминиевой ассоциацией для обеспечения уникальной идентификации каждого сплава.
Вторая цифра во всех группах указывает на незначительную модификацию основного сплава. Например, 5252 — это вторая модификация сплава 5052.
ОБОЗНАЧЕНИЯ ЗАКАЛА АЛЮМИНИЯ
Обозначение отпуска следует за кодом сплава и отделяется дефисом.
-F В готовом виде: Применяется к продуктам прокатки или формовки, где нет специального контроля за термическими условиями или условиями деформационного упрочнения. Поскольку механические свойства могут широко варьироваться, предельные значения не установлены. Этот отпуск обычно применяется к листовым изделиям, которые находятся на промежуточных стадиях производства.
-H Деформационно-упрочненные: Применяется к кованым изделиям, упрочненным путем холодной прокатки или холодной обработки.
-O Отожженный: Применяется к деформируемым изделиям, которые были нагреты выше температуры рекристаллизации для получения сплава с самой низкой прочностью на растяжение.
ОБОЗНАЧЕНИЯ –H ОТКАЗОВ ДЕФОРМАЦИИ
Первая цифра
Существует три различных метода, используемых для достижения окончательного состояния материала, подвергнутого деформационному упрочнению.
– h2 Только для деформационного упрочнения: Применяется к продуктам, подвергнутым деформационному упрочнению для достижения желаемого уровня прочности без какой-либо последующей термической обработки.
– h3 Деформационное упрочнение и частичный отжиг: Применяется к изделиям, подвергнутым деформационному упрочнению до более высокого уровня прочности, чем требуется, с последующим частичным отжигом (или «обратным отжигом»), который снижает прочность до желаемого уровня.
– h4 Деформационно-упрочненный и стабилизированный: Это обозначение применяется только к сплавам, содержащим магний, которые после деформационного упрочнения постепенно размягчаются при комнатной температуре при старении. Применяется низкотемпературный отжиг, который стабилизирует свойства.
Применяется низкотемпературный отжиг, который стабилизирует свойства.
Вторая цифра
Величина деформационного упрочнения и, следовательно, уровень прочности указывается второй цифрой.
-Hx2 | Четверть твердый |
-Hx4 | полутвердый |
-Hx6 | Три четверти |
-Hx8 | Полный жесткий |
-Hx9 | Сверхтвердый (минимальный предел прочности при растяжении превышает предел прочности сплава Hx8 на 2 тыс.фунтов на кв. дюйм или более) |
Hx1, Hx3, Hx5 и Hx7 имеют промежуточный характер между указанными выше.
Пределы механических свойств, которые соответствуют каждому обозначению состояния, можно найти, обратившись к соответствующему стандарту для алюминия, такому как Стандарты и данные Ассоциации алюминиевых сплавов или ASTM B 209. .
.
Третья цифра
Третья цифра иногда используется для обозначения разновидности основного двузначного темперамента.
ТЕМПЕРАТУРА ТЕРМООБРАБОТКИ
Сплавы групп 2ххх, 6ххх и 7ххх могут быть упрочнены в процессе термообработки. Алюминий подвергается термообработке путем проведения процесса обработки на твердый раствор, при котором металл нагревают до повышенной температуры с последующим быстрым охлаждением, а затем процессом дисперсионного твердения (или процессом «старения»). Отпуски обозначаются буквой -T, за которой следует цифра. Вот некоторые распространенные состояния –T:
– T3 Термическая обработка на твердый раствор, деформация в холодном состоянии и естественное старение: Применяется к изделиям, подвергнутым холодной обработке для повышения прочности после термообработки на твердый раствор, или в отношении которых признается эффект плющения или выпрямления в пределах механических свойств.
– T4 Термическая обработка раствором и естественное старение: Применяется к продукту, который подвергается старению при комнатной температуре после обработки раствором.
– T6 Раствор термообработанный и искусственно состаренный: Применяется к продуктам, которые повторно нагреваются до низкой температуры после обработки раствором. Это позволяет металлу достичь наивысшего уровня прочности при термообработке.
ПРЕДЕЛЫ ХИМИЧЕСКОГО СОСТАВА ДЛЯ АЛЮМИНИЕВЫХ СПЛАВОВ
Состав в весовых процентах согласно данным The Aluminium Association. Значения указывают максимальные пределы, если они не показаны в виде диапазона или минимума.
Сплав | Си | Fe | Медь | Мн | Мг | Кр | Цинк | Ти | ДРУГИЕ КАЖДЫЙ | ДРУГИЕ ВСЕГО | Ал МИН. | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
1070 | 0,20 | 0,25 | 0,04 | 0,03 | 0,03 | — | 0,04 | 0,03 | 0,03 | — | “> | |
1060 | 0,25 | 0,35 | 0,05 | 0,03 | 0,03 | — | 0,05 | 0,03 | 0,03 | — | 99,60 | |
1050 | 0,25 | 0,40 | 0,05 | 0,05 | 0,05 | — | 0,05 | 0,03 | 0,03 | — | “> | |
1350 | 0,10 | 0,40 | 0,05 | 0,01 | — | 0,01 | 0,05 | — | 0,05 Б, | 0,03 | 0,10 | 99,50 |
1145 | 0,55 Si + Fe | 0,05 | 0,05 | 0,05 | — | 0,05 | 0,03 | 0,03 | — | 99,45 | ||
1100 | 0,95 Si + Fe | 0,05-0,20 | 0,05 | — | — | 0,10 | — | 0,05 | 0,15 | “> | ||
2024 | 0,50 | 0,50 | 3,8-4,9 | 0,30-0,9 | 1,2-1,8 | 0,10 | 0,25 | 0,15 | 0,05 | 0,15 | Рем. | |
3003 | 0,6 | 0,7 | 0,05-0,20 | 1,0-1,5 | — | — | 0,10 | — | 0,05 | 0,15 | “> | |
3004 | 0,30 | 0,7 | 0,25 | 1,0-1,5 | 0,8-1,3 | — | 0,25 | — | 0,05 | 0,15 | Рем. | |
3005 | 0,6 | 0,7 | 0,30 | 1,0-1,5 | 0,20-0,6 | 0,10 | 0,25 | 0,10 | 0,05 | 0,15 | “> | |
3104 | 0,6 | 0,8 | 0,05-0,25 | 0,8-1,4 | 0,8-1,3 | — | 0,25 | 0,10 | 0,05 | 0,15 | Рем. | |
3105 | 0,6 | 0,7 | 0,30 | 0,30-0,8 | 0,20-0,8 | 0,20 | 0,40 | 0,10 | 0,05 | 0,15 | “> | |
4004 | 9,0-10,5 | 0,8 | 0,25 | 0,10 | 1,0-2,0 | — | 0,20 | — | 0,05 | 0,15 | Рем. | |
4104 | 9,0-10,5 | 0,8 | 0,25 | 0,10 | 1,0-2,0 | — | 0,20 | — | 0,02-0,20 | 0,05 | 0,15 | “> |
4043 | 4,5-6,0 | 0,8 | 0,30 | 0,05 | 0,05 | — | 0,10 | 0,20 | 0,05 | 0,15 | Рем. | |
4045 | 9,0-11,0 | 0,8 | 0,30 | 0,05 | 0,05 | — | 0,10 | 0,20 | 0,05 | 0,15 | “> | |
5005 | 0,30 | 0,7 | 0,20 | 0,20 | 0,50-1,1 | 0,10 | 0,25 | — | 0,05 | 0,15 | Рем. | |
5050 | 0,40 | 0,7 | 0,20 | 0,10 | 1,1-1,8 | 0,10 | 0,25 | — | 0,05 | 0,15 | “> | |
5052 | 0,25 | 0,40 | 0,10 | 0,10 | 2,2-2,8 | 0,15-0,35 | 0,10 | — | 0,05 | 0,15 | Рем. | |
5252 | 0,08 | 0,10 | 0,10 | 0,10 | 2,2-2,8 | — | 0,05 | — | 0,03 | 0,10 | “> | |
5754 | 0,40 | 0,40 | 0,10 | 0,50 | 2,6-3,6 | 0,30 | 0,20 | 0,15 | 0,10-0,6 | 0,05 | 0,15 | Рем. |
5056 | 0,30 | 0,40 | 0,10 | 0,05-0,20 | 4,5-5,6 | 0,05-0,20 | 0,10 | — | 0,05 | 0,15 | Рем. | |
5657 | 0,08 | 0,10 | 0,10 | 0,03 | 0,6-1,0 | — | 0,05 | — | 0,02 | 0,05 | Рем. | |
5182 | 0,20 | 0,35 | 0,15 | 0,20-0,50 | 4,0-5,0 | 0,10 | 0,25 | 0,10 | 0,05 | 0,15 | “> | |
6061 | 0,40-0,8 | 0,7 | 0,15-0,40 | 0,15 | 0,8-1,2 | 0,04-0,35 | 0,25 | 0,15 | 0,05 | 0,15 | Рем. | |
7075 | 0,40 | 0,50 | 1,2-2,0 | 0,30 | 2,1-2,9 | 0,18-0,28 | 5. | 0,20 | 0,05 | 0,15 | Рем. | |
8111 | 0,30-1,1 | 0,40-1,0 | 0,10 | 0,10 | 0,05 | 0,05 | 0,10 | 0,08 | 0,05 | 0,15 | Рем. | |
Остаток=Остаток
АЛЮМИНИЕВЫЙ ЛИСТ И РУЛОНА ОПУБЛИКОВАННЫЕ ДОПУСКИ НА РАЗМЕРЫ
Допуски по толщине для алюминиевого листа
Указанная толщина (дюймы) | Толщина Допуск по ширине до 39,37″ | |
|---|---|---|
Более | Через | Дюймы плюс-минус |
0,0059 | 0,016 | 0,0010 |
0,016 | 0,025 | 0,0015 |
0,025 | 0,039 | 0,0020 |
0,039 | 0,047 | 0,0025 |
0,047 | 0,063 | 0,0030 |
0,063 | 0,098 | 0,0035 |
0,098 | 0,126 | 0,0045 |
0,126 | 0,158 | 0,0055 |
0,158 | 0,197 | 0,0070 |
Выше приведены опубликованные допуски по толщине в ANSI-h45. 2 для всех листовых сплавов, не включенных в Таблицу аэрокосмических сплавов или не указанных для аэрокосмических применений.
2 для всех листовых сплавов, не включенных в Таблицу аэрокосмических сплавов или не указанных для аэрокосмических применений.
Допуски по толщине для аэрокосмических сплавов
Указанная толщина (дюймы) | Толщина Допуск по ширине до 39,37″ | |
|---|---|---|
Более | Через | Дюймы плюс и минус |
0,0059 | 0,010 | 0,0010 |
0,010 | 0,039 | 0,0015 |
0,039 | 0,079 | 0,0020 |
0,079 | 0,098 | 0,0025 |
0,098 | 0,126 | 0,0035 |
0,126 | 0,158 | 0,0040 |
0,158 | 0,197 | 0,0055 |
Выше приведены опубликованные допуски по толщине в ANSI-h45. 2 для аэрокосмических сплавов 2024 и 7075.
2 для аэрокосмических сплавов 2024 и 7075.
Указанная толщина
дюймов
Указанная ширина (дюймы)
Вверх через 6
Больше 6
До 12
старше 12 лет
До 24
старше 24 лет
Через 48
0,006-0,125
0,010
1⁄64
1/32
3⁄64
0,126-0,186
0,012
1/32
1/32
1/16
ANSI-h45.2
Ограничения бокового изгиба (или «изгиба») для разрезной катушки
Допустимое отклонение кромки от 6 футов. прямая
Указанный | Указанный | Ширина (дюймы) | |||
|---|---|---|---|---|---|
Толщина дюймов | 1/2 до 1 | Более 1 Через 2 | Более 2 | Более 4 | Более 10 |
0,006-0,064 | 3⁄4 | 9/16 | 3⁄8 | 1⁄4 | 3⁄16 |
0,065-0,125 | – | – | 3⁄8 | 1⁄4 | 3⁄16 |
ТИПИЧНЫЕ МЕХАНИЧЕСКИЕ СВОЙСТВА
Следующие типичные свойства не гарантируются, так как в большинстве случаев они являются средними для различных размеров и методов производства и могут не точно отражать какой-либо конкретный продукт или размер. Данные предназначены для сравнения сплавов и состояний и не должны использоваться в целях проектирования.
Данные предназначены для сравнения сплавов и состояний и не должны использоваться в целях проектирования.
| Сплав | Характер |
|---|---|
| 1100 | О |
| h22 | |
| h24 | |
| h26 | |
| h28 | |
| 1350 | О |
| h22 | |
| h24 | |
| h26 | |
| h29 | |
| 2024 | О |
| Т3 | |
| Т4 | |
| 3003 | О |
| h22 | |
| h24 | |
| h26 | |
| h28 | |
| 3004 | О |
| h42 | |
| h44 | |
| h46 | |
| h48 | |
| 3005 | О |
| h22 | |
| h24 | |
| h26 | |
| h28 | |
| 5005 | О |
| h22 | |
| h24 | |
| h26 | |
| h28 | |
| х42 | |
| х44 | |
| h46 | |
| h48 | |
| 5050 | О |
| h42 | |
| х44 | |
| h46 | |
| h48 | |
| 5052 | О |
| h42 | |
| х44 | |
| h46 | |
| h48 | |
| 5056 | О |
| h48 | |
| 5182 | О |
| h42 | |
| х44 | |
| h46 | |
| h48 | |
| 6061 | О |
| Т4 | |
| Т6 | |
| 7075 | О |
| Т6 |
Растяжение Прочность | Выход Прочность | Удлинение (%) для Следующие диапазоны размеров: | Растяжение Прочность | Выход Прочность | Удлинение (%) для следующие диапазоны размеров: | ||||
|---|---|---|---|---|---|---|---|---|---|
Сплав | Характер | (фунтов на квадратный дюйм) | (фунтов на квадратный дюйм) | 0,010-0,050˝ | 0,051–0,125 дюйма | (МПа) | (МПа) | 0,25–1,25 мм | 1,26–3,0 мм |
1100 | О | 13 | 5 | 30 | 32 | 89,6 | 34,5 | 30 | 6 |
х22 | 16 | 15 | 4 | 12 | 110,3 | 103,4 | 4 | 12 | |
х24 | 18 | 17 | 3 | 10 | 124,1 | 117,2 | 3 | 10 | |
х26 | 21 | 20 | 2 | 8 | 144,8 | 137,9 | 2 | 8 | |
х28 | 24 | 22 | 2 | 6 | 165,5 | 151,7 | 2 | 6 | |
1350 | О | 12 | 4 | 34 | 42 | 82,7 | 27,6 | 34 | 42 |
х22 | 14 | 12 | 5 | 12 | 96,5 | 82,7 | 5 | 12 | |
х24 | 16 | 14 | 3 | 9 | 110,3 | 96,5 | 3 | 9 | |
х26 | 18 | 16 | 3 | 8 | 124,1 | 110,3 | 3 | 8 | |
х29 | 27 | 24 | 2 | 6 | 186,2 | 165,5 | 2 | 6 | |
2024 | О | 27 | 11 | 18 | 20 | 186,2 | 75,8 | 18 | 20 |
Т3 | 70 | 50 | 16 | 18 | 482,6 | 344,7 | 16 | 18 | |
Т4 | 68 | 47 | 20 | 19 | 468,8 | 324,1 | 20 | 19 | |
3003 | О | 16 | 6 | 30 | 33 | 110,3 | 41,4 | 30 | 33 |
х22 | 19 | 18 | 9 | 11 | 131,0 | 124,1 | 9 | 11 | |
х24 | 22 | 21 | 3 | 7 | 151,7 | 144,8 | 3 | 7 | |
х26 | 26 | 25 | 3 | 5 | 179,3 | 172,4 | 3 | 5 | |
х28 | 29 | 27 | 3 | 5 | 199,9 | 186,2 | 3 | 5 | |
3004 | О | 26 | 10 | 19 | 23 | 179,3 | 68,9 | 19 | 23 |
х42 | 31 | 25 | 6 | 15 | 213,7 | 172,4 | 6 | 15 | |
х44 | 35 | 29 | 5 | 10 | 241,3 | 199,9 | 5 | 10 | |
х46 | 38 | 33 | 5 | 8 | 262,0 | 227,5 | 5 | 8 | |
х48 | 41 | 36 | 4 | 6 | 282,7 | 248,2 | 4 | 6 | |
3005 | О | 20 | 8 | 22 | 23 | 137,9 | 55,2 | 22 | 23 |
х22 | 26 | 24 | 5 | 13 | 179,3 | 165,5 | 5 | 13 | |
х24 | 29 | 28 | 4 | 9 | 199,9 | 193,1 | 4 | 9 | |
х26 | 31 | 30 | 3 | 5 | 213,7 | 206,8 | 3 | 5 | |
х28 | 37 | 36 | 2 | 3 | 255,1 | 248,2 | 2 | 3 | |
5005 | О | 18 | 6 | 22 | 25 | 124,1 | 41,4 | 22 | 25 |
х22 | 20 | 19 | 5 | 9 | 137,9 | 131,0 | 5 | 9 | |
х24 | 23 | 22 | 4 | 7 | 158,6 | 151,7 | 4 | 7 | |
х26 | 26 | 25 | 3 | 5 | 179,3 | 172,4 | 3 | 5 | |
х28 | 29 | 28 | 2 | 2 | 199,9 | 193,1 | 2 | 2 | |
х42 | 20 | 17 | 8 | 9 | 137,9 | 117,2 | 8 | 9 | |
х44 | 23 | 20 | 6 | 8 | 158,6 | 137,9 | 6 | 8 | |
х46 | 26 | 24 | 5 | 6 | 179,3 | 165,5 | 5 | 6 | |
х48 | 29 | 27 | 3 | 4 | 199,9 | 186,2 | 3 | 4 | |
5050 | О | 21 | 8 | 20 | 25 | 144,8 | 55,2 | 20 | 25 |
х42 | 25 | 21 | 9 | 13 | 172,4 | 144,8 | 9 | 13 | |
х44 | 28 | 24 | 5 | 10 | 193,1 | 165,5 | 5 | 10 | |
х46 | 30 | 26 | 4 | 7 | 206,8 | 179,3 | 4 | 7 | |
х48 | 32 | 29 | 2 | 4 | 220,6 | 199,9 | 2 | 4 | |
5052 | О | 28 | 13 | 20 | 21 | 193,1 | 89,6 | 20 | 21 |
х42 | 33 | 28 | 7 | 10 | 227,5 | 193,1 | 7 | 10 | |
х44 | 38 | 31 | 6 | 8 | 262,0 | 213,7 | 6 | 8 | |
х46 | 40 | 35 | 4 | 5 | 275,8 | 241,3 | 4 | 5 | |
х48 | 42 | 37 | 3 | 4 | 289. | 255,1 | 3 | 4 | |
5056 | О | 42 | 22 | 23 | 24 | 289,6 | 151,7 | 23 | 24 |
х48 | 60 | 50 | 6 | 13 | 413,7 | 344,7 | 6 | 13 | |
5182 | О | 40 | 21 | 21 | 25 | 275,8 | 144,8 | 21 | 25 |
х42 | 41 | 22 | 20 | 21 | 282,7 | 151,7 | 20 | 21 | |
х44 | 48 | 37 | 11 | 14 | 330,9 | 255,1 | 11 | 14 | |
х46 | 51 | 42 | 9 | 11 | 351,6 | 289,6 | 9 | 11 | |
х48 | 54 | 47 | 6 | 7 | 372,3 | 324,1 | 6 | 7 | |
6061 | О | 18 | 8 | 25 | 26 | 124,1 | 55,2 | 25 | 26 |
Т4 | 35 | 21 | 22 | 24 | 241,3 | 144,8 | 22 | 24 | |
Т6 | 45 | 40 | 12 | 17 | 310,3 | 275,8 | 12 | 17 | |
7075 | О | 33 | 15 | 16 | 18 | 227,5 | 103,4 | 16 | 18 |
Т6 | 83 | 73 | 11 | 12 | 572,3 | 503,3 | 11 | 12 | |
ТИПИЧНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
| Сплав |
|---|
| 1100 |
| 1350 |
| 2024-О |
| 2024-Т3,Т4 |
| 2024-Т6 |
| 3003 |
| 3004 |
| 3005 |
| 5005 |
| 5050 |
| 5052 |
| 5056 |
| 5182 |
| 5657 |
| 6061-О |
| 6061-Т4 |
| 6061-Т6 |
Сплав | Средний коэффициент теплового расширения от 68° до 212°F (°F) -1 | Плавление Диапазон 2,3 Приблизительно (°F) | Плотность (фунты/дюйм³) | Тепловой Проводимость (Английские единицы 4 ) | Электропроводность при 68°F (в процентах от международного стандарта на отожженную медь) | Электрика Удельное сопротивление при 68°F (Ом-окр. | |
|---|---|---|---|---|---|---|---|
Равно Том | Равно Том | ||||||
1100 | 13.1 | 1190-1215 | 0,098 | 1520 | 59 | 194 | 18 |
1350 | 13,2 | 1195-1215 | 0,0975 | 1625 | 62 | 204 | 17 |
2024-О | 12,9 | 935-11805 | 0,100 | 1340 | 50 | 160 | 21 |
2024-Т3, Т4 | 12,9 | 935-11805 | 0,100 | 840 | 30 | 96 | 35 |
2024-Т6 | 12,9 | 935-11805 | 0,100 | 1050 | 38 | 122 | 27 |
3003 | 12,9 | 1190-1210 | 0,099 | 1200 | 48 | 156 | 22 |
3004 | 13,3 | 1165-1210 | 0,098 | 1100 | 41 | 134 | 25 |
3005 | 13. | 1175-1210 | 0,098 | 1190 | 45 | 148 | 23 |
5005 | 13,2 | 1170-1210 | 0,098 | 1390 | 52 | 172 | 20 |
5050 | 13,2 | 1155-1205 | 0,097 | 1340 | 50 | 165 | 21 |
5052 | 13,2 | 1125-1200 | 0,097 | 960 | 35 | 116 | 30 |
5056 | 13,4 | 1055-1180 | 0,096 | 790 | 28 | 95 | 37 |
5182 | 13,4 | 1055-1180 | 0,096 | 790 | 28 | 95 | 37 |
5657 | 13,2 | 1180-1215 | 0,097 | 960 | 35 | 116 | 30 |
6061-О | 13. | 1080-12056 | 0,098 | 1250 | 47 | 155 | 22 |
6061-Т4 | 13.1 | 1080-12056 | 0,098 | 1070 | 40 | 132 | 26 |
6061-Т6 | 13.1 | 1080-12056 | 0,098 | 1160 | 43 | 142 | 24 |
1. Коэффициент умножения на
10-6. Пример 12,2 х 10-6 = 0,0000122.
2. Указанные диапазоны плавления относятся к кованым изделиям из
Толщина 1/4 дюйма или более.
3. На основе типичного состава указанных сплавов
.
4. Английские единицы =
btu-in/ft2hr °F.
5. Плавление эвтектики не устраняется гомогенизацией
.
6. Плавление эвтектики может быть полностью устранено с помощью
гомогенизации
Элементный контейнер | Основные характеристики алюминия
Что такое алюминий?
Алюминий (Aluminium) – серебристо-белый мягкий металл, отличающийся легкостью, высокой отражательной способностью, высокой теплопроводностью, высокой электропроводностью, нетоксичностью и коррозионной стойкостью. Алюминий — самый распространенный металлический элемент, составляющий 1/12 часть земной коры. Однако он никогда не встречается в природе в виде элементарного металла, а только в сочетании с кислородом и другими элементами. На обычном языке алюминий часто означает алюминиевый сплав.
Среди всех видов металлических материалов алюминий выигрывает либо потому, что его свойства и характеристики превосходны, либо потому, что технологии изготовления позволяют производить готовый продукт по конкурентоспособной цене. Использование алюминия продолжает увеличиваться и расширяться; новые рынки, такие как автомобильный сектор, начинают признавать его истинные беспрецедентные преимущества.
Использование алюминия продолжает увеличиваться и расширяться; новые рынки, такие как автомобильный сектор, начинают признавать его истинные беспрецедентные преимущества.
Где и как получить алюминий
Боксит, минерал, добываемый из земли, является основным источником алюминия. Бокситы измельчают и опрыскивают водой, удаляют глину и кремнезем, затем сушат в печи и смешивают с кальцинированной содой и дробленой известью. Затем смесь обрабатывается в варочном котле, затем сгущается под давлением и направляется в отстойник, где удаляются дополнительные примеси.
После фильтрации, охлаждения и дальнейшей обработки в осадителе смесь сгущают и еще раз фильтруют перед нагреванием в печи для обжига. Полученный материал представляет собой оксид алюминия, порошкообразную химическую комбинацию кислорода и алюминия.
Плавка
Глинозем должен пройти процессы плавки и легирования, чтобы стать алюминием общего пользования. Алюминиевый завод содержит криолитовую ванну (в которой минеральный криолит плавится с помощью электрического тока). Глинозем в виде порошка помещают в криолитовую ванну, где он плавится и отделяется от кислородного компонента, оседая под криолитом. Расплавленный алюминий перекачивается из нижней части плавильной печи и помещается в тигель, затем формуется в слиток или переносится в печь для легирования.
Глинозем в виде порошка помещают в криолитовую ванну, где он плавится и отделяется от кислородного компонента, оседая под криолитом. Расплавленный алюминий перекачивается из нижней части плавильной печи и помещается в тигель, затем формуется в слиток или переносится в печь для легирования.
Легирование
В печи для легирования алюминиевый слиток расплавляется и смешивается с легирующими металлами, такими как магний, кремнезем, медь и т. д., с образованием алюминиевого сплава, обладающего широким спектром конкретных свойств материала. Физические свойства сплава во многом определяются содержанием сплава.
Например:
- Марганец обладает хорошей коррозионной стойкостью
- Магний подходит для сварки
- Медь обеспечивает отличную обрабатываемость
- Цинк обладает очень высокой прочностью
Смесь расплавленных металлов затем отливается в твердые бревна. Бревна можно разрезать, чтобы получить более управляемую заготовку. Бревна и заготовки отправляются на экструдеры для экструзии алюминия.
Бревна и заготовки отправляются на экструдеры для экструзии алюминия.
Основные характеристики алюминия
Алюминий при использовании в виде листов, рулонов или прессованных форм имеет ряд преимуществ по сравнению с другими металлами и материалами. В то время как другие материалы могут обладать некоторыми полезными характеристиками алюминия, они не могут обеспечить весь спектр преимуществ, которые может дать алюминий. Экструзия алюминия — это универсальный процесс формовки металла, который позволяет дизайнерам, инженерам и производителям в полной мере использовать широкий спектр физических характеристик:
Легкий вес:
Алюминий имеет удельный вес 2,7 и весит всего 0,1 фунта на кубический дюйм. Он весит меньше по объему, чем большинство других металлов. На самом деле, это около одной трети веса железа, стали, меди или латуни. Легкий алюминий проще в обращении, дешевле в транспортировке и является привлекательным материалом для применения в таких областях, как аэрокосмическая промышленность, высотное строительство и автомобильный дизайн. При использовании в области транспорта он может дать значительные преимущества в сокращении расхода топлива.
При использовании в области транспорта он может дать значительные преимущества в сокращении расхода топлива.
Strong:
Алюминиевые профили могут быть изготовлены настолько прочными, насколько это необходимо для большинства применений. Когда температура падает, он становится еще прочнее, поэтому этот материал чаще всего используется в холодных зонах.
Высокое соотношение прочности к весу:
Алюминий предлагает уникальное сочетание легкости и высокой прочности. Более высокие прочности могут быть получены путем добавления одного или нескольких из следующих компонентов: марганца, кремния, меди, магния или цинка. Увеличение также может быть достигнуто с помощью специальной термической обработки. В настоящее время аэрокосмическая промышленность и автомобильная промышленность в значительной степени зависят от алюминия как материала.
Коррозионная стойкость:
Превосходная коррозионная стойкость алюминия обусловлена наличием тонкой, твердой защитной пленки оксида алюминия, которая прочно связывается с поверхностью. Это происходит естественным образом и может достигать толщины 0,2 миллионных дюйма. Дополнительная защита может быть выполнена путем нанесения краски или анодирования. Не ржавеет, как сталь.
Это происходит естественным образом и может достигать толщины 0,2 миллионных дюйма. Дополнительная защита может быть выполнена путем нанесения краски или анодирования. Не ржавеет, как сталь.
Превосходный теплопроводник:
Алюминий является превосходным проводником как тепла, так и холода. Эти факторы делают алюминий идеальным для применения в теплообменниках, испарителях холодильников и компонентах двигателей. Процесс экструзии алюминия идеально подходит для изготовления нестандартных форм, которые оптимально используют свойства теплопроводности.
Отличный проводник электричества:
Алюминий — наименее дорогой металл с достаточно высокой электропроводностью для использования в качестве электрического проводника. Из-за своей низкой плотности алюминий проводит более чем в два раза больший ток, чем медь эквивалентного веса. Различные алюминиевые сплавы имеют разную электропроводность и могут быть адаптированы для специальных электрических применений, например, для линий электропередач.
Немагнитный:
Поскольку алюминий немагнитен, его можно использовать в высоковольтных устройствах, а также в электронике. Он также используется для защиты чувствительных электронных устройств.
Эластичный:
Алюминий легко формуется или перерабатывается в другую форму. Алюминий сочетает в себе прочность и гибкость и может изгибаться под нагрузкой или пружинить при ударе. Существует множество различных процессов переработки алюминия, наиболее распространенными из которых являются: экструзия, прокатка, ковка и волочение.
Отражающий:
Полированный алюминий является отличным отражателем лучистой энергии во всем диапазоне длин волн. Отражение видимого света алюминия (более 80%) привело к его широкому использованию в качестве отражателей ламп. Его можно использовать для защиты продуктов или областей от света, радиоволн или инфракрасного излучения.
Негорючий:
Алюминий не воспламеняется и не горит, даже при очень высоких температурах он не выделяет токсичных паров.
Подходит для экстремально низких температур:
Алюминий подходит для криогенных целей. Прочность алюминия фактически увеличивается при очень низких температурах. Это привело к использованию его в космическом пространстве, а также для самолетов и для строительства в высоких широтах.
Пригоден для вторичной переработки:
Алюминий может быть переработан за долю первоначальных производственных затрат. Его можно перерабатывать снова и снова, не теряя при этом своих характеристик. Это привлекает производителей, конечных пользователей и экологические консорциумы.
Привлекательный внешний вид:
Алюминий имеет неотъемлемое преимущество перед большинством других металлов благодаря привлекательному внешнему виду и хорошей коррозионной стойкости. Существует множество различных методов отделки, которые можно использовать. Наиболее распространенными являются: жидкая краска (включая акриловые, алкидные, полиэфирные и другие), порошковые покрытия, анодирование или гальваническое покрытие.
Технологичность:
Сложные формы могут быть реализованы в цельных экструдированных алюминиевых профилях без применения методов механического соединения. Полученный профиль, как правило, прочнее, чем сравнимая сборка, с меньшей вероятностью протекания или ослабления с течением времени. Области применения: бейсбольные биты, холодильные трубки и теплообменники. Алюминиевые детали можно соединять с помощью сварки, пайки или пайки, а также с помощью клея, зажимов, болтов, заклепок или других средств крепления. Методы цельного соединения могут быть особенно полезны для определенных конструкций. Клеевое соединение используется для таких работ, как соединение алюминиевых компонентов самолета.
Экономичный:
Инструменты или формовочные детали (штампы) относительно недороги и могут быть изготовлены в короткие сроки. Различные типы используемых инструментов можно быстро и часто менять во время производственных циклов, что делает его рентабельным для небольших производственных циклов.
Переработанный алюминий
Исторически сложилось так, что алюминий является одним из самых важных материалов в успешных программах переработки. Алюминий предлагает высокую стоимость лома, широкое признание потребителей, а переработка алюминия пользуется значительной поддержкой отрасли.
Алюминий можно перерабатывать и использовать снова и снова без потери своих характеристик. При использовании переработанного алюминия нет потери качества. Переработка алюминия требует меньше энергии и может обеспечить значительную экономию средств. Во время многих производственных процессов, связанных с алюминием, образуется лом. Обычно его возвращают на плавильные или литейные заводы и повторно используют для повторного производства сырья. По сравнению с первоначальными четырьмя фунтами руды для производства одного фунта алюминия каждый фунт переработанного алюминия экономит четыре фунта руды.
Алюминий: свойства и преимущества
Что такое алюминий? Это химический элемент, который в природе встречается на Земле. Это самый распространенный металл на нашей планете, так как он составляет примерно 8% земной коры. Он очень универсален, что делает его вторым наиболее часто используемым металлом после стали в различных областях, таких как производство автомобилей и зданий. Спустя столетия после начала промышленного производства алюминия спрос на него во всем мире быстро вырос до примерно 29 миллионов тонн в год, из которых примерно 22 миллиона тонн приходится на первичный алюминий. Для сравнения, из металлолома повторно используется 7 млн тонн алюминия. Стоит отметить, что алюминий относится к металлам, используемым в машиностроении, поскольку его соотношение прочности к весу выше, чем у стали.
Это самый распространенный металл на нашей планете, так как он составляет примерно 8% земной коры. Он очень универсален, что делает его вторым наиболее часто используемым металлом после стали в различных областях, таких как производство автомобилей и зданий. Спустя столетия после начала промышленного производства алюминия спрос на него во всем мире быстро вырос до примерно 29 миллионов тонн в год, из которых примерно 22 миллиона тонн приходится на первичный алюминий. Для сравнения, из металлолома повторно используется 7 млн тонн алюминия. Стоит отметить, что алюминий относится к металлам, используемым в машиностроении, поскольку его соотношение прочности к весу выше, чем у стали.
Преимущества использования алюминия связаны с его замечательными свойствами:
• Стойкость к коррозии Когда алюминий подвергается воздействию воздуха и влаги, образуется слой оксидной пленки для защиты алюминиевой поверхности от экстремальных воздействий. окисление. Этот самозащитный оксидный слой придает алюминию устойчивость к износу, устойчивость к атмосферным воздействиям даже в промышленной атмосфере, которая способствует атмосферным воздействиям. Анодирование может дополнительно использоваться для повышения стойкости оксидного слоя на поверхностях.
Этот самозащитный оксидный слой придает алюминию устойчивость к износу, устойчивость к атмосферным воздействиям даже в промышленной атмосфере, которая способствует атмосферным воздействиям. Анодирование может дополнительно использоваться для повышения стойкости оксидного слоя на поверхностях.
Алюминий отлично проводит тепло и электричество. Теплопроводность алюминия составляет от 50 до 60 процентов теплопроводности меди, что делает его очень применимым в крупномасштабном производстве кухонной утвари. Теплопроводность связана с переходом из одной среды в другую; таким образом, алюминиевые теплообменники используются в химической, пищевой и авиационной промышленности. Высокая проводимость алюминия (1350) составляет около 62 процентов от Международного стандарта на отожженную медь (IACS), что делает его эффективным для использования в качестве электрического проводника и имеет около трети удельного веса меди.
• Отражательная способность Гладкий алюминий обладает высокой отражательной способностью в электромагнитном спектре от радиоволн, а также в инфракрасном и тепловом диапазонах. Он отражает около 80% света и 90% тепла, попадающего на его поверхность. Эта высокая отражательная способность придает алюминию декоративный вид и делает его эффективным для защиты от излучения света и тепла в таких областях применения, как кровля и автомобильные теплозащитные экраны.
Он отражает около 80% света и 90% тепла, попадающего на его поверхность. Эта высокая отражательная способность придает алюминию декоративный вид и делает его эффективным для защиты от излучения света и тепла в таких областях применения, как кровля и автомобильные теплозащитные экраны.
Нетоксичность алюминия была открыта столетия назад при его первом промышленном использовании. Эта характеристика делает его пригодным для использования в кухонной утвари, не оказывая вредного воздействия на организм человека. Это также облегчает его использование в фольге для упаковки пищевых продуктов в перерабатывающей промышленности.
• Возможность повторного использования Повторное использование алюминия не имеет себе равных. Примечательно, что существует значительная разница в свойствах между переработанным и первичным алюминием. Около 5% энергии, используемой при производстве первичного алюминия, необходимо для переработки алюминия. В настоящее время около 60% алюминия перерабатывается в конце своего жизненного цикла.
В настоящее время около 60% алюминия перерабатывается в конце своего жизненного цикла.
В большинстве случаев алюминий не нуждается в защитном покрытии. Такие методы отделки, как пескоструйная обработка, полировка и чистка проволочной щеткой, удовлетворяют большинство потребностей в отделке, и в большинстве случаев используемая отделка поверхности достаточна и не требует дополнительной отделки. Там, где требуется чистый алюминий или дополнительная защита, применяется широкий спектр отделки поверхности, например, краска, химические и электрохимические методы.
• Прочность Чистый алюминий для коммерческого использования имеет предел прочности при растяжении 90 МПа, что делает его очень подходящим для конструкционных материалов. Работа над ним с помощью таких процессов, как холодная прокатка, делает его прочнее. Дальнейшее увеличение прочности достигается путем легирования его такими элементами, как медь, марганец и кремний в измеренных процентах. Сплавы намного прочнее и могут быть дополнительно упрочнены путем термической обработки.
Сплавы намного прочнее и могут быть дополнительно упрочнены путем термической обработки.
Отношение прочности к весу алюминия намного выше, чем у конструкционной стали. Эта особенность делает его подходящим для проектирования и строительства прочных и легких конструкций со многими преимуществами для движущихся конструкций, таких как корабли, транспортные средства и самолеты.
• Простота изготовления Легкость изготовления алюминия является одной из его важнейших особенностей из-за меньшей степени обрабатываемости любыми методами литья. Алюминий можно изготовить нужной толщины из фольги, которая тоньше бумаги, до алюминиевой проволоки, подлежащей прокатке, алюминиевых листов, которые можно прокатывать, штамповать и вытягивать. По сути, скорость и простота обработки алюминия в значительной степени способствуют низкой стоимости производства алюминиевых деталей. Металлический алюминий можно точить, фрезеровать и растачивать на высокой скорости, на что способны машины в сочетании с его гибким характером.
• Пластичность
Алюминий пластичен, что означает, что из него можно втягивать провода без разрушения. Однако его пластичность ниже, чем у меди. Алюминий также имеет низкую плотность и температуру плавления. В расплавленном виде алюминий можно отливать несколькими способами благодаря его гибкости для производства желаемых продуктов, таких как листы, фольга, трубы и стержни.
• Прочность при низких температурах
Алюминий и его сплавы доказали свою пригодность при низких температурах. В отличие от других металлов, таких как сталь, которые становятся хрупкими при воздействии низких температур, алюминий и его сплавы становятся прочнее. При низких температурах увеличивается не только прочность, но и показатели прочности при растяжении, текучести и ударных нагрузках. Кроме того, в этих условиях повышается коррозионная стойкость алюминия, что делает его пригодным для использования в холодных и ледяных регионах без ускоренного разрушения из-за наличия влаги.
• Непроницаемый и без запаха
Алюминий, даже свернутый в виде фольги, имеет толщину 0,007 мм, является достаточно непроницаемым и не выделяет запаха или вкуса. Кроме того, он нетоксичен и в сочетании с отсутствием запаха и непроницаемостью делает его идеальным для упаковки таких продуктов, как фармацевтические препараты и продукты питания.
• Немагнитный
Алюминий не притягивает магниты и поэтому на языке неспециалистов называется парамагнитным. Эта особенность делает его идеальным для экранирования антенн и компьютерных дисков.
• Звуко- и звукопоглощение
Алюминий хорошо поглощает звук, что делает его идеальным материалом для изготовления потолков на крышах и амортизаторов в автомобилях. Вспененный алюминий, его пористость, состав материала, толщина и различные виды обработки делают его звуко- и ударопроницаемым.
Источники и дополнительная литература
Алюминиевый сплав – Общая информация – Введение в алюминий и его сплавы . Aalco.co.uk. Получено 27 мая 2020 г. с http://www.aalco.co.uk/datasheets/Aluminium-Alloy_Introduction-to-Aluminium-and-its-alloys_9..ashx.
Aalco.co.uk. Получено 27 мая 2020 г. с http://www.aalco.co.uk/datasheets/Aluminium-Alloy_Introduction-to-Aluminium-and-its-alloys_9..ashx.
Асминтернэшнл.орг. (2020). Основные характеристики алюминия . Асминтернэшнл.орг. Получено 27 мая 2020 г. с https://www.asminternational.org/documents/10192/3456792/06787G_Sample.pdf/c4151917-99fc-46e8-a310-d5578d0af160.
ДЖУКАНОВИЧ, Г. (2016). Алюминиевые сплавы в судостроении – быстро развивающееся направление . Aluminiuminsider.com. Получено 27 мая 2020 г. с https://aluminiuminsider.com/aluminium-alloys-in-shipbuilding-a-fast-growing-trend/.
Коррозионные свойства алюминия и его сплавов
За последние 100 лет алюминий и алюминиевые сплавы нашли широкое применение практически во всех отраслях промышленности, уступая только стали. Основная причина заключается в относительной распространенности материала наряду с его высокими механическими и металлургическими свойствами.
Advertisement
Эти же свойства могут быть точно разработаны для соответствия широкому спектру требований с использованием различных процессов легирования, отпуска и изготовления. Гибкость алюминиевых сплавов, наряду с присущей им коррозионной стойкостью, позволила использовать их в различных отраслях промышленности, от транспорта, упаковки и общего строительства до аэрокосмической промышленности.
Гибкость алюминиевых сплавов, наряду с присущей им коррозионной стойкостью, позволила использовать их в различных отраслях промышленности, от транспорта, упаковки и общего строительства до аэрокосмической промышленности.
Основные свойства алюминия
Алюминий — металлический химический элемент. Его атомы образуют кристаллическую решетку, подобную кристаллической решетке аустенитных сталей, а это означает, что у него нет температуры вязко-хрупкого перехода (в отличие от неаустенитных сталей).
Реклама
Кроме того, он легче стали, при этом его плотность составляет всего одну треть. Однако алюминиевые сплавы имеют высокое отношение прочности к весу. Чистый алюминий — достаточно пластичный материал с низкой прочностью на растяжение, но высокопрочные сплавы могут иметь прочность на растяжение до 690 МПа (100 фунтов на квадратный дюйм).
Кроме того, алюминий сохраняет свою прочность при экстремально низких температурах, что делает его хорошим материалом для криогенных применений. Он также является отличным проводником тепла и электричества и не является ферромагнитным, что является важной характеристикой для использования в электронной и электротехнической промышленности (узнайте больше об этом предмете в разделе «Контроль коррозии в электронных устройствах»).
Он также является отличным проводником тепла и электричества и не является ферромагнитным, что является важной характеристикой для использования в электронной и электротехнической промышленности (узнайте больше об этом предмете в разделе «Контроль коррозии в электронных устройствах»).
Алюминий обладает высокой отражающей способностью и имеет привлекательную естественную отделку. Большинство сплавов легко перерабатываются и нетоксичны, что делает их отличным выбором для упаковки продуктов питания и напитков.
Кроме того, его можно легко изготовить с помощью большинства распространенных методов металлообработки, а его свариваемость варьируется от довольно хорошей до приличной, в зависимости от сплава.
Реклама
Естественная коррозионная стойкость алюминия
Одним из важнейших свойств алюминия является его коррозионная стойкость, которая позволяет конструкциям иметь достаточно длительный срок службы даже в тех случаях, когда указанная конструкция подвергается экстремальным погодным изменениям, морская вода и пресноводная среда или различные почвы и химические вещества.
В сочетании с отличными механическими свойствами, эта естественная коррозионная стойкость способствовала использованию алюминия практически во всем: от строительства кораблей, трубопроводов, линий электропередач, различных резервуаров и трубопроводов для химикатов до производства напитков и продуктов питания, а также высокоэффективных аэрокосмических приложений (для более о применении в аэрокосмической отрасли см. «Авиационные покрытия для предотвращения коррозии»).
По иронии судьбы причина такой коррозионной стойкости не в низкой реакционной способности алюминия, а совсем в другом. Алюминий является высокореактивным элементом, и только бериллий и магний более реакционноспособны из всех конструкционных металлов.
Однако та же самая реакционная способность заставляет чистый алюминий спонтанно связываться с кислородом в высокоинертный оксидный слой. Этот оксидный барьер имеет толщину всего 5 нм (50 Å) в нормальной атмосфере, но этого более чем достаточно для защиты ядра, поскольку слой мгновенно восстанавливается в случае повреждения (при условии присутствия кислорода).
Кроме того, в то время как температура плавления чистого алюминия довольно низкая и составляет 660°C (1220°F), эта оксидная пленка имеет температуру плавления более 2000°C (3632°F), что делает сварку алюминия довольно сложной. Используется переменный ток, так как он способен разорвать пленку, а не расплавить ее.
По сути, единственные ситуации, когда алюминий подвержен коррозии, это когда нет кислорода для восстановления поврежденного оксидного слоя или если слой поврежден быстрее, чем может произойти самовосстановление (например, в чрезвычайно кислых средах). ).
Коррозия алюминия
Коррозия алюминия обычно связана с потоком электронов между анодной и катодной областями материала в электролите, как это обычно происходит при электрохимической коррозии других распространенных металлов. Интенсивность коррозии в этом случае зависит от разности потенциалов двух областей, что обусловлено дефектами микроструктуры, вызванными изготовлением, сваркой и другими способами соединения. Эффект дополнительно усиливается разницей в электрическом потенциале легирующих материалов (сплав никогда не бывает идеально однородным, поэтому существуют микрообласти, где легирующий материал может находиться в несколько больших количествах).
Эффект дополнительно усиливается разницей в электрическом потенциале легирующих материалов (сплав никогда не бывает идеально однородным, поэтому существуют микрообласти, где легирующий материал может находиться в несколько больших количествах).
Само собой разумеется, что этот эффект только усугубляется, если алюминиевый сплав находится в контакте с металлом (или другим сплавом) с другим потенциалом.
Из-за антикоррозионного эффекта оксидной пленки образование однородной коррозии редко, и более вероятно, что произойдет некоторая форма локализованной коррозии, обычно из-за сочетания электрохимических и механических факторов. .
Чаще всего это происходит в форме механической деградации, при которой процесс коррозии усиливается питтингом, кавитацией, эрозией и истиранием.
Локальная коррозия также может быть вызвана коррозионным растрескиванием под напряжением (SCC), когда мы имеем статическое растягивающее напряжение в агрессивной среде, или коррозионной усталостью, если нагрузки (и напряжения) являются динамическими.
С другой стороны, хотя однородная коррозия алюминия встречается редко, она может возникать в сильнокислой или щелочной среде (поэтому следует избегать значений pH ниже 4 или выше 9).
В средах, где оксидная пленка может растворяться, таких как гидроксид натрия или фосфорная кислота, алюминий разрушается с постоянной скоростью, зависящей от концентрации и температуры раствора. В зависимости от этих факторов коррозия может варьироваться от поверхностного повреждения до полного и быстрого растворения. Эту равномерную коррозию легче всего оценить, измерив потерю веса или толщины.
Равномерная коррозия наиболее распространена в чистом алюминии, разбавленных сплавах и нетермообрабатываемых сплавах. Шероховатость поверхности, изменения толщины и различные концентрации легирующих элементов могут значительно изменить состав поверхности материала и создать локальные области положительных и отрицательных ионов, которые приводят к более локальным формам коррозии.
Кроме того, если поверхностный оксидный слой нерастворим в окружающей среде, это приводит к локализованным слабым местам в пленке, где вероятность коррозии значительно выше, чем в других областях. Как уже говорилось, на эти слабые места дополнительно влияет механическое воздействие.
Как уже говорилось, на эти слабые места дополнительно влияет механическое воздействие.
Наиболее распространенными видами локальной коррозии алюминия являются:
- Точечная коррозия.
- Щелевая коррозия, включая пятнающую коррозию и коррозию припарки.
- Нитевидная коррозия.
- Межкристаллитная коррозия.
- Отслаивающая коррозия, представляющая собой более серьезную форму межкристаллитной коррозии, которая часто возникает в оперении фюзеляжа и обшивке крыльев самолетов.
- Гальваническая коррозия (Хотя гальваническая коррозия обычно имеет сильно локализованный характер, в некоторых случаях она может проявляться в виде равномерного утончения материала, если она происходит в присутствии высокопроводящего электролита и если анодная площадь достаточно велика).
- Биологическая коррозия, которая обычно сопровождает и ускоряет точечную или щелевую коррозию.
Как равномерная, так и локальная коррозия носят электрохимический характер, а в случае локальной коррозии (которая встречается чаще) она вызвана разницей электрического потенциала локализованной области.

