Коррозия алюминий – Коррозия алюминия
alexxlab | 18.08.2019 | 503 | Разное
Коррозия алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия – 660 °C.
Плотность алюминия – 2,6989 г/см3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!

Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 → 2Al2O3.
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.

Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.
Образуются алюминаты.
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
www.okorrozii.com
Предотвращение коррозии алюминия
Алюминий и, в разной степени, его сплавы обладают высокой стойкостью к коррозии даже без какого-либо специального защитного покрытия.
Естественное оксидное покрытие
Естественная поверхность алюминия, которая возникает в ходе изготовления алюминиевого изделия, например, прессованием, прокаткой или литьем, имеет высокое сопротивление коррозии в большинстве типов окружающей среды. Это происходит потому, что свежая поверхность алюминия спонтанно и мгновенно образует тонкий, но очень эффективный оксидный слой, который предотвращает дальнейшее окисление металла.
Эта оксидная пленка является непроницаемой и, в отличие от оксидных пленок других металлов, например, железа, очень прочно «прикрепляется» к основному металлу. При каком-либо механическом повреждении эта пленка мгновенно восстанавливается, залечивается.
Естественный оксидный слой и является главной причиной хорошего сопротивления алюминия к коррозии. Это покрытие является стойким в средах с кислотностью – водородным показателем рН – от 4 до 9.
Три главных вида коррозии алюминия
Наиболее частыми видами коррозии алюминия являются:
- гальваническая (контактная) коррозия;
- язвенная (точечная) коррозия;
- щелевая коррозия.
Коррозия под напряжением, которая ведет к образованию трещин, является более специфическим видом коррозии. Она случается в основном в высокопрочных алюминиевых сплавах, например, сплавах AlZnMg, когда они подвергаются длительным растягивающим напряжениям в присутствии коррозионной среды. Этот тип коррозии обычно не происходит в сплавах серии 6ххх, то есть сплавах AlMgSi.
Гальваническая коррозия алюминия
Гальваническая коррозия может случаться тогда, когда два различных металла находятся в непосредственном контакте и между ними образовался электролитический мост. Менее благородный металл в этой комбинации становится анодом и корродирует. Более благородный металл становиться катодом и находится под защитой от коррозии.
В большинстве комбинаций с другими металлами алюминий является менее благородным металлом. Поэтому алюминий подвержен более высокому риску гальванической коррозии, чем другие строительные материалы. Однако, этот риск меньше, чем это обычно считается.
Необходимые условия: контакт и влага
Гальваническая коррозия алюминия происходит только тогда, когда одновременно:
- есть контакт с более благородным металлом (или другим электрическим проводником с более высоким химическим потенциалом, чем у алюминия, например, графитом;
- между двумя металлами находится электролит с хорошей проводимостью, чаще всего, вода с растворенными солями.
Гальваническая коррозия не происходит в сухой воздушной атмосфере, например, внутри нормального жилого помещения. Нет большого риска гальванической коррозии и чистой сельской атмосфере. Вместе с тем, риск гальванической коррозии необходимо всегда принимать в расчет в атмосферах с высоким содержанием хлоридов, например, в районах вблизи морей и океанов.
Алюминий и оцинкованная сталь
Могут быть проблемы с гальванической коррозией и в паре алюминия с оцинкованной сталью. Цинковое покрытие оцинкованной стали будет сначала защищать алюминий от коррозии. Однако, эта защита снижается, когда поверхность стали начинает обнажаться по мере расходования цинка. Горячее цинкование стали дает большую толщину цинкового покрытия, чем электрохимическое цинкование и обеспечивает более длительную защиту алюминия. Поэтому в агрессивной атмосфере в контакте с алюминием применяют только оцинкованную сталь горячего цинкования.
Электрическая изоляция
Там, где различные металлы применяются в контакте, гальванической коррозии можно избежать путем электрической изоляции одного металла от другого. Пример такого решения для болтового соединения между алюминиевым и стальным листом приведен на рисунке 1. Между головкой болта и поверхностью алюминия может возникнуть электролит, но электроизолирующая шайба не даст возможности протекать гальваническому электрическому току и коррозии не произойдет. С другой стороны в контакте алюминиевого и стального листа отсутствует возможность попадания влаги, электролит не образуется и коррозия не происходит.
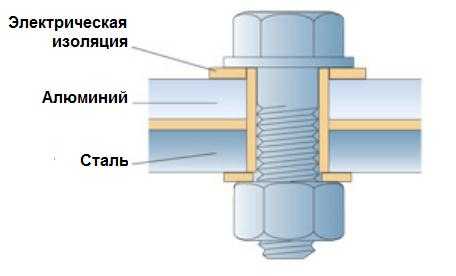 Рисунок 1 – Электрическая изоляция алюминия от стали
Рисунок 1 – Электрическая изоляция алюминия от стали
Разрыв электролитической цепи
В больших конструкциях, там, где применение электроизоляции затруднительно, применяют альтернативное решение – предотвращение электролитического мостика между двумя металлами. Окраска поверхности – это один из путей сделать это. Чаще всего лучшим вариантом является окраска поверхности катода, то есть более благородного металла.
Катодная защита
Катодная защита от коррозии может достигаться двумя путями. Чаще всего – это установка анода из менее благородного металла в прямом металлическом контакте с алюминием. Этот менее благородный металл «жертвует» собой, то есть корродирует вместо алюминия. Поэтому его называют жертвенным анодом.
Чтобы такой жертвенный анод работал, он должен быть в жидком контакте с защищаемой алюминиевой поверхностью. Для защиты алюминия в качестве жертвенных анодов чаще всего применяют цинк и магний. Пример катодной защиты показан на рисунке 2.
Другим путем получения катодной защиты является подсоединение алюминиевого объекта к отрицательному полюсу выпрямителя тока.
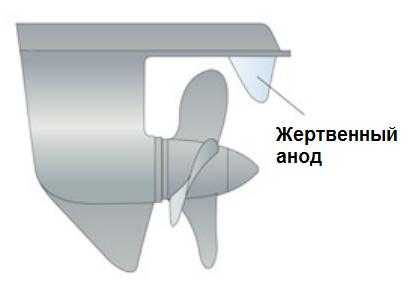 Рисунок 2 – Катодная защита алюминиевого винта судна
Рисунок 2 – Катодная защита алюминиевого винта судна
Язвенная коррозия алюминия
Для алюминия именно язвенная коррозия является наиболее частым видом коррозии. Она также случается только в присутствии электролита (воды или влаги), который содержит растворенные соли, обычно хлориды.
Эта коррозия обычно выглядит как очень маленькие ямки, которые на открытом воздухе достигают максимальной глубины незначительной части толщины металла. Глубина этих ямок может быть больше в воде и почве.
Предотвращение язвенной коррозии
Язвенная коррозия является в основном вопросом эстетическим, потому что, в практическом смысле, никогда не снижает прочности алюминиевых изделий.
Проявление язвенной коррозии, конечно, бывает более серьезным на алюминии с естественной поверхностью, то есть поверхностью без какой-либо защитной обработки. Защитная обработка поверхности алюминия (анодирование, окраска или другие методы нанесения покрытий) успешно защищает его от язвенной коррозии.
Для предотвращения язвенной коррозии применяют также катодную защиту (см. выше).
Конструирование дренажа
Очень важно проектировать алюминиевые профили и другие алюминиевые изделия так, что они имели возможность дренажа осадков и быстрого высыхания поверхности. Профили, которые могут подвергаться воздействию влаги, не должны иметь углов или карманов, в которых скапливается вода. Каждый профиль, в котором может скапливаться вода, должен иметь дренажные отверстия (рисунок 3).
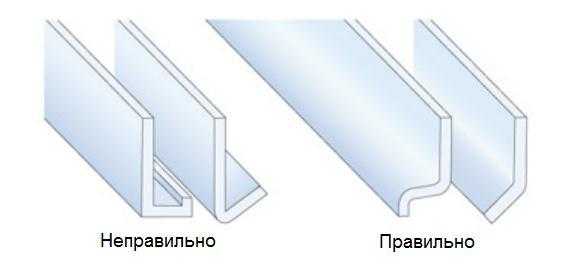 Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Эффективный дренаж (рисунок 4) и вентилирование «мокрых» алюминиевых профилей значительно снижает риск появления на них язвенной коррозии.
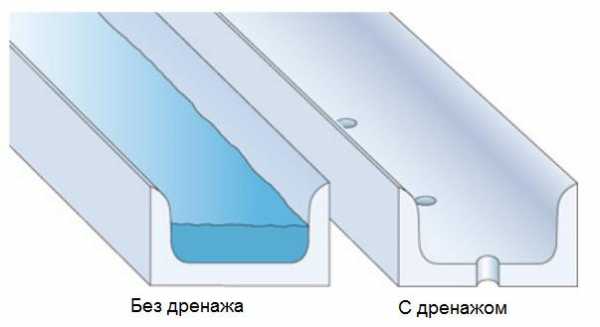 Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Щелевая коррозия алюминия
Сущность щелевой коррозии
Щелевая коррозия может возникать в узких, наполненных жидкостью щелях. Возникновение такой коррозии в алюминиевых профилях маловероятно. Однако, значительная щелевая коррозия может возникать в морской атмосфере или на наружной поверхности кузовов транспортных средств. В ходе транспортирования и хранения алюминиевых профилей иногда может собираться вода в щелях между смежными алюминиевыми поверхностями, которая вызывает поверхностную коррозию в виде «водяных пятен» (рисунок 4).
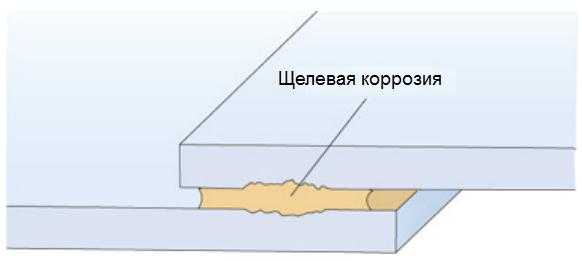 Рисунок 5 – Сущность щелевой коррозии
Рисунок 5 – Сущность щелевой коррозии
Источником этой воды является дождь или конденсация влаги. Эта вода по капиллярному механизму буквально засасывается в пространство между двумя металлическими поверхностями. Конденсация влаги может возникать тогда, когда холодный материал помещают в теплое помещение. Разность между ночной и дневной температурами может также вызывать конденсацию, когда алюминий хранится снаружи под плотным тентом, который препятствует вентиляции.
Предотвращение щелевой коррозии
На соединяемые поверхности наносят герметики или двухсторонний скотч. Это предотвращает попадание в зазор между ними воды и предотвращает возникновение щелевой коррозии.
В некоторых случаях вместо соединения на заклепках и винтах применяют клеевое соединение. Это также противодействует образованию щелевой коррозии.
 Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Источник: Материалы корпорации SAPA
См. продолжение: Когда и как защищать алюминий от коррозии
aluminium-guide.ru
Коррозия алюминия и его сплавов (док)
Низкая плотность и механическая прочность в сочетании с удовлетворительной стойкостью к коррозии делают алюминий привлекательным конструкционным материалом, который широко используется в строительстве. Однако с химической точки зрения алюминий — один из наиболее реакционноспособных металлов, который активно взаимодействует не только с кислотами и щелочами, но и с водой! Кажущееся противоречие очень просто объясняется: под воздействием кислорода (или других окислителей) поверхность металлического алюминия покрывается прочной, химически устойчивой оксидной пленкой, предохраняющей металл от разрушения. Это явление называется пассивацией. Металл пассивен в том случае, когда при взаимодействии с потенциальным источником коррозии он не подвергается изменениям, и активен тогда, когда агрессивное вещество его разрушает.
Напомним, что коррозией называется процесс разрушения металлов и их сплавов в результате химического или электрохимического воздействия окружающей среды.
Металл, стойкий к коррозии в одних условиях, может разрушаться в других. Так, например, алюминий стоек к коррозии, вызываемой жидким топливом, и не стоек к действию натриевой щелочи (так называемое явление пассивности и активности).
Окись алюминия создает химически инертный защитный слой, толщина которого составляет 20—100Å. Алюминий, поверхность которого очищена от защитной пленки, может реагировать с водой, выделяя при этом водород. Под влиянием окислителей поверхность алюминия пассивируется, поэтому кислород, содержащийся в воздухе или растворенный в воде, повышает его коррозионную стойкость.
Коррозионная стойкость алюминия в значительной степени зависит от содержания примесей других металлов. Как известно, при контакте двух металлов, погруженных в среду электролита, образуется гальваническая пара, где более активный металл становится анодом, а менее активный — катодом. В результате электрохимической реакции анод разрушается. Большинство примесей (за исключением металлов, более активных, чем алюминий) играют роль катода по отношению к алюминию, т.е. способствуют его разрушению.
По этой причине алюминий высокой чистоты отличается более высокой коррозионной стойкостью, чем технический металл, который, в свою очередь, более устойчив к коррозии, чем сплавы алюминия. Кроме того, коррозионная стойкость алюминия зависит от характеристик окружающей среды и от реакций, вызываемых этой средой в алюминии.
Механизм коррозии алюминия
В присутствии окислителей поверхность алюминия покрывается защитным слоем окиси алюминия.
Защитный слой, в свою очередь, состоит из двух слоев:
Внутреннего слоя Al2O3, который образуется при непосредственной реакции кислорода с металлом. Внутренний слой оксида прочно прилегает к металлу основы, а его структура и толщина зависят от температуры окисления.
Наружного, образующегося в результате реакции внутреннего слоя с внешней средой, в основном, с водой. Толщина этого слоя зависит от времени протекания коррозии и концентрации агрессивных веществ в окружающей среде. Увеличение толщины наружного слоя происходит за счет окисления металла основы. Наружный слой порист, он пропускает воздух и влагу.
В результате коррозионных процессов на поверхности алюминия общая толщина защитного слоя увеличивается, но толщина внутреннего слоя при этом остается постоянной. Схема механизма образования защитного слоя представлена на рис. 1.

Виды коррозии
Коррозию металлов можно разделить на химическую и электрохимическую.
Электрохимическая коррозия происходит при действии на металл растворов электролитов (т.е. растворов, содержащих носители электрического тока — ионы) и сопровождается возникновением электрического тока.
Химическая коррозия происходит при воздействии на металл сухих газов, пыли, жидких веществ (не электролитов) и не сопровождается возникновением электрического тока.
Разрушающее действие коррозии всегда начинается с поверхности металла. Затем коррозия распространяется в глубину со скоростью, зависящей от вида металла или сплава, его состава, структуры, характеристик, а также состава и характеристик окружающей среды. Этому процессу чаще всего сопутствуют изменения внешнего вида поверхности: она становится матовой, изменяет цвет, появляются точки, пятна, вздутия и т. д.
В результате взаимодействия алюминия с окружающей средой образуются вещества (продукты коррозии), свойства которых в значительной мере влияют на протекание коррозионных процессов. Рассмотрим возможные разновидности такого влияния:
В процессе коррозии образуются летучие или растворимые вещества, которые легко и быстро удаляются с места реакции и не препятствуют распространению коррозии. В результате реакция проходит по всей поверхности металла, доступной для коррозионного воздействия, и без помех распространяется в глубину.
На поверхности металла возникают тонкие, прозрачные, прочно связанные с металлом слои, которые перекрывают доступ агрессивного реагента к металлу основы. Эти слои являются причиной так называемой “пассивации” поверхности. С образованием такого слоя коррозия практически полностью останавливается, а остаточные процессы происходят только на наружной поверхности слоя, который может частично растворяться в агрессивной среде.
Неоднородность поверхностного слоя приводит к проявлению неравномерной или местной коррозии. Слой продуктов коррозии неравномерно распределяется по всей поверхности корродирующего металла.
В зависимости от свойств продуктов коррозии можно выделить следующие разновидности последней:
Локальная коррозия в виде пятен на поверхности металла.
Локальная коррозия в виде разъеданий, которая возникает в случае, если процесс происходит на поверхности малой площади и интенсивно распространяется вглубь металла.
Межкристаллическая коррозия, возникающая в случае, если агрессивное вещество поступает вглубь металла и разрушает внешние границы кристаллов (зерен), из которых состоит сплав. Продукты коррозии остаются внутри металла, причем на наружной поверхности не происходит никаких заметных изменений. Это особенно опасный вид коррозии с точки зрения скорости процесса. В этом случае материал, создающий границу зерен, выполняет роль анода по отношению к зернам, которые занимают значительную площадь и действуют, как катод.
Коррозия напряжения и ее разновидность — коррозия усталости, возникающая в случае, если, помимо воздействия коррозионной среды, изделие из металла подвергается постоянным или переменным нагрузкам.
Селективная (избирательная) коррозия, во время которой одна или несколько составных частей сплава подвергается коррозии, а пористая основа сплава сохраняет первоначальную форму изделия.
Электрохимическая коррозия
В техническом алюминии (или в его сплавах) содержатся примеси металлов в виде отдельных вкраплений (магний, титан, железо, марганец и др.)
Благодаря наличию таких вкраплений сплав, погруженный в электролит, представляет собой совокупность большого количества микроскопических гальванических очагов. В результате электрохимической реакции, возникающей в этих очагах, металл, выступающий в роли анода (а в нашем случае это основной компонент сплава, алюминий), растворяется, в то время как на микрокатодах выделяется водород (рис. 2).
Такие микроисточники коррозии по своей природе являются обычными гальваническими элементами и отличаются:
1 микроскопическими размерами анода и катода;
2 горизонтальным расположением электродов;
3 прямым соединением катода и анода.
Процесс электрохимической коррозии не всегда является результатом возникновения микроскопических гальванических элементов. В ряде случаев очаги коррозии имеют “видимые” (макроскопические) размеры.
Механизм электромеханического коррозионного разрушения для разной величины поверхности катода (сталь) и анода (алюминий) представлен на рис. 3.
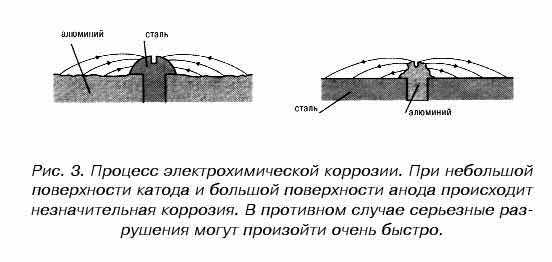
Атмосферная коррозия
Атмосферной коррозией называют процесс разрушения металлов на воздухе в результате происходящих на их поверхности химических и электрохимических реакций. Это наиболее распространенный пример разрушения металлов.
Основной причиной атмосферной коррозии является тонкий слой влаги, который образуется на поверхности металла, если его температура находится ниже точки росы. С понижением температуры или при увеличении содержания водяного пара в воздухе излишек пара оседает в виде капель воды.
Если поверхность негладкая, покрыта пылью и слоями продуктов коррозии, то значительно раньше достижения точки росы во всех углублениях, порах и трещинах конденсируется пар и образуется слой воды.
Некоторые газообразные вещества, содержащиеся в атмосфере, такие как оксиды азота, серы, хлорид водорода и другие, растворяются в конденсированной влаге, образуя кислоты. Поскольку растворимость этих веществ в воде очень высока, они концентрируются в слое воды даже тогда, когда их содержание в воздухе сравнительно невелико.
Скорость коррозии зависит как от характеристик коррозионной среды (внешних факторов), так и от характера самого металла (внутренних факторов).
К внешним факторам относятся:
К внутренним факторам относятся:
химический состав сплава;
структура металла;
внутренние напряжения.
Влияние атмосферы на процесс коррозии зависит от климатической зоны, уровня развития промышленности в регионе и загрязненности атмосферы. Наиболее существенными факторами, определяющими коррозионные свойства атмосферы, являются содержание пыли, газов, влажность и температура.
Влиянием этих факторов объясняется различная скорость процесса коррозии в различных точках земного шара. Например, чем ближе к морю, тем больше в воздухе морских солей, ускоряющих коррозию, особенно NaCl. В регионах, где много промышленных объектов, в воздухе много таких соединений, как SO2.
Отметим, что скорость коррозии на воздухе, как правило, значительно ниже, чем в пресной воде или почве. Атмосферную коррозию можно разделить на сухую, влажную и морскую.
Сухая (газовая) атмосферная коррозия проходит в условиях полного отсутствия влаги на поверхности металла. Этот вид коррозии протекает очень медленно. Если в атмосфере содержатся агрессивные газы, то скорость коррозии значительно ускоряется.
Влажная атмосферная коррозия протекает в слое электролита малой толщины. Скорость процесса зависит от влажности воздуха, атмосферных загрязнений и гигроскопичности продуктов коррозии: если эти вещества задерживают влагу на поверхности металла, скорость коррозии возрастает.
Морская атмосферная коррозия. В регионах с морским климатом в состав атмосферы входит большое количество солей, на поверхности металла собираются капли морской воды, соли и другие загрязнения, ускоряющие коррозию.
Взаимодействие алюминия и его сплавов с другими металлами и сплавами
В среде электролита два различных металла, соприкасающиеся между собой или соединенные проводником, образуют гальванический элемент, в котором генерируется электрический ток. Направление движения электронов в гальваническом элементе определяется величинами электродных потенциалов металлов, значения которых приведены в таблице 1. Электроны движутся от металла с более высоким потенциалом (анода) к металлу с низшим потенциалом (катоду). В такой ситуации металл с высоким потенциалом (и большей химической активностью) разрушается.
Таблица 1.
Снижение | Реакция на | Стандартный | Элемент |
|---|---|---|---|
↓ | Ca=Ca2++2e– | +2.87 | Кальций |
| Mg=Mg2++2e– | +2.37 | Магний | |
| Al=Al3++3e– | +1.66 | Алюминий | |
| Ti=Ti2++2e– | +1.63 | Титан | |
| Mn=Mn2++2e– | +1.18 | Манганин | |
| Zn=Zn2++2e– | +0.76 | Цинк | |
| Cr=Cr3++3e– | +0.74 | Хром | |
| Fe=Fe2++2e– | +0.44 | Железо | |
| Cd=Cd2++2e– | +0.40 | Кадмий | |
| Ni=Ni2++2e– | +0.25 | Никель | |
| Sn=Sn2++2e– | +0.136 | Олово | |
| Pb=Pb2++2e– | +0.126 | Свинец | |
| H2=2H++2e– | 0.000 | Водород | |
| Cu=Cu2++2e– | -0.337 | Медь | |
| Cu=Cu++e– | -0.521 | Медь | |
| 2Hg=Hg22++2e– | -0.789 | Ртуть | |
| Ag=Ag++e– | -0.800 | Серебро | |
| Hg=Hg2++2e– | -0.854 | Ртуть | |
| Au=Au3++3e– | -1.50 | Золото |
В таблице 1 представлены значения стандартных электродных потенциалов (электрохимический ряд напряжений) для элементов, которые входят в состав алюминиевых сплавов или металлических соединений, использующихся в алюминиевых конструкциях.
Интенсивность коррозии, возникающей при соединении двух металлов, зависит от их расположения в ряду напряжений (разности потенциалов), от соотношения площади поверхности и уровня их поляризации.
Чем больше разность потенциалов в гальваническом элементе, тем выше напряжение и тем интенсивнее разрушается анод. Значения потенциалов, приведенные в электрохимическом ряде напряжений, определены для стандартных условий (температура 25°С и единичная активность ионов в растворе электролита). Нужно учитывать, что в зависимости от состава электролита эти значения могут меняться. Так, например, в щелочных растворах алюминий корродирует значительно сильнее, чем в кислых.
Цинк, потенциал которого близок к потенциалу алюминия, может использоваться для непосредственного контакта с алюминием. Если такой контакт происходит в нейтральных и кислых средах, цинк выполняет функцию анода и поэтому защищает катодный алюминий от коррозии. Однако в щелочных средах, наоборот, активность алюминия возрастает, поэтому цинк ускоряет коррозию алюминия.
При контакте стальных оцинкованных деталей (шурупов и т.д.) с алюминием слой цинка вначале обеспечивает защиту алюминия, но после стирания цинка стальная поверхность становится открытой, что может привести к коррозии алюминия. В контакте с алюминием рекомендуется применение стали, оцинкованной горячим методом, поскольку в этом случае толщина покрытия больше, чем при электролитической оцинковке.
Ни в коем случае алюминий не должен соединяться с медью и ее сплавами, поскольку это приводит к быстрой коррозии алюминия (так называемой “катастрофической коррозии”). В связи с этим в алюминиевых конструкциях недопустимы всякого рода элементы и дополнения из меди.
По этой же причине не следует допускать влияния на алюминий дождевой воды, которая стекает с медных крыш и труб непосредственно на алюминиевые конструкции, даже тогда, когда она содержит небольшие количества ионов меди.
Следует также избегать контакта с оловом и его соединениями, особенно в атмосфере, загрязненной промышленными отходами. Соли олова, образующиеся в кислой среде, сильно разрушают поверхность алюминия.
Свинцовый сурик, при наличии влаги, содержащей кислоту, проявляет сильную коррозионную активность. Поэтому при контакте с алюминием следует избегать стальных элементов, покрытых свинцовым суриком.
Ртуть и ее соли уже в присутствии следов влаги вызывают сильную коррозию алюминия. В этом случае процесс коррозии усиливается благодаря образованию амальгамы: амальгамированный алюминий интенсивно взаимодействует с водой в даже отсутствие кислот и щелочей! Поэтому при складировании алюминиевых профилей даже пары ртути (из разбитой лампочки) могут привести к мгновенной коррозии.
Соединение алюминия и стали допустимо в сельской местности, но на приморских и промышленных территориях сталь ускоряет коррозию алюминия. Поэтому при контакте стали и алюминия необходимо избегать их непосредственного контакта, например, путем оцинковки стали, покраски алюминия с одновременным использованием изолирующих прокладок из синтетических материалов.
При соединении железа, никеля и хрома с алюминием возникает значительная разность потенциалов, поэтому их не следует соединять непосредственно друг с другом. Кроме того, соли этих металлов (хлориды, сульфаты и т. д.), которые образуются в результате их коррозии, также способствуют разрушению алюминия.
Химическая коррозия
Процесс химической коррозии протекает при воздействии сухих газов, жидких неэлектролитов и других материалов (в том числе и строительных) на алюминий.
В результате химической коррозии на поверхности алюминия образуется защитный слой, состоящий из продуктов коррозии и препятствующий взаимодействию агрессивных веществ с металлом. Скорость и вид химической коррозии определяет процесс диффузии агрессивного вещества через защитный слой.
Как мы упоминали ранее, слой окиси алюминия возникает на поверхности в результате окисления металла кислородом воздуха. На воздухе в отсутствие влаги толщина этого слоя в течение нескольких минут достигает 10 Å.
Химическая стойкость сплавов алюминия
Вода
В дистиллированной воде алюминий проявляет очень хорошие показатели стойкости к коррозии при любой температуре.
Дождевая вода может разрушать алюминий, если в атмосфере содержится значительное количество промышленных газов. Растворяясь в воде, это газы (SO2, NO2, хлороводород и т.д.) образуют кислоты, разрушающие алюминий. Поэтому во избежание коррозии алюминиевые конструкции следует проектировать так, чтобы свести до минимума скапливание дождевой воды на поверхности металла.
Водопроводная вода действует на алюминий по-разному, в зависимости от содержащихся в ней примесей. В кислых или щелочных водах алюминий может подвергаться коррозии. Процесс коррозии ускоряют ионы хлора или тяжелых металлов, содержащиеся в водопроводной воде.
Промышленные сточные воды вызывают очень сильную коррозию, которую ускоряют ионы тяжелых металлов.
Газы
Водород, азот и благородные газы (гелий, аргон, неон, криптон, ксенон) не действуют на алюминий даже при повышенных температурах.
Галогены (хлор, бром, йод, фтор) в отсутствие влаги не действуют на алюминий. При взаимодействии с водой они образуют кислоты, агрессивные по отношению к алюминию.
Сухие хлороводород, бромоводород, йодоводород, фтороводород не действуют на алюминий. Но водные растворы этих газов — кислоты, активно разрушающие алюминий.
Сероводород не разрушает алюминий при температуре до 500°С.
Двуокись серы в отсутствие водяного пара не разрушает алюминий (до 400°С), хотя при наличии влаги вызывает коррозию. Аналогично действует и триокись серы.
Аммиак в газообразном состоянии не действует на алюминий даже при высоких температурах.
Оксид углерода СО разрушает алюминий только при температуре свыше 550°С.
Углекислый газ ведет себя аналогично СО. В воде углекислый газ образует угольную кислоту, не вызывающую значительных коррозионных разрушений.
Неорганические соединения
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.
Органические соединения
Не вызывают коррозии:
Все насыщенные углеводороды, бензол, толуол, нафталин.
Алифатические спирты (взаимодействие с алюминием возможно только после испарения воды и только при нагревании). Метиловый спирт вызывает незначительную коррозию в водном растворе, самую сильную — при 25% содержании воды. Другие спирты, такие как этиловый, пропиловый, глицерин и его производные, не приводят к коррозии алюминия.
Фенол и его водные растворы (незначительное разрушение происходит при температуре свыше 60°С и концентрации 50%). Аналогично ведут себя производные фенола.
Сложные эфиры.
Альдегиды, в том числе формалин, акролеин, бензальдегид.
Кетоны.
Фреоны.
Амины и амиды.
Некоторые галогенсодержащие соединения (например, поливинилхлорид).
Углеводы: глюкоза, лактоза, целлюлоза.
Приводят к незначительной коррозии:
Некоторые органические соединения хлора, выделяющие соляную кислоту вследствие гидролиза в водных растворах.
Водные растворы органических кислот: уксусной, муравьиной, монохлоруксусной, щавелевой, винной, лимонной, яблочной, салициловой, аскорбиновой и т. д.
Сильно действуют на алюминий:
Некоторые органические кислоты при полном отсутствии воды.
Соли органических кислот могут создавать источники локальной коррозии.
Четыреххлористый углерод вызывает сильную коррозию в присутствии следов влаги.
Большинство соединений галогенов разрушают алюминий, скорость коррозии увеличивается с ростом температуры. Коррозионная активность галогена уменьшается в следующей последовательности: F-Cl-Br-I.
Некоторые серосодержащие органические соединения, например этилсерная кислота.
Материалы естественного происхождения
Не действуют на алюминий:
Каменная соль.
Продукты нефтеперегонки: бензин, керосин, парафин, масла, смолы.
Воск.
Каучук.
Эфирные масла.
Каменный уголь, антрацит, бурый уголь.
Целлюлоза.
Белки.
Природный гипс.
Особо чистые виды нефти.
Действуют на алюминий:
Нефть, а точнее — содержащиеся в ней загрязнения, в основном, вода с растворенными в ней солями, которые в результате гидролиза образуют кислоты.
Дубильные вещества.
Средства для импрегнации древесины.
Глина.
Продукция синтетической химии и промышленные продукты
Не действуют на алюминий:
Синтетические смолы.
Инсектецидные средства (за исключением арсената натрия).
Косметические препараты.
Лаки.
Органические красители.
Некоторые клеи, не содержащие солей тяжелых металлов.
Действуют на алюминий умеренно или сильно:
Чистящие средства.
Моющие средства.
Некоторые косметические препараты (кислые или щелочные).
Одеколон.
Неорганические красители.
Чернила и тушь.
Клеи.
Продукты сгорания органических веществ, в особенности серо- и азотсодержащих.
Строительные материалы
На практике монтажные работы очень часто реализуются параллельно со строительными, так называемыми “мокрыми” работами.
Строительные материалы, такие, как штукатурки, портланд-цемент, бетон, мел, очень сильно влияют на алюминий, поскольку при контакте с водой дают щелочную реакцию. Под воздействием этих материалов в присутствии влаги на контактных поверхностях необработанного, анодированного, и даже алюминия с порошковым покрытием появляются пятна.
Коррозия длится до затвердевания штукатурки, цемента или бетона. В случаях, когда бетонная конструкция периодически подвергается увлажнению, ее следует изолировать от алюминия битумной прокладкой. Рекомендуется изолировать алюминий от наружных железобетонных конструкций. В сухих помещениях, когда бетон “схватился”, поверхность алюминия можно не изолировать.
Особенно вредно для алюминия действие бетонов, содержащих хлорид магния, позволяющий производить бетонирование во время морозов. А цементы с высоким содержанием алюминия, менее щелочные, чем обычные цементы, разрушают конструкционный алюминий значительно слабее.
Наталия Донская, журнал “Витрина” № 1(15)’2002
miuz.org
Коррозия алюминия
Коррозионная стойкость алюминия
Обычно алюминий и алюминиевые сплавы имеют хорошее сопротивление коррозии в следующих средах: атмосфере, пресной и морской воде, большинстве почв, большинстве продуктов питания и многих химических веществах. Выражение «хорошее сопротивление коррозии» означает, что в большинстве случаев изделия или детали из алюминиевых сплавов можно использовать без специальной защиты поверхности в течение длительного срока службы.
Степень воздействия коррозии на алюминиевое изделие зависит от степени агрессивности среды, в которой оно работает, а также особенностей его функций и ожидаемого срока службы. При необходимости принимают меры по предотвращению или ограничению воздействия коррозии алюминия и алюминиевых сплавов, в том числе, применение защитных покрытий поверхности, таких как, например, порошковая окраска и анодирование.
Влияние легирующих элементов
Легирующие элементы алюминиевых сплавов оказывают влияние на их коррозионные свойства. Поэтому для каждой коррозионной среды необходимо выбрать наиболее подходящий сплав. Главными легирующими элементами, которые применяются в алюминиевых сплавах, являются медь, магний, марганец, кремний и цинк, а также неизбежные примеси промышленных сплавов – железо и кремний. Влияние, которое эти элементы оказывают на коррозию алюминия и алюминиевых сплавов, заключается в следующем:
- медь снижает коррозионную стойкость больше, чем любой другой легирующий элемент;
- железо снижает коррозионную стойкость и его содержание нужно держать низким, если требуется максимальное сопротивление коррозии;
- магний оказывает положительное влияние на коррозионную стойкость;
- марганец производит на коррозионную стойкость небольшой положительный эффект;
- кремний оказывает на коррозионную стойкость небольшое отрицательное влияние;
- цинк в большинстве сред мало влияет на коррозионную стойкость.
Коррозия деформируемых алюминиевых сплавов
Алюминий (более 99,9 % Al)
Сверхчистый алюминий (более 99,9 % Al) показывает наибольшую коррозионную стойкость. Она резко падает с увеличением содержания примесей, особенно меди и железа.
Алюминиевые сплавы Al-Mn
Сплавы Al-Mn имеют очень хорошую коррозионную стойкость и применяются на открытом воздухе без какой-либо защиты.
Алюминиевые сплавы Al-Mg
В общем случае сплавы Al—Mg имеют самую лучшую коррозионную стойкость среди всех деформируемых алюминиевых сплавов.
При содержании магния более 4 % на коррозионную стойкость изделий из этих сплавов большое влияние оказывает технология изготовления. После длительной выдержки при температуре выше 60 °С сплавы с большим содержанием магния становятся подверженными коррозии под напряжением и подповерхностной коррозии.
Алюминиевые сплавы Al-Cu
Сплавы с содержанием меди больше 0,25 % — все дюралюмины (дюралюминии, дюрали дуралюмины) имеют низкую коррозионную стойкость и не применяются в агрессивных средах морского воздуха или промышленной атмосферы без защитных покрытий. Раньше одной из самых частых ошибок было применение дюралей в коррозионно-агрессивных средах без адекватного защитного покрытия.
Алюминиевые сплавы Al—Zn—Mg—Cu
Сплавы, содержащие цинк, магний и медь, по коррозионному поведению аналогичны сплавам Al-Cu и также требуют защиты в коррозионно-агрессивных средах.
Алюминиевые сплавы Al-Zn-Mg
Для этого семейства сплавов критическую важность для коррозионной стойкости играют технологические методы, особенно термическая обработка, а также химический состав сплава. Алюминиевые сплавы Al-Zn-Mg могут быть чувствительными к коррозионному растрескиванию под напряжением и подповерхностной коррозии.
Коррозия литейных алюминиевых сплавов
Для алюминиевых отливок коррозия обычно является намного меньшей проблемой, чем, скажем, для листовых изделий, так как обычно поперечное сечение отливок значительно толще и можно допустить больше поверхностной коррозии.
- Литейные алюминиевые сплавы Al—Mg обычно имеют хорошую коррозионную стойкость и применяются в морской среде.
- Литейные алюминиевые сплавы Al—Si обычно относят к сплавам, которые имеют хорошую коррозионную стойкость в различных воздушных и водных средах.
- Литейные алюминиевые сплавы Al—Cu и Al—Si—Cu требуют защитного покрытия при работе коррозионной среде.
Рейтинг сплавов по стойкости к коррозии
Коррозионное поведение алюминиевых сплавов зависит от вида среды, которой они должны сопротивляться. Таблица ниже дает рейтинг коррозионной стойкости различных алюминиевых сплавов в кислотных и щелочных средах. Чем меньше число – тем выше рейтинг.

Источник: TALAT 5104
aluminium-guide.ru
Алюминий коррозия в воде – Справочник химика 21
I. Взаимодействие алюминия с кислотами. 2. Растворение алюминия в водном растворе щелоч . 3. Взаимодействие амальгамированного алюминия с водой. 4, Влияние хлор-иона на коррозию алюминия. [c.8]Вода обычно способствует коррозии алюминия. Однако в некоторых случаях, разбавлял и вымывая с поверхности алюминия осадки, вызывающие коррозию, вода моя ет уменьшать скорость носледней. Если мягкая вода не приводит к значительному коррозионному разрушению, то жесткая вода часто [c.173]
Широко известно применение бихромата калия или натрия в качестве ингибиторов коррозии сталей и алюминия в воде и пассиваторов при обработке нержавеющих сталей, особенно действенных в растворах азотной кислоты. [c.129]
В промышленности встречаются случаи, когда электрохимическая коррозия возникает в результате образования локальных элементов с сравнительно крупными электродами. Образующиеся в этом случае гальванические элементы в отличие от микроэлементов называют макроэлементами. Примером такого макроэлемента могут служить некоторые типы морских катеров, у которых алюминиевый или дюралюминиевый корпус склепан стальными заклепками. В образующемся здесь макроэлементе, работающем по схеме алюминий морская вода сталь алюминий, анодом является алюминий, который и корродирует. [c.27]
Водорастворимые кислоты вызывают сильную коррозию любых металлов, а щелочи корродируют алюминий, поэтому присутствие их в автомобильных бензинах недопустимо. Водорастворимые кислоты и щелочи определяют качественный пробой по ГОСТ 6307—60. Бензин взбалтывается с равным количеством воды в делительной воронке, и с помощью индикаторов (метилоранжа и фенолфталеина) проверяется реакция водной вытяжки. [c.289]
Коррозия алюминия в воде. Когда алюминий находится в контакте с водой, он покрывается оксидным слоем. Было показано, что основными стадиями этой реакции являются образование слоя аморфного соединения АЬОз, растворение оксида и выделение гидроксида алюминия имеет вид [c.289]
Ингибитор коррозии алюминия в воде (системы башенного охлаждения) [53, 306, 903]. [c.89]
Однако следует иметь в виду особую подверженность алюминия коррозии в сильно обезвоженных спиртах, особенно с большим молекулярным весом, при температуре кипения. Так, прима-лом увлажнении агрессивность метилового спирта уменьшается, однако добавка 1 % воды не оказывает никакого действия то же наблюдается при добавлении ацетона или других кетонов. [c.533]
Вода обычно способствует коррозии алюминия и его сплавов. Однако в некоторых случаях, разбавляя и вымывая с поверхности алюминия осадки, вызывающие коррозию, вода может уменьшать скорость последней. Если мягкая вода не приводит к значительному коррозионному разрушению, то жесткая вода часто вызывает точечную коррозию алюминия или его сплавов. Присутствие в воде (как мягкой, так и жесткой) меди увеличивает коррозию алюминия. Щелочные воды также разрушают изделия, изготовленные из алюминия. С повышением температуры скорость коррозии алюминия и его сплавов в жидкой среде обычно возрастает. Но иногда нагрев может оказать и благоприятное действие, ускоряя высыхание поверхности, подвергающейся коррозии, т. е. сокращая период соприкосновения коррозионной среды с поверхностью алюминия. [c.198]
Термодинамически алюминий является неустойчивым в водных растворах. Его равновесный потенциал равен — 1,66 В, т.е. на 1,2 В отрицательнее равновесного потенциала железа. Однако термодинамическая возможность коррозии еще не является мерой ее скорости. Высокая коррозионная стойкость алюминия в воде объясняется образованием на его поверхности окисной пленки. [c.59]
Алюминий и его сплавы применяются для изготовления теплообменной аппаратуры радиаторов в двигателях внутреннего сгорания, в установках очистки нефти, трансформаторного масла. Конденсатор на установке коксования с трубами из плакированного сплава 3003 с трубными решетками нз сплава 6061-Тб долго и успешно эксплуатировали на загрязненной воде. Температура углеводородных паров, содержащих сероводород, аммиак, цианистые соединения на входе в конденсатор составляла 82 °С [54]. В настоящее время алюминиевые сплавы, легированные до 1% никелем, железом, медью, рекомендуются для работы в дистиллированной воде при температурах до 300— 360 °С. Детально вопросы коррозии сплавов алюминия в воде при этих параметрах рассмотрены в работах (55 и 56]. [c.31]
Применение цинка очень разнообразно. Значительная часть его идет для нанесения покрытий на железные и стальные изделии, предназначенные для работы в атмосферных условиях или в воде. При этом цинковые покрытия в течение миогих лет хорошо защищают основной металл от коррозии. Однако в условиях высокой влажности воздуха при значительных колебаниях температуры, а также в морской воде цинковые покрытия неэффективны. Широкое промышленное использование имеют сплавы цинка с алюминием, медью и магнием. С медью цинк образует важную группу сплавов — латуни (см. стр. 571). Значительное количество цинка расходуется для изготовления гальванических элементов. [c.621]
Исходя из вышеизложенного предположения, следует ожидать, что монокристаллы чистого алюминия не должны подвергаться межкристаллитной коррозии в воде при высоких температурах. И действительно, в воде с рН = 5—6 при 220 °С монокристалл алюминия в отличие от поликристалла не подвергается межкристаллитной коррозии [163]. Объяснить межкристаллитную коррозию алюминия в воде при высоких температурах растворением неустойчивых интерметаллидов, выпадающих по границам зерен, довольно трудно. [c.86]
Такие окислители, как хроматы н бихроматы, являются плохими катодными деполяризаторами и в то же время сильно пассивируют практически важные металлы (Fe, Al, Zn, u). Достаточно добавить в водопроводную воду 0,1% двухромовокислого калия, чтобы резко снизить скорость коррозии углеродистой стали н алюминия. При содержании в воде сильных активаторов коррозии (например, хлористых солей) концеитрацию бихромата следует увеличить до 2—3%. Хроматы и бихроматы относятся к типу смешанных замедлителей коррозии, но тормозят преимущественной анодный процесс. [c.312]
В воде, содержащей 0,3 мг л хлористого натрия и 0,7 г/л сульфата натрия, 0,03-м. раствор хромата натрня при 77 °С снижает скорость коррозии алюминиевого сплава 3003 в 10—15 раз. Полностью подавляет коррозию 0,03-м. раствор хро. лата кальция. Хромат магния или смесь хромата магния и натрия в той же концентрации снижают скорость коррозии алюминия в 35—150 раз. В воде, содержащей ржавчину, хромат магния в концентрации 0,01-м. полностью прекращает коррозию алюминия. Хромат натрия в той же концентрации снижает скорость коррозии лишь в 2—4 раза [192]. В этой среде хро ат натрня при концентрации 0,03-м. даже интенсифицирует коррозию. Хроматы магния, кальция в этой же концентр
www.chem21.info
Коррозия алюминиевых сплавов: влияние химического состава
Коррозия технического алюминия
Технический алюминий (99,00 % и чище) всегда более стоек к коррозии, чем любой алюминиевый сплав.
В сильно концентрированных кислотных и щелочных растворах он быстро растворяется, но в интервале рН от 4 до 9 на его поверхности могут появляться только пятна и незначительная локальная питтинговая коррозия.
Чистый алюминий не подвержен таким серьезным видам локальной коррозии, как межкристаллитная и подповерхностная коррозия.
Коррозионная стойкость алюминия снижается с увеличением содержания примесей — железа, кремния и меди. Медь и часть кремния находятся в твердом растворе. Частицы вторичной фазы содержат или железо или железо и кремний – Al6Fe, Al3Fe и Al12Fe3Si2 – все они являются катодными, более благородными, к алюминиевой матрице. Когда эти частицы находятся на поверхности, оксидная пленка над ними или очень тонкая, или ее вообще нет.
Эти частицы образуют локальные электрические цепи, которые вызывают питтинговую коррозию поверхности, которая находится в токопроводящем электролите (рисунок 1). Количество и размер таких корродирующих участков пропорциональны доле площади, занимаемой частицами вторичной фазы.
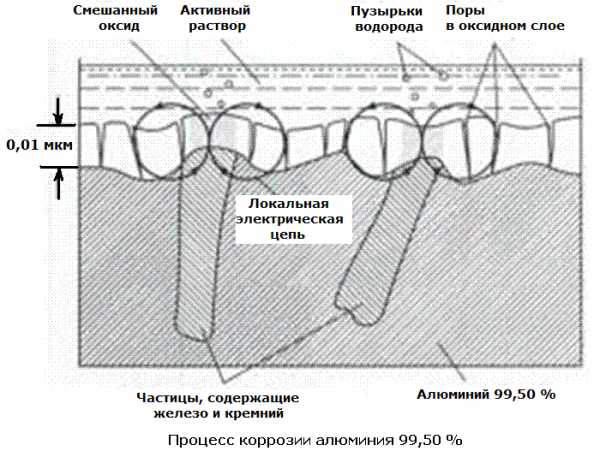 Рисунок 1
Рисунок 1
Коррозия дюралюминов
У дюралей-дюралюминов медь является основным легирующим элементом. Поэтому у них более низкая коррозионная стойкость, чем у других сплавов, у которых меди намного меньше. Электрохимические эффекты коррозии могут проявляться в этих сплавах значительно сильнее, чем в других сплавах уже потому, что у них выше разность электродных потенциалов различных участков поверхности при колебании содержания меди в твердом растворе.
Однако снижение общего сопротивления коррозии с увеличением содержания меди происходит не из-за неоднородности меди в твердом растворе, а из-за гальванических ячеек, которые образуются на мельчайших частичках меди, которые осаждаются на поверхность сплава в результате его коррозии.
Коррозия сплавов алюминия с магнием
Сплавы Al—Mg имеют высокое сопротивление коррозии и поэтому широко применяются в строительстве, химической и пищевой промышленности, а также в машинах и сооружениях, подвергающихся воздействию морской воды.
При малом содержании в сплаве (где-то до 3 %) магний находится в твердом растворе или частично в виде частиц Al8Mg5, которые равномерно распределены по матрице. Сопротивление коррозии у таких сплавов как у алюминия.
В сплавах с содержанием магния более 3 % частицы Al8Mg5 начинают выпадать в основном не внутри зерен, а по их границам, что весьма отрицательно сказывается на коррозионной стойкости.
Коррозия сплавов алюминия с магнием и кремнием
Довольно высокая прочность и очень хорошее сопротивление коррозии делает эти термически упрочняемые сплавы весьма подходящим для применения в строительстве, морской инфраструктуре и машиностроении. Фаза Mg2Si является основой механизма упрочнения этих сплавов. Как в твердом растворе, так и в виде выделений она оказывает пренебрежимо малое влияние на электродный потенциал.
Добавки меди, которые вводят для повышения прочностных свойств некоторых из этих сплавов, ограничивают небольшими количествами, чтобы минимизировать отрицательное влияние на коррозионную стойкость. При содержании меди более 0,5 % может начать проявляться межкристаллитная коррозия.
Когда в этих сплавах содержание магния и кремния сбалансировано в пропорции для образования только Mg2Si (сплавы 6060/6063 и АД31), то межкристаллитная коррозия очень незначительна в большинстве промышленных атмосфер. Если сплав содержит кремния больше чем нужно для образования Mg2Si, как, например, в сплаве 6005, то склонность к межкристаллитной коррозии возрастает.
Коррозия сплавов алюминия с цинком
В этих сплавах магний, марганец и медь добавляют для достижения различных уровней прочности.
Сплавы с медью, например, 7075 или В95, имеют максимальную прочность и применяются как конструкционный материал, в том числе в самолетостроении.
Сплавы без меди, например, 7005 или 1915, имеют много положительных качеств: высокая прочность, высокая вязкость, хорошие обрабатываемость, формуемость и свариваемость. Их все больше применяют в автомобилях (например, в бамперах), строительных конструкциях и транспортных средствах. Поскольку эти сплавы содержат цинк, они являются анодными к техническому алюминию и другим алюминиевым сплавам. Из всех алюминиевых сплавов они наиболее склонны к коррозии под напряжением.
Сопротивление общей коррозии сплавов без легирования медью достигает уровня сплавов Al—Mn, Al—Mg и Al—Mg—Si. Сплавы, легированные медью, например, 7075 и В95, имеют более низкое сопротивление общей коррозии, чем сплавы без меди (7005 и 1915). Все сплавы Al—Zn являются более стойкими к общей коррозии, чем сплавы Al-Сu-(Mg,Mn), но уступают в этом сплавам других серий.
Источник: Corrosion of Aluminum and Aluminum Alloys. Edited by J.R. Davis. — ASM International, 1999.
aluminium-guide.ru
Алюминий коррозия
Коррозия резервуаров (средств хранения), топливных отсеков реактивных самолетов сопровождается образованием на их стенках и дне коричневого слизистого осадка, представляющего собой сгустки твердых загрязнений топлив, воды и бактерий. Иногда слизистый осадок покрывает сплошь всю нижнюю поверхность топливных отсеков. После удаления этого осадка обнаруживается, что полимерное защитное покрытие топливных отсеков разрушилось и на поверхности алюминия появились очаги коррозии. В этих случаях коррозия носит питгинговый характер, или бывает настолько глубокой, что топливо начинает просачиваться или обнаруживаться на поверхности крыла реактивного самолета.[ …]
Алюминий по своим химическим свойствам — активный металл ,и в присутствии окислителей быстро покрывается окисной пленкой А1203: которая становится защитным слоем и резко снижает его химическую активность. Устойчивость алюминия против коррозии во многом зависит от условий, в которых он находится. Алюминий устойчив в тех случаях, когда сохраняется защитная .пленка, и неустойчив, когда пленка А1203 разрушается или не может быть образована. На воздухе алюминий покрывается защитной пленкой окиси алюминия толщиной-■0,01—0,02 мк.[ …]
Коррозия оказывает влияние на морфологию повреждений поверхности и скорость механической эрозии под действием кавитации. При измерениях остаточных напряжений указанные выше исследователи установили, что механическое повреждение, вызванное в поверхностном слое кавитацией, было значительно меньше, когда на металл накладывался анодный ток. Таким образом, представляется, что находящиеся в состоянии механического напряжения слои могут непрерывно удаляться приложенным током, и скопление кавитационных пузырьков будет воздействовать на свежую, нена-клепанную поверхность металла. С другой стороны, Хирс и Спекхардт [121] наблюдали увеличение «механической» составляющей потери массы меди при наложении анодного тока. Однако область кавитации, вызванной неровностями поверхности металла, была в этих условиях более плоской и широкой. Это приписывалось преимущественному растворению гребней неровностей. Повреждения поверхности пассивных металлов (титана, алюминия и железа [21, 118, 119] распределены неоднородно вследствие местного растрескивания пленки и ускоренной коррозии обнаженных участков. Местная коррозия (в особенности питтинг) усиливает механическую эрозию, так как шероховатая поверхность способствует образованию пустот в питтингах [4].[ …]
Наблюдения за алюминиевыми пластинками, находившимися в различных атмосферных условиях в течение долгого времени, показали прямое соответствие между скоростью коррозии и содержанием Б02 в атмосфере [86]. В атмосфере промышленных районов на поверхности алюминия образуется серосодержащий продукт коррозии А12(804)з-18НгО[87]. При низкой относительной влажности алюминий поглощает незначительное количество Э02 в основном за счет физической адсорбции [87]. При повышении влажности поглощение увеличивается, хотя и не достигает таких размеров, как для железа и цинка [74, 87]. Предполагаемым механизмом ускорения коррозии алюминия в присутствии ЭОг является воздействие кислотой среды на защитную оксидную пленку; кислота образуется при растворении и окислении 02 в водной пленке на поверхности металла [87].[ …]
Вызывает коррозию железа, цинка, алюминия; натриевая соль менее коррозийна и стабильна при отсутствии влаги.[ …]
Ускоренная коррозия в содержащих серу окислительных газах и солях щелочных металлов известна под названием «высокотемпературная коррозия». Высокотемпературная коррозия связана с образованием солей щелочных металлов Ма2504 и К2Э04, которые растворяют защитные окисные пленки, и в результате на металлах образуются незащитные окисные пленки £33]. Введение окиси ванадия, ванадия [6], хлоридов [100] и свободного углерода [60] в газовую среду увеличивает скорость высокотемпературной коррозии. Добавки алюминия и хрома к сплаву в общем повышают его стойкость к высокотемпературной коррозии.[ …]
Малая плотность алюминия, высокие электропроводность, пластичность и устойчивость к коррозии позволяют использовать его в чистом виде и в сплавах с другими металлами в самых разнообразных отраслях промышленности.[ …]
Установлено, что алюминий -марки АД1М непригоден в качестве материала; тары под 20% к.э. ВФ из-за активного характер питтинговой коррозии на нем. Возникновение питтинговой коррозии в средах к.э. ВФ связывают с присутствием О-ионов, являющихся активаторами локальных видов коррозии.[ …]
Коррозийная стойкость алюминия во многом зависит и от его чистоты: чем меньше в алюминии примесей, тем больше его коррозиоустойчивость. Скорость коррозии алюминиевого сплава, содержащего 98% алюминия в 80 раз больше, чем содержащего 99,5% ¡алюминия [55].[ …]
Поверхности деталей из алюминия, меди и их сплавов очищают от коррозии тонким порошком или куском пемзы или наждачной бумагой с зернистостью не ниже 180, смоченными бензином-растворителем или трансформаторным маслом. Зачищенную поверхность протирают хлопчатобумажными салфетками, смоченными бензином Б-70.[ …]
Железо и цинк больше подвержены коррозии в присутствии солей, а не в присутствии газов, латунь и алюминий — наоборот [60].[ …]
Протекторы изготовляют из цинка, алюминия и сплавов, являющихся анодами по отношению к железу. Протекторную защиту широко применяют для борьбы с коррозией в емкостях и особенно в подземных магистральных нефте- и газопроводах, удлиняя срок их службы и предотвращая утечки продукта в почву, а затем в водоемы и воздух. Эти утечки могут быть большими, так как продукт перекачивается под высоким давлением, а расстояния между запорными устройствами — значительны.[ …]
Способствует увеличению скорости коррозии и присутствие нескольких металлов, например сталь-алюминий, сталь-медь. В этом случае, особенно в присутствии воды, интенсивно протекают процессы электрохимической коррозии, продукты которой загрязняют топлива и масла.[ …]
Кислотные осадки ускоряют процессы коррозии металлов, разрушения зданий, сооружений. Установлено, что в промышленных районах сталь ржавеет в 20 раз, а алюминий разрушается в 100 раз быстрее, чем в сельских районах. Многочисленны примеры начавшегося с середины XX в. разрушения памятников истории и культуры, изготовленных из природных минералов (мрамора, известняка и других, имеющих в своем составе СаС03 и МёС03).[ …]
Большую проблему представляет собой коррозия металлов под действием кислотных осадков [21, 34]. Различные металлы — медь, алюминий, железо и даже сталь — быстро поглощают на своей поверхности двуокись серы и кислоты и постепенно разрушаются [55].[ …]
В обычных атмосферных условиях чистый алюминий устойчив против коррозии и не требует специальной защиты. В условиях города или промышленных предприятий, где атмосфера •сильно загрязнена, алюминий неустойчив и требуется защита.. В воде алюминий устойчив в том случае, если в ней содержится мало хлоридов и фторидов; в морской воде алюминий неустойчив и без защиты не применяется. Алюминий устойчив в растворах сульфатов и нитратов. В щелочных растворах алюминий неустойчив [68].[ …]
Результаты количественной оценки ПК на алюминии приведены в таблице. Оценка питтинговой коррозии проводилась на четырех образцах А1, два из которых находились в жидкой фазе, два — на границе раздела фаз (жидкость—пар).[ …]
Установлено, что максимальная скорость коррозии для углеродистой стали наблюдается при температурах циркулирующей воды 45—65°С. Сплавы ЭЖ-2, ЭИ-811, ЭИ-268, ЭИ-645, вТ-1, хотеллой «С», алюминий в потоках воды коррозионно устойчивы.[ …]
Расчет ресурсов амортизационного лома по алюминию выполняют, исходя из объема металлофонда, который определяют суммированием ежегодных металлоинвестиций за вычетом амортизации, потерь металла от коррозии, истирания и неполноты сбора амортизационного лома. Расчет образования амортизационного лома по отдельным его видам выполняют, исходя из металлоинвестиций на выпуск данного изделия и срока его службы.[ …]
Технология получения дигидроксосульфата алюминия (ДГСА) A12(S04)2(0H)2 – 11Н20 до недавнего времени не была разработана, и поэтому он не применялся в качестве коагулянта. Мицеллы, образовавшиеся в результате гидролиза, несут более высокий положительный заряд и обладают лучшей адсорбционной способностью. Являясь более основным коагулянтом, растворы его менее агрессивны, благодаря чему резко снижается кислотная коррозия оборудования и коммуникаций. Для производства дигидроксосульфата требуется значительно меньше (на 33 %) серной кислоты, что позволяет существенно снизить его себестоимость. Расход нового коагулянта (в расчете на А1203) на 15—20 %, а в некоторых случаях на 30—35 % ниже, чем сульфата алюминия.[ …]
В случаях обработки сточной »оды сернокислым алюминием ее активная реакция при повторном использовании снижается. Для предотвращения коррозии трубопроводов и сооружений оборотная вода подщелачивается известью; доза ее не превышает 70 мг)л в пересчете на СаО.[ …]
Произведена количественная оценка питтинговой коррозии микроскопическим методом на алюминии марки АД1М в средах концентрата эмульсии (к.э. винилфосфата (ВФ).[ …]
Основными способами предотвращения или уменьшения коррозии резервуаров, трубопроводов и другого оборудования являются: применение коррозионностойких металлов и сплавов, замена металлических изделий химически стойкими неметаллическими, нанесение защитных покрытий, введение в жидкость специальных присадок •—■ ингибиторов коррозии. Иногда для этой цели применяют также электрохимическую защиту металлоконструкций. Применение стойких к коррозии металлов и их сплавов для изготовления резервуаров, трубопроводов, цистерн и другого оборудования для транспортировки и хранения жидкостей является весьма эффективным способом предотвращения образования коррозионных загрязнений, но довольно высокая стоимость этих материалов и большой спрос на них в различных отраслях народного хозяйства ограничивает область использования данного способа борьбы с коррозией. Обычно из стойких к коррозии металлов (нержавеющей стали, алюминия и т. п.) изготовляют оборудование для хранения и транспортирования жидкостей, имеющих ярко выраженные агрессивные свойства (неорганических кислот, щелочей и т. п.), а также в случаях, когда к чистоте жидкостей предъявляют особо высокие требования.[ …]
Результаты трех циклов таковы: в омагниченных растворах коррозия стали снизилась на 87,8%, алюминия— на 88,2% и чугуна — на 68,3%. Увеличение противокоррозионного действия (для стали в 4—5 раз) свидетельствует о целесообразности многократной магнитной обработки данного раствора.[ …]
В зависимости от типа металла и времени экспозиции скорости коррозии в городской атмосфере от 1,5 до 5 раз выше скоростей, наблюдаемых в сельской местности [18]. Трехкратное уменьшение содержания БОг в воздухе Питтсбурга с 0,15 до 0,05 млн-1 за период с 1926 по 1960 г. привело почти к четырехкратному уменьшению скорости коррозии цинка. На рис. 1.6 показано влияние БОг на коррозию малоуглеродистой стали в Чикаго. Двуокись серы считается наиболее вредным загрязнителем, влияющим на коррозию металлов. Скорость коррозии в значительной степени зависит также от температуры и особенно относительной влажности воздуха. Алюминий слабо подвержен воздействию БОг-Однако при относительной влажности 70% и более скорость коррозии резко увеличивается [28];. НАКЗА опубликовала недавно результаты долговременных исследований влияния атмосферы на предел прочности алюминия на разрыв [29]. Экспозиция в сельских районах приводит за 20 лет к уменьшению предела прочности алюминия на 1% или менее, тогда как промышленная атмосфера за тот же период приводит соответственно к величинам от 14 до 17%. В литературе имеется обширный обзор, который посвящен коррозии металлов, обусловленной различными атмосферными характеристиками, за период до 1960 г. [30]. Серная и сернистая кислоты воздействуют на различные строительные материалы, включая известняк, мрамор, шиферные плиты и известковый строительный раствор. Образующиеся ¡при этом хорошо растворимые сульфаты выщелачиваются затем дождем. Особо чувствительны к содержанию загрязнителей в атмосфере ткани, изготовленные из нейлона, прежде всего нейлоновые чулки. Воздействие и а них связано, очевидно, с 502 или аэрозолями серной кислоты.[ …]
Соли железа как коагулянты, имеют ряд преимуществ перед солями алюминия: лучшее действие при низких температурах воды; более широкая область оптимальных значений pH среды; большая прочность и гидравлическая крупность хлопьев; возможность использовать для вод с более широким диапазоном солевого состава; способность устранять вредные запахи и привкусы, обусловленные присутствием сероводорода. Однако имеются и недостатки: образование при реакции катионов железа с некоторыми органическими соединениями сильно окрашивающих растворимых комплексов; сильные кислотные свойства, усиливающие коррозию аппаратуры; менее развитая поверхность хлопьев.[ …]
При очистке питьевых и сточных вод в качестве коагулянтов используют соли алюминия, соли железа и их смеси в разных пропорциях. Реже применяют соли магния, цинка и титана. Коагулянты поставляют на водоочистные станции в виде кусков и плит, гранул и порошков, а иногда в виде концентрированных растворов. На станциях в специальных баках, защищенных от коррозии, приготавливают рабочие растворы коагулянтов определенной концентрации и дозируют их в обрабатываемую воду.[ …]
Компактность пленок зачастую оказывает решающее влияние на развитие процессов коррозии. Например, алюминий окисляется легче железа (более электроотрицателен). Однако на воздухе он устойчивее, так как, окисляясь, покрывается плотной пленкой оксида. Ее изолирующее действие тем более значительно, что образующийся А120з менее растворим в воде, чем оксиды железа.[ …]
Корпус сопла может быть изготовлен из латуни, нержавеющей стали, анодированного алюминия или другого металла, не подвергающегося коррозии под действием инсектицидов. Наконечник сопла с отверстием изготовляется из нержавеющей стали типа 18/8 или другого материала с равноценными антикоррозийными свойствами.[ …]
Вся аппаратура, применяемая при получении аммиакатов на основе аммиачной селитры, изготовляется из алюминия или нержавеющей стали. При изучении свойств аммиакатов различного состава было установлено, что аммиакаты на основе аммиачной селитры вызывают более интенсивную коррозию стали, чем аммиакаты, в которых наряду ю 1ЧН4Ы03 содержится кальциевая селитра. Поэтому целесообразно применение аммиакатов примерно следующего состава: 20% 1МНз, 30% ЫН4Ы03, 27,7% Са(Ы03)2 и 22,3% воды. Аммиакат такого состава содержит 31,9% азота, плотность жидкости при 20 °С равна 1,25 г/см3, давление паров при 20— 30 °С примерно 1 кгс/см2.[ …]
Так, например, я«елезо может содержаться в воде водоисточника, но в питьевую воду оно может попадать и как продукт коррозии металлических трубопроводов; алюминий моя«ет оказываться в питьевой воде в связи с применением его соединений для коагуляции воды на водопроводных станциях.[ …]
Нельзя допускать контакта деталей, окрашенных эмалями, содержащими ртутные фунгисиды, с деталями из незащищенного алюминия или его сплавов во избежание коррозии последних. При окраске таких деталей наносят на грунт не менее двух слоев эмали без фунгисидов. При введении в эмали ртутных фунгисидов необходимо соблюдать правила безопасности, относящиеся к работе с ртутными препаратами.[ …]
Неблагоприятное воздействие загрязнение воздушной среды оказывает (вследствие абразивного действия, осаждения сажи и коррозии) на фасады и крыши зданий, металлоконструкции и транспорт, причем коррозия металлов зависит от относительной влажности воздуха: коррозия алюминия начинается при влажности воздуха более 80%, мягкой стали — при влажности от 60 до 75%, никеля и меди — при влажности от 63 до 70%. Коррозия происходит в значительной степени под действием серной кислоты, которая образуется в воздухе при взаимодействии серного ангидрида с водяными парами и выпадает с дождем.[ …]
Действие синтетическихповерхностн о-а к т и в-ных веществ на оборудование. Результатом воздействия этих веществ на оборудование является коррозия, которая может возникнуть на металлических стенах стиральных машин, выпускных отверстиях умывальников, на оборудовании очистительных станций или в водоснабжающих станциях. Систематические опыты показали, что коррозионное действие растворов чистого алкиларилсульфоната (0,8 г активной части вещества на 1 л) является весьма малым, но оно усиливается при наличии неорганических солей. Самые большие повреждения претерпевает цинк, коррозия меди и алюминия намного меньше.[ …]
В Советском Союзе разработано несколько типовых конструкций сбцрно-разборных понтонов для цилиндрических резервуаров, которые монтируются через лазовые люки. Для изготовления элементов понтонов используют алюминий и его сплавы, пенопласты, пластики или комбинации этих материалов, причем предпочтение отдается понтонам из синтетических материалов, стоимость которых на 25—30% ниже, чем металлических, а масса меньше в 3—4 раза. При серийном изготовлении понтонов в заводских условиях монтаж их в резервуаре недолог (резервуар емкостью 5—10 тыс. м3 оборудуется бригадой из 3 человек за 8—10 дней). Капитальные вложения на сооружение понтонов окупаются снижением потерь бензина от испарения менее чем за 1 год эксплуатации резервуара. Применяемые ранее плавающие понтоны часто тонули в резервуарах и этим вызвали недоверие -к ним производственников. Причинами затопления понтонов .главным образом являются неудачные конструкции затворов, герметизирующих пространство между краем понтона и стенкой резервуара, а также дефекты сварки, трещины и коррозия или деформация резервуара. Затопляться могут и исправные понтоны за счет газовых и воздушных пробок, случайно закаченных под понтон вместе с нефтепродуктом или нефтью из подводящих трубопроводов после их ремонта, если трубопроводы не оборудованы фитингами для вывода газа. Газовоздушные пробки, всплывая над приемо-раздаточным патрубком, способны нарушить герметичность затвора и выбросить значительную массу жидкости на понтон. По этой же причине не рекомендуется закачивать в резервуары, оборудованные понтонами, продукты с давлением насыщенных паров выше установленной нормы.[ …]
В полупроизводственных условиях такой же раствор N30 с pH 5,6—5,7 циркулировал со скоростью 2 м/с в контуре, проходя 65—70 раз магнитное поле напряженностью 41 к А/м. Продолжительность цикла составляла 48 ч. В этих условиях коррозия пластин алюминия снизилась на 88%, Стали 45 — на 87% и чугуна — на 68%.[ …]
Близкие результаты получены и А. Н. Шаховым. Он подвергал магнитной обработке дистиллерную жидкость (концентрированный водный раствор солей, преимущественно хлоридов). В раствор помещали образцы из Стали 20, сплава алюминия с бронзой и медные пластинки. Напряженность магнитного поля в опытах с образцами стали составляла 5 кА/м (62 Э), с образцами алюминия с бронзой 35 кА/м (440 Э) и с образцами из бронзы 100 кА/м (1250 Э). При этом коррозия уменьшилась соответственно на 25, 25,6 и 64,3%.[ …]
Некоторые пигменты обладают специфическими свойствами, определяющими область их применения. Так, в настоящее время установлено, что цинковый крон является лучшим ингибитором, т. е. лучшим материалом для предохранения от коррозии алюминия и его сплавов; поэтому в грунтовки для алюминия и его сплавов в качестве пигмента вводят обязательно цинковый крон.[ …]
Более надежным приемом можно считать поддержание в межэлектродном объеме условий, предотвращающих образование мало-или нерастворимых соединений. Для выбора таких условий целесообразно использовать диаграммы Пурбе [104], описывающие область коррозии и пассивации металла в водных средах в зависимости от pH и ЕЬ. Как подтвердили экспериментальные исследования, для железа и алюминия необходимо поддерживать pH менее 4 или более 10 для активации поверхности электрода, а также редокси-потенциал ниже —(0,2ч-0,4) В. Подтверждением этих предпосылок являются электрокоагуляторы, предложенные Вильнюсским ПКБ механизации и автоматизации, использующие в качестве рабочего раствора кислые или щелочные электролиты гальванических или других производств.[ …]
При реагентной обработке осадка происходит коагуляция — процесс агрегации тонкодисперсных и коллоидных частиц. Образование при этом крупных хлопьев с разрывом сольвентных оболочек и изменением форм связи воды способствует изменению структуры осадка и улучшению его водоотдающих свойств. Эти соли вводят в осадок в виде 10 %-ных растворов. Могут быть также использованы отходы, содержащие РеС13, А О з и др. Наиболее эффективным является применение хлорного железа совместно с известью. Доза хлорного железа составляет 5-8%, извести 15-30% (от массы сухого вещества осадка). Недостатком реагентной обработки является высокая стоимость, повышенная коррозия материалов, сложность транспортирования, хранения и дозирования реагентов.[ …]
Коррозионная активность ряда металлов и сплавов уменьшается в определенных окружающих условиях. Такая потеря активности известна под названием «пассивация». Пассивация вызывается формированием защитной пленки (возможно, окис-ной) на поверхности металла. Природа и свойства защитных пленок очень важны с точки зрения стойкости к эрозионной коррозии. Способность этих пленок защищать металл зависит от быстроты и легкости, с которыми они образуются при первоначальной экспозиции металла в среде, от их стойкости к механическим повреждениям и от скорости их возобновления после разрушения или повреждения. Защита от коррозии железа, никеля, титана, алюминия и их сплавов, которые образуют пассивные окисные пленки, зависит от доступа кислорода к их поверхности. В связи с этим условия, при которых увеличивается скорость диффузии кислорода к поверхности указанных металлов, будут способствовать образованию окислов и, следовательно, уменьшению скорости коррозии металлов. Наоборот, увеличение скорости диффузии кислорода к поверхности активных (непассивирующихся) металлов, например меди, приводит к увеличению скорости разъедания металла вследствие возрастания скорости реакции по реакции (3).[ …]
ru-ecology.info

