Коррозия металлов химическая и электрохимическая: Коррозия металлов. Виды коррозии металлов
alexxlab | 27.04.2022 | 0 | Разное
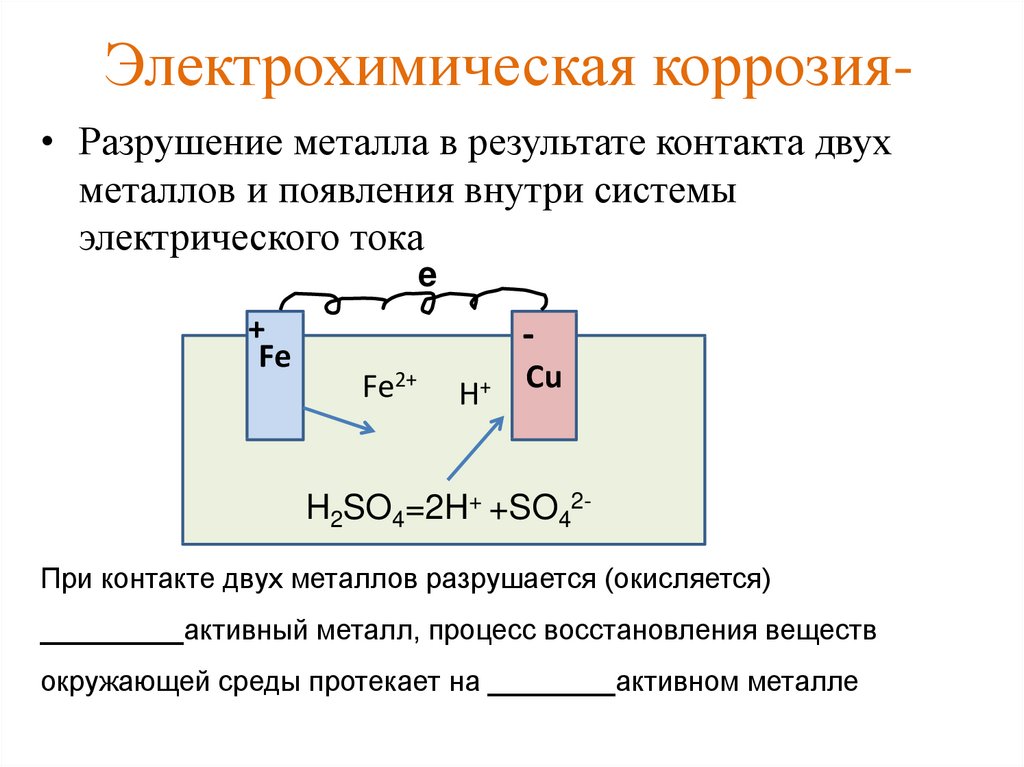
Электрохимическая коррозия. Электрохимическая коррозия металлов. Химическая коррозия. Химическая коррозия металлов.
Коррозия — разрушение металла под воздействием окружающей среды. Коррозия помимо уничтожения металла отрицательно влияет на эксплуатационные характеристики деталей, содействуя всем видам разрушения. Коррозия в зависимости от характера окружающей среды может быть химической и электрохимической.
Цианирование. Цианирование стали. Процесс цианирования. Нитроцементация. Нитроцементация стали.
Азотирование. Азотирование стали. Азотирование деталей. Ионное азотирование. Технология азотирования.
Электрохимическая коррозия имеет место в водных растворах, а так же в обыкновенной атмосфере, где имеется влага. Сущность этой коррозии в том, что ионы металла на поверхности детали, имея малую связь с глубинными ионами, легко отрываются от металла молекулами воды. Металл, потеряв часть положительно заряженных частиц, ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле.
Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле.
Если количество ионов переходящих в раствор и осаждающихся на металле одинаково, то скорости растворения и осаждения металла равны и процесс коррозии (разрушения металла) не происходит. Этому соответствует равновесный потенциал φ.
За нулевой потенциал принимают равновесный потенциал водородного иона в водном растворе при концентрации положительных ионов водорода, равной 1 моль ионов H+ на 1 литр.
Стандартные потенциалы элементов по отношению к водородному потенциалу
Металлы, стандартный потенциал которых отрицательный – корродируют в воде, в которой растворен кислород тем активнее, чем отрицательней значение электрохимического потенциала. Уходящие ионы металла, взаимодействуя с ионами OH–, образуют гидроксиды, нерастворимые в воде, которые называют ржавчиной, а процесс их образования – ржавлением.
Уходящие ионы металла, взаимодействуя с ионами OH–, образуют гидроксиды, нерастворимые в воде, которые называют ржавчиной, а процесс их образования – ржавлением.
Схема ржавления железа:
2Fe — 4e -> 2Fe2+
2Fe2+ + 4OH– -> 2Fe(OH)2
Гидроксид железа Fe(OH)2 в присутствии кислорода, растворенного в воде, превращается в Fe(OH)3. Так как это нерастворимое соединение, то равновесный потенциал не может быть достигнут и коррозия будет продолжаться до полного разрушения.
В зависимости от структуры коррозия имеет разное проявление: при однородном металле – коррозия происходит равномерно по всей поверхности. При неоднородном металле – коррозия избирательная и называется точечной. Это явление наиболее опасно, так как приводит к быстрой порче всего изделия. Избирательная коррозия создает очаги концентрации напряжений, что содействует разрушению.
Химическая коррозия может происходить за счет взаимодействия металла с газовой средой при отсутствии влаги. Продуктом коррозии являются оксиды металла. Образуется пленка на поверхности металла толщиной в 1…2 периода кристаллической решетки. Этот слой изолирует металл от кислорода и препятствует дальнейшему окислению, защищает от электрохимической коррозии в воде. При создании коррозионно-стойких сплавов – сплав должен иметь повышенное значение электрохимического потенциала и быть по возможности однофазным.
Продуктом коррозии являются оксиды металла. Образуется пленка на поверхности металла толщиной в 1…2 периода кристаллической решетки. Этот слой изолирует металл от кислорода и препятствует дальнейшему окислению, защищает от электрохимической коррозии в воде. При создании коррозионно-стойких сплавов – сплав должен иметь повышенное значение электрохимического потенциала и быть по возможности однофазным.
Для скачивания – Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии.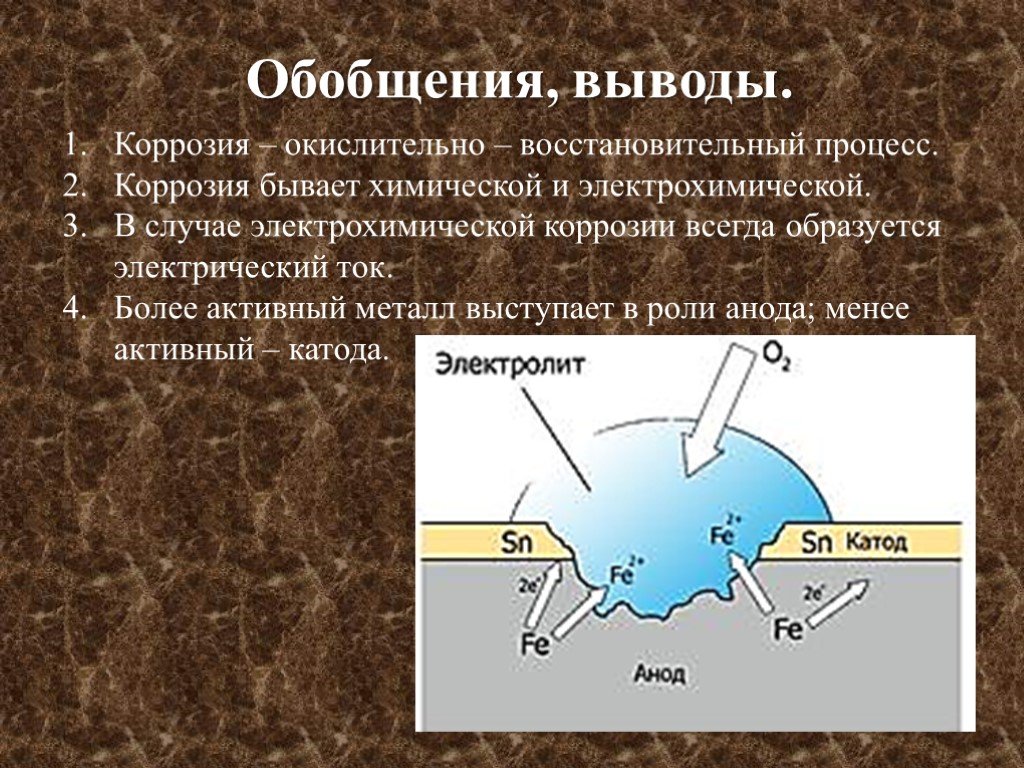 Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:03
12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Коррозия как электрохимический процесс
Коррозия как электрохимический процесс Кусок оголенного железа, оставленный снаружи, где он подвергается воздействию влаги, быстро заржавеет. Рассматривая набросок капли воды (после Эббинга), окисляющееся железо поставляет электроны на край капли для восстановления кислорода из воздуха. Поверхность железа внутри капли действует как анод для процесса Fe(s) -> + Fe 2+ (водн.) + 2e – Электроны могут двигаться через металлическое железо наружу капли, где O 2 (g) + 2H 2 O(l) + 4e – -> 4OH – (водн.) Внутри капли ионы гидроксида могут двигаться внутрь, чтобы реагировать с ионами железа (II), перемещающимися из области окисления. Гидроксид железа(II) осаждается. Fe 2+ (водн.) + 2OH – (водн. . 4Fe(OH) 2 (т) + O 2 (ж) -> 2Fe 2 O 3 H 2 O(т) + 2H 2 Ржавление незащищенного железа в присутствии воздуха и воды в таком случае неизбежно, так как оно обусловлено электрохимическим процессом. Однако другие электрохимические процессы могут обеспечить некоторую защиту от коррозии. Магниевые стержни можно использовать для защиты подземных стальных труб с помощью процесса, называемого катодной защитой.
| Индекс Окисление/ Electrochemistry Concepts Справочник EBBING | ||
| Вернуться |
Подземные стальные трубы обладают прочностью для транспортировки жидкостей под высоким давлением, но они уязвимы для коррозии, вызываемой электрохимическими процессами. Mg(s) -> + Mg 2+ (водн.) + 2e – в то время как стальная труба как катод будет защищена реакцией O 2 (г) + 2H 2 O(ж) + 4e – -> 4OH – (водн.). | Индекс Окисление/ Принципы электрохимии Ссылка Эббинг | |
| Вернуться |
Что такое коррозия? – Домашняя
NACE/ASTM G193
Коррозия – это повреждение материала, обычно металла, в результате химической или электрохимической реакции с окружающей средой.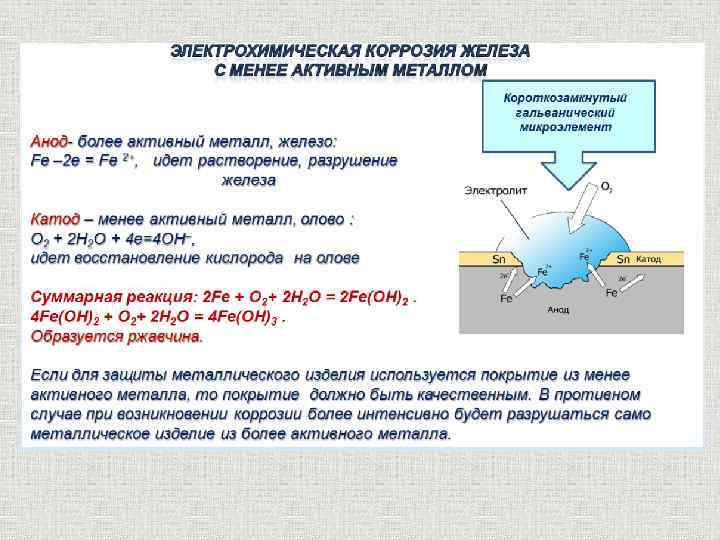 (1)
(1)
ISO 8044
Физико-химическое взаимодействие между металлом и окружающей средой, которое приводит к изменению свойств металла и может привести к значительному нарушению функции металла, окружающей среды или технической системы , частью которых они являются. (2)
Международный союз теоретической и прикладной химии.
Коррозия представляет собой необратимую межфазную реакцию материала (металла, керамики или полимера) с окружающей средой, которая приводит к изнашиванию материала или растворению в материале компонента окружающей среды.
Часто , но не обязательно, коррозия приводит к эффектам, вредным для использования рассматриваемого материала. Исключительно физические или механические процессы, такие как плавление или испарение, истирание или механическое разрушение, не включаются в термин коррозия. (3)
Электрохимическая коррозия : Электрохимическая коррозия всегда связана с электродными реакциями. Типичными примерами являются коррозия металла при растворении ионов металла или при образовании оксидной пленки.
Типичными примерами являются коррозия металла при растворении ионов металла или при образовании оксидной пленки.
M. Fontana
Коррозия – это ухудшение материала из-за реакции с окружающей окружающей средой . (4)
Д.А. Jones
Коррозия является разрушительным результатом химических реакций между металлом и окружающей средой. (5)
P.R. Roberge
Коррозия представляет собой разрушительное воздействие на материал в результате реакции с окружающей средой. (6)
E. McCafferty
Коррозия представляет собой разрушительное воздействие металла на его реакцию с окружающей средой. (7)
L.L. Shreir
Определение трансформации : термин металлическая коррозия охватывает все взаимодействия металла или сплава (твердого или жидкого) с окружающей средой, независимо от того, является ли это преднамеренным и полезным или случайным и вредным.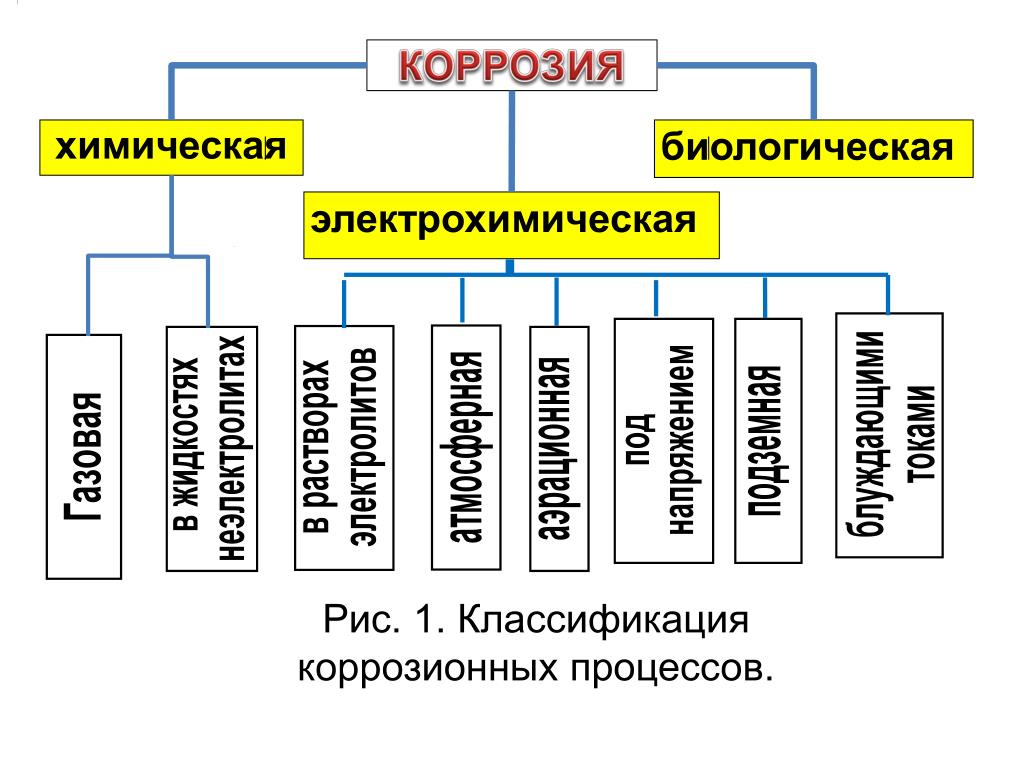 Это определение включает, например, преднамеренное анодное растворение цинка при катодной защите и гальванике, а также самопроизвольный постепенный износ цинкового кровельного листа в результате воздействия атмосферы.
Это определение включает, например, преднамеренное анодное растворение цинка при катодной защите и гальванике, а также самопроизвольный постепенный износ цинкового кровельного листа в результате воздействия атмосферы.
Определение износа : коррозия определяется как нежелательное ухудшение металла или сплава , т. е. взаимодействие металла с окружающей средой, которое неблагоприятно влияет на те свойства металла, которые должны быть сохранены. Это определение также применимо к неметаллическим материалам, таким как стекло, дерево, бетон, керамика и композиты. Это определение рассматривает коррозию только как вредный процесс.
Образование пассивных оксидных пленок на коррозионностойких сплавах соответствует преобразование определение коррозии, , но не с определением износа . В этих примерах скорость и степень реакции не оказывают существенного вредного воздействия на рассматриваемый металл.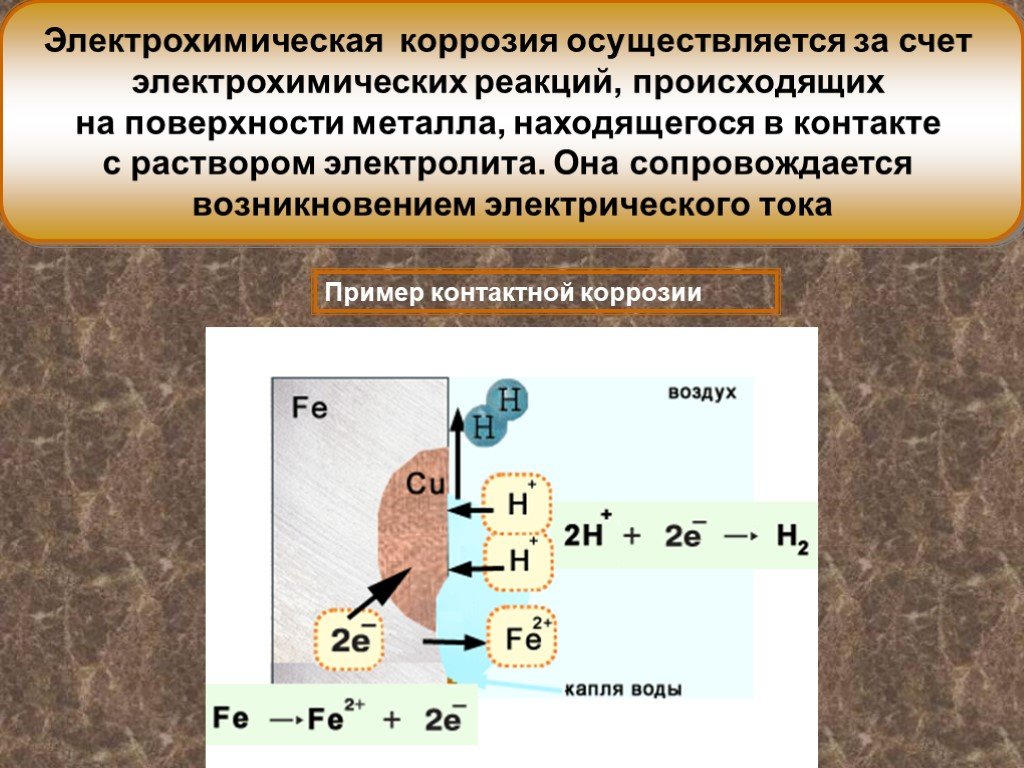 (8)
(8)
Р.М. Latanison
Коррозия – это разрушение материалов под воздействием окружающей среды
Ссылки
- NACE International/ ASTM G193-12d, 2012, «Стандартная терминология и сокращения, относящиеся к коррозии», ASTM International, West Conshohocken, PA, 2012, DOI: 10/152 G0193-12Д.
- ISO 8044:1999, “Коррозия металлов и сплавов. Основные термины и определения”, Международная организация по стандартизации, Брюссель, 2000 г.
- К.Э. Heuslerl, D. Landolt и S. Trasatti, «Номенклатура электрохимической коррозии», Pure & Appl. хим. 61 (1), (1989): стр. 19-22. DOI: 10.1351/pac198961010019.
- М.Г. Фонтана, «Коррозионная наука и техника», 3-е издание, Tata McGraw-Hill, ISBN: 978-0070607446, 2005.
- Д.А. Джонс, «Принципы и предотвращение коррозии», 2-е издание, Prentice Hall, ISBN: 978-0133599930, 1995.
- PR Roberge, «Справочник по коррозионной инженерии», 1-е издание, McGraw-Hill, ISBN 0-07-076516-2, 1999 г.



 Это произойдет еще быстрее, если влага представляет собой соленую воду. Скорость коррозии увеличивается за счет электрохимического процесса, в котором капля воды становится гальваническим элементом при контакте с металлом, окисляя железо.
Это произойдет еще быстрее, если влага представляет собой соленую воду. Скорость коррозии увеличивается за счет электрохимического процесса, в котором капля воды становится гальваническим элементом при контакте с металлом, окисляя железо. ) -> Fe(OH) 2 (тв.)
) -> Fe(OH) 2 (тв.) Меру защиты можно обеспечить, вбив магниевый стержень в землю рядом с трубой и обеспечив электрическое соединение с трубой. Поскольку магний имеет стандартный потенциал -2,38 вольта по сравнению с -0,41 вольта для железа, он может действовать как анод гальванического элемента, а стальная труба – как катод. При использовании влажного грунта в качестве электролита по проводу, соединенному с трубой, может протекать небольшой ток. Магниевый стержень в конечном итоге будет поглощен реакцией
Меру защиты можно обеспечить, вбив магниевый стержень в землю рядом с трубой и обеспечив электрическое соединение с трубой. Поскольку магний имеет стандартный потенциал -2,38 вольта по сравнению с -0,41 вольта для железа, он может действовать как анод гальванического элемента, а стальная труба – как катод. При использовании влажного грунта в качестве электролита по проводу, соединенному с трубой, может протекать небольшой ток. Магниевый стержень в конечном итоге будет поглощен реакцией