Медь вики – Медь — Википедия
alexxlab | 07.11.2019 | 0 | Разное
Медь — Википедия
| Внешний вид простого вещества | |
|---|---|
| пластичный металл красно-розового цвета (на изображении медь самородная) | |
| Свойства атома | |
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) | 63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации | 745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1 083,4 °С) |
| Температура кипения | 2 567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO+(CuOH)2CO3→2Cu+3CO2+h3O{\displaystyle {\mathsf {2CO+(CuOH)_{2}CO_{3}\rightarrow 2Cu+3CO_{2}+H_{2}O}}}
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике
Видео по теме
Происхождение названия
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[6][7]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία [8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[8].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[9], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[9][10] С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры[9].
Нахождение в природе
Самородная медьМедь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[11]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси) [12].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Кристаллы медиМедь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[13] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[14]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52⋅1028{\displaystyle 8,52\centerdot 10^{28}}(атом/м³).
Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu и 65Cu с распространённостью 69,1 и 30,9 атомных процентов соответственно. Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[15].
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°C :
- 2CuFeS2+O2⟶Cu2S+2FeS+SO2↑{\displaystyle {\mathsf {2CuFeS_{2}+O_{2}\longrightarrow Cu_{2}S+2FeS+SO_{2}\uparrow }}}
- 2FeS+3O2⟶2FeO+2SO2↑{\displaystyle {\mathsf {2FeS+3O_{2}\longrightarrow 2FeO+2SO_{2}\uparrow }}}
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
- FeO+SiO2⟶FeSiO3{\displaystyle {\mathsf {FeO+SiO_{2}\longrightarrow FeSiO_{3}}}}
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
- 2Cu2S+3O2⟶2Cu2O+2SO2{\displaystyle {\mathsf {2Cu_{2}S+3O_{2}\longrightarrow 2Cu_{2}O+2SO_{2}}}}
- 2Cu2O+Cu2S⟶6Cu+SO2{\displaystyle {\mathsf {2Cu_{2}O+Cu_{2}S\longrightarrow 6Cu+SO_{2}}}}
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
- CuSO4+Fe⟶Cu↓+FeSO4{\displaystyle {\mathsf {CuSO_{4}+Fe\longrightarrow Cu\downarrow +FeSO_{4}}}}
Электролизный метод
Электролиз раствора сульфата меди:
- CuSO4⇄Cu2++SO42−{\displaystyle {\mathsf {CuSO_{4}\rightleftarrows Cu^{2+}+SO_{4}^{2-}}}}
- K−:Cu2++2e⟶Cu0{\displaystyle {\mathsf {K^{-}:Cu^{2+}+2e\longrightarrow Cu^{0}}}}
- A+:2h3O−4e⟶O2+4H+{\displaystyle {\mathsf {A^{+}:2H_{2}O-4e\longrightarrow O_{2}+4H^{+}}}}
- 2CuSO4+2h3O⟶2Cu↓+O2↑+2h3SO4{\displaystyle {\mathsf {2CuSO_{4}+2H_{2}O\longrightarrow 2Cu\downarrow +O_{2}\uparrow +2H_{2}SO_{4}}}}
Химические свойства
Возможные степени окисления
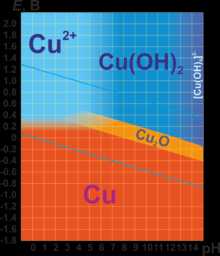
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
- 2Cu+h3O+CO2+O2⟶ (CuOH)2CO3↓{\displaystyle {\mathsf {2Cu+H_{2}O+CO_{2}+O_{2}\longrightarrow \ (CuOH)_{2}CO_{3}\downarrow }}}
Реагирует с концентрированной холодной серной кислотой:
- Cu+h3SO4⟶ CuO+SO2↑ +h3O{\displaystyle {\mathsf {Cu+H_{2}SO_{4}\longrightarrow \ CuO+SO_{2}\uparrow \ +H_{2}O}}}
С концентрированной горячей серной кислотой:
- Cu+2h3SO4⟶ CuSO4+SO2↑ +2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}\longrightarrow \ CuSO_{4}+SO_{2}\uparrow \ +2H_{2}O}}}
С безводной горячей серной кислотой:
- 2Cu+2h3SO4 →200oC Cu2SO4↓+SO2↑ +2h3O{\displaystyle {\mathsf {2Cu+2H_{2}SO_{4}\ {\xrightarrow {200^{o}C}}\ Cu_{2}SO_{4}\downarrow +SO_{2}\uparrow \ +2H_{2}O}}}
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
- 2Cu+2h3SO4+O2→t∘ 2CuSO4+2h3O{\displaystyle {\mathsf {2Cu+2H_{2}SO_{4}+O_{2}{\xrightarrow {t^{\circ }}}\ 2CuSO_{4}+2H_{2}O}}}
С концентрированной азотной кислотой:
- Cu+4HNO3⟶ Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}\longrightarrow \ Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
С разбавленной азотной кислотой:
- 3Cu+8HNO3⟶ 3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}\longrightarrow \ 3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
С «царской водкой»:
- 3Cu+2HNO3+6HCl⟶ 3CuCl2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+2HNO_{3}+6HCl\longrightarrow \ 3CuCl_{2}+2NO\uparrow +4H_{2}O}}}
С концентрированной горячей соляной кислотой:
- 2Cu+4HCl⟶ 2H[CuCl2]+h3↑{\displaystyle {\mathsf {2Cu+4HCl\longrightarrow \ 2H[CuCl_{2}]+H_{2}\uparrow }}}
C разбавленной соляной кислотой в присутствии кислорода:
- 2Cu+4HCl+O2⟶ 2CuCl2+2h3O{\displaystyle {\mathsf {2Cu+4HCl+O_{2}\longrightarrow \ 2CuCl_{2}+2H_{2}O}}}
С газообразным хлороводородом при 500—600 °C:
- 2Cu+4HCl+O2 →500−600oC 2CuCl2+2h3O{\displaystyle {\mathsf {2Cu+4HCl+O_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CuCl_{2}+2H_{2}O}}}
С бромоводородом:
- 2Cu+4HBr⟶ 2H[CuBr2]+h3↑{\displaystyle {\mathsf {2Cu+4HBr\longrightarrow \ 2H[CuBr_{2}]+H_{2}\uparrow }}}
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
- 2Cu+4Ch4COOH+O2⟶ [Cu2(h3O)2(Ch4COO)4]{\displaystyle {\mathsf {2Cu+4CH_{3}COOH+O_{2}\longrightarrow \ [Cu_{2}(H_{2}O)_{2}(CH_{3}COO)_{4}]}}}
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
- Cu→Nh4⋅h3O,O2 [Cu(Nh4)2]OH⇄ [Cu(Nh4)4](OH)2{\displaystyle {\mathsf {Cu{\xrightarrow {NH_{3}\cdot H_{2}O,O_{2}}}\ [Cu(NH_{3})_{2}]OH\rightleftarrows \ [Cu(NH_{3})_{4}](OH)_{2}}}}
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
- 4Cu+O2 →200oC 2Cu2O{\displaystyle {\mathsf {4Cu+O_{2}\ {\xrightarrow {200^{o}C}}\ 2Cu_{2}O}}}
- 2Cu+O2 →400−500oC 2CuO{\displaystyle {\mathsf {2Cu+O_{2}\ {\xrightarrow {400-500^{o}C}}\ 2CuO}}}
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
- Cu+Cl2⟶ CuCl2{\displaystyle {\mathsf {Cu+Cl_{2}\longrightarrow \ CuCl_{2}}}}
- Cu+Br2⟶ CuBr2{\displaystyle {\mathsf {Cu+Br_{2}\longrightarrow \ CuBr_{2}}}}
- Cu+S →CS2 CuS{\displaystyle {\mathsf {Cu+S\ {\xrightarrow {CS_{2}}}\ CuS}}}
При 300—400 °C реагирует с серой и селеном:
- 2Cu+S →300−400oC Cu2S{\displaystyle {\mathsf {2Cu+S\ {\xrightarrow {300-400^{o}C}}\ Cu_{2}S}}}
- 2Cu+Se →300−400oC Cu2Se{\displaystyle {\mathsf {2Cu+Se\ {\xrightarrow {300-400^{o}C}}\ Cu_{2}Se}}}
C оксидами неметаллов:
- 4Cu+SO2 →600−800oC Cu2S+2CuO{\displaystyle {\mathsf {4Cu+SO_{2}\ {\xrightarrow {600-800^{o}C}}\ Cu_{2}S+2CuO}}}
- 2Cu+2NO →500−600oC 2CuO+N2↑{\displaystyle {\mathsf {2Cu+2NO\ {\xrightarrow {500-600^{o}C}}\ 2CuO+N_{2}\uparrow }}}
- 4Cu+2NO2 →500−600oC 4CuO+N2↑{\displaystyle {\mathsf {4Cu+2NO_{2}\ {\xrightarrow {500-600^{o}C}}\ 4CuO+N_{2}\uparrow }}}
- Cu+2N2O4 →80oC,Ch4−COO−Ch3−Ch4 Cu(NO3)2+2NO↑{\displaystyle {\mathsf {Cu+2N_{2}O_{4}\ {\xrightarrow {80^{o}C,CH_{3}-COO-CH_{2}-CH_{3}}}\ Cu(NO_{3})_{2}+2NO\uparrow }}}
С концентрированной соляной кислотой и хлоратом калия (образуется дихлоромедная кислота):
- 6Cu+12HCl+KClO3⟶ 6H[CuCl2]+KCl+3h3O{\displaystyle {\mathsf {6Cu+12HCl+KClO_{3}\longrightarrow \ 6H[CuCl_{2}]+KCl+3H_{2}O}}}
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида.
wiki2.red
Медь — SportWiki энциклопедия
Зачем нужна медьПищевые источники — печень, морепродукты, орехи и семена подсолнечника, вишня, какао. Участвует в регуляции процессов биологического окисления и генерации АТФ, в синтезе гемоглобина и важнейших белков соединительной ткани — коллагена и эластина, в обмене железа, в защите клетки от токсического воздействия активированного кислорода. Необходима для нормального усвоения витамина С.
Продукты питания богатые медиСледует помнить, что алкоголь может усугублять дефицит меди. Яичный желток может связывать медь в кишечнике и препятствовать ее усвоению. Высокое содержание в рационе фруктозы может привести к дефициту меди. Железо может уменьшить способность всасывать медь, а молибден увеличивает потерю меди с мочой. Фитаты могут снизить способность усваивать медь из пищи. Дополнительный прием витамина С в высоких дозах может снизить поглощение меди из пищи, если человек принимает витамин С в составе еды, лучше принимать витамин С сам по себе.
Дефицит меди может быть одной из причин спортивной анемии, отрицательно сказывается на кроветворении, функциях щитовидной железы (часто развивается гипотиреоз), всасывании железа, состоянии соединительной ткани, процессах миелинизации в нервной системе, усиливает предрасположенность к бронхиальной астме, аллергодерматозам, кардиопатиям, витилиго и многим другим заболеваниям, нарушает менструальную функцию женщин.
Медь участвует во многих физиологических функциях центральной нервной системы, включая модулирование возбудимости нейронов. Цинк и медь также играют определенную роль при некоторых неврологических заболеваниях, в том числе при болезнях Альцгеймера, Паркинсона, инсульте и судорогах.
Как известно, медь является существенным компонентом многих важных ферментов. Транспорт элемента нарушается при заболеваниях Вильсона и Менке, причем оба нарушения транспортировки меди связаны с белками мембраны. Вообше в транспортировке меди участвуют многие белки, некоторые из них были идентифицированы в результате исследований путей транспорта меди в дрожжах. Все это позволило говорить о необычном виде транспорта меди при заболеваниях. Стало возможным диагностировать болезни, связанные с транспортом меди на молекулярном уровне.
Повышенное содержание меди в организме у спортсменов отмечается при острых и хронических воспалительных заболеваниях, а также при наличии у них бронхиальной астмы, заболеваний почек и печени.
Хроническая интоксикация медью и ее солями может встречаться у пловцов (в связи с окрашиванием воды медным купоросом и другими солями меди) и приводить к функциональным расстройствам нервной системы, печени и почек, изъязвлению и перфорации носовой перегородки, сухости кожи и даже к аллергодерматозам. Избыток элемента приводит к дефициту цинка и молибдена.
sportwiki.to
|
wiki.web.ru
Медь — Циклопедия
Медь (лат.: Cuprum) — химический элемент одиннадцатой группы четвёртого периода периодической системы; атомный номер 29. Металл золотисто-розового цвета.
Медь известна с древних времен: это первый металл, который заменил камень в первобытных орудиях труда — начало медного века датируется примерно 4-м тысячелетием до н. э.
Открытие древними египтянами бронзы (сплава меди с оловом) — более легкоплавкой и твердой, чем сама медь, положило конец короткому медному веку и дало начало гораздо более длинному бронзовому: с конца 4-го по 1-е тысячелетие до н. э.
Древние римляне вывозили медную руду с острова Кипр, откуда пошло латинское название меди — «купрум».
По распространенности в земной коре занимает 26-е место среди элементов. В основном медь присутствует в горных породах в виде соединений. Промышленное значение имеют халькопирит CuFeS2, халькозин Cu2S, малахит CuCO3·Cu(OH)2, некоторые другие.
Много меди добывается в виде сульфидов меди в крупных карьерах в медно-порфировых месторождениях, которые содержат от 0,4 до 1,0 % меди. Примерами таких месторождений являются шахты Чукикамата в Чили, Бинго-Каньон (Юта) и Эль-Чино (Нью-Мексико) в США. Согласно Британской геологической службе в 2005 году Чили была крупнейшим производителем меди из рудников, кроме того треть всей добычи приходилась на США, Индонезию и Перу. Медь может также быть восстановлена через подземное выщелачивание. Несколько месторождений в штате Аризона считаются первыми кандидатами для применения этого метода. Масштабы использования меди увеличиваются, но ее количество едва удовлетворяет уровень использования в развитых странах.
Более половины всей добычи меди идет на производство электрической проволоки, около 30-40 % — используется для получения различных сплавов — бронзы, латуни.
- Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 0-8493-0485-7.
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
cyclowiki.org

