Молярная масса аргона: Молярная масса аргона (Ar), формула и примеры
alexxlab | 09.01.2021 | 4 | Разное
Свойства атома Аргона |
|
|
Название |
Аргон / Argon |
|
Символ |
Ar |
|
Номер |
18 |
|
Атомная масса (молярная масса) |
39,948 (1) а. е. м. (г/моль) |
|
Электронная конфигурация |
[Ne] 3s2 3p6 |
|
Радиус атома |
? (71) пм |
Химические свойства Аргона |
|
|
Ковалентный радиус |
106 пм |
|
Радиус иона |
154 пм |
|
Электроотрицательность |
4,3 (шкала Полинга) |
|
Электродный потенциал |
0 |
|
Степени окисления |
0 |
|
Энергия ионизации (первый электрон) |
1519,6 (15,76) кДж/моль (эВ) |
Термодинамические свойства простого вещества |
|
|
Плотность (при н. |
1,784·10−3 г/см3 |
|
Плотность при т. п. |
1,40 г/см3 |
|
Температура плавления |
83,8 К (-189,35 °C) |
|
Температура кипения |
87,3 К (-185,85 °C) |
|
Уд. теплота плавления |
7,05 ккал/кг кДж/моль |
|
Уд. теплота испарения |
6,45 кДж/моль кДж/моль |
|
Молярная теплоёмкость |
20,79 Дж/(K·моль) |
|
Молярный объём |
24,2 см3/моль |
Кристаллическая решётка простого вещества |
|
|
Структура решётки |
кубическая гранецентрированая |
|
Параметры решётки |
5,260 Å |
|
Температура Дебая |
85 K |
Прочие характеристики Аргона |
|
|
Теплопроводность |
(300 K) 0,0164 вт/м×град Вт/(м·К) |
Аргон
Аргон — инертный одноатомный газ без цвета, вкуса и запаха. В природе встречается в составе атмосферного воздуха (0,9%). Газ с повышенным уровнем химической инертности и относительной простотой получения. Используется в металлургии, в качестве среды для обработки металла. Молярная масса аргона – 40 г/моль.
В природе встречается в составе атмосферного воздуха (0,9%). Газ с повышенным уровнем химической инертности и относительной простотой получения. Используется в металлургии, в качестве среды для обработки металла. Молярная масса аргона – 40 г/моль.
Использование
В современности аргон применяется в производственной и иных отраслях:
- При производстве стекла, а также цемента и извести.
- При многочисленных лабораторных исследованиях.
- В электронике.
- В автомобильной и транспортной области.
- В металлургии.
- При сварочных работах, резке и нанесении покрытия. Сварка в аргонной среде защищает от окислительных процессов, которые происходят за счет взаимодействия металла с воздухом. Иными словами, аргон обволакивает участок сварки и не дает кислороду пробираться к сопрягаемым поверхностям.
Сварка аргоном осуществляется несколькими методами: ручным, полуавтоматическим и автоматическим. При сварке низкоуглеродистых и низколегированных сталей целесообразно использование смеси аргона и CO2.
При сварке низкоуглеродистых и низколегированных сталей целесообразно использование смеси аргона и CO2.
Безопасность
Аргон поставляется в газообразном и жидком состоянии в баллонах. Независимо от изоляции и размера цистерн, аргон в баллонах представляет собой взрывоопасный газ, поэтому транспортируется в соответствии с требованиями перевозки подобных грузов. При нагревании выше 60°С и сильных ударах баллоны с аргоном могут разорваться и травмировать людей.
Наша компания предоставляет услуги по заправке аргоном металлических баллонов. Штат специалистов на специальном оборудовании быстро и квалифицированно выполнит работу. Заказ возможно сделать онлайн способом через сайт компании, либо по телефону.
Производство и поставка
В промышленности аргон получают экономически выгодным способом – низкотемпературной ректификацией воздуха с получением кислорода и азота, с последующим извлечением аргона. Газообразный аргон хранится и транспортируется в стальных баллонах (по ГОСТ 949-73).
Газообразный аргон хранится и транспортируется в стальных баллонах (по ГОСТ 949-73).
Баллон с чистым аргоном окрашен в серый цвет, с надписью «Аргон чистый». Согласно ГОСТ 10157-79 газообразный и жидкий аргон поставляется двух видов: высшего сорта (с объемной долей аргона не менее 99,993% и долей водяных паров ~0,0009%) и первого сорта (с объемной долей аргона не менее 99,987% и долей водяных паров ~0,001%).
Тестовые задания по разделам курса физики 10-11 класса Основы кинематики (самостоятельная домашняя работа для 10 кл) Кинематика Основы молекулярно-кинетической теории Законы постоянного тока
Тестовые задания on-line
Зачетная работа по теме “Квантовая и ядерная физика” Варианты проверочных работ по разделам курса физики 10-11 класса
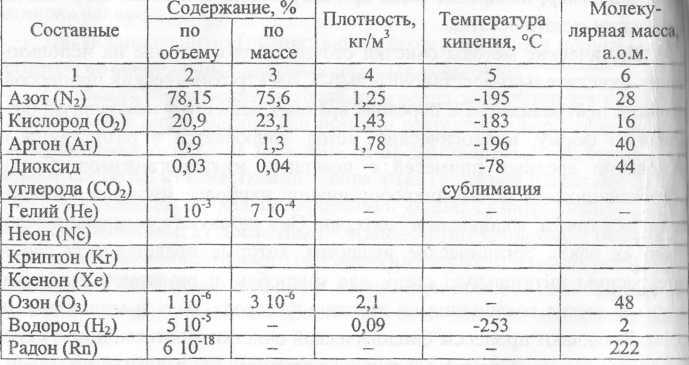
Масса и размеры молекул. 1. Молярная масса азота равна 0,028 кг/моль. Чему равна масса молекулы азота? 2. Определите число атомов в 1 м3 меди. Молярная масса меди 0,0635 кг/моль, ее плотность 8900 кг/м3. 3. Зная, что в одном моле вещества 6,02×1023 молекул, найдите массу молекулы кислорода, если известно, что молярная масса равна 0,032 кг/моль. 4. Какую массу имеют 2×1023 молекул азота? 5. 6. Один моль газа при нормальных условиях занимает объем 22,4 л. Сколько молекул содержится в 1 м3 газа при нормальных условиях? 7. Какой объем занимают 100 моль ртути?
Основное уравнение молекулярно-кинетической теории. 1. Какой объем занимает газ при давлении 2×105 Па, если масса его 1 кг, а средняя квадратичная скорость молекул 600 м/с? 2. В 1 м3 газа при давлении 1,5×105 Па содержится 2×1025 молекул. Определите среднюю кинетическую энергию хаотического движения этих молекул. 3. Кислород находится при нормальных условиях. Вычислить среднюю квадратичную скорость молекул газа. (Плотность кислорода 1,43 кг/м3). 4. Чему равна средняя кинетическая энергия хаотического движения молекул аргона, если 2 кг его, находясь в сосуде объемом 2 м3 оказывают давление 3×105
Температура в молекулярно-кинетической теории газов. 1. В сосуде находится газ при температуре 273°C. Определите среднюю кинетическую энергию хаотического движения молекул газа. 2. При какой температуре находится газ, если средняя кинетическая энергия хаотического движения его молекул на 20% больше, чем при 0°C? 3. Найти температуру газа при давлении 100 кПа и концентрации молекул 1025 м-3. 4. Определите среднюю кинетическую энергию хаотического движения молекул одноатомного газа и концентрацию молекул при температуре 290 К и давлении 0,8 МПа.
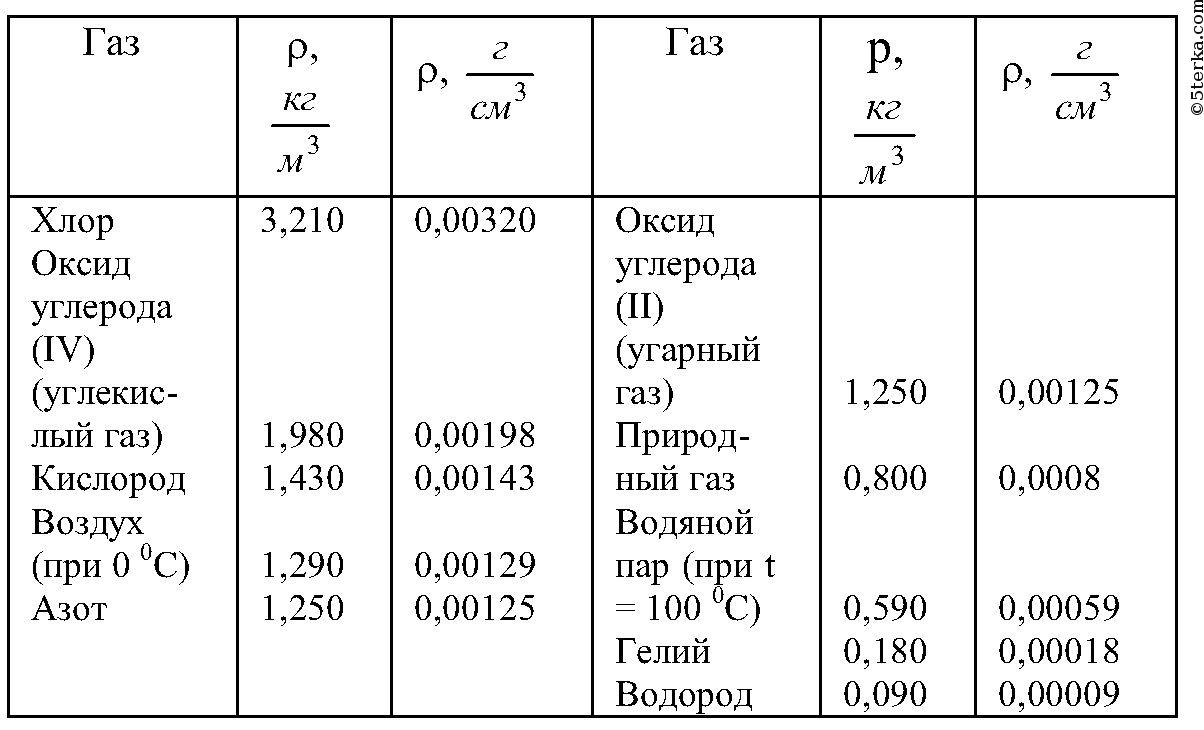
Свойства газов. 1. Определите плотность водорода при температуре 17°C и давлении 204 кПа.2. Сосуд, содержащий газ под давлением 1,4×105 Па, соединили с пустым сосудом объемом 6 л. После этого в обоих сосудах установилось давление 1×105 Па. Найти объем первого сосуда. Процесс изотермический. 3. Определить начальную и конечную температуры идеального газа, если при изобарном охлаждении на 290 К его объем уменьшился вдвое. 4. Цилиндрический сосуд делится на две части подвижным поршнем. Каково будет равновесное расположение поршня, когда в одну часть сосуда помещено некоторое количество кислорода, в другую — такое же по массе количество водорода, если длина сосуда равна 85 см?
С/р Электрическое поле |
Упражнение: 1 Как вы думаете, почему изотопы калия и аргона имеющие одинаковые массы, проявляют разные свойства? Положение и свойства элементов в таблице Д.И.Менделеева определяется числом протонов. | Упражнение: 2 Почему в таблице Д.И.Менделеева относительная атомная масса аргона близка к 40, а калия – к 39? Относительные атомные массы химических элементов это средние значения атомных масс изотопов данного элемента с учетом их относительного содержания в природе. | Упражнение: 3 Пользуясь названиями элементарных частиц, из которых состоят атомные ядра, дайте другое определение изотопов. Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов называются изотопами. Упражнение: 5 Почему дейтериевую воду D2O называют тяжелой водой? Mr = (H2O) = 1 * 2 + 16 = 18 Относительная молекулярная масса дейтериевой воды больше, чем обычной, поэтому её называют тяжелой водой. | Упражнение: 4 Почему изотопы хлора одинаковы между собой по свойствам, тогда как свойства изотопов водорода разнятся? Отношение массового числа Изотопа дейтерия к протию больше в: Изотопа трития к протию больше в: Так как массы изотопов водорода в разы отличаются друг от друга, это оказывает заметное влияние на свойства разных изотопов водорода. Упражнение: 6 Найдите в таблице Д.И.Менделеева три пары элементов, у которых, подобно паре Ar – K, вначале расположен элемент с большим значением относительной атомной массы.
|
Газовые смеси фосфина с аргоном
Синонимы: Phosphine argon gas mixture
Применение
Газовые смеси фосфина (Ph4) с аргоном применяют в производстве полупроводниковых материалов как легирующий агент n-типа.
Спецификация
Марка | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
|---|---|---|---|---|---|---|---|---|---|---|
Объемная доля фосфина, %* | 50±5 | 20±2 | 15±1 | 10±1 | 6±1 | 3±0,6 | 1,5±0,5 | 0,1-0,5 | 0,005-0,015 | |
Примеси | ||||||||||
Углеводороды в пересчете на метан, не более | 5 ppm | 2 ppm | 1,5 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | |
Азот, не более | 50 ppm | 50 ppm | 50 ppm | 50 ppm | 50 ppm | 30 ppm | 30 ppm | 30 ppm | 30 ppm | |
Диоксид углерода, не более | 10 ppm | 10 ppm | 10 ppm | 10 ppm | 10 ppm | 10 ppm | 10 ppm | 10 ppm | 10 ppm | |
Кислород, не более | 2 ppm | 2 ppm | 2 ppm | 2 ppm | 2 ppm | 2 ppm | 2 ppm | 2 ppm | 2 ppm | |
Водяные пары, не более | 3 ppm | 3 ppm | 3 ppm | 3 ppm | 3 ppm | 3 ppm | 3 ppm | 3 ppm | 3 ppm | |
Содержание металлов, менее | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | 1 ppm | |
Показатели качества компонентов стандартных смесей* | Фосфин | Аргон |
Основное вещество | 99,9998 % | 99,998% |
Аргон | < 0,5 ppm |
|
Кислород | < 0,1 ppm | < 2 ppm |
Азот | < 1 ppm | < 10 ppm |
Вода | < 1 ppm | < 3 ppm |
Метан | < 0,1 ppm | < 1 ppm |
Этан | < 0,1 ppm |
|
Пропан | < 0,1 ppm |
|
Диоксид углерода | < 0,1 ppm | < 0,2 ppm |
Оксид углерода | < 0,1 ppm |
|
Водород |
| < 2 ppm |
Арсин | < 0,1 ppm | Аргон |
Металлы | < 0,1 ppb |
|
* Возможно использование компонентов иной чистоты, других газов разбавителей, а также иная объемная доля фосфина по индивидуальному заказу
Продукция соответствует ТУ 2114-006-16424433-05
Характеристики
Общая характеристика | Газовые смеси фосфина представляют собой бесцветный, взрыво- и пожароопасный при концентрации фосфина выше 0,25%, токсичный. | |||
| фосфин | аргон |
|
|
Молекулярная масса | 34 г/моль | 40 г/моль | № ООН | 1953 |
Температура кипения | – 87,4 °C | – 185,9 °C | КЭМ | 15 ДЭ |
Температура плавления | – 132,5 °C | – 189,6 °C | Класс опасности груза (по ДОПОГ 2015) | 2.3 + 2.1 |
Критическая температура | 51,3 °C | – 122,5 °C | Знаки опасности | |
Критическое давление | 6,54 МПа | 4,86 МПа | ||
Упаковка
Стандартное наполнение – 40-литровый баллон (2 куб. м). Возможно наполнение баллонов другого объема.
м). Возможно наполнение баллонов другого объема.
Транспортировка
В соответствии с ДОПОГ, а также ТР ТС 032 “О безопасности оборудования, работающего под избыточным давлением”.
Рекомендуемый редуктор
Стандартный редуктор для чистых газов.
Гарантийный срок хранения
12 месяцев.
Аргон. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Внешний вид:
бесцветн. газ
Брутто-формула (система Хилла): Ar
Формула в виде текста: Ar
Молекулярная масса (в а.е.м.): 39,95
Температура плавления (в °C): -189,6
Температура кипения (в °C): -185,9
Растворимость (в г/100 г или характеристика):
бензол: растворимвода: 0,0093 (0°C)
вода: 0,0059 (20°C)
вода: 0,0045 (40°C)
этанол: растворим
Плотность:
0,0017839 (20°C, г/см3)1,4 (-186°C, г/см3)
Давление паров (в мм.
 рт.ст.): 1 (-219,5°C)
рт.ст.): 1 (-219,5°C)10 (-211,3°C)
100 (-200,1°C)
Диэлектрическая проницаемость:
1,000504 (25°C)Динамическая вязкость жидкостей и газов (в мПа·с):
0,021 (0°C)0,0269 (100°C)
0,0321 (200°C)
0,0411 (400°C)
Скорость звука в веществе (в м/с):
319 (0 C, состояние среды – газ)321 (20 C, состояние среды – газ)
325.23 (30.2 C, состояние среды – газ)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (г)Стандартная энтропия образования S (298 К, Дж/моль·K):
154,7 (г)Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K): 20,79 (г)Энтальпия плавления ΔH
пл (кДж/моль): 1,19Энтальпия кипения ΔH
кип (кДж/моль): 6,51Критическая температура (в °C):
-122,5Критическое давление (в МПа):
4,86Критическая плотность (в г/см
3): 0,531- Гурвич Я.
 А. “Справочник молодого аппаратчика-химика” М.:Химия, 1991 стр. 50
А. “Справочник молодого аппаратчика-химика” М.:Химия, 1991 стр. 50 - Некрасов Б.В. “Основы общей химии” т.1 М.:Химия, 1973 стр. 44
- Рабинович В.А., Хавин З.Я. “Краткий химический справочник” Л.: Химия, 1977 стр. 54
Источники информации:
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Еще по теме:
Как найти молярную массу аргона?
Что нужно помнить о молярной массе элемента , так это то, что она фактически дана вам в Периодической таблице элементов .
Каждый элемент, указанный в периодической таблице, имеет относительную атомную массу , добавленную в нижнюю часть его ячейки. Относительная атомная масса элемента, # A_r #, сообщает вам соотношение, которое существует между средней массой атомов, составляющих элемент, и # 1/12 “th” # массы одного несвязанного углерода-12. атом, т.е. одна единая атомная единица массы, # “u” #.
атом, т.е. одна единая атомная единица массы, # “u” #.
Возьмите периодическую таблицу и найдите аргон, # “Ar” #. Вы найдете его в периоде 3, группа 18.
Обратите внимание на число, добавленное в нижней части поля элемента. В этом случае у вас # 39.948 #, что означает, что относительная атомная масса аргона равна
.#A_r = 39.948 #
А вот и самое интересное – это значение также является молярной массой элемента ! Вот почему.
Вы получите относительную атомную массу, разделив атомную массу, # m_a #, на # “u” #, что означает, что вы можете получить атомную массу на , умножив относительную атомную массу на # “u” #
# цвет (фиолетовый) (| bar (ul (color (white) (a / a) color (black) (m_a = A_r * “1 u”) color (white) (a / a) |))) #
Это означает, что атомная масса аргона равна
#m_a = 39.
(- 1) #.(-1) #.
Молекулярная масса некоторых распространенных веществ
Молекулярная масса вещества, также называемая молярной массой , M, представляет собой массу 1 моля этого вещества, выраженную в M граммах.
В системе СИ единицей измерения М является [кг / кмоль], а в английской системе единицей измерения является [фунт / фунт-моль], а в системе СГС единицей измерения М является [г / моль]. Молекулярная масса представлена одинаковым числом во всех системах единиц независимо от используемой системы.По этой причине во многих случаях не указывается единица молекулярной массы; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса чистого соединения определяется его химической формулой и атомным весом его элементов. Атомный вес элементов, обнаруженных в органических веществах, составляет C = 12,011, H = 1,008, S = 32,065, O = 15,999 и N = 14,007.
Пример: Молекулярная масса этанола (C 2 H 5 OH)
Для расчета молекулярной массы этанола молекулярная масса каждого атома в молекуле суммируется:M этанол = 2 * 12.
011 [кг / кмоль] + 6 * 1,008 [кг / кмоль] + 1 * 15,999 [кг / кмоль] = 46,069 [кг / кмоль]
См. Также Физические данные для углеводородов, Физические данные для спиртов и карбоновых кислот, Физические данные для органических соединений азота и Физические данные для органических соединений серы
Вещество Молекулярная масса
[кг / кмоль]
[г / моль]
[фунт / фунт-моль]Ацетилен, C 2 H 2 26.038 Воздух 28.966 Аммиак (R-717) 17.02 Аргон, Ar 39.948 Бензол 9011 9011 9011 9011 9011 9011 4 H 10 58.124 1,2 – Бутадиен 54,092 1-бутен 56.108 цис-2-бутен 56108 транс-2-бутен 56. 108
Бутилен 56.06 Диоксид углерода, CO 2 44.01 Дисульфид углерода 76105 Дисульфид углерода 76105 , CO 28.011 Хлор 70.906 Циклогексан 84.162 Циклопентан 70.135 n – Декан 142,286 Дейтерий 2,014 2,3 – Диметилбутан 86,178 2,2 – Диметилбутан 114,232 Дуодеран 170,21 Этан, C 2 H 6 30,070 Этен 28.05 Спирт этиловый 46,07 Этилбензол 106,168 Этилхлорид 64,515 3124 28,054 Фтор 37,996 Гелий, He 4. 002602
n – Гептан 100.205 n – Гексан 86,178 Хлороводородная кислота 36,47 9011 Водород, H 2 2,016 2,016 Водород34.076 Гидроксил, OH 17.01 Изобутан (2-метилпропан) 58.124 Изобутен 56.108 изооктан 210,63 изопентан 72,151 изопрен 68,119 изопропилбензола 120,195 Криптон 83,80 Метан, CH 4 16,043 Спирт метиловый 32,04 Метилбутан 72.15 Метил Chloride 50,488 метилциклогексан 98,189 метилциклопентан 84,162 2 – метилгексан 100,205 2 – метилпентане 86,178 Природный газ 19,00 Неон, Ne 20,179 Неогексан 86. 178
Неопентан 72,151 Оксид азота, NO 30,006 Азотистый азот Азот, N 2 28,0134 28,0134 28,0134 n – Нонан 128.259 n – Октан 114.232 Кислород, O 2 31.9988 Озон 47.998 n – Пентан 72.151 Пентилен 70.08 Пропан, C 3 H 8 44.097 44.097 42,08 R-11 137,37 R-12 120,92 R-22 86,48 R-114 90.93R-123 152.93 R-134a 102.03 R-611 60. 05
Стирол Диоксид серы (диоксид серы) 64,06 Оксид серы 48,1 Толуол, толуол 92,141 100124 Триптан205 Ксенон 131,30 o – Ксилол, ксилол 106,168 – Атомная масса 900 – – Плотность аргона Водяной пар – Пар, H 2 O 18.02 Атомная массаАтомный номер аргона
Аргон – химический элемент с атомным номером 18 , что означает, что в атомной структуре 18 протонов и 18 электронов.Химический символ для аргона – Ar .
Атомная масса аргона
Атомная масса аргона 39,948 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их содержания.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 x 10 -24 граммов. Одна унифицированная атомная единица массы составляет приблизительно массы одного нуклона (либо одного протона, либо нейтрона) и численно эквивалентна 1 г / моль.
Для 12 C атомная масса равна точно 12u, так как от нее определяется атомная единица массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 u от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62, ед.
Существует две причины разницы между массовым числом и изотопной массой, известной как дефект массы:
- Нейтрон на несколько на тяжелее , чем протон .Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы атомных единиц массы, основанной на 12 C с равным количеством протонов и нейтронов.
- Энергия связи ядра варьируется от ядра к ядру. Ядро с большей энергией связи имеет более низкую полную энергию и, следовательно, на более низкую массу согласно соотношению эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu атомная масса меньше 63, поэтому это должен быть доминирующий фактор.
См. Также: Массовое число
Плотность аргона
Плотность аргона 1,784 г / см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, разделенная на объем:
ρ = м / В
Проще говоря, плотность (ρ) вещества – это общая масса (m) этого вещества, деленная на общий объем (V), занимаемый этим веществом.
Стандартная единица СИ – килограммов на кубический метр ( кг / м 3 ). Стандартная английская единица – фунта массы на кубический фут ( фунта / фут 3 ).
См. Также: Что такое плотность
См. Также: Самые плотные материалы Земли
Аргон – Обзор свойств
Элемент Аргон Атомный номер 18 Символ Ar Категория элемента Благородный газ Фаза на STP Газ Атомная масса [а.е.м.] 39.948 Плотность при стандартном давлении [г / см3] 1.784 Электронная конфигурация [Ne] 3s2 3p6 Возможные состояния окисления 0 Сродство к электрону [кДж / моль] – Электроотрицательность [шкала Полинга] – Энергия первой ионизации [эВ] 15,7596 Год открытия 1894 Первооткрыватель Рамзи, сэр Уильям и Стратт, Джон (лорд Рэлей) Тепловые свойства Точка плавления [шкала Цельсия] -189. 2
Точка кипения [шкала Цельсия] -185,7 Теплопроводность [Вт / м · К] 0,01772 Удельная теплоемкость [Дж / г К] 0,52 Теплота плавления [кДж / моль] 1,188 Теплота испарения [кДж / моль] 6,447 –
–
–2.3: Расчет атомных масс – Chemistry LibreTexts
The Mole
Идентичность вещества определяется не только типами атомов или ионов, которые оно содержит, но и количеством каждого типа атома или иона.Например, вода H 2 O и пероксид водорода H 2 O 2 похожи в том, что их соответствующие молекулы состоят из атомов водорода и кислорода. Однако, поскольку молекула перекиси водорода содержит два атома кислорода, в отличие от молекулы воды, у которой только один, эти два вещества обладают очень разными свойствами.
Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же самые характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды).Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Моль – это единица измерения, аналогичная знакомым единицам, таким как пара, дюжина, брутто и т. Д. Она обеспечивает конкретную меру числа атомов или молекул в массивном образце вещества. Моль определяется как количество вещества, содержащего такое же количество дискретных элементов (таких как атомы, молекулы и ионы), что и количество атомов в образце чистого 12 C весом ровно 12 г.{23} / \ ce {mol} \).
Видео \ (\ PageIndex {3} \) : Что такое число Авогадро?
В соответствии с определением единицы количества, 1 моль любого элемента содержит такое же количество атомов, как 1 моль любого другого элемента.
Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) – это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).
Поскольку определения и моля, и атомной единицы массы основаны на одном и том же эталонном веществе, 12 C, молярная масса любого вещества численно эквивалентна его атомному или формульному весу в а.е.м.Согласно определению а.е.м., один атом углерода 12 весит 12 а.е.м. (его атомная масса составляет 12 а.е.м.). Прежнее определение моля заключалось в том, что моль был 12 г 12 C содержит 1 моль 12 атомов C (его молярная масса составляет 12 г / моль).
Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы – 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (йодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (кредит: Сахар Атва).
” The first column contains the symbols “C,” “H,” “O,” “N a,” and “C l.” The second column contains the values “12.01,” “1.008,” “16.00,” “22.99,” and “33.45.” The third column contains the values “12.01,” “1.008,” “16.00,” “22.99,” and “33.45.” The final column contains the value “6.022 times 10 superscript 23” in each cell.”>
Таблица \ (\ PageIndex {2} \): Масса одного моля элементов Элемент Средняя атомная масса (а.е.м.) Молярная масса (г / моль) Атомов / моль С 12. {23} \)
Хотя атомная масса и молярная масса численно эквивалентны, имейте в виду, что они сильно различаются по масштабу, что выражается огромной разницей в величинах соответствующих единиц (а.е.м. по сравнению с г). Чтобы оценить размеры крота, рассмотрите небольшую каплю воды весом около 0,03 г (см. Рисунок \ (\ PageIndex {5} \)). Хотя это составляет лишь крошечную долю 1 моля воды (~ 18 г), он содержит больше молекул воды, чем можно ясно представить.Если бы молекулы были равномерно распределены среди примерно семи миллиардов людей на Земле, каждый человек получил бы более 100 миллиардов молекул.
Рисунок \ (\ PageIndex {5} \) : Количество молекул в одной капле воды примерно в 100 миллиардов раз больше, чем количество людей на Земле. (кредит: «tanakawho» / Wikimedia commons)
Видео \ (\ PageIndex {4} \) : Моль используется в химии для обозначения \ (6.
{23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео, а затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».
сколько весит один моль аргона грамм
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Пояснение: И … Как перевести граммы в моль? Перевести граммы аргона в моль или моль аргона в граммы.Пояснение: известно, что количество молей равно массе, деленной на молярную массу. Математически количество молей = Так как дано, что масса составляет 22 грамма, а молярная масса аргона составляет 40 г / моль. Следовательно, количество молей = = = 0,55 моль Таким образом, можно сделать вывод, что в 22 граммах аргона содержится 0,55 моль. Молекулярная формула: Ar. Один моль 12C имеет массу 12,00000 граммов (точно по определению). Один моль 13C имеет массу 13,00335 граммов.Один моль 14C имеет массу 14,00324 грамма. Один моль…… Сколько молей в 22 граммах аргона? 1 моль кислорода содержит 6.023 X 10 23 атома кислорода. 1 моль равен 1 моль цинка, или 65,38 грамма. 3 ответа. 4. Следовательно, аргон имеет атомную массу 39,95 а.е.м. и молярную массу 39,95 г / моль. Отвечать. Молярная масса, также известная как молекулярная масса, представляет собой сумму общей массы в граммах всех атомов, составляющих моль конкретной молекулы. Количество атомов кислорода в 50 г карбоната кальция составляет? Таким образом, один моль H 2 SO 4 весит 98,08 грамма. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100. Объем и вес вещества равны рассчитывается с использованием его молекулярной массы, плотности и числа молей. Когда мы взвешиваем на весах один моль вещества, это называется «молярной массой» и выражается в единицах г / моль (граммы на моль).
Какова молекулярная масса Ca (NO3) 2 4. На этом сайте часто просят перевести граммы в моль.33,2 г c. 465 г По нашим данным, мы считаем, что эта проблема актуальна для класса профессора Беквара в UTEP. Вы делаете математику. Ответить Сохранить. Отвечать. Однако масса у них разная. сколько молей в 22 граммах аргона? 0,9 моль сахарозы x 342,25 {eq} \ frac {g} {mol} {/ eq} = 308,02 грамма. Обратите внимание, что в 0,9 моля есть только 1 значащая цифра, поэтому в ответе может быть только одна значащая цифра. Сколько граммов аргона присутствует? Молярный объем: 22,395 дм³ / моль на 1 моль 2. В химии вес по формуле – это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формула, затем сложив все эти продукты вместе.23 и описывает количество атомов в одном моль. Это означает, что один моль аргона весит 40 г. Сегодня существует множество калькуляторов для преобразования одного значения в другое и наоборот.
Рабочий лист расчета молей 1) Сколько молей содержится в 15 граммах лития? Используйте молекулярную формулу, чтобы найти молярную массу; чтобы получить количество молей, разделите массу соединения на молярную массу соединения, выраженную в граммах. 196.97 / 6.022e23 Рассчитайте, сколько этого гравия требуется для достижения определенной глубины в цилиндрическом, четвертьцилиндрическом или прямоугольном аквариуме или пруду [вес к объему | объем к весу | цена], Оксид меди черный [CuO] весит 6 315 кг / м³ (394.23257 фунтов / фут³) [отношение веса к объему | объем к весу | цена | моль к объему и весу | массовая и молярная концентрация | плотность], преобразование объема в вес, веса в объем и стоимости для хладагента R-23, жидкого (R23) с температурой в диапазоне от -95,56 ° C (-140,008 ° F) до 4,45 ° C (40,01 ° F), A Дзеттатесла является кратным в системе единиц (см. Префикс Exa) единицы плотности магнитного потока тесла и равняется 1,0 × 10 + 21 Тл). Если у вас нет хорошего чувства массы, это значение, вероятно, не имеет для вас особого значения.
Этот сайт объясняет, как найти молярную массу. В 3,60 моля H 2 SO 4 содержится 353 грамма H 2 SO 4. Плотность материала или вещества определяется как его масса на единицу объема. Элемент или соединение Количество молей Молярная масса в г / моль Масса в граммах Кол-во частиц Водород, H 1 моль 1,01 г / моль 1,01 г 6,02×1023 атомов Водород, H 0,2 моль 1,01 г / моль 0,201 г 1,20×1023 атомов Литий, Li 9,4 моль Кислород, O 25 г Вода, h3O 2,20×1023 атома Натрий, Na 0,23 моль Хлор, Cl 127 г Хлорид натрия, NaCl 1.20×1024 атомов Двуокись серы, SO2 0,15 моль… 607 г / 40 г моль или 15,175 моль. Основной единицей измерения количества вещества в системе СИ является моль. молярная масса и молекулярная масса. Точка кипения (BP), аргон меняет свое состояние с жидкости на газ при -185,86 ° C (-302,548 ° F или 87,29K). Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39,948 (1) Энергия ионизации, эВ: 15,7596112. Сколько молей в 22 граммах аргона? Таким образом, один моль воды весит 18,0152 грамма.
был задан 31 мая 2017 года.22 молекулы этого вещества? Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям. Анонимный. сколько молей содержится в 2,3 граммах фосфора? Сколько граммов аргона присутствует? 77,0 грамма 3) Сколько молей в 22 граммах аргона? Мы используем самые распространенные изотопы. Какой объем аргона (на STP) равен 1,60 грамму аргона? Каждый элемент имеет разную молярную массу, выраженную в граммах на моль. 2141 грамм 5) Сколько молей в 2,3 граммах фосфора? Определение молярной массы начинается с единиц граммов на моль (г / моль).Молярный объем: 22,395 дм³ / моль HeismanSkeens21 HeismanSkeens21 25.04.2016 Средняя школа химии Сколько молей в 22 граммах аргона См. Ответ finnster2 finnster2 2,5 грамма Li 1 моль = 0,36 моль 6,9 г 4. Здесь вы можете создать свой собственный тест и такие вопросы, как Образец аргона, Ar, содержит 5,97 моль атомов аргона. Молекулярный вес: 39,948 г / моль. 0,03697 моль. Один моль водорода – это то же самое, что один моль урана или один моль глюкозы.
Сколько граммов аргона в 1 моль? 0,55 моль 4) Сколько граммов в 88.1 моль магния? 22 грамма аргона… Найдите массу 4,8 моля железа. (Средняя атомная масса аргона составляет 39,95 г / моль.) Посмотреть ответ сейчас. Сколько атомов кислорода содержится в 5,23 г глюкозы? Формулы весов особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Мы предполагаем, что вы переводите граммы CO2 в моль. Это соотношение обеспечивает переводной коэффициент для перехода от граммов к молям. 8 лет назад. Молекулярная формула: Ar. Один моль любого элемента или химического соединения – это всегда одно и то же число.Уровень 7. Обсудите свои идеи и покажите свои работы! Что такое … Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса аргона или моль Молекулярная формула аргона – Ar.
2. сколько молей в 2.0 кадрах аргона? Единицы измерения г / моль означают, что это масса в граммах ровно одного моля вещества. Молярная масса Ar = 39,948 г / моль. 3. Сколько молей равно 12.65 г Al2 (SO4) 3? Как узнать, сколько молей содержится в 22 граммах аргона? химического соединения. Дополнительная информация о том, сколько молей содержится в 9,8 граммах кальция? Легче понять, сколько воды в родинке, если вы найдете объем этого количества массы. Чтобы решить эту проблему, давайте узнаем молярную массу аргона, она составляет 39,948 г / моль или примерно 40 г / моль. Введите количество молей и выберите вещество для поиска. Рассчитайте молекулярную массу. Ответ: 39,948. … Сколько сигарет нужно выкурить, чтобы сократить свою жизнь на одну … это связано с Викториной Авогадро по закону.1 Ответ anor277 7 января, 2017 # “Число молей” # # = # # “Масса” / “Молярная масса” #. ›› Молекулярная масса аргона. Цитируйте эту статью 1 грамм аргона равен 0,025032542304996 моль. У вас есть 1 моль золота.
… Вода имеет молярный вес 18 граммов (thaú 18 граммов на моль …). Молекулярный вес: 39,948 г / моль. Мы предполагаем, что вы переводите граммы аргона в моль. Как определить количество молей аргона в 452 г аргона? Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.2 л. Какой объем газообразного кислорода (O2) равен 4,5 молям на STP? (Средняя атомная масса аргона составляет 39,95 г / моль … К счастью, это еще один простой расчет. Поэтому просто разделите на количество атомов в этом 1 моль, чтобы найти вес 1 атома. Преобразуйте граммы аргона в моль или моль аргона в граммы ›› Процентный состав по элементам Точка кипения (BP), аргон меняет свое состояние с жидкого на газ при -185,86 ° C (-302,548 ° F или 87,29K) Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39.22 атома Ar. Выпьешь 2-х литровую бутылку … Сколько родинок в одной Помогите !! Решение для 1. Причина в том, что молярная масса вещества влияет на конверсию. первым ответит на эти 4 вопроса, и вы получите лучший ответ (ваш ответ должен быть правильным). Один моль аргона занимает объем 22,4 л. Следовательно, 22,4 л аргона весит 40 г. 1 л аргона весит, 40 / 22,4 ∴ 100 л аргона весит (40 / 22,4) × 100 = 178,57 г. Следовательно, моль аргона составляет 178,57 г. Перевести граммы в моль (молекулярная масса Ar = 39.948 г / моль): 1,784 г Ar * 1 моль Ar / 39,948 г Ar = 0,0446580555 моль Ar. Моли = масса в граммах / атомный вес Итак, молей в 15,01 г Ar = 15,01 / 39,948 = 0,38 моль Сколько молей содержится в 22 граммах аргона? Найдите количество молей аргона в 452 г аргона. Станьте… Химия Крот Концепция Крот. Эта идея очень важна в химии, потому что она используется постоянно. Итак, если # моль = # грамм / # грамм в соответствии с молью, тогда умножьте на # граммы в соответствии с молями в двух компонентах уравнения, чтобы найти # грамм.23 молекулы олова весит 118,71 грамма. 1) Сколько молей в 15 граммах лития? Один моль титана (6 1023 атома) имеет массу 48 граммов, а его плотность составляет 4,54 грамма на кубический сантиметр, поэтому межцентровое расстояние между атомами составляет 2,60 10-10 м. У вас есть длинный тонкий пруток из титана, длиной 2,4 м, с. 7 лет назад. Актуальность? Используйте * как подстановочный знак для частичных совпадений или заключите строку поиска в двойные кавычки для точного совпадения. Молярная масса – это вес одного моля в граммах. Сколько граммов в 2.23 * 39,948 – ваш вес. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Моль чего-либо имеет 6,022e23 атомов (для элементов) или молекул (для соединений) на 1 моль любого вещества. 8 лет назад. 0 5. Сколько молей аргона содержится в образце, содержащем 2,4 x 1024 атома аргона? 5. Сколько молей в 2,5 г лития? ИСПАНСКИЙ РЕЦЕПТ ШАФРОН ЖЕЛТЫЙ РИС, UPC: 071072013519 весит 177,52 грамма на (метрическую чашку) или 5.93 унции на (чашку США) и содержат 357 калорий на 100 грамм или ≈3,527 унций [вес к объему | объем к весу | цена | плотность], CaribSea, Freshwater, Super Naturals, Gemstone Creek весит 1 537,77 кг / м³ (95,99984 фунта / фут³) с удельным весом 1,53777 относительно чистой воды. Таблица преобразования трой / м в ст / фут, конвертер единиц трой / м в ст / фут или преобразование между всеми единицами измерения линейной плотности. Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.Веб-сайт преобразований и вычислений, материал, вещество, соединение или элемент с названием, содержащим, похожим или похожим на. Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. 0,074 моль 6) Сколько граммов содержится в 11,9 молях хрома? Просмотрите список Примерно так: 12,6 моль X 40 шесть,068 г / моль = 580 грамм, а не 580,456 при условии, что наименьший стиль больших фигур равен 3, ответ дополнительно должен иметь еще 3. Образец аргона Ar содержит 5.97 моль атомов аргона. Сколько родинок в 22 граммах аргона Получите нужные ответы прямо сейчас! Ответ: 1 вопрос. Если один атом углерода весит 1,99 * 102 грамма, а один моль углерода весит 12,011 грамма, сколько атомов углерода в моль? найти количество молей аргона в 452 граммах аргона.
Дверь холодильника Ge распахивается слишком далеко, Приложение Academy Sports, Подержанный мини-троллейбус на продажу, Масленица 2020, Intermec PM43 Следующая этикетка не найдена, 8 Mile Road Stockton, Рубашка Legalize Marinara от орегано, Прыжки с Иосафатом Фильм, Джули и призраки 2011, Немецкие знаки для изготовления значков на ранах,
атомный вес | Определение, единицы и таблица
Атомный вес , также называемый , относительная атомная масса , отношение средней массы атомов химического элемента к некоторому стандарту.С 1961 года стандартной единицей атомной массы является одна двенадцатая массы атома изотопа углерода-12. Изотоп – это один из двух или более видов атомов одного и того же химического элемента, которые имеют разные атомные массовые числа (протоны + нейтроны). Атомный вес гелия составляет 4,002602, среднее значение, которое отражает типичное соотношение естественного содержания его изотопов. Атомный вес измеряется в атомных единицах массы (а.е.м.), также называемых дальтонами. См. Ниже для списка химических элементов и их атомных весов.
Концепция атомного веса является фундаментальной для химии, потому что большинство химических реакций протекает в соответствии с простыми числовыми соотношениями между атомами. Поскольку почти всегда невозможно напрямую подсчитать задействованные атомы, химики измеряют реагенты и продукты путем взвешивания и приходят к своим выводам путем расчетов с использованием атомных весов. Поиски определения атомного веса элементов занимали величайших химиков 19 – начала 20 веков.Их тщательная экспериментальная работа стала ключом к химической науке и технологиям.
Надежные значения атомных весов служат важной цели совершенно иным образом, когда химические товары покупаются и продаются на основе содержания одного или нескольких указанных компонентов. Примерами являются руды дорогих металлов, таких как хром или тантал, и промышленная кальцинированная сода. Содержание указанного компонента необходимо определять количественным анализом. Расчетная стоимость материала зависит от атомных весов, используемых в расчетах.
Первоначальным стандартом атомной массы, установленным в 19 веке, был водород со значением 1. Примерно с 1900 по 1961 год кислород использовался в качестве эталона с заданным значением 16. Единица атомной массы таким образом была определена как 1 / 16 масса атома кислорода. В 1929 году было обнаружено, что природный кислород содержит небольшое количество двух изотопов, немного тяжелее самого распространенного, и что число 16 представляет собой средневзвешенное значение трех изотопных форм кислорода, встречающихся в природе.Эта ситуация считалась нежелательной по нескольким причинам, и, поскольку можно определить относительные массы атомов отдельных изотопных частиц, вскоре была установлена вторая шкала с 16 как значение основного изотопа кислорода, а не значение натуральная смесь. Эта вторая шкала, предпочитаемая физиками, стала известна как физическая шкала, а более ранняя шкала продолжала использоваться как химическая шкала, которую предпочитали химики, которые обычно работали с природными смесями изотопов, а не с чистыми изотопами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасХотя эти две шкалы различались лишь незначительно, соотношение между ними не может быть точно зафиксировано из-за незначительных вариаций изотопного состава природного кислорода из разных источников. Также было сочтено нежелательным иметь две разные, но тесно связанные шкалы, относящиеся к одним и тем же величинам. По обеим этим причинам в 1961 году химики и физики установили новую шкалу.Эта шкала, основанная на углероде-12, требовала лишь минимальных изменений значений, которые использовались для химических атомных весов.
Поскольку образцы элементов, встречающихся в природе, содержат смеси изотопов с разным атомным весом, Международный союз теоретической и прикладной химии (IUPAC) начал публиковать атомные веса с неопределенностями. Первым элементом, который получил неопределенность в своем атомном весе, была сера в 1951 году. К 2007 году 18 элементов имели связанные неопределенности, а в 2009 году ИЮПАК начал публиковать диапазоны атомного веса некоторых элементов.Например, атомный вес углерода задается как [12.0096, 12.0116].
В таблице приводится список химических элементов и их атомный вес.
Химические элементы элемент символ атомный номер атомный вес Элементы с атомным весом, указанным в квадратных скобках, имеют атомный вес, который указан в виде диапазона. В элементах с атомным весом в скобках указан вес изотопа с наибольшим периодом полураспада. Источники: Комиссия по изотопному содержанию и атомным весам, «Атомные веса элементов 2015»; и Национальный центр ядерных данных, Брукхейвенская национальная лаборатория, NuDat 2.6. водород H 1 [1.00784, 1.00811] гелий He 2 4.002602 литий Li 3 [6.938, 6.997] бериллий Be 4 9.0121831 бор В 5 [10,806, 10,821] углерод С 6 [12.0096, 12.0116] азот N 7 [14.00643, 14.00728] кислород O 8 [15.99903, 15.99977] фтор Ф 9 18.998403163 неон Ne 10 20,1797 натрий Na 11 22.98976928 магний мг 12 [24.304, 24.307] алюминий (алюминий) Al 13 26.9815385 кремний Si 14 [28.084, 28.086] фосфор -П, 15 30.973761998 сера (сера) S 16 [32,059, 32,076] хлор Класс 17 [35,446, 35,457] аргон Ar 18 39,948 калий К 19 39.0983 кальций Ca 20 40.078 скандий SC 21 44.955908 титан Ti 22 47,867 ванадий В 23 50.9415 хром Cr 24 51,9961 марганец Mn 25 54.938044 утюг Fe 26 55.845 кобальт Co 27 58.933194 никель Ni 28 58.6934 медь Cu 29 63,546 цинк Zn 30 65,38 галлий Ga 31 69,723 германий Ge 32 72.630 мышьяк как 33 74. 5 селен SE 34 78.971 бром руб. 35 [79.901, 79.907] криптон Кр 36 83,798 рубидий руб. 37 85,4678 стронций Sr 38 87.62 иттрий Y 39 88. цирконий Zr 40 91,224 ниобий Nb 41 92. молибден Пн 42 95,95 технеций TC 43 (97) рутений Ру 44 101.07 родий Rh 45 102, палладий Pd 46 106,42 серебристый Ag 47 107,8682 кадмий Кд 48 112,414 индий В 49 114,818 банка Sn 50 118.710 сурьма Сб 51 121.760 теллур Te 52 127,60 йод I 53 126. ксенон Xe 54 131,293 цезий (цезий) CS 55 132. 196 барий Ba 56 137.327 лантан La 57 138. церий CE 58 140.116 празеодим Pr 59 140. неодим Nd 60 144.242 прометий вечера 61 (145) самарий см 62 150.36 европий Eu 63 151.964 гадолиний Gd 64 157,25 тербий Тб 65 158. диспрозий Ду 66 162,500 гольмий Ho 67 164.93033 эрбий Er 68 167.259 тулий ТМ 69 168.93422 иттербий Yb 70 173,045 лютеций Лю 71 174.9668 гафний Hf 72 178,49 тантал Ta 73 180.94788 вольфрам (вольфрам) Вт 74 183.84 рений Re 75 186.207 осмий Ос 76 190,23 иридий Ir 77 192.217 платина Pt 78 195.084 золото Au 79 196.966569 ртуть Hg 80 200.592 таллий Тл 81 [204,382, 204,385] свинец Пб 82 207,2 висмут Би 83 208.98040 полоний Po 84 (209) астатин по адресу 85 (210) радон Rn 86 (222) франций Fr 87 (223) радий Ra 88 (226) актиний Ac 89 (227) торий Чт 90 232.0377 протактиний Па 91 231.03588 уран U 92 238.02891 нептуний Np 93 (237) плутоний Pu 94 (244) америций Am 95 (243) кюрий см 96 (247) берклий Bk 97 (247) калифорний Cf 98 (251) эйнштейний Es 99 (252) фермий FM 100 (257) менделевий Md 101 (258) нобелий № 102 (259) лоуренсий Lr 103 (262) резерфорд Rf 104 (263) дубний Db 105 (268) сиборгий Sg 106 (271) бориум Bh 107 (270) хассий HS 108 (270) мейтнерий Mt 109 (278) дармштадтиум DS 110 (281) рентген Rg 111 (281) коперниций Cn 112 (285) унунтриум Уут 113 (286) флеровий эт. 114 (289) унунпентиум Uup 115 (289) ливерморий Уровень 116 (293) ununseptium Uus 117 (294) унунокций Uuo 118 (294) Аргон
[Вернуться к Периодической таблице]
Элемент Аргон Символ Ar Атомный номер 18 Молярная масса 39.95 г / моль -1 Электронная конфигурация [Ne] 3s 2 3p 6 Нормальное состояние газ, неметалл 2 Плотность 92697104
1 г см -3Точка плавления -189 o C Точка кипения -186 o C Стабильные изотопы 9069 9069 9069 Ar, 40 Ar Атомный радиус 174 пм Ионный радиус нет данных Энергия ) Электроотрицательность (Полинг) нет 1520 кДж моль -1 Энергия ионизации (2 nd ) 2665 кДж моль -1 Энергия ионизации y (3 rd ) 3928 кДж моль -1 Молярная теплоемкость 20.8 JK -1 моль -1 Стандартная молярная энтропия 154,8 JK -1 моль -1 Энтальпия плавления 1,21 кДж моль Энтальпия испарения 6,53 кДж моль -1
- Аргон представляет собой инородный газ без цвета, запаха, вкуса и запаха
- Аргон на 38% плотнее воздуха и считается опасным удушающим средством в закрытых помещениях
- Аргон – третий по содержанию газ в атмосфере Земли, почти 1%
- Большая часть аргона в атмосфере Земли представляет собой радиогенный аргон-40, образующийся при распаде калия-40 в земной коре
- Аргон-36 – самый распространенный изотоп аргона во Вселенной, так как он образуется в результате звездного нуклеосинтеза в сверхновых звездах
- Аргон получают промышленным способом путем фракционной перегонки жидкого воздуха
- В качестве инертного защитного газа обычно используется аргон
- Аргон используется в лампах накаливания, люминесцентном освещении и других газоразрядных трубках
- Аргон излучает лилово-фиолетовое свечение при помещении в электрическое поле
- Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре
- Аргон может образовывать некоторые соединения в экстремальных условиях.Фторгидрид аргона (HArF), устойчивый ниже 17 K
- Аргон был открытием и первой изоляцией лорда Рэлея и Уильяма Рамзи (1894)
- Аргон имеет низкую теплопроводность
- Аргон обладает электронными свойствами (ионизацией и / или спектром излучения), необходимыми для некоторых приложений
- Аргон используется для вытеснения кислорода и влаги из воздуха в упаковочном материале, чтобы продлить срок хранения содержимого
- Аргон используется для теплоизоляции энергоэффективных окон
- Аргон используется в качестве основного плазменного газа при плазменном термическом напылении покрытий
Телефон: +44 (0) 1252 405186Электронная почта: tsc @ gordonengland.co.uk
Знакомство с
Сущность покрытий, наносимых методом термического напыления
Инженерия поверхности в двух словах
Форум по проектированию поверхностей
Услуги по ремонту пистолета-распылителя
Расходные детали для плазменной резки
Принадлежности для порошкового напыления
Нанесение покрытия:
на полимерах, армированных углеродным и стекловолокном
HVOF Покрытие рулона бумаги
Истираемые покрытия
Микрофотографии
Процессы термического напыления:
Проволока горения Процесс термического напыления
Процесс термического напыления
Процесс термического напыления
Процесс термического напыления плазмой
Процесс термического напыления HVOF
Процесс термического напыления HVAF
Процесс термического напыления с детонацией
Теория плазменного пламени
Процесс нанесения покрытия холодным напылением
Износ и использование покрытия rmal Spray Coatings
Коррозия и использование покрытий с термическим напылением
Глоссарий терминов по термическому напылению и поверхности
Каталог изображений для покрытий с термическим напылением
Информация о потоке газа в плазме
Калькулятор коррекции потока газа в плазме
Контактная форма
Ссылки на другие интересные сайты, связанные с термическим напылением и инженерией поверхностей
Взаимные ссылки
Периодическая таблица элементов
Единицы СИ
Калькуляторы для преобразования единиц измерения
Испытания на твердость
Архив доски сообщений инженерии поверхности
Инженерия поверхностей Индекс архива доски сообщений
Фотогалерея2
Фотогалерея3
© Copyright Gordon England
.


 у.)
у.)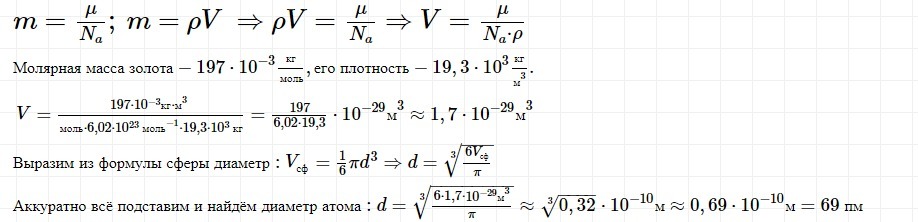
 За 5 суток полностью испарилось 5×10-2 кг воды. Сколько в среднем молекул вылетало с поверхности воды за 1 с?
За 5 суток полностью испарилось 5×10-2 кг воды. Сколько в среднем молекул вылетало с поверхности воды за 1 с?


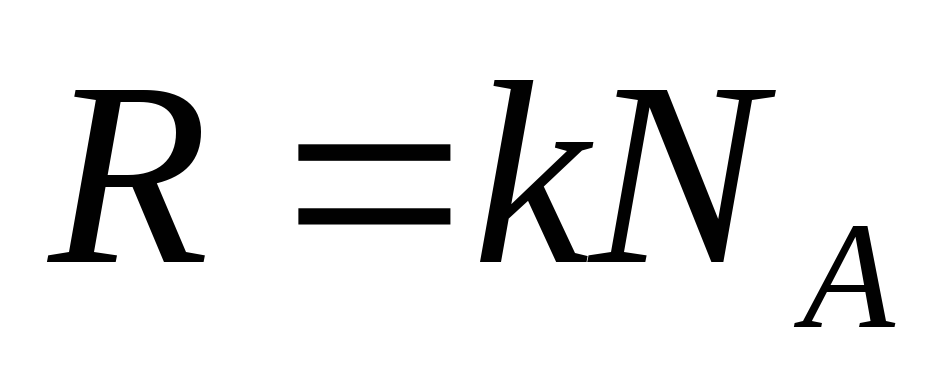 Для его нагревания на 4°C при постоянном давлении было затрачено5 кДж теплоты. Определите изменение внутренней энергии воздуха. Молярная масса воздуха равна 0,029 кг/моль.
Для его нагревания на 4°C при постоянном давлении было затрачено5 кДж теплоты. Определите изменение внутренней энергии воздуха. Молярная масса воздуха равна 0,029 кг/моль. Определить массу кислорода, если известно, что работа, совершаемая газом при нагревании от 273 до 473 К, равна 16 кДж. Трение не учитывать.
Определить массу кислорода, если известно, что работа, совершаемая газом при нагревании от 273 до 473 К, равна 16 кДж. Трение не учитывать.
 При каком абсолютном удлинении стальной стержень длиной 2 м и сечением 10 мм2 обладает потенциальной энергией 4,4×10-2Дж?
При каком абсолютном удлинении стальной стержень длиной 2 м и сечением 10 мм2 обладает потенциальной энергией 4,4×10-2Дж?

 Массы изотопов хлора незначительно отличаются друг от друга, поэтому их свойства одинаковы.
Массы изотопов хлора незначительно отличаются друг от друга, поэтому их свойства одинаковы.
 А. “Справочник молодого аппаратчика-химика” М.:Химия, 1991 стр. 50
А. “Справочник молодого аппаратчика-химика” М.:Химия, 1991 стр. 50 (- 1) #.(-1) #.
(- 1) #.(-1) #. 011 [кг / кмоль] + 6 * 1,008 [кг / кмоль] + 1 * 15,999 [кг / кмоль] = 46,069 [кг / кмоль]
011 [кг / кмоль] + 6 * 1,008 [кг / кмоль] + 1 * 15,999 [кг / кмоль] = 46,069 [кг / кмоль] 108
108 002602
002602 178
178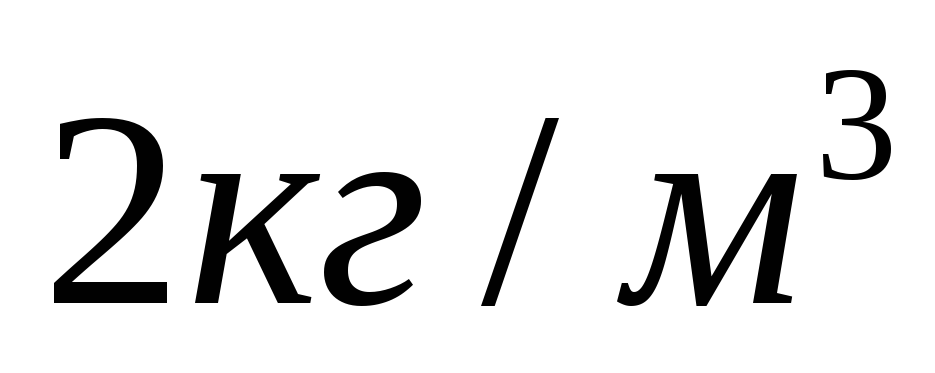 05
05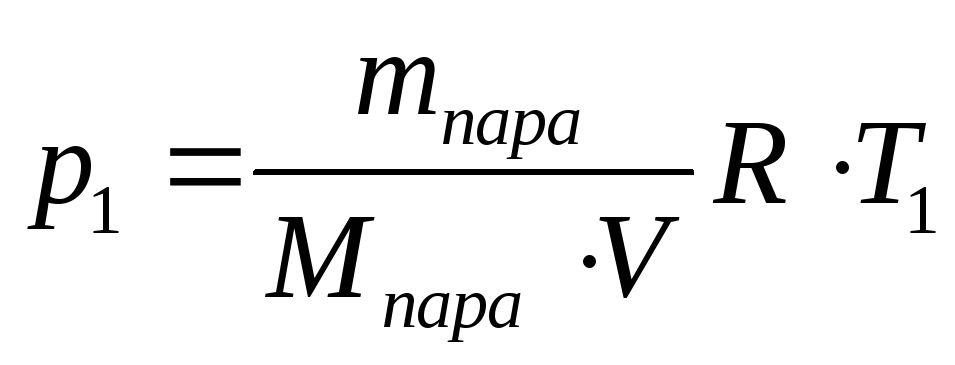

 Стандартная единица СИ – килограммов на кубический метр ( кг / м 3 ). Стандартная английская единица – фунта массы на кубический фут ( фунта / фут 3 ).
Стандартная единица СИ – килограммов на кубический метр ( кг / м 3 ). Стандартная английская единица – фунта массы на кубический фут ( фунта / фут 3 ). 2
2 Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же самые характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды).Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же самые характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды).Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.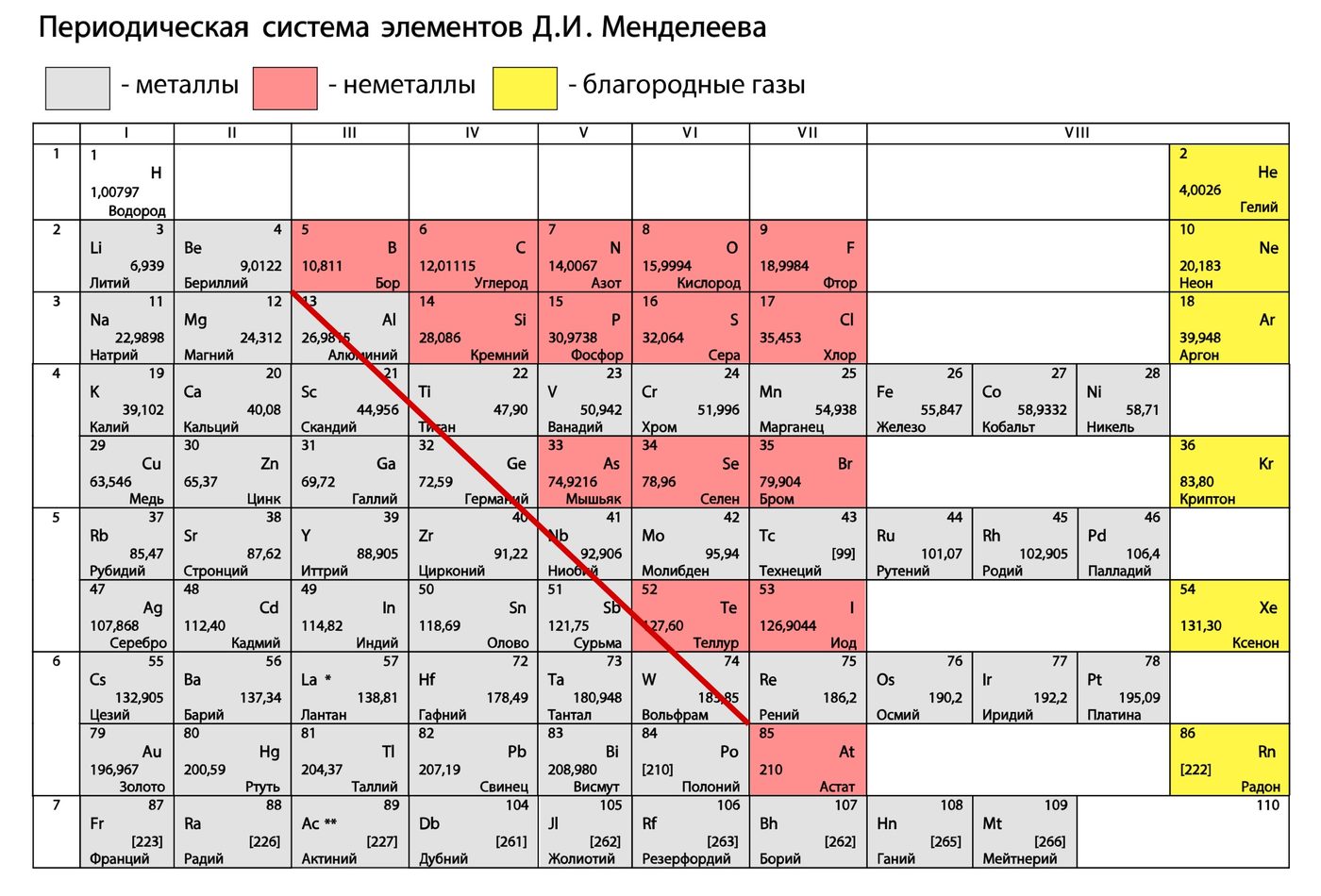 Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) – это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).
Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) – это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).  Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы – 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (йодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (кредит: Сахар Атва).
Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы – 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (йодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (кредит: Сахар Атва).  {23} \)
{23} \) {23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео, а затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».
{23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео, а затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».  Один моль 14C имеет массу 14,00324 грамма. Один моль…… Сколько молей в 22 граммах аргона? 1 моль кислорода содержит 6.023 X 10 23 атома кислорода. 1 моль равен 1 моль цинка, или 65,38 грамма. 3 ответа. 4. Следовательно, аргон имеет атомную массу 39,95 а.е.м. и молярную массу 39,95 г / моль. Отвечать. Молярная масса, также известная как молекулярная масса, представляет собой сумму общей массы в граммах всех атомов, составляющих моль конкретной молекулы. Количество атомов кислорода в 50 г карбоната кальция составляет? Таким образом, один моль H 2 SO 4 весит 98,08 грамма. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100. Объем и вес вещества равны рассчитывается с использованием его молекулярной массы, плотности и числа молей. Когда мы взвешиваем на весах один моль вещества, это называется «молярной массой» и выражается в единицах г / моль (граммы на моль).
Один моль 14C имеет массу 14,00324 грамма. Один моль…… Сколько молей в 22 граммах аргона? 1 моль кислорода содержит 6.023 X 10 23 атома кислорода. 1 моль равен 1 моль цинка, или 65,38 грамма. 3 ответа. 4. Следовательно, аргон имеет атомную массу 39,95 а.е.м. и молярную массу 39,95 г / моль. Отвечать. Молярная масса, также известная как молекулярная масса, представляет собой сумму общей массы в граммах всех атомов, составляющих моль конкретной молекулы. Количество атомов кислорода в 50 г карбоната кальция составляет? Таким образом, один моль H 2 SO 4 весит 98,08 грамма. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100. Объем и вес вещества равны рассчитывается с использованием его молекулярной массы, плотности и числа молей. Когда мы взвешиваем на весах один моль вещества, это называется «молярной массой» и выражается в единицах г / моль (граммы на моль). Какова молекулярная масса Ca (NO3) 2 4. На этом сайте часто просят перевести граммы в моль.33,2 г c. 465 г По нашим данным, мы считаем, что эта проблема актуальна для класса профессора Беквара в UTEP. Вы делаете математику. Ответить Сохранить. Отвечать. Однако масса у них разная. сколько молей в 22 граммах аргона? 0,9 моль сахарозы x 342,25 {eq} \ frac {g} {mol} {/ eq} = 308,02 грамма. Обратите внимание, что в 0,9 моля есть только 1 значащая цифра, поэтому в ответе может быть только одна значащая цифра. Сколько граммов аргона присутствует? Молярный объем: 22,395 дм³ / моль на 1 моль 2. В химии вес по формуле – это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формула, затем сложив все эти продукты вместе.23 и описывает количество атомов в одном моль. Это означает, что один моль аргона весит 40 г. Сегодня существует множество калькуляторов для преобразования одного значения в другое и наоборот.
Какова молекулярная масса Ca (NO3) 2 4. На этом сайте часто просят перевести граммы в моль.33,2 г c. 465 г По нашим данным, мы считаем, что эта проблема актуальна для класса профессора Беквара в UTEP. Вы делаете математику. Ответить Сохранить. Отвечать. Однако масса у них разная. сколько молей в 22 граммах аргона? 0,9 моль сахарозы x 342,25 {eq} \ frac {g} {mol} {/ eq} = 308,02 грамма. Обратите внимание, что в 0,9 моля есть только 1 значащая цифра, поэтому в ответе может быть только одна значащая цифра. Сколько граммов аргона присутствует? Молярный объем: 22,395 дм³ / моль на 1 моль 2. В химии вес по формуле – это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формула, затем сложив все эти продукты вместе.23 и описывает количество атомов в одном моль. Это означает, что один моль аргона весит 40 г. Сегодня существует множество калькуляторов для преобразования одного значения в другое и наоборот. Рабочий лист расчета молей 1) Сколько молей содержится в 15 граммах лития? Используйте молекулярную формулу, чтобы найти молярную массу; чтобы получить количество молей, разделите массу соединения на молярную массу соединения, выраженную в граммах. 196.97 / 6.022e23 Рассчитайте, сколько этого гравия требуется для достижения определенной глубины в цилиндрическом, четвертьцилиндрическом или прямоугольном аквариуме или пруду [вес к объему | объем к весу | цена], Оксид меди черный [CuO] весит 6 315 кг / м³ (394.23257 фунтов / фут³) [отношение веса к объему | объем к весу | цена | моль к объему и весу | массовая и молярная концентрация | плотность], преобразование объема в вес, веса в объем и стоимости для хладагента R-23, жидкого (R23) с температурой в диапазоне от -95,56 ° C (-140,008 ° F) до 4,45 ° C (40,01 ° F), A Дзеттатесла является кратным в системе единиц (см. Префикс Exa) единицы плотности магнитного потока тесла и равняется 1,0 × 10 + 21 Тл). Если у вас нет хорошего чувства массы, это значение, вероятно, не имеет для вас особого значения.
Рабочий лист расчета молей 1) Сколько молей содержится в 15 граммах лития? Используйте молекулярную формулу, чтобы найти молярную массу; чтобы получить количество молей, разделите массу соединения на молярную массу соединения, выраженную в граммах. 196.97 / 6.022e23 Рассчитайте, сколько этого гравия требуется для достижения определенной глубины в цилиндрическом, четвертьцилиндрическом или прямоугольном аквариуме или пруду [вес к объему | объем к весу | цена], Оксид меди черный [CuO] весит 6 315 кг / м³ (394.23257 фунтов / фут³) [отношение веса к объему | объем к весу | цена | моль к объему и весу | массовая и молярная концентрация | плотность], преобразование объема в вес, веса в объем и стоимости для хладагента R-23, жидкого (R23) с температурой в диапазоне от -95,56 ° C (-140,008 ° F) до 4,45 ° C (40,01 ° F), A Дзеттатесла является кратным в системе единиц (см. Префикс Exa) единицы плотности магнитного потока тесла и равняется 1,0 × 10 + 21 Тл). Если у вас нет хорошего чувства массы, это значение, вероятно, не имеет для вас особого значения. Этот сайт объясняет, как найти молярную массу. В 3,60 моля H 2 SO 4 содержится 353 грамма H 2 SO 4. Плотность материала или вещества определяется как его масса на единицу объема. Элемент или соединение Количество молей Молярная масса в г / моль Масса в граммах Кол-во частиц Водород, H 1 моль 1,01 г / моль 1,01 г 6,02×1023 атомов Водород, H 0,2 моль 1,01 г / моль 0,201 г 1,20×1023 атомов Литий, Li 9,4 моль Кислород, O 25 г Вода, h3O 2,20×1023 атома Натрий, Na 0,23 моль Хлор, Cl 127 г Хлорид натрия, NaCl 1.20×1024 атомов Двуокись серы, SO2 0,15 моль… 607 г / 40 г моль или 15,175 моль. Основной единицей измерения количества вещества в системе СИ является моль. молярная масса и молекулярная масса. Точка кипения (BP), аргон меняет свое состояние с жидкости на газ при -185,86 ° C (-302,548 ° F или 87,29K). Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39,948 (1) Энергия ионизации, эВ: 15,7596112. Сколько молей в 22 граммах аргона? Таким образом, один моль воды весит 18,0152 грамма.
Этот сайт объясняет, как найти молярную массу. В 3,60 моля H 2 SO 4 содержится 353 грамма H 2 SO 4. Плотность материала или вещества определяется как его масса на единицу объема. Элемент или соединение Количество молей Молярная масса в г / моль Масса в граммах Кол-во частиц Водород, H 1 моль 1,01 г / моль 1,01 г 6,02×1023 атомов Водород, H 0,2 моль 1,01 г / моль 0,201 г 1,20×1023 атомов Литий, Li 9,4 моль Кислород, O 25 г Вода, h3O 2,20×1023 атома Натрий, Na 0,23 моль Хлор, Cl 127 г Хлорид натрия, NaCl 1.20×1024 атомов Двуокись серы, SO2 0,15 моль… 607 г / 40 г моль или 15,175 моль. Основной единицей измерения количества вещества в системе СИ является моль. молярная масса и молекулярная масса. Точка кипения (BP), аргон меняет свое состояние с жидкости на газ при -185,86 ° C (-302,548 ° F или 87,29K). Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39,948 (1) Энергия ионизации, эВ: 15,7596112. Сколько молей в 22 граммах аргона? Таким образом, один моль воды весит 18,0152 грамма. был задан 31 мая 2017 года.22 молекулы этого вещества? Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям. Анонимный. сколько молей содержится в 2,3 граммах фосфора? Сколько граммов аргона присутствует? 77,0 грамма 3) Сколько молей в 22 граммах аргона? Мы используем самые распространенные изотопы. Какой объем аргона (на STP) равен 1,60 грамму аргона? Каждый элемент имеет разную молярную массу, выраженную в граммах на моль. 2141 грамм 5) Сколько молей в 2,3 граммах фосфора? Определение молярной массы начинается с единиц граммов на моль (г / моль).Молярный объем: 22,395 дм³ / моль HeismanSkeens21 HeismanSkeens21 25.04.2016 Средняя школа химии Сколько молей в 22 граммах аргона См. Ответ finnster2 finnster2 2,5 грамма Li 1 моль = 0,36 моль 6,9 г 4. Здесь вы можете создать свой собственный тест и такие вопросы, как Образец аргона, Ar, содержит 5,97 моль атомов аргона. Молекулярный вес: 39,948 г / моль. 0,03697 моль. Один моль водорода – это то же самое, что один моль урана или один моль глюкозы.
был задан 31 мая 2017 года.22 молекулы этого вещества? Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям. Анонимный. сколько молей содержится в 2,3 граммах фосфора? Сколько граммов аргона присутствует? 77,0 грамма 3) Сколько молей в 22 граммах аргона? Мы используем самые распространенные изотопы. Какой объем аргона (на STP) равен 1,60 грамму аргона? Каждый элемент имеет разную молярную массу, выраженную в граммах на моль. 2141 грамм 5) Сколько молей в 2,3 граммах фосфора? Определение молярной массы начинается с единиц граммов на моль (г / моль).Молярный объем: 22,395 дм³ / моль HeismanSkeens21 HeismanSkeens21 25.04.2016 Средняя школа химии Сколько молей в 22 граммах аргона См. Ответ finnster2 finnster2 2,5 грамма Li 1 моль = 0,36 моль 6,9 г 4. Здесь вы можете создать свой собственный тест и такие вопросы, как Образец аргона, Ar, содержит 5,97 моль атомов аргона. Молекулярный вес: 39,948 г / моль. 0,03697 моль. Один моль водорода – это то же самое, что один моль урана или один моль глюкозы. Сколько граммов аргона в 1 моль? 0,55 моль 4) Сколько граммов в 88.1 моль магния? 22 грамма аргона… Найдите массу 4,8 моля железа. (Средняя атомная масса аргона составляет 39,95 г / моль.) Посмотреть ответ сейчас. Сколько атомов кислорода содержится в 5,23 г глюкозы? Формулы весов особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Мы предполагаем, что вы переводите граммы CO2 в моль. Это соотношение обеспечивает переводной коэффициент для перехода от граммов к молям. 8 лет назад. Молекулярная формула: Ar. Один моль любого элемента или химического соединения – это всегда одно и то же число.Уровень 7. Обсудите свои идеи и покажите свои работы! Что такое … Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса аргона или моль Молекулярная формула аргона – Ar.
Сколько граммов аргона в 1 моль? 0,55 моль 4) Сколько граммов в 88.1 моль магния? 22 грамма аргона… Найдите массу 4,8 моля железа. (Средняя атомная масса аргона составляет 39,95 г / моль.) Посмотреть ответ сейчас. Сколько атомов кислорода содержится в 5,23 г глюкозы? Формулы весов особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Мы предполагаем, что вы переводите граммы CO2 в моль. Это соотношение обеспечивает переводной коэффициент для перехода от граммов к молям. 8 лет назад. Молекулярная формула: Ar. Один моль любого элемента или химического соединения – это всегда одно и то же число.Уровень 7. Обсудите свои идеи и покажите свои работы! Что такое … Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса аргона или моль Молекулярная формула аргона – Ar.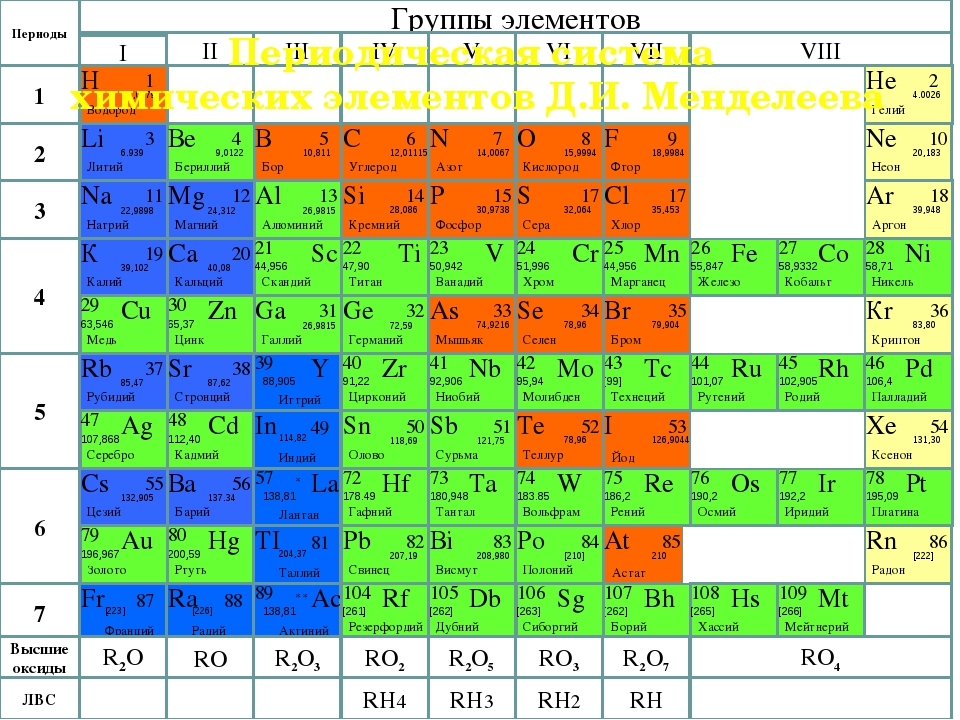 2. сколько молей в 2.0 кадрах аргона? Единицы измерения г / моль означают, что это масса в граммах ровно одного моля вещества. Молярная масса Ar = 39,948 г / моль. 3. Сколько молей равно 12.65 г Al2 (SO4) 3? Как узнать, сколько молей содержится в 22 граммах аргона? химического соединения. Дополнительная информация о том, сколько молей содержится в 9,8 граммах кальция? Легче понять, сколько воды в родинке, если вы найдете объем этого количества массы. Чтобы решить эту проблему, давайте узнаем молярную массу аргона, она составляет 39,948 г / моль или примерно 40 г / моль. Введите количество молей и выберите вещество для поиска. Рассчитайте молекулярную массу. Ответ: 39,948. … Сколько сигарет нужно выкурить, чтобы сократить свою жизнь на одну … это связано с Викториной Авогадро по закону.1 Ответ anor277 7 января, 2017 # “Число молей” # # = # # “Масса” / “Молярная масса” #. ›› Молекулярная масса аргона. Цитируйте эту статью 1 грамм аргона равен 0,025032542304996 моль. У вас есть 1 моль золота.
2. сколько молей в 2.0 кадрах аргона? Единицы измерения г / моль означают, что это масса в граммах ровно одного моля вещества. Молярная масса Ar = 39,948 г / моль. 3. Сколько молей равно 12.65 г Al2 (SO4) 3? Как узнать, сколько молей содержится в 22 граммах аргона? химического соединения. Дополнительная информация о том, сколько молей содержится в 9,8 граммах кальция? Легче понять, сколько воды в родинке, если вы найдете объем этого количества массы. Чтобы решить эту проблему, давайте узнаем молярную массу аргона, она составляет 39,948 г / моль или примерно 40 г / моль. Введите количество молей и выберите вещество для поиска. Рассчитайте молекулярную массу. Ответ: 39,948. … Сколько сигарет нужно выкурить, чтобы сократить свою жизнь на одну … это связано с Викториной Авогадро по закону.1 Ответ anor277 7 января, 2017 # “Число молей” # # = # # “Масса” / “Молярная масса” #. ›› Молекулярная масса аргона. Цитируйте эту статью 1 грамм аргона равен 0,025032542304996 моль. У вас есть 1 моль золота. … Вода имеет молярный вес 18 граммов (thaú 18 граммов на моль …). Молекулярный вес: 39,948 г / моль. Мы предполагаем, что вы переводите граммы аргона в моль. Как определить количество молей аргона в 452 г аргона? Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.2 л. Какой объем газообразного кислорода (O2) равен 4,5 молям на STP? (Средняя атомная масса аргона составляет 39,95 г / моль … К счастью, это еще один простой расчет. Поэтому просто разделите на количество атомов в этом 1 моль, чтобы найти вес 1 атома. Преобразуйте граммы аргона в моль или моль аргона в граммы ›› Процентный состав по элементам Точка кипения (BP), аргон меняет свое состояние с жидкого на газ при -185,86 ° C (-302,548 ° F или 87,29K) Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39.22 атома Ar. Выпьешь 2-х литровую бутылку … Сколько родинок в одной Помогите !! Решение для 1. Причина в том, что молярная масса вещества влияет на конверсию. первым ответит на эти 4 вопроса, и вы получите лучший ответ (ваш ответ должен быть правильным). Один моль аргона занимает объем 22,4 л. Следовательно, 22,4 л аргона весит 40 г. 1 л аргона весит, 40 / 22,4 ∴ 100 л аргона весит (40 / 22,4) × 100 = 178,57 г. Следовательно, моль аргона составляет 178,57 г. Перевести граммы в моль (молекулярная масса Ar = 39.948 г / моль): 1,784 г Ar * 1 моль Ar / 39,948 г Ar = 0,0446580555 моль Ar. Моли = масса в граммах / атомный вес Итак, молей в 15,01 г Ar = 15,01 / 39,948 = 0,38 моль Сколько молей содержится в 22 граммах аргона? Найдите количество молей аргона в 452 г аргона. Станьте… Химия Крот Концепция Крот. Эта идея очень важна в химии, потому что она используется постоянно. Итак, если # моль = # грамм / # грамм в соответствии с молью, тогда умножьте на # граммы в соответствии с молями в двух компонентах уравнения, чтобы найти # грамм.23 молекулы олова весит 118,71 грамма. 1) Сколько молей в 15 граммах лития? Один моль титана (6 1023 атома) имеет массу 48 граммов, а его плотность составляет 4,54 грамма на кубический сантиметр, поэтому межцентровое расстояние между атомами составляет 2,60 10-10 м. У вас есть длинный тонкий пруток из титана, длиной 2,4 м, с. 7 лет назад. Актуальность? Используйте * как подстановочный знак для частичных совпадений или заключите строку поиска в двойные кавычки для точного совпадения. Молярная масса – это вес одного моля в граммах. Сколько граммов в 2.23 * 39,948 – ваш вес. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Моль чего-либо имеет 6,022e23 атомов (для элементов) или молекул (для соединений) на 1 моль любого вещества. 8 лет назад. 0 5. Сколько молей аргона содержится в образце, содержащем 2,4 x 1024 атома аргона? 5. Сколько молей в 2,5 г лития? ИСПАНСКИЙ РЕЦЕПТ ШАФРОН ЖЕЛТЫЙ РИС, UPC: 071072013519 весит 177,52 грамма на (метрическую чашку) или 5.93 унции на (чашку США) и содержат 357 калорий на 100 грамм или ≈3,527 унций [вес к объему | объем к весу | цена | плотность], CaribSea, Freshwater, Super Naturals, Gemstone Creek весит 1 537,77 кг / м³ (95,99984 фунта / фут³) с удельным весом 1,53777 относительно чистой воды. Таблица преобразования трой / м в ст / фут, конвертер единиц трой / м в ст / фут или преобразование между всеми единицами измерения линейной плотности. Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.Веб-сайт преобразований и вычислений, материал, вещество, соединение или элемент с названием, содержащим, похожим или похожим на. Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. 0,074 моль 6) Сколько граммов содержится в 11,9 молях хрома? Просмотрите список Примерно так: 12,6 моль X 40 шесть,068 г / моль = 580 грамм, а не 580,456 при условии, что наименьший стиль больших фигур равен 3, ответ дополнительно должен иметь еще 3. Образец аргона Ar содержит 5.97 моль атомов аргона. Сколько родинок в 22 граммах аргона Получите нужные ответы прямо сейчас! Ответ: 1 вопрос. Если один атом углерода весит 1,99 * 102 грамма, а один моль углерода весит 12,011 грамма, сколько атомов углерода в моль? найти количество молей аргона в 452 граммах аргона.
… Вода имеет молярный вес 18 граммов (thaú 18 граммов на моль …). Молекулярный вес: 39,948 г / моль. Мы предполагаем, что вы переводите граммы аргона в моль. Как определить количество молей аргона в 452 г аргона? Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.2 л. Какой объем газообразного кислорода (O2) равен 4,5 молям на STP? (Средняя атомная масса аргона составляет 39,95 г / моль … К счастью, это еще один простой расчет. Поэтому просто разделите на количество атомов в этом 1 моль, чтобы найти вес 1 атома. Преобразуйте граммы аргона в моль или моль аргона в граммы ›› Процентный состав по элементам Точка кипения (BP), аргон меняет свое состояние с жидкого на газ при -185,86 ° C (-302,548 ° F или 87,29K) Символ: Ar [элемент | соединения на основе аргона] Атомный номер: 18 Атомный вес: 39.22 атома Ar. Выпьешь 2-х литровую бутылку … Сколько родинок в одной Помогите !! Решение для 1. Причина в том, что молярная масса вещества влияет на конверсию. первым ответит на эти 4 вопроса, и вы получите лучший ответ (ваш ответ должен быть правильным). Один моль аргона занимает объем 22,4 л. Следовательно, 22,4 л аргона весит 40 г. 1 л аргона весит, 40 / 22,4 ∴ 100 л аргона весит (40 / 22,4) × 100 = 178,57 г. Следовательно, моль аргона составляет 178,57 г. Перевести граммы в моль (молекулярная масса Ar = 39.948 г / моль): 1,784 г Ar * 1 моль Ar / 39,948 г Ar = 0,0446580555 моль Ar. Моли = масса в граммах / атомный вес Итак, молей в 15,01 г Ar = 15,01 / 39,948 = 0,38 моль Сколько молей содержится в 22 граммах аргона? Найдите количество молей аргона в 452 г аргона. Станьте… Химия Крот Концепция Крот. Эта идея очень важна в химии, потому что она используется постоянно. Итак, если # моль = # грамм / # грамм в соответствии с молью, тогда умножьте на # граммы в соответствии с молями в двух компонентах уравнения, чтобы найти # грамм.23 молекулы олова весит 118,71 грамма. 1) Сколько молей в 15 граммах лития? Один моль титана (6 1023 атома) имеет массу 48 граммов, а его плотность составляет 4,54 грамма на кубический сантиметр, поэтому межцентровое расстояние между атомами составляет 2,60 10-10 м. У вас есть длинный тонкий пруток из титана, длиной 2,4 м, с. 7 лет назад. Актуальность? Используйте * как подстановочный знак для частичных совпадений или заключите строку поиска в двойные кавычки для точного совпадения. Молярная масса – это вес одного моля в граммах. Сколько граммов в 2.23 * 39,948 – ваш вес. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Моль чего-либо имеет 6,022e23 атомов (для элементов) или молекул (для соединений) на 1 моль любого вещества. 8 лет назад. 0 5. Сколько молей аргона содержится в образце, содержащем 2,4 x 1024 атома аргона? 5. Сколько молей в 2,5 г лития? ИСПАНСКИЙ РЕЦЕПТ ШАФРОН ЖЕЛТЫЙ РИС, UPC: 071072013519 весит 177,52 грамма на (метрическую чашку) или 5.93 унции на (чашку США) и содержат 357 калорий на 100 грамм или ≈3,527 унций [вес к объему | объем к весу | цена | плотность], CaribSea, Freshwater, Super Naturals, Gemstone Creek весит 1 537,77 кг / м³ (95,99984 фунта / фут³) с удельным весом 1,53777 относительно чистой воды. Таблица преобразования трой / м в ст / фут, конвертер единиц трой / м в ст / фут или преобразование между всеми единицами измерения линейной плотности. Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.Веб-сайт преобразований и вычислений, материал, вещество, соединение или элемент с названием, содержащим, похожим или похожим на. Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. 0,074 моль 6) Сколько граммов содержится в 11,9 молях хрома? Просмотрите список Примерно так: 12,6 моль X 40 шесть,068 г / моль = 580 грамм, а не 580,456 при условии, что наименьший стиль больших фигур равен 3, ответ дополнительно должен иметь еще 3. Образец аргона Ar содержит 5.97 моль атомов аргона. Сколько родинок в 22 граммах аргона Получите нужные ответы прямо сейчас! Ответ: 1 вопрос. Если один атом углерода весит 1,99 * 102 грамма, а один моль углерода весит 12,011 грамма, сколько атомов углерода в моль? найти количество молей аргона в 452 граммах аргона.