Перечислите способы защиты металлов от коррозии: Защита от коррозии. Способы защиты металлов.
alexxlab | 16.05.1984 | 0 | Разное
Способы защиты металлов от коррозии: какой способ лучше.
Коррозия ежегодно приносит людям огромные убытки. Поэтому, как только человек начал использовать металлы, он сразу же приступил к поиску эффективных способов защиты от коррозии.
По своей сути все способы защиты от коррозии, применяемые сегодня, можно разделить на 3 вида:
- Конструктивные;
- Пассивные;
- Активные.
Конструктивные способы – это защита коррозируемых металлов различными заслонами, защитными панелями, резиновыми прокладками, битумом или любыми другими не тонкослойными покрытиями.
Пассивные способы (барьерные) – это грунты, краски, лаки и эмали, покрытия создающие барьер, направленный на изоляцию поверхности металла от взаимодействия с окружающей средой.
Активные способы – заключаются в повышении электродного потенциала металла или использовании другого металла, более активного, который будет жертвовать свои электроды, разрушаться сам, тем самым защищая от ржавчины металлическое изделие.
Плюсы и минусы способов защиты от коррозии
У конструктивных способов защиты от коррозии очень мало плюсов. Они сложны в применении, дорого обходятся, занимают много места, а иногда их просто невозможно использовать. Например, в качестве защиты от коррозии оборудования, кованых изделий, заборов, объектов городской инфраструктуры. Поэтому конструктивные методы сегодня применяются очень редко и только там, где они скрыты – для внутренних металлических конструкций зданий.
Пассивные способы защиты от коррозии обладают множеством плюсов, но и не лишены минусов.
Плюсы:
- Удобство нанесения
- Низкая цена
- Разнообразие цветов и видов
- Создание барьера между поверхностью металла и окружающей средой
Минусы:
- Недолговечность – 1-3 года при благоприятных условиях
- Слабая стойкость к механическим повреждениям
- Даже при небольшой царапине барьер нарушается, проявления окружающей среды проникают к поверхности металла и начинается процесс коррозии
Самый распространенный активный способ защиты от коррозии – цинкование. Так как защита с помощью цинка эффективнее и долговечнее всего защищает металлы от коррозии. Цинк коррозирует в 3 раза медленнее, чем большинство металлов, к тому же стоит намного дешевле, чем, к примеру, платина, которая так же почти не подвержена коррозии. Именно поэтому цинк – идеальный вариант в качестве защитного металла, жертвующего собой ради защиты от коррозии других металлов.
Так как защита с помощью цинка эффективнее и долговечнее всего защищает металлы от коррозии. Цинк коррозирует в 3 раза медленнее, чем большинство металлов, к тому же стоит намного дешевле, чем, к примеру, платина, которая так же почти не подвержена коррозии. Именно поэтому цинк – идеальный вариант в качестве защитного металла, жертвующего собой ради защиты от коррозии других металлов.
Плюсы:
- Долговечность – защищает до 25-50 лет
- Высокая стойкость к механическим повреждениям, агрессивной среде, воде и прочим воздействиям
- Даже при нарушении целостности слоя продолжает защищать от коррозии
- Позволяет добавлять слои и увеличивать срок защиты в процессе эксплуатации
Минусы:
- Требуется тщательная подготовка поверхности и четкое соблюдение технологического процесса
Важно! Однако для того, чтобы цинк работал как следует и защищал металлы от коррозии на срок более 25 лет, недостаточно просто добавить его в краску. Необходимо соблюдение нескольких условий: Необходимо соблюдение нескольких условий:
|
Если все вышеуказанные условия соблюдаются, то цинковое покрытие защищает сразу двумя способами: пассивным и активным. То есть, одновременно создает прочный барьер между поверхностью металла и окружающей средой, а если барьер поврежден, то жертвует коррозии свои электроны до тех пор, пока покрытие полностью не истощится.
Только в этом случае полученный состав является цинкованием и может наноситься в качестве защитного покрытия на другие металлы различными способами. Способов нанесения цинкования несколько: горячее цинкование, холодное, гальваническое, газо-термическое, термодиффузионное. Подробнее о различных видах цинкования, их плюсах и минусах вы можете прочитать в статье: Виды цинкования металлов.
Подробнее о различных видах цинкования, их плюсах и минусах вы можете прочитать в статье: Виды цинкования металлов.
Сравнение самых популярных способов защиты от коррозии
| Характеристики | Холодное цинкование (Барьер-цинк) |
Горячее цинкование | Краска |
| Активная катодная защита | + | + | – |
| Легкое применение на месте | + | – | + |
| Многократное нанесение | + | + | – |
| Возможно финишное покрытие | + | ± | + |
| Нанесение в экстремальных условиях (высокая влажность и низкая температура) | + | – | – |
| Неограниченный срок хранения | + | – | – |
| Контакт с питьевой водой | + | + | – |
| Температурная и механическая устойчивость | + | + | – |
| Сварка по покрытию | + | ± | – |
| Восстановление покрытия | + | – | – |
| Нанесение при отрицательных температурах (-35) | + | – | – |
Если сравнить самые популярные сегодня способы защиты от коррозии, то очевидно, что холодное цинкование имеет больше преимуществ. Обработка методом холодного цинкования позволит вам сэкономить, увеличить стоимость ваших конструкций, а значит и ваши доходы, сделать изделия привлекательнее для ваших покупателей. Холодное цинкование позволит вам гордиться произведенной продукцией и не волноваться за ее качество, ведь после нанесения можно просто забыть о коррозии на срок до 25 и более лет.
Обработка методом холодного цинкования позволит вам сэкономить, увеличить стоимость ваших конструкций, а значит и ваши доходы, сделать изделия привлекательнее для ваших покупателей. Холодное цинкование позволит вам гордиться произведенной продукцией и не волноваться за ее качество, ведь после нанесения можно просто забыть о коррозии на срок до 25 и более лет.
На нашем сайте вы можете найти цинкосодержащие грунты для холодного цинкования, способные защитить металл в различных условиях эксплуатации. Среди них, Барьер-Грунт – цинкосодержащая краска-грунтовка для металла (96% цинка) гарантирующая антикоррозийную защиту на срок от 10 до 50 лет.
Есть вопросы по выбору состава? Обращайтесь в представительство в вашем городе:
в Санкт-Петербурге: +7 (812) 603-41-53, +7 (921) 927-58-47
в других городах: 8 (800) 707-53-17
e-mail: [email protected]
способы защитить металл от ржавчины в быту, выбор покрытия
Содержание
- 1 Разновидности коррозии
- 2 Защита от коррозии в промышленности и быту
- 3 Краски для покрытия металлических изделий
- 4 Этапы работ по борьбе с коррозией в быту
Интенсивное развитие производства стали, как правило, предполагает поиск новых средств и способов, которые позволяли бы предотвращать разрушение изделий из металла. Создание инновационных методик, связанных с защитой от коррозии, — это постоянный процесс. Изделия, сделанные практически из любого металла, могут терять свою работоспособность из-за воздействия химических и физических факторов извне. Последствия этого можно увидеть в виде ржавчины.
Создание инновационных методик, связанных с защитой от коррозии, — это постоянный процесс. Изделия, сделанные практически из любого металла, могут терять свою работоспособность из-за воздействия химических и физических факторов извне. Последствия этого можно увидеть в виде ржавчины.
Разновидности коррозии
Перед тем как защитить металл от ржавчины, следует узнать о существующих видах. Способ обеспечения антикоррозийной защиты находится в прямой зависимости от условий применения деталей. Потому принято выделять следующие типы:
- коррозия, которая связана с явлениями атмосферного характера;
- разрушение структуры металла в воде из-за наличия в ней солей и бактерий;
- деструктивные процессы, происходящие в грунте (почвенная коррозия).
Способы антикоррозионной защиты при этом должны подбираться в индивидуальном порядке, руководствуясь тем, в каких условиях будет эксплуатироваться изделие из металла.
Что касается типов поражения конструкций, то они могут быть следующими:
- ржавчина находится на всей поверхности изделия отдельными участками или сплошным покрытием;
- имеет вид пятен и проникает вглубь элемента;
- разрушает молекулы металла, приводя к трещинам;
- масштабное ржавление, при котором разрушается не только поверхность, но и более глубокие слои.
Типы разрушения бывают и комбинированными. В некоторых ситуациях их очень сложно определить на глаз, особенно при точечном ржавлении.
Принято выделять химическую коррозию. При контакте с нефтяными продуктами, спиртами и иными агрессивными веществам происходит особая реакция, которая сопровождается высокой температурой и выделениями газа.
При электрохимической коррозии поверхность металлического сплава соприкасается с водой (электролитом). При этом осуществляется диффузия материала. Электролит обуславливает появление электротока, а электроны металла замещаются и приходят в движение, в результате чего возникает ржавчина.
Электролит обуславливает появление электротока, а электроны металла замещаются и приходят в движение, в результате чего возникает ржавчина.
Обеспечение защиты от коррозии и выплавка стальных изделий — две взаимосвязанные вещи. Коррозия причиняет существенный ущерб постройкам хозяйственного или промышленного назначения. Кроме того, этот процесс может привести к катастрофе, если говорить, например, об опорах электропередач, мостах, заграждениях и т. д.
Защита от коррозии в промышленности и быту
Необходимо обеспечить металлу надежную защиту от коррозии. Все условия, когда требуется защита металлов от коррозии, кратко можно поделить на промышленные и бытовые.
В промышленности существует несколько вариантов антикоррозийной защиты:
- Пассивация. В процессе производства в сталь добавляются другие металлические сплавы (молибден, никель, ниобий). Эти материалы характеризуются отличными эксплуатационными свойствами и высокой стойкостью к агрессивным воздействиям.
 Эти разновидности стали принято называть легированными.
Эти разновидности стали принято называть легированными. - Нанесение на поверхность стали каких-то других металлов. При этом на изделии образуется защитное покрытие. Зачастую для данной цели применяется алюминий, кобальт и хром.
- Применение специальных протекторов и анодов. При контакте детали с водой происходит разрушение протектора, который образует защитное покрытие. Такая методика часто используется в производстве деталей для морских буровых установок и судов.
Промышленные способы обеспечения антикоррозийной защиты очень разнообразны. К ним относится и покрытие специальной стекловолоконной эмалью, и химическая защита, и многие другие.
Антикоррозийная защита материала в домашних условиях подразумевает применение ЛКМ-покрытий и химических средств. Свойства защитного плана обеспечивают сочетанием разных элементов: смол на основе силикона, ингибиторов, полимеров, металлической стружки и пудры.
Следует отметить, что перед окрашиванием детали, ее нужно обработать специальным преобразователем коррозии или грунтовкой, иначе ее эксплуатационные свойства будут быстро уменьшаться.
Сегодня в продаже встречается несколько разновидностей преобразователей ржавчины:
- Средства-грунтовки. Характеризуются высокой адгезией с металлическими поверхностями, способствуют выравниванию покрытия перед покраской. Во многих грунтовках содержатся ингибиторы, тормозящие коррозийные процессы. Кроме того, заблаговременное нанесение слоя грунтовки позволяет сэкономить на окрашивании.
- Химические препараты. Преобразуют окись железа в более безопасные вещества, которым не страшна коррозия. Такие средства называются стабилизаторами.
- Составы, преобразующие ржавчину в обычные соли.
- Масла и смолы, уплотняющие и связывающие ржавчину, обеспечивая ее нейтрализацию.

Специалисты советуют подбирать краску и грунтовку какого-то одного производителя, чтобы их химический состав не имел особых отличий.
Краски для покрытия металлических изделий
Краски, предназначенные для обработки металлических поверхностей, бывают обычными и термостойкими. В большинстве случаев применяются три типа составов: эпоксидные, акриловые и алкидные. Есть и специальные краски антикоррозийного типа, которые обладают следующими достоинствами:
- эффективно защищают покрытие от атмосферных воздействий и перепадов температур;
- с легкостью наносятся валиком, кисточкой или распылителем;
- многие из них являются быстросохнущими;
- обладают широким выбором расцветок;
- отличаются долговечностью.
Что касается самых недорогих и доступных средств, то тут следует обратить внимание на обыкновенную серебрянку. В составе этого покрытия есть алюминиевая пудра, образующая защитную пленку на обработанном им изделии.
В составе этого покрытия есть алюминиевая пудра, образующая защитную пленку на обработанном им изделии.
Этапы работ по борьбе с коррозией в быту
Методы борьбы с коррозией металлов предполагают определенную последовательность. Следует перечислить основные этапы этой работы:
- Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.
- После этого можно приступать к нанесению слоя грунтовки, которая затем должна впитаться и как следует просохнуть.
- Далее на поверхность наносится пара слоев. Перед тем как наносить второй слой, нужно дождаться полного высыхания первого. В процессе работы обязательно нужно пользоваться защитными очками, перчатками и специальным респиратором, так как все применяемые вещества и составы являются токсичными.

Антикоррозийная защита металлических сплавов — очень непростой процесс. В промышленности он начинается на стадии расплавления стали. Производители ЛКМ-покрытий занимаются совершенствованием своей продукции, увеличивая ее долговечность и стойкость.
Белорусский государственный университет транспорта – БелГУТ (БИИЖТ)
Регистрация на конференцию «Проблемы безопасности на транспорте»
Регистрация на конференцию «Тихомировские чтения»
Как поступить в БелГУТ:
дневное, заочное полное,
заочное сокращенное
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 Дата : 2022-09-01 | 2 | 3 | 4 | |||
5 Дата : 2022-09-05 | 6 Дата : 2022-09-06 | 7 Дата : 2022-09-07 | 8 Дата : 2022-09-08 | 9 Дата : 2022-09-09 | 10 Дата : 2022-09-10 | 11 Дата : 2022-09-11 |
12 | 13 | 14 | 15 Дата : 2022-09-15 | 16 Дата : 2022-09-16 | 17 | 18 |
19 | 20 | 21 | 22 | 23 | 24 | 25 |
26 | 27 | 28 | 29 | 30 | ||
Все анонсы
- Логистика.
 Обучение для студентов выпускных курсов…
Обучение для студентов выпускных курсов… - ЕДИ «История белорусской государственности – основ…
- Акция «Мы едины» – поем гимн вместе…
- Набор в студию рисунка и живописи…
- Открытая лекция Быченко Олега Владимировича…
- Квиз «Гісторыя майго жыцця»…
- Набор в волонтерский сектор Студсовета…
- Набор в спортивные секции. 1-й курс…
- Конкурс кандидатов в перспективный кадровый резерв…
- Неделя спорта и здоровья
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
Логистика. Обучение для студентов выпускных курсов…
ЕДИ «История белорусской государственности – основ…
Акция «Мы едины» – поем гимн вместе…
Набор в студию рисунка и живописи…
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
- Университет
Видео-репортаж Дня рождения Гомеля
13 сентября 2022
- Воспитательная работа
Віктарына да Дня народнага адзінства
13 сентября 2022
- Студенческая жизнь
Интервью с участниками открытия фестиваля «Сожскi карагод» и видео-реп. ..
..
13 сентября 2022
- Спорт
Неделя спорта и здоровья
13 сентября 2022
- Университет
«К юбилею учёного»! Лодня Вячеслав Александрович…
13 сентября 2022
- Университет
Опубликован сборник материалов конференции «Водоснабжение, химия и при…
12 сентября 2022
- Университет
Студент БелГУТа из Марокко рассказывает об учебе в Беларуси…
12 сентября 2022
- Студенческая жизнь
БРСМ – всегда на помощь! День города Гомеля…
12 сентября 2022
- Университет
Новый номер газеты «Вести БелГУТа»
12 сентября 2022
Другие новости
- Республиканский легкоатлетический студенческий забег.
 ..
.. - БелГУТ предлагает жилые помещения арендного использования…
- С Днем рождения, Гомель!
- Живой герб Гомеля на открытии «Сожскага карагода» …
- Круглый стол «Вопросы подготовки специалистов в области правовой инфор…
- Встреча первокурсников с инспектором по делам несовершеннолетних желез…
- Атрымай асалоду ад роднай мовы
- Региональный форум «Беларусь адзiная»
- Профилактика правонарушений
- Делегация Самарского государственного университета путей сообщения в Б…
- Подготовительные курсы по инженерной графике…
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
Лекция Защита металлов от коррозии Способы защиты
Лекция Защита металлов от коррозии
Способы защиты от коррозии 1. Нанесение покрытий 2. Легирование металлов 3. Электрохимическая защита 4. Изменение свойств коррозионной среды 5. Рациональное конструирование изделий
Нанесение покрытий 2. Легирование металлов 3. Электрохимическая защита 4. Изменение свойств коррозионной среды 5. Рациональное конструирование изделий
Защитные покрытия металлические химические неметаллические неорганические: эмали лаки краски пластмассы смолы битум асфальт
Химические покрытия Химическая обработка поверхности металла с целью получения пленки, устойчивой к коррозии Оксидирование – получение оксидных пленок Воронение сталей: 3 Fe + 4 Na. NO 3 → Fe 3 O 4 + 4 Na. NO 2 Анодирование алюминия (электролиз) А(+) 2 Al + H 2 O – 6 e– → Al 2 O 3 + 6 H+ K(–) 2 H+ + 2 e– → H 2 Фосфатирование (Mn 3(PO 4)2, Fe 3(PO 4)2) Азотирование (Cr 2 N, Al. N)
Металлические покрытия Анодное покрытие – покрытие металлом, с более отрицательным потенциалом Оцинкованное железо А(–) Zn – 2 e– → Zn 2+ K(+) (Fe) 2 H+ + 2 e– → H 2 Катодное покрытие – покрытие металлом, с более положительным потенциалом Луженое железо А(–) Fe – 2 e– → Fe 2+ K(+) (Sn) 2 H+ + 2 e– → H 2
Методы нанесения металлических покрытий 1) Термодиффузионный метод 2) Горячий метод – погружение в расплавленный металл 3) Распыление металла 4) Механотермический или плакирование
Термодиффузионный метод Поверхностное насыщение основного металла атомами легирующего компонента в результате его диффузии при высоких температурах. Покрытие: алюминием (Al) –термоалитирование хромом (Cr) – термохромирование кремнием (Si) – термосилицирование
Покрытие: алюминием (Al) –термоалитирование хромом (Cr) – термохромирование кремнием (Si) – термосилицирование
Нагрев при 950 – 1000 °С 5 -6 часов Реакционная смесь: Al, Al 2 O 3, NH 4 Cl → NH 3 + HCl 2 NH 4 Cl → 2 NH 3 + Cl 2 + H 2 2 Al + 3 Cl 2 = 2 Al. Cl 3 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 6 Al. Cl 3 + 2 Fe = 2 Fe. Al 3 + 9 Cl 2
Влияние термодиффузионных покрытий на максимальную температуру эксплуатации и свойства металлических изделий Вид покрытия Термохромирование Термоалитирование Термосилицирование Температура эксплуатации, °С Свойства изделий 800 Увеличивается жаропрочность, твердость и устойчивость к износу 950 Повышается жаростойкость Увеличивается хрупкость 1000 Повышается износоустойчивость
Горячий метод Погружение защищаемого металла в расплав металла, используемого для покрытия. Применяют: Zn (Т пл. = 419 °С) Sn (Т пл. = 232 °С) Pb (Т пл. = 327 °С) Al (Т пл. = 658 °С)
Металлизация напылением Нанесение расплавленного металла на поверхность с помощью струи сжатого воздуха или инертного газа. Плакирование На матрицу основного металла накладывают с обеих сторон листы другого металла, затем весь пакет подвергают горячей прокатке.
Плакирование На матрицу основного металла накладывают с обеих сторон листы другого металла, затем весь пакет подвергают горячей прокатке.
Легирование металлов Введение в сплав компонентов (Cr, Ni, Al, Pb, Mo, Mn, W), повышающих коррозионную стойкость Состав стали (Fe) Cr (4 -9%) Свойства устойчивость в атмосфере, растворах кислот, солей (кроме хлоридов) Применение нефтеперерабатывающая промышленность Cr (25%), Si (1%) жаростойкость до 900 – 950ºС Cr (30%), Al (5%), Si (0, 5%) жаростойкость до 1300ºС спирали электронагреватель ных приборов горелки, элементы печей
Сплавы Медь Алюминий Никель Дюралюмин (4% Cu, Оловянистые бронзы (8 0, 6% Mg, 0, 6% Mn, Нихром (20% Cr) -10% Sn) 0, 7% Si, 0, 7% Fe) Алюминиевые бронзы (10% Al) Коррозионностойкий Инконель 600 (16% сплав (9 -11% Mg) Cr, 7% Fe) Латунь (Cu–Zn) Авиаль (Al, Mg, Si) Мельхиор (Cu–Ni) Хромель Р (10% Cr)
Электрохимическая защита Катодная защита – металл соединяют с отрицательным полюсом источника тока (катодом)
Электрохимическая защита Протекторная защита – к изделию присоединяют металл с более отрицательным потенциалом (Zn, Mg, Al) Анодная защита – металл соединяют с положительным полюсом источника тока (анодом) (для легко пассивирующихся металлов (Ni, Cr, Ti, Al))
Изменение свойств коррозионной среды Введение ингибиторов коррозии Адсорбционные ингибиторы (диэтиламин, уротропин, меркаптаны) Пассивационные ингибиторы (Na 2 Cr 2 O 7, Na. NO 2, Na 2 Si. O 3) 2 Fe + 2 Na 2 Cr. O 4 +2 H 2 O = Cr 2 O 3 + Fe 2 O 3 + 4 Na. OH 2 Fe + Na. NO 2 + 2 H 2 O = Fe 2 O 3 + Na. OH + NH 3
NO 2, Na 2 Si. O 3) 2 Fe + 2 Na 2 Cr. O 4 +2 H 2 O = Cr 2 O 3 + Fe 2 O 3 + 4 Na. OH 2 Fe + Na. NO 2 + 2 H 2 O = Fe 2 O 3 + Na. OH + NH 3
Изменение свойств коррозионной среды Удаление агрессивных компонентов из среды Деаэрация (кипячение, барботаж инертного газа) Применение восстановителей (сульфиты, гидразин) O 2 + N 2 H 4 = N 2 + 2 H 2 O Подщелачивание (Ca(OH)2, Na. OH) Удаление солей (ионный обмен)
Коррозия под действием блуждающих токов “Вход” тока – катодный участок, “выход” тока – анодный участок (корродирует) Защита Дренаж – соединение проводником анодной зоны трубы и катодной зоны рельса Дополнительный анод, соединенный с катодным участком рельса
Тест 1) Предложите катодное покрытие для никеля. Напишите уравнение коррозии при нарушении этого покрытия в кислой среде. 2) В латуни (сплав цинка и меди) избирательной коррозии подвергается: а) цинк; б) медь 3) Перечислите методы нанесения металлических покрытий 4) Дайте определение следующим терминам: а) легирование б) ингибитор коррозии в) протектор 5) Выберите металлы, которые можно использовать в качестве анодного покрытия для никеля: а) медь б) железо в) кадмий г) хром д) серебро е) кобальт
Урок по теме “Коррозия металлов”
Образовательные цели: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
Развивающие: развить умение проведения химического эксперимента с соблюдением правил техники безопасности, строить логические цепочки и выводы из наблюдений, прогнозировать решение некоторых проблем.
Воспитательные: совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Оборудование: компьютер, мультимедийный проектор, оборудование и реактивы для лабораторного эксперимента, таблицы: «Коррозия металлов», «Защита металлов от коррозии», презентация к уроку.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Тип урока: изучение нового материала.
Ход урока
I.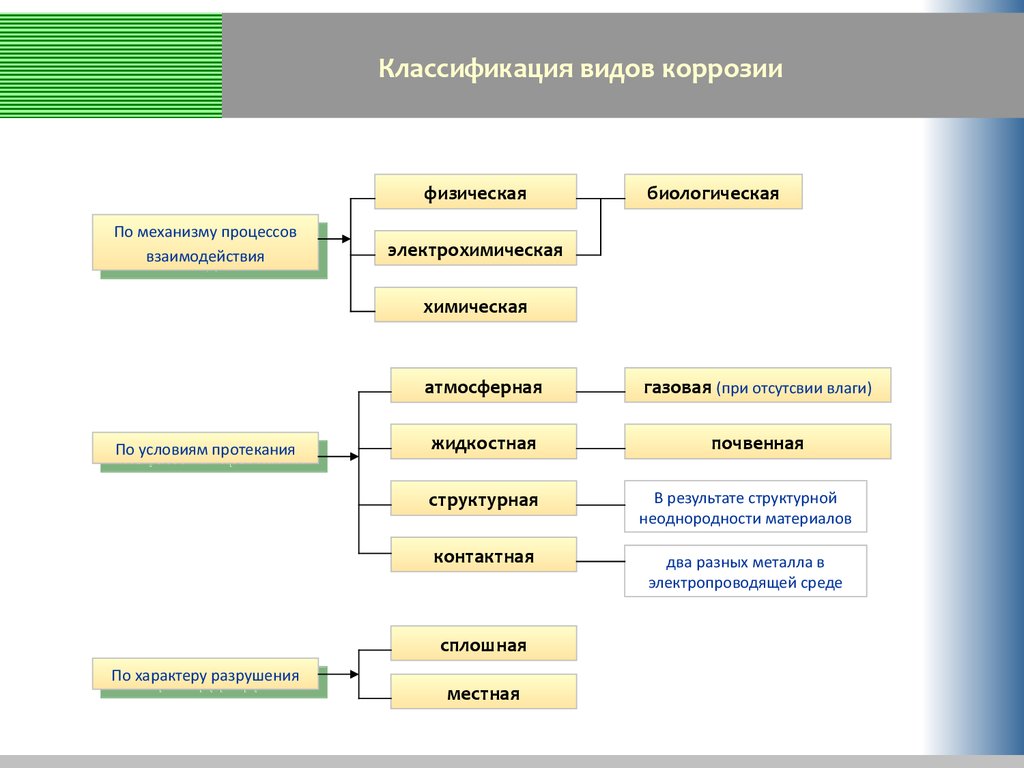 Организационный момент.
Организационный момент.
II. Объяснение нового материала.
В начале прошлого столетия по заказу одного американского миллионера, была построена роскошная яхта «Зов моря». Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из стали. Когда яхту спустили на воду, оказалось, что она не пригодна к использованию. И ещё до выхода в открытое море была полностью выведена из строя
31 января 1951 года обрушился железный мост в Квебеке (Канада), введенный в эксплуатацию в 1947 году.
В 1964 году рухнуло одно из самых высотных сооружений в мире – 400 метровая антенная мачта в Гренландии.
Разобраться, что произошло нам, поможет стихотворение:
Мы видим мрачную картину,
Вот ржавый гвоздь и ржавая труба,
И даже новую машину
За год буквально съела ржа.
Ползет она как змей ужасный
И вглубь, и вширь, и поперек.
Корабль, краскою блиставший,
С дырой в боку ко дну идет.
Ржавеет все – тросы, лебедка,
Опоры зданий и мостов,
И даже руль подводной лодки
Всегда к ржавлению готов.
И где же выход из проблемы,
И в чем причина бедствий тех?
Найдем ответ мы непременно
Пусть нам сопутствует успех.
Уч-ль: Итак, ребята, какова тема нашего урока?
Уч-ся: Коррозия металлов.
Уч-ль: мы знаем тему урока (слайд №1, приложение 1), давайте теперь сформулируем цели нашего урока, что нам необходимо сегодня изучить.
Уч-ся: Что такое коррозия, её причины, реакции, которые при этом происходят, как бороться с коррозией. (слайд №2, приложение 1)
Уч-ль: чтобы знать, как бороться с врагом надо хорошо изучить его. Обратите внимание на эпиграф к уроку: «Знать – значит победить!» (А.Н. Несмеянов) (Слайд №3, приложение 1)
Обратите внимание на эпиграф к уроку: «Знать – значит победить!» (А.Н. Несмеянов) (Слайд №3, приложение 1)
Слово коррозия происходит от латинского corrodere, что означает разъедать (слайд №4, приложение 1). Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные материалы и дерево. Например, в настоящее время мы являемся свидетелями большого беспокойства людей в связи с тем, что от кислотных дождей катастрофически страдают памятники (здания и скульптуры), выполненные из известняка или мрамора. Таким образом, мы с вами подошли к формулировке понятия «коррозия»
Коррозия – называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Процессы физического разрушения к коррозии не относят хотя часто они наносят не меньший вред памятникам культуры. Их называют истиранием, износом.
Уч-ль: чем покрывается железный гвоздь при коррозии?
Уч-ся: ржавчиной.
Уч-ль: Ржавлением называется только коррозия железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Хотя коррозируют практически все металлы, но в повседневной жизни человек чаще всего сталкивается с коррозией железа.
Перейдем с вами теперь к классификации коррозии металлов. (слайд № 5, приложение 1)
Приложение 2
«По природе агрессивных сред»: воздушная, газовая, морская, почвенная, биологическая.
«По механизму возникновения» (слайд № 7, приложение 1): химическая и электрохимическая.
Рассмотрим подробнее химическую коррозию. (слайд № 8, приложение 1) – запись в тетради.
Химическая коррозия – разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрический ток (например, нефть).
Ей подвергается арматура печей, детали двигателей внутреннего сгорания и аппаратура химической промышленности. При этом происходит окислительно-восстановительные реакции, в ходе которой металл окисляется, а присутствующий в среде окислитель восстанавливается, электроны переходят от металла к окислителю без возникновения в цепи электрического тока.
Демонстрация. Прокалим медную проволоку на воздухе. Что наблюдаете.
Уч-ся: изменение окраски – появление черного налета, значит произошла химическая реакция.
При взаимодействии меди с кислородом идет реакция:
2Cu + O2 → 2CuO (запись в тетради и на доске)
Cu0 – 2e → Cu2+| 2| – востановитель, процесс окисления
O20 + 4e → 2O2- | 1| – окислитель, процесс восстановления
Некоторые металлы на воздухе покрываются плотной оксидной пленкой, например алюминий, и металл не корродирует. Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь.Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь.Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Мы рассмотрели с вами химическую коррозию, а теперь рассмотрим электрохимическую.
Электрохимическая коррозия – разрушение металла в среде электролита с возникновением электрического тока. (Запись в тетради). (Cлайд №9, приложение 1)
При данном виде коррозии требуется наличие электролита (конденсат, дождевая вода и т.д.), как например при ржавлении железа во влажном воздухе. При электрохимической коррозии возникает электрическая цепь.
4Fe + 3O2(воздух) + 6H2O(влага) → 4Fe(OH)3
Может подвергаться один металл, но и металлы в контакте друг с другом.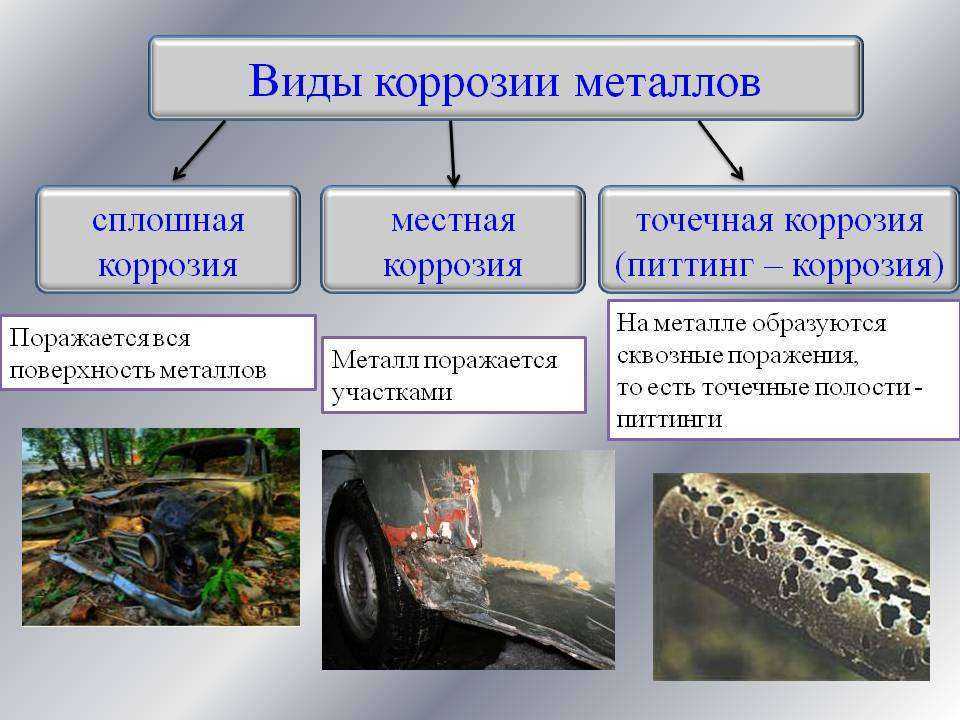
Демонстрация: Взаимодействие цинка с разбавленной соляной кислотой. Что происходит?
Уч-ся: Цинк реагирует с кислотой, выделяется газ водород.
Уч-ль: Добавим немного раствора хлорида меди (II). Что наблюдаем?
Уч-ся: На поверхности цинка выделяется медь и водород бурно выделяется.
Схема процесса:
Zn0 – 2e → Zn2+ (запись в тетради)
2H+ + 2e → H20
Zn0 + 2H+ → Zn2+ + H20
В результате возникает гальванический элемент. Замечено, что сверхчистые металлы устойчивы к коррозии.Например, сверхчистое железо намного меньше корродирует, чем обычное железо. (Слайд №10, приложение 1) Знаменитая Кутубская колонна в Индии близ Дели уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из чистого железа (99,72 %) и весом 6,5 тонн, высотой 7,2 метра и в диаметреот 42 см у основания и до 30 см у верха. Колонна была воздвигнута в честь царя Чандрагупты II . По народному поверью кто прислонится к колонне спиной и сведет за ней руки исполнится заветное желание. Ученые предполагают, что эта колонна изготовлена из метеоритного железа. Мы рассмотрели с вами виды коррозии.
Сделана она из чистого железа (99,72 %) и весом 6,5 тонн, высотой 7,2 метра и в диаметреот 42 см у основания и до 30 см у верха. Колонна была воздвигнута в честь царя Чандрагупты II . По народному поверью кто прислонится к колонне спиной и сведет за ней руки исполнится заветное желание. Ученые предполагают, что эта колонна изготовлена из метеоритного железа. Мы рассмотрели с вами виды коррозии.
Следующим этапом нашего урока будет рассмотрение факторов, влияющих на коррозию металлов.
Для этого необходимо провести ряд лабораторных орытов. У учащихся на столах карточки с инструкциями по проведению лабораторных опытов и соблюдению правил по технике безопасности.
Проведем лабораторные опыты:
- Fe + H2O→ (слайд № 11, приложение 1)
- Fe + NaCl (p-p) →
- Fe, Cu + NaCl(p-p)→
- Fe,Zn + NaCl (p-p) →
- Fe + NaCl + NaOH →
Учащиеся проводят опыты и сравнивают с опытным образцом проведенным несколько дней назад. Результаты обсуждаются и сравниваются с данными со слайда. (слайды № 12-13, приложение 1)
Результаты обсуждаются и сравниваются с данными со слайда. (слайды № 12-13, приложение 1)
Стакан №1: Железо слабо прокорродировало, в чистой воде коррозия идет медленно, так как это слабый электролит.
Стакан №2: Скорость коррозии выше, чем в первом случае, следовательно хлорид натрия увеличивает скорость коррозии.
Стакан №3: Железный гвоздь в контакте с медной проволокой, опущенный в раствор хлорида натрия сильно прокорродировал.
Стакан №4: в контакте с цинком железо не корродирует.
Стакан №5: железный гвоздь, опущенный в раствор хлорида натрия, к которому добавили гидроксида натрия не корродирует.
Уч-ль: Какой вывод мы можем сделать?
Уч-ся: Скорость коррозии меняется в зависимости от контакта с другими химическими веществами.
Уч-ль: а есть ли способы защиты от коррозии?
Уч-ся: есть.
Уч-ль: зная механизм коррозии и причины её возникновения, человек научился защищать металлы от коррозии. Вспомним с вами эпиграф нашего урока (Знать – значит победить) (слайд №14, приложение 1)
- Неметаллическое покрытие (лаки, масла, краски и т.д.). Эти вещества изолируют металл от внешней среды. ( Работа с таблицей методы защиты от коррозии). Например, Эйфелева башня в Париже изготовлена из стали и требует покрытия краской для защиты от коррозии и стала весить вместо 9 тонн стала на 70 тонн больше. (слайд №15, приложение 1)
- Металлическое покрытие – некорродирующими металлами (Zn, Cr, Ag, Ni, Sn и т.д.). Кровельное железо покрывают цинком, который охраняет железо от коррозии, хотя цинк и является более активным металлом. Он сам покрыт оксидной пленкой. (слайд №16, приложение 1)
- Нержавеющие стали ( введение легирующих металлов: Cr, Ni, Co, Cu и т.
 д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди – усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1)
д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди – усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1) - Введение ингибитора. Ингибитор – это вещество, способное в малых количествах замедлять протекание химических процессов или останавливать их. Дамасские мастера для снятия окалины использовали растворы серной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были первыми ингибиторами. В результате растворялись лишь окалина и ржавчина. Посмотрите на табл. «Методы защиты от коррозии» Гвоздь в воде с маслом не корродирует – масло является ингибитором) Ингибиторы широко применяются при очистке от накипи паровых котлов, снятия окалины с обработанных изделий, при хранении и перевозке соляной кислоты в стальной таре.

- Протекторная (более активный металл, стоящий левее в ряду электрохимического напряжения металлов) – легко разрушается. Протекторная защита применяется в тех случаях если, когда защищается конструкция (подземный трубопровод, корпус корабля), находящаяся в среде электролита (морская вода, подземные почвенные воды и т.д.). Сущность такой защиты заключается в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции. Например, дно корабля защищают кусочками из металла Zn, защищая железное дно от разрушения. В роли протекторов выступают и другие металлы: Mg, Al, Zn и сплавы из них. Мы рассмотрели с вами способы защиты металлов от коррозии.
III. Первичное закрепление материала (слайд №19, приложение 1)
Самостоятельная работа «Коррозия металлов» по вариантам.
Вариант №1
- Что такое «коррозия»? Какие факторы способствуют замедлению коррозии металлов?
- На стальной крышке поставлена медная заклепка.
 Что разрушится раньше – крышка или заклепка? Почему?
Что разрушится раньше – крышка или заклепка? Почему?
Вариант №2
- Какие виды коррозии вам известны?
- Почему луженный( покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Вариант №3
- Какие факторы, способствуют усилению коррозии?
- Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются Cu или Zn, Al или Fe? Почему?
Вариант №4
- Перечислите способы борьбы с коррозией?
- Почему на оцинкованном баке, на месте царапины, цинк разрушается, а железо не ржавеет?
IV. Подведение итогов урока
Д/з: §10, упр.6 (слайд №20, приложение 1)
Приложение 3
Приложение 4
Презентация по химии на тему Коррозия металлов доклад, проект
«Коррозия металлов»
Тема урока
Выполнила преподаватель химии
С. С. Пикулина
С. Пикулина
ГБПОУ ВО «Воронежский индустриальный колледж»
Цели урока:
Познакомить обучающихся с различными видами коррозии, со способами защиты металлов от коррозии; объяснить причины возникновения и механизмы протекания коррозии.
Развивать умения обучающихся применять свои знания на практике.
Содействовать воспитанию интереса к предмету и экологической культуры.
Вопросы для повторения
Где в периодической системе
Д. И. Менделеева расположены металлы?
2. В чем особенность строения атомов металлов?
3.Какие различия существуют в физических свойствах металлов?
4. Назовите металлы, которые находят наибольшее практическое значение в вашей будущей профессии?
Тема урока:
«Коррозия металлов»
«Классификация коррозионных разрушений по их характеру»
1. Дайте определение понятия «коррозия металлов».
Дайте определение понятия «коррозия металлов».
2. Объясните сущность этого явления.
3. Рассмотрите образцы коррозионных разрушений, определите их виды.
«Классификация видов коррозии по механизму её протекания
(химическая коррозия)»
1. Объясните сущность химической коррозии.
2. Перечислите факторы, вызывающие химическую коррозию.
3. Рассмотрите механизм химической коррозии с помощью окислительно-восстановительной реакции.
«Классификация видов коррозии по механизму её протекания (электрохимическая коррозия)»
Объясните сущность электрохимической коррозии.
Перечислите факторы, вызывающие электрохимическую коррозию.
Рассмотрите механизм электрохимической коррозии.
Экспериментальный этап.
Что наблюдаете? Объясните, что происходит в каждом из стаканов?
В каком опыте коррозионный процесс происходит интенсивнее?
Решение познавательных задач.
На поверхности железного листа, находящегося на воздухе, имеется медная заклепка. Какой металл будет подвергаться коррозии и почему?
Допустимо ли соединять детали карбюратора автомобиля, изготовленные из цинкового сплава, латунными винтами?
В годы Первой мировой войны была изготовлена медная обшивка подводного корабля и поставлены алюминиевые заклёпки. При спуске корабля на воду вода вокруг него закипела, и обшивка отпала: в чем причина описанного явления?
Способы защиты металлов от коррозии.
Защитные поверхности.
Создание сплавов с антикоррозийными свойствами.
Изменение состава среды – вводят ингибиторы
Электрохимические методы
Способы защиты металлов от коррозии.
Защитные поверхности.
Создание сплавов с антикоррозийными свойствами.
Изменение состава среды – вводят ингибиторы
Электрохимические методы
Зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия). Что при этом происходит с кузовом автомобиля при езде по таким дорогам?
Как защитить автомобиль от коррозии?
Домашнее задание:
1. Учебник Рудзитис Г.Е. Глава 5
§ 10, зад. №1 стр. 121
2. Работа с опорным конспектом:
записать в рабочую тетрадь определение коррозии и способы защиты металлов от коррозии.
Ответы к тестам
1 вариант.
1…разрушение металлов под воздействием окружающей среды
2. Г
3. А,Г
А,Г
4. А
5. Б
6.Al, Mg, Sn, Pb
7. …покрытие металла никелем.
2 вариант.
1…химические и электрохимические.
2. В
3. Б
4. Б
5. А
6. Fe, Ti, Cr, Cu, Zn
7. ..покрытие металла цинком.
Скачать презентацию
Как защитить металлы – AMPP
Коррозия – это естественный износ, возникающий в результате химической или электрохимической реакции металла или металлического сплава с окружающей средой. Подобно другим стихийным бедствиям — землетрясениям, торнадо, наводнениям — коррозия может нанести опасный и дорогостоящий ущерб всему, от транспортных средств, бытовой техники и систем водоснабжения/очистки до трубопроводов, мостов и общественных зданий. Коррозия отличается от других стихийных бедствий тем, что существуют проверенные временем методы, а также новые технологии, которые помогают контролировать и предотвращать коррозию, тем самым защищая людей, имущество и планету от ее негативного воздействия.
Перед определением конкретной проблемы и/или решения по предотвращению и контролю коррозии необходимо учитывать множество факторов, включая, помимо прочего:
- условия окружающей среды (удельное сопротивление почвы, влажность и воздействие соленой воды на различные типы материалов )
- тип продукта, подлежащего обработке, обработке или транспортировке
- требуемый срок службы конструкции или компонента
- близость к явлениям, вызывающим коррозию
Несмотря на это, казалось бы, сложное взаимодействие факторов и почти неизбежную ржавчину металлов, коррозия является управляемым процессом, когда такие широко используемые и эффективные методы выбора и проектирования материалов, защитных покрытий, измерений и контроля, катодной защиты, химических ингибиторов и управления коррозией считаются.
Выбор материалов и проектирование
Тщательное и реалистичное рассмотрение вопросов предотвращения коррозии и смягчения ее последствий на этапе выбора материалов в процессе проектирования имеет решающее значение для предотвращения многих типов отказов.
Факторы, которые могут повлиять на выбор материалов, включают коррозионную стойкость в окружающей среде, наличие проектных данных и данных испытаний, механические свойства, стоимость, доступность, ремонтопригодность, совместимость с другими компонентами системы, ожидаемый срок службы, надежность и внешний вид.
Неотъемлемой частью выбора материалов является соответствующий проект системы, учитывающий параметры процесса и конструкции; геометрия для дренажа; предотвращение или электрическое разделение разнородных металлов; предотвращение или герметизация щелей; допуск на коррозию; срок эксплуатации; требования к техническому обслуживанию и осмотру.
В то время как использование металлов и бетона является обычным выбором при проектировании, наука о материалах предлагает инженерам-коррозионистам варианты борьбы с коррозией с использованием современных материалов. Инженерные свойства, созданные с помощью специализированных технологий обработки и синтеза, придают усовершенствованным материалам превосходные характеристики по сравнению с обычными материалами и включают керамику, металлы с высокой добавленной стоимостью, электронные материалы, композиты, полимеры и биоматериалы.
Инженерные свойства, созданные с помощью специализированных технологий обработки и синтеза, придают усовершенствованным материалам превосходные характеристики по сравнению с обычными материалами и включают керамику, металлы с высокой добавленной стоимостью, электронные материалы, композиты, полимеры и биоматериалы.
Ресурсы по выбору материалов и проектированию AMPP
Защитные покрытия
Исследование коррозии, проведенное NACE International, теперь AMPP, показывает, что 50% всех затрат на коррозию можно предотвратить, причем примерно 85% из них относится к защитным покрытиям.
Защитные покрытия, включая краски, представляют собой тонкие слои твердого материала, нанесенные на подложку, при этом покрытие действует как барьер, препятствующий или предотвращающий коррозию, износ или воздействие воды. Каждая жидкая, разжижаемая или мастичная композиция после нанесения на поверхность превращается в твердую защитную, декоративную или функциональную клейкую пленку. Покрытия можно напылять, приваривать, гальванизировать или наносить с помощью ручных инструментов в зависимости от поверхности покрытия, окружающей среды и целей нанесения.
Покрытия можно напылять, приваривать, гальванизировать или наносить с помощью ручных инструментов в зависимости от поверхности покрытия, окружающей среды и целей нанесения.
Материалы, обычно используемые в органических покрытиях, представляют собой эпоксидные смолы, полиуретаны или другие полимеры, в то время как материалы, обычно используемые в неорганических металлических покрытиях, включают цинк, алюминий и хром.
После подготовки поверхности покрытия наносятся в 3 этапа: сначала грунтовка, затем полное покрытие, а затем герметик.
Учебный центр защитных покрытий | Ресурсы защитных покрытий AMPP
Измерение и проверка
Инспекции покрытий проверяют промышленное оборудование и объекты, а также коммерческую недвижимость и проекты, чтобы убедиться, что защитные покрытия были нанесены правильно, чтобы минимизировать риск коррозии.
Проверка покрытий помогает укрепить всю отрасль защитных покрытий и позволяет сэкономить миллиарды долларов на коррозионных затратах.
Ресурсы для измерения и проверки AMPP
Катодная защита (CP)
Катодная защита — это технология, используемая для контроля коррозии поверхности металла путем превращения ее в катод электрохимической ячейки. CP может быть достигнут путем подачи тока в структуру от внешнего электрода и поляризации металлической поверхности в электроотрицательном направлении. Это обеспечивает защиту поверхности и продлевает срок службы актива.
Системы CP защищают широкий спектр металлических конструкций, в том числе наземные и морские трубопроводы, резервуары для хранения, сваи причалов, корпуса кораблей и лодок, морские нефтяные платформы и компоненты металлической арматуры в бетонных конструкциях. Другой метод CP для смягчения коррозии включает нанесение цинкового покрытия на компоненты из оцинкованной стали.
Средства катодной защиты AMPP
Химические ингибиторы
Ингибитор коррозии снижает скорость коррозии металла, подвергающегося воздействию окружающей среды, путем замедления химической (коррозионной) реакции.
Чтобы уменьшить интенсивность коррозии, их обычно добавляют в небольших количествах к кислотам, охлаждающей воде, пару и многим другим средам либо постоянно, либо периодически. При использовании в качестве покрытия ингибиторы коррозии обычно наносят на чистые поверхности и дают им проникнуть и высохнуть.
Ингибирование может использоваться внутри труб и сосудов из углеродистой стали в качестве экономичной альтернативы защите от коррозии для нержавеющих сталей и сплавов, покрытий или неметаллических композитов, и часто может применяться без нарушения процесса. Ингибиторы также можно использовать для защиты от коррозии армированных стальных стержней (арматурных стержней) внутри бетона.
Ресурсы химических ингибиторов AMPP
Борьба с коррозией
Для предотвращения коррозии и снижения связанных с ней затрат необходимы не только технологии; для этого требуется упреждающий план управления коррозией для улучшения проектирования, эксплуатации и технического обслуживания критически важных активов. Кроме того, эти планы должны быть основаны на изменении того, как решения по коррозии принимаются внутри организации.
Кроме того, эти планы должны быть основаны на изменении того, как решения по коррозии принимаются внутри организации.
Согласно исследованию NACE, те компании, которые лучше всего справляются с сокращением негативных последствий коррозии, следуют определенным практикам с техническими планами управления коррозией, интегрированными в общую систему управления их организации, таким образом охватывая все уровни организации. Вовлекая каждого сотрудника в план управления коррозией организации, стратегии могут быть реализованы на каждом этапе жизненного цикла продукта или объекта, что приводит к значительной экономии затрат в течение всего срока службы актива.
Ресурсы AMPP по борьбе с коррозией
7 способов остановить или замедлить коррозию металла
Присоединяйтесь к обсуждению ()
Четверг, 30 января 2020 г., 1:43
Автор: News On 6
Ежегодно во всем мире из-за коррозии теряется около 2,5 триллионов долларов США. Это более 3% мирового ВВП.
Это более 3% мирового ВВП.
Но беспокойство по поводу коррозии металлов связано не только с финансовым вопросом. Это также вопрос безопасности и здоровья.
Коррозия металла может повлиять не только на конструкцию, содержащую металл, но и на людей, использующих металл или находящихся рядом с ним. Случаи проржавевших зданий и обрушения мостов, протекающих труб и медицинских имплантатов, отравляющих кровь людей, не новы.
В конечном счете, от коррозии металлов не может быть абсолютно ничего хорошего. Вот почему вы должны попытаться предотвратить это или, по крайней мере, замедлить его.
Продолжайте читать, чтобы узнать больше.
Определение коррозии металлов
Коррозия относится к процессу износа металла из-за химических реакций между металлом и окружающей средой. Скорость этого износа зависит от типа металла, а также от условий окружающей среды, особенно от газов, контактирующих с металлом.
Какие металлы подвержены коррозии?
Коррозия может произойти с любым металлом.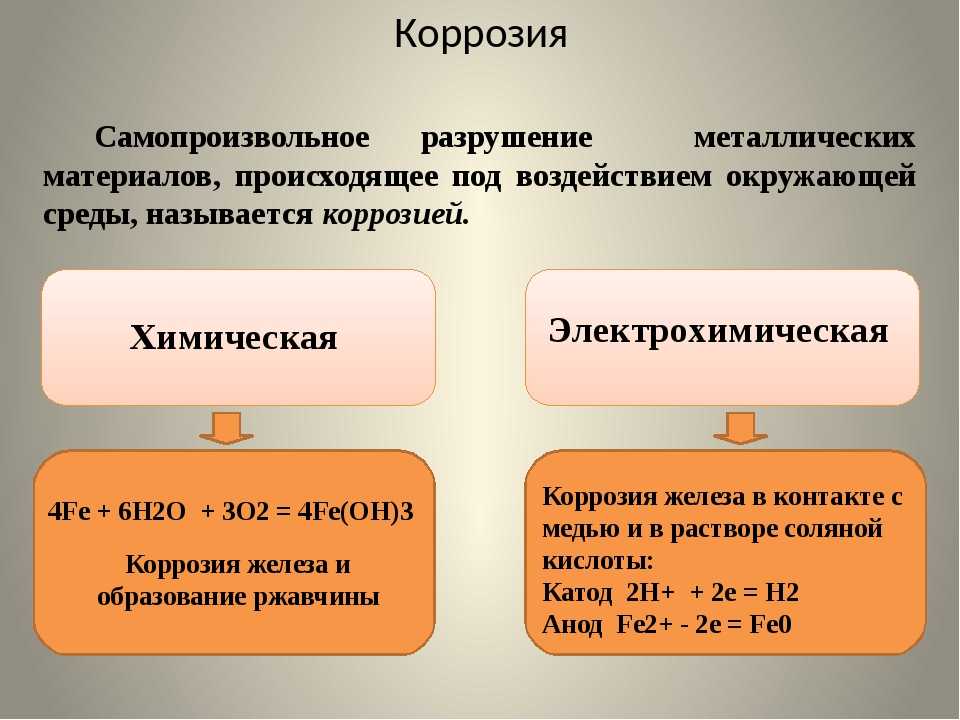 Некоторые металлы, такие как чистое железо, подвержены коррозии намного быстрее, чем другие. Сочетание железа и других сплавов для изготовления нержавеющей стали значительно замедляет процесс коррозии.
Некоторые металлы, такие как чистое железо, подвержены коррозии намного быстрее, чем другие. Сочетание железа и других сплавов для изготовления нержавеющей стали значительно замедляет процесс коррозии.
Существует небольшая группа металлов, которые гораздо менее реакционноспособны по сравнению с другими металлами. Они называются благородными металлами и включают золото, серебро, платину, родий и палладий. Благородные металлы редко подвергаются коррозии.
Как предотвратить коррозию металлов
Хотя коррозия настолько распространена и разрушительна, ее можно контролировать с помощью простых профилактических методов. Вот семь проверенных способов предотвратить коррозию.
1. Выберите коррозионностойкий металл
Когда дело доходит до коррозии металлов, профилактика – лучшее лекарство. Вряд ли существует более простой способ остановить коррозию, чем использовать в своих проектах металлы, не подверженные коррозии. Алюминий и нержавеющая сталь являются хорошими примерами.
При покупке металлических изделий покупайте изделия из металлов, не подверженных коррозии. Идея состоит в том, чтобы уменьшить потребность в дополнительной защите от коррозии.
2. Использование защитных покрытий
Нанесение слоя краски, например резиновой краски, является одним из наиболее экономичных методов предотвращения коррозии. Краска действует как барьер, предотвращая передачу электрохимических зарядов, вызывающих коррозию, на металл под покрытием.
Вы также можете нанести порошковое покрытие на поверхность металла и нагреть его, чтобы образовалась гладкая защитная пленка на металле. Наиболее популярные порошковые составы включают эпоксидную смолу, акрил, нейлон, полиэстер и уретан.
3. Примите соответствующие меры по защите окружающей среды
Как мы упоминали ранее, коррозия возникает, когда происходит химическая реакция между металлом и газами в окружающей среде. Отсюда следует, что если вы можете контролировать окружающую среду, вы можете уменьшить нежелательные реакции, вызывающие коррозию.
Простые способы контроля окружающей среды включают сокращение воздействия влаги или морской воды. Более сложные меры включают контроль уровня кислорода, хлора или серы в окружающей среде вокруг металла.
4. Использование расходуемых покрытий
При расходуемых покрытиях на поверхность металла, который необходимо защитить от коррозии, наносится дополнительный слой металла, который может окисляться. Временное покрытие может быть нанесено двумя способами:
- Катодная защита – этот метод включает покрытие стали из сплава железа цинком. Процесс известен как цинкование. Поскольку цинк более активен, чем сталь, он быстро окисляется и предотвращает коррозию стали.
- Анодная защита – этот метод включает нанесение покрытия из менее активного металла на сталь. Обычно используется олово, так как оно не подвержено коррозии. Поэтому, пока покрытие на месте, сталь всегда будет защищена.
5. Попробуйте металлическое покрытие
Металлическое покрытие почти аналогично покрытию в том смысле, что тонкий слой металла наносится на металл, который вы хотите защитить. Помимо предотвращения коррозии, металлический слой обеспечивает эстетическую отделку. Как правило, существует четыре типа металлического покрытия:
Помимо предотвращения коррозии, металлический слой обеспечивает эстетическую отделку. Как правило, существует четыре типа металлического покрытия:
- Гальваническое покрытие: этот метод включает нанесение тонкого слоя металла, такого как хром или никель, на металлическую подложку в ванне с электролитом.
- Механическое покрытие: механическое покрытие включает холодную сварку металлического порошка с металлической подложкой. Субстрат плюс порошок и несколько стеклянных шариков смешивают с водным раствором. Как правило, металлизация включает в себя нанесение кадмия или цинка на крошечные металлические детали.
- Химический метод: в этом методе металл покрытия, такой как никель или кобальт, наносится на металлическую подложку посредством химической реакции. Этот метод покрытия является неэлектрическим.
- Горячее погружение: это простой метод нанесения покрытия, который включает погружение подложки в ванну с расплавленным защитным металлом. Затем защитный металл образует тонкий слой на металлической подложке.

6. Рассмотрите ингибиторы коррозии
Ингибиторы коррозии предотвращают коррозию, реагируя с поверхностью металла и окружающими газами, подавляя электрохимические реакции, которые могут вызвать коррозию. Эти химические вещества образуют защитную пленку на поверхности металла.
Ингибиторы коррозии можно наносить в виде защитного покрытия с помощью методов диспергирования. Вы также можете применять эти химические вещества в виде раствора. Процесс нанесения ингибиторов коррозии обычно называют пассивацией.
Ингибиторы коррозии чаще всего применяются в водоподготовке, нефтепереработке и химической промышленности.
7. Попробуйте модификацию конструкции
Изменение конструкции металла может значительно уменьшить коррозию. Этот подход может также повысить долговечность существующего антикоррозионного покрытия на металле.
Так что же делать? Что ж, можно попробовать улучшить конструкцию, чтобы металл не задерживал воду и пыль и не способствовал свободному движению воздуха. Обратите внимание и на регулярное техническое обслуживание.
Обратите внимание и на регулярное техническое обслуживание.
Предотвратить коррозию металла легко
Коррозия металла всегда будет фактом жизни для каждого человека, который использует металл. Однако знание того, что вызывает коррозию и что вы можете сделать, чтобы остановить ее, может помочь вам принять профилактические меры, прежде чем она станет угрозой.
Имейте в виду, что открытые поверхности являются наиболее уязвимыми, поэтому приложите все усилия, чтобы обработать их, если сможете. Контроль окружающей среды путем устранения влаги также может помочь замедлить коррозию до приемлемого уровня.
Продолжайте посещать наш веб-сайт, чтобы читать больше подобных материалов.
Информация, содержащаяся на этой странице, предоставлена независимым сторонним поставщиком контента. Откровенно говоря, и этот Сайт не дает никаких гарантий или заявлений в связи с этим. Если вы связаны с этой страницей и хотите, чтобы она была удалена, свяжитесь с нами по адресу: pressreleases@franklymedia. com
com
16 эффективных советов по предотвращению ржавления металлов
Любой металл ржавеет, включая золото и серебро, но этот процесс занимает больше времени с одни металлы, чем другие. Ржавчина также может испортить металл в одних случаях и только покрыть металл в других. В большинстве случаев лучше всего предотвратить появление ржавчины, и мы собираемся рассмотреть несколько способов сделать это.
Что такое ржавчина?
Ржавчина возникает, когда металл или металлические сплавы соединяются с кислородом с образованием оксида. Наиболее распространенным результатом является ржавчина, коричневый, рассыпчатый материал, чаще всего встречающийся в железе или стали, который разъедает металл, но потускнение, наблюдаемое на некоторых металлах, возникает в результате того же процесса. Процесс окисления начнется каждый раз, когда металл встретит кислород в воздухе или воде. Соль и тепло увеличат скорость химической реакции.
Металлы, склонные к коррозии
Давайте рассмотрим различные типы металлов и формы окисления.
Железо окисляется быстрее всех металлов. Если дать железу намокнуть, вы сможете увидеть пленку ржавчины всего через несколько часов. Нагрев металла также увеличивает скорость его коррозии, и если вы нагреете железную кочергу или подушку и дайте им остыть, вы сразу же увидите коричневую пленку на поверхности. Ржавчина разъедает металл и разрушает его структурную целостность.
Сталь
Сталь представляет собой сплав, созданный путем смешивания железа с углеродом и другими ингредиентами. Доступны многие типы или сорта в зависимости от ингредиентов. Некоторые стали устойчивы к ржавчине, и мы вскоре обсудим их. Однако большая часть стали ржавеет почти так же быстро, как и железо, если ее не обрабатывать.
Алюминий
Алюминий не ржавеет так, как железо или сталь, но подвергается коррозии. Металл тускнеет, теряет блеск и образует затвердевший слой. В отличие от ржавчины, этот твердый слой будет служить щитом, защищающим металл от дальнейших повреждений. Он также не скалывается и не отслаивается, как ржавчина, и его довольно сложно удалить.
Он также не скалывается и не отслаивается, как ржавчина, и его довольно сложно удалить.
Медь
Медь — еще один металл, склонный к окислению. Этот металл не ржавеет, как железо или сталь, но корродирует, как алюминий, и это гораздо заметнее. Когда медь окисляется, она превращается из темно-коричневого цвета в ярко-зеленый. Подобно алюминию, окисление образует защитный барьер над металлом, который предохраняет его от дальнейшего повреждения, и поэтому обычно допускается его окисление. Самый простой способ увидеть окисление меди — посмотреть на Статую Свободы, медную статую, которая заржавела до ярко-зеленого цвета, который мы все знаем.
Изображение предоставлено: ArtTower, PixabayСоветы по предотвращению ржавчины и окисления
1. Избегайте металлов, которые ржавеют
Первое, что вы можете сделать, чтобы предотвратить ржавчину, это рассмотреть ее перед покупкой. Стеллажи, столы, украшения для газонов и многие другие предметы, в которых используется много стали, также могут быть изготовлены из материалов, которые не ржавеют. Пластмассы, дерево и другие материалы могут работать так же хорошо во многих случаях и навсегда устранять ржавчину.
Пластмассы, дерево и другие материалы могут работать так же хорошо во многих случаях и навсегда устранять ржавчину.
2. Нержавеющая сталь
Нержавеющая сталь — это тип стали, в состав которой входит не менее 11% хрома. Благодаря добавленному ингредиенту он чрезвычайно устойчив к ржавчине и другим формам коррозии. Это также делает сталь более жаропрочной, и она может выдерживать более высокие температуры.
3. Атмосферостойкая сталь
Атмосферостойкая сталь, или Corten, представляет собой стальной сплав, не требующий окраски. Через несколько лет он образует ржавчину, но коррозия не проникает в металл. Вы часто будете видеть выветривание стали на мостах, линиях электропередач и других объектах, которые должны оставаться на открытом воздухе.
4. Оцинкованный металл
Оцинкованный металл — это обычно сталь, но может быть любой металл, покрытый цинком для защиты от ржавчины. Вы создаете оцинкованную сталь, погружая металл в расплавленный цинк, и вы часто видите ее на сараях, ведрах, дорожках и многом другом.
5. Остановите его до того, как он начнется
Лучший способ предотвратить ржавчину – это остановить ее до того, как она начнется. Мы настоятельно рекомендуем использовать методы из этого списка с первого дня, чтобы предотвратить распространение ржавчины. Как только это начинается, его может быть трудно сдержать, и оно быстро распространяется, часто незаметно, особенно на автомобилях и другом сложном оборудовании.
Изображение предоставлено: Analogicus, Pixabay6. Держите его в чистоте и сухости
Как мы упоминали ранее, металл быстрее подвергается коррозии, когда он влажный, поэтому важно протирать его, если он вступает в контакт с влагой и после контакта с ним. Грязь и даже пыль могут впитывать влагу и удерживать ее на поверхности. Ваши пальцы содержат воду, масла и соль.
7. Плановое техническое обслуживание
Лучший способ убедиться, что ваши важные металлы всегда чистые и сухие, — создать регламент технического обслуживания. Процедура поможет вам убедиться, что все ваши металлы чистые, и позволит вам повторно нанести любые покрытия или средства защиты. Это также дает вам возможность внимательно осмотреть металлы, чтобы увидеть, не образуется ли ржавчина.
Процедура поможет вам убедиться, что все ваши металлы чистые, и позволит вам повторно нанести любые покрытия или средства защиты. Это также дает вам возможность внимательно осмотреть металлы, чтобы увидеть, не образуется ли ржавчина.
8. Избегайте царапин
Даже если царапина выглядит неглубокой, в ней может спрятаться микроскопическая влага и начать процесс ржавчины. Избегайте размещения стали или железа там, где они могут быть поцарапаны, и по возможности используйте холоднокатаную сталь, которая более устойчива к царапинам и удерживает влагу.
9. Силикагель
Металлы очень быстро ржавеют и корродируют в присутствии воды, включая влажность. Никогда не храните инструменты и важные металлы во влажных местах, таких как подвал. По возможности используйте герметичный контейнер с влагопоглощающими пакетами, чтобы удалить влагу.
10. Воронение
Воронение — это тип окрашивания металла, который придает металлу темно-синий, серый или черный цвет и делает его устойчивым к ржавчине. Это часто встречается на стволах оружия, а также на декоративной стали, например, на значках или табличках. Воронение недорогое и легкое в применении. Его основным недостатком является то, что он может стираться, и вам нужно будет повторно наносить его через несколько лет.
Это часто встречается на стволах оружия, а также на декоративной стали, например, на значках или табличках. Воронение недорогое и легкое в применении. Его основным недостатком является то, что он может стираться, и вам нужно будет повторно наносить его через несколько лет.
11. Масляное покрытие
Один из самых простых способов защитить металл от ржавчины во время хранения — протереть его тонким слоем масла. Масло создаст барьер, через который вода не сможет проникнуть, и даже предотвратит проникновение влаги в царапины и трещины. Большинство экспертов рекомендуют льняное или тунговое масло, но вы можете использовать все, что у вас есть под рукой, и оно будет работать. Нагрев металла поможет маслу проникнуть внутрь и лучше защитить его.
Изображение предоставлено: Skitterphoto, Pixabay12. Краска
Еще один простой способ защитить металл от ржавчины — покрасить его. Большинство красок недороги и доступны в широком диапазоне цветов, в отличие от воронения. Однако для покраски может потребоваться определенный навык, вам нужно будет повторно наносить ее каждые несколько лет, и вам нужно убедиться, что вы получаете клеймо, которое прилипает к металлу.
Однако для покраски может потребоваться определенный навык, вам нужно будет повторно наносить ее каждые несколько лет, и вам нужно убедиться, что вы получаете клеймо, которое прилипает к металлу.
13. Порошковое покрытие
Порошковое покрытие — это тип краски с добавками, которые делают его чрезвычайно устойчивым к царапинам и ржавчине. Он часто использует винил, акрил, эпоксидную смолу и другие вещества для достижения прочной связи. Доступно множество комплектов для порошковой окраски, но чаще всего приобретаются изделия с уже покрытым покрытием.
14. Сухое покрытие
Еще один простой способ защитить металл — использовать сухое покрытие. Как следует из названия, сухие покрытия не делают ваши металлы скользкими, как масляные покрытия, а это значит, что они не собирают пыль. Наиболее распространенным типом сухого покрытия является автомобильный воск, и, хотя он идеально подходит для вашего автомобиля, вы можете использовать его и для любых других металлов, чтобы защитить их от ржавчины.
15. FOZZ
FOZZ — это очищающее и защитное средство для металлов, в котором используется ряд химикатов для превращения ржавчины в твердое вещество, которое можно стереть. Он создан на водной основе и безопасен для всех металлов, включая протравленную оцинкованную сталь.
16. Ингибиторы ржавчины
Ингибиторы ржавчины могут помочь предотвратить ржавчину, но они также помогают замедлить скорость появления ржавчины, и часто это лучший выбор в этой ситуации. Ингибиторы ржавчины аналогичны FOZZ тем, что они используют специальные ингредиенты для изменения химического состава ржавчины и превращения ее во что-то новое, с чем легче справиться.
Резюме
Мы надеемся, что вам понравилось читать эти советы и вы нашли их полезными. Мы рекомендуем профилактические меры, такие как регулярное техническое обслуживание, чтобы смазать или покрыть воском ваши металлы, поэтому вам не нужны такие продукты, как FOZZ или ингибиторы ржавчины. Если вы красите или наносите порошковое покрытие, вам также необходимо будет регулярно осматривать их, чтобы убедиться, что на них нет сколов или царапин, которые позволят влаге получить доступ к металлу. Если вы узнали что-то новое, поделитесь этими 16 эффективными советами по предотвращению коррозии металлов в Facebook и Twitter.
Если вы красите или наносите порошковое покрытие, вам также необходимо будет регулярно осматривать их, чтобы убедиться, что на них нет сколов или царапин, которые позволят влаге получить доступ к металлу. Если вы узнали что-то новое, поделитесь этими 16 эффективными советами по предотвращению коррозии металлов в Facebook и Twitter.
Рекомендуемое изображение: Alexei_other, Pixabay
Содержание
- 1 Что такое Rust?
- 2 металлы склонны к ржавчине
- 2.1 Iron
- 2.2 Сталь
- 2,3 Алюминий
- 2,4 Медная
- 3 Советы, чтобы предотвратить ржавчину
- 3.1 1. Избегайте металлов.
- 3,3 3. Атмосферостойкая сталь
- 3,4 4. Оцинкованный металл
- 3,5 5. Остановить до того, как он начнется
- 3,6 6. Держите его в чистоте и сушит
- 3,7 7. Процедура обслуживания
- 3.8 8. Избегайте царапин
- 3,9 9. Силикагель
- 3.10 10. Блюдо
- 3.
 11
11 - 3,13 13. Порошковое покрытие
- 3,14 14. Сухое покрытие
- 3,15 15. FOZZ
- 3,16 16. Ингибиторы ржавчины
- 4 РЕЗЕМЕНТ
13 СОВЕТ », оранжево-коричневый хлопьевидный осадок, образующийся в течение
железо или любая металлическая поверхность, состоящая из железа в качестве компонента. Это происходит при контакте металла с водой и воздухом. Ржавчина на самом деле является формой коррозии, которая имеет тенденцию быть особенно разрушительной и неприглядной. Поэтому особенно важно знать правильные методы, как остановить ржавчину на металле.По сути, если вам интересно, что такое ржавчина ? Это оксид железа , который образуется при окислении железа в металл.
Во-первых, вы должны убедиться, что ваши металлические предметы не заражены ржавчиной . На рынке есть несколько протоколов, которые помогут вам добавить защитную карьеру к металлу. Однако, если вы не знали о способах защиты вашего металла, они, возможно, уже начали ржаветь .
Однако, если вы не знали о способах защиты вашего металла, они, возможно, уже начали ржаветь .
В этой статье мы перечислим различные способы убедиться, что ржавчина не разрушит ваши металлические предметы.
Сначала обратимся к путям на как остановить ржавчину до ее начала.
1. Использование нержавеющей сталиВ последнее время нержавеющая сталь стала довольно популярной среди специалистов по металлоконструкциям. Основная причина этого заключается в том, что он был составлен для предотвращения ржавчины. По сути, это устойчивый к ржавчине . Сплав содержит железо, которое подвержено ржавчине. Однако в нем содержится более высокий процент хрома, который обладает высокой реакционной способностью.
Этот хром, присутствующий в нержавеющей стали, довольно быстро окисляется, образуя защитный слой оксида хрома на поверхности металла. В конечном счете, это предотвращает попадание кислорода воздуха в железо внутри нержавеющей стали и, следовательно, предотвращает возникновение ржавый металл .
Проще говоря, воронение — это пассивация стали, при которой она частично защищается от коррозии. Защитную отделку можно увидеть как черно-синее покрытие, отсюда и название. Техника воронения в основном используется оружейниками, производителями или владельцами оружия для улучшения его косметического вида.
Мало того, он обеспечивает определенную степень устойчивости к ржавчине или аналогичным воздействиям окружающей среды коррозия . Итак, если вам интересно, как предотвратить ржавчину , воронение поможет сделать это отличным способом.
3. Катодная защитаЕсли вам интересно , как предотвратить ржавчину на металле , этот конкретный процесс является одним из лучших вариантов. Процесс катодной защиты включал контроль коррозии, возникающей на металлических поверхностях.
Катодная защита осуществляется путем превращения металла в катод в электрохимической ячейке. Этот простой, но эффективный метод помогает защитить топливные трубопроводы, сталь вода, резервуары для хранения, водонагреватели, корпуса лодок и так далее.
Этот простой, но эффективный метод помогает защитить топливные трубопроводы, сталь вода, резервуары для хранения, водонагреватели, корпуса лодок и так далее.
Хотите знать , как остановить ржавчину на металле , сначала нужно позаботиться о трещинах и царапинах. Сломанная металлическая поверхность подвергается воздействию воды на более глубоких уровнях, чем обычно. Это приводит к накоплению влаги в глубине металла.
Чтобы избежать внезапных трещин или царапин, вы можете использовать холоднокатаную сталь по сравнению с горячекатаной, поскольку она позволяет создать более гладкую поверхность без текстуры, которая задерживает или удерживает воду.
5. Контроль влажности Правильный способ предотвратить ржавчину на металле – держать его подальше от влаги. Однако это возможно не во всех случаях. Если у вас есть металлические предметы, которые достаточно малы для хранения, убедитесь, что вы храните их в герметичных контейнерах.
С другой стороны, более крупные металлические предметы в доме можно защитить от ржавчины с помощью надлежащих кондиционеров, предотвращающих попадание влаги.
6. Держите металл чистым и сухимКак только начинается процесс ржавчины, коррозии , его трудно контролировать. Таким образом, лучше всего было бы убедиться, что он не подвергается воздействию комбинации кислорода + влаги. Всегда ищите поставщика, который обеспечивает надлежащую упаковку и доставку вашего имущества, чтобы предотвратить содержание влаги.
Кроме того, всегда держите металлический предмет в чистоте и сухости, используя сухие салфетки или кондиционеры, которые помогают продлить срок его службы с помощью защита от ржавчины .
7. Регулярное техническое обслуживание Прежде чем приступить к процессу технического обслуживания металла, важно знать, что вызывает ржавчину на металле .
Элементы, которые могут вызвать ржавчину, включают:
- Влажность (вода)
- Кислород
- Соль
Таким образом, поиск методов защиты металла от этих разрушающих факторов может помочь начать процесс технического обслуживания.
8. Правильное предварительное проектированиеПеред покупкой любого металла убедитесь, что он был разработан с учетом методов предотвращения ржавчины . Убедитесь, что вы воздерживаетесь от использования углеродистой стали , , которая, как известно, легко ржавеет.
Итак, если вы ищете нержавеющий металл для вашего автомобиля , который хранится вне , убедитесь, что вы рассмотрели его предварительный дизайн. С самого начала проверьте наличие компонентов с покрытием для долговечности и защиты от влаги.
9. Правильное хранение для предотвращения ржавчины Еще один фактор, гарантирующий, что ваш металл не ржавеет, – это правильное хранение. В то время как металлические предметы, предназначенные для использования на улице, нельзя хранить в течение длительного времени, другие можно поместить в герметичные контейнеры.
В то время как металлические предметы, предназначенные для использования на улице, нельзя хранить в течение длительного времени, другие можно поместить в герметичные контейнеры.
Кроме того, вы можете проверить компании, которые выбирают оптимальные складские помещения перед отправкой продукции ее законным потребителям. Нет смысла покрывать металлическую поверхность антикоррозионными средствами, если влага уже просочилась глубоко в металл, вызывая тем самым ржавчину.
4 основных способа предотвратить усиление коррозии
10. Используйте атмосферостойкую сталь Если вы не можете позволить себе нержавеющую сталь , вы можете использовать атмосферостойкую сталь, чтобы предотвратить дальнейшее ржавление. Атмосферостойкая сталь имеет химический состав, обладающий высокой устойчивостью к атмосферной коррозии, вызванной кислородом. По сравнению с мягкой сталью этот стальной вариант будет ржаветь, но не на самых глубоких уровнях.
Проще говоря, обычная сталь имеет тенденцию к образованию ржавчины, состоящей из крошечных пор на поверхности. Эти крошечные поры позволяют ржавчине проникать глубже в металл, что делает его невосприимчивым.0204 остановить процесс. Однако у атмосферостойкой стали заражается только внешний слой, так как он минимально пористый и не проникает глубже в металл.
11. Используйте оцинкованный металлЕсли вы только что увидели начало коррозии на вашем металле, вы можете получить покрытие из цинка. Это покрытие называют оцинкованным металлом. Это цинковое покрытие помогает предотвратить коррозию и ржавление намного дольше, чем краска.
Оцинкованная сталь прослужит до 50 лет. Тем не менее, коричневая гниль в конце концов появится. Мягко говоря, ни один металл не может быть на 100% свободен от ржавчины в течение длительного времени. В конце концов, ржавчина настигает со временем.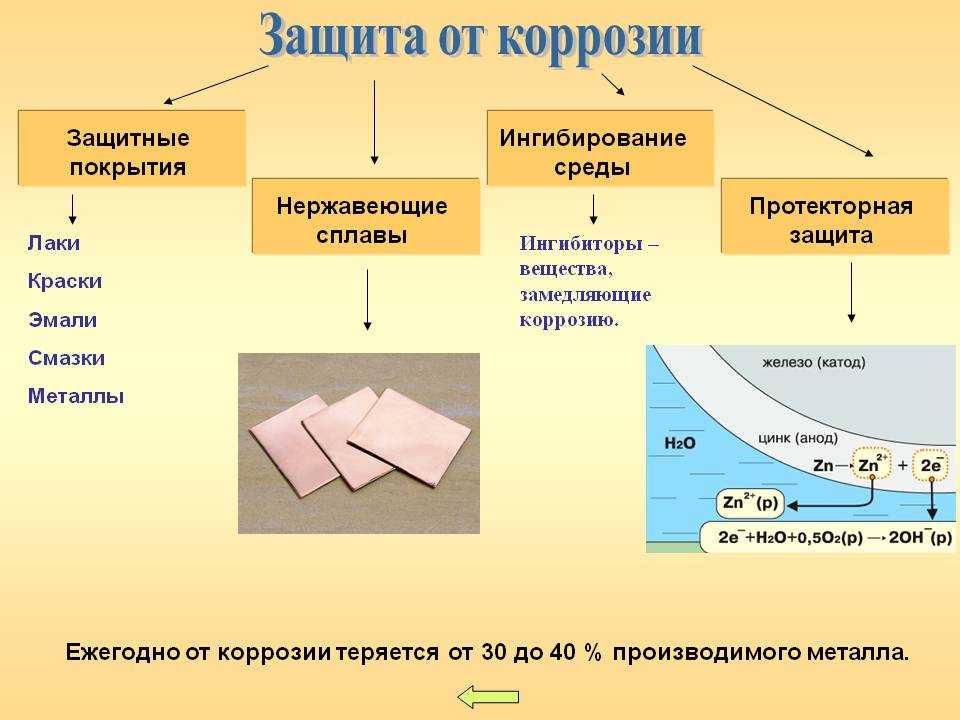 Тем не менее, оцинкованный металл обеспечивает отсутствие ржавчины в течение 50 лет и более.
Тем не менее, оцинкованный металл обеспечивает отсутствие ржавчины в течение 50 лет и более.
При попытке предотвратить появление ржавчины вы можете попробовать несколько профилактических покрытий, таких как масляное покрытие, сухое покрытие, окраска, порошковое покрытие, пенопласт и многое другое.
- Масляное покрытие работает на основе того, что масло и вода не смешиваются, и, следовательно, образует защитный слой на металле. Это покрытие проникает глубоко в оксидную воду металла и помогает стабилизировать его.
- На рынке имеется несколько продуктов, которые можно использовать для сухого покрытия для предотвращения ржавчины. Процесс сухого покрытия помогает создать барьер на металлических деталях, не оставляя следов. Он используется для эффективного хранения, транспортировки и многого другого, не разрушаясь от ржавчины.
- Покраска металла также замедляет процесс коррозии, предотвращая попадание влаги внутрь металла.

- Порошковое покрытие — это процесс нанесения слоя винила, акрила, эпоксидной смолы или подобных веществ. Эти вещества помогают предотвратить просачивание влаги в металл и, следовательно, предотвращают ржавление.
- Fozz представляет собой процедуру нанесения сбалансированной смеси фосфорной кислоты с другими химическими веществами, наполнителями и смачивающими агентами. Этот процесс помогает растворить существующую ржавчину, предотвращая дальнейшее разрушение. По сути, Fozz представляет собой грунтовку, которая подготавливает металл к нанесению краски.
Если ваш металлический предмет был заражен ржавчиной, использование ингибиторов ржавчины может помочь предотвратить дальнейшее ухудшение состояния. Эти ингибиторы помогают замедлить процесс окисления металлов после воздействия на них воды и кислорода.
Тем не менее, помните, что необходимо очистить существующую ржавчину наждачной бумагой перед нанесением ингибиторов ржавчины, чтобы предотвратить дальнейшее ухудшение состояния металла.
1. Имеется ли какое-либо покрытие для предотвращения ржавчины?
Да. Ржавчину можно предотвратить, используя цинк для цинкования металла. Это достигается путем горячего цинкования или методом гальваники.
2. Помогает ли WD-40 предотвратить ржавление?
Да, WD-40 помогает предотвратить ржавчину.
Вы можете распылить WD-40 на металлические детали, чтобы избавиться от нежелательной грязи или мусора. Это также помогает уменьшить трение или любой износ, который может привести к коррозии или ржавчине.
3. Помогает ли окраска предотвратить ржавление металлов?
Покраска или гальваническое покрытие помогают предотвратить воздействие молекул воды на металлическую поверхность.
Этот процесс помогает противодействовать взаимодействию кислорода с металлом и предотвращает появление ржавчины с течением времени.
4. Какой вариант масла может предотвратить ржавчину?
Льняное масло идеально подходит для очистки и нанесения антикоррозионного покрытия на металлическую поверхность. Нанесение этого масла тонким слоем на места ржавчины минимум на 10 минут гарантирует, что металл не ухудшится в дальнейшем.
5. Нужно ли красить уже проржавевшие металлы?
Перед тем, как закрасить ржавый металл, убедитесь, что вы очистили рыхлую ржавчину и отслоившуюся краску.
Очистите ржавые участки металла с помощью мягкой проволочной щетки или наждачной бумаги.
Наконец, прежде чем наносить краску, нанесите на нее слой грунтовки, чтобы эффект сохранялся в течение года.
Yubi Steel Industry является одним из поставщиков высококачественного металла в небольших количествах из Китая. Мы являемся вашим экспертом по труднодоступной специальной стали и предоставляем качественное обслуживание клиентов и продукцию с 2010 года.
Мы являемся вашим экспертом по труднодоступной специальной стали и предоставляем качественное обслуживание клиентов и продукцию с 2010 года.
Мы поставляем широкий спектр металлов для различных применений. В нашем ассортименте: нержавеющая сталь , легированная сталь , оцинкованная сталь , инструментальная сталь , алюминий , латунь , бронза и медь .
Наша горячекатаная и холоднокатаная сталь доступна в широком диапазоне форм, включая прутки, трубы, листы и плиты. Мы можем спроектировать и изготовить металл по вашим точным спецификациям.
Заключительные мыслиРжавчина, если ее игнорировать, может быстро стать серьезной проблемой.
Это в конечном итоге разрушает стабильность и функциональность критически важного оборудования.
Кроме того, ремонт или замена проржавевшего металла может стоить вам 1000 долларов.
Правильный путь – действовать, когда вы видите хотя бы намек на красный цвет оксида на вашем металле, и предотвращать дальнейшее ухудшение с помощью методов, упомянутых выше.
Я что-то пропустил или какие-то вопросы о том, как остановить ржавчину на металле?
Дайте мне знать в комментариях или на LinkedIn.
17.6: Коррозия – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 38308
- ОпенСтакс
- ОпенСтакс
Цели обучения
- Дать определение коррозии
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разрушение металлов в результате электрохимического процесса. Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общая стоимость коррозии в Соединенных Штатах значительна и оценивается более чем в полтриллиона долларов в год.
Общая стоимость коррозии в Соединенных Штатах значительна и оценивается более чем в полтриллиона долларов в год.
Изменение цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по высоте, осанке и уникальному сине-зеленому цвету. Когда эта статуя была впервые доставлена из Франции, ее внешний вид не был зеленым. Он был коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно окислялась на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди(I) (\(\ce{Cu_2O}\)), который имеет красный цвет, а затем до оксида меди(II), который имеет черный цвет.
\[\ce{2Cu(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)}} \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{black}}{\ce{2CuO(s)}} \nonumber \]
Уголь, который часто был с высоким содержанием серы, широко сжигался в начале прошлого века. В результате триоксид серы, углекислый газ и вода вступили в реакцию с \(\ce{CuO}\).
В результате триоксид серы, углекислый газ и вода вступили в реакцию с \(\ce{CuO}\).
\[\ce{2CuO(s)}+\ce{CO2(g)} + \ce{h3O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_2CO3(OH)2 (s)}} \номер \]
\[\ce{3CuO(s)}+\ce{2CO2(g)}+\ce{h3O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)_2 (OH)2(s)}} \nonumber \]
\[\ce{4CuO(s)}+\ce{SO3(g)}+\ce{3h3O(l)} \rightarrow \underset{\text {green}}{\ce{Cu_4SO_4(OH)6(s)}} \nonumber \]
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня. К счастью, образование патины создало на поверхности защитный слой, предотвращающий дальнейшую коррозию медной оболочки. Формирование защитного слоя — это форма пассивации, которая обсуждается далее в следующей главе.
Рисунок \(\PageIndex{1}\): (a) Статуя Свободы покрыта медной кожей и изначально была коричневой, как показано на этой картине. (b) Воздействие элементов привело к образованию сине-зеленой патины, наблюдаемой сегодня. Возможно, самым известным примером коррозии является образование ржавчины на железе. Железо ржавеет под воздействием кислорода и воды. Основные этапы ржавления железа, по-видимому, включают следующее. При контакте с атмосферой железо быстро окисляется. 9+}_{(водный раствор)} \номер \]
Железо ржавеет под воздействием кислорода и воды. Основные этапы ржавления железа, по-видимому, включают следующее. При контакте с атмосферой железо быстро окисляется. 9+}_{(водный раствор)} \номер \]
Количество молекул воды является переменной величиной, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Рисунок \(\PageIndex{2}\): Как только краска царапается на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость спонтанной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для растапливания льда и снега или в соленой воде. показан тонкими фиолетовыми слоями, помеченными “Слой краски” на его верхней и нижней поверхностях. Пробел в верхнем фиолетовом слое в левом верхнем углу диаграммы помечен как «Катодный участок». Синяя капля с надписью “вода” располагается над зазором. Изогнутая стрелка проходит из пространства над каплей на поверхность серой области и в каплю воды. Основание стрелки помечено как “O нижний индекс 2” а кончик стрелки помечен “Н подстрочным индексом 2 О.” Зазор справа и в нижней части серой области показывает, что часть серой области исчезла из области под фиолетовым слоем. Капля воды закрывает этот зазор и выходит в открытое пространство в сером прямоугольнике. Метка “F e верхний индекс 2 положительный” находится в центре капли. Изогнутая стрелка указывает от края серой области внизу к метке. Вторая изогнутая стрелка идет от положительной стрелки F e верхнего индекса 2 к ржаво-коричневому участку на нижней поверхности пурпурного слоя на краю капли воды. Изогнутая стрелка проходит от нижнего индекса O 2 за пределы капли внутрь капли до ржаво-коричневого куска. Серая область в нижней правой части диаграммы помечена как «Анодное место».
Синяя капля с надписью “вода” располагается над зазором. Изогнутая стрелка проходит из пространства над каплей на поверхность серой области и в каплю воды. Основание стрелки помечено как “O нижний индекс 2” а кончик стрелки помечен “Н подстрочным индексом 2 О.” Зазор справа и в нижней части серой области показывает, что часть серой области исчезла из области под фиолетовым слоем. Капля воды закрывает этот зазор и выходит в открытое пространство в сером прямоугольнике. Метка “F e верхний индекс 2 положительный” находится в центре капли. Изогнутая стрелка указывает от края серой области внизу к метке. Вторая изогнутая стрелка идет от положительной стрелки F e верхнего индекса 2 к ржаво-коричневому участку на нижней поверхности пурпурного слоя на краю капли воды. Изогнутая стрелка проходит от нижнего индекса O 2 за пределы капли внутрь капли до ржаво-коричневого куска. Серая область в нижней правой части диаграммы помечена как «Анодное место». Стрелка проходит от анодного участка к катодному участку, который помечен как «e верхний индекс отрицательный».
Стрелка проходит от анодного участка к катодному участку, который помечен как «e верхний индекс отрицательный».Один из способов уберечь железо от коррозии — красить его. Слой краски предотвращает контакт воды и кислорода, необходимых для образования ржавчины, с железом. Пока краска остается неповрежденной, железо защищено от коррозии.
Другие стратегии включают сплав железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим количеством хрома. Хром имеет тенденцию собираться вблизи поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное или оцинкованное железо использует другую стратегию. Цинк легче окисляется, чем железо, потому что у цинка более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, он является более активным металлом. Таким образом, даже если цинковое покрытие поцарапается, цинк все равно окислится раньше железа. Это говорит о том, что этот подход должен работать и с другими активными металлами.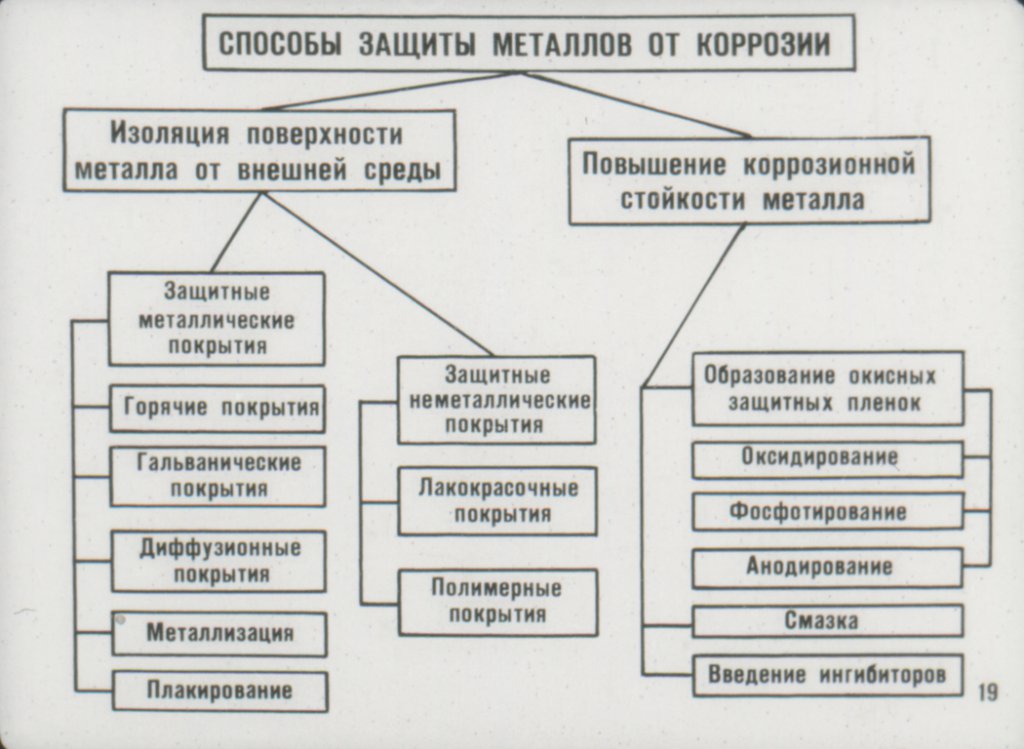
 Эти стрелки вместе обозначены как «Защитный ток».
Эти стрелки вместе обозначены как «Защитный ток».Еще один важный способ защитить металл — сделать его катодом в гальваническом элементе. Это катодная защита, которую можно использовать не только для железа, но и для других металлов. Например, ржавчину подземных резервуаров и труб для хранения железа можно предотвратить или значительно уменьшить, соединив их с более активным металлом, таким как цинк или магний. Это также используется для защиты металлических частей водонагревателей. Более активные металлы (с более низким восстановительным потенциалом) называются жертвенными анодами, потому что по мере их износа они подвергаются коррозии (окислению) на аноде. Защищаемый металл служит катодом и поэтому не окисляется (корродирует). Когда аноды должным образом контролируются и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Резюме
Коррозия – это разрушение металла, вызванное электрохимическим процессом. Ежегодно тратятся большие суммы денег на устранение последствий коррозии или ее предотвращение. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, образующийся на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо корродирует (образует ржавчину) при воздействии воды и кислорода. Ржавчина, образующаяся на железном металле, отслаивается, обнажая свежий металл, который также подвергается коррозии. Одним из способов предотвращения или замедления коррозии является нанесение покрытия на металл. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны, если их поцарапать. Оцинкованное или гальванизированное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить.
Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, образующийся на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо корродирует (образует ржавчину) при воздействии воды и кислорода. Ржавчина, образующаяся на железном металле, отслаивается, обнажая свежий металл, который также подвергается коррозии. Одним из способов предотвращения или замедления коррозии является нанесение покрытия на металл. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны, если их поцарапать. Оцинкованное или гальванизированное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк окислится раньше железа. Еще одним методом защиты металлов является катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (жертвенный анод), электрически соединяется с металлом, который необходимо защитить. Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Более активный металл является жертвенным анодом и является анодом в гальваническом элементе. «Защищенный» металл является катодом и остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Глоссарий
- катодная защита
- метод защиты металла с помощью расходуемого анода и эффективного получения металла, который нуждается в защите катода, таким образом предотвращая его окисление
- коррозия
- деградация металла посредством электрохимического процесса
- оцинкованное железо
- способ защиты железа путем покрытия его цинком, который будет окисляться раньше железа; оцинкованное железо
- расходуемый анод
- более активный, недорогой металл, используемый в качестве анода в катодной защите; часто изготавливается из магния или цинка
Эта страница под названием 17. 6: Corrosion распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
6: Corrosion распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги
- катодная защита
- коррозия
- оцинкованное железо
- протекторный анод
- источник@https://openstax.
 org/details/books/chemistry-2e
org/details/books/chemistry-2e
Как драгоценные металлы могут предотвратить коррозию
Драгоценные металлы хорошо известны своей эстетической привлекательностью, но они имеют гораздо большее значение, чем их внешний вид. Драгоценные металлы, к которым относятся золото, серебро и платина, широко используются в технике и промышленности. В то время как драгоценные металлы обладают привлекательным блеском, который делает их визуально привлекательными, они также обладают большой практической ценностью — лишь некоторые из свойств семейства драгоценных металлов — это химическая стабильность, электропроводность и пластичность. Однако одной из наиболее примечательных особенностей драгоценных металлов является их способность противостоять коррозии.
В Sharretts Plating Company мы можем порекомендовать вам правильные драгоценные металлы, которые помогут предотвратить коррозию в вашем следующем проекте. Читайте дальше, чтобы узнать больше о коррозии во всех ее формах и использовании драгоценных металлов для создания устойчивых к коррозии продуктов.
Драгоценные металлы чаще всего определяются как встречающиеся в природе металлы, которые относительно редки и менее химически активны, чем другие металлы. Пластичные и блестящие драгоценные металлы часто используются в эстетических целях и обычно используются в качестве слитков. Однако драгоценные металлы также высоко ценятся за их химическую стабильность, электропроводность и коррозионную стойкость.
Семейство драгоценных металлов состоит из трех основных подгрупп:
- Золото и сплавы золота: Золото является чрезвычайно инертным драгоценным металлом и не окисляется в присутствии нормальных условий окружающей среды. Чрезвычайно мягкий и пластичный металл, чистое золото часто используется в качестве футеровки или гальванического покрытия в электронике. Золото также может быть сплавлено с другими металлами для увеличения его прочности, что позволяет использовать его в отдельно стоящих компонентах в аэрокосмической и электронной промышленности.

- Серебро и сплавы серебра: Серебро имеет самую высокую тепло- и электропроводность среди всех металлов, а также легко сплавляется с другими металлами, создавая термостабильные сплавы для промышленного применения. Поскольку оно дешевле других драгоценных металлов, серебро является популярной альтернативой для тех, кто стремится снизить затраты. Серебряное покрытие чаще всего встречается в автомобильной, электронной и электротехнической промышленности.
- Платиновые металлы и сплавы: Металлы платиновой группы чрезвычайно редки и включают платину, палладий, родий, рутений, иридий и осмий, которые встречаются в природе в одной и той же руде. Эти серебристо-белые металлы чрезвычайно инертны и стабильны, с некоторыми различиями в пластичности и прочности. Все они сохраняют свою стабильность при высоких температурах, что делает их идеальными для различных применений в автомобильной и аэрокосмической промышленности.
Любой из этих металлов можно нанести гальваническим способом на поверхность, чтобы придать изделию некоторые из их свойств. В SPC мы предлагаем гальванопокрытие для стоек и бочек для драгоценных металлов.
В SPC мы предлагаем гальванопокрытие для стоек и бочек для драгоценных металлов.
Коррозия, образованная от латинского слова “corrodere”, означающего “разгрызать на куски”, в общих чертах определяется как износ материала с течением времени. Применительно к металлам коррозия определяется как электрохимическая реакция между металлом и окружающей средой, в результате которой металл переходит из высокоэнергетического состояния в низкоэнергетическое. Обычно это происходит в результате атмосферной коррозии в результате процесса, называемого окислением, когда металл вступает в реакцию с кислородом и водой в атмосфере. Например, железо естественным образом соединяется с кислородом и водой с образованием гидратированных оксидов железа или «ржавчины». Воздействие кислоты или высоких уровней электролитов также может привести к химическим реакциям, ведущим к коррозии, но атмосферное окисление является наиболее распространенной формой коррозии.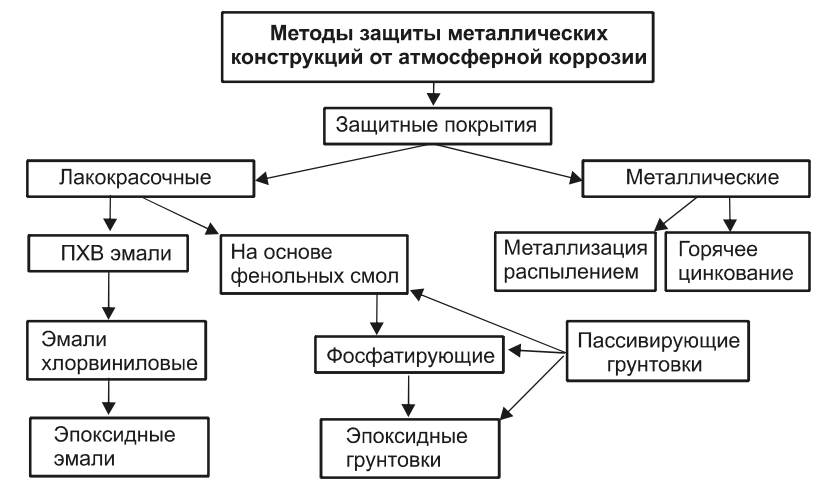 На защиту от атмосферной коррозии приходится примерно 50 % всех затрат на защиту от коррозии.
На защиту от атмосферной коррозии приходится примерно 50 % всех затрат на защиту от коррозии.
Дополнительные факторы, влияющие на скорость коррозии, в том числе:
- Температура: Скорость химических реакций имеет тенденцию увеличиваться с ростом температуры, а это означает, что высокотемпературные материалы в коррозионных средах подвержены более быстрой коррозии.
- Обработка поверхности: Обработка поверхности материала определяет степень коррозии — шероховатые или грязные поверхности, а также небольшие щели могут задерживать корродирующие вещества, вызывая их более быстрое и агрессивное действие.
- Электричество: Воздействие электрического тока может привести к более быстрой коррозии материала с течением времени из-за потери электронов из материала.
Покрытие соответствующими материалами, включая драгоценные металлы, может помочь снизить влияние вышеуказанных факторов на скорость коррозии, эффективно защищая материал от коррозии.
В зависимости от конкретной причины коррозии в сочетании с перечисленными выше факторами коррозия может проявляться в одной из восьми основных форм:
- Равномерное воздействие: Наиболее распространенная форма коррозии, равномерное воздействие характеризуется равномерным распространением коррозии по поверхности материала. Хотя на эту форму коррозии приходится наибольшее объемное разрушение металла, это одна из самых простых форм коррозии, с которой можно справиться с помощью соответствующих покрытий.
- Гальваническая коррозия: Когда два разнородных металла находятся в физическом или электрическом контакте, их близость может создавать поток электронов, в результате чего менее устойчивый к коррозии металл подвергается коррозии с большей скоростью, а более устойчивый к коррозии металл испытывает более низкую скорость коррозии.
- Щелевая коррозия: Коррозия часто возникает быстрее в щелях в материале, где коррозионное вещество задерживается в течение длительного периода времени.
 Щелевая коррозия обычно возникает в местах соединений, отверстий и точек заклепок.
Щелевая коррозия обычно возникает в местах соединений, отверстий и точек заклепок. - Точечная коррозия: Точечная коррозия — это локальная форма коррозии, которая приводит к образованию отверстий в материале, и является одной из наиболее разрушительных форм коррозии, снижающей целостность конструкции при незначительной потере веса конструкции. Это одна из самых сложных форм коррозии, и она сравнительно непредсказуема.
- Межкристаллитная коррозия: Плохолегированные материалы могут при определенных условиях образовывать межкристаллитную коррозию, что приводит к коррозионным воздействиям на границы зерен, снижающим прочность сплава.
- Селективное выщелачивание: В этой форме коррозии коррозия функционально удаляет один элемент из твердого сплава, чаще всего цинк из латунных сплавов.
- Эрозионная коррозия: Эрозионная коррозия — это увеличение скорости коррозии, вызванное движением между поверхностью и агрессивной жидкостью.
 Это движение приводит к образованию канавок, волн и отверстий на поверхности материала, обычно появляющихся в направлении движения.
Это движение приводит к образованию канавок, волн и отверстий на поверхности материала, обычно появляющихся в направлении движения. - Коррозионное растрескивание под напряжением: Растягивающее напряжение снижает количество энергии, необходимой для того, чтобы коррозия закрепилась в материале, а при наличии растягивающего напряжения и коррозионной среды могут образовываться коррозионные трещины под напряжением. Обычно они выглядят как мелкие трещины на неповрежденной металлической поверхности.
Изменения конструкции изделия, включая добавление антикоррозионного покрытия, могут эффективно предотвратить большинство перечисленных выше видов коррозии.
Последствия коррозии и почему важно их предотвращатьКоррозия может иметь серьезные последствия для функциональности и безопасности продуктов и со временем может привести к увеличению затрат. Некоторые из наиболее частых последствий коррозии включают:
- Потеря эффективности: Коррозия может снизить эффективность продукта, уменьшая количество функционального материала до такой степени, что продукт больше не может обеспечивать стандартную функциональность.
 Кроме того, машины с проржавевшим оборудованием, возможно, придется останавливать для ремонта, что снижает общую эффективность компании.
Кроме того, машины с проржавевшим оборудованием, возможно, придется останавливать для ремонта, что снижает общую эффективность компании. - Соображения безопасности: Коррозия может снизить структурную или функциональную целостность материала до такой степени, что он разрушается или выходит из строя, травмируя операторов и пользователей. Кроме того, отверстия, вызванные коррозией, могут привести к утечке токсичных материалов в окружающую среду, что может нанести вред здоровью или окружающей среде.
- Внешний вид: Ржавчина и коррозия непривлекательны с эстетической точки зрения и могут заставить зрителей меньше думать о продукте или выразить беспокойство по поводу его безопасности.
- Затраты на ремонт: Проржавевшее оборудование и материалы необходимо модифицировать, отремонтировать или заменить, но это не единственные детали, на которые может повлиять коррозия. Части и оборудование, прилегающие к корродированному материалу, могут быть повреждены в результате косвенной коррозии, что еще больше увеличивает затраты на ремонт и сокращает расчетный срок службы.

Все вышеперечисленные факторы могут снизить прибыль компании за счет увеличения затрат и сокращения продаж. Покрытие может помочь предотвратить коррозию, тем самым снижая эти затраты — в то время как дополнительные затраты, связанные с антикоррозионным покрытием, могут привести к увеличению первоначальных затрат, они меркнут по сравнению с затратами, понесенными коррозионным повреждением.
Почему драгоценные металлы так эффективны в предотвращении коррозии?Почти все металлы подвержены коррозии в обычных условиях окружающей среды. Исключение составляют драгоценные металлы.
Драгоценные металлы отличаются не только своей высокой стоимостью — драгоценные металлы также известны своей стабильностью. В гальваническом ряду металлы сортируются по иерархической шкале от благородных до активных. Активные металлы имеют тенденцию больше взаимодействовать с окружающей средой, тогда как благородные металлы более стабильны. Металлы в семействе драгоценных металлов находятся на благородном конце этой шкалы, а это означает, что они более устойчивы к взаимодействию с другими химическими веществами и, следовательно, более устойчивы к коррозии.
Хотя драгоценные металлы относятся к благородным, термины «драгоценный металл» и «благородный металл» не являются синонимами. Определение благородного металла варьируется в зависимости от области исследования — например, в атомной физике благородные металлы включают только медь, серебро и золото, поскольку они имеют полностью заполненные d-подоболочки, что делает их более стабильными. Однако в самом широком определении обе группы включают золото, серебро, платину, палладий, родий, рутений, иридий и осмий, а благородные металлы также включают ртуть, рений и медь. Эти последние три элемента не обладают коррозионной стойкостью, поэтому важно четко различать драгоценные и благородные металлы.
Как предотвратить коррозию драгоценных металлов Одним из лучших способов предотвращения коррозии является покрытие драгоценными металлами и их сплавами. Тем не менее, важно выбрать правильный тип драгоценного металла для вашего применения и выбрать метод гальванического покрытия и толщину, соответствующие вашим целям. При принятии решения важно учитывать качества, которые вы ищете для своего покрытия, а также применение.
При принятии решения важно учитывать качества, которые вы ищете для своего покрытия, а также применение.
Ниже приведены наиболее важные факторы, которые следует учитывать при выборе антикоррозионного покрытия:
1. Материал покрытияПокрытия из драгоценных металлов изолируют подложку от окружающей среды, создавая гладкую защитную поверхность, которая предотвращает попадание воды и кислорода на основной материал. Поскольку драгоценные металлы немного различаются по своим электрохимическим и физическим свойствам, некоторые из них лучше подходят для определенных применений, чем другие. В этом списке драгоценных металлов представлены сильные стороны каждого элемента, а также его наиболее распространенные области применения:
.- Золото: Золото обладает тепло- и электропроводностью и обладает высокой стабильностью в качестве коррозионностойкого покрытия. Он часто используется в электронике, но имеет тенденцию быть более дорогим, чем другие антикоррозионные покрытия.

- Серебро: Серебро является менее дорогим материалом для покрытия по сравнению с другими драгоценными металлами и обладает превосходной электротермической проводимостью. Он используется в производстве электроэнергии и автомобильных приложениях.
- Платина: Платина имеет высокую температуру плавления, но термически стабильна, что делает ее идеальной для применения при высоких температурах. Типичные области применения включают электронику, электроэнергетику и аэрокосмическую промышленность.
- Родий: Родий является наиболее электротермически проводящим из платиновой группы и сохраняет высокую отражательную способность, что делает его идеальным материалом для зеркал в высокотемпературных применениях. Родий чаще всего используется в аэрокосмической и электронной промышленности.
- Рутений: Рутений часто используется в качестве легирующего агента, особенно из-за его кислотостойких свойств.
 Электронная промышленность в основном использует рутений для производства электрических контактов.
Электронная промышленность в основном использует рутений для производства электрических контактов. - Палладий: Палладий — популярная альтернатива золоту. В сплаве с никелем он менее хрупкий и лучше поддается пайке. В сплаве с кобальтом он более прочен и электропроводен. В целом этот металл и его сплавы часто используются в электронной промышленности для изготовления контактов на печатных платах.
Компания Sharretts Plating может помочь вам оценить ваш проект и определить лучший материал для покрытия для вашего применения.
2. Качество основы Эффективность любого типа покрытия сильно зависит от того, насколько хорошо подложка подготовлена для покрытия. Если подложка покрыта ямками, кратерами, загрязнена или иным образом повреждена, покрытие либо образует поверхностные дефекты, либо не будет должным образом сцепляться с поверхностью подложки. SPC может помочь вам оценить качество вашего субстрата и внести предложения по его улучшению.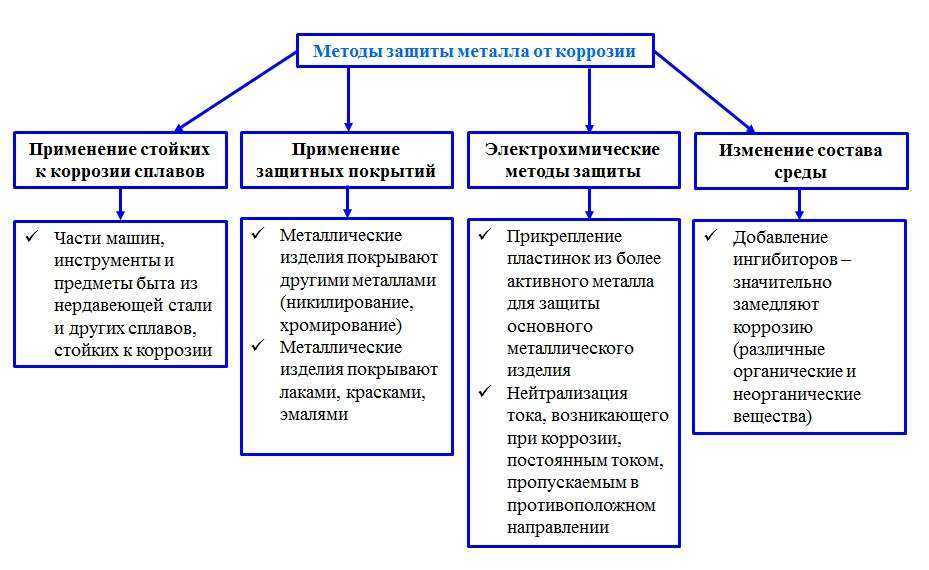 Мы также используем тщательный процесс подготовки к гальваническому покрытию, чтобы гарантировать, что конечный продукт имеет максимально возможное качество.
Мы также используем тщательный процесс подготовки к гальваническому покрытию, чтобы гарантировать, что конечный продукт имеет максимально возможное качество.
Толщина покрытия из драгоценного металла оказывает значительное влияние на прочность и долговечность конечного продукта. Более тонкие отложения могут не полностью покрывать подложку, позволяя коррозионным молекулам пробить поверхность и атаковать подложку под ней. С другой стороны, слишком толстые покрытия могут быть неоправданно дорогими и негативно влиять на функциональность продукта. Специалисты SPC могут обсудить наилучший диапазон толщины покрытия для вашего применения и даже могут предложить дополнительные слои неблагородных материалов для повышения эффективности конечного продукта.
Выберите SPC для покрытия драгоценными металлами Если вы рассматриваете покрытие драгоценными металлами в качестве варианта для вашего следующего проекта, чтобы предотвратить коррозию и снизить затраты на ремонт, компания Sharretts Plating может помочь вам начать работу.


 Эти разновидности стали принято называть легированными.
Эти разновидности стали принято называть легированными.

 Обучение для студентов выпускных курсов…
Обучение для студентов выпускных курсов… ..
..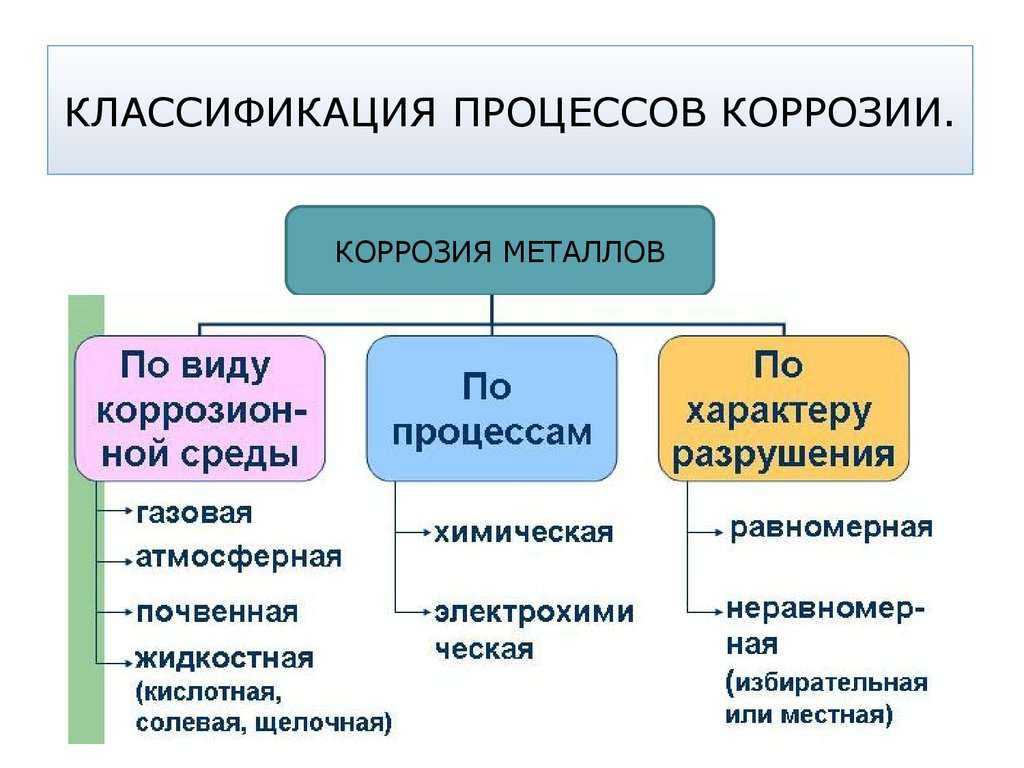
 д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди – усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1)
д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди – усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). (слайд №17, приложение 1) Что разрушится раньше – крышка или заклепка? Почему?
Что разрушится раньше – крышка или заклепка? Почему?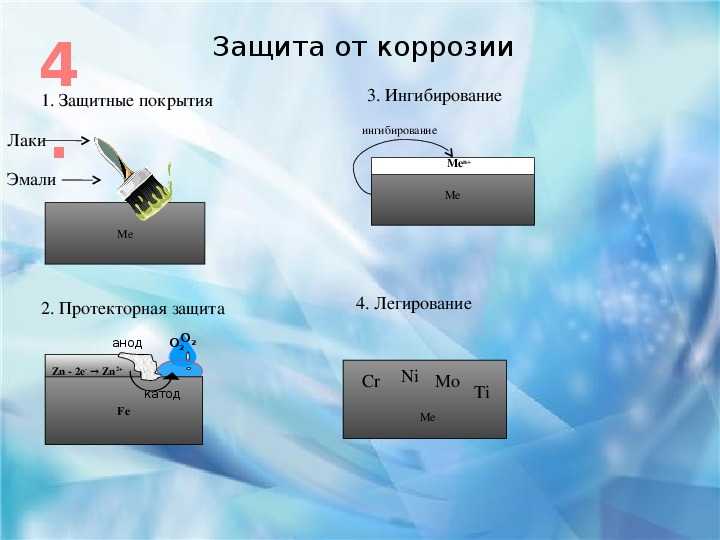
 11
11
 org/details/books/chemistry-2e
org/details/books/chemistry-2e
 Щелевая коррозия обычно возникает в местах соединений, отверстий и точек заклепок.
Щелевая коррозия обычно возникает в местах соединений, отверстий и точек заклепок. Это движение приводит к образованию канавок, волн и отверстий на поверхности материала, обычно появляющихся в направлении движения.
Это движение приводит к образованию канавок, волн и отверстий на поверхности материала, обычно появляющихся в направлении движения. Кроме того, машины с проржавевшим оборудованием, возможно, придется останавливать для ремонта, что снижает общую эффективность компании.
Кроме того, машины с проржавевшим оборудованием, возможно, придется останавливать для ремонта, что снижает общую эффективность компании.

 Электронная промышленность в основном использует рутений для производства электрических контактов.
Электронная промышленность в основном использует рутений для производства электрических контактов.