Признаки ржавления железа: Физические и химические явления. Признаки химических реакций
alexxlab | 20.10.2018 | 0 | Разное
Физические и химические явления. Признаки химических реакций
Различные изменения, происходящие с веществами, называются явлениями.
Пример. Испарение воды, плавление стекла, ржавление металлов — явления.
Явления делятся на физические и химические.
Физические явления — это явления, при которых не происходит превращения одних веществ в другие.
Пример. Изменение формы тела или агрегатного состояния вещества — физические явления.
Химические явления — это явления, в результате которых из одних веществ образуются другие, новые вещества с новыми химическими и физическими свойствами. Химические явления иначе ещё называются химическими реакциями или химическими превращениями.
Пример. Ржавление железа, горение веществ, разложение воды при высокой температуре на водород и кислород — химические явления.
О веществах, вступающих в химическую реакцию, говорят, что они реагируют, взаимодействуют между собой или одни вещества превращаются в другие.
Вещества, которые вступают в химическую реакцию, называются исходными веществами или реагентами. Новые вещества, которые образуются в результате химической реакции, называются продуктами реакции.
Пример. При взаимодействии натрия и воды образуются гидроксид натрия и водород. Натрий и вода — реагенты, а гидроксид натрия и водород — продукты реакции.
Признаки химических реакций
О том, что происходит химическая реакция можно узнать по внешним признакам. Возможные признаки протекания химических реакций:
- изменение цвета;
- образование или растворение осадка;
- выделение газа;
- появление или изменение запаха;
- выделение или поглощение теплоты;
- излучение света.

Пример. Горение веществ часто сопровождается излучением света, выделением запаха и теплоты.
Что такое ржавчина. Виды и причины коррозии
Содержание:
- Виды коррозии различных металлов
- От чего может ржаветь металл?
- Способы защиты металла от коррозии
- Равномерная коррозия. Характеризуется разрушением металла по всей поверхности. Встречается на металлах или сплавах с однофазной структурой.
- Местная коррозия. Охватывает отдельные участки поверхности. Данный вид можно наблюдать на металлах с однофазной и многофазной структурой. Причиной становится механический дефект (скол, зазубрина, царапина).
- Межкристаллитная. Разрушает металл по границам зерен. К слову, это самый коварный вид коррозии, поскольку внешних признаков на начальных этапах может не быть. Разрушение происходит внутри металла. Более подвержены межкристаллитной коррозии сплавы алюминия, хромоникелевые стали.
- Легирование. Способ подразумевает введение в сплав элементов, предотвращающих или замедляющих коррозию. В сталь обычно добавляют титан, никель.
- Создание окисных пленок искусственным путем при помощи оксидирования или фосфатирования. Введение хрома способствует возникновению оксида, который «пленкой» покрывает поверхность и уберегает ее от негативного воздействия коррозийных факторов.
- Обработка внешней среды.
 Суть этого метода в удалении вредоносных составляющих окружения. Например, нейтрализовать воздействие воды можно добавлением 0,5% бихромата калия.
Суть этого метода в удалении вредоносных составляющих окружения. Например, нейтрализовать воздействие воды можно добавлением 0,5% бихромата калия. - Катодное или анодное покрытие поверхности. Метод широко применяется в промышленности, и хорош, когда возобновить покрытие не предоставляется возможным (например, в подземных коммуникациях, свайных фундаментах).
- Неметаллическое покрытие. К этому методу относят покрытие лаками, красками, полимерными материалами (эпоксидной смолой, полиэтиленом, поливинилхлоридом).
- Электрическая защита. Заключается в подключении металлического изделия к источнику тока (отрицательному полюсу).
- Протектор. В роли протектора выступает материал, имеющий больший электроотрицательный потенциал, чем металл, который необходимо защитить. Для стали такой защитой выступают цинк, кадмий.
Коррозия металла – это разрушение металлов или сплавов в результате электрохимического взаимодействия с окружающей средой. Следствием процесса является ухудшение качеств материала и его дальнейшее разрушение. Ущерб от коррозии огромен, поскольку страдает не только техника, но и сооружения, коммуникации государственного значения. Производители металлопродукции лучше других знают масштабы урона. Приобрести качественный металл, в том числе нержавеющий прокат, в Санкт-Петербурге и области можно по телефону +7 (812) 334-91-51.
Виды коррозии различных металлов
По степени распространения выделяют следующие виды коррозии металлов:
От чего может ржаветь металл
Ржавчина – это результат окисления железа. Только изделия из железа и его сплавов подвержены такому разрушению. Распознать ржавчину можно по характерному рыхлому налету от желтого до красного цвета. От чего же он возникает?
От чего же он возникает?
Причиной желтой ржавчины является наличие воды, поэтому она чаще образуется на изделиях и объектах, находящихся под водой. Красная ржавчина проявляется при одновременном воздействии воды и кислорода. Это самый распространенный вариант ржавления железа, который можно встретить на элементах строительных конструкций, сооружений, транспортных средствах. Коричневая ржавчина не нуждается в воде. Она встречается довольно редко.
При незначительном содержании кислорода и отсутствии воды образуется черная ржавчина. Скорость распространения ее невысока, и она не оказывает большой угрозы для изделий с непродолжительным сроком эксплуатации.
Кислород и вода – не единственные причины, от чего может ржаветь металл. Если к их воздействию присоединяются разрушительные соли – процесс ржавления заметно ускоряется. Соль может находиться в средствах бытовой химии, в зимний период на дорогах, как способ борьбы со льдом, снегом. Спровоцировать быстрое разрушение железа могут блуждающие токи. Пагубному их воздействию подвержен наземный электротранспорт. Такие виды коррозии называют электрохимическими.
Способы защиты металла от коррозии
Ржавление или коррозия железа – это не только эстетическая проблема изделия или конструкции. Появление ржавчины свидетельствует об изменении свойств металла: уменьшении прочности, пластичности, возможной деформации.
Для защиты используют следующие методы:
Ржавый, покрытый налетом металл требует немедленных действий для остановки распространения разрушения. В некоторых случаях сделать это не удается, поэтому лучше заранее позаботиться о защите металлических изделий и конструкций, используя изложенные выше способы.
Признаки химических реакций | Образовательная социальная сеть
Урок-лабораторная работа в 8 классе
«Признаки химических реакций»
ХОД УРОКА:
В природе с момента ее зарожденья
Всегда с веществами идут превращенья.
Про эти природные измененья
Мы с вами сказали бы: “Это явленья!”
Явленья бывают различными,
Рассмотрим химические и физические.
Должны научиться мы их наблюдать,
А самое главное их различать!
ДЕМОНСТРАЦИОННЫЙ ЭКСПЕРИМЕНТ: ГОРЕНИЕ БУМАГИ И РЖАВЫЙ ГВОЗДЬ.
УЧИТЕЛЬ. Какие явления, происходящие с веществами, вам известны? Какие явления называются физическими? Приведите примеры физических явлений.
УЧЕНИК. Физическими явлениями называются изменения, при которых новые вещества не образуются. Переход воды в пар при нагревании, вытягивание кусочка меди в проволоку относятся к физическим явлениям.
УЧИТЕЛЬ. Какие изменения происходят с веществами при физических явлениях?
УЧЕНИК. При физических явлениях происходит изменение агрегатного состояния вещества, формы, размера тел. Физические явления – это явления: происходящие с веществами с сохранением их молекул, при которых данные вещества не превращаются в другие, а обычно изменяется только агрегатное состояние;
УЧИТЕЛЬ. Какие явления называются химическими? Приведите примеры химических явлений.
УЧЕНИК. Химическими называются явления, при которых исходные вещества (реагенты) превращаются в другие вещества (продукты реакции). К таким явлениям относятся: ржавление железа, скисание молока и множество других.
Химические явления – это явления, происходящие с веществами с разрушением молекул , в результате которых из одних веществ образуются другие.
А теперь попробуем применить полученные знания для выполнения следующего задания: укажите, о каких явлениях, физических или химических, идет речь в высказываниях поэтов:
• Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье,
В багрец и золото одетые леса!
А.С.Пушкин
• И трещат сухие сучья,
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко!
И.Суриков
• В декабре, в декабре
Все деревья в серебре,
Нашу речку, словно в сказке,
За ночь вымостил мороз…
С.Я.Маршак
•…А если медь в печи нагреть,
То станет тяжелее медь
Не верите – так взвесьте…
Е.Ефимовский
• Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
Е.Благинина
При изучении химии нас конечно же будут интересовать явления химические. Ежеминутно в мире протекает миллионы химических реакций – в нашем желудке, когда мы едим, в выпекающемся пироге или в двигателе автомобиля. Но как определить происходит химическая реакция или нет?
При химических процессах происходит превращение одних веществ в другие, которые обладают новыми свойствами, которыми не обладали исходные вещества. Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки.
Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки.
На ваших столах имеются инструкции по выполнению лабораторной работы и необходимый набор реактивов. Перед выполнением опытов я напоминаю о необходимости соблюдения правил техники безопасности:
- При выполнении опытов следует соблюдать осторожность.
2) Не разбрызгивайте и не разливайте реактивы.
3) Работу выполняйте только над подносом.
4) Не направляйте пробирку на себя или на соседа.
5) Свое рабочее место оставляйте чистым.
Лабораторные опыты:
1) Взаимодействие мела с серной кислотой.
На кусочек мела капните 2-3 капли раствора серной кислоты. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
CaCO3 + h3SO4 = CaSO4 + h3О + СO2↑
Почему дрожжевое тесто «пыхтит» в кастрюле? А когда его обминают, то появляется писк? Это тоже признак того, что протекает химическая реакция. При брожении дрожжей образуется углекислый газ, происходит образование нового вещества.
- Взаимодействие хлорида бария с сульфатом натрия.
В пробирку с хлоридом бария добавьте 2-3 капли раствора сульфата натрия. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
BaCl2 + Na2SO4 = BaSO4 + 2 NaCl
- Взаимодействие FeCl3 c KCNS.
В пробирку с хлоридом железа (III) добавьте 2 капли роданида калия KCNS. Что вы наблюдаете? Что является признаком данной реакции?
Давайте составим уравнение этого превращения.
FeCl3 + 3KNCS = Fe(CNS)3 + 3KCl
- Взаимодействие гидроксида натрия с фенолфталеином.
В пробирку с гидроксидом натрия добавьте 2 капли фенолфталеина. Что вы наблюдаете? Что является признаком данной реакции?
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ:
- Выделение газа
- Образование осадка
- Изменение окраски
- Появление запаха
- Выделение или поглощение энергии (в виде света или тепла).

ВИРТУАЛЬНАЯ ЛАБОРАТОРИЯ.
ДОМАШНЕЕ ЗАДАНИЕ:
- Физическое или химическое явление?
• кипение воды;
• образование на деревьях инея;
• скисание молока;
• ржавление гвоздя;
• таяние льда;
• горение бенгальских огней;
• гниение растений;
• приготовление сахарного сиропа;
• приготовление сахарной пудры из сахара;
• горение свечи;
- почернение медной пластинки при нагревании;
- измельчение сахара в ступке.
2) Физические явления – это явления:
А) происходящие с веществами в разные времена года;
Б) происходящие с веществами с разрушением молекул;
В) при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние;
Г) в результате которых из одних веществ образуются другие.
3) Признаком химических реакций не является:
А) появление запаха;
Б) изменение объёма;
В) изменение цвета;
Г) выделение света и тепла.
- В крепко заваренный свежий чай в стакане опустите кусочек лимона или несколько кристаллов лимонной кислоты. Что наблюдаете?
5) Немного лимонной кислоты на кончике чайной ложки растворите в воде, а затем добавьте в полученный раствор столько же пищевой (питьевой) соды. Что наблюдаете?
Лабораторная работа по химии
Ученика(цы) 8 класса
_________________________________________________________
ФИО
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
В природе с момента ее зарожденья
Всегда с веществами идут превращенья.
Про эти природные измененья
Мы с вами сказали бы: “Это явленья!”
Явленья бывают различными,
Рассмотрим химические и физические.
Должны научиться мы их наблюдать,
А самое главное их различать!
Физические явления – это явления, происходящие с веществами с сохранением их молекул, при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние.
Химические явления – это явления, в результате которых из одних веществ образуются другие.
ЗАДАНИЕ: укажите, о каких явлениях, физических или химических, идет речь в высказываниях поэтов:
• Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье,
В багрец и золото одетые леса! (А.С.Пушкин)
• И трещат сухие сучья,
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко! (И.Суриков)
• В декабре, в декабре
Все деревья в серебре,
Нашу речку, словно в сказке,
За ночь вымостил мороз… (С.Я.Маршак)
•…А если медь в печи нагреть,
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте… (Е.Ефимовский)
• Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке? (Е.Благинина)
При химических процессах происходит превращение одних веществ в другие, которые обладают новыми свойствами, которыми не обладали исходные вещества. Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки химических реакций.
ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНОЙ РАБОТЫ ПОМНИ О СЛЕДУЮЩИХ ПРАВИЛАХ:
- При выполнении опытов следует соблюдать осторожность.
2) Не разбрызгивайте и не разливайте реактивы.
3) Работу выполняйте только над подносом.
4) Не направляйте пробирку на себя или на соседа.
5) Свое рабочее место оставляйте чистым.
I. Взаимодействие мела с серной кислотой.
На кусочек мела капните 2-3 капли раствора серной кислоты. Что вы наблюдаете? Что является признаком данной реакции?
Уравнение реакции:
Признаком реакции является:_____________________________
II. Взаимодействие хлорида бария с сульфатом натрия.
В пробирку с хлоридом бария добавьте 2-3 капли раствора сульфата натрия. Что вы наблюдаете? Что является признаком данной реакции?
Уравнение реакции:
Признаком реакции является:_____________________________
III. Взаимодействие FeCl3 c KCNS.
Взаимодействие FeCl3 c KCNS.
В пробирку с хлоридом железа (III) добавьте 2 капли роданида калия KCNS. Что вы наблюдаете? Что является признаком данной реакции
Уравнение реакции:
Признаком реакции является:_____________________________
IV. Взаимодействие гидроксида натрия с фенолфталеином.
В пробирку с гидроксидом натрия добавьте 2 капли фенолфталеина. Что вы наблюдаете? Что является признаком данной реакции?
Признаком реакции является:_____________________________
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
1)
2)
3)
4)
5)
ДОМАШНЕЕ ЗАДАНИЕ:
- Физическое или химическое явление?
• кипение воды;
• образование на деревьях инея;
• скисание молока;
• ржавление гвоздя;
• таяние льда;
• горение бенгальских огней;
• гниение растений;
• приготовление сахарного сиропа;
• приготовление сахарной пудры из сахара;
• горение свечи;
- почернение медной пластинки при нагревании;
- измельчение сахара в ступке.
2) Физические явления – это явления:
А) происходящие с веществами в разные времена года;
Б) происходящие с веществами с разрушением молекул;
В) при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние;
Г) в результате которых из одних веществ образуются другие.
3) Признаком химических реакций не является:
А) появление запаха;
Б) изменение объёма;
В) изменение цвета;
Г) выделение света и тепла.
4) В крепко заваренный свежий чай в стакане опустите кусочек лимона или несколько кристаллов лимонной кислоты. Что наблюдаете?
5) Немного лимонной кислоты на кончике чайной ложки растворите в воде, а затем добавьте в полученный раствор столько же пищевой (питьевой) соды. Что наблюдаете?
Урок 10. Признаки химических реакций – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 10 «Признаки химических реакций» из курса «Химия для чайников» рассмотрим, что из себя представляют физические и химические явления; выясним, что такое химическая реакция, а также признаки и условия протекания химических реакций.
Давайте внимательно посмотрим вокруг себя. Мы уже знаем, что весь окружающий нас мир состоит из различных веществ: органических и неорганических, простых и сложных, твердых, жидких и газообразных. Остаются ли эти вещества в природе неизменными? Нет, в природе происходят различные изменения, которые называются явлениями. В зависимости от того, какие изменения происходят с веществами, различают явления физические и химические. Эти два рода явлений можно отличить друг от друга.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.
Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.
Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
Химические явления (реакции)
Всегда ли вещества остаются неизменными? Нагреем красную медную проволоку в пламени спиртовки. Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Химические реакции — это явления, при которых происходит превращение одних веществ в другие.
Природа — это огромная лаборатория, в которой непрерывно происходит образование новых веществ. Горные породы и минералы под воздействием солнца, воды, углекислого газа и других веществ постепенно разрушаются и превращаются в новые вещества. В зеленых растениях из углекислого газа и воды образуются глюкоза и крахмал.
Человек превращает взятые из природы вещества (природный газ, нефть, руды) в необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в результате множества превращений получаются новые вещества, которых нет в природе. При всех этих явлениях происходит разрушение исходных веществ и образование новых веществ.
Например, в результате сгорания магния образуется новое вещество MgO (рис. 50). При сгорании метана получаются два вещества: углекислый газ CO2 и вода H2O. Из одного сложного вещества HgO в результате его разложения образуются два новых — ртуть Hg и кислород O2 (рис. 51).
Ржавление железа (рис. 52), кипячение воды, горение лучины, распространение запаха — какие из этих явлений можно отнести к химическим реакциям? По каким признакам можно судить, что химическая реакция произошла?
Признаки химических реакций
Проведем несколько химических реакций. Нагреем в пробирке зеленый порошок малахита (рис. 53) — минерала, в состав которого входят атомы меди, углерода, водорода и кислорода. Порошок малахита начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки спичку, она гаснет — это выделяющийся углекислый газ препятствует ее горению. На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
Существуют и другие признаки химических реакций. Например, при горении магния излучается яркий свет и выделяется много теплоты (см. рис. 50).
На заметку: Раньше вспышка магния использовалась для освещения объекта во время фотографирования.
При сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые осадки можно растворить при помощи других веществ. Например, при сливании растворов соды и известковой воды образуется белый осадок, который легко растворяется в уксусе.
При сгорании спички ощущается резкий запах. Какие еще признаки химических реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций:
• Выделение газа.
• Образование или исчезновение осадка.
• Изменение цвета.
• Появление запаха.
• Излучение света.
• Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
- Химические реакции — это явления превращения одних веществ в другие.
- О протекании химических реакций судят по выделению газа, выпадению или исчезновению осадка, изменению цвета, появлению запаха, поглощению или выделению теплоты и излучению света.
- Необходимым условием протекания большинства химических реакций является соприкосновение реагирующих веществ.
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Что такое ржавчина и как ее удалить с поверхности металла?
По статистике, потери от ржавчины (коррозии) составляют до 12% от всего производимого металла. Условия эксплуатации металлических изделий и конструкций постоянно ужесточаются, в том числе и из-за загрязнения атмосферы. Так, выбросы оксидов серы или азота приводят к образованию микрокапель серной или азотной кислот, при этом скорость образования ржавчины увеличивается в несколько раз.
Ржавчина – химические основы процесса
Железо – химически активный металл, который в присутствии воды и кислорода легко окисляется, образуя несколько соединений – оксидов, гидроксидов и их гидратов. Как ни странно, но точной формулы ржавчины не существует: в зависимости от условий окружающей среды продукт окисления железа имеет переменный состав: nFe(OH)3*mFe(OH)2*ph3O. Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.
Опасность процесса в том, что визуально оценить степень поражения металлической конструкции не представляется возможным: под красно-бурым слоем ржавчины металл может быть полностью разрушен. Если своевременно не принять меры, результат может оказаться плачевным, вплоть до полного разрушения изделия. Одно дело, если это – ржавый гвоздь в стене дачного домика, и совсем другое – если ржавчина поразила опору ЛЭП или корпус морского судна.
Способы удаления ржавчины
Народная мудрость гласит, что любую проблему проще предотвратить, чем потом прикладывать героические усилия для устранения ее последствий. Ржавчина – не исключение. За последние 20-30 лет химики и физики предложили немало способов предотвращения коррозии – от защитных покрытий до сложных инженерных сооружений – станций электрохимической защиты.
Ржавчина – не исключение. За последние 20-30 лет химики и физики предложили немало способов предотвращения коррозии – от защитных покрытий до сложных инженерных сооружений – станций электрохимической защиты.
Если ржавчина все-таки появилась – это не повод опускать руки: есть немало эффективных способов ее удаления, и чем раньше предприняты активные меры, тем большим будет эффект от их применения. Итак, обо всем по порядку.
Механическое удаление ржавчины
Продукты коррозии обладают малой адгезией и поэтому легко удаляются с поверхности металла при механическом воздействии – например, при обработке металлической щеткой. Снять ржавый налет с крупных изделий можно с помощью шлифовального станка, соблюдая при этом простое правило: начинать нужно с крупного зерна, а для финишной обработки использовать самое мелкое. Участки металла, с которых удалена ржавчина, оказываются совершенно беззащитными перед атмосферным воздействием. Если их не обработать антикоррозионными составами, предотвращающими контакт с водой и кислородом, процесс ржавления только ускорится.
Химические способы удаления ржавчины
Зная природу и химический состав ржавчины, логично предположить, что удалить ее можно с помощью кислот. Из школьного курса химии известно, что оксиды и гидроксиды металлов легко взаимодействуют с кислотами, при этом образуются соли железа и соответствующей кислоты, и вода.
Например, при действии соляной кислоты происходят следующие реакции:
- 2Fe (OH)3 + 6HCL → 2FeCl3 + 6h3O
- Fe (OH)2 + 2HCL → FeCl2 +2h3O
Образующийся хлорид железа – водорастворимая соль, которую необходимо удалить с поверхности обрабатываемого изделия простым ополаскиванием в воде, а затем насухо вытереть поверхность. Не надо ждать, пока ржавчина начнет образовываться снова, очищенные участки следует обработать защитными составами.
При обработке кислотами существует опасность растворения металла, поскольку железо в электрохимическом ряду напряжений стоит до водорода, оно активно реагирует со многими разбавленными кислотами:
- Fe + 2HCl → FeCl2 + h3↑
По этой причине прежде, чем заняться химическими экспериментами в домашних условиях, необходимо почитать соответствующую литературу. Устранить побочный эффект поможет ингибитор коррозии – уротропин, при добавлении всего 1-2 г на литр раствора соляной кислоты реакция с железом не протекает.
Преобразователи ржавчины
Жидкие составы на основе ортофосфорной кислоты являются отличным способом предотвратить дальнейшее образование ржавчины на поверхности стальных и железных изделий. При таком способе обработки предварительно удаляются лишь те участки ржавчины, которые слабо держатся на основе. Образующийся в процессе реакции ортофосфат железа создает прочную защитную пленку, через которую не проникает влага и кислород, благодаря чему предотвращается дальнейшая коррозия металла. Для ускорения процесса высыхания на литр 25%-ого раствора ортофосфорной кислоты можно добавить 30-40 мл изобутилового спирта или 15 граммов винной кислоты.
Современное оборудование для удаления ржавчины
Механические способы очистки поверхности от ржавчины с помощью подручных средств применимы далеко не всегда, если изделие имеет сложную форму, то обработать все участки не представляется возможным. Химические способы тоже имеют свои недостатки, при несоблюдении элементарных правил техники безопасности можно получить химический ожог или отравление. Определенную проблему представляет и утилизация отработанных растворов.
Оптимальным способом удаления ржавчины, особенно с поверхности изделий сложной геометрической формы, является мягкий бластинг. Суть метода состоит в следующем, на металлическое изделие направляется струя сжатого воздуха, содержащая особые абразивные гранулы. Меняя давление, можно регулировать глубину слоя, снимаемого с поверхности – таким образом удаляется только слой ржавчины или окалины, а металл остается нетронутым. Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.
Суть метода состоит в следующем, на металлическое изделие направляется струя сжатого воздуха, содержащая особые абразивные гранулы. Меняя давление, можно регулировать глубину слоя, снимаемого с поверхности – таким образом удаляется только слой ржавчины или окалины, а металл остается нетронутым. Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.
Отличительной особенностью метода является абсолютная экологическая безопасность: применяемые компоненты химически инертны. Многочисленные исследования доказали, что на поверхности металла практически не образуются царапины и иные микроскопические дефекты, которые последствии могут стать центрами повторного образования ржавчины. Щелочная природа гранул способствует образованию пассивной пленки на изделиях из железа или стали, предохраняя основной объем металла от коррозионного разрушения.
Наилучшие результаты применения аппарата мягкого бластинга Nordblast NB 28-2 получены при обработке деталей машин или яхт. Процесс чистки от ржавчины зависит от степени коррозии, обычно на полную обработку автомобиля уходит 1 день, яхты – 2 дня.
Чем раньше обнаружена проблема, тем проще бороться с ржавчиной. Какой способ наиболее предпочтителен – каждый решает самостоятельно, но не стоит пользоваться дедовскими методами, если есть оборудование, удаляющее ржавчину со 100%-ой эффективностью!
Причины коррозии металла и их устранение
Коррозия – один из самых опасных врагов металла. Что это такое мы выясним в этой статье.
В переводе с латыни коррозия (или corrodere) означает «разъедать». Коррозия преследует не только металлы, но и камни, дерево, полимерные материалы. Фактически, коррозия металла – это его разрушение под влиянием внешних условий, вызванных химическими воздействиями.
Склонны к коррозии практически все виды металлов, в том числе, черные металлы. Протекать она может с различной скоростью. При этом, даже при большом опыте работы с металлопрокатом бывает довольно сложно выявить скорость протекания коррозии и динамику ее развития. Но ясно то, что скорость протекания и развития коррозии зависит от окружающих условия и характера образующих продуктов. При этом, несмотря на наличие коррозии, металл может существовать некоторое (и даже продолжительное) время.
Условно коррозию можно разделить на два вида: химическую и электрохимическую. При этом, каждый вид коррозии имеет свои признаки. Например, признаками химической коррозии являются появление ржавчины и патины бронзы. Атмосферная коррозия является видом химической. Причинами ее являются взаимодействие поверхности металла с воздухом, погодные условия. При нагревании металла наблюдается резкое динамическое развитие химической коррозии, появляется окалина.
На развитие коррозии в железе влияет наличие в нем серы, которая попадает в железо из каменного угля. Как сера влияет на металл? Дело в том, что сера содержится в виде сульфидов, которые со временем разлагаются и выделяется сероводород. Именно сероводород и оказывает негативное влияние на металл.
Коррозия – серьезная проблема, которая оказывает огромный урон экономике. В производствах, на фабриках, во всех видах промышленности используется металл. Коррозия значительно снижает износостойкость оборудования. В результате, экономика несет большие потери. Потому как приходится либо полностью обновлять оборудование, либо заведомо закупать более прочное оборудование, что, само собой, дороже. Кроме этого, коррозия может сказаться и на качестве выпускаемой на станках продукции, так как загрязняет металл. Коррозия наносит вред не только производству. Взгляните вокруг: мосты, автомобили, самолеты, котлы, трубопроводы и многое другое. Все эти предметы общего обихода так же разрушаются от коррозии. По подсчетам, в результате разрушения металла развитые страны теряют около 3-4% валового национального дохода. Это значительная цифра. Установлено, что потери металла из-за разрушительного действия коррозии составляют около 30% годового производства. При этом, 10% металлических изделий разрушаются полностью.
По подсчетам, в результате разрушения металла развитые страны теряют около 3-4% валового национального дохода. Это значительная цифра. Установлено, что потери металла из-за разрушительного действия коррозии составляют около 30% годового производства. При этом, 10% металлических изделий разрушаются полностью.
Для того, чтобы избежать таких колоссальных разрушений, существуют различные способы заведомой защиты металла. Например, оцинкованная или нержавеющая сталь. Выявлено, что цинковое покрытие благотворно влияет на состояние металла и защищает его от коррозии. То же действие имеет и нержавеющее покрытие. Поэтому для металлических конструкций ответственного назначения используются только защищенные металлы. Данная защита является надежной при условии, что металлическая поверхность не имеет механических повреждений в виде царапин или трещин. В противном случае, возможно появление внутренней коррозии, например, при проникновении воздуха или влаги в трещину.
Железо ржавление – Справочник химика 21
Нередко состояния, относительно мало устойчивые в термодинамическом смысле, практически длительно сохраняются во времени, что дает возможность применять вещества в таких состояниях. Так, окислы железа являются более устойчивыми в обычных условиях в присутствии кислорода, чем металлическое железо. Однако это не мешает широко применять металлическое железо в атмосферных условиях, хотя при этом и происходит некоторая потеря железа (ржавление), а в соответствующих условиях железо приобретает пирофорные свойства (см. примечание к стр. 358). Также и углекислый гае в обычных условиях является более устойчивым, чем уголь или графит. Однако это не препятствует их- применению в присутствии кислорода, хотя при определенных условиях может произойти самовозгорание угля. [c.227]Особенно широко распространен процесс коррозии с кислородной деполяризацией.
 Он наблюдается в случае коррозии металлов в воде, почве и т. д. Примером может служить ржавление железа во влажном воздухе, при котором продуктом коррозии является гидрат закиси железа, постепенно окисляющийся до гидрата окиси железа [c.134]
Он наблюдается в случае коррозии металлов в воде, почве и т. д. Примером может служить ржавление железа во влажном воздухе, при котором продуктом коррозии является гидрат закиси железа, постепенно окисляющийся до гидрата окиси железа [c.134]Общеизвестным случаем коррозии является ржавление железа. Коррозионное разрушение металла наблюдается и у ряда других металлов (алюминий, медь, свинец и т. д.). Стойкими против коррозии являются лишь благородные металлы (серебро, золото, платина и т. п.). [c.356]
При ржавлении металлическое железо окисляется, переходя в состояние окисления + 2, и отслаивается от металла в виде хлопьев, состоящих из РеО или других оксидов железа. Коррозия алюминия протекает еще энергичнее [c.190]
Однако это определение не отвечает на вопрос о том, как отличить элемент, когда мы встречаемся с ним. Более практическое определение элемента принадлежит Роберту Бойлю (1627-1691) Элемент-это вещество, которое при химическом превращении всегда увеличивает свой вес . Это утверждение следует понимать в том смысле, которь[й ему приписывался. Например, при ржавлении железа образующийся оксид железа имеет больший вес, чем исходное железо. Однако вес железа и соединяющегося с ним кислорода точно равен весу образующегося оксида железа, И наоборот, когда мы нагреваем красный порошок оксида ртути, происходит выделение газообразного кислорода, а остающаяся серебристая жидкая ртуть имеет меньший вес, чем исходный красный порошок. Но если это разложение проводится в закрытой реторте, можно убедиться, что в процессе реакции не происходит изменения общего веса всех веществ, (Лишь спустя 100 лет после Бойля Лавуазье провел опыты с точным взвешиванием, продемонстрировав, что в подобных реакциях выполняется закон сохранения массы,) [c.270]
Сильнее всего коррозии подвергается железо. Ежегодно от коррозии теряется около четверти мировой добычи железа. Ржавление железа — сложный процесс, в результате которого на поверхности металла образуется гидроксид железа Ре(ОН)з, представляющий собой рыхлую массу красно-коричневого цвета. Он не предохраняет железо от дальнейшего воздействия на него окружающей среды, а поэтому железо разрушается до конца. Некоторые металлы, например алюминий, цинк, хром, при соприкосновении с кислородом воздуха покрываются плотной пленкой оксида, которая защищает их от дальнейшего разрушения. [c.261]
Он не предохраняет железо от дальнейшего воздействия на него окружающей среды, а поэтому железо разрушается до конца. Некоторые металлы, например алюминий, цинк, хром, при соприкосновении с кислородом воздуха покрываются плотной пленкой оксида, которая защищает их от дальнейшего разрушения. [c.261]
Ржавлением называется коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидратированных оксидов железа. Цветные металлы, следовательно, корродируют, но не ржавеют. [c.16]
Коррозии подвержены почти все -металлы и, особенно, железо, ржавление которого является частным случаем коррозии металлов. [c.292]
Большая часть добываемого цинка используется для оцинкования железа (предохранения от ржавления), а также для получения различных сплавов. Из последних наиболее известны латунь (60% Си, 40% Zn), томпак (90% Си, 10% Zn), нейзильбер (65% Си, 20% Zn, 15% Ni). Из кадмия изготовляют регулирующие стержни атомных реакторов. Его применяют для получения легкоплавких сплавов, гальванических покрытий, электродов щелочных аккумуляторов, механически прочных медно-кадмиевых сплавов для электро- [c.633]
Разрушение металлов под воздействием внешней среды называется коррозией. Ржавление — частный случай коррозии, когда разрушению подвергаются черные металлы, т. е. железо и его сплавы. В зависимости от характера внешней среды, с которой взаимодействует металл, различают два вида коррозии — химическую и электрохимическую. = [c.131]
Один из способов предотвращения ржавления заключается в защите поверхности железа от влаги и кислорода путем нанесения какого-либо искусственного покрытия, например краски. Хорошая краска пристает X поверхности железа лучше, чем FeO, но и она не остается на поверхности навсегда. [c.191]
Как известно, химическая кинетика изучает скорости протекания реакций и зависимость этих скоростей от различных факторов — природы, концентрации реагирующих веществ, давления, температуры, катализаторов и др. Опыт показывает, что скорости химических реакций могут значительно отличаться друг от друга некоторые реакции, сопровождающиеся взрывом, протекают в тысячные доли секунды, другие же совершаются в течение значительно более длительного времени. Так, ржавление железа становится заметным уже через несколько часов после того, как оно пришло в контакт с водой или влажным воздухом, а процессы, совершаемые в земной коре (например, образование антрацита), протекают в течение сотен и тысяч лет. [c.84]
Опыт показывает, что скорости химических реакций могут значительно отличаться друг от друга некоторые реакции, сопровождающиеся взрывом, протекают в тысячные доли секунды, другие же совершаются в течение значительно более длительного времени. Так, ржавление железа становится заметным уже через несколько часов после того, как оно пришло в контакт с водой или влажным воздухом, а процессы, совершаемые в земной коре (например, образование антрацита), протекают в течение сотен и тысяч лет. [c.84]
Какое из указанных ниже защитных средств не предохранит железо от ржавления (т.е. окисления), если его поверхность окажется поврежденной [c.596]
Сплавы железа с углеродом и легирующими добавками, улучшающими отдельные свойства марганец до 14% (износоустойчивость) хром до 13% (твердость, устойчивость к ржавлению) [c.262]
К третьей группе принадлежат такие процессы, как опускание груза на более низкий уровень, взаимная нейтрализация сильной кислоты и сильного основания, любая реакция, используемая в работающем гальваническом элементе, сгорание горючего, взрыв взрывчатого вещества, ржавление железа, кристаллизация переохлажденной или вскипание перегретой жидкости, переход вещества из стеклообразного состояния в кристаллическое и др. Процессы этой группы называют положительными, в отличие от процессов первой группы, требующих затраты работы, которые называют отрицательными. [c.205]
В качестве других примеров можно привести реакции растворения, травления металлических стружек кислотой, ржавления железа и т. п. [c.330]
Равномерная коррозия включает общеизвестные ржавление железа или потускнение серебра. Помутнение никеля и высокотемпературное окисление металлов также являются примерами равномерной коррозии. [c.26]
Большая часть добываемого цинка используется для оцинковывания железа (предохранения от ржавления), а также для получения различных сплавов. Из последних наиболее известны латунь (60% Сц, 40% [c.581]
Из последних наиболее известны латунь (60% Сц, 40% [c.581]
А. нежелательна, т. к. приводит к порче пищевых продуктов, осмолению масел и бензинов, старению каучука, ржавлению железа. Для предотвращения А. добавляют антиокислители, металл покрывают защитной пленкой. [c.35]
Одним из наиболее широко известных коррозионных процессов является ржавление железа. С экономической точки зрения это очень важный процесс. Согласно имеющимся оценкам, 20% железа, производимого ежегодно в США, идет на замену железных изделий, пришедших в негодность из-за ржавления. [c.230]
Известно, что в ржавлении железа участвует кислород железо не окисляется в воде в отсутствие кислорода. В процессе ржавления также принимает участие вода железо не корродирует в масле, насыщенном кислородом, если в нем нет следов воды. Ржавление ускоряется под действием целого ряда факторов, таких, как pH среды, наличие в ней солей, контакт железа с металлом, который окисляется труднее, чем железо, а также под влиянием механических напряжений. [c.230]
Конечными продуктами процесса ржавления железа являются а- и у-модификацпи РеО (ОН) и Рез04. Суммарно (упрощенно) процесс ржавления железа представляют уравнением [c.193]
Запись данных опыта. Описать наблюдаемые явления и ответить на поставленные вопросы. Дать схему перехода электронов при коррозии оцинкованного и луженого железа и указать, в каком случае при местном разрушении защитного покрытия будет происходить ржавление железа под остающимся неизменным защитным слоем. [c.114]
Опыт показывает, что скорости химических реакций весьма различны. Так, продолжительность взрыва составляет миллионные доли секунды, а ржавление железа в атмосферных условиях может затягиваться на многие годы. Химические процессы, ис- [c.253]
Совершенно иными свойствами обладают оловянные покрытия. Жесть, из которой изготовлены консервные банки, представляет собой железо, покрытое оловом. В табл. 19-1 восстановительных потенциалов олово расположено выше железа следовательно, ионы обладают большей способностью восстанавливаться до металлического состояния, чем ионы Ре . Это означает, что оловянное покрытие благоприятствует окислению железа, т.е. его ржавлению. Поэтому жестяная банка не подвержена ржавлению только до тех пор, пока вся поверхность олова остается неповрежденной. Поцарапайте жестяную банку, и она наверняка поржавеет. Оловянное покрытие играет роль лишь очень прочной и плотно прилегаюшей идеальной краски. Благодаря этому жестяные изделия не загрязняют навеки окружаюшую среду. Со временем жестяные банки саморазрушаются, но этого не происходит с алюминиевыми предметами. [c.192]
В табл. 19-1 восстановительных потенциалов олово расположено выше железа следовательно, ионы обладают большей способностью восстанавливаться до металлического состояния, чем ионы Ре . Это означает, что оловянное покрытие благоприятствует окислению железа, т.е. его ржавлению. Поэтому жестяная банка не подвержена ржавлению только до тех пор, пока вся поверхность олова остается неповрежденной. Поцарапайте жестяную банку, и она наверняка поржавеет. Оловянное покрытие играет роль лишь очень прочной и плотно прилегаюшей идеальной краски. Благодаря этому жестяные изделия не загрязняют навеки окружаюшую среду. Со временем жестяные банки саморазрушаются, но этого не происходит с алюминиевыми предметами. [c.192]
Основным продуктом ржавлении железа считают гидроксид Ре(0Н)з. При удалении влаги (высушивании) гидроксид частично отщепляет воду [c.380]
Железо способно окисляться и кислородом, и водой, а их совместное воздействие резко увеличивает скорость коррозии. Процесс коррозии (ржавления) железа при этих условиях выражается следующим суммарным уравнением [c.234]
Чистые металлы корродируют медленно (даже железо). Однако технические металлы, содержащие различные примеси, корродируют гораздо быстрее. Значит, наличие примесей в металлах — одна из причин ускорения коррозии. Поясним это на примере. Чистые цинк и железо в воде корродируют медленно, но если пластинки этих металлов привести в соприкосновение, коррозия цинка резко ускорится, железа — прекратится вообще. Объясняется это явление следующим образом. Как известно, вследствие частичной растворимости на поверхности металла, погруженного в воду, возникает отрицательный заряд, а контактирующий с поверхностью металла раствор заряжается положительно. Возникающий скачок потенциала между металлом и раствором (электродный потенциал) препятствует дальнейшему выходу катионов из кристаллической решетки металла в раствор, т. е. растворению металла. Этот скачок потенциала будет тем больше, чем левее в ряду напряжений расположен металл. Если в растворе присутствует кислород, то он будет выступать как окислитель, снимая с поверхности металла электроны, и процесс растворения металла, следовательно, будет продолжаться (см. уравнение реакции ржавления железа). Окислителем по отношению к металлу в растворе могут также выступать ионы водорода при растворении металлов в растворах кислот или воде. Но поскольку концентрация ионов водорода в чистой воде очень мала, то для вытеснения водорода из воды, т. е. ра- [c.261]
Если в растворе присутствует кислород, то он будет выступать как окислитель, снимая с поверхности металла электроны, и процесс растворения металла, следовательно, будет продолжаться (см. уравнение реакции ржавления железа). Окислителем по отношению к металлу в растворе могут также выступать ионы водорода при растворении металлов в растворах кислот или воде. Но поскольку концентрация ионов водорода в чистой воде очень мала, то для вытеснения водорода из воды, т. е. ра- [c.261]
Отсюда становится понятным, почему наиболее интенсивно ржавление железа протекает при одновременном присутствии влаги и кислорода. В сухом воздухе или в воде, не содержащей растворенного кислорода, железо практически не ржавеет. [c.280]
Если окисление идет быстро с выделением большого количества теплоты и света, то такой процесс называют горением. Процессы окисления, протекающие медленно, в зависимости от характера окисляющегося вещества называют ржавлением (для железа), тлением (для органических остатков). Если медленное окисление происходит в большой массе вещества, то теплота может накопиться и привести к интенсивному горению (самовоспламенение на складах соломы, угля, хлопка, зерна). Медленное окисление пищи (жиров, углеводов и белков) в нашем организме — энергетическая база жизни. [c.128]
Железо также реагирует с кислородом, но гораздо медленнее. Ржавление металла (один из видов коррозии) включает в себя ряд реакций, в которых принимают участие вода и газообразный кислород. Хорошо известно, например, что сухая железная кухонная утварь не ржавеет. Машины также быстрее ржавеют на морском берегу, чем в пустыне. С химической точки зрения ржавчина — это смесь ряда железосодержащих соединений, в основном состава Ре20з. [c.129]
Если судить по шкале окислительно-восстановительных потешщалов, алюминий должен проявлять большую склонность к окислению, чем железо. Однако все знают, что алюминий довольно устойчив к коррозии, тогда как ржавление железа и стали представляет собой серьезную экономическую проблему. Как это объяснить [c.190]
Как это объяснить [c.190]
Химические свойства воды также определяются ее составом и строением. Молекулу воды можно разрушить только энергичным внешним воздействием. Вода начинает заметно разлагаться только при 2000 °С (термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация). На воду действует также радиоактивное излучение. При этом образуются водород, кислород и пероксид водорода Н2О2. Щелочные и щелочноземельные металлы разлагают воду с выделением водорода при обычной температуре, а магний и цинк — при кипячении. Железо реагирует с водяными парами при красном калении. Вода является одной из причин коррозии — ржавления металлов (с. 156). Благородные металлы с водой не реагируют. [c.101]
В первом случае местное повреждение поверхности приводит к ржавлению железа под остающимся неизменным слоем олова. Во втором случае, наоборот, происходит разрушение покровного слоя цинка, тогда как коррозия железа задерживается. Это происходит оттого, что железо более активно, чем олово, и менее активно, чем цинк (в ряду активности металлов цинк стоит перед железом, а олово — после железа). При ржавлении образуется вначале гидроокись железа (II), которая окисляется во влажном воздухе в гидроокись железа (III) по уравнению 4Ре(0Н)2 + 02 + 2Н20->– -4Ре(ОН)з или (электродное уравнение) 02 + 2Н20-Н4е– 40Н-Корро п1я такого типа обычно происходит в нейтральных водах Кислород содержится в воде, но по мере связывания может посту пать из воздуха. Коррозия с поглощением кислорода часто прини мает точечную форму, которая сопровождается вздутием поверх ности над пораженными местами. Например, это наблюдается при точечной коррозии магистральных трубопроводов для горячей во- [c.176]
Задание. Какие процессы из перечнслеиных можно назвать самопроизвольными распрямление сжатой пружины, заряд аккумулятора, нейтрализация кислоты щелочью, взрыв, ржавление железа, переход теплоты от горячего тела к холодному. [c.57]
[c.57]
Довольно часто железо покрывают слоем олова ( лужение ), которое устойчиво к действию воды обычного солевого состава в присутствии кислорода воздуха. Поведение луженого железа в условиях эксплуатации изделий принципиально противоположно поведению оцинкованного железа. Повреждение слоя цинка на железе приводит к разъеданию цинка, что предохраняет железо от ржавения. Но повреждение слоя олова приводит к ржавлению железа при неизменяемости покрытия. При этом также возникает гальванический элемент, но направ–ление перехода электронов в нем иное, чем в случае с оцинкованным железом. Железо в соответствии со значениями стандартных электродных потенциалов обладает большей способностью посылать ионы в раствор и приобретает отрицательный заряд. В соответствии с этим электроны с железа переходят на олово, на поверхности которого они, взаимодействуя в кислот- [c.379]
Кадмий сильно поглощает медленные нейтроны. Поэтому его используют в виде стержней в ядерных реакторах для регулирования скорости цепной реакции. Кялмий используется в щелочных а1скумуляторах, входит в лекоюрые-сплавы. Сплавы меди, содержащие – 1% d, служат для изготовления проводов, подвергающихся трению от скольжения контактов не снижая электрической проводимости меди, кадмий улучшает ее механические свойства. Кадмирование стальных изделий лучше, чем цинковое покрытие, предохраняет железо и сталь от ржавления. Из солей кадмия наибольшее применение имеет сульфид. Сульфид кадмия применяется для изготовления краски и цветных стекол. [c.425]
Гидроксид железа (III) является главной составной частью ржавчины. Основные реакции ржавления железа заклю чаются в следующем. Вначале имеет место вытеснение железом водорода из воды [c.280]
Растворенный в воде кислород окисляет Fe + до Ре +, а также выделяющийся водород, который в нерзоначальный момент находится в атомарном состоянии. Суммарное уравнение реакции ржавления железа можно записать так [c. 280]
280]
На воздухе железо легко окисляется, особенно быстро происходит процесс окисления в присутствии вляги (ржавление) [c.352]
В качестве примера мИкрокоррозионного процесса рассмотрим ржавление технического железа. [c.359]
Признаков ржавчины (и причин их возникновения)
Эта статья была первоначально опубликована в марте 2018 года.
Если он есть в вашей машине, вы, вероятно, недовольны этим. Ржавчина – одна из неприятных, но неизбежных проблем, связанных с владением автомобилем.
Понимание процесса ржавления, проблемных областей и способов устранения неисправностей имеет решающее значение для устранения ржавчины до того, как она станет серьезной проблемой. В этой первой статье мы обсудим типы ржавчины и их причины.
Типы ржавчиныРжавчина – это непрофессиональный термин «окисление» или разложение металлов на основе железа. При достаточном времени и при воздействии элементов большинство типов железа и стали полностью превращаются в оксид железа в процессе ржавления. Поскольку эти металлы обычно используются в автомобилях, водителям следует беспокоиться о трех основных типах ржавчины:
1) Поверхность ржавчиныПервые признаки поверхностной ржавчины обычно появляются на краске.Этот тип ржавчины поражает небольшие зазубрины, трещины и царапины. По мере износа прозрачного покрытия ваша краска также становится уязвимой для износа и истирания. Как только вода проникает в незащищенный металл, он окисляется. Чистое железо и алюминий окисляются не так агрессивно, но сталь, как правило, содержит примеси в металле, которые ускоряют процесс ржавления.
2) Шкала ржавчины Открытая сталь ржавеет с разной скоростью в зависимости от нескольких переменных: компонентов сплава, толщины, окружающей среды, в которой находится сталь, и типа термической обработки стали.Окалина относится к оксидам железа, которые образуются на деформируемых или обработанных металлах в результате работы прокатного стана (обычно в результате высокотемпературной прокатки или обработки в печи). Эти химические процессы повреждают поверхность и снижают прочность металла, делая его более уязвимым к окислению. Со временем вода может реагировать на химические вещества, используемые при термообработке, создавая ржавчину. Чешуя обычно твердая, но хрупкая и шелушащаяся.
Эти химические процессы повреждают поверхность и снижают прочность металла, делая его более уязвимым к окислению. Со временем вода может реагировать на химические вещества, используемые при термообработке, создавая ржавчину. Чешуя обычно твердая, но хрупкая и шелушащаяся.
После длительного воздействия элементов окисленная сталь обычно разлагается до хрупкого оксида железа, вызывая образование отверстий в металлических листах.Автопроизводители делают все возможное, чтобы предотвратить этот серьезный вид коррозии, и теперь многие автомобили имеют толстое покрытие на нижней стороне, которое химически изолирует сталь от окислителей. Но эти углубления и покрытия со временем стираются, особенно на обочине автомобиля, где соль и другие элементы вызывают чрезмерный износ металла. Проникновение ржавчины обычно можно предотвратить, если ее вовремя выловить и обработать.
В V&FЕсли не остановить этот процесс, пятно ржавчины может быстро разрастаться, пока не вызовет структурную проблему.Во многих штатах автомобиль с дырами от ржавчины в кузове не проходит техосмотр, независимо от того, где они находятся и насколько серьезны они.
С 1988 года наш семейный сервисный центр предоставляет высококачественные услуги по ремонту автомобилей в Агаваме, Фидинг-Хиллз, Саутвике, Вест-Спрингфилде и прилегающих районах штата Массачусетс. Если ваш автомобиль нуждается в обслуживании или ремонте в этот зимний сезон, позвоните нам по телефону (413)314-2280 или запишитесь на прием через Интернет.
Что вызывает ржавчину железа? | Эксперимент
На этом практическом занятии учащиеся помещают железные гвозди в различные условия, включая влажные, сухие, без воздуха и соленые, чтобы выяснить, что вызывает ржавчину железа.Эксперимент нужно будет настроить на одно занятие, а затем оставить более чем на 3 дня перед повторным исследованием. При необходимости его можно было оставить настроенным на более длительный срок.
Оборудование
Аппарат
- Защита глаз
- Пробирки, 4 шт.
- Штатив для пробирок
- Резиновая пробка для пробирки
- Вата
- Щипцы
- Ручка или другие средства маркировки пробирок
Химическая промышленность
- Гвозди железные, 4 шт.
- Гранулы безводного хлорида кальция (РАЗДРАЖАЮЩИЙ) (см. Примечание 3)
- Растительное масло
- Деионизированная вода
- Деионизированная вода кипяченая (кипяченая 15 минут – см. Примечание 5)
- Натрия хлорид (поваренная соль)
Примечания по технике безопасности, охране здоровья и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Безводный хлорид кальция, CaCl 2 (s), (РАЗДРАЖАЮЩИЙ) – см. CLEAPSS Hazcard HC019A. Студентам с чувствительной кожей следует предложить перчатки.
- Хлорид натрия, NaCl (ы) – см. CLEAPSS Hazcard HC047b.
- Лучше всего, если деионизированная вода будет вскипячена, например, в чайнике, как можно ближе к началу урока и подана ученикам в тепле. Они могут сами варить его в течение 15 минут в стакане на горелке Бунзена, но целесообразно ли это, будет зависеть от класса.
Процедура
Показать в полноэкранном режиме- Пометьте пробирки 1–4.
- Заполните трубку 1 примерно на 1/4 деионизированной водой и добавьте гвоздь.
- Заполните трубку 2 кипяченой деионизированной водой примерно на 1/4 и добавьте гвоздь. Осторожно налейте немного масла на поверхность, чтобы воздух не попадал в воду.
- Смешайте немного соли с небольшим количеством деионизированной воды, чтобы приготовить раствор. Залейте этой смесью трубку 3 примерно на 1/4 и добавьте гвоздь.
- Вставьте гвоздь в трубку 4 и насыпьте гранулы безводного хлорида кальция на глубину около 2 см (они впитывают воду).
 Вставьте пробку в эту трубку, чтобы вода не попала внутрь.
Вставьте пробку в эту трубку, чтобы вода не попала внутрь. - Оставьте как минимум на три дня, а затем обратите внимание на любые изменения внешнего вида ногтей.
Вы можете попросить студентов составить таблицу, какие условия присутствуют или отсутствуют в каждой из пробирок:
- Трубка 1 – вода и воздух
- Трубка 2 – вода, но без воздуха (удаляется во время кипячения, и масло не позволяет лишним веществам растворяться в воде и достигать ногтя)
- Трубка 3 – вода, воздух и соль
- Трубка 4 – воздух, без воды (хлорид кальция удаляет воду из воздуха, а пробка предотвращает попадание лишнего)
Они должны убедиться, что гвозди в трубках 2 и 4 не ржавеют.Гвоздь в тюбике 3 ржавеет больше всего. Из этого они должны сделать вывод, что вода и воздух (на самом деле кислород в воздухе) необходимы для ржавления. Соль может увеличить скорость ржавления. Это может привести к дискуссии о защите от ржавчины и методах, которые можно использовать для предотвращения попадания воздуха и воды в утюг, таких как краска, жир и пластиковое покрытие.
Проще говоря, ржавчина – это реакция железа с кислородом, но вода также является важной частью этого процесса.
Дополнительная информация
Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом.Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов. Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические заметки и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016
Химическая реакция, вызывающая ржавчину
Ржавчина – это общее название оксида железа. Самая известная форма ржавчины – красноватый налет, образующий чешуйки на железе и стали (Fe 2 O 3 ), но ржавчина также бывает других цветов, включая желтый, коричневый, оранжевый и даже зеленый! Разные цвета отражают различный химический состав ржавчины.
Самая известная форма ржавчины – красноватый налет, образующий чешуйки на железе и стали (Fe 2 O 3 ), но ржавчина также бывает других цветов, включая желтый, коричневый, оранжевый и даже зеленый! Разные цвета отражают различный химический состав ржавчины.
Ржавчина, в частности, относится к оксидам на железе или железных сплавах, таких как сталь. Окисление других металлов имеет другие названия. Например, на серебре есть потускнение, а на меди – зеленоватый оттенок.
Ключевые выводы: как работает Rust
- Ржавчина – это общее название химического вещества, называемого оксидом железа.Технически это гидрат оксида железа, потому что чистый оксид железа – это не ржавчина.
- Ржавчина образуется при контакте железа или его сплавов с влажным воздухом. Кислород и вода в воздухе реагируют с металлом с образованием гидратированного оксида.
- Знакомая красная форма ржавчины (Fe 2 O 3 ), но железо имеет другие степени окисления, поэтому оно может образовывать ржавчину других цветов.
Химическая реакция, приводящая к образованию ржавчины
Хотя ржавчина считается результатом реакции окисления, стоит отметить , что не все оксиды железа являются ржавчиной .Ржавчина образуется, когда кислород вступает в реакцию с железом, но простого соединения железа и кислорода недостаточно. Хотя около 21% воздуха состоит из кислорода, в сухом воздухе ржавчины не происходит. Встречается во влажном воздухе и в воде. Для образования ржавчины необходимы три химиката: железо, кислород и вода.
железо + вода + кислород → гидратированный оксид железа (III)
Это пример электрохимической реакции и коррозии. Происходят две различные электрохимические реакции:
Происходит анодное растворение или окисление железа, переходящего в водный (водный) раствор:
2Fe → 2Fe 2+ + 4e-
Катодное восстановление кислорода, растворенного в воде, также происходит:
O 2 + 2H 2 O + 4e – → 4OH –
Ион железа и ион гидроксида реагируют с образованием гидроксида железа:
2Fe 2+ + 4OH – → 2Fe (OH) 2
Оксид железа реагирует с кислородом с образованием красной ржавчины Fe 2 O 3 . H 2 O
H 2 O
Из-за электрохимической природы реакции растворенные в воде электролиты способствуют реакции. Например, в соленой воде ржавчина возникает быстрее, чем в чистой.
Имейте в виду, что газообразный кислород (O 2) – не единственный источник кислорода в воздухе или воде. Двуокись углерода (CO 2) также содержит кислород. Диоксид углерода и вода реагируют с образованием слабой угольной кислоты. Угольная кислота – лучший электролит, чем чистая вода. Когда кислота атакует железо, вода распадается на водород и кислород.Свободный кислород и растворенное железо образуют оксид железа, высвобождая электроны, которые могут течь к другой части металла. Как только начинается ржавчина, она продолжает разъедать металл.
Предотвращение ржавчины
Ржавчина хрупкая, хрупкая, прогрессирующая и ослабляет железо и сталь. Чтобы защитить железо и его сплавы от ржавчины, поверхность нужно отделить от воздуха и воды. Покрытия можно наносить на утюг. Нержавеющая сталь содержит хром, который образует оксид, подобно тому, как железо образует ржавчину.Разница в том, что оксид хрома не отслаивается, поэтому он образует защитный слой на стали.
Дополнительные ссылки
- Gräfen, H .; Horn, E.M .; Schlecker, H .; Шиндлер, Х. (2000). «Коррозия». Энциклопедия промышленной химии Ульмана . Wiley-VCH. DOI: 10.1002 / 14356007.b01_08
- Holleman, A. F .; Виберг, Э. (2001). Неорганическая химия . Академическая пресса. ISBN 0-12-352651-5.
- Уолдман, Дж.(2015). Ржавчина – самая долгая война . Саймон и Шустер. Нью-Йорк. ISBN 978-1-4516-9159-7.
Что вызывает коррозию?
Что такое коррозия?
Коррозия – это естественный процесс, связанный с износом металлических компонентов. Согласно NACE International , коррозия – это «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». Это в конечном итоге приводит к потенциально серьезным повреждениям вашего здания или приложения и может стать очень дорогостоящим для ремонта .
Это в конечном итоге приводит к потенциально серьезным повреждениям вашего здания или приложения и может стать очень дорогостоящим для ремонта .
Как возникает коррозия
Коррозия – это электрохимическая реакция, которая проявляется в нескольких формах, таких как химическая коррозия и атмосферная коррозия, последняя из которых является наиболее распространенной формой. Когда кислотные вещества (включая воду) вступают в контакт с металлами, такими как железо и / или сталь, начинает образовываться ржавчина. Ржавчина является результатом коррозии стали после того, как частицы железа (Fe) подверглись воздействию кислорода и влаги (например, влажности, пара, погружения). Когда сталь подвергается воздействию воды, частицы железа теряются с кислотными электролитами воды.Затем частицы железа окисляются, что приводит к образованию Fe2. Когда образуется Fe⁺⁺, два электрона высвобождаются и проходят через сталь в другую область стали, известную как катодная область.
Кислород заставляет эти электроны подниматься вверх и образовывать ионы гидроксила (ОН). Ионы гидроксила реагируют с FE⁺⁺ с образованием водного оксида железа (FeOH), более известного как ржавчина. Там, где были затронутые частицы железа, теперь образовалась коррозионная яма, а там, где они сейчас находятся, это называется продуктом коррозии (ржавчиной).
Коррозия может произойти в любом случае, в зависимости от окружающей среды, в которой находится металл. Однако, поскольку атмосферная коррозия настолько широко распространена, рекомендуется принять эффективные меры предосторожности, когда дело доходит до предотвращения коррозии.
Это ржавый резервуар.Удаление и обработка ржавчины
В зависимости от ситуации и применения вы можете обработать заржавевший участок. Если пораженный участок небольшой и поддается лечению, вам могут потребоваться некоторые инструменты и средства для его удаления.Начните с удаления ржавчины с металла с помощью таких инструментов, как шлифовальный круг или игольчатый пистолет. Будьте осторожны, чтобы не повредить металл.
Будьте осторожны, чтобы не повредить металл.
Для больших участков, подверженных коррозии, вам может потребоваться постоянное защитное покрытие, такое как антикоррозионное защитное покрытие SI-COAT компании CSL. Вы также можете потратить это время на то, чтобы посмотреть на приложение в целом на предмет других преждевременных признаков коррозии.
Как предотвратить коррозию?
Одним из лучших способов предотвращения коррозии является нанесение антикоррозионного защитного покрытия .Защитное покрытие защищает субстрат, предотвращая контакт субстрата с агрессивными средами (атмосферными, химическими и т. Д.). Здесь, в CSL Silicones Inc, мы предлагаем два вида антикоррозионных защитных покрытий (один – экологически безопасный вариант с низким содержанием летучих органических соединений!), Которые легко наносятся одним слоем. Защитное покрытие Si-COAT® 579 AC является экономичным и обеспечивает долговременную защиту практически любой подложки.
Покрытия экологически безопасны, обладают превосходной термостойкостью (выдерживают температуры от -76 ° F до 392 ° F), не выгорают и не выгорают, имеют слабую пленку, требуют нанесения только одного слоя и обладают отличными характеристиками. Устойчивость к ультрафиолетовому излучению.Эластичность 180% делает покрытие очень гибким, что допускает тепловое расширение и сжатие основы, на которую оно наносится.
| Слева: резервуар, подверженный коррозии. | Справа: Тот же резервуар после нанесения антикоррозионного защитного покрытия Si-COAT 579. |
Si-COAT Anti-Corrosion Protective Coatings может применяться в широком диапазоне применений, таких как конструкционная сталь, мосты, машины и оборудование, области с сильной коррозией, внешние поверхности резервуаров, металлические крыши, облицовка и многое другое.
идеально подходят для нанесения там, где требуется необходимое покрытие и максимальная защита, адгезия, эластичность и долговечность.
Если вас интересует защита от коррозии, посетите страницу Антикоррозийные защитные покрытия, стр. , для получения дополнительной информации.
Стадий ржавчины | Блог Hardscape
Для некоторых металлов ржавчина – это хорошо
Металл как материал, отвечающий жестким промышленным требованиям и обладающий привлекательной эстетикой, используется для изготовления изделий повсюду.Металлы обладают устойчивостью и прочностью в тяжелых условиях эксплуатации и в расходных материалах. В инфраструктуре металл можно разнообразно стилизовать, чтобы он гармонировал как с традиционным, так и с современным стилем.
При первичном фрезеровании или литье нового высококачественного металла металл обычно имеет однородный цвет поверхности и не имеет следов травления или точечной коррозии. Благородные металлы, такие как золото или платина, сохраняют эту однородную безупречную поверхность в большинстве сред. Однако неблагородные металлы подвергаются процессу окисления при воздействии влажного воздуха.Это окисление может быть коррозионным и медленно разъедать металл, или может образовывать патину на уровне поверхности, которая меняет внешний вид металла, но защищает целостность его структуры.
Хорошо сделанный чугун приобретает темную медную патину, когда достигает третьей стадии ржавчины.Металлы и окисление
Окисление происходит с течением времени, поскольку необработанный металл подвергается воздействию воздуха и влаги из атмосферы. При образовании стойкой патины на поверхности металла образуется окалина, представляющая собой сочетание твердых минеральных покрытий и коррозионных отложений.Патина может давать много разных оттенков, оттенков и цветов, потому что химический состав каждой патины уникален для сплава и его воздействия на элементы. Ржавчина относится к оксидам, образующимся на железе и стали: коричневые, черные и характерные чешуйчатые красные элементы ржавого железа и стали представляют собой разные типы закиси железа.
Ржавчина относится к оксидам, образующимся на железе и стали: коричневые, черные и характерные чешуйчатые красные элементы ржавого железа и стали представляют собой разные типы закиси железа.
Патина может добавить индивидуальности памятнику или архитектурному объекту и придать ему историческую привлекательность. Возьмем, к примеру, Статую Свободы, знаковый символ свободы и демократии – ее насыщенный сине-зеленый оттенок вызван окислением.Внешний слой статуи состоит из меди. Когда он был первоначально собран, он был однородно коричневого цвета. Со временем в результате окисления и выветривания на поверхности образовался тонкий слой карбоната меди, который иногда называют зеленым, что дает уникальный цвет, достигаемый сегодня.
Статуя Свободы когда-то была медно-коричневой, но известна своим сине-зеленым оттенком – результатом окисления.Некоторые сплавы справляются лучше, чем другие, когда дело доходит до окисления. В стали ржавчина обычно агрессивна и вызывает коррозию, разъедает и травит металл.Действия по предотвращению коррозии следует выполнять на протяжении всего срока службы. Однако для сплавов, таких как чугун, медь, алюминий, хром и цинк, оксиды могут образовывать покрытие, которое защищает металл от дальнейшего воздействия. Этот тип окисления не опасен, и его способность изменять цвет металла часто востребована из-за его деревенского шарма.
Не всякая ржавчина агрессивна
Обнаружение следов ржавчины на поверхности металла не обязательно означает нарушение его структурной целостности.И сплав, и способ приготовления металла определяют, является ли окисление агрессивным или нет. В сплавах, таких как чугун, алюминий и медь, окисление может создавать прочные и защитные соединения, которые предотвращают точечную коррозию металла под ними.
Стадии ржавчины
1 этап
На первой стадии образования ржавчины на поверхности металла становятся заметны красные, черные или белые отложения. Обычно это проявляется небольшими пятнами, поскольку общий цвет поверхности металла становится более пятнистым и менее однородным. В чугуне это первый шаг к образованию прочной патины. Нержавеющая сталь зависит от оксида хрома в качестве защитной пленки, а не от оксида железа, поэтому эта ржавчина является дефектом этой защитной пленки. Тем не менее, в случае нержавеющей стали Этап 1 представляет собой поверхностную проблему, которую при желании можно легко устранить.
В чугуне это первый шаг к образованию прочной патины. Нержавеющая сталь зависит от оксида хрома в качестве защитной пленки, а не от оксида железа, поэтому эта ржавчина является дефектом этой защитной пленки. Тем не менее, в случае нержавеющей стали Этап 1 представляет собой поверхностную проблему, которую при желании можно легко устранить.
2 этап
Для сталей и некоторых типов железа стадия 2 представляет собой первое реальное разложение металла, поскольку начинает образовываться накипь с молекулами, составляющими первые слои металла.Во многих черных металлах эта окалина неравномерна, и начинается процесс точечной коррозии или травления, что приводит к ослаблению материала. В чугуне образуется ровная окалина, которая не вызывает травления или точечной коррозии.
На этой стадии производится несколько оксидов. Ярко-оранжевый / красный оксид железа (III), который мы ассоциируем с ржавчиной, можно удалить щеткой. Он оставит порошкообразный красный пигмент на руках или дождевой воде. Отсутствие адгезии этого оксида связано с тем, что молекулы красного оксида железа больше, чем молекулы чугуна, которые их создали.
Однако в хорошо подготовленном чугуне оксиды, которые не отслаиваются и не стекают, также образуются равномерно. Они более темные, обычно коричневого или медного цвета. Этот слой ржавчины формируется равномерно, так что целостность основного металла не нарушается.
3 этап
На стадии 3 все поверхностные молекулы, образующие красные оксиды железа, задействованы и находятся в порошкообразном или гранулированном состоянии. Масштабирование продолжается. По мере того как ржавый порошок красного железа становится рыхлым и отпадает, оставшиеся более темные оксиды железа остаются в прочном герметизирующем слое.Цвет металла потемнеет до бронзового или темно-коричневого по мере того, как ярко-оранжевый и красный смахнут его. Со временем патина растечется по всей поверхности. Как только патина достигнута, она становится стойкой и защитной и не требует ухода.
Время, необходимое для появления патинирования, зависит от типа сплава, износа и влажности окружающей среды. Для таких сплавов, как чугун, патинирование происходит довольно быстро.Металлические изделия возле океана также будут быстро патинировать, поскольку они подвержены воздействию высоких уровней влажности и солей в воздухе по сравнению с изделиями в более сухих условиях.
Патины на обнаруживаемых предупредительных табличках
Есть определенные продукты с жестким дизайном, где ржавая патина приветствуется, так как влияние на цвет имеет жизненно важное значение для их характеристик. Это касается обнаруживаемых предупреждающих табличек, формы тактильного покрытия, где важен цветовой контраст.
Обнаруживаемые предупреждающие таблички сообщают слабовидящим пешеходам о городской навигации, сигнализируя об изменении уровня или переходе с тротуара на улицу.Усеченные купола пластин ощущаются под ногами, а патина на пластинах создает четкий цветовой контраст на фоне окружающего тротуара.
Хотя цветовой контраст может быть достигнут с помощью краски или порошкового покрытия, нет более простой альтернативы, чем оставить пластины сырыми, чтобы могла образоваться естественная патина. Это означает, что пластины не требуют технического обслуживания или доработки в течение всего срока службы, а патина также обеспечивает защиту от вредной точечной коррозии.
Один из самых простых способов добиться цветового контраста обнаруживаемых предупреждающих табличек – это патинирование.Работа с ржавчиной
Первый шаг в понимании ржавчины – это осознать, что это не всегда угроза и не обязательно должна быть неприглядной. Для многих сплавов ржавчина или патинация являются практическим решением, исключающим длительное обслуживание. Сплав защищен тонким оксидным слоем, а эксперименты с патиной позволяют оживить различные оттенки и оттенки.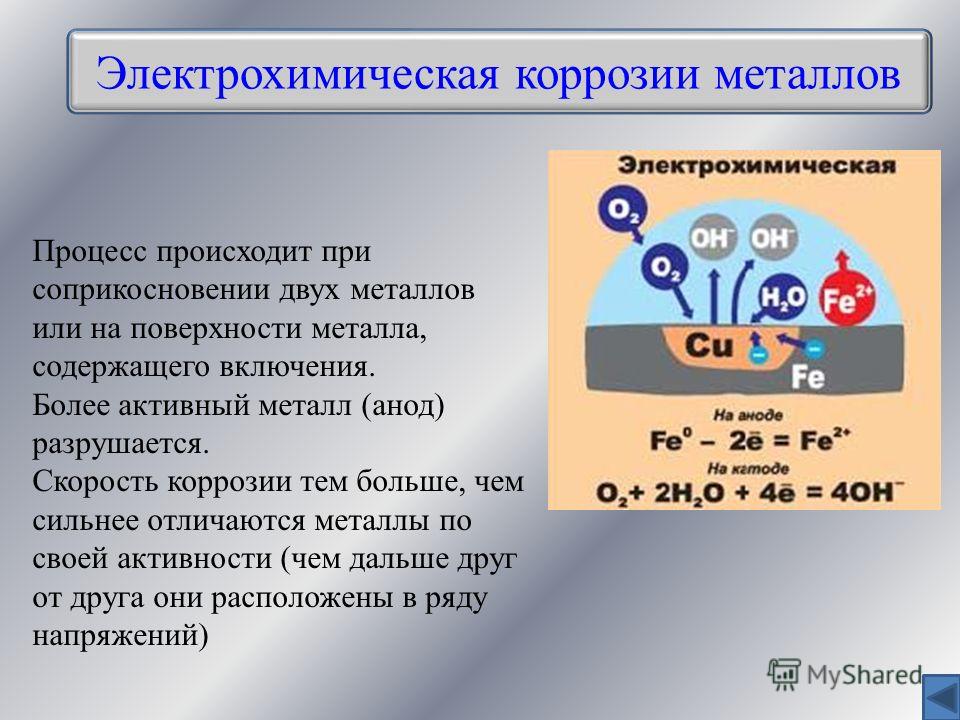 На протяжении всей истории люди играли на способности металла патинировать, а не противодействовали ему, извлекая выгоду из способности природы защищать и улучшать.
На протяжении всей истории люди играли на способности металла патинировать, а не противодействовали ему, извлекая выгоду из способности природы защищать и улучшать.
Что вызывает ржавчину? | HinderRUST
Мы видим ржавчину на автомобилях, грузовиках, водостоках в наших домах, на лодках и машинах – но что такое ржавчина и почему она возникает?
Ржавчина – это результат естественного процесса, при котором железо в металлах вступает в контакт с кислородом и водой, вызывая коррозию и разрушение. Поскольку железо и кислород имеют противоположные заряды, они притягиваются друг к другу, как если бы они были магнитами. Когда они сочетаются, это называется окислением, и возникающая химическая реакция вызывает образование оксида железа – ржавчины.Обычно он красного или черного цвета, и процесс ржавления часто происходит быстрее в определенных условиях, когда он подвергается воздействию соли, кислот, химикатов и изменений температуры.
Почему ржавчина является такой проблемой?
Ржавчина не только непривлекательна на вид, она на самом деле вызывает разложение металла, становясь шелушащимся, слабым и рассыпчатым. Это означает, что металлы превращаются из одного из самых прочных материалов на Земле в один из самых слабых, что делает его серьезной проблемой для всего, от автомобилей и оружия до производственного оборудования, поездов, грузовиков, лодок и металлических конструкций.
Hinder
RUST : универсальный антикоррозионный продуктПредотвращение ржавчины – это регулярный осмотр и техническое обслуживание ваших автомобилей, лодок и других металлических конструкций. Если вы видите небольшие пятна образования ржавчины, немедленно нанесите проверенный ингибитор коррозии и ржавчины в соответствии с инструкциями производителя. Это остановит процесс окисления, удалит пятна ржавчины и нанесет антикоррозийное покрытие на уязвимое место.
Разработанный на основе передового опыта в отрасли, Hinder RUST – это антикоррозионный продукт, который представляет собой не содержащий растворителей ингибитор ржавчины, антикоррозионную смазку и смазку для защиты от коррозии – все в одном. Простой в использовании и доступный по цене, этот спрей для защиты от ржавчины является лидером в области предотвращения и контроля коррозии, облегчая обслуживание, хранение и защиту металлического оборудования.
Простой в использовании и доступный по цене, этот спрей для защиты от ржавчины является лидером в области предотвращения и контроля коррозии, облегчая обслуживание, хранение и защиту металлического оборудования.
Для получения дополнительной информации о наших продуктах, пожалуйста, свяжитесь с нами сегодня по телефону 507-205-9216 или приобретите наши антикоррозионные продукты здесь.
От чего гвоздь ржавеет?
Обновлено 26 марта 2020 г.
Автор: Rosann Kozlowski
Проверено: Lana Bandoim, B.S.
На серебряном блеске нового ногтя со временем могут появиться красновато-коричневые пятна, особенно при длительном воздействии элементов.Это знакомое начало ржавчины. Причины ржавления являются химическими и связаны с реакциями с водой и кислородом.
Химические причины коррозии
Причины коррозии требуют наличия воды и кислорода . Вода может соединяться с углекислым газом в воздухе с образованием углекислоты, слабой кислоты.
Когда этот кислый раствор достигает железа, происходят две реакции. Во-первых, подкисленная вода (хороший электролит – подробнее об этом позже) растворяет часть железа, удаляя электроны.Затем вода начнет распадаться на водород и кислород. Свободный кислород реагирует с растворенным железом с образованием оксида железа, а оксид железа представляет собой ржавчину.
Из этого объяснения можно составить словесное уравнение для ржавчины:
Железо + вода + кислород → оксид железа (ржавчина)
Результирующая химическая реакция ржавчины
Результирующая химическая реакция ржавления:
4Fe (s ) + 3O 2 (г) + 6H 2 O (л) → 4Fe (OH) 3 (с)
Эта пористая ржавчина, Fe (OH) 3 (с) реагирует с дополнительным кислородом, образуя дают более кристаллизованную ржавчину с формулой Fe 2 O 3 . xH 2 0. Гидратированный оксид железа (III) (Fe 2 O 3 ) имеет присоединенную воду с приблизительно 3/2 H 2 O; количество воды не фиксировано, поэтому x перед H 2 0.
xH 2 0. Гидратированный оксид железа (III) (Fe 2 O 3 ) имеет присоединенную воду с приблизительно 3/2 H 2 O; количество воды не фиксировано, поэтому x перед H 2 0.
Эта реакция, однако, происходит поэтапно.
Электрохимический процесс ржавчины
Металлы, такие как железо, растворяются в электрохимическом процессе. Это означает, что процесс действует как электрохимический элемент (обычно его называют батареей).
Анод будет местом, где металл подвергается напряжению или поврежден. Катод – еще одна часть металла, не подверженная коррозии. Вода действует как электролит – мостик – и переносит ионы, чтобы поддерживать движение потока электронов или, в данном случае, потока электронов, которые разъедают анодную область железа.
Все электрохимические процессы включают тип химической реакции, называемой окислительно-восстановительной или окислительно-восстановительными реакциями.В окислительно-восстановительной реакции происходит перенос электронов. При коррозии электроны переносятся с поверхности металла на подходящие акцепторы электронов, такие как кислород и водород.
Двухступенчатые химические реакции ржавчины
Окислительно-восстановительные реакции часто можно рассматривать как полуреакции, чтобы увидеть, как движутся электроны в реакции. В полуреакции окисления электроны теряются, в полуреакции восстановления – электроны.
Когда вода вступает в контакт с железом, Fe, железо теряет электроны в процессе окисления:
- На аноде, полуреакция окисления: Fe (s) → Fe 2+ (водн.) + 2_e_ –
Одновременно на катоде полуреакция восстановления может быть:
- Восстановление газообразного кислорода: O 2 (г) + 2H 2 O (л) + 4e – → 4OH – (вод.




 Суть этого метода в удалении вредоносных составляющих окружения. Например, нейтрализовать воздействие воды можно добавлением 0,5% бихромата калия.
Суть этого метода в удалении вредоносных составляющих окружения. Например, нейтрализовать воздействие воды можно добавлением 0,5% бихромата калия.
 Вставьте пробку в эту трубку, чтобы вода не попала внутрь.
Вставьте пробку в эту трубку, чтобы вода не попала внутрь.