Ржавеет сталь: Почему «нержавейка» ржавеет
alexxlab | 27.05.2019 | 0 | Разное
Почему «нержавейка» ржавеет
Почему «нержавейка» ржавеет
Ржавчина на нержавеющей стали вызывает много вопросов. Действительно ли эта сталь нержавеющая? Если это нержавейка, то почему она заржавела? Откуда берется ржавчина?
Нержавеющие стали устойчивы к коррозии потому, что в их состав входит хром. Когда этот элемент присутствует в стали в достаточном количестве и подвергается окислительному воздействию кислот, щелочей, воды, воздуха и других сред, он образует очень тонкий (130 ангстрем) непроницаемый слой оксида хрома CrO, который препятствует коррозии и делает сталь нержавеющей. Хром должен быть распределен равномерно в структуре стали для того, чтобы она стала «нержавейкой». Коррозия (ржавчина) образуется на поверхности из нержавеющей стали тогда, когда недостаточно легирующего хрома для создания и поддержания необходимого оксидного слоя.
Практически все случаи появления ржавчины на поверхности нержавейки обусловлены повреждением защитного слоя оксида хрома.
При изготовлении изделий из нержавеющей стали повреждение защитного слоя связано с термическим и механическим воздействием (сварка и шлифовка). Хром окисляется медленно. Поэтому новые изделия особенно «чувствительны» к неблагоприятным факторам и требуют более тщательного ухода.
Другое условие, при котором ржавление может возникнуть на нержавеющей стали — это ее контакт с обычной углеродистой или низколегированной сталью. Эксплуатация изделий из нержавеющей стали должна предусматривать отсутствие ее контакта с обыкновенной сталью. Нельзя проводить ремонт в помещениях, где установлены или складируются изделия из нержавеющей стали. При строительных работах металлическая пыль от резки арматуры или прочих стальных конструкций попадет на нержавеющую поверхность и приклеивается к ней, что ведет к точечным источникам коррозии (ржавчины), удалить которые с изделия можно лишь при помощи мелкого (специального для нержавейки) абразива.
Повреждение защитного слоя возможно и в процессе эксплуатации. При работе стальными ножами и другими твердыми предметами непосредственно на столешнице возможно появление царапин. Во время разделки мяса или мороженой рыбы при сильных ударах ножом поверхность столешницы может быть даже повреждена насквозь. Используйте в таких случаях разделочные доски.
Большое значение для сохранения свойств нержавейки имеет качество водопроводной воды. Мыть изделия и вытирать их насухо рекомендуется сразу после использования, не допуская засыхания грязи и остатков пищи. Имейте в виду, что в водопроводной воде содержится определенное количество металлических частиц, поэтому при свободном высыхании воды, на нержавеющей поверхности может появляться налет желтоватого цвета, который удаляется моющими средствами. Такой налет образуется даже на фаянсовых изделиях.
Врагом оксидной пленки являются фтор, хлор, бром, йод. Поэтому необходима установка фильтров воды при превышении в ней содержания этих элементов.
Именно поэтому при чистке нержавеющих поверхностей нельзя использовать хлорсодержащие вещества, например, белезну. По этой же причине более тщательный уход требуется за изделиями, контактирующими с морской или минеральной водой.
Уход за оборудованием заключается в ежедневной влажной уборке с использованием неагрессивных и не содержащих твердых абразивных веществ моющих средств. После окончания уборки изделие следует ополоснуть и насухо протереть.
Для мытья и чистки изделий лучше пользоваться средствами, предназначенными специально для нержавеющей стали. Недопустимо применять чистящие и дезинфицирующие средства, содержащие в составе хлор, твердые абразивные вещества, кислоты и соду.
Средства, используемые для ухода за нейтральным оборудованием по содержанию кислот, щелочей, хлора, солей должны соответствовать требованиям СанПиН, СНиП и ГОСТ. Уровень рН должен находиться в пределах 7,2 — 7,6.
Самый простой и эффективный способ борьбы с коррозией нержавеющей стали это ЧИСТОТА. Посмотрите на нержавеющую кухонную раковину в любом доме — она подвергается воздействию самых различных химических веществ, но ее поверхность всегда остается яркой.
Почему ржавеет нержавейка?
Иногда приходится слышать от заказчиков пожелание, чтобы при изготовлении изделия из нержавейки под заказ была использована сталь, которая не будет ржаветь. Иногда просят, чтобы была “не китайская”. От чего зависит будет ли ржаветь нержавейка? Почему вообще это происходит?
По сути могут быть две причины. Первая – условия эксплуатации в агрессивной среде. И вторая – дефекты материала.
Рассмотрим эти явления подробнее.
Не все виды нержавеющей стали предназначены для эксплуатации в агрессивных средах. Например на пищевых производствах при технологических процессах используются хлорсодержащие моющие средства и там могут должна применяться нержавеющая сталь с повышенной коррозионной устойчивостью. То же самое относится к условиям эксплуатации в морской воде. По этой причине оборудование, например, из AISI 304 может попросту придти в негодность. Для агрессивных сред имеет смысл использовать AISI 316 или дуплексные виды нержавеющей стали, такие как Ferralium SD40, SAF 2205 или Zeron 100.
Вторая причина более распространена – ржавчина может возникнуть на поверхности металла в следствии механических повреждений или термической обработки(вызванные сваркой). Это так называемая точечная коррозия. Этот вид коррозии может начаться в металле где присутствуют посторонние примеси, например такие как сера.
Гладкая поверхность нержавеющего металла менее подвержена точечной коррозии чем шероховатая. На графике приведенном ниже показана зависимость коррозионной устойчивости от шероховатости поверхности. Эксперимент проводился с коррозионноустойчивой маркой нержавеющей стали AISI 316 в хлорсодержащей среде. На графике видно, что после того как шероховатость поверхности превышает Ra > 0,5 мкм, устойчивость к коррозии резко снижается. Таким образом, шероховатая поверхность AISI 316 делает ее коррозионную устойчивость даже хуже, чем полированная поверхность AISI 304.
На графике приведенном ниже показана зависимость коррозионной устойчивости от шероховатости поверхности. Эксперимент проводился с коррозионноустойчивой маркой нержавеющей стали AISI 316 в хлорсодержащей среде. На графике видно, что после того как шероховатость поверхности превышает Ra > 0,5 мкм, устойчивость к коррозии резко снижается. Таким образом, шероховатая поверхность AISI 316 делает ее коррозионную устойчивость даже хуже, чем полированная поверхность AISI 304.
Следы ржавчины могут появиться даже в местах куда попала раскаленная окалина. Это происходит потому, что при температуре сварки выгорают легирующие элементы, в первую очередь хром. На металле в местах сварки образуются “следы побежалости”(иногда называют следы термического воздействия). В этих местах нержавейка неизбежно начнет ржаветь. Слой ржавчины, однако, может остаться только на поверхности металла, там где нет оксидной пленки, которая образуется благодаря хрому. То есть в глубь ржавчина развиваться не будет. Но выглядят следы побежалости и тем более ржавчина очень не эстетично. Чтобы этого не произошло сварочный шов обрабатывают специальными эмульсиями, травильными пастами или при помощи абразивных материалов. При очистке шва от железных окислов(окалины окисей) травильными пастами, следует работать в защитных очках и наносить только на остывший металл, поскольку в них может содержатся плавиковая кислота. После очистки зону сварного шва необходимо подвергнуть операции пассивации. Пассивация металла – это процесс обработки поверхности с целю образования на ней слоев соединений препятствующих коррозии. То есть недостаточно только очистить сварной шов от продуктов сварки, необходимо так же восстановить защитный слой. Для этого так же существует разнообразная химия: гели, пасты. Иногда используют для пассивации нержавейки азотную или лимонную кислоту.
Существуют инновационные методы очистки и пассивации. Например метод электро-химической пассивации нержавеющего металла. Причем этот процесс осуществляется без применения продуктов травления, которые очень вредны для здоровья и окружающей среды. Компания “Строй Металл” использует оборудование компании Surfox. Благодаря этому производительность и качество работ позволяют нам выполнять заказы по изготовлению изделий из зеркальной нержавейки для элитных магазинов одежды, ресторанов, элементов интерьера.
Причем этот процесс осуществляется без применения продуктов травления, которые очень вредны для здоровья и окружающей среды. Компания “Строй Металл” использует оборудование компании Surfox. Благодаря этому производительность и качество работ позволяют нам выполнять заказы по изготовлению изделий из зеркальной нержавейки для элитных магазинов одежды, ресторанов, элементов интерьера.
Рекомендуем ознакомиться со статьями:
Виды нержавеющей стали
Виды коррозии нержавеющей стали
Шлифованная или полированная нержавейка.
Почему ржавеет нож. Причины, способы устранения ржавчины. | Лучшие статьи, обзоры и новости
Большинство взрослых людей каждый день пользуются ножами. Они могут быть абсолютно разными — складными EDC, мощными охотничьими, обычными кухонными. Что объединяет все эти ножи, так это то, что у них есть клинок, который может ржаветь. Конечно, какая-то сталь ржавеет меньше, какая-то больше. Но при определенных условиях, даже на Sandvik 12C27 могут появиться предательские рыжие пятна.
Что такое ржавчина?
Прежде всего разберемся, что такое ржавчина. Ржавчиной называется оксид железа, обозначаемый химической формулой Fe2O3. Он образуется, когда железо из вашего стального клинка соединяется с кислородом из атмосферы. Если говорить более подробно, то ржавчина это гидратированный оксид железа (III), также известный как оксид железа (Fe2O3), он возникает, когда железо реагирует с кислородом и водой — эта реакция называется окислением.
Теперь, когда мы знаем, что эта рыжая поверхность является оксидом железа, разберемся при каких условиях ржавеет нож. Для этого необходимы три вещи: кислород, железо и вода. Кислород поступает из атмосферы, он присутствует в воздухе вокруг нас. Железо является основным материалом в стальных клинках. Вода не обязательно должна быть в жидком виде. Влажного воздуха будет достаточно, чтобы вызвать ржавчину.
Железо является основным материалом в стальных клинках. Вода не обязательно должна быть в жидком виде. Влажного воздуха будет достаточно, чтобы вызвать ржавчину.
Почему некоторые стали ржавеют сильнее?
Большинство типов сталей для клинка можно классифицировать или как нержавеющие или как углеродистые.
Углеродистая сталь – это сталь с повышенным содержанием углерода. Стали могут содержать примеси различных металлов. Тем не менее, именно процент углерода, содержащийся в клинке, играет в процессе окисления главную роль. Обычно клинки из углеродистой стали содержат от 0,5 до 1,5% углерода. Это делает нож очень прочным и долговечным. Но из-за того, что углерод также реагирует с кислородом воздуха, клинки из такой стали гораздо больше подвержены коррозии.
Клинки из нержавеющей стали содержат различные присадки, например хром, содержание которого обычно составляет от 12,5% до 13,5%. Это создает оксидный слой на поверхности клинка, который предотвращает дальнейшее окисление стали. В результате коррозия замедляется, поэтому сталь и называется «нержавеющая». Ножи из нержавеющей стали являются хорошим выбором для агрессивных сред, таких как море. Тем не менее, ножи из нержавейки также могут ржаветь, особенно в суровых условиях.
Существуют и другие материалы для клинков, например титан или керамика. Поскольку они не содержат железа, они не ржавеют и нож не будет подвержен коррозии. Другой фактор, который следует учитывать, является покрытие клинка. Некоторые ножи имеют специальные покрытия, например из нитрида титана или оксида алюминия, которые делают их более устойчивыми к коррозии.
Опасна ли ржавчина?
Ржавчина сама по себе не опасна, и вы не умрете, если съедите что-нибудь порезанное ржавым ножом. Однако, особо сильная коррозия может снизить качество клинка, и сделать его более хрупким.
Способы удаления ржавчины
1. ХИМИЧЕСКИЕ РАСТВОРИТЕЛИ
ХИМИЧЕСКИЕ РАСТВОРИТЕЛИ
Есть много типов химикатов, которые можно использовать для удаления ржавчины с вашего ножа. Популярным является WD-40 (однако он токсичен, поэтому лучше потом не нарезать еду этим ножом).
Шаг 1: Очистите нож от пятен или загрязнений.
Шаг 2: Опрыскайте клинок растворителем.
Шаг 3: Используйте тонкую наждачную бумагу, чтобы очистить клинок от пятен ржавчины.
Шаг 4: При необходимости повторите, затем протрите, промойте и высушите нож.
2. СОДА
Шаг 1: Намочите область с коррозией водой и посыпьте пищевой содой. Пищевая сода должна прилипать к влажной зоне. Аккуратно постучите ножом, чтобы лишняя часть упала.
Шаг 2: Используйте влажную чистящую салфетку, чтобы вычистить область, покрытую пищевой содой.
Шаг 3: После нескольких минут очистки ржавчина должна исчезнуть. Повторите при необходимости, затем ополосните нож водой и вытрите его тканью.
3. УКСУС
Шаг 1: Налейте уксус в широкий контейнер.
Шаг 2: Погрузите нож (или только клинок) в уксус. Удерживать в течение 5 минут. Слишком долго лучше не оставлять, это может повредить клинок.
Шаг 3: Протрите лезвие тканью. Затем промыть и высушить нож.
4. НАЖДАЧНАЯ БУМАГА
Наждачная бумага с мелкой зернистостью (3000) обычно хорошо работает с небольшими пятнами ржавчины. Просто возьмите маленький кусочек тонкой наждачной бумаги и аккуратно протрите им коррозионное пятно, пока оно не исчезнет. Убедитесь, что вы используете мелкую наждачную бумагу. В противном случае можно повредить отделку клинка или сам клинок, в частности поцарапать или затупить его.
5. КАРТОФЕЛЬ
Картофель содержит щавелевую кислоту, которая может растворять ржавчину. Можно оставить нож между двух половинок картофеля на несколько часов. И после этого стереть ржавчину тканью.
6. ЛУК
ЛУК
Лук содержит сульфеновые кислоты, которые могут помочь растворить оксид железа. Действовать нужно также как в случае с картофелем.
Заключение
Для того, чтобы ваш любимый нож никогда не подвергся коррозии, за ним нужно правильно ухаживать.
Самые основные советы по уходу за ножом:
- Во-первых, мыть после использования. Независимо от того, резали ли вы древесину или потрошили рыбу, у вас всегда останется какая-то часть загрязнения на клинке. Удалите остатки водой и мягкой стороной губки, затем тщательно вытрите нож тканью. Не пропускайте этот шаг, иначе ваш нож обязательно заржавеет.
- Во-вторых, храните соответствующим образом. В помещении нож лучше всего хранить в каком-то сухом ящике или шкафу. Если вы на улице, держите его в кармане, ножнах или специальных чехлах. Стараться не допускать попадания влаги.
- Использовать специальное масло для ножа, чтобы предотвратить контакт между клинком и атмосферой.
Надеемся, что эта статья поможет вам удалить ржавчину с вашего ножа. Помните, что лучший способ защитить нож от ржавчины – это предотвратить её появление. Убедитесь, что вы всегда держите свой нож в идеальном состоянии, чтобы он работал как можно лучше.
Теперь, когда ваш нож чист, пришло время его заточить.
Почему нержавеющая сталь не ржавеет. «Морская» нержавейка
По статистике примерно пятая часть всего годового производства стали в мире уходит на замену стальных деталей, поврежденных ржавчиной. Это составляет значительные экономические потери, большей части которых можно было бы избежать, добавляя в сталь специфические элементы, значительно улучшающие ее свойства: хром (Cr), вольфрам (W), никель (Ni), ванадий (V), молибден (Mo) , кремний (Si), марганец (Mn) и др. Данный вид стали называется — Легированной. Изменение химического состава приводит к изменению структуры стали и ее свойств. Легированная сталь приобретает свойства, которых нет у обычной углеродистой стали, и исключает ее недостатки. Изделия из нержавеющей стали экологичны, соответствуют всем требованиям и нормам гигиены, поэтому также нашли широкое применение при производстве кухонной посуды. По химическому составу различают низко-, средне- и высоколегированную сталь.
Легированная сталь приобретает свойства, которых нет у обычной углеродистой стали, и исключает ее недостатки. Изделия из нержавеющей стали экологичны, соответствуют всем требованиям и нормам гигиены, поэтому также нашли широкое применение при производстве кухонной посуды. По химическому составу различают низко-, средне- и высоколегированную сталь.
Остановимся подробнее на завоевывающую все большую популярность высоколегированной нержавеющей стали, противостоящей коррозии как в агрессивных средах, так и в атмосфере. Основная составляющая нержавеющей стали также железо. Антикоррозионные свойства ей придают легирующие элементы, в первую очередь хром и никель. От количества и пропорционального содержания этих элементов зависит марка стали и ее технические свойства, которые влияют на коррозионную устойчивость и внешний вид.
- Всего различают пять больших групп нержавеющих сталей, определяемых их микроструктурой. Наиболее распространенными являются три из них:
- Аустенитные (Austenitic) — не магнитная сталь с основными составляющими 15-20% хрома и 5-15% никеля, которые увеличивают сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа.
- Мартенситные (Martensitic) – в связи с большим содержанием углерода, значительно более твердые, чем аустетнитные и ферритные стали. Могут быть магнитными. Находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше подвержены коррозии.
- Ферритные (Ferritic) стали содержат меньшее количество углерода, поэтому значительно более мягкие, чем мартенситные. Они также обладают магнитными свойствами. Эти стали применяют для изготовления изделий, работающих в окислительных средах (например, в растворах азотной кислоты), для бытовых приборов, в пищевой, легкой промышленности и для теплообменного оборудования в энергомашиностроении.
 Ферритные хромистые стали имеют высокую коррозионную стойкость в азотной кислоте, водных растворах аммиака, в аммиачной селитре, смеси азотной, фосфорной и фтористоводородной кислот, а также в других агрессивных средах. К этому виду относятся все стали 400 серии.
Ферритные хромистые стали имеют высокую коррозионную стойкость в азотной кислоте, водных растворах аммиака, в аммиачной селитре, смеси азотной, фосфорной и фтористоводородной кислот, а также в других агрессивных средах. К этому виду относятся все стали 400 серии.
Самая широкая и востребованная группа из этих категорий стали- аустенитные, составляющие примерно 90% общего потребления нержавеющей стали. К этому виду относятся нержавеющие стали 300-ой серии: aisi 304, aisi 316, aisi 316T, aisi 321.
Из-за универсальности своих физических характеристик наиболее популярна из многочисленных марок нержавеющей стали — AISI 304 (08Х18Н10). В ней содержится 18% Хрома (Cr) и 8% Никеля (Ni). Благодаря высокому содержанию никеля на поверхности стали образуется оксидная пленка, защищающая металл от коррозии и воздействия агрессивных химических веществ. Практически на любых поверхностях при резких перепадах температуры образуются микротрещины, при попадании жидкости в эти трещины, основной металл коррозирует и со временем разрушается. В случае с нержавеющей сталью, даже при механическом повреждении верхний слой при доступе кислорода самовосстанавливается и изделие полностью сохраняет свои антикоррозийные свойства. Этим обусловлено ее широкое применение во многих отраслях промышленности и быту.
Однако, существуют отрасли, требующие в применении специфические материалы и приспособления: химическая, нефтегазовая, пищевая промышленности, а также судоходство и судостроение. Все большее распространение получает улучшенная версия стали AISI 304 (08Х18Н10)- AISI 316 (10Х17Н13М2) с добавлением молибдена (Мо). К примеру, практически все оборудование для целлюлозных заводов и для предприятий по изготовлению бумаги изготавливаются из нержавеющих сталей. Минимально допустимой маркой является AISI 316.
Технические характеристики материала
| состав | материал | |
|---|---|---|
AISI 316 L 1. 4404 4404 | AISI 304 L 1.4301 | |
| Углерод (С %) | макс. 0,03 | макс. 0,07 |
| Хром (Cr %) | 16,5 – 18,5 | 17,0 – 19,0 |
| Никель (Ni %) | 11,0 – 14,0 | 8,5 – 10,5 |
| Молибден (Mo %) | 2,0 – 2,5 | — |
| Марганец (Mn %) | макс. 2,0 | макс. 2,0 |
| Кремний (Si %) | макс. 1,0 | макс. 1,0 |
| Сера (S %) | макс. 0,03 | макс. 0,03 |
Молибден делает сталь более защищенной от щелевой и питтинговой коррозии в хлористой, морской воде и в сильноагрессивных средах: серной, фосфорной, борной, муравьиной, уксусной, щавелевой, молочной и других кислотах. Недаром этот вид стали называют «морской нержавейкой».
Таблицы воздействия некоторых кислот и их растворов на нержавеющую сталь:
| марка AISI 316 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Температура | 20° | 80° | ||||||||||
| Концентрация, % к массе | 10 | 20 | 40 | 60 | 80 | 100 | 10 | 20 | 40 | 60 | 80 | 100 |
| Серная Кислота | 0 | 1 | 2 | 2 | 1 | 0 | 2 | 2 | 2 | 2 | 2 | 2 |
| Азотная Кислота | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 2 |
| Фосфорная Кислота | 0 | 0 | 0 | 0 | 1 | 2 | 0 | 0 | 0 | 0 | 1 | 2 |
| Муравьиная Кислота | 0 | 0 | 0 | 1 | 1 | 2 | 0 | 0 | 1 | 1 | 1 | 0 |
| маркаAISI 304 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Температура | 20° | 80° | ||||||||||
| Концентрация, % к массе | 10 | 20 | 40 | 60 | 80 | 100 | 10 | 20 | 40 | 60 | 80 | 100 |
| Серная Кислота | 2 | 2 | 2 | 2 | 1 | 0 | 2 | 2 | 2 | 2 | 2 | 2 |
| Азотная Кислота | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 1 | 2 |
| Фосфорная Кислота | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 2 |
| Муравьиная Кислота | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 2 | 1 | 0 |
Расшифровка:
0 = высокая степень защиты — Скорость коррозии менее чем 100 mm/год
1 = частичная защита — Скорость коррозии от 100m до 1000 mm/год
2 = non resistant — Скорость коррозии более чем 1000 mm/год
Как видно из таблицы, изделия из стали AISI 316 противостоят воздействию коррозии в большинстве кислот и их растворов, чем и обусловлено их применение в агрессивных средах.
Отчего ржавеет нержавеющая сталь? | Журнал “Лучик”
Название «нержавеющая сталь» как бы подразумевает, что перед нами – сталь, которая не ржавеет. Однако вот лежат на заброшенной стройке ржавые трубы (из нержавеющей стали), вот стоит на свалке ржавый «Запорожец» (из нержавеющей стали), а где-нибудь под ванной можно отыскать случайно потерянное бритвенное лезвие – ржавое-ржавое, зато с гордой надписью «stainless steel»(«нержавеющая сталь»). В чём же дело?
У побережья Италии, в заливе Таранто, археологи обнаружили остатки корабля, затонувшего в далёком 180 году нашей эры. Анализ обломков показал, что виновником древней катастрофы стали проржавевшие железные гвозди, которыми была приколочена к днищу судна деревянная заплата. Скорее всего, во время внезапно налетевшей бури ржавые гвозди не выдержали, заплата отвалилась и корабль пошёл ко дну с грузом и экипажем – всего в 500 метрах от берега.
Как видите, уже 2000 лет назад люди сталкивались с трагическими последствиями «коррозии металла» – от латинского слова «corrodere», то есть «грызть, разъедать»). Ржавчина стала причиной многих трагедий – например, в 1967 в США из-за вызванной коррозией трещины в подвесном стержне обрушился Серебряный Мост через реку Огайо. В катастрофе погибло 46 человек!
С точки зрения химии ржавчина – это оксид железа-три, соединение железа с кислородом. Кислород (O), содержащийся в воздухе, воде или кислотах, активно реагирует с атомами железа (Fe), образуя оранжево-красный оксид (с формулой Fe2O3). Если вы когда-нибудь видели природные источники железистых минеральных вод, например, знаменитого нарзана, то наверняка обращали внимание на оранжевый цвет земли и камней рядом – это в точности та же самая ржавчина, соединение железа с кислородом. На поверхности железного или стального предмета ржавчина не останавливается – она продолжает распространяться вглубь, пока предмет не проржавеет насквозь.
Что же такое «нержавеющая сталь»? Это сплав железа и углерода с примесью другого металла – хрома. Кислород соединяется с хромом более активно, чем с железом. Хром для кислорода «вкуснее» железа – в результате образуется тонкая невидимая плёнка окиси хрома, абсолютно непроницаемая для кислорода. В итоге сталь оказывается надёжно защищённой от коррозии.
Кислород соединяется с хромом более активно, чем с железом. Хром для кислорода «вкуснее» железа – в результате образуется тонкая невидимая плёнка окиси хрома, абсолютно непроницаемая для кислорода. В итоге сталь оказывается надёжно защищённой от коррозии.
«Но почему же она тогда всё-таки ржавеет?» – спросите вы. Причин – две. Первая – хрома может оказаться недостаточно, такая ситуация может возникнуть при контакте нержавеющей стали с обыкновенной углеродистой сталью. Именно поэтому инструкции категорически запрещают контакт деталей из «нержавейки» с деталями из обычной стали – нержавейка начнёт ржаветь. Вторая причина – защитная плёнка не является какой-то суперпрочной, её можно повредить. Она легко разрушается кислотами или соединениями йода, фтора и хлора. Морская вода или чистящие средства, содержащие хлор («Доместос гель», «Белизна» и так далее) – страшные враги нержавеющей стали! Даже обычная дождевая вода для нержавеющей стали опасна – потому что в каплях дождевой воды всегда содержится небольшое количество угольной кислоты (h3CO3).
Таким образом, нержавеющая сталь не будет ржаветь только в том случае, если за ней постоянно и бережно «ухаживают» – чистят (средствами, не содержащими хлор!), вытирают насухо, покрывают лаком или краской и так далее. А вот если предмет из «нержавейки» просто бросить на улице, как тот же старый автомобиль, рано или поздно краска облупится, кислота разъест защитную плёнку, и железо начнёт превращаться в ту самую ржавчину со всеми вытекающими последствиями. «По ржавому ножу узнаёшь нерадивого хозяина» – говорит восточная поговорка. Так и есть!
Читайте также:
Что такое теория катастроф?
Может ли автомобиль работать на газировке?
Как на самом деле изобрели велосипед?
Из-за чего металлы ржавеют
Ржавчина — итог окисления металла, также общий термин для определения оксидов железа.
Что есть общего между ржавым гвоздем, проржавевшим мостом или прохудившимся железным забором? Отчего вообще ржавеют железные конструкции и изделия из железа? Что такое ржавчина как таковая? На эти вопросы постараемся дать ответы в нашей статье. Рассмотрим причины ржавления металлов и способы защиты от этого вредного для нас природного явления.
Рассмотрим причины ржавления металлов и способы защиты от этого вредного для нас природного явления.
Причины ржавления
Все начинается с добычи металла. Не только железо, но и, например, алюминий, и магний – добывают изначально в виде руды. Алюминиевая, марганцевая, железная, магниевая руды содержат в себе не чистые металлы, а их химические соединения: карбонаты, оксиды, сульфиды, гидроксиды.
Это химические соединения металлов с углеродом, кислородом, серой, водой и т. д. Чистых металлов в природе раз, два и обчелся — платина, золото, серебро — благородные металлы – они встречаются в форме металлов в свободном состоянии, и не сильно стремятся к образованию химических соединений.
Однако большинство металлов в природных условиях все же не являются свободными, и чтобы высвободить их из исходных соединений, необходимо руды плавить, восстанавливать таким образом чистые металлы.
Но выплавляя металлсодержащую руду, мы хоть и получаем металл в чистом виде, это все же состояние неустойчивое, далекое от естественного природного. По этой причине чистый металл в обычных условиях окружающей среды стремится вернуться назад в исходное состояние, то есть окислиться, а это и есть коррозия металла.
Таким образом, коррозия является естественным для металлов процессом разрушения, происходящим в условиях их взаимодействия с окружающей средой. В частности ржавление — это процесс образования гидроксида железа Fe(ОН)3, который протекает в присутствии воды.
Но на руку людям играет тот естественный факт, что окислительная реакция протекает в привычной нам атмосфере не особо стремительно, она идет с очень небольшой скоростью, поэтому мосты и самолеты не разрушаются мгновенно, а кастрюли не рассыпаются на глазах в рыжий порошок. К тому же коррозию в принципе можно замедлить, прибегнув к некоторым традиционным хитростям.
Например, нержавеющая сталь не ржавеет, хотя и состоит из железа, склонного к окислению, она тем не менее не покрывается рыжим гидроксидом. А дело здесь в том, что нержавеющая сталь — это не чистое железо, нержавеющая сталь — это сплав железа и другого металла, главным образом — хрома.
А дело здесь в том, что нержавеющая сталь — это не чистое железо, нержавеющая сталь — это сплав железа и другого металла, главным образом — хрома.
Кроме хрома в состав стали могут входить никель, молибден, титан, ниобий, сера, фосфор и т. д. Добавление в сплавы дополнительных элементов, ответственных за определенные свойства получаемых сплавов, называется легированием.
Пути защиты от коррозии
Как мы отметили выше, главным легирующим элементом, добавляемым к обычной стали для придания ей антикоррозийных свойств, является хром. Хром окисляется быстрее железа, то есть принимает удар на себя. На поверхности нержавеющей стали, таким образом, появляется сначала защитная пленка из оксида хрома, которая имеет темный цвет, и не такая рыхлая как обычная железная ржавчина.
Оксид хрома не пропускает через себя вредные для железа агрессивные ионы из окружающей среды, и металл оказывается защищенным от коррозии, словно прочным герметичным защитным костюмом. То есть оксидная пленка в данном случае несет защитную функцию.
Количество хрома в нержавеющей стали, как правило, не ниже 13%, чуть меньше в нержавеющей стали содержится никеля, и в гораздо меньших количествах имеются другие легирующие добавки.
Именно благодаря защитным пленкам, принимающим на себя воздействие окружающей среды первыми, многие металлы получаются стойкими к коррозии в различных средах. Например, ложка, тарелка или кастрюля, изготовленные из алюминия, никогда особо не блестят, они, если присмотреться, имеют белесый оттенок. Это как раз оксид алюминия, который образуется при контакте чистого алюминия с воздухом, и защищает затем металл от коррозии.
Пленка оксида возникает сама, и если зачистить алюминиевую кастрюлю наждачной бумагой, то через несколько секунд блеска поверхность снова станет белесой — алюминий на зачищенной поверхности вновь окислится под действием кислорода воздуха.
Поскольку пленка оксида алюминия образуется на нем сама, без особых технологических ухищрений, она называется пассивной пленкой. Такие металлы, на которых оксидная пленка образуется естественным образом, называются пассивирующимися. В частности алюминий — пассивирующийся металл.
Такие металлы, на которых оксидная пленка образуется естественным образом, называются пассивирующимися. В частности алюминий — пассивирующийся металл.
Некоторые металлы принудительно переводят в пассивное состояние, например высший оксид железа — Fe2О3 способен защитить железо и его сплавы на воздухе при высоких температурах и даже в воде, чем не может похвастаться ни рыжий гидроксид, ни низшие оксиды все того же железа.
Есть в явлении пассивации и нюансы. Например, в крепкой серной кислоте мгновенно пассивированная сталь оказывается устойчивой к коррозии, а в слабом растворе серной кислоты тут же начнется коррозия.
Почему так происходит? Разгадка кажущегося парадокса состоит в том, что в крепкой кислоте на поверхности нержавеющей стали мгновенно образуется пассивирующая пленка, поскольку кислота большей концентрации обладает ярко выраженными окислительными свойствами.
В то же время слабая кислота не окисляет сталь достаточно быстро, и защитная пленка не формируется, начинается просто коррозия. В таких случаях, когда окисляющая среда не достаточно агрессивна, для достижения эффекта пассивации прибегают к специальным химическим добавкам (ингибиторам, замедлителям коррозии), помогающим образованию пассивной пленки на поверхности металла.
Так как не все металлы склонны к образованию на их поверхности пассивных пленок, даже принудительно, то добавление замедлителей в окисляющую среду попросту приводит к превентивному удержанию металла в условиях восстановления, когда окисление энергетически подавляется, то есть в условиях присутствия в агрессивной среде добавки оказывается энергетически невыгодным.
Есть и другой путь удержания металла в условиях восстановления, если нет возможности использовать ингибитор, – применить более активное покрытие: оцинкованное ведро не ржавеет, поскольку цинк покрытия корродирует при контакте с окружающей средой вперед железа, то есть принимает удар на себя, являясь более активным металлом, цинк охотнее вступает в химическую реакцию.
Днище корабля часто защищено аналогичным образом: к нему крепят кусок протектора, и тогда протектор разрушается, а днище остается невредимым.
Электрохимическая антикоррозийная защита подземных коммуникаций — также весьма распространенный путь борьбы с образованием на них ржавчины. Условия восстановления создаются подачей отрицательного катодного потенциала на металл, и в таком режиме процесс окисления металла уже не сможет протекать просто энергетически.
Кто-то может спросить, почему подверженные риску коррозии поверхности просто не красят краской, почему бы просто не покрывать каждый раз эмалью уязвимую к коррозии деталь? Для чего нужны именно разные способы?
Ответ прост. Эмаль может повредиться, например автомобильная краска может в неприметном месте отколоться, и кузов начнет постепенно но непрерывно ржаветь, поскольку сернистые соединения, соли, вода, кислород воздуха, – станут поступать к этому месту, и в итоге кузов будет разрушаться.
Чтобы такое развитие событий предотвратить, прибегают к дополнительной антикоррозийной обработке кузова. Автомобиль — это не эмалированная тарелка, которую можно в случае повреждения эмали просто выбросить, и купить новую..
Текущее положение дел
Несмотря на кажущуюся изученность и проработанность явления коррозии, несмотря на применяемые разносторонние методы защит, коррозия по сей день представляет определенную опасность. Трубопроводы разрушаются и это приводит к выбросам нефти и газа, падают самолеты, терпят крушение поезда. Природа более сложна, чем может показаться на первый взгляд, и человечеству предстоит изучить еще многие стороны коррозии.
Так, даже коррозиестойкие сплавы оказываются стойкими лишь в некоторых предсказуемых условиях, для работы в которых они изначально предназначены. Например, нержавеющие стали не терпят хлоридов, и поражаются ими — возникает язвенная, точечная и межкристальная коррозия.
Внешне без намека на ржавчину конструкция может внезапно рухнуть, если внутри образовались мелкие, но очень глубокие поражения. Микротрещины, пронизывающие толщу металла незаметны снаружи.
Микротрещины, пронизывающие толщу металла незаметны снаружи.
Даже сплав не подверженный коррозии может внезапно растрескаться, будучи под длительной механической нагрузкой — просто огромная трещина внезапно разрушит конструкцию. Такое уже случалось по всему миру с металлическими строительными конструкциями, механизмами, и даже с самолетами и вертолетами.
Ранее ЭлектроВести писали, что немецкий исследовательский институт Фраунхофера по переработке материалов и ресурсным стратегиям (Fraunhofer IWKS) создал экологически устойчивый «Центр демонтажа и переработки в области электрической мобильности» (нем. — Zentrum für Demontage und Recycling — Elektromobilität ZDR-EMIL). Он разместился в городе Ханау (Hanau) в Федеральной земле Гессен при поддержке регионального министерства науки и искусств.
По материалам: electrik.info.
Почему ножи ржавеют и как с этим справиться?
Большинство из нас знает, что ржавчина – это красновато-коричневое хлопьевидное покрытие на металле, и не думает о нем больше ничего. Однако ржавчина – это термин, обычно используемый для обозначения коррозии и окисления железа и его сплавов, таких как сталь.
Технически ржавчина представляет собой оксид гидратированного железа (III), также известный как оксид железа (Fe2O3), так как он вызывается, когда железо вступает в реакцию с кислородом и водой – эта реакция известна как окисление.
Если кусок железа остается достаточно долго, под воздействием воды и кислорода, его ржавчина неизбежна – это может занять дни, недели, месяцы или даже годы в зависимости от интенсивности воздействия, однако он будет ржаветь, если его никоим образом не защитить.
Ржавчина повсеместна, так как железо легко вступает в реакцию с кислородом. Так что уважаемые ножеманы, запоминаем самое главное – даже самый суровый клинок с самым высоким содержанием хром все равно заржавеет при длительном нахождении на открытом воздухе. Это только вопрос времени.
Что вызывает ржавчину?
Ну ладно, теперь я знаю, что ржавчина это оксид железа. Но какие условия вызывают коррозию на ноже? Для того, чтобы ваш нож заржавел, требуется три вещи: кислород, железо и вода.
Но какие условия вызывают коррозию на ноже? Для того, чтобы ваш нож заржавел, требуется три вещи: кислород, железо и вода.
Кислород поступает из атмосферы и присутствует в окружающем нас воздухе. Железо – основной материал стальных клинков. Влага (вода) способствует образованию ржавчины. Это не обязательно должна быть вода как жидкость. Влажного воздуха будет достаточно, чтобы вызвать ржавчину вашего ножа.
Это знание дает нам представление о том, как защитить нож от ржавчины. Если мы сможем предотвратить контакт ножа с этими тремя ингредиентами, ваш нож не заржавеет!
Почему некоторые стали ржавеют легче, чем другие?
Большинство видов ножевой стали можно классифицировать как нержавеющую или углеродистую сталь. Как следует из названия, углеродистая сталь – это сталь с высоким содержанием углерода. Многие стали могут содержать различные металлические сплавы. Однако, именно процент углерода, входящий в состав, играет здесь главную роль.
Обычно клинки из углеродистой стали содержат от 0,5% до 1,5% углерода. Это делает клинок очень послушным в процессе обработки и заточки. Таким образом, углеродистая сталь является любимой для специалистов, так как обеспечивает хорошо контролируемый рез.
Однако клинки из углеродистой стали будут подвержены коррозии, если вы не позаботитесь об этом! Они будут легко ржаветь во влажной и кислой среде.
Клинки из нержавеющей стали содержат хром, который обычно составляет от 12,5% до 13,5% лезвия. Это создает сильный оксидный слой на поверхности лезвия, который предотвращает дальнейшее окисление стали. В результате коррозия клинка замедляется, поэтому сталь называется “нержавеющая”. В силу чего ножи из нержавеющей стали являются хорошим выбором для работы в агрессивных средах, таких как соленая морская вода.
Просто помните, что обозначение stainLESS не означает “супер защита от ржавчины”. Клинки из нержавеющей стали также будут ржаветь, если вы не будете поддерживать их в надлежащем состоянии, просто процесс ржавления займет больше времени, чем в случае с углеродистой сталью.
Существуют и другие материалы для клинков, например, такие как титан или керамика. Они не содержат железа, и поэтому они не будут ржаветь, и ваш нож будет полностью коррозионностойким.
Еще один фактор, который следует учитывать – покрытие лезвия. Некоторые лезвия имеют специальные покрытия, которые делают их более прочными и коррозионностойкими.
Например, некоторые ножи поставляются с покрытием из титана или окиси алюминия, которое предотвращает ржавчину внутреннего стального лезвия.
Чем плоха ржавчина?
Ржавчина сама по себе не опасна, и ты не умрешь, если съешь что-нибудь порезанное ржавым ножом. Однако, длительное воздействие ржавчины на клинок может разрушить его структуру, что приведет к затуплению, выкрашиваю режущей кромки. Или сам клинок может сломаться вовсе.
Ну а чтобы удалить ржавчину с ножа (если такая неприятность все-таки случилась) есть проверенные дедовские способы: химические растворители и смазки, питьевая сода, уксус, лимонная кислота и добрая старая наждачная бумага.
Как обработать металл ржавчиной (специально!)
Фото: istockphoto.com
Несмотря на то, что он нежелателен для садовых инструментов и мебели для патио, не всегда всегда нужно удалять. Фактически, с развитием деревенских и промышленных схем декорирования, все больше и больше людей принимают вид состаренного металла до такой степени, что вызывают коррозию новой металлической посуды. Металлы, сделанные из железа или сплавов железа, такие как железо и сталь, конечно, ржавеют естественным образом при достаточном воздействии влаги и кислорода, но опытные мастера могут ускорить процесс и быстрее схватить состаренные металлические акценты, создав секретную ржавчину. решение.
Если вы хотите заржаветь петли и фурнитуру, чтобы еще больше скрыть возраст старого деревянного сундука, или вы предпочитаете внешний вид старых металлических подсвечников на столе в фермерском доме, следуйте этим простым шагам, чтобы ржаветь металл, и вы можете преобразовать любой объект вокруг своего дома. дом. Всего за час можно добавить годы к вашим металлическим акцентам!
дом. Всего за час можно добавить годы к вашим металлическим акцентам!
Фото: istockphoto.com
ШАГ 1. Подготовьте рабочее место.Переместите металлический предмет, который вы хотите заржаветь, во двор или в открытый гараж в жаркий день.Прямой солнечный свет помогает ускорить процесс ржавления. Кроме того, перекись водорода и уксус могут выделять умеренный уровень дыма, поэтому вам все равно нужно работать в хорошо вентилируемом помещении.
ШАГ 2: При необходимости удалить краску.Если ваш металл окрашен, нанесите средство для снятия краски на всю поверхность объекта в соответствии с инструкциями производителя, чтобы удалить этот цветной слой. Осторожно сотрите остатки краски скребком.
ШАГ 3: Отшлифуйте металл мелкозернистой наждачной бумагой.Слегка отшлифуйте всю поверхность металла мелкозернистой наждачной бумагой, чтобы удалить любое имеющееся защитное покрытие, которое может предотвратить ржавчину объекта. Поместите отшлифованный предмет в центр пластикового контейнера, который стоит на твердой земле или на плоской рабочей поверхности в гараже.
ШАГ 4: Распылите белый уксус на металл и подождите несколько минут.Надев перчатки и защитные очки, чтобы защитить себя от брызг, налейте белый уксус в пластиковую бутылку с распылителем, а затем обильно распылите на металл.
Дайте объекту высохнуть на солнце (пять минут или дольше в зависимости от размера объекта). По мере высыхания кислота уксуса начнет разъедать поверхность металла, и вы увидите, как появляется ржавчина.
ШАГ 5: Нанесите раствор перекиси водорода, уксуса и соли. Налейте две чашки перекиси водорода, четыре столовые ложки белого уксуса и полторы чайных ложки поваренной соли в пластиковый распылитель. Энергично перемешайте бутылку, чтобы перемешать содержимое.Как только соль растворится, распылите раствор на предмет, чтобы покрыть его частично или полностью, в зависимости от желаемого эффекта. При контакте с металлом перекись должна начать пузыриться, и сразу же начнется образование ржавчины. Дайте объекту высохнуть на солнце еще пять минут или дольше, в зависимости от размера объекта.
При контакте с металлом перекись должна начать пузыриться, и сразу же начнется образование ржавчины. Дайте объекту высохнуть на солнце еще пять минут или дольше, в зависимости от размера объекта.
При однократном нанесении раствора на металлическом предмете должна образоваться легкая ржавая патина. Однако для получения более глубокой и отчетливой патины повторите нанесение этого раствора для защиты от ржавчины еще до четырех раз.
ШАГ 6: Закройте металл прозрачным акриловым герметиком.Наконец, нанесите тонкий слой прозрачного акрилового герметика на сухой заржавевший предмет. Хотя аэрозольный баллончик может указывать на то, что выбранный вами герметик предотвращает ржавчину , он не отменяет вашу работу. Он закрепит ржавчину и сохранит состаренный вид на долгие годы, создавая акриловый барьер, который не даст ему случайно испачкать любой другой металл или дерево, с которыми он вступит в контакт в будущем.
Фото: istockphoto.com
Как обработать металл
Понятно, что большинство людей хотят защитить свои автомобили и электроинструменты от ржавчины, но некоторые стальные предметы действительно приобретают характер благодаря красивой ржавой патине. С помощью небольшого количества бытовой химии легко ускорить процесс окисления. Ниже мы поделились основными шагами, которые помогут придать вашим уличным украшениям очаровательный, выветренный вид.
Ознакомьтесь с нашими продуктами безопасности, доступными для вашего проекта!
Купить Материалы:
Возможно, у вас уже есть некоторые из этих продуктов в кладовой, поэтому внимательно осмотрите весь дом, прежде чем что-либо покупать.Чтобы сталь приобрела ржавый вид, вам понадобится поваренная соль, белый уксус и обезжириватель, а также мерные чашки / ложки и распылитель. Мы также рекомендуем вам купить новый флакон с перекисью водорода вместо того, чтобы использовать старый в своей аптечке. В целях безопасности вы всегда должны носить защитные очки и химически стойкие перчатки. Помните, что вы собираетесь комбинировать вредные химические вещества, так что будьте осторожны!
Помните, что вы собираетесь комбинировать вредные химические вещества, так что будьте осторожны!Обезжирить сталь:
После удаления с вашей стали какого-либо покрытия или краски металл будет готов к обезжириванию.Прочтите инструкции к бутылке с обезжиривающим средством, когда будете наносить ее на металл, и не прикасайтесь к ней голыми руками. Вы хотите, чтобы обезжириватель творил чудеса, но не хотите добавлять в процесс больше масла и грязи.Рассолить сталь:
Да, следующий шаг – как мариновать огурцы, только вот мариновать сталь. Это помогает создать равномерный слой ржавчины, вместо того, чтобы одни участки были более ржавыми, чем другие. Налейте немного белого уксуса в распылитель, а затем распылите каждый дюйм металлического предмета.Дайте высохнуть на солнце, а затем повторите еще несколько раз. Теперь ваша сталь будет готова к главному событию.Металлопродукции для вашего проекта!
Сделай это ржавым:
Итак, вы подготовили металлический предмет к ржавчине, но как на самом деле происходит процесс окисления? Во-первых, вам нужно создать раствор для ржавчины, смешав 16 унций перекиси водорода, 2 унции белого уксуса и ½ столовой ложки соли. Если возможно, смешайте этот раствор в пульверизаторе с небольшим количеством оставшегося белого уксуса.Встряхните его, чтобы все хорошо перемешалось, а затем начните распылять на ваш объект. Если ржавчина не начинается сразу, возможно, вам придется на время подержать объект под прямыми солнечными лучами. Тепло помогает процессу.После того, как вы напылите на металл, дайте ему высохнуть, а затем повторите примерно 7 циклов, ваша сталь должна выглядеть так, как будто она состарилась годами. Не прикасайтесь к ржавчине, пока она полностью не высохнет, потому что она может стереться. Чем дольше он будет находиться на солнце, тем лучше.
Ваш местный поставщик металла, обслуживающий Южную Калифорнию, Аризону и Северную Мексику
Industrial Metal Supply – крупнейший поставщик всех видов металла и аксессуаров для металлообработки в Саутленде.
Как сделать металл ржавчиной менее чем за 10 минут
Как сделать металл ржавчиной менее чем за 10 минут
Заявление об ограничении ответственности: этот пост может содержать партнерские ссылки, что означает, что если вы перейдете по ссылке и сделаете покупку, мы можем получить комиссию. Это бесплатно для вас. Ознакомьтесь с нашим полным раскрытием здесь.Не знаю, как вы, но мое сердце замирает, когда я натыкаюсь на вторичное дерево, ржавый металл и кованое железо. Есть что сказать о предметах, которые отражают свою историю сквозь старость и ржавую патину, и это одна из причин, по которой меня так тянет к горным домам и бревенчатым домикам.
Однако бывают случаи, когда эти вторичные материалы выходят за рамки бюджета или их просто трудно найти. К счастью, есть способы придать новинке вид старины, и сегодня я расскажу, как сделать металлическую ржавчину менее чем за 10 минут!
Как сделать металл ржавчиной
У нас есть проект для нашего дома на колесах, все, что нам нужно, – это антикварные подковы. Не могу сказать, сколько раз мне попадались ржавые подковы, пока мы жили в Джорджии, но я был не совсем готов к своему проекту, поэтому продолжал говорить себе, что куплю их позже.
Перенесемся на несколько месяцев вперед, и теперь, когда мы готовы к проекту, я нигде не могу найти старые подковы! Что ж, это правда лишь отчасти, я нашел кое-что в Интернете, но хотел их СЕЙЧАС, потому что нетерпелив. Я нашел пару в местном антикварном магазине, но их было всего два (я хотел как минимум три), и в них не было отверстий, которые мы хотели упростить для прикрепления к нашей переработанной древесине. Ах да, и они были очень тяжелыми.
Если вы не знали, путешествие в доме на колесах означает, что вы должны быть особенно осторожны с тем, сколько веса вы добавляете к дому на колесах, и каждая мелочь складывается.Естественно, меня привлекают слишком тяжелые дерево и железо. Иди разберись.
Даже такая маленькая вещь, как подкова, внезапно кажется весит намного больше, чем я когда-либо думал. В любом случае, поскольку моя миссия по поиску старинных подков провалилась, я решил, что пришло время вернуться к плану B, купить новые подковы и сделать их похожими на старых . Я смог купить эту упаковку из 4 подков за 8 долларов в местном магазине тракторов. Были разные виды, поэтому мы выбрали те, которые якобы «легкие».
Обновление: видео, показывающее, как сделать металлическую ржавчину
Посмотрите наше недавнее видео, показывающее, как легко сделать металл ржавчиной:
Соберите припасы
Должен сказать, создание металлической ржавчины при быстрой перемотке вперед было даже веселее, чем я ожидал. К тому же у вас, вероятно, есть все необходимое, чтобы попробовать это прямо сейчас. Единственное, что нам нужно было купить, это соль. У нас была гималайская соль, которая может сработать, но я не был уверен, сколько я буду использовать, поэтому мы просто взяли большой контейнер с поваренной солью за 1 доллар.
Должен признать, что на самом деле я не следовал никакому конкретному рецепту для этого. Первоначально я наткнулся на этот пост о том, как сделать металлическую ржавчину, и планировал использовать его до футболки, но потом я стал нетерпеливым и взволнованным и просто сделал свое дело. Хорошая новость в том, что это сработало.
Безопасность прежде всего!
Не забывайте о безопасности – хотя это предметы домашнего обихода, вы должны быть особенно осторожны при смешивании и надевать подходящие средства защиты глаз и перчатки.Обязательно делайте это вдали от детей и домашних животных и помните, что если эта смесь попадет на какой-либо металл, он может заржаветь. Я рекомендую делать это на улице, чтобы у вас была хорошая вентиляция и ничто не испортилось.
Моя новая подкова:
Вот одна из подков, которые я сфотографировал во время этого процесса:
Обновление: Если вы посмотрите видео в верхней части сообщения, вы увидите, как использование небольшого пульверизатора или распылителя с функцией запотевания делает этот метод еще проще! В первый раз, когда я сделал это, мой распылитель сломался, поэтому я пропустил его, но когда я попытался использовать один во второй раз, я обнаружил, что он использовал меньше расходных материалов, был менее беспорядочным и работал отлично! Однако на метод, который я упомянул ниже, интересно наблюдать, так что просто поиграйте с ним и получайте удовольствие!
Шаг 1:
Первое, что вам нужно сделать, это взять свою сталь / железо / металл и поместить ее в контейнер или ведро. Я просто использовал небольшой пластиковый контейнер для хранения.
Я просто использовал небольшой пластиковый контейнер для хранения.
После того, как я поместил свою подкову в емкость, я налил сверху немного белого дистиллированного уксуса. Я не измерял, но налил ровно столько, чтобы она покрыла подкову, а затем я как бы взмахнул ею сверху. Вы можете налить немного уксуса в распылитель и вместо этого опрыскать металлические предметы.
Шаг 2:
Дайте металлическим предметам постоять в уксусе столько, сколько захотите, затем слейте уксус из емкости.
Для этой конкретной подковы я оставил ее в уксусе примерно на 5 минут, прежде чем вылил уксус из емкости.
Шаг 3:
На этом этапе вам нужно добавить перекись поверх металлических предметов. Если хотите, можете смешать его с уксусом и солью в пульверизаторе.
Я предварительно смешал примерно 5 унций перекиси с 2 унциями уксуса и начал распылять это на подкову, пока она еще была в контейнере.Моя бутылка с распылителем не работала так хорошо, и я стал нетерпеливым, поэтому просто снял крышку с распылителя и вылил смесь на свою подкову. Здесь начинается самое интересное, потому что перекись начинает пузыриться на металле, и вы можете видеть, как появляется цвет ржавчины.
Шаг 4:
Добавьте соль.
Затем я посыпал … эээ вылил … пучок соли на мою подкову, и ржавый цвет начал проявляться еще больше. Ооооооооо! #EasilyAmused
Затем я позвал Эрика, потому что я был очень взволнован, чтобы показать ему, но я хотел больше пузырей и шипения, поэтому я налил немного больше перекиси водорода.Я не измерял.
Шаг 5:
Удалить из смеси и дать высохнуть на воздухе.
Через несколько минут я окунул подкову в раствор, чтобы как бы смыть соль, а затем промокнул ее бумажным полотенцем. Не следует протирать его слишком сильно, иначе он может удалить часть патины. Вы увидите, что он немного заржавел, но не беспокойтесь, если он выглядит не так, как вы хотите, он на самом деле больше ржавеет по мере высыхания. Вот так мой выглядел сразу после того, как вынул его из смеси – я сделал все это менее чем за 10 минут.
Вот так мой выглядел сразу после того, как вынул его из смеси – я сделал все это менее чем за 10 минут.
На улице темнело, поэтому я оставил его на ночь, а на следующий день моя подкова выглядела так, рядом с металлом, который ржавеет годами:
Мне нравится, что часть голубовато-серого цвета железа просачивается сквозь ржавчину.
Я сделал еще несколько подков перед этой и оставил некоторые из них на час, потому что я не сразу заметил изменение цвета. Позже я понял, что по мере высыхания они становятся более ржавыми.Так что я бы просто сказал поэкспериментировать. Если вам не нравится, как ваш металл выглядит после 10 минут высыхания на воздухе, вы всегда можете повторить процесс и подержать их в растворе в течение более длительного периода времени 🙂
Шаг 6:
Распылите прозрачный герметик.
Вам нужно добавить прозрачный герметик, чтобы ржавая патина не отслаивалась и не окрашивала все, к чему прикасаются.
Честно говоря, я немного подождал, прежде чем запечатать шахту, что было ПЛОХОЙ идеей.К тому времени часть патины стерлась, в том числе с некоторых моих полотенец. Ой. Когда я заклеил их, я просто использовал немного оставшегося уретана Spar и поролоновую кисть, но вы можете использовать любой прозрачный герметик и, возможно, предпочтете распылитель.
Во второй раз, когда я сделал это, я запечатал подкову примерно через 2 часа, но вы всегда можете подождать ночь.
Вот и все! Теперь у нас есть несколько ржавых подков, похожих на старину, которые идеально подходят для нашего проекта, которыми мы поделимся с вами на следующей неделе.
Это всего лишь один из способов ржавчины на металле, но я определенно его фанат. Если вы решите попробовать это, мы будем рады услышать о ваших результатах в комментариях ниже. И если у вас есть особая техника, которую вы предпочитаете, когда дело доходит до того, чтобы новый металл выглядел старым, мы хотели бы услышать об этом тоже!
Не все металлы ржавеют
Получив много комментариев и писем о том, что это не работает с некоторыми объектами, я хотел добавить, что не все металлы будут ржаветь. Я считаю, что в нем должно быть железо, чтобы ржаветь, и если он оцинкованный, нержавеющая сталь или какой-либо другой тип металла, который не подвержен коррозии, этот процесс не сработает. Я усвоил это на собственном горьком опыте, пытаясь заржаветь некоторые оцинкованные ведра, которые у меня были под рукой, и прочитал об этом здесь.
Я считаю, что в нем должно быть железо, чтобы ржаветь, и если он оцинкованный, нержавеющая сталь или какой-либо другой тип металла, который не подвержен коррозии, этот процесс не сработает. Я усвоил это на собственном горьком опыте, пытаясь заржаветь некоторые оцинкованные ведра, которые у меня были под рукой, и прочитал об этом здесь.
Уплотнитель – это важно
Если вы не хотите, чтобы патина стиралась с вас или чего-либо еще, к чему она прикасается, вам обязательно нужно нанести прозрачный герметик!
Spray vs. Dunk
Если вы посмотрите видео в верхней части этого поста, вы увидите разницу между спреем иметод замочить. По сути, метод распыления позволит проявить больше контраста исходного металла, и легче работать слоями и добавлять больше ржавчины, если хотите. Метод данка может покрыть почти весь металлический объект, в зависимости от того, сколько вы покрываете и как долго он находится. Хотя вы заметите, что некоторые из моих «замоченных» подков все еще имеют приличный контраст.
Дать высохнуть
Я знаю, что может показаться, что он не сразу меняется, или патина может не казаться такой жирной, пока объект влажный, но если вы будете терпеливы и дадите ему постоять 5-10 минут, вы заметите, насколько сильно патина была создана.Конечно, вы всегда можете добавить еще, но я немного переборщил с некоторыми из них только потому, что я был нетерпеливым и продолжал добавлять больше смеси.
Не забудьте взглянуть на полку для ванной в деревенском стиле, которую мы создали с помощью этих подков.
Я не могу заставить себя написать длинный
трактат на эту тему. Это слишком больно и слишком сложно.У меня также есть
рассмотрены части этого в другом месте, так что давайте будем краткими. Я просто задам (и отвечу) на несколько основных вопросов. | ||||||
| 1. Железо и сталь
ржавеет. Почему? Ответ, сначала для простоты, только для чистого железа , прост: железо ржавеет, что означает окисляется, потому что атомы железа любят быть окруженными атомами кислорода (или серы атомы или …) гораздо больше, чем быть окруженными братьями атомами железа.Существование окисленное ближе к нирване, чем чистое. Вот почему мы находим только железную руду а не чистый металл в природе. | ||||||
| Хороший ответ, совершенно правильный, но не удовлетворительно. Если вы не понимаете почему, посмотрите мой следующий вопрос | ||||||
| 2. Почему
алюминий, кремний и многие другие чистые элементарные кристаллы , а не , ржавчина или коррозия? Теперь мы являемся самой сутью проблемы.Ответ выше относится ко всем этим элементы так же хорошо, как и гладить – но они не подвержены коррозии! По крайней мере, намного медленнее чем железо. | ||||||
И снова у нас есть два основных ингредиента
к материаловедению и инженерии в двух словах:
| ||||||
Тогда ответ на вопрос: Кремний
алюминий и многие другие материалы действительно окисляются. Сформированный оксидный слой
на поверхности этих материалов, однако, есть два
важные свойства:
Теперь очевиден следующий вопрос: | ||||||
| 3. Почему
слой оксида железа не самовосстанавливающийся , в
в отличие от слоев кремния или оксида алюминия? Это непростой вопрос. Фактически, качество слоев оксида железа как ржавчины протекторы различаются совсем немного. Если сделать правильный оксид осторожно, он защищать, или, если использовать правильное слово, passivate поверхность красиво.Именно это и делает процесс “воронения”. Право оксид – магнетит (Fe 3 O 4 ), черный оксид железа. Гематит (Fe 2 O 3 ), красный оксид – это плохо. Реагирует с водой на какой-то гидроксид (например, FeO (OH)), который вызывает большое изменение объема с неизбежное растрескивание, образование пузырей и отслаивание, которое не прекращается до тех пор, пока есть железо, которое нужно потреблять.  Вы это видели. Это называется ржавчиной. Вы это видели. Это называется ржавчиной. | ||||||
| Если хотите, корень всего этого зла приходит
из того прискорбного факта, что существует несколько оксидов и гидроксидов железа, которые
может образовываться в нормальной, богатой кислородом и влажной атмосфере.Они соревнуются с каждым
другие и и превращаются друг в друга, в зависимости от условий, разрываясь на части
защитный слой всякий раз, когда это происходит. Напротив, кремний производят только
чрезвычайно прочный и стабильный диоксид кремния (SiO 2 ) и алюминий
вполне доволен своим очень твердым и очень стабильным только оксидом
(Al 2 O 3 ), материал для изготовления
драгоценные камни. Но продолжим: | ||||||
| ||||||
| 4.Собственно, чистый
железо даже не сильно ржавеет – в отличие от углеродистой стали . Почему? В принципе просто. Не все так просто, если разобраться в деталях. Легкая часть состоит в том, что как как только вы «посмотрите» (в микроскоп) на поверхность углерода стали, вы видите (слегка окисленные) феррит и цементит. Вот картинки для что. Цементит нельзя покрыть оксидом. Если бы вы могли его окислить, газ CO 2 будет производиться без твердого слоя.  По краям, где железо
и его оксид отвечает цементиту, механическим и «химическим» нагрузкам
производится, предлагая точки атаки для молекул кислорода и воды из
воздух. По краям, где железо
и его оксид отвечает цементиту, механическим и «химическим» нагрузкам
производится, предлагая точки атаки для молекул кислорода и воды из
воздух. | ||||||
| Самое трудное возникает, если учесть, что Коррозия – это часть электрохимии. Как только два материала или фазы прямой контакт и некоторый контакт с жидкость, у вас есть аккумулятор со встроенным напряжением, который может управлять химическим в остальном процессы не наблюдаются.Сталь, любая сталь по определению состоит как минимум из двух фаз, как правило, из многих. Некоторая электрохимия обязательно произойдет во влажной среде, и коррозия – это скорее правило, чем исключение. | ||||||
| 5. Как же так?
что у нас есть что-то вроде нержавеющей стали, которая не ржавеет? Ответ на этот вопрос состоит из двух частей. Первый и простой – нержавеющая сталь. Типичный нержавеющая сталь должна иметь достаточно легированного хрома (не менее 11%) для образования закрытый слой оксида хрома на поверхности.Поскольку оксид хрома (Cr 2 O 3 ) соответствуют обоим требованиям сверху, сталь поверхность теперь пассивирована и противостоит коррозии. Вторая и более сложная часть ответа касается Кортеновская сталь. Это специальная сталь с необычными легированными элементами, позволяющая производить стабильную и довольно густой оксид. Он такой толстый, что на самом деле сталь выглядит очень ржавой. Но ржавление не продолжается после первоначального образования оксида. | ||||||
| 6. Все остальное
нужно знать о коррозии железа и стали? Вы должны сами ответить на этот вопрос. Лучше всего выйти за рамки того, что я тебе дал чтением хороших книг, которому, возможно, предшествуют несколько лет изучения необходимые основы химии, материаловедения и физики.  | ||||||
Почему сталь ржавеет? А также ответы на другие вопросы о ржавлении стали
Несмотря на то, что сталь является одним из наиболее распространенных и полезных материалов для производства в мире, у нее всегда был один серьезный недостаток.Ржавеет. Мы часто видим темно-коричневый или красный цвет и отслаивающийся материал на старых мостах, старых зданиях и на стали, которая слишком долго оставалась открытой. Однако сталь – не единственный металл, который ржавеет. Просто взгляните на любые копейки, которые у вас лежат, на любое серебро, которое у вас есть, или на фотографии Статуи Свободы. Цинк, никель, медь, алюминий и многие другие металлы также подвержены коррозионной химической реакции. Почему сталь вообще ржавеет, почему одни стали ржавеют, а другие нет, и почему сталь не ржавеет в определенных ситуациях, – это интересная тема.
Почему сталь ржавеет?
Любой материал, сделанный из железа, который подвергается воздействию кислорода и воды, ржавеет. Поскольку сталь почти полностью состоит из железа, это самый высокотехнологичный искусственный материал, подверженный ржавчине. Чтобы понять, почему сталь ржавеет, вам нужно немного узнать о химии и таблице Менделеева. После элемента гелия, элементы, как имеющие 8 электронов на своей внешней оболочке, будут заимствовать электроны у других элементов для достижения этого уровня.Например, вода состоит из атома кислорода с 6 внешними электронами и 2 атомов водорода, каждый из которых имеет по 1 электрону. Заимствуя и разделяя электроны в реакции восстановления, образуется FeO (OH) (наиболее распространенная форма ржавчины).
Как образуется ржавчина?
Когда любой тип стали ржавеет, включая сталь, она подвергается химической реакции, называемой коррозией. Во время этого процесса воздействия воздуха и воды при нахождении вне или в элементах в течение длительного периода времени могут образовываться различные типы ржавчины, но наиболее распространенной формой является Fe2O3.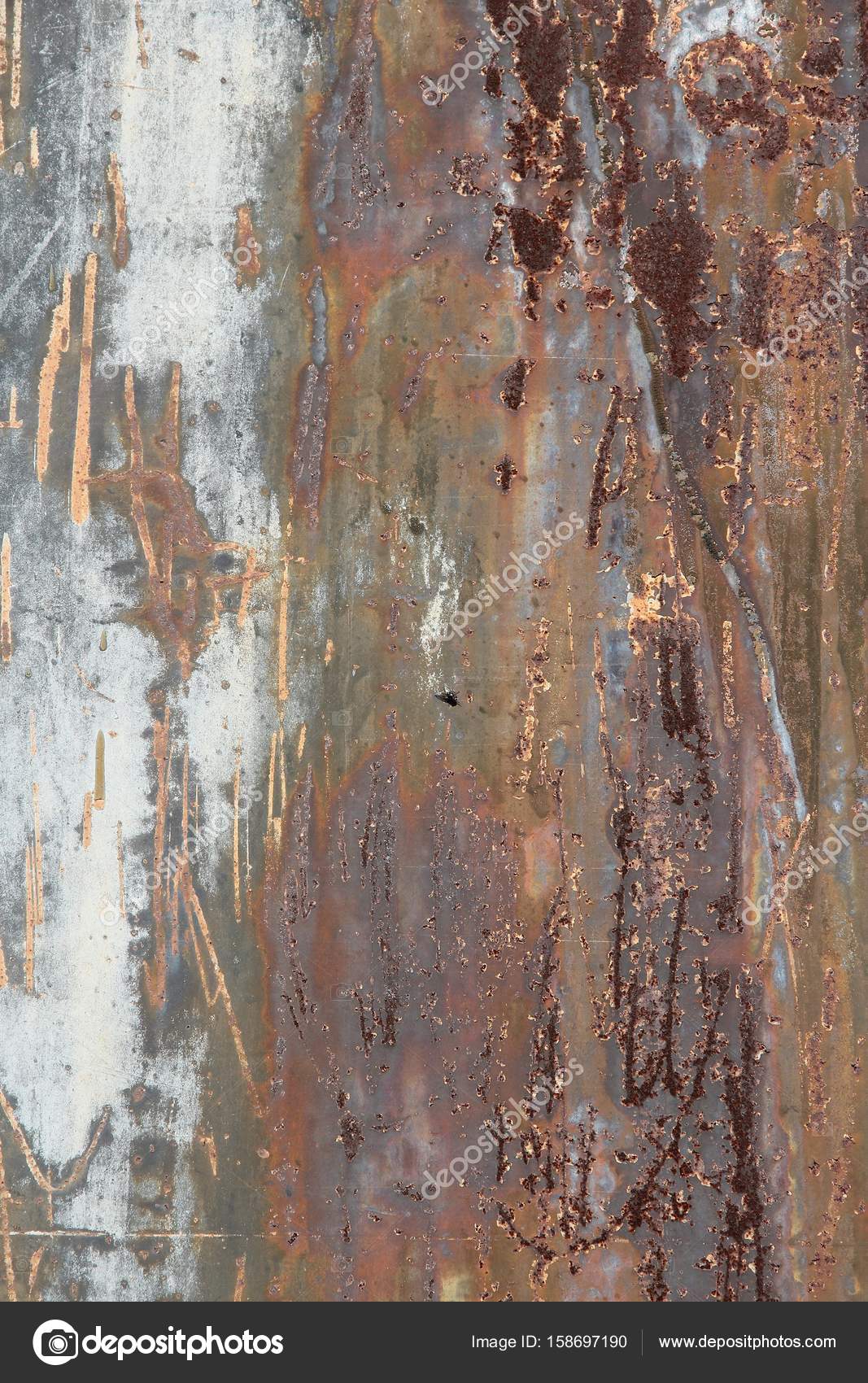 Ржавчина образуется только на внешней стороне металлической поверхности, потому что для ее образования требуется кислород и вода. Если вы найдете старый металлический стол или стальной стержень, оставленный снаружи, который вы пытаетесь очистить от ржавчины, то все, что вы видите под поверхностью, еще не подверглось воздействию кислорода и воды.
Ржавчина образуется только на внешней стороне металлической поверхности, потому что для ее образования требуется кислород и вода. Если вы найдете старый металлический стол или стальной стержень, оставленный снаружи, который вы пытаетесь очистить от ржавчины, то все, что вы видите под поверхностью, еще не подверглось воздействию кислорода и воды.
Ржавеет ли сталь в воде?
Да, сталь действительно ржавеет в воде, только посмотрите подводные фотографии затонувших кораблей. Однако он образует другой тип ржавчины, который не развивается так быстро, как обычная ржавчина, которую вы видите на металлах, оставленных на открытом воздухе, – FeO (OH).В частности, он создает гидроксид железа (III) Fe (OH) 3. Сталь нуждается как в воде, так и в кислороде воздуха для образования ржавчины FeO (OH). Однако это не означает, что ваша лодка, сделанная из стальных материалов, защищена от коррозии, поскольку только небольшое количество воздуха может вызвать ржавчину стали. Вы можете сами убедиться, что для создания обычной ржавчины требуется как воздух, так и вода, попробовав это в домашнем научном эксперименте:
Ржавеет ли сталь в соленой воде?
Да.Фактически, в соленой воде сталь ржавеет быстрее, чем в пресной. Присутствие соли действует как катализатор, ускоряя процесс химической коррозии. Соль – это электролит, и он вносит ионы в воду. Те, кто живет в более холодном климате, хорошо осведомлены о коррозионной опасности соли и должны регулярно проверять свои автомобили зимой на наличие признаков ржавчины, если соль регулярно наносится на их дороги для борьбы со льдом. Дороги, мосты и другие стальные конструкции вдоль дорог в более холодном климате также подвержены риску износа.
Как быстро ржавеет сталь?
Сталь немедленно ржавеет при воздействии влаги и воздуха. Скорость коррозии стали обычно зависит от того, насколько сталь подвергается воздействию влаги и воздуха, уровня влажности и воздуха, а также наличия защитных покрытий (мы вернемся к этому позже). Хотя химическая реакция, приводящая к коррозии стали, происходит мгновенно, вам может потребоваться некоторое время, чтобы это заметить. Визуальные признаки ржавчины могут появиться через неделю или две при правильных условиях.Ржавчина сначала затронет внешнюю поверхность стали, а затем начнет медленно разъедать стальную поверхность. По прошествии достаточного времени все железо в стальном материале окислится и сделает сталь практически бесполезной для той цели, для которой она была предназначена. К счастью, этот процесс окисления обычно занимает много времени, и некоторые ржавые поверхности можно исправить, немного поработав, как помогает объяснить Джей Лено.
Хотя химическая реакция, приводящая к коррозии стали, происходит мгновенно, вам может потребоваться некоторое время, чтобы это заметить. Визуальные признаки ржавчины могут появиться через неделю или две при правильных условиях.Ржавчина сначала затронет внешнюю поверхность стали, а затем начнет медленно разъедать стальную поверхность. По прошествии достаточного времени все железо в стальном материале окислится и сделает сталь практически бесполезной для той цели, для которой она была предназначена. К счастью, этот процесс окисления обычно занимает много времени, и некоторые ржавые поверхности можно исправить, немного поработав, как помогает объяснить Джей Лено.
Ржавеет ли низкоуглеродистая сталь?
Да. Низкоуглеродистая сталь, также известная как углеродистая сталь, со временем ржавеет, если на нее не будет нанесено какое-либо защитное покрытие, предотвращающее коррозию стали.Низкоуглеродистая сталь имеет низкое содержание углерода, и углерод не помогает предотвратить коррозию стали. Элементы, которые вводятся в сталь, такие как молибден, титан и хром, могут улучшить коррозионную стойкость стали, но не делают ее стойкой к ржавчине.
Ржавеет ли оцинкованная сталь? А как насчет титановой стали и нержавеющей стали?
Хотя железо в стали подвергается процессу окисления, в результате которого образуется ржавчина, нанесение на сталь тонкого слоя материала, который не ржавеет, является эффективным способом защиты стали от коррозии.Вот несколько наиболее распространенных методов защиты металлов от коррозии.
Цинк (оцинкованная сталь)
Сталь с цинковым покрытием обычно называют сталью для цинкования. Сталь, а также другие металлы, такие как алюминий и железо, погружены в цинк с температурой 860 градусов по Фаренгейту. Цинк реагирует с кислородом и углекислым газом с образованием карбоната цинка, который является внешним видом многих металлических предметов, таких как уличные фонари, двутавровые балки и другие изделия из стали. Он не только придает стали приятный внешний вид, но и отлично предотвращает образование ржавчины.Конечно, если внешняя поверхность поцарапана или изнашивается, то теперь обнаженная сталь начнет разъедать.
Он не только придает стали приятный внешний вид, но и отлично предотвращает образование ржавчины.Конечно, если внешняя поверхность поцарапана или изнашивается, то теперь обнаженная сталь начнет разъедать.
Хром (нержавеющая сталь)
Сталь с покрытием тонким слоем оксида хрома чаще называют нержавеющей сталью и является одной из наиболее широко производимых коррозионно-стойких сталей в мире. Хром действует в основном для предотвращения процесса окисления и коррозии, поскольку он действует как барьер для кислорода от проникновения кислорода в железо стали.Хром также придает стали чистый и полированный вид, что делает ее практичной для широкого спектра применений.
Алюминий (алюминиевая сталь)
Сталь, покрытая алюминиево-кремниевым сплавом, имеет большую коррозионную стойкость, чем сталь, а также сохраняет свойства стали при чрезвычайно высоких температурах. По этой причине алюминиевая сталь часто используется для применений, где требуется, чтобы материал выдерживал высокие температуры, но не ржавел со временем, например, в установках HVAC, автомобильных глушителях, духовках, водонагревателях и каминах.
Как уберечь сталь от ржавчины
Независимо от того, есть ли у вас стальные инструменты, автомобильные детали или стальной сарай, все они могут подвергнуться коррозии, если вы не будете обращаться с ними должным образом. Вот несколько наших любимых советов по предотвращению образования ржавчины на повседневных предметах из стали.
- Держите его сухим – Если вы моете инструменты или случайно оставили их под дождем, лучше всего держать их в сухом состоянии. Высушите инструменты после использования и по возможности храните их в закрытом помещении с низким уровнем влажности.
- Держите его в чистоте – Скопившаяся грязь и мусор могут удерживать влагу и вызывать коррозию даже в сухой день. Периодическое использование шланга или мойки высокого давления для очистки грязных участков вокруг металлических поверхностей может помочь избежать ржавчины в долгосрочной перспективе.
- Нанесите защитное покрытие – В зависимости от поверхности, которую вы хотите защитить, вы можете нанести покрытие для защиты металла от ржавчины. Добавление слоя акриловой латексной краски или краски на масляной основе помогает металлическим объектам, таким как водостоки, от ржавчины, и, вероятно, является наиболее экономичным вариантом для предметов вокруг дома.
Какие химические вещества быстро ржавеют металл?
Ржавчина – это химическая реакция, при которой происходит обмен электронами между атомами; некоторые химические вещества могут ускорить ржавление, увеличивая электрическую активность между железом и кислородом. Такие вещества, как соли и кислоты, увеличивают проводимость влаги вокруг металла, ускоряя образование ржавчины.
Вода
Металлы быстро разрушаются во влажной среде, поскольку влажный воздух является идеальной средой для образования ржавчины.Капля воды, по сути, становится маленькой батареей, позволяющей ионам свободно перемещаться между железом и кислородом. Около точки, где встречаются вода, железо и воздух, электрохимическая реакция вытягивает кислород из воздуха, образуя ионы гидроксида в воде. Когда металл покрыт водой, атомы железа теряют электроны, что приводит к медленному распаду металла; ионизированное железо растворяется в воде. В воде растворенное железо реагирует с ионами гидроксида с образованием ржавчины.
Соль
Соль ускоряет процесс ржавления за счет снижения электрического сопротивления воды.Ржавчина возникает в результате химического процесса, называемого окислением, при котором атомы металла теряют электроны, образуя ионы. Чем легче электроны переходят от железа к кислороду, тем быстрее ржавеет металл. В тех штатах, где зимой используют дорожную соль для таяния снега, стальные кузова автомобилей ржавеют быстрее, чем в штатах с засушливой пустыней.
Отбеливатель
Активным ингредиентом отбеливателя является химическое соединение, называемое гипохлоритом натрия. Он действует как окислитель, ионизируя другие материалы, удаляя из них электроны; Вот почему он удаляет пятна с одежды и убивает микробы.Окислительные свойства отбеливателя ускоряют ржавление; железо легче теряет электроны в присутствии отбеливателя, чем в простой воде.
Уксус
Уксус ускоряет ржавление, поскольку он содержит разбавленную форму уксусной кислоты; положительные ионы водорода в кислоте удаляют электроны из железа, ионизируя его и делая его восприимчивым к ржавчине. Уксус в воде также проводит электричество лучше, чем одна вода, облегчая движение электронов и ионов в процессе ржавления.Хотя отбеливатель и уксус ускоряют ржавление, не используйте их вместе, так как смесь выделяет токсичный газообразный хлор.
Почему нержавеющая сталь не ржавеет?
Инженер-металлург Майкл Л. Фри из Университета Юты предлагает следующее объяснение:Нержавеющая сталь остается нержавеющей или не ржавеет из-за взаимодействия между ее легирующими элементами и окружающей средой. Нержавеющая сталь содержит железо, хром, марганец, кремний, углерод и, во многих случаях, значительные количества никеля и молибдена.Эти элементы вступают в реакцию с кислородом воды и воздуха, образуя очень тонкую стабильную пленку, состоящую из таких продуктов коррозии, как оксиды и гидроксиды металлов. Хром играет доминирующую роль в реакции с кислородом с образованием пленки продуктов коррозии. Фактически, все нержавеющие стали по определению содержат не менее 10 процентов хрома.
Наличие стабильной пленки предотвращает дополнительную коррозию, действуя как барьер, ограничивающий доступ кислорода и воды к находящейся под ним металлической поверхности.Поскольку пленка образуется так легко и плотно, даже всего несколько атомных слоев снижают скорость коррозии до очень низкого уровня. Тот факт, что пленка намного тоньше длины волны света, затрудняет просмотр без помощи современных инструментов. Таким образом, хотя сталь подвергается коррозии на атомарном уровне, она кажется нержавеющей.


 Ферритные хромистые стали имеют высокую коррозионную стойкость в азотной кислоте, водных растворах аммиака, в аммиачной селитре, смеси азотной, фосфорной и фтористоводородной кислот, а также в других агрессивных средах. К этому виду относятся все стали 400 серии.
Ферритные хромистые стали имеют высокую коррозионную стойкость в азотной кислоте, водных растворах аммиака, в аммиачной селитре, смеси азотной, фосфорной и фтористоводородной кислот, а также в других агрессивных средах. К этому виду относятся все стали 400 серии.