Типы кристаллических решеток металлов: Глава 2.2. Атомно-кристаллическое строение металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
alexxlab | 05.03.2023 | 0 | Разное
1.Кристаллическое строение металлов. Типы кристаллических решёток.
Все тела состоят из атомов. Тела, в которых атомы расположены беспорядочно, называютаморфными(стекло, канифоль, воск, смола и др.).Кристаллические тела(все металлы и металлические сплавы), характеризуются упорядоченным расположением атомов. В металлах и металлических сплавах атомы находятся в узлах пространственных кристаллических решеток.
В процессе кристаллизации металлов и
сплавов могут образовываться
кристаллические решетки разного типа.
Наиболее распространенными являются объемно-центрированная кубическая (рис.1, а) (К,V, Сr,Fеа, Мо,W),
гранецентрированная кубическая (рис.1,
б) (Аl,Fe, Ni, Сu,
Аg, Аu, Рb) и гексагональная решетки(рис.1, а)
(Ве, Мg, Со,Zn, Тi). Гранецентрированная
кубическая и гексагональная решетки
характеризуются наиболее плотной
упаковкой атомов и их компактным
размещением.
Расстояния между соседними атомами в кристаллической решетке (параметр решётки) Рис.1
исключительно малы. Для их измерения пользуются особой единицей – ангстремом (А°), который равен 1А°=10-8см, или нанометром (1 нм=10-9см).
2. Аллотропические превращения в металлах.
Некоторые металлы в твердом состоянии (железо, марганец, кобальт и др.) в зависимости от температуры нагрева могут иметь кристаллические решетки различного строения и, следовательно, обладать различными свойствами. Это явление называется аллотропией, илиполиморфизмом.Кроме того, известен полиморфизм под влиянием температуры и давления. При нагреве до 2000 °С и давлении ~ 1010Па углерод в форме графита перекристаллизовывается в алмаз.
Аллотропические формы принято обозначать
буквами греческого алфавита: альфа,
бета, гамма и т.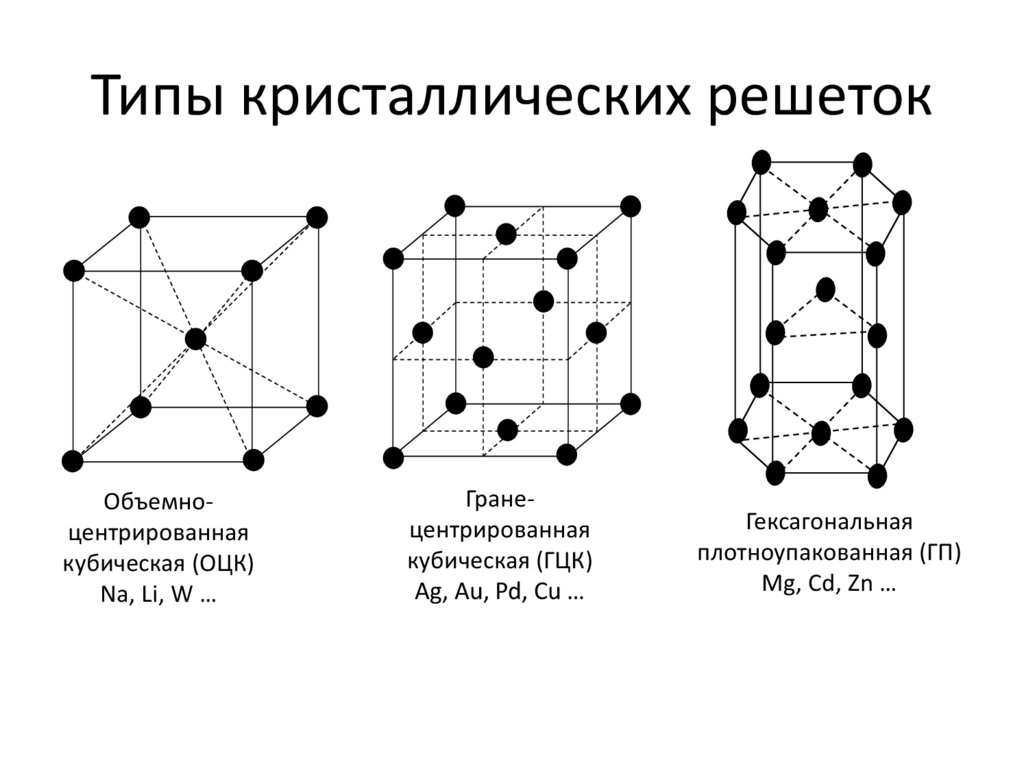
К металлам, не претерпевающим аллотропических превращений в твердом состоянии при нагревании и охлаждении, относятся алюминий, магний, медь и др. Большое число технически важных металлов (олово, цинк, никель, кобальт и др.) подвержено аллотропическим изменениям.
3. Процесс кристаллизации. Дефекты кристаллического строения.
Кристаллизациейназывается образование кристаллов в металлах и сплавах при переходе из жидкого состояния в твёрдое (первичная кристаллизация), а также перекристаллизация в твёрдом состоянии (вторичная кристаллизация).
Процесс кристаллизации металла
складывается из двух элементарных
процессов: образования центров
кристаллизации (зародышей) и роста
кристаллов из этих центров. При температуре
кристаллизации в жидком металле сначала
образуются центры кристаллизации,
причем их роль играют разные примеси,
мельчайшие шлаковые и неметаллические
включения. После образования зародышей
атомы жидкого металла, расположенные
беспорядочно, начинают располагаться
вокруг этих зародышей и образуют
кристаллы правильной геометрической
формы.
а — вакансия; б — межузельный атом; в — примесный атом внедрения
поверхностные (двухмерные), объемные (трехмерные).
Наиболее распространены точечные. К
ним относят вакансии(узлы в
кристаллической решетке, свободные
от атомов),межузельные атомы (атомы,
находящиеся вне узлов кристаллической
решетки), а такжепримесные атомы(рис.2).
К
ним относят вакансии(узлы в
кристаллической решетке, свободные
от атомов),межузельные атомы (атомы,
находящиеся вне узлов кристаллической
решетки), а такжепримесные атомы(рис.2).
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Раздел 1
Строение и свойства
металлов.
Тема 1.1 Кристаллическое строение
металлов и сплавов
Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в
пространстве двумя способами:
Беспорядочное расположение атомов, когда они
не
занимают
определенного
места
друг
относительно друга. Такие тела называются
аморфными.
Аморфные вещества обладают формальными
признаками твердых тел, т.е. они способны
сохранять постоянный объем и форму. Однако они
не имеют определенной температуры плавления
или кристаллизации.
Упорядоченное расположение атомов, когда
атомы
занимают
в
пространстве
вполне
определенные места, Такие вещества называются
кристаллическими.
Атомы совершают относительно своего среднего
положения колебания с частотой около 1013 Гц.
Амплитуда этих колебаний пропорциональна
температуре.
Благодаря
упорядоченному
расположению
атомов в пространстве, их центры можно соединить
воображаемыми прямыми линиями. Совокупность
таких
пересекающихся
линий
представляет
пространственную решетку, которую называют
кристаллической решеткой.
Внешние
электронные
орбиты
атомов
соприкасаются, так что плотность упаковки атомов
в кристаллической решетке весьма велика.
Кристаллические твердые тела состоят из
кристаллических зерен – кристаллитов. В соседних
зернах кристаллические решетки повернуты
относительно друг друга на некоторый угол.
В кристаллитах соблюдаются ближний и дальний
порядки. Это означает наличие упорядоченного
расположения и стабильности как окружающих
данный атом ближайших его соседей (ближний
порядок), так и атомов, находящихся от него на
значительных расстояниях вплоть до границ зерен
(дальний порядок).
а
б
Рис. 1.1. Расположение атомов в кристаллическом
(а) и аморфном (б) веществе
Вследствие диффузии отдельные атомы могут
покидать свои места в узлах кристаллической
решетки, однако при этом упорядоченность
кристаллического строения в целом не нарушается.
Внешние
электронные
орбиты
атомов
соприкасаются, так что плотность упаковки атомов
в кристаллической решетке весьма велика.
Кристаллические твердые тела состоят из
кристаллических зерен – кристаллитов. В соседних
зернах кристаллические решетки повернуты
относительно друг друга на некоторый угол.
1.1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами,
имеющими определенный тип кристаллической
решетки,
состоящей
из
малоподвижных
положительно заряженных ионов, между которыми
движутся свободные электроны (так называемый
электронный газ). Такой тип структуры называется
металлической связью.
Тип решетки определяется формой элементарного
геометрического тела, многократное повторение
которого по трем пространственным осям образует
решетку данного кристаллического тела.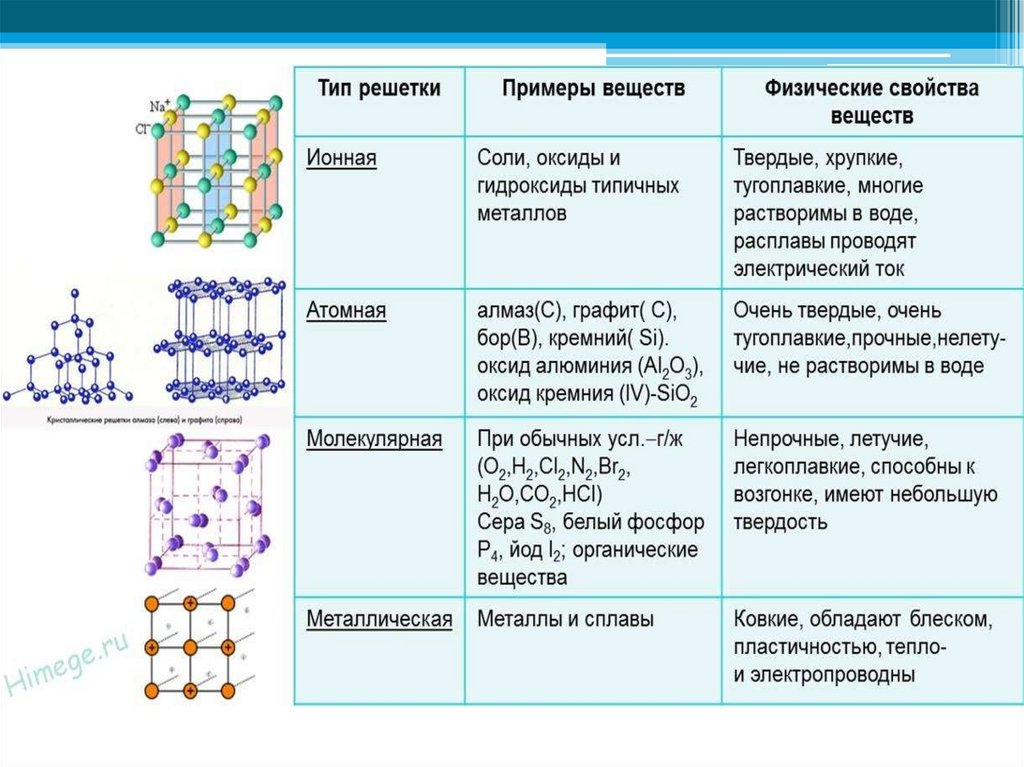
Рис. 1.2. Основные типы кристаллических решеток
металлов
а) кубическая
(1 атом на ячейку)
б) объемно-центрированная
кубическая (ОЦК)
(2 атома на ячейку)
в) гранецентрированная
кубическая (ГЦК)
(4 атома на ячейку)
г) гексагональная
плотноупакованная (ГП)
(6 атомов на ячейку)
Металлы имеют относительно сложные типы
кубических решеток – объемно центрированная (ОЦК) и
гранецентрированная (ГЦК) кубические решетки.
Основу ОЦК-решетки составляет элементарная
кубическая ячейка (рис.1.2,б), в которой положительно
заряженные ионы металла находятся в вершинах куба, и
еще один атом в центре его объема, т. е. на пересечении
его диагоналей. Такой тип решетки в определенных
диапазонах температур имеют железо, хром, ванадий,
вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой
служит куб с центрированными гранями. Подобную
решетку имеют железо, алюминий, медь, никель, свинец
и др. металлы.
металлы.
Третьей
распространенной
разновидностью
плотноупакованных решеток является гексагональная
плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка
состоит из отстоящих друг от друга на параметр с
параллельных
центрированных
гексагональных
оснований. Три иона (атома) находятся на средней
плоскости между основаниями.
У гексагональных решеток отношение параметра
с/а всегда больше единицы. Такую решетку имеют
магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или
степень заполненности ее объема атомами является
важной характеристикой. Она определяется такими
показателями как параметр решетки, число атомов в
каждой элементарной ячейке, координационное
число и плотность упаковки.
Параметр решетки – это расстояние между
атомами по ребру элементарной ячейки. Параметры
решетки измеряется в нанометрах (1 нм = 10-9 м = 10 Å).
Параметры кубических решеток характеризуются
длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки
принимают два параметра – сторону шестигранника
а и высоту призмы с. Когда отношение с/а = 1,633,
то атомы упакованы наиболее плотно, и решетка
называется гексагональной плотноупакованной
(рис. 1.2 г). Некоторые металлы имеют
гексагональную решетку с менее плотной упаковкой
атомов (с/а > 1,633). Например, для цинка с/а =
1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в
пределах от 0,286 до 0,607 нм. Для металлов с гексагональной
решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах
0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут
быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной
ячейке следует иметь в виду, что каждый атом входит
одновременно в несколько ячеек. Например, для ГЦКрешетки, каждый атом, находящийся в вершине куба,
принадлежит 8 ячейкам, а атом, центрирующий грань, двум.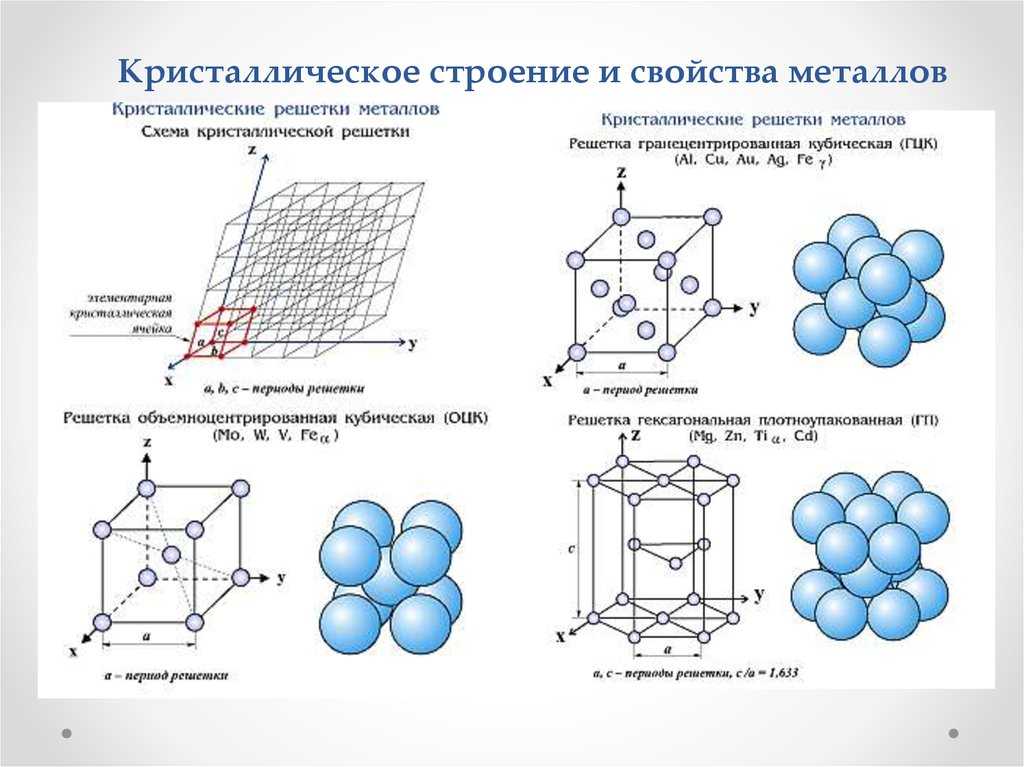
И лишь атом, находящийся в центре куба, полностью
принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат
соответственно 2 и 4 атома.
Анизотропия в кристаллах
Под анизотропией понимается неодинаковость
механических и других свойств в кристаллических телах
вдоль различных кристаллографических направлений.
Она
является
естественным
следствием
кристаллического строения, так как на различных
кристаллографических плоскостях и вдоль различных
направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в)
по направлениям вдоль ребер насчитывается меньше
атомов, чем вдоль диагоналей куба в ОЦК-решетке или
диагоналей граней в ГЦК-решетке. На плоскостях,
проходящих через грани ОЦК- и ГЦК-решеток, находится
меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические
свойства вдоль различных направлений зависят от
плотности
находящихся
на
них
атомов,
то
перечисленные свойства вдоль различных направлений
в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах
одного монокристалла или зернакристаллита. В
поликристаллических телах она не наблюдается из-за
усреднения свойств по каждому направлению для
огромного количества произвольно ориентированных
друг относительно друга зерен. Поэтому реальные
металлы являются квазиизотропными телами, т. е.
псевдоизотропными.
Сдвиг в кристалле происходит наиболее легко вдоль
атомных плоскостей с наиболее плотной упаковкой
атомов. Рассмотрим объемно-центрическую кубическую
решетку (ОЦК) (рис. 1.5):
Рис. 1.5. Элементарная ячейка
решетки ОЦК
1) Плоскость ABCD (рис 1.6 а). Количество атомов в
плоскости ABCD – 1; площадь ABCD = a2; площадь,
приходящаяся на 1 атом – удельная площадь:
– мера плотности упаковки
2) Плоскость ABGH (рис 1.6 б). Количество атомов в
плоскости ABGH – 2; площадь ABGH = a2
В плоскости ABGH плотность упаковки больше чем в
ABСD. Наиболее вероятен сдвиг вдоль диагональных
плоскостей.
Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и
др. способны по достижении определенных температур
изменять кристаллическое строение, т. е. изменять тип
элементарной ячейки своей кристаллической решетки.
Это явление получило название аллотропии или
полиморфизма,
а
сами
переходы
от
одного
кристаллического строения к другому называются
аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии F
от температуры t для двух вариантов кристаллического
строения железа: ОЦК (кривая 1) и ГЦК (кривая 2).
В интервале температур 911-1392оC железо имеет
решетку ГЦК, так как при этом его свободная энергия
меньше. При t<911°С и t>1392°С, у него должна быть
решетка ОЦК, обладающая меньшей свободной
энергией.
Разные
аллотропические
формы
металлов
обозначаются буквами греческого алфавита, при этом
низкотемпературные модификации обозначаются буквой
a, а последующие в порядке роста температур – буквами
b, g ,d и т.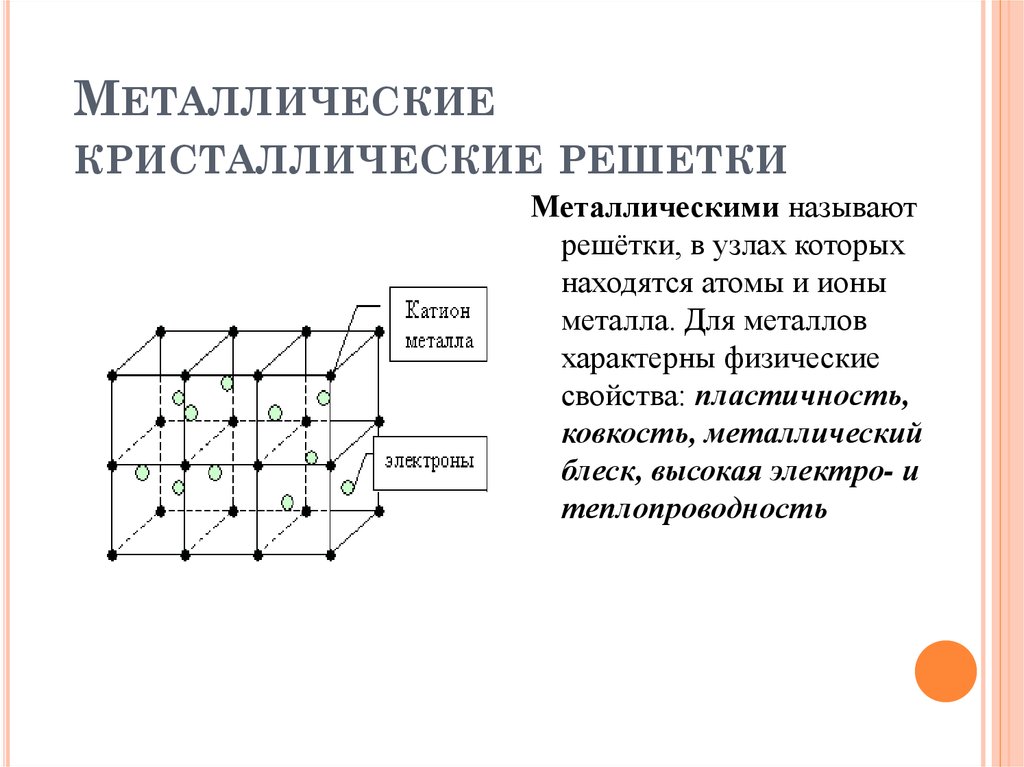 д. Аллотропическими формами железа
д. Аллотропическими формами железа
являются: до 911°С – альфа-железо (a-Fe), имеющее ОЦКрешетку, от 911°С до 1392 °С -гамма-железо (g -Fe) с
решеткой ГЦК и от 1392°С до 1539 °С т. е. до температуры
плавления-снова a-Fe с решеткой OЦK, однако, чтобы
отличить его от низкотемпературной модификации, его
принято называть дельта-железом (d Fе).
Известное в практике так называемое немагнитное
бета-железо (b -Fe) самостоятельной аллотропической
формой не является, так как имеет такую же, как у a-Fe
ОЦК-решетку и отличается от него только отсутствием
магнитных свойств, которые оно теряет при 768°С (точка
Кюри).
Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют
нарушения сплошности и все узлы заполнены
однородными
атомами
называется
идеальной
кристаллической решеткой металла.
В решетке реального металла могут находиться
различные дефекты.
Все дефекты кристаллической решетки принято делить
на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами
атомов. К ним относятся вакансии, т. е. незаполненные
узлы решетки, межузельные атомы данного металла (рис
1.8), примесные атомы замещения, т. е. атомы, по
диаметру соизмеримые с атомами данного металла и
примесные атомы внедрения, имеющие очень малые
размеры и поэтому находящиеся в междоузлиях (рис 1.9).
Влияние этих дефектов на прочность металла может
быть различным в зависимости от их количества в
единице объема и характера.
Рис. 1.8.
Схема
образования
пары
вакансиявнедренный
атом
Линейные
дефекты
имеют
длину,
значительно
превышающую их поперечные размеры. К ним относятся
дислокации, т. е. дефекты, образующиеся в решетке в
результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация
(рис. 1.10). Она образуется в результате возникновения в
решетке
так
экстраплоскости.
называемой
полуплоскости
или
Нижний ряд экстраплоскости собственно и принято
называть дислокацией
Рис. 1.10. Схема краевой дислокации в идеальном
кристалле
Другим типом дислокации является винтовая
дислокация, которая представляет собой некоторую
условную ось внутри кристалла, вокруг которой закручены
атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные
искажения кристаллической решетки наблюдаются только вблизи
оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому
существенно уменьшают прочность металла, так как облегчают
образование сдвигов в зернах-кристаллитах под действием
приложенных напряжений.
Дислокационный
механизм
сдвиговой
пластической
деформации внутри кристаллов может привести к разрушению
изделия. Таким образом, дислокации непосредственно влияют на
прочностные характеристики металла.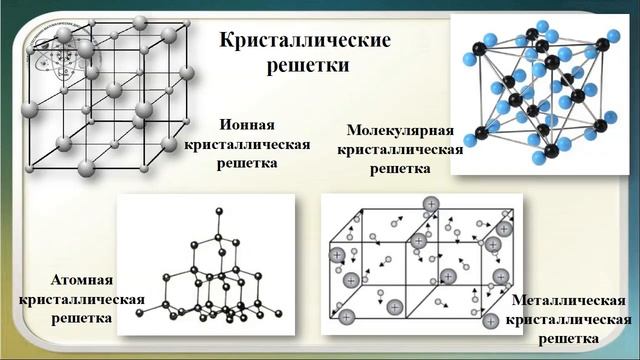
Для оценки этого влияния используется плотность дислокаций,
под которой принято понимать отношение суммарной длины
дислокаций к объему содержащего их металла. Плотности
дислокаций измеряется в см-2 или м-2.
На рис. 1.12 в виде кривой ABC схематически
показана зависимость прочности металла от плотности
дислокаций. Точка А соответствует теоретической
прочности металла, обусловленной необходимостью
одновременного разрыва всех межатомных связей,
проходящих через плоскость сдвига, в случае отсутствия
дислокаций.
При увеличении количества дислокаций (см. участок
АВ) прочность резко снижается, так как на несколько
порядков уменьшаются усилия, необходимые для
осуществления сдвигов в зернах металла при его
деформировании и разрушении
При плотности дислокаций 106-107 см-2 (точка В на
кривой), прочности минимальна, и на участке ВС
происходит ее рост. Это объясняется тем, что с ростом
плотности дислокаций их передвижение происходит не
только по параллельным, но и по пересекающимся
плоскостям, что существенно затрудняет процесс
деформирования зерен.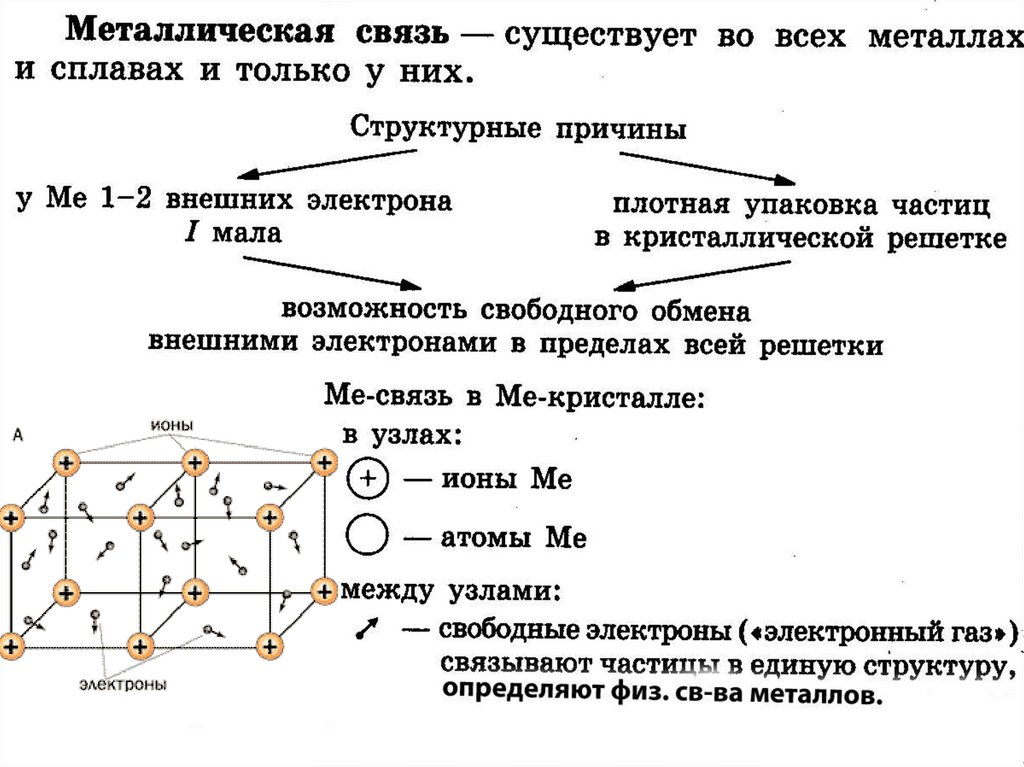
Поэтому начиная с точки В прочность металла
возрастает.
Максимальная
плотность
дислокаций,
может
составить 1013 см-2. При дальнейшем росте плотности
дислокаций происходит разрушение металла.
Поверхностные дефекты включают
главным образом границы зерен (рис.1.13).
в
Рис.1.13. Структура границы двух соседних
кристаллических зерен
себя
На границах кристаллическая решетка сильно
искажена. В них скапливаются перемещающиеся
изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл
прочнее крупнозернистого. Так как у последнего меньше
суммарная протяженность (площадь) границ. То можно
сделать
вывод,
что
поверхностные
дефекты
способствуют повышению прочности металла. Поэтому
создано несколько технологических способов получения
мелкозернистых сплавов.
Объемные дефекты кристаллической решетки
включают трещины и поры. Наличие данных дефектов,
уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными
концентраторами напряжений, в десятки и более раз
повышающими напряжения создаваемые в металле
рабочими нагрузками. Последнее обстоятельство
наиболее существенно влияет на прочность металла
Контрольные вопросы
1.В чем состоит существенная разница между строением
аморфных и кристаллических тел? Что такое кристаллическая
решетка?
2.Перечислите основные типы ячеек кристаллических решеток
металлов. Что такое параметры решеток?
3.Что такое анизотропия свойств в кристаллах, чем она
обусловлена? Привести пример.
4.Почему поликристаллические тела являются изотропными?
Что такое квазиизотропия (псевдоизотропия)?
5.Что такое аллотропия (полиморфизм) металлов и каково ее
практическое значение?
6.Что представляют собой краевые дислокации, какова их роль в
протекании пластической деформации металла и как они влияют
на его прочность?
7.Что такое плотность дислокаций и как она влияет на характер
изменения прочности металла?
Кристаллическая структура – типы, примеры, элементарная ячейка и решетка
Решетка или кристаллическая решетка – это формирование асимметричного трехмерного структурного расположения ионов, атомов и молекул, образующих элементарную ячейку. Значительная и отчетливая геометрическая форма элементарной ячейки определяет тип кристаллической решетки.
Значительная и отчетливая геометрическая форма элементарной ячейки определяет тип кристаллической решетки.
Особенности кристаллической структуры:
В элементарной ячейке кристаллической структуры каждый ион, атом или молекула представляет собой точку в трехмерном пространстве. Это означает, что все частицы, составляющие эту единицу, можно считать точками.
Каждая точка в кристаллической структуре определяется как точка решетки или узел решетки.
Две или более точек решетки могут быть соединены в прямую линию в зависимости от формы элементарной ячейки.
При соединении двух или более прямых линий образуется трехмерная конструкция элементарной ячейки, представляющая собой кристаллическую структуру. Такое расположение точек решетки в трехмерном пространстве называется решеткой Браве.
Что такое элементарная ячейка?
Наименьшая единица твердой кристаллической структуры называется элементарной ячейкой. Его можно определить как структурную единицу твердого кристалла, а решетка создается его повторением в определенном формате.
Его можно определить как структурную единицу твердого кристалла, а решетка создается его повторением в определенном формате.
Для идентификации элементарной ячейки кристаллической структуры учитываются следующие параметры.
Три ребра a, b и c
Углы между этими ребрами ∝, β и γ
Углы между этими ребрами могут быть разными. Когда высокоэнергетические электромагнитные волны проходят через кристалл, элементарные ячейки поглощают и посылают сигналы. Эти сигналы можно интерпретировать, чтобы понять форму элементарной ячейки. Следовательно, можно идентифицировать взаимное расположение нескольких элементарных ячеек, что приводит к выражению кристаллической структуры.
Типы решетчатых структур
Элементарные элементарные ячейки
В этом расположении составляющие точки решетки занимают только угловые положения.
Центральные единичные ячейки
В этом расположении частицы занимают центральное положение вместе с угловыми. Они бывают следующих типов.
Это типичная решетчатая структура, в которой атомные плоскости или плоскости решетки лежат в промежутках нижних плоскостей соответствующих атомов. В этом типе элементарная ячейка имеет форму куба. Это означает, что один атом непосредственно контактирует с восемью другими атомами или узлами решетки. Такой тип расположения можно найти в ванадии, вольфраме и хроме.
Наложенные друг на друга атомы или узлы решетки создают зазоры, в которых нижележащая плоскость может входить в верхнюю. Атомные уровни плотно упакованы, создавая гексагональную структуру решетки с плотнейшей упаковкой (HCP). Такие металлы, как кобальт, цинк, титан и магний, имеют такой тип расположения решетки. Точка связана с 12 соседними точками, что дает ее координационное число 12.
Эта решетчатая структура также упаковывает максимальное количество атомных плоскостей в последовательности укладки. Второй слой атомов в основном уложен в стопку, следуя структуре ГПУ в промежутках нижележащего слоя. Третий слой, наоборот, лежит в свободных промежутках. Такие металлы, как медь, свинец и никель, демонстрируют такие типы твердокристаллической решетки. Координационное число этой кристаллической структуры равно 12,9.0003
(изображение будет загружено в ближайшее время)
Типы кристаллических систем
(изображение будет загружено в ближайшее время)
ТРИКЛИНАЯ Система
В этой системе все три акса включены к тому друг друга и имеют одинаковую длину. В зависимости от угла наклона кристаллы имеют разную форму. Пример – кианит, амазонит, полевой шпат и др.
Моноклинная система
В этой кристаллической структуре есть три оси.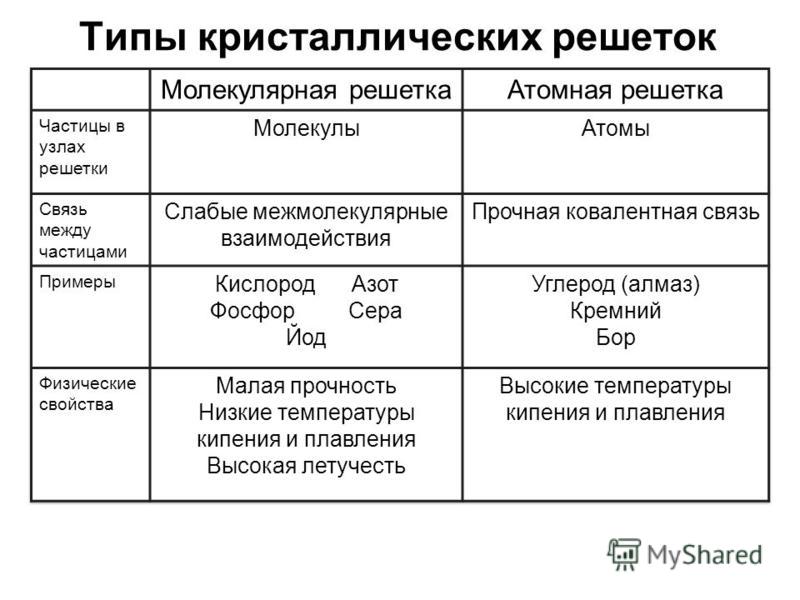 Две из них перпендикулярны друг другу, а третья наклонена, образуя другой угол. Лучшими примерами моноклинных систем являются гипс, петалит, диопсид и др.
Две из них перпендикулярны друг другу, а третья наклонена, образуя другой угол. Лучшими примерами моноклинных систем являются гипс, петалит, диопсид и др.
Орторомбическая система
Структура кристаллической решетки этого типа состоит из трех осей, которые перпендикулярны друг другу, но длины этих осей различаются. Примерами такой решетчатой структуры являются топаз, иолит, цоизит и др.
Тригональная структура
Элементарная ячейка этой системы в основном представляет собой трехстороннюю пирамиду. Он также может принимать такие формы, как ромбоэдрические и скаленоэдрические. Примерами являются кальцит, рубин, агат и т. д.
Гексагональная система
Теперь, когда мы знаем, что такое кристаллическая структура, эта система кажется немного отличной от остальных. Он имеет четыре оси, три из которых имеют одинаковую длину. Четвертая пересекает эти три под прямым углом. Примеры: берилл, апатит и др.
Он имеет четыре оси, три из которых имеют одинаковую длину. Четвертая пересекает эти три под прямым углом. Примеры: берилл, апатит и др.
Тетрагональная система
Эта система также состоит из трех осей. Изменяется размерность только главной оси. Две другие одинаковой длины. Примером этой системы является перовскит.
Кубическая система
Это решетчатая система, в которой все три угла расположены под прямым углом друг к другу и имеют одинаковую длину. Эту кристаллическую структуру металлов можно найти в золоте и серебре. Среди неметаллов эту характерную кристаллическую форму демонстрирует алмаз.
Форма кристалла
Кристалл имеет правильную форму, которую принимают некоторые вещества при затвердевании, например соль или снежинка. Одними из самых красивых кристаллов в природе являются снежинки, представляющие собой просто воду, сконденсировавшуюся вокруг пылинки. Снежинки – одно из самых удивительных явлений природы. Каждая снежинка отличается тем, что ее кристаллическая структура уникальна.
Снежинки – одно из самых удивительных явлений природы. Каждая снежинка отличается тем, что ее кристаллическая структура уникальна.
Изделия из хрусталя
Хрусталь в нашем общеупотребительном языке представляет собой красивый и драгоценный предмет посуды, сделанный из прозрачного стекла, преломляющего свет лучше, чем обычное стекло. Хрустальные вазы и стаканы украшают дом. Что выделяет хрусталь, так это то, как он преломляет свет, довольно поразительно. Когда его подносят к свету, он создает эффект радужной призмы, что отличает его от стекла. При постукивании по хрустальному стакану звучит музыкальное звенящее эхо, а обычный стакан таких звуков не издает.
Кристаллография
Наука очень подробно изучает кристаллы и их решетки с многочисленными приложениями. Изучение кристаллов называется кристаллографией. Его можно определить как экспериментальное и прикладное изучение кристаллических структур и того, как устроены их атомы. Слово Кристаллография использует два латинских слова: crystallon и graphein. Кристаллон означает «застывшая капля». Графеин означает «писать». Можно отметить, что суффикс -graphy образует окончательную часть многих видов исследований, таких как география (изучение Земли), картография (изучение карт) или стенография (навыки стенографии, машинописи и транскрипции).
Слово Кристаллография использует два латинских слова: crystallon и graphein. Кристаллон означает «застывшая капля». Графеин означает «писать». Можно отметить, что суффикс -graphy образует окончательную часть многих видов исследований, таких как география (изучение Земли), картография (изучение карт) или стенография (навыки стенографии, машинописи и транскрипции).
Решетка: Каркас
Поскольку кристаллы имеют заданную форму, каркас этих кристаллов называется решеткой. Этот каркас кристалла трехмерен, как каркас деревянного ящика. Решетка также представляет собой узор, созданный путем переплетения полос крест-накрест, чередующихся между осями X и Y. Типичным примером такой решетки может быть решетчатая корка для пирога или плетение бамбуковой корзины.
Решетка в исследованиях
Решетка используется в различных предметах для обозначения трехмерной структуры или структуры, таких как химия, физика, математика, биология и взаимосвязанные области, такие как биофизика. Химия использует решетку для описания структуры молекул. Математика использует решетки в абстрактной алгебре. Физика конденсированного состояния использует решетку для представления атомов. Биология использует решетки для представления структур ДНК или белка.
Химия использует решетку для описания структуры молекул. Математика использует решетки в абстрактной алгебре. Физика конденсированного состояния использует решетку для представления атомов. Биология использует решетки для представления структур ДНК или белка.
Понимание решетки
В базовых ремеслах изготовление игральных костей из бумаги или картона было бы хорошей практикой для понимания решетки. Понимание решетки требует пространственного понимания. Это понимание размера или положения любого объекта или точки в пространстве. Люди с хорошим пространственным пониманием и ориентацией могут определять направления и маршруты. Те, у кого хорошее пространственное мышление, могут видеть в уме, где объект или объекты расположены по отношению к другим объектам вокруг них в трех измерениях. Те, у кого исключительное пространственное понимание и пространственно-визуальная память, отлично решают кубик Рубика.
кристаллическая структура металлов – Physics Stack Exchange
Категории твердых тел на основе связей, которые удерживают твердое тело вместе
Твердые тела можно классифицировать на основе связей, которые удерживают атомы или молекулы вместе. Этот подход классифицирует твердые тела как молекулярные, ковалентные, ионные или металлические.
Этот подход классифицирует твердые тела как молекулярные, ковалентные, ионные или металлические.
Йод (I2), сахар (C12h32O11) и полиэтилен являются примерами соединений, которые являются молекулярными твердыми веществами при комнатной температуре. Вода и бром — это жидкости, которые при небольшом охлаждении образуют твердые молекулярные вещества; h3O замерзает при 0°C, а Br2 замерзает при -7°C.
Молекулярные твердые тела характеризуются относительно сильными внутримолекулярными связями между атомами, образующими молекулы, и гораздо более слабыми межмолекулярными связями между этими молекулами. Поскольку межмолекулярные связи относительно слабы, твердые молекулярные тела часто представляют собой мягкие вещества с низкой температурой плавления.
Сухой лед или твердая двуокись углерода — прекрасный пример твердого молекулярного вещества. Силы Ван-дер-Ваальса, удерживающие молекулы CO2 вместе, настолько слабы, что сухой лед возгоняется — он переходит непосредственно из твердой фазы в газовую — при -78°C.
диаграмма
Ковалентные твердые тела, такие как алмаз, образуют кристаллы, которые можно рассматривать как единую гигантскую молекулу, состоящую из почти бесконечного числа ковалентных связей. Каждый атом углерода в алмазе ковалентно связан с четырьмя другими атомами углерода, ориентированными по углам тетраэдра, как показано на рисунке ниже. Поскольку все связи в этой структуре одинаково сильны, ковалентные твердые вещества часто очень твердые, и их, как известно, трудно расплавить. Алмаз — самое твердое природное вещество, плавится при температуре 3550°С.
Диаграмма
Ионные твердые вещества представляют собой соли, такие как NaCl, которые удерживаются вместе сильной силой притяжения между ионами с противоположным зарядом.
Уравнение
Поскольку эта сила притяжения зависит от квадрата расстояния между положительным и отрицательным зарядами, прочность ионной связи зависит от радиусов ионов, образующих твердое тело. По мере того, как эти ионы становятся больше, связь становится слабее.
Чтобы понять металлические твердые тела, мы должны развеять распространенное заблуждение о химических связях. Ионные и ковалентные связи часто представляются как противоположные концы двумерной модели связи, в которой соединения, содержащие полярные связи, находятся где-то между этими крайностями.
ионная …….. полярная …….. ковалентная
В действительности существует три вида связей между соседними атомами: ионная, ковалентная и металлическая, как показано на рисунке ниже. Сила притяжения между атомами в металлах, таких как медь и алюминий, или сплавах, таких как латунь и бронза, представляет собой металлические связи.
Диаграмма
Молекулярные, ионные и ковалентные твердые тела имеют одну общую черту. За редким исключением электроны в этих твердых телах локализованы. Они либо принадлежат одному из атомов или ионов, либо принадлежат паре атомов или небольшой группе атомов.

