Углекислота формула: Углекислота жидкая , СО2, двуокись углерода, диоксид углерода
alexxlab | 19.11.2022 | 0 | Разное
Объем углекислого газа, его концентрация в воздухе, масса, молекула и физические свойства
Главная » Диоксид углерода
Рубрика: Диоксид углеродаАвтор: admin
Молекула углекислого газа
Углекислый газ представляет собой бесцветный газ, без запаха,который относится к неорганическим веществам. Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.
Электронная формула диоксида углеродаХимическая формула — CO2. Молярная масса углекислоты равна 44,01 г/моль. Расстояние от центра центрального атома углерода до каждого центра атома кислорода равно 116,3 пикометров (10 в -12 степени).
Структурная формула молекулыCO2 при низких температурах и нормальном давлении замерзает и кристаллизуется в белую массу, похожую на снег — «Сухой лед».
В жидкостное состояние газ преобразуется при высоком давлении (73.8 атм.) и средних температурах (+31.1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).
CO2 не ядовит, но при превышении концентрации в десятки раз, он оказывает удушающее воздействие на живые организмы и вызывает кисловатый вкус и запах (реакция CO 2 со слюной и слизистыми образует угольную кислоту).
Читайте также: Углекислый газ в помещении.
Двуокись углерода превышает по плотности кислород на 37 процентов и равна 1,96 кг/м3 при нормальных условиях среды (температура — 273 К, давление — 101 кПа). Этим физическим свойством объясняется потеря сознания у животных в «Собачьей пещере», расположенной рядом с городом Поццуоли, Италия. Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.
Плотность углекислоты, воздуха и кислорода.Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Понравилась статья? Поделиться с друзьями:
Углекислый газ (CO2, углекислота)
Углекислый газ (химическая формула CO2) постоянно присутствует в окружающем воздухе в различной концентрации. Его другие названия – диоксид углерода, двуокись углерода, углекислота, сarbon dioxide. В замороженном твёрдом состоянии – «сухой лёд». Этот газ не имеет цвета и запаха. Количество газа в воздухе измеряется в процентах или ppm (parts per million — частей на миллион). Концентрация углекислого газа в атмосферном воздухе у поверхности земли 350-400 ppm (0,04%) и зависит от места измерения. В городской или промышленной среде возможно местное повышение концентрации углекислоты (особенно, в безветренную погоду).
Его другие названия – диоксид углерода, двуокись углерода, углекислота, сarbon dioxide. В замороженном твёрдом состоянии – «сухой лёд». Этот газ не имеет цвета и запаха. Количество газа в воздухе измеряется в процентах или ppm (parts per million — частей на миллион). Концентрация углекислого газа в атмосферном воздухе у поверхности земли 350-400 ppm (0,04%) и зависит от места измерения. В городской или промышленной среде возможно местное повышение концентрации углекислоты (особенно, в безветренную погоду).
Углекислый газ. Модель молекулы и химическая формула
Хотя углекислый газ нетоксичен, он относится к вредным веществам IV класса опасности (по ГОСТ 12.1.007-76). Организм человека не воспринимает малые повышения концентрации СО2 во вдыхаемом воздухе и прекрасно временно адаптируется. При высокой концентрации, углекислый газ представляет смертельную опасность для человека – вызывает удушающее действие и относится к удушающим газам (см. Нормы содержания углекислого газа в помещениях).
Нормы содержания углекислого газа в помещениях).
| Внимание! Иногда, нетоксичный углекислый газ (CO2) путают с опасным и токсичным угарным газом (CO). Хотя формулы и названия похожи. |
CO2 тяжелее воздуха в 1,5 раза и легко концентрируется в воздухе закрытых помещений с людьми. В выдыхаемом человеком воздухе, его содержится около 4,5% (45 000 ppm). Без вентиляции, при отсутствии притока свежего воздуха, содержание CO2 быстро накапливается дыханием самого человека. Но человеческий организм приспособлен для краткосрочного повышения углекислоты в воздухе (у газа нет запаха) и не воспринимает повышения.
Углекислый газ. Модель молекулы и химическая формула.
Рост концентрации CO2 в спальне с 1 человеком, при минимальной вентиляции через клапаны проветривания на окне. Ситуация резко ухудшается, когда окна (и проветривающие клапаны) закрыты зимой или в комнате спят 2 человека.
Ситуация резко ухудшается, когда окна (и проветривающие клапаны) закрыты зимой или в комнате спят 2 человека.
Дополнительная информация: про выбор системы вентиляции для квартиры.
Предельно допустимая концентрация 5000 ppm (0,5%), не сможет сильно повлиять на организм здорового человека за короткое время, хотя заметно снижает трудоспособность и когнитивные функции мозга. Но при долговременном воздействии (сон, работа, офис или квартира) в помещении без вентиляции, постоянное превышение CO2 смертельно опасно для людей с заболеваниями сердца, гипертонической болезнью и др. Организм пытается компенсировать ситуацию повышением давления, учащением сердцебиения и дыхания. Долгое пребывание (проживание, сон) в такой атмосфере вызывает различные заболевания, стресс и постоянный синдром усталости. Особенно часто превышение нормы происходит в зимний период, когда недостаток проветривания происходит из-за экономии тепла в помещениях.
Вентиляция – единственный и обязательный способ устранения превышения концентрации
Избавится от фактора появления СО2 невозможно – он является продуктом выделения самого человека (при дыхании) и быстро накапливается в небольших помещениях (комнатах).
Как сделать угольную кислоту, свойства и применение
Угольная кислота Угольная кислота представляет собой химическое соединение с химической формулой H 2 CO 3 и молекулярной формулой CH 2 8 O 3
. Это неорганическая слабая кислота, которая существует только в виде раствора. Угольная кислота также известна как воздушная кислота, воздушная кислота или дигидрокарбонат. Он образует два вида солей: карбонаты и бикарбонаты.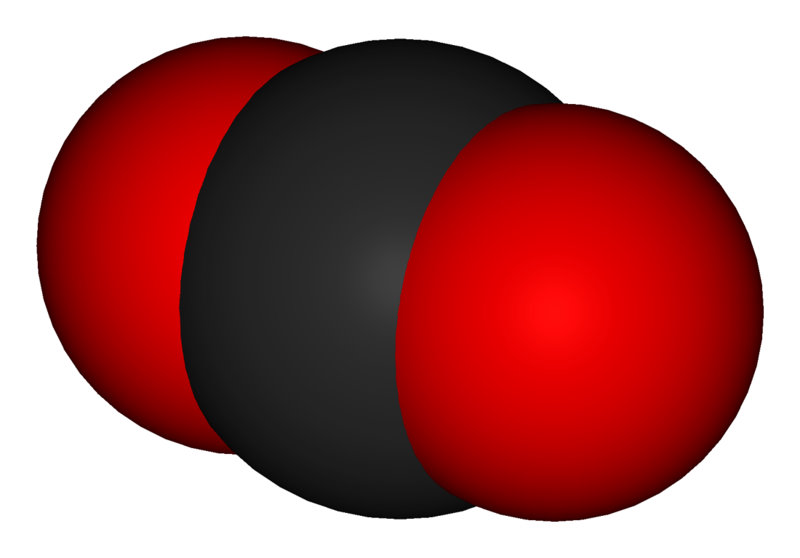 Ph угольной кислоты составляет 4,68 в 1 мМ.
Ph угольной кислоты составляет 4,68 в 1 мМ.
Угольная кислота является специфически двухпротонной кислотой, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы. Таким образом, есть две константы диссоциации, первая для диссоциации иона бикарбоната и вторая для диссоциации иона бикарбоната в ион карбоната.
Возникновение:Углекислота присутствует в крови в организме человека. Он образуется в организме человека при растворении воды с углекислым газом. Он также присутствует в дождевой воде, кальците, ферментации, угле, грунтовых водах, метеорах, вулканах, аминокислотах, белках, океанах, растениях, эритроцитах, отложениях серы, солях и пещерах.
Свойства угольной кислоты:
Физические свойства:
Внешний вид: серовато-белое твердое вещество.
Температура плавления: 210 градусов по Цельсию, температура кипения: -78 градусов по Цельсию.

Молекулярная масса: 62,024 г/моль.
Растворимость: нерастворим.
Угольная кислота имеет значение pH менее 7.
Угольная кислота не имеет запаха и имеет щелочной вкус.
Химическая Свойства :
Углекислота — слабая и нестабильная двухосновная кислота.
Кислотность 6,3 пК.
Приготовление углекислоты:
Реагенты
Карбонат кальция
Раствор соляной кислоты
Лакмус
Вода
Носите лабораторные очки и старайтесь избегать контакта кожи с соляной кислотой. Соблюдайте общие рекомендации по безопасности.
Количество шагов:
- Налейте в стакан немного воды.

- Добавьте в химический стакан 5-6 капель лакмуса.
- Положите кусочек карбоната кальция в пробирку или в стакан.
- Налейте в пробирку/стакан небольшое количество соляной кислоты и закройте ее отверстие пробкой с выпускной трубкой.
- Опустите конец выпускной трубки в раствор лакмуса. Образовавшийся газ начнет пузыриться через раствор, и цвет раствора изменится.
- Проверить рН воды. Воды больше нет, образовалась углекислота. рН будет читать его как слабую кислоту.
Химическая реакция в виде уравнения:
CaCO 3 + HCl → CaCl 2 + CO 2 ↑+ H 2 O
CO 2 + H 2 O → H 2 CO 3
Углекислота Применение: 4Угольная кислота чаще всего используется в виде солей.
 Он также играет жизненно важную роль в протонировании многих азотистых оснований в сыворотке крови. Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ ферментом, называемым карбоангидразой.
Он также играет жизненно важную роль в протонировании многих азотистых оснований в сыворотке крови. Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ ферментом, называемым карбоангидразой.В напитках: Угольная кислота широко используется для приготовления шипучих, шипучих напитков.
Для лечения дерматитов: обычно используется для лечения дерматитов, таких как стригущий лишай.
Также используется для полоскания рта или вагинального душа.
При отравлении или передозировке препарата углекислота дается перорально для вызывания рвоты.
Для очистки контактных линз очень эффективна углекислота, она также используется в качестве газа для сварки, пищевой промышленности и косметики.
Для гидролиза крахмала также используется угольная кислота.
Углекислота – Энциклопедия Нового Света
Материал из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Карбонатит)
Следующий (Углеугольный)
| Другие названия | Раствор диоксида углерода |
| Идентификаторы | |
|---|---|
| CAS-номер | [463-79-6] |
| УЛЫБКИ | С(=О)(О)О |
| Недвижимость | |
| Молекулярная формула | H 2 CO 3 |
| Молярная масса | 62,03 г/моль |
| Плотность | 1,0 г/см 3 (разбавленный раствор) |
| Растворимость в воде | существует только в растворе |
| Кислотность (p K a ) | 6,36 (см. текст) текст) 10,25 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | |
Угольная кислота (древнее название кислота воздуха или воздушная кислота ) является слабой кислотой с формулой H 2 CO 3 . Он образуется в небольших количествах при растворении углекислого газа в воде и обычно находится только в растворе. Соли угольных кислот называются бикарбонатами (или гидрокарбонатами, когда анион HCO 3 − ) и карбонаты (когда анионом является CO 3 2− ).
Содержимое
- 1 Раствор в воде
- 2 Кислотность угольной кислоты
- 3 Роль угольной кислоты в крови
- 4 Получение чистой угольной кислоты
- 5 pH и состав раствора угольной кислоты
- 6 См. также
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Присутствие угольной кислоты в крови и других жидкостях организма помогает контролировать уровень pH (кислотность) этих жидкостей.
Раствор в воде
Диоксид углерода, растворенный в воде, находится в равновесии с угольной кислотой:
- CO 2 + H 2 O ⇌ H 2 CO 3
Констагистрация равновесия при 25 ° C IS K H = 1,7067707707.707.707.707.707.707.707.707.707.707.707.707.707.707
7
. что указывает на то, что большая часть углекислого газа не превращается в угольную кислоту и остается в виде CO 2 молекул. В отсутствие катализатора равновесие достигается довольно медленно.
Константы скорости составляют 0,039 с -1 для прямой реакции (CO 2 + H 2 O → H 2 CO 3 ) и 23 с -1 для обратной реакции (0 -1 2 CO 3 → CO 2 + H 2 O).
Кислотность угольной кислоты
Угольная кислота имеет два кислых атома водорода и, следовательно, две константы диссоциации:
- H 2 CO 3 ⇌ HCO 3 – + H +
- K A1 = 2.
 5.920920 .920.920.920.920.920.920.920.920.
5.920920 .920.920.920.920.920.920.920.920.- . p K a1 = 3,60 при 25 °C.
- K A1 = 2.
- H 2 CO 3 ⇌ HCO 3 – + H +
- HCO 3 − ⇌ CO 3 2− + H +
- K a2 = 5.61×10 −11 mol/L ; стр К а2 = 10,25 при 25 °С.
- HCO 3 − ⇌ CO 3 2− + H +
Следует соблюдать осторожность при указании и использовании первой константы диссоциации угольной кислоты. Приведенное выше значение верно для молекулы H 2 CO 3 и показывает, что это более сильная кислота, чем уксусная кислота или муравьиная кислота: этого можно было ожидать из-за влияния электроотрицательного кислородного заместителя. Однако,
угольная кислота существует только в растворе в равновесии с двуокисью углерода, поэтому концентрация H 2 CO 3 значительно ниже концентрации
CO 2 , снижающий измеренную кислотность. Уравнение можно переписать следующим образом ( ср. сернистая кислота ):
Уравнение можно переписать следующим образом ( ср. сернистая кислота ):
- CO 2 + H 2 O ⇌ HCO 3 − + H +
- K a = 4.30×10 −7 mol/L; р К а = 6,36.
- CO 2 + H 2 O ⇌ HCO 3 − + H +
Эта цифра цитируется как константа диссоциации угольной кислоты, хотя это двусмысленно: ее лучше было бы назвать константой кислотности диоксида углерода, поскольку она особенно полезна для расчета pH CO 2 растворы.
Роль угольной кислоты в крови
Углекислота играет очень важную роль в крови млекопитающих. Является промежуточным звеном при переносе углекислого газа из легких в кровь и обратно. Превращение диоксида углерода в угольную кислоту катализируется ферментом (карбоангидраза), который увеличивает скорость реакции почти в миллиард раз. Углекислота диссоциирует в крови (как и в других растворах) с образованием в основном H + и HCO 3 – (бикарбонат) ионы. Эта диссоциация является равновесной реакцией и помогает контролировать уровень рН крови.
Эта диссоциация является равновесной реакцией и помогает контролировать уровень рН крови.
Получение чистой угольной кислоты
Долгое время исследователи считали невозможным получение чистого бикарбоната водорода (H 2 CO 3 ) при комнатной температуре (около 20 °C или около 70 °F). Однако в 1991 году ученым из Центра космических полетов имени Годдарда НАСА (США) удалось получить первый чистый H 2 CO 3 проб. Они сделали это, подвергнув замороженную смесь воды и углекислого газа высокоэнергетическому излучению, а затем нагрев, чтобы удалить избыток воды. Оставшуюся угольную кислоту охарактеризовали с помощью инфракрасной спектроскопии.
Способность производить угольную кислоту путем облучения твердой смеси H 2 O и CO 2 привела к предположению, что H 2 CO 3 можно найти в космическом пространстве, где замерзшие льды H 2 О и СО 2 распространены, как и космические лучи и ультрафиолетовый свет, чтобы помочь им реагировать.
Такой же полиморф угольной кислоты (обозначается бета-угольной кислотой) был получен криотехнологией в Университете Инсбрука: чередующиеся слои стеклообразных водных растворов бикарбоната и кислоты нагревали в вакууме, что вызывает протонирование бикарбоната, и растворитель впоследствии удалены. Второй полиморф (обозначенный альфа-угольной кислотой) был получен по той же методике в Университете Инсбрука с использованием в качестве растворителя метанола, а не воды.
Исследователи из Инсбрука сообщили, что чистая, не содержащая воды угольная кислота очень стабильна в газовой фазе с рассчитанным периодом полураспада 180 000 лет. Тем не менее, согласно их расчетам, присутствие одной молекулы воды заставляет молекулу угольной кислоты быстро разлагаться на углекислый газ и воду.
pH и состав раствора угольной кислоты
При данной температуре состав чистого раствора угольной кислоты (или чистого CO 2 9раствор 0008) полностью определяется парциальным давлением двуокиси углерода над раствором pCO2{\displaystyle \scriptstyle p_{CO_{2}}}. Для расчета этого состава необходимо принять во внимание указанные выше равновесия между тремя различными карбонатными формами (H 2 CO 3 , HCO 3 − и CO 3 2− ), а также равновесие между растворенным CO 2 и H 2 CO 3 с константой Kh = [h3CO3] [CO2] {\ displaystyle \ scriptstyle K_ {h} = {\ frac {[H_ {2} CO_ {3} ]}{[CO_{2}]}}} (см. выше) и следующего равновесия между растворенным CO 9{2-}]} дают шесть уравнений для шести неизвестных [CO 2 ], [H 2 CO 3 ], [H + ], [OH − ], [HCO 3 – ] и [CO 3 2− ], показывая, что состав раствора полностью определяется pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}}. Уравнение, полученное для [H + ], представляет собой кубическую форму, численное решение которой дает следующие значения pH и различных концентраций частиц:
Для расчета этого состава необходимо принять во внимание указанные выше равновесия между тремя различными карбонатными формами (H 2 CO 3 , HCO 3 − и CO 3 2− ), а также равновесие между растворенным CO 2 и H 2 CO 3 с константой Kh = [h3CO3] [CO2] {\ displaystyle \ scriptstyle K_ {h} = {\ frac {[H_ {2} CO_ {3} ]}{[CO_{2}]}}} (см. выше) и следующего равновесия между растворенным CO 9{2-}]} дают шесть уравнений для шести неизвестных [CO 2 ], [H 2 CO 3 ], [H + ], [OH − ], [HCO 3 – ] и [CO 3 2− ], показывая, что состав раствора полностью определяется pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}}. Уравнение, полученное для [H + ], представляет собой кубическую форму, численное решение которой дает следующие значения pH и различных концентраций частиц:
PCO2 {\ displaystyle \ scriptstyle P_ {CO_ {2}}} (атм.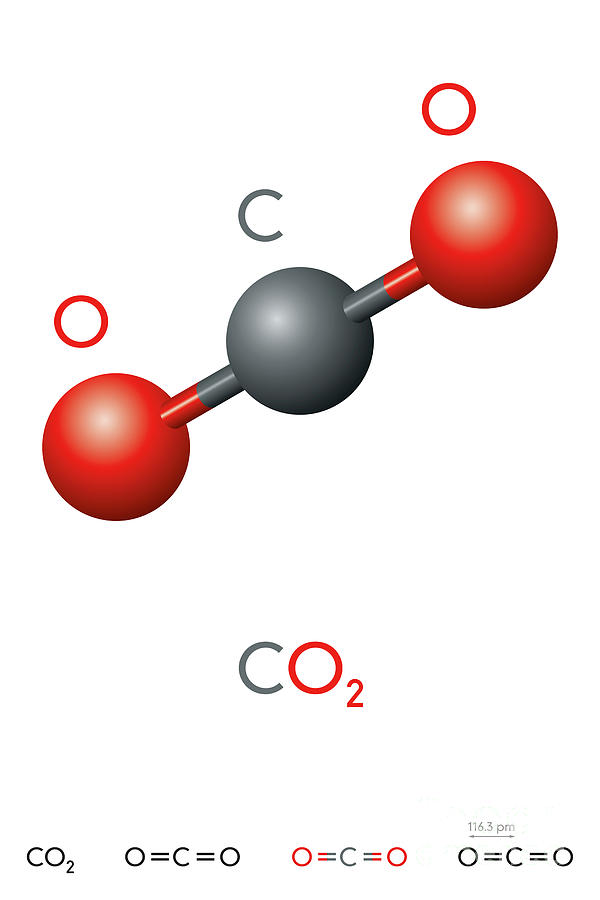 ) ) | рН | [CO 2 ] (моль/л) | [H 2 CO 3 ] (моль/л) | [HCO 3 − ] (моль/л) | [CO 3 2− ] (моль/л) |
| 10 −8 | 7,00 | 3,36 × 10 -10 | 5,71 × 10 −13 | 1,42 × 10 −9 | 7,90 × 10 −13 |
| 10 −6 | 6,81 | 3,36 × 10 −8 | 5,71 × 10 −11 | 9,16 × 10 −8 | 3,30 × 10 −11 |
| 10 −4 | 5,92 | 3,36 × 10 −6 | 5,71 × 10 −9 | 1,19 × 10 −6 | 5,57 × 10 −11 |
| 3,5 × 10 −4 | 5,65 | 1,18 × 10 −5 | 2,00 × 10 −8 | 2,23 × 10 −6 | 5,60 × 10 −11 |
| 10 −3 | 5,42 | 3,36 × 10 −5 | 5,71 × 10 −8 | 3,78 × 10 −6 | 5,61 × 10 −11 |
| 10 −2 | 4,92 | 3,36 × 10 −4 | 5,71 × 10 −7 | 1,19 × 10 −5 | 5,61 × 10 −11 |
| 10 −1 | 4,42 | 3,36 × 10 −3 | 5,71 × 10 −6 | 3,78 × 10 −5 | 5,61 × 10 −11 |
| 1 | 3,92 | 3,36 × 10 −2 | 5,71 × 10 −5 | 1,20 × 10 −4 | 5,61 × 10 −11 |
| 2,5 | 3,72 | 8,40 × 10 −2 | 1,43 × 10 −4 | 1,89 × 10 −4 | 5,61 × 10 −11 |
| 10 | 3,42 | 0,336 | 5,71 × 10 −4 | 3,78 × 10 −4 | 5. 61 × 10 −11 61 × 10 −11 |
- Мы видим, что во всем диапазоне давлений pH всегда значительно ниже pKa 2 , так что концентрация CO 3 1−7 g − по концентрации HCO 3 − . Фактически CO 3 9{-4}} атм), мы получаем слабокислый раствор (р Н = 5,7) и растворенный углерод теперь находится в основном в форме СО 2 . Начиная с этого давления, [OH – ] также становится незначительным, так что ионизированная часть раствора теперь представляет собой эквимолярную смесь H + и HCO 3 – .
- При давлении CO 2 , типичном для бутылок с газировкой (PCO2{\displaystyle \scriptstyle P_{CO_{2}}} ~ 2,5 атм), мы получаем относительно кислую среду (стр. H = 3,7) с высокой концентрацией растворенного СО 2 . Эти особенности обуславливают кисловатый и игристый вкус этих напитков.
- В диапазоне от 2,5 до 10 атм pH пересекает значение pKa 1 (3,60), что дает преобладающую концентрацию H 2 CO 3 (по отношению к HCO 3 − − − − − − −
Как отмечалось выше, [CO 3 2− ] можно пренебречь для этой конкретной задачи, что приводит к следующему очень точному аналитическому выражению для [H 9{1/2}}
См.
 также
также- Кислота
- Углерод
- Углекислый газ
- pH
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Hage, W., K.R. Liedl, A. Hallbrucker и E. Mayer. 1998. «Углекислота в газовой фазе и ее астрофизическое значение». Наука , 279:1332-1335.
- Hage, W., A. Hallbrucker, and E. Mayer. 1993. «Угольная кислота: синтез путем протонирования бикарбоната и спектроскопическая характеристика FTIR с помощью нового криогенного метода». Дж. Ам. хим. соц. 115:8427-8431.
- Hage, W., A. Hallbrucker, and E. Mayer. 1995. Полиморф угольной кислоты и его возможное астрофизическое значение. J. Chem. соц. Фарада. Транс. 91:2823-2826.
- Jolly, WL 1991. Современная неорганическая химия , 2-е изд. Нью-Йорк: MgGraw-Hill. ISBN 0-07-112651-1
- Лёртинг, Т., К. Таутерманн, Р.Т. Кремер, И. Коль, Э. Майер, А. Халльбрукер и К. Р. Лидл. 2001. «Об удивительной кинетической стабильности угольной кислоты».
 Анжю. хим. Междунар. Эд. 39:891-895.
Анжю. хим. Междунар. Эд. 39:891-895. - Мур, М. Х. и Р. Ханна. 1991. «Инфракрасные и масс-спектральные исследования льда, облученного протонами h3O+CO2: доказательства существования угольной кислоты». Spectrochimica Acta , 47A:255-262.
- Welch, M.J., J.F. Lipton, and J.A. Seck. 1969. . J. Phys. хим. 73:3351.
Внешние ссылки
Все ссылки получены 10 января 2017 г.
- Почему так долго несправедливо сомневались в существовании угольной кислоты?
Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.



 5.920920 .920.920.920.920.920.920.920.920.
5.920920 .920.920.920.920.920.920.920.920. Анжю. хим. Междунар. Эд. 39:891-895.
Анжю. хим. Междунар. Эд. 39:891-895.