Углекислый газ жидкий – Углекислота жидкая , СО2, двуокись углерода, диоксид углерода
alexxlab | 31.12.2019 | 0 | Разное
Применение жидкой углекислоты – Справочник химика 21
Сжижение газов получило широкое применение в промышленпости. Аммиак, хлор (и некоторые другие газы) большей частью сохраняются и транспортируются в сжиженном состоянии в стальных баллонах или цистернах. Для многих целей в таком же виде применяется и углекислота. Сжижение воздуха используется для разделения его на составные части, главным образом для выделения азота. Жидкий воздух применяется и в лабораторной практике для получения низких температур до —180° С. Жидкий водород дает возможность понижать температуру до 15—20° К, жидкий гелий — до 4,2° К и при кипении в вакууме — до 0,8° К . [c.111]Трехступенчатые углекислотные компрессоры с дифференциальными поршнями находят применение на заводах жидкой углекислоты и сухого льда (см. стр. 308). [c.76]
ПРОИЗВОДСТВО и ПРИМЕНЕНИЕ ЖИДКОЙ УГЛЕКИСЛОТЫ [c.1]
ПРИМЕНЕНИЕ ЖИДКОЙ УГЛЕКИСЛОТЫ
Для сжижения природного метанового газа обычно применяют метод последовательного дросселирования с применением охлаждения газа жидкими хладоагентами (аммиак, этилен), получаемыми в специальных холодильных установках. Дросселирование заключается в том, что газ, находящийся под большим давлением, выпускается через узкое отверстие в трубопровод, где давление невелико. Резкое снижение давления и происходящее при этом расширение вызывают и резкое понижение температуры газа. Природный газ предварительно очищается о углекислоты, сероводорода и паров воды. [c.211]
По сообщению Р. Дюбуа [129] продолжительность охлаждения изделий удалось сократить вдвое за счет применения жидкой углекислоты. Полое изделие формуют обычным способом сжатым воздухом, а затем по специальному каналу, расположенному параллельно с каналом для подвода воздуха, подают хладоагент. В коммуникации при этом [c.174]
В недавних патентах описано 17 трехкомпонентных систем с тремя жидкими фазами [12, 13]. В эти системы входит жидкая углекислота. Применение некоторых из этих систем обсуждается шике. [c.176]
Практическое применение получил способ, основанный на внутреннем отводе теплоты при дросселировании жидкой углекислоты с последующим прессованием снега в специальных сухоледных прессах или отводом образующихся паров через поры блока сухого льда в льдогенераторах. [c.288]
Ректификацию газа на медной колонке производят согласно вышеприведенному описанию (стр. 169). В качестве охлаждающих агентов применяют жидкий азот или твердую углекислоту. Применение жидкого азота позволяет проводить технический анализ газов различного состава, с разделением газа на фракции 1) метан — водородную, 2) этан — этиленовую, 3) пропан — пропиле- [c.187]
Производство сухого льда при среднем давлении (фиг. 212) заключается в применении каскадного цикла. После двухступенчатого сжатия с промежуточным охлаждением и осушением паров они поступают в конденсатор из двойных труб, в которых тепловая нагрузка отводится за счет кипения аммиака аммиачной установки. Из ресивера конденсатора жидкая углекислота поступает в промежуточный сосуд с предварительным дросселированием и понижением давления до 8—9 ата. Ледогенераторы наполняются жидкой углекислотой из промежуточного сосуда. Образующиеся при дросселировании пары отсасываются компрессором второй ступени, а пары, образующиеся в ледогенераторах, — компрессором первой ступени.
При выборе конструкции известково-обжигательной печи исходят из требований, предъявляемых к извести. Для получения обожженной и достаточно чистой извести применяют шахтные известково-обжигательные печи с полугенераторными или генераторными топками. В таких печах можно получать чистую известь, используя в качестве топлива низкосортные длиннопламенные угли. В тех случаях, когда наряду с известью для производства требуется и углекислый газ, который содержится в отходящих из печи газах, применяют пересыпные печи, которые работают на короткопламенном топливе (кокс и антрацит). Известь из этих печей получается загрязненной, так как к ней примешивается шлак от сгоревшего топлива. В пересыпных печах может быть получен топочный газ с содержанием до 35—40% углекислого газа, находящий широкое применение в производствах соды, мочевины, жидкой углекислоты, сухого льда и в других отраслях химической промышленности. Получать топочные газы с высоким содержанием углекислого газа в известково-обжигательных печах с генераторными и полугенераторными топками не представляется возможным. [c.44]
Наряду с ацетоном в качестве поглотителя для ацетилена может быть применен жидкий метанол [137 ] при температуре —70° С при этом растворитель поглощает не только ацетилен, но и углекислоту. Нагреванием растворителя до 20° С выделяют оба компонента. Полученную смесь газов промывают водным раствором аммиака для связывания углекислоты и таким образом получают чистый ацетилен. Высшие соединения ацетилена отделяют от метанола дистилляцией.
Структура потребления жидкой углекислоты за последние годы существенно изменилась, что связано со значительным ростом применения ее в отраслях тяжелой индустрии, которые расходуют в настоящее время около 35% всей вырабатываемой углекислоты. [c.175]
Применение для создания давления различных сжиженных газов можно рассмотреть в зависимости от природы топлива и растворимости в нем газа помимо данных, приведенных выше в связи с ракетой У-2, пока в этой области еще ничего не сделано. Жидкая углекислота применялась в огнеметах, причем было показано, что при использовании СО, для подачи жидкостей под давлением 35 кг/сж на каждый куб. метр топлива потребуется около 120 кг газа СО,. Вес баллона на каждые 7 кг СО составит 6 кг. Допуская даже [c.47]
Особо чистой должна быть углекислота, используемая как теплоноситель (главным образом, в Англии и Франции) в ядерных реакторах. Для этого очень тщательно удаляют водяные пары, так как вода является источником водорода, который, диффундируя сквозь защитную оболочку тепловыделяющего элемента, образует гидриды урана и циркония. Такую углекислоту получают фракционированной возгонкой в вакууме или низкотемпературной дистилляцией чистой жидкой углекислоты с применением вымораживания. Малые количества СО2 удобно получать термическим разложением чистого карбоната магния при 540° в трубчатой электропечи. Достоинство этого метода в том, что в продукте не содержится паров влаги в отличие от углекислоты, получаемой термическим или кислотным разложением бикарбоната натрия. В углекислоте высшей чистоты, пол
www.chem21.info
Жидкая углекислота – Энциклопедия по машиностроению XXL
Компрессор углекислотной холодильной установки всасывает сухой пар и сжимает его по адиабате. Температура испарения углекислоты tl = —10° С, а температура конденсации /3 = 20° С. После конденсации жидкая углекислота расширяется в редукционном вентиле.Углекислый газ хранят и транспортируют в жидком виде преимущественно в стальных баллонах емкостью 40 л под давлением 6,0—7,0 МПа. В баллоне находится 60—80% жидкой углекислоты, а остальное — испарившийся газ. Цвет баллона — черный, надпись — желтого цвета. [c.54]
Вода принадлежит к наименее вязким жидкостям. Лишь немногие из практически используемых жидкостей (например, эфир и спирт) обладают несколько меньшей вязкостью, чем вода. Наименьшую вязкость имеет жидкая углекислота (в 50 раз меньше вязкости воды). Все жидкие масла обладают значительно более высокой [c.16]
Углекислотные огнетушители изготовляются нескольких типов, из которых наиболее распространен тип РУО (ручной углекислотный огнетушитель). Основной частью углекислот-него огнетушителя этого типа (фиг. 16) является стальной баллон 1, заранее наполняемый при помощи специального насоса жидкой углекислотой баллон закрывается вентилем 2, имеющим сифонную трубку 3. Для приведения огнетушителя в действие открывают вентиль 2 баллона жидкая углекислота устремляется по сифонной трубке 3 и через специальный короткий шланг 4 и диффузор 5 выбрасывается на горящую поверхность. [c.803]
Опытные данные по q p для некоторых веществ (жидкие углекислота, кислород, азот, жидкие металлы) существенно отличаются от значений, вычисленных по формуле (28). В этих случаях следует пользоваться непосредственно опытными данными. [c.223]
Поток жидкой углекислоты после конденсации разделяется на две части. Первая часть поступает в углекислотный регенератор, а вторая — в конденсатор водяного пара, систему пароводяных подогревателей и при необходимости в несколько ртутных подогревателей. Затем оба потока смешиваются и после подогрева в ртутных подогревателях поступают в углекислотную турбину. Так как подвод тепла в углекислотной части установки, на долю которой приходится 65—70% общей мощности, осуществляется отборами пара из ртутной турбины, то объемы этого пара из отборов значительны. При начальной температуре 565° С и противодавлении 1 10 Па ртутную турбину мощностью 285 МВт удается выполнить двухпоточной, по четыре ступени в потоке,
Из таблицы видно, что теплопроводность жидкой углекислоты в измеренном интервале температур сильно зависит от температуры, уменьшаясь по абсолютной величине с ростом температуры. Теплопроводность пара также сильно меняется в зависимости от температуры, увеличиваясь по абсолютному значению при приближении к критической области, т. е. приближаясь к значению теплопроводности в жидком состоянии. Особенно круто меняется теплопроводность вблизи критической области. Отсутствие аномальных явлений показывает, что в отличие от статических параметров, каким является теплоемкость, сильные флуктуации плотности, возникающие в критической области, не влияют на теплопроводность. [c.108]
Углекислый газ получают из отходящих газов при производстве аммиака, спиртов, переработки нефти, а также путем специального сжигания топлива. При повышении давления углекислый газ переходит в жидкое (углекислота) состояние. При испарении I кг жидкого диоксида углерода образуется 509 л углекислого газа. [c.157]
При обработке жаропрочных сталей в ряде отраслей промышленности применяют для охлаждения жидкую углекислоту. [c.274]
Углекислый газ поставляется в сжиженном состоянии в баллоне типа А вместимостью 40 л, в котором при максимальном давлении 7,5 МПа (75 кгс/см ) вмещается 25 кг углекислоты. При испарении такого количества жидкой углекислоты образуется более 12,5 тыс. л углекислого газа. Нормальный расход углекислого газа при полуавтоматической сварке тонколистовых кузовных деталей легкового автомобиля составляет 6—9 л/мип.
Б настоящее время начинает находить применение способ подачи охлаждающей жидкости в распыленном виде, чем обеспечивается более эффективное охлаждение. [93]. В ряде случаев применяется также охлаждение жидкой углекислотой. [c.705]
Углекислый газ (углекислота) СО2 — бесцветный нейтральный газ без запаха, легко переходит в жидкое состояние (при температуре 0° С и давлении 35 кгс/см ), поэтому в баллонах хранится в жидком состоянии. Из одного литра жидкой углекислоты образуется 509 л углекислого газа. При низких температурах давление в баллонах настолько снижается, что газ из баллона выходит вяло, а при температуре —78° С и обычном давлении углекислота затвердевает. Для обеспечения работоспособности углекислоты при низких температурах баллоны размещают в обогреваемых участках, а различные узкие участки трубопроводов (жиклеры, редукторы и т. п.) должны иметь электроподогрев. [c.118]
Жидкая углекислота. Длительное время в авиационных системах тушения пожара в качестве огнегасящего вещества применялась жидкая углекислота, из 1 кг которой при нормальных атмосферных условиях образуется 506 л углекислого газа. Последний переходит в жидкость при температуре 0° С под давлением 35,5 кгс/см . [c.138]
Углекислый газ под давлением превращается в жидкость. При охлаждении без давления углекислый газ переходит непосредственно в твердое состояние (сухой лед). Твердая углекислота при повышении температуры непосредственно переходит в газ, минуя жидкое состояние. Исходным продуктом для получения сухого льда и углекислого газа является жидкая углекислота. [c.106]
Жидкая углекислота представляет собой бесцветную жидкость. В результате испарения при 0° С и нормальном давлении (760 мм рт. ст.) из 1 кг жидкой углекислоты образуется 509 л газа. Жидкая углекислота транспортируется в стальных баллонах, в которых она занимает 60—80% всего объема баллона. В стандартный баллон емкостью 40 л заливают 25 кг углекислоты, образующей при испарении около 12 газа. Давление газа в баллоне зависит от температуры, понижающейся при расходе газа. [c.106]
Для сварки применяют углекислоту по ГОСТ 8050—64, поставляемую в баллонах в жидком состоянии. При испарении 1 кг жидкой углекислоты при 0° С и 760 мм рт. ст. образуется 506,8 л газа. В стандартный баллон емкостью 40 л заливают 25 кг жидкой углекислоты, что составляет 12,67 м газа. Вредными примесями в углекислом га е являются азот и влага. [c.247]
Углекислый газ применяется при сварке сталей. В баллоне емкостью 40 л помещается 25 кг жидкой углекислоты, дающей при испарении 12,7 м газа при 0° и атмосферном давлении. [c.438]
Углекислый газ. можно обратить в жидкость только с помощью давления. Исходным продуктом для получения углекислого газа является жидкая углекислота. Жидкая углекислота представляет собой бесцветную жидкость, которая при температуре ниже 1ГС становится тяжелее воды, а выше этой температуры — легче. Удельный вес жидкой углекислоты сильно меняется с изменением температуры, вследствие чего она продается не по объему, а по весу. При нормальных условиях (0° С и 760 мм рт. ст.) при испарении 1 кг жидкой углекислоты образуется 509 л газа. [c.455]
Для приведения в действие углекислотного огнетушителя ОУ-2 (рнс. 88) нужно взять огнетушитель левой рукой за рукоятку 5, направить раструб 9 на горящий предмет и, поворачивая маховичок 3 против часовой стрелки, открыть вентиль до отказа. При выходе из баллона жидкая углекислота мгновенно превращается в газ, горение в котором невозможно. [c.190]
Защитные газы хранят и транспортируют в баллонах вместимостью 40…50 л под давлением 150 атм, а жидкую углекислоту — под давлением до 60 атм. Для предохранения от коррозии и быстрого опознавания баллоны окрашивают в разные цвета и выполняют соответствующие надписи (табл. 4.20). В использованных баллонах необходимо оставлять сжатый газ под давлением не менее 0,2…0,3 МПа (2…3 атм). [c.107]
Применяемые для сварки газы хранят, транспортируют и используют в стальных баллонах, в которых они находятся под давлением 15 МПа. Баллоны— это стальные цилиндрические сосуды с днищем и горловиной, в которой сделано конусное отверстие с резьбой, куда ввертывается вентиль. Вентиль закрывают металлическим колпаком на резьбе, предохраняющим вентиль от повреждения при транспортировке. Наиболее распространены баллоны объемом 0,04 м . При давлении газа 15 МПа баллон вмещает примерно 6 м газа. Исключением являются сжиженные или растворенные газы углекислый газ, ацетилен, пропан-бутан. Углекислый газ заполняют и транспортируют в баллонах в жидком состоянии под давлением 5—6 МПа летом в баллон объемом 0,04 м заливают 0,025 м жидкой углекислоты, а зимой 0,03 м . При испарении в процессе работы из этого количества жидкого СОг получается соответственно 12,6 и 15,12 м газа. При газификации углекислоты, поставляемой в баллонах, между баллоном и редуктором устанавливают подогреватель, предохраняющий от образования пробок из твердого СОг. Согласно требованиям ГОСТа, баллоны для газа в целях быстрого опознания их содержимого и для предотвращения коррозии окрашиваются в разные цвета и имеют надписи. Кислородный баллон окрашивают в голубой цвет, ацетиленовый — в белый, баллоны для углекислого газа, азота и воздуха — в черный цвет с соответствующей надписью желтой краской, для аргона — в серый цвет с зеленой надписью, для гелия — в коричневый цвет с белой надписью, для водорода — в темно-зеленый цвет с красной надписью. [c.151]
Вода принадлежит к наименее вязким жидкостям. Лишь немногие из практически используемых жидкостей (например, эфир и спирт) обладают несколько меньшей вязкостью, чем вода. Наименьшую вязкость имеет жидкая углекислота (в 50 раз меньше вязкости воды). Все жидкие масла обладают значительно более высокой вязкостью, чем вода (касторовое масло при температуре 20° jpeeT вязкость в 1000 раз большую, чем вода при той же темпера ре). В табл. В 7 приведены значения вязкости некоторых жидкостей. [c.17]
Основным элементом опытной установки является вертикальный бронзовый цилиндр с толстыми стенками для выравнивания температурного поля. По оси цилиндра, имеющего диаметр 18 мм. ятягивается с помощью пружинки платиновая нить диаметром 30 жк и длиной 70 мм. Нить подвергается предварительному отжигу и служит одновременно нагревателем и термометром сопротивления. Последовательно с нитью включаются эталонное сопротивление (/ з = 10 ом), штепсельный магазин сопротивления и миллиамперметр. Питание платиновой нити осуществляется постоянным током от аккумуляторной батареи. Сила тока измеряется потенциометром ППТВ-1. Падение напряжения на рабочем участке нити и на эталонном сопротивлении также измеряется потенциометром. В бронзовый цилиндр в радиальном направлении впаиваются две медные трубочки. Одна из них ведет к манометру и продувочному вентилю, а другая к резервуару с углекислотой. Жидкая углекислота из баллона пропускается через селикагелевый фильтр и запирается в системе, состоящей из внутреннего рабочего о бъема цилиндра и небольшого баллончика емкостью 0,5 л. Баллончик помещается в масляный термостат, который служит для создания необходимого давления опыта. Для этого изменяется только температура термостата. Давление измеряется образцовым манометром. [c.209]
У екислый газ хранят и перевозят в сжиженном со–стоян , в стандартных баллонах (группы В по ГОСТ 949-57), чаще всего имеющих емкость 40 л, под давлением до 75 кГ/см . В таком баллоне находится 25 кг жидкой углекислоты, из которой при испарении образуется около 12,5 углекислого газа. В качестве защитной среды используется свароч ная углекислота первого и второго сортов, 1ВЫ1пускаемая ло ГОСТ 8050-64. Содержание чистого газа в углекислоте первого сорта составляет 99,5%, второго —99%. Содержание влаги не более 0,178 и 0,515 г/м соответственно. [c.73]
Сведения огазовых баллонах приведены в гл. 2. При выпуске жидкой углекислоты из баллона она испаряется, температура газа резко уменьшается. Чтобы предупредить замерзание влаги в каналах редуктора и закупорку их льдом, между вентилем баллона и редуктором устанавливают электрический подогреватель (рис. 87). Он состоит из корпуса 1, кожуха 2, трубчатого змеевика 3, теплоизоляции 4 и нагревательного элемента 3. На клеммы б подают постоянное (20 В) или переменное (36 В) напряжение. Газ, проходя по трубчатому змеевику 3, нагревается до температуры 10…15 °С. [c.161]
К способам обработки, основанным на изменении характера механического воздействия на срезаемый слой, относятся вибрационное резание, сверхскоростное резание и ультразвуковая обработка к способам,, основанным на термохимическом воздействии, относятся обработка с предварительным нагревом заготовок, с непрерывным предварительным нагревом срезаемого слоя в процессе резания ТВЧ к способам, основанным на одновременном механическом и химическом воздействии, относятся обработка в специальных средах смазочно-охлаждающих жидкостей с различным подводом их в зону резания, например в виде воздушной эмульсии (распылением), под давлением пенистой жидкости, жидкой углекислоты, в газовых средах (сероводород, хлор, кислород и др.), в твердых средах (смазки из графита, талька и дисульфид. молибдена) и др., а также обработка в растворах солей металлов (например, шлифование с погружением притира в раствор медного купороса) к способам обработки, основанным Ъа электрическом воздействии, относятся электроэрозионная, анодномеханическая, электрохимическая, электроконтактная и комбинированная обработка, например химико-механическая обработка с наложением обычного и вибрационного резания и др. [c.365]
Углекислый газ (СОа) является наиболее распространенным защитным газом, применяющимся при сварке плавящимся электродом. Его основные свойства газ бесцветен и не ядовит плотность при атмосферном давлении и температуре 20 °С составляет кг/м” температура сжижетгия при атмосферш>м давлснитг 78,5 °С выход газа из 1 кг жидкой углекислоты (при О °С и [c.229]
Среди полуавтоматических и автоматических способов сварки значительное место заслуженно завоевала сварка в углекислом газе, полностью исключающая проникновение ионизированного азота воздуха в сварной шов и, следовательно, его охрупчивание. Этот способ характеризуется высокой производительностью и низкой стоимостью и находит все большее применение для сварки малоуглеродистых, низколегированных и некоторых высоколегированных сталей. Углекислый газ поставляют в сжиженном состоянии в стальных баллонах вместимостью 40 л, в которых под давлением 7,5 МПа содержится 25 л жидкой углекислоты, что соответствует 12,7 м газообразной углекислоты. Углекислый газ СОг при высокой температуре дуги разлагается на оксид углерода СО и атомарный кислород О. Для нейтрализации его окислительного воздействия используют проволоку с повышенным содержанием марганца и кремния, которые имеют большее сродство с кислородом, чем железо (марок СВ-08ГСА Св-08Г2СА). [c.170]
Важное значение имеет комбинирование и рациональное использование мощностей и сырья в пищевой промынлленности, где доля затрат на сырье и материалы в обидей себестоимости продукции в 1964 г. составляла свыше 85%. Сырье в этой отрасли подвергается в основном комплексной переработке. Например, из сахарной свеклы при комбинированной и комплексной переработке кроме сахарного песка получают спирт, жидкую углекислоту, дрожжи, глицерин, эфироальдегидную фракцию, пектин, жом и много других продуктов. Миогочисленные продукты дает также комплексная переработка животного сырья, мяса и молока. [c.166]
Дефекты в швах чаще всего появляются при использовании газа, находящегося в верхней и нижней части баллона. Это происходит потому, что после заполнения баллона газ, находящийся в верхней части, над поверхностью жидкой углекислоты, содержит наибольшее количество примесей (азота, кислорода и влаги). Вода же, содержащаяся в некоторых баллонах до 150— 200 г, скапливается под жидкой углекислотой на дне баллона. После того как жидкая углекислота будет полностью израсходована, из баллона выделяется газ с повышенным содерлсани-ем влаги. [c.106]
Шланговый полуавтомат дл 1 заварки в углекислом газе дефектов стального литья и сварки металлоконструкций сварочной проволокой диаметром 1,6—2,5 мм на постоянном токе. Состоит пз механизма подачи сварочной проволоки, смонтированного на тележке с катушкой для 20 кг проволоки горелки с гибким кабелем-шлангом длинои 3 м, охлаждаемой водой шкафа с электроаппаратурой газовой системы, включающей баллон с жидкой углекислотой, осушителя газа, расходомера газа, редуктора типа РК-50 п предредукторно-го осушителя Р0К,-1. Скорость подачи проволоки независимая, изменяется ступенчато за счет сменных шестерен, а в пределах ступеней—плавно вариатором скоростей системы Светозарова [c.434]
I — баллон с жидкой углекислотой 2 — вентиль 3 — предредукторный осушитель газа 4 — подогреватель газа 5 — редуктор 5 — регулятор давления (расхода) углекислого газа 7 — электромагнитный клапан — реле давления —резиновый рукав для подачи газа /О — газоэлектрическая горелка [c.451]
Жидкая углекислота транспортируется в стальных баллонах. В наполненном баллоне жидкость занимает 60—80% всего объема баллона. Обычно в стандартный баллон емкостью 40 л заливается 25 кг углекислоты, образующей при испарении 12,725 м газа. Для сварки используют жидкую пищевую углекислоту ( Углекислый газ сжиженный ) по ГОСТ 8050—56, а также осушенную углекислоту, выпускаемую по специальным ТУ. Жидкая пищевая углекислота по ГОСТ 8050—56 должна содержать не менее 98,5% СО2 и не более 1,5% кислорода и азота. Окись углерода, минеральные масла, глицерин, сероводород, соляная, сернистая и азотная кислота, аммиак и моноэтанола.мин должны отсутствовать. Помимо воды, растворенной в жидкой углекислоте (около 0,05%), в каждом баллоне допускается наличие воды в свободном состоянии в количестве до 0,10% от веса жидкой углекислоты. Осушенная углекислота может иметь до 1,5% примесей (кислород и азот). Она отличается от пищевой только отсутствием влаги. [c.455]
Обычно для сварки используют сжиженный углекислый газ поставляемый в стальных баллонах. В связи с возрастающим применением сварки в углекислом газе в последнее время ощущается недостаток в баллонах. Кроме того, транспортирование и использование углекислоты в баллонах в сварочном производстве неудобно и дорого стоит. Опыты, проведенные УкрНИИПищепромом совместно с Харьковским турбинным заводом и Дублянским спиртза-водом, показали, что транспортировать жидкую углекислоту, хранить и использовать ее в крупных сварочных цехах целесообразно в контейнерах. Такие контейнеры спроектированы, изготовлены и опробованы указанными выше организациями. Предусмотрено изго- [c.205]
Как показали опыты ВНИХИ и ЦНИИТМАШ, для сварки можно использовать углекислый газ, поставляемый в виде сухого льда и обладающий высокой чистотой. Сухой лед легче транспортировать, и его стоимость ниже стоимости осушенной жидкой углекислоты. [c.206]
Хранение и перевозку защитных газов производят преимущественно в стандартных баллонах (ГОСТ 949—57). Для аргона и азота используют стальные баллоны группы А емкостью 40 л под давлением 150 ат, а для углекислоты — стальные баллонь[ группы Б такой же емкости. В один баллон входит 6000 л, или 6 аргона, плп 25 кг жидкой углекислоты, из которой при испытании образуется 12,725 газа. Давление в углекислотном баллоне зависит от температуры, которая по мере расхода газа понижается. При большом расходе газа жидкая углекислота может превратиться в лед. [c.91]
mash-xxl.info
Статьи углекислота
| |||
О пользе углекислоты
Изучить физиологию и патологию дыхания и кровообращения — казалось бы, что может быть особенного в такой задаче? Но сотрудники лаборатории вскоре почувствовали необычность избранного ими пути. Необычность хотя бы потому, что традиционные приборы и средства не годились для проведения исследований. Вот тогда Бутейко и предложил идею физиологического комбайна.
Состоящий из 14 электронных приборов, работающих синхронно, этот комбайн позволяет изучать пациента комплексно: он одновременно снимает 12 электрокардиограмм, записывает ритмы сердца, скорость вдоха и выдоха. Фотоэлементы оценивают насыщение крови кислородом, а инфракрасный анализатор — содержание углекислого газа во вдыхаемом и выдыхаемом воздухе. Вся эта информация, обработанная на ЭВМ, давала наглядное представление о механизме возникновения некоторых заболеваний сердца, сосудов, легких.
Все мы привыкли к мысли, что при глубоком дыхании организм человека полнее насыщается кислородом. А значит — и обменные процессы в нем идут интенсивнее. Еще нагляднее получается картина, если сравнить организм с топкой, а легкие — с мехами, подающими в нее кислород. Чем энергичнее работают мехи, тем сильнее приток кислорода, тем жарче пламя и больше сжигается топлива. А в результате — и выше выход энергии. Так?
«Нет, не так!» — показали бесстрастные приборы. При глубоком дыхании содержание кислорода в крови не увеличивается. И при нормальном вдохе кровь насыщается им почти до предела — 96—98 процентов. Более того, «перекормленный» воздухом человек начинает испытывать:., кислородное голодание. Почему? Попробуем разобраться.
Вы глубоко вдохнули и выдохнули. Инфракрасный анализатор тут же показал: из организма ушла солидная порция углекислоты. «Прекрасно,— думаете вы. Организм избавился от яда!» И… ошибаетесь. Оказывается, только часть углекислого газа, образующегося в организме, подлежит удалению. Остальной же газ не только не удаляется, а наоборот — организм оберегает его как одно из необходимейших для жизнедеятельности веществ.
Академик АН Украины М. Гулый доказал, что без него невозможен синтез белков. Опыты на животных подтвердили: углекислота способствует восстановлению поврежденных тканей, клеток крови. Есть и цифры для (равнения: организм реагирует на содержание углекислоты с точностью до ОД процента, на содержание кислорода — со строгостью в 50 раз меньшей.
Но почему организм поддерживает столь тонкий баланс углекислоты?
Целебный яд Жизнь на Земле миллиарды лет развивалась при высокой концентрации углекислоты. И она стала необходимым компонентом обмена веществ. Скажем, клеткам животных и человека ее надо около 6—7 процентов. А кислорода — всего 2 процента. Этот факт установили эмбриологи. Они же выяснили, что в крови материнского плода содержание кислорода в 3—4 раза ниже, чем у взрослого человека, а углекислоты — в 1,5 раза больше. Не означает ли это, что организм матери стремится создать для нормального развития плода среду, какая была на планете миллиарды лет назад?
А возьмите другой факт: горцы почти не страдают такими недугами, как астма, гипертония или стенокардия, которые распространены среди горожан. Не потому ли, что на высоте трех-четырех тысяч метров содержание кислорода в воздухе намного меньше? Медицина накопила уже немало фактов, когда больные выздоравливают именно в условиях высокогорья. Отсюда и напрашивается вывод: видимо, наш организм не успел приспособиться в процессе эволюции к быстрому изменению газовой среды.
Академик П. Анохин считал, что болезнь возникает тогда, когда в организме сдвигаются нормы. Развивая эту мысль, К. Бутейко пришел к выводу, что уровень углекислоты определяет норму жизни. Эксперименты на животных показали, что снижение ее содержания в клетке ниже трех процентов ведет к гибели. А если повысить содержание углекислоты? Здесь исследователь столкнулся с интереснейшим явлением — сверхвыносливостью организма: возросла «прочность» нервной системы, активность защитных реакций.
— Когда мы обнаружили это явление,— вспоминает Константин Павлович,— невольно возникла мысль: не здесь ли ключ к секретам сверхвыносливости йогов? Позднее, изучив их систему дыхательных упражнений с . помощью приборов, мы убедились, что она способствует накоплению углекислоты…
Так, шаг за шагом, К. Бутейко пришел к выводу, что причина многих недугов — в тех противоречиях, которые нередко раздирают организм. Скажем, чтобы сохранить необходимое количество углекислоты, он решается даже на крайние меры — спазм сосудов и бронхов. Но по этим же каналам поступает и кислород. Чтобы не допустить кислородного голодания, сердце начинает быстрее гнать кровь по сузившимся сосудам. Отсюда — повышенное артериальное давление, а дальше — и гипертония. Значит, с помощью волевой регуляции дыхания можно прекратить «гипервентиляцию легких» и восстановить норму жизни — баланс углекислоты. Это — принцип. А его воплощение — своего рода алгоритм или система дыхания, разработанная К. Бутейко. Благодаря его методике многие пациенты обрели здоровье.
— Но особенно легко осваивают волевую регуляцию дыхания дети,— считает научный сотрудник Клинического центра Сибирского отделения АН СССР Вильма Августовна Генина. У трехлетней Наташи М. после пневмонии развился астматический бронхит.
— Полтора месяца я водила дочь в группу Гениной,—рассказывала ее мама. — Надо сказать, дети ходят на занятия с удовольствием, быстро учатся самостоятельно купировать приступы. Тем более что тренировки здесь проходят в виде игры. Методике волевого дыхания обучаются и родители, чтобы контролировать занятия детей дома. Вот уже год, как дочь практически здорова. Даже диагноз «астматический бронхит» снят…
Лечение в этой группе проводится под контролем медицинских приборов. Регулярно делаются многочисленные клинические анализы. В частности, измеряется содержание углекислоты в альвеолах легких и других тканях. По просьбе медиков родители ведут подробные дневники, которые заполняют по специальной методике. Все это позволило исследователям накопить обширный материал.
Вместо рецептов «Пока дышу — надеюсь»,— говорили древние римляне. «Пока нормально дышу — здоров»,— добавляют бывшие больные, прошедшие курс лечения методом волевой регуляции дыхания. Можно ли самостоятельно научиться правильно дышать? — Как правило, здоровому организму соответствует и нормальное дыхание. И специально его тренировать нет необходимости… В любой поликлинике есть приборы для контроля дыхания. А в домашних условиях можно с помощью секундомера замерить продолжительность паузы после выдоха. Если вы свободно, без напряжения выдерживаете 20—30 секунд, значит, дыхание у вас в норме, — говорит Константин Павлович.
— Можно ли накопить углекислоту, употребляя газированные напитки?
— Организм взрослого человека при средней нагрузке вырабатывает за сутки 600—1000 литров углекислоты.
И те ничтожные ее доли, что содержатся в газированной воде, существенной роли играть не могут…
— Как сочетается с волевой регуляцией дыхания популярная формула «бег ради жизни»?
— Физические нагрузки усиливают обмен веществ, стабилизируют норму жизни, увеличивая содержание углекислоты в крови и тканях. Поэтому их лечебный эффект неоспорим. К сожалению, бегать можно не всем.
-А волевая регуляция дыхания, избавляющая от дефицита углекислоты, противопоказаний не имеет…
-Наверное, и метод волевой регуляции дыхания способен исцелить тоже далеко не всех. Но если хоть кому-то он может помочь, значит, заслуживает самого пристального внимания.
Углекислота — источник жизни
Глубокое дыхание ведет к потере углекислоты в крови. Но почему вдруг, углекислота являлась ядом в старых представлениях, когда потеря этого “яда” вызывает несчастья и страшные нарушения в организме? Для этого надо кратко рассмотреть историю эволюции жизни на Земле, атмосферы нашей планеты. Предположительно, жизнь на Земле возникла около 3-4 млрд. лет назад. Если рассмотреть развитие Земли зa 7 млрд. лет, то где-то в середине этого срока на Земле появилась жизнь, появилась атмосфера, которая состояла тогда, в основном из углекислоты и других недоокисленных продуктов — кислород практически отсутствовал. А жизнь все-таки возникла в этой «ядовитой» среде. Свободного кислорода вообще не было. Он был только в связанном, в неактивном состоянии. В основном состояло все из углекислоты, метана, сероводорода и недоокисленных продуктов. Та же атмосфера, что сейчас на Венере, как показали наши ракеты. Венера — более молодая планета в космогоническом paзвитии. Наши исследования подтвердили: на Венере 90% углекислоты и лишь около 2% кислорода. Предположение теоретиков об условиях зарождения жизни на Земле блестяще подтвердились межпланетными исследованиями. Таким образом, все живое на Земле построено из углекислоты, и продолжает строиться из нее. Мы просто не отдаем себе в этом отчета. Как известно, Тимирязев и его школа установил, что растения питаются углекислым газом из воздуха, присоединяя воду в реакции фотосинтеза, выбрасывают кислород, как отброс. Берется еще немного других элементов из почвы, и строится организм: растения, плоды, водоросли. Основной источник жизни на Земле — это углекислота воздуха. Растениями питаются животные, а мы — и теми и другими. Значит, и мы построены при помощи энергии Солнца из углекислоты воздуха и воды.Итак, развились растения и животные и стали поглощать углекислоты больше, чем ее выделяют газы вулканов, гейзеров и т. д. Огромные запасы углекислоты оказались съеденными растительностью и унесенными в подземелья под осадочные породы, образовав торфы, нефть, угли, сланцы, почву. Все это есть под землей, засыпанное космической и земной пылью. Надо понимать, что с уходом углекислоты из воздуха все на Земле погибнет, жизнь прекратится. Основные запасы углекислоты на Земле уже исчерпаны — осталось лишь 0, 03%. Ничтожная доля! Одна тридцатитысячная доля от общего газового состава воздуха… Если это исчезнет, жизнь на Земле прекратится полностью — растениям и человеку нечего будет есть! Человечеству придется задуматься о переселении на Венеру, где есть огромные запасы углерода и углекислоты. Ясно, что жизнь на Земле продолжалась при высокой концентрации углекислоты миллиарды лет и строилась из углекислоты.
УГЛЕКИСЛОТА — ОСНОВНОЙ ИСТОЧНИК ПОСТРОЕНИЯ ЖИВЫХ СУЩЕСТВ, крайне необходимая среда для обмена веществ. Сейчас атмосфера резко изменилась — сейчас в воздухе 21% кислорода, а углекислоты 0, 03%, т. е. образовались ножницы, которые должны срезать «голову» жизни на Земле. Но жизнь сопротивляется, приспосабливается, и поэтому все еще сохраняется, хотя по объему и представительству видов она значительно уже уменьшилась. Это связано с тем, что основным источником и хранителем влаги является живое существо. Растительная влага содержит около 95% воды. А растительность будет там, где есть углекислота. Исчезнет растительность — исчезнет жизнь на земле. Процесс этот прослеживается даже в письменной истории, как пустыни, сухие степи, солончаки наступают на материки, а жизнь отступает. Этот закономерный процесс отмирания жизни на Земле связан именно с ликвидацией запаса углекислоты. Но клеткам животных и человека по-прежнему надо около 7% углекислоты и всего 2% кислорода в окружающей среде. Так живут наши клетки: клетки сердца, мозга, почек.
А сейчас воздух содержит в 10 раз больше кислорода, в 250 paз меньше углекислоты, т. е. не подходит для жизни наших клеток, ядовит по своему составу. Это подтверждает эмбриология. За последние годы всесторонне исследовано кровообращение плода и содержание газов в крови эмбрионов человека и животных. Оказалось, мы все 9 месяцев находимся в среде, где кислорода в 3-4 раза меньше, а углекислоты в 1, 5 раза больше (по парциальному давлению), чем у взрослых. Очевидно, что организм матери создает такую среду для плода, какая была на Земле миллиард лет тому назад. Подтверждается закон Геккеля-Северцева — эмбрион в онтогенезе повторяет филогенез. Все, что происходит в организме плода, повторяет историю развития жизни на Земле. При рождении, при первых вдохах, резко повышается кислород в крови ребенка, резко уменьшается углекислота.
Известно, что в утробе матери дитя почти ничем не болеет. Только после рождения начинаются диатезы и все иные нарушения, связанные с обменом веществ. Почему? Резко отрицательно влияет газовая среда. Надо только удивляться народной мудрости на Востоке, где новорожденных туго пеленают, а в некоторых местах даже крепко привязывают к деревянной дощечке. Грудь прикрывают слоями войлока. Наши бабушки накрывали пологом коляску с грудным ребенком, пеленали тоже… Народная мудрость понимала, что к этому воздуху, особенно ядовитому для новорожденного, надо привыкать постепенно. Что же сейчас делают научные медики? Новорожденного посылают в кислородную палату, дают ему 100% кислород, да еще дыхательную гимнастику проводят: ручки вверх, ручки вниз… Проделывали опыты с новорожденными крысятами, помещая их в чистый кислород. Через 2-3 дня слепота! Происходит мгновенный склероз сосудов сетчатки. Понятно, почему — в утробе матери такого высокого содержания кислорода не было.
Человеку нужно всего лишь 2% кислорода, а не 100%, как ему дают!Вот как ужасны предрассудки, все надо делать строго наоборот. Первый предрассудок «о пользе глубокого дыхания» — безусловный виновник болезней человечества. Вот еще психоз — «кислородный». Сегодня дают его под давлением: повышают до 5-6 атмосфер и загоняют в организм. Для этого строятся специальные палаты, где предполагается «оживление» больных. Но мы помним эксперименты: при давлении 1атм. кислород убивает мышку за 11 дней, а при давлении 5-6 атм. мышь дохнет зa 40 минут при той же концентрации кислорода. Очевидно, что предрассудки ведут по ложному пути, наши клетки в своем развитии не встречали концентрации кислорода выше 2%. Содержание 21% кислорода в вoздухе непереносимо для нашего организма, мы к этому изменению среды не приспособились. Полезным было бы для наших клеток 10-15% содержание кислорода во внешней среде, примерно то, что находится на уровне 3-4 тыс. метров над уровнем моря. Вот почему в горах распространено долголетие — там меньше отравление кислородом. Там меньше болеют астмой, гипертонией, стенокардией, инфарктами, инсультом, склерозом. Это установленный факт. Если на высоту поднимать больных, астмой, гипертонией, стенокардией и даже шизофренией (сейчас таких опытов много), им становится легче.
Значит, на уровне моря мы находимся в избытке кислорода, а его надо как можно меньше стремиться загонять в организм. Что углекислота нам не яд, думаю уже всем понятно. Мы пьем пиво, квас, минеральные воды, даже простую воду газируем, стопроцентно насыщаем углекислотой. Инстинктивно стремимся к источнику жизни. Если бы углекислота была ядом, мы бы повредили желудочно-кишечный тракт, все бы ходили с язвами пищевода, желудка. Наоборот, регулярно принимая газированную воду с углекислотой, больные, имеющих гастриты, колиты, язвы желудка, улучшают свое состояние, иногда даже язвы вылечиваются. Глубокое дыхание вызывает нарушение деятельности гладкой мускулатуры, спазмы, болезни, сокращает нам жизнь. Углекислота — ценнейший источник жизни. Избыток углекислоты вреден, как и избыток любого другого вещества. Во всем должна быть норма! По законам физиологии, в частности, по учению академика Анохина, болезнь возникает тогда, когда сдвигаются константы, границы, нормы. Количество CO2 Анохин называет важнейшей константой организма, определяющей нормы жизни нашего организма. Ее уровень понижается при глубоком дыхании. Чем ниже уровень константы, тем ближе человек к гибели. А если углекислота повышается — это не опасно. Животные клетки миллиарды лет существовали с высоким содержанием углекислоты, человеческие клетки в утробе матери тоже. Полной односторонности нет. Если повышать углекислоту выше нормы, (средней нормы), можно получить интересное явление – сверхвыносливость, особую устойчивость некоторых процессов, особую устойчивость нервной системы и т. д. Теперь перекинем мостик к тем феноменам йоги, которые до сих пор нерасшифрованы. Чудеса эти заключаются в том, что йоги умеют накапливать СО2, а все их тайны связаны с уменьшением дыхания!
Холден еще 30 лет тому назад установил, что организм регулирует уровень СО2 с точностью до 0,1% («порог регуляции CO2»). Pаз с такой точностью осуществляется дозировка, значит, углекислота очень важна.
А кислород с какой точностью? Только когда кислород уменьшается более, чем на 5% в легких, организм реагирует, чтобы его выровнять. А если кислород повышается? 100% кислородом вы можете дышать и реакции защиты не будет, потому что организм никогда не встречал такого содержания кислорода, не приспособлен к защите, к адаптации. Организм умеет защищаться только от того, от чего представителям его вида раньше приходилось гибнуть. Так как углекислота регулируется с точностью в 50 раз большей, чем кислород, то биологическое значение углекислоты” в 50 раз больше, чем кислорода”. Это согласовывается с постулатами Анохина.
В процессе эволюции, когда углекислота начала исчезать из атмосферы, в организме стали образоваться защитные механизмы от ее потери. В первую очередь — спазмы. Сужение клапанов выделения углекислоты: спазм бронхов, сосудов, кишечника, желчных путей, вся гладкая мускулатура травмируется, вся мускулатура выделительных органов повреждается. Природа спазмов — это защитная реакция от потери углекислоты за счет сужения каналов ее оттока.
Глубокое дыхание уменьшает содержание углекислоты в организме и как следствие уменьшает содержание кислорода. Поэтому, чем меньше глубина дыхания, тем больше кислорода попадает в организм, и наоборот, чем глубже дыхание, тем меньше кислорода попадает в организм меньше. При дыхании ртом выделение углекислоты из организма усиливается.
Ученые превратят углекислый газ в бензин
Если два исследователя из Национальной лаборатории в Лос-Аламосе не ошибаются, спустя 50 лет люди по-прежнему будут ездить на автомобилях, работающих на бензине и исторгающих в атмосферу парниковый углекислый газ, – однако этот углекислый газ не будет способствовать глобальному потеплению.Ученые Ф.Джеффри Мартин и Уильям Л.Кьюбик-младший разработали концепцию с патриотическим названием “Зеленая свобода” (Green Freedom), согласно которой углекислый газ может извлекаться из воздуха и возвращаться в бензин.
Идея проста. Воздух будет продуваться над жидким углекислым калием, который абсорбирует углекислый газ. Экстракт углекислоты будет подвергаться химическим реакциям, которые превратят его в топливо: метанол, бензин или авиационное топливо.
В результате этого процесса углекислый газ может перестать играть роль нежелательного, провоцирующего климатические изменения загрязнителя и станет обширным источником возобновляемого топлива. Замкнутый цикл, в котором в атмосферу попадает, а затем извлекается из нее равное количество углекислого газа, может означать, что легковые автомобили, грузовики и самолеты, использующие синтетическое топливо, больше не будут провоцировать глобальное потепление.
Хотя завод по производству синтетического топлива и даже его мини-прототип еще не созданы, ученые говорят, что эта концепция основана целиком и полностью на уже существующих технологиях. “Все элементы этой концепции в отдельности уже созданы, эксплуатируются или имеют близкие аналоги, запущенные в эксплуатацию”, – подчеркивает д-р Мартин. Схема, разработанная в Лос-Аламосе, согласуется со всеми законами физики, и другие ученые, такие как Джордж Ола, химик-лауреат Нобелевской премии из Университета Южной Каролины, и Клаус Лакнер, профессор геофизики из Университета Колумбии, независимо друг от друга выступали со схожими идеями. По словам д-ра Мартина, концепция, предложенная им и д-ром Кьюбиком, проработана более детально, чем предыдущие предложения.
Однако есть один момент, объясняющий, почему до сих пор никто так и не построил завод по преобразованию углекислого газа в топливо: это производство требует огромного количества энергии.
Чтобы решить эту проблему, ученые из Лос-Аламоса разработали ряд инноваций, включая новый электрохимический процесс для отделения углекислого газа после того, как его абсорбировал углекислый калий. Технология была протестирована в гараже Кьюбика, на примитивном аппарате, который внешне напоминает мутировавшую одноразовую посудину Tupperware.
Даже со всеми этими новшествами обеспечение энергией производства топлива в коммерческих масштабах – скажем, 750 тыс. галлонов в сутки – потребует специальной электростанции, предпочтительно атомной, указывают ученые.
Согласно их анализу, концепция, реализация которой обойдется примерно в 5 млрд долларов, обеспечит производство топлива с себестоимостью 1,4 доллара за галлон. Учитывая затраты на строительство и другие расходы, она станет экономически выгодной тогда, когда розничная цена достигнет 4,6 долларов за галлон. С помощью дополнительных технологических инноваций безубыточная цена упадет до 3,4 долларов, отмечают они.
Атомный реактор не является технологическим императивом. Те же химические процессы могут обеспечиваться энергией с помощью солнечных батарей, например, однако в таком случае экономические расчеты выглядят менее привлекательно.
Д-р Мартин и д-р Кьюбик представят “Зеленую свободу” в среду на конференции “Альтернативная энергия сегодня” (Alternative Energy Now) в Лейк Буэна-Виста во Флориде. Они планируют создать несложную демонстрационную модель в течение года и более крупный прототип через пару лет.
Создание коммерческого топливного завода на атомной энергии может натолкнуться на ряд серьезных барьеров, а для того, чтобы полностью заменить нефтяное топливо, потребуются тысячи таких заводов, однако перед лицом проблемы глобального потепления простых решений не бывает. В усилиях по сокращению выбросов углекислого газа, которые сейчас составляют 30 метрических тонн в год, значительная часть внимания до сих пор была сосредоточена на крупных стационарных источниках, таких как электростанции. Они, по крайней мере теоретически, должны перейти с топлива, сжигание которого сопровождается выбросами углекислого газа – с угля и природного газа – на другие виды, такие как атомная, солнечная энергия и сила ветра.
Другая стратегия, известная как улавливание и утилизация углекислого газа, предполагает продолжение использования ископаемого топлива, но с параллельным улавливанием углекислого газа и закачиванием его под землю, где он не будет влиять на климат.
Однако, чтобы стабилизировать уровень углекислого газа в атмосфере, потребуется резкое сокращение его выбросов. Кроме того, еще не разработано аналогичного решения для мелких, мобильных источников выбросов углекислого газа, тогда как автомобили, работающие на атомной или солнечной энергии, вряд ли появятся в обозримом будущем.
Было предложено три решения: водородные топливные элементы, электромобили и биотопливо. Биотопливо, как и этанол, является топливным субститутом, получаемым из таких растений, как кукуруза, сахарный тростник и просо, и в основе этого подхода лежит та же идея, что и в основе “Зеленой свободы”. Растения поглощают углекислый газ, балансируя уровень углекислого газа, который выбрасывается при их сжигании. Однако выращивание культур для производства топлива требует большого количества земель.
Пользование машинами на водородном топливе не сопровождается выбросом углекислого газа, однако производство водорода путем расщепления воды или иных химических реакций требует огромного количества энергии, а если эта энергия поступает с электростанций, работающих на угле, то это не решение проблемы. Кроме того, водород сложнее хранить и транспортировать, чем бензин, то есть потребуется перекраивать всю мировую энергетическую инфраструктуру. Электромобили также перекладывают проблему углекислого газа на электростанции. Кроме того, электромобили обычно ограничены маршрутом в десятки миль, в то время как на канистре бензина можно проехать сотни миль.
Таким образом, бензин оказывается почти идеальным топливом (за тем исключением, что выбросы углекислого газа на галлон составляют 19,4 фунта). Его легко транспортировать, и он дает больше энергии, чем большинство альтернативных источников. Если бензин можно производить из атмосферного углекислого газа, то концепция Лос-Аламоса может означать, что переходить на иные источники смысла нет. Эта концепция также может быть адаптирована для производства авиатоплива – для самолетов ни водород, ни батареи не представляются разумной альтернативой. “Это единственная схема, которая устраняет все тревоги, имеющиеся в данный момент”, – отмечает Мартин.
Другие ученые заявили, что концепция Лос-Аламоса выглядит многообещающей, но оценить ее в полной степени не представляется возможным, ибо детали еще не опубликованы.
“Эту концепцию определенно стоит разрабатывать, – заявил Мартин Хофферт, профессор физики в Университете Нью-Йорка. – Дело не в том, что эта идея нова, но в ней есть пара элементов, которые очень интересны”.
Солнечная печь для обратного расщепления углекислоты и последующего получения топлива
Ученые из Национальной лаборатории Sandia, США, сконструировали солнечную печь, которая под действием высокой температуры будет обратно расщеплять углекислый газ на моноксид углерода и кислород. По замыслу исследователей, полученный таким образом моноксид СО можно затем уже использовать для получения водорода из воды и других различных видов жидкого топлива. Таким образом, станет возможно повторно и экологическим чистым образом использовать ископаемое топливо. Первоначально установка CR5 (сокращение от Counter Rotating Ring Receiver Reactor Recuperator) создавалась для расщепления воды на водород и кислород. Однако затем ученые показали, что ее можно использовать и для разложения углекислоты.В перспективе возможно ее применения на различных производствах и энергетических установках, где сжигается большое количество топлива и производится много СО2.
В еще же более отдаленной перспективе, как считают ученые, можно напрямую утилизировать углекислый газ, находящийся в атмосфере.
gidro.tech-group.pro
Пищевая жидкая углекислота.
Источниками промышленного получения пищевой жидкой углекислоты являются дымовые газы; газы, выделяющиеся при спиртовом брожении Сахаров в спиртовом, пивоваренном и лесогидролизном производствах; газообразные продукты обжига карбонатов (известняка, мела, мергеля) и некоторых химических производств.
В зависимости от вида используемого сырья, способа получения и степени очистки жидкая углекислота может содержать то или иное количество примесей, снижающих ее ценность как сырья для производства газированных напитков. В ней могут содержаться воздух (азот, кислород), побочные и промежуточные продукты брожения (альдегиды, эфиры, спирты, фурфурол), сернистый газ, вода, следы смазочного масла. Наличие примесей в углекислоте отрицательно влияет на вкус газированных напитков; поэтому к используемой углекислоте предъявляются определенные требования. Жидкая углекислота (согласно ГОСТ 8050-64) не должна содержать окиси углерода, минеральных масел, сероводорода, соляной, сернистой и азотистой кислот, спирта, эфиров, альдегидов и органических кислот; двуокиси углерода в ней должно быть не менее 98,5%, а воды не более 0,1%.
Заводы безалкогольных напитков получают жидкую углекислоту со специализированных углекислотных заводов или из утилизационных цехов спиртовых и пивоваренных заводов. При транспортировании и хранении жидкой углекислоты в баллонах требуется соблюдать определенные условия. Разлитая в стальные баллоны жидкая углекислота является крайне нетранспортабельным продуктом, так как масса тары составляет 70%, а масса продукта всего 30%. Баллоны перевозятся автомашинами, на которые они загружаются транспортерами; для выгрузки баллонов с автомашин имеются специальные лотки. Внутризаводское транспортирование баллонов производится специальными тележками.
Баллоны с жидкой углекислотой хранятся в одноэтажных складах с наружной входной дверью без чердачных перекрытий. Баллоны устанавливают в вертикальном положении на расстоянии не менее 1 м от отопительных приборов. В складах оборудуется приточно-вытяжная вентиляция, обеспечивающая в сутки пятикратный обмен воздуха.
Украинским научно-исследовательским институтом пищевой промышленности разработан способ безбаллонного хранения жидкой кислоты. Для этой цели используются специальные резервуары барабанно-секционного типа из стальных сварных труб диаметром 600 – 300 мм со штампованными эллиптическими днищами. Резервуары изолируются изотермическим поролоном (пенополиуротаном). Углекислота в них хранится при избыточном давлении 7,84 – 9,80 Мн/м2 (8-10 кГ/см2) и температуре минус 40 – минус 50° С. Перевозка углекислоты осуществляется в контейнерах.
Газобаллонная станция и подача углекислоты на сатурацию
На сатурацию углекислый газ подается по коммуникации из газобаллонной станции. Для уменьшения углекислотных коммуникаций газобаллонную станцию рационально разместить в непосредственной близости от сатураторов, в помещении первого этажа, имеющего наружный выход.
Для снижения давления углекислоты при выпуске ее из баллона используется редуктор с манометром и предохранительным клапаном, устанавливаемый на баллоне. Вследствие резкого перепада давлений при выпуске газа из баллона в проходном сечении вентиля может образоваться ледяная пробка, которая ликвидируется при смачивании вентиля теплой водой.
Во избежание обмерзания углекислотных коммуникаций баллоны с углекислотой присоединяют с помощью гибких трубок к коллектору с вентилями, который погружается в воду, подогретую до 25-30° С. Выпускные устройства баллонов орошаются теплой водой из шлангов с перфорированными наконечниками. Иногда выпускные устройства подогреваются электроподогревателями. Из коллектора углекислый газ давлением 4,9 – 7,84 Мн/м2 (5-8 кГ/см2) поступает в ресивер; отсюда по коммуникации он поступает к сатураторам.
www.comodity.ru
ПРОИЗВОДСТВО ЖИДКОЙ И ТВЕРДОЙ УГЛЕКИСЛОТЫ
Углекислота — это бесцветный газ с едва ощутимым запахом. Плотность ее по отношению к воздуху при 0° и 760 мм рт. ст. составляет 1,524, т. е. углекислый газ почти в 1,5 раза тяжелее воздуха. Благодаря этому углекислый газ может вытеснять воздух из различных сосудов большой и малой емкости, заполняя их до краев. 1 м3 углекислого газа при нормальных условиях весит 1,97 кг. Давление, при котором углекислый газ превращается в жидкость, зависит от температуры и составляет при 5° 35 атм, при 10° 44 атм, при 15° 52 атм и при 20° 56 атм. Критическое давление углекислоты равно 72,9 атм и критическая температура 31,3°.
Сжиженная углекислота представляет собой бесцветную, подвижную жидкость с удельным весом при 0° 0,947, при 15° 0,813 и при 30° 0,46. При нагревании жидкой углекислоты от 0 до 30° ее объем увеличивается почти в 1,5 раза. Эту особенность жидкой углекислоты необходимо учитывать при заполнении ею сосудов. При испарении 1 кг жидкой углекислоты образуется 509 л газа. Теплота испарения жидкой углекислоты составляет 47,7 ккал/кг. При быстром испарении часть жидкой углекислоты превращается в твердое состояние — снегообразную, мелкокристаллическую массу, удельный вес которой после прессования при —79° достигает 1,53. При повышении температуры твердая углекислота переходит в газ, не плавясь.
Жидкая углекислота широко применяется в пищевой промышленности для газирования фруктовых и минеральных вод, шампанского, используется для тушения пожаров, применяется в сварочной технике для предохранения нагретого металла от окисления и т. д.
Твердая углекислота, или сухой лед, используется для охлаждения мороженого, пищевых продуктов; применяется для уничтожения облаков над аэродромами и т. д.
В гидролизной промышленности практическое значение имеет углекислота, выделяющаяся при спиртовом брожении гидроли — затов и сульфитных щелоков. Из 1000 кг сброженных гексоз образуется около 500 кг, углекислого газа, который частично остается растворенным в бражке, но большая часть его выделяется на поверхности бродящего сусла. Так, при спиртовом брожении древесного сусла, содержащего в 1 л3 27 кг сбраживаемых Сахаров, образуется около 14 кг углекислого газа, который при атмосферном давлении и 30° занимает объем около 7 м3. При 30° около 1 мэ углекислого газа растворяется в 1 м3 бражки и около 6 м3 выделяется на поверхности бродящего сусла.
На гидролизных заводах углекислоту собирают, очищают и превращают в жидкое и твердое состояние по схеме, приведенной на рис, 97. По этой схеме газообразный углекислый газ отбирается из закрытых бродильных чанов в газгольдер 1, откуда газодувка 2 гонит его через систему из четырех очистительных колонок 3, 4, 5. В первой колонке 3 газ освобождается от примесей (спирт, эфиры, альдегиды) путем обработки его 0,5%-ным водным раствором марганцевокислого калия. Затем газ промывается водой в колонке 4, заполненной кусками кокса. Очищенный газ проходит две колонки 5, из них первая заполнена простым древесным углем, а вторая активированным. Эти колонки служат для поглощения водяных паров и дезодорации газа.
Очищенный и высушенный газ поступает в трехступенчатый компрессор 6. На первой ступени газ сжимается от 1 до 4,5 ата, На второй от 4,5 до 18 ата, и на третьей от 18 до 72 ата. Между первой и второй ступенью сжатия газ охлаждается в холодильнике 7. Между второй и третьей ступенью газ охлаждается в холодильнике 8 и после третьей — в холодильнике 9. Между первой и второй ступенью сжатия, после охлаждения, газ дополнительно подвергается высушиванию хлористым кальцием или силикаге — лем в колонке 10.
После каждого холодильника газа установлен маслоотделитель.
Сжатый до 72 ата таз подается в холодильник 25, где охлаждается ниже критической температуры ( + 27,8°), после чего превращается в жидкость. Жидкая углекислота собирается в сборном резервуаре И, откуда поступает для наполнения стальных баллонов 13 при помощи аппаратуры наполнительной станции 12.
Твердую углекислоту из жидкой получают охлаждением ее при помощи трехступенчатого последовательного испарения. На первой ступени испарения давление снижается с 72 до 25 ата, Причем жидкая углекислота, частично испаряясь, вследствие поглощения теплоты испарения охлаждается до —15°. На второй ступени давление снижается с 25 до 8 ата, а жидкость соответственно охлаждается до —47°. На третьей ступени давление снижается с 8 до 1 ата, а температура падает до —78,5°, и жидкость переходит в твердое состояние.
В результате снижения давления часть углекислоты на каждой ступени испаряется, превращаясь в газ. Испарившаяся углекислота вспомогательным трехступенчатым компрессором 17 Сжимается, затем охлаждается, снова образуя жидкую углекислоту.
Этот процесс осуществляется следующим образом. Жидкая углекислота из резервуара 23 поступает сначала в первый теплообменник 24, где охлаждается газом, идущим из первого испарителя 21, затем во второй теплообменник 22, где дополнительно охлаждается парами углекислоты из испарителя второй ступени 18. Охлажденная в теплообменниках жидкая углекислота поступает в испаритель первой ступени 21, где частично испа-
|
Ряется и соответственно охлаждается. Охлажденная жидкость из первого испарителя проходит во второй 18, где снова частично испаряется. Охлажденная до —47° жидкая углекислота из испарителя второй ступени поступает в испаритель третьей ступени, или ледогенератор 19. Образовавшийся в ледогенераторе углекислый газ под давлением 1 ата засасывается первой ступенью вспомогательного компрессора 17, где сжимается до 8 ата. Нагревшийся при сжатии газ охлаждается в холодильнике 15 и в таком виде засасывается второй ступенью компрессора 17, где сжимается до 25 ата. Перед поступлением во вторую ступень компрессора 17 сжатый до 8 ата газ смешивается с углекислым газом из второго теплообменника, находящегося под тем же давлением. После сжатия до 25 ата газ охлаждается в холодильнике 16 и поступает на третью ступень сжатия в компрессор 17. По пути он смешивается с углекислым газом, выходящим из первого теплообменника 24 под тем же давлением. После третьей ступени сжатия углекислота проходит холодильник 14, охлаждается в ней и возвращается в конденсатор 25, где снова превращается в жидкость.
При таком методе работы за один цикл из 1 кг жидкой углекислоты получают около 0,29 кг твердой углекислоты. Остальное количество ее испаряется и после сжатия и охлаждения снова возвращается в производство.
При получении 1 т жидкой углекислоты по описанной выше схеме расходуется 170 м3 холодной воды, 0,69 т пара, 480 квт-ч Электроэнергии и 0,13 кг марганцевокислого калия. При переработке жидкой углекислоты в твердую на 1 т расходуется дополнительно 42 м3 воды и 109 квт-ч электроэнергии.
Себестоимость такой углекислоты почти в 2 раза ниже себестоимости жидкой и твердой углекислоты, получаемой сжиганием угля или кокса.
Комментирование на данный момент запрещено, но Вы можете оставить
на Ваш сайт.
gazogenerator.com
Жидкая углекислота Вики
| Диоксид углерода | |
|---|---|
| Систематическое наименование | Диоксид углерода |
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) |
| Хим. формула | CO2 |
| Рац. формула | CO2 |
| Состояние | бесцветный газ |
| Молярная масса | 44,01 г/моль |
| Плотность | газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ |
| Динамическая вязкость | 8,5⋅10−5 Па·с (10°C, 5,7 МПа) |
| Энергия ионизации | 13,77 ± 0,01 эВ[2] |
| Скорость звука в веществе | 269 м/с |
| −78,5 °C | |
| Тройная точка | −56,6 °C, 0,52 МПа [1] |
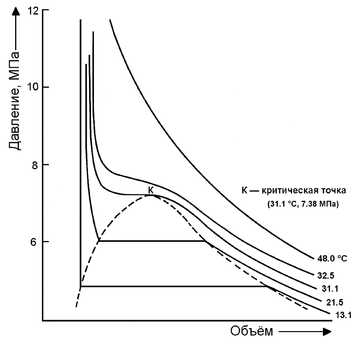
| Кр. точка | 31 °C, 7,38 МПа |
| Уд. теплоёмк. | 849 Дж/(кг·К) |
| Теплопроводность | 0,0166 Вт/(м·K) |
| Энтальпия образования | 394 кДж/моль |
| Энтальпия плавления | 9,02 кДж/моль |
| Энтальпия кипения | 16,7 кДж/моль |
| Энтальпия сублимации | 26 кДж/моль |
| Удельная теплота испарения | 379,5 кДж/кг |
| Удельная теплота плавления | 205 кДж/кг |
| Давление пара | 56,5 ± 0,1 атм[2] |
| Растворимость в воде | 1,48 кг/м³ |
| Рег. номер CAS | 124-38-9 |
| PubChem | 280 |
| Рег. номер EINECS | 204-696-9 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E290 |
| RTECS | FF6400000 |
| ChEBI | 16526 |
| Номер ООН | 1013 |
| ChemSpider | 274 |
| ПДК | 9 000 мг/м3 |
| ЛД50 | LC50: 90 000 мг/м3*5 мин (человек, ингаляция) |
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. |
| S-фразы | S9, S23, S36 |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[3]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Свойства[ | код]
Физические[ | код]
Оксид углерода (IV) — углекислый газ, бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В спокойном электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические[ | код]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы[4]:
- 2Mg+CO2↑→2MgO+C{\displaystyle {\mathsf {2Mg+CO_{2}\uparrow \to 2MgO+C}}}
Взаимодействие с оксидом активного металла:
- CaO+CO2↑→CaCO3{\displaystyle {\mathsf {CaO+CO_{2}\uparrow \to CaCO_{3}}}}
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- CO2↑+h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}\uparrow +H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- Ca(OH)2+CO2↑→CaCO3↓+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\uparrow \to CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ)
- KOH+CO2↑→KHCO3{\displaystyle {\mathsf {KOH+CO_{2}\uparrow \to KHCO_{3}}}}
Биологические[ | код]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[5].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[6].
Содержание углекислого газа в крови человека приблизительно таково:
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2) Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[7]—6,8[7] 4,8 4,7[7]—6,0[7] мм рт. ст. 41—51 36 35[8]—45[8]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[9] при помощи реакции CO₂ + H₂O → H₂CO₃ → H⁺ + HCO₃⁻.
- Около 5—10 % углекислого газа растворено в плазме крови[9].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[9].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[9].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 670 дней]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение[ | код]
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[10] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[10].
- CaCO3 +2HCl⟶CaCl2 +h3O +CO2↑⋅{\displaystyle {\ce {CaCO3\ +2HCl->CaCl2\ +h3O\ +CO2\uparrow .}}}
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется зкзотермическая реакция горения углерода в кислороде[10]:
- C+O2⟶CO2↑+ 394kJ⋅{\displaystyle {\ce {C + O2 -> CO2 ^ + \ 394 kJ.}}}
Применение[ | код]
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[11]
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации[ | код]
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[12].
Углекислый газ в природе[ | код]
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[13].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие[ | код]
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к 4-му классу опасности.
Незначительные повышения концентрации, вплоть до 2—4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7—10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[14].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[15].
См. также[ | код]
Примечания[ | код]
- ↑ Carbon Dioxide – Thermophysical Properties
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения 24 сентября 2013.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ How much carbon dioxide do humans contribute through breathing? (неопр.). Дата обращения 30 апреля 2009. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry. — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide (неопр.). solarnavigator.net. Дата обращения 12 октября 2007.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: “Himiâ”, 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. ОПРЕДЕЛЕНИЕ СОСТАВА МЕТОДОМ ГАЗОВОЙ ХРОМАТОГРАФИИ С ОЦЕНКОЙ НЕОПРЕДЕЛЕННОСТИ. Часть 6. ОПРЕДЕЛЕНИЕ ВОДОРОДА, ГЕЛИЯ, КИСЛОРОДА, АЗОТА, ДИОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ C1 — C8 С ИСПОЛЬЗОВАНИЕМ ТРЕХ КАПИЛЛЯРНЫХ КОЛОНОК.
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (неопр.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Т. SAM—TR—67—77.
Литература[ | код]
Ссылки[ | код]
ru.wikibedia.ru
Углекислота в быту
| |||
Приготовление газированных воды и напитков
В бутылку наливается охлажденная вода или напиток, в объеме 80-90% от максимальной вместимости бутылки, выдавливается остаток воздуха из бутылки, бутылка плотно прикручивается к пробке. Редуктором углекислотного баллона устанавливается давление углекислоты в 4 атм. Для лучшего растворения углекислоты рекомендуется встряхивать бутылку с водой или напитком. Во время насыщения углекислотой воды показания манометра снижаются. Когда манометр вновь станет показывать 4 атм. процесс получения газированной воды завершается. На редукторе баллона перекрывается подача углекислоты. Осторожно (чтобы не обрызгаться), бутылка отвинчивается от пробки со шлангом и закручивается другой, герметичной пробкой. Если использовалась сифонная насадка, то шланг (также осторожно) снимается с насадки, а насадка остается на бутылке. Все.
Зарядка углекислотных огнетушителей углекислотой
Необходимо быть уверенным, что в пустом огнетушителе нет содержания воздуха, иначе давление воздуха в огнетушителе не позволит углекислоте наполнить огнетушитель в необходимом количестве. Если же уверенности нет, необходимо продуть огнетушитель углекислотой до удаления остатков воздуха.Углекислотный баллон с достаточным количеством находящейся в нем жидкой углекислоты, ложится на пол с уклоном в сторону вентиля (для слива жидкой углекислот). Взвешенный пустой огнетушитель, находящийся на весах, присоединяется посредством шланга высокого давления (рассчитанного на давление не ниже 100 атм. от гидро- или тормозной системы) к штуцеру углекислотного баллона. Открытием вентилей, сначала углекислотного баллона, а затем наполняемого огнетушителя, подается углекислота в огнетушитель. Контроль наполнения огнетушителя углекислотой ведется по увеличению массы огнетушителя, лежащего на весах. Для лучшего наполнения огнетушителя углекислотой желательно чтобы температура огнетушителя была ниже температуры углекислотного баллона. При этом следует иметь ввиду, что при температуре выше + 31 градус Цельсия жидкая углекислота переходит в газообразное состояние.
Вес заряда углекислоты должен быть для огнетушителя ОУ-2 1,25 -1,45 кг, для ОУ -3 2,1 кг, для ОУ-5 3,15 -3,5 кг и для ОУ-8 5,15 – 5,6 кг.
Предохранение пищевых продуктов от повреждения насекомыми-вредителями
Очень часто в пищевых продуктах, хранимых при комнатной температуре, обнаруживаются насекомые- вредители. Это в первую очередь относится к сухофруктам, крупам, муке и т.п. Если герметичную емкость, с находящимися в ней продуктами, через шланг, доходящий до дна этой емкости, наполнить газообразной углекислотой то вредители продуктам уже будут не страшны, а качество продуктов при хранении будет ухудшаться в меньшей мере, чем без углекислоты.Электрическая сварка металлов в среде углекислоты
Схема наиболее распространенной электродуговой сварки плавящимся электродом в защитной среде углекислоты предусматривает одновременную подачу к сварочному инструменту электродной проволоки, постоянного сварочного тока и углекислоты. Этим способом, в отличие от дуговой сварки без применения углекислоты, можно сваривать конструкции из тонколистовой стали и стыки труб малого диаметра. Для сварки в среде углекислоты используют сварочные полуавтоматы промышленного или нестандартного изготовления. В схему полуавтомата для сварки плавящимся электродом в защитной среде углекислоты включаются источник тока, механизм подачи электродной проволоки, баллон с углекислотой, кабели и шланги для подачи электродной проволоки и углекислоты, а также аппарат управления. Электродуговая сварка плавящимся электродом в защитной среде углекислоты имеет ряд преимуществ перед остальными видами сварки. Этот способ обеспечивает высокую производительность и хорошее качество сварки. При полуавтоматической сварке в среде углекислоты производительность сварки в 2,5- 4 раза выше, чем при ручной сварке без применения углекислоты, а стоимость сварки в 2-3 раза ниже по сравнению с ручной сваркой качественными электродами.Хранение цветов, плодов и овощей в атмосфере углекислоты
Хранение цветов, плодов и овощей в атмосфере углекислоты ослабляет интенсивность жизненного процесса и позволяет сохранить их более длительное время. Для хранения срезанных цветов используется атмосфера углекислоты при температуре 1-5 градусов Цельсия и содержании углекислоты 2-16 % по объему. В этих условиях продолжительность хранения цветов составляет 20 дней и более. В углекислотную атмосферу цветы помещаются после хранения в холодильной камере. При хранении плодов и овощей в атмосфере углекислоты необходимо, чтобы кислород и углекислота содержались в оптимальных пропорциях. Практикой установлено, что при хранении плодов и овощей в атмосфере углекислоты концентрация ее не должна превышать 7-10%, что удлиняет сроки хранения в 2-3 раза. Плоды помещаются в контейнеры или непосредственно в газовые камеры, в которых концентрация углекислоты и температура воздуха поддерживаются на постоянном уровне с помощью слабой вентиляции.Подкормка овощей углекислотой
Применение углекислоты для питания растений основано на процессе фотосинтеза. Листья растений с помощью хлорофилла поглощают углекислоту воздуха и вместе с водой перерабатывают ее в питательные органические вещества, необходимые для их развития и роста. Для усиленного построения органических питательных веществ растения должны получать больше углекислоты. Однако концентрация углекислоты в воздухе незначительна. При искусственном добавлении углекислоты и повышении ее концентрации в воздухе можно повысить интенсивность фотосинтеза в 1,5-3 раза. На этом основан прием агротехники – воздушное удобрение растений в условиях закрытого грунта подкормкой их углекислотой. Многочисленные опыты показывают, что при подкормке углекислотой вес зелени и плодов увеличивается: у огурцов на 74-103%, у томатов до 124%, у бобов на 112%. При получении этих результатов концентрация углекислоты была увеличена с 0,043 до 0, 065%. В других случаях при повышении концентрации углекислоты с 0,06 до 0,11% урожай огурцов увеличился на 36 -75%, редиса – на 33 -77%, томатов –на 18 %. Продолжительность подкормки является фактором, улучшающим возможности прироста урожая. Количество расходуемой углекислоты должно быть пропорционально площади теплицы. Чем меньше расход углекислоты на единицу площади теплицы, тем хуже результаты по приросту урожая и наоборот. К вентилятору подводится шланг, соединенный с баллоном с углекислотой; включенный вентилятор равномерно рассеивает углекислоту по всей площади теплицы. В условиях открытого грунта наиболее целесообразно использовать растворенную углекислоту вместе с поливной водойРазведение декоративных водорослей в аквариумах
Декоративные водоросли, как правило, являются растениями тропических рек и озер, где вода в результате усиленного гниения их органического содержимого имеет повышенную концентрацию углекислоты. Насыщение воды аквариумов углекислотой из малолитражных углекислотных баллонов (2-5 л.) позволяет значительно повысить условия содержания декоративных водорослей в аквариумах.Получение сухого льда из жидкой углекислоты
При получении сухого льда желательно баллон с жидкой углекислотой охладить до возможно более низкой температуры для уменьшения потерь жидкой углекислоты на испарение. К вентилю баллона с жидкой углекислотой прикрепляется небольшой мешок из плотной двойной ткани, обладающей хорошими теплоизолирующими свойствами, так чтобы он плотно охватывал отверстие вентиля. Баллон устанавливается на подставке вертикально вентилем вниз или горизонтально с уклоном в сторону вентиля. При выходе из баллона углекислота, быстро испаряясь, образует снег, имеющий температуру – 78 градусов Цельсия. Выпускать углекислоту нужно медленно, толчками, открывая и закрывая вентиль. При быстром и непрерывном выходе углекислоты из баллона снег формируется плохо. Собранный снег можно собирать и прессовать прессом или домкратом в плотную массу /сухой лед/ для уменьшения его испарения. Полученный сухой лед применяется для замораживания, охлаждения и хранения продуктов. Удобно производить гибку труб, с замороженной в них сухим льдом, водой. При смешивании сухого льда с эфиром температура смеси понижается до -100 градусов Цельсия, что используется при ремонте автомобилей и другой техники, для холодной посадки металлических деталей.Замораживание бородавок
Углекислый снег, получаемый при выходе углекислоты из углекислотного баллона (углекислотного огнетушителя) с жидкой углекислотой, собирают в замшевый мешочек. Для уменьшения испарения снег завертывают в полотенце, вату. Снег из мешочка набирают в полую трубочку, диаметром в соответствии с величиной удаляемого кожного дефекта и с помощью поршня спрессовывают в плотный снежный столбик. Набрав снег в трубочку, ставят ее в вертикальное положение и сильным нажимом поршня плотно прессуют снег, чтобы его поверхность была гладкой. Для замораживания дефекта углекислый снег прикладывают к коже с легким давлением, иначе между кожей и снегом будет образован слой газообразной углекислоты, являющийся плохим теплопроводником и замораживание кожи не произойдет. Воздействие холодом более 20 сек. может вызвать воспаление кожи с образованием пузыря, поэтому продолжительность замораживания нужно выбирать с осторожностью. Бывают случаи когда одного сеанса недостаточно и замораживание повторяют с интервалом 3-5 дней.gidro.tech-group.pro


