Защита алюминия от окисления: Как защитить алюминий от коррозии и окисления — все способы
alexxlab | 28.05.2018 | 0 | Разное
Алюминий – металл с большой реакционной способностью, окисляется при нормальных условиях в окружении кислорода. В обычном состоянии алюминиевые изделия покрыты оксидной пленкой, которая немного защищает металл. Спонтанно образовавшийся оксид алюминия покрывает поверхность неравномерно, сцепление с субстратом не всегда прочное. Защищенность металла самопроизвольно сформированным покрытием из оксида ненадёжна.
Коррозию алюминия инициируют кислород, влага. Катализируют процесс агрессивные среды, присутствие рядом некоторых металлов, материалов. Защита алюминия от коррозии сводится к нивелированию действия инициирующих, катализирующих влияний. Нейтрализовать внешнюю агрессию можно следующими методами:
- формированием на поверхности специального покрытия из целенаправленно полученного оксида;
- окрашиванием внешнего слоя.
Анодное оксидирование алюминия
Реакцию образования экранирующего слоя можно проводить электрохимически. Процесс реализуют поэтапно.
Подготовка к анодированию. Изделие очищают от жирового налета погружением в раствор щавелевой кислоты. Затем промывают водой, окунают в раствор щёлочи для удаления слоя оксидов, неравномерно образовавшегося ранее.
Материал погружают в электролитический раствор сульфатной (серной) кислоты строго обозначенной плотности. В международной литературе эту кислоту называют дигидрогенсульфатом. Алюминиевый объект подключают к положительному полюсу источника электроэнергии. Поэтому процесс называют анодным. Катод сделан из свинца. Через рабочий раствор начинают пропускать ток определенной плотности при указанном напряжении. Огромное значение на плотность и цвет оксидного покрытия оказывает температура раствора.
Пониженная температура способствует образованию плотной пленки красивого насыщенного цвета. Повышенная температура приводит к формированию рыхлой бесцветной пленки, требующей последующего окрашивания. Охлаждение рабочей ванны – процесс энергоемкий. Решение о режиме проведения оксидирование принимают, основываясь на полученное техническое задание.
Для получения дополнительного окрашивания конструкцию можно погружать в подобранные растворы солей. Сформировавшееся покрытие в большем или меньшем количестве содержит поры. Для их закупоривания алюминиевый материал подвергают действию паров или кипящих растворов воды.
Завершает обработку просушивание материала, его упаковка.
В некоторых технологиях в качестве рабочего электролита используют вместо серной кислоты хромовокислый или щавелевокислый растворы. Согласно статистике в мире таким методом защищают меньшую часть алюминиевых конструкций.
Окрашивание алюминиевой продукции
Большую часть производимых изделий предохраняют нанесением слоя красящих веществ. Если красители растворены, то крашение называют мокрым. Если красители сухие, процедуру часто называют порошковым окрашиванием.
Мокрое окрашивание
Нанесение лакокрасочных слоёв возможно после защиты алюминия пассивирующим грунтом, в состав которых входят соединений цинка, стронция. Грунт наносят в две стадии на скрупулезно подготовленную металлическую основу. После полного испарения растворителя из грунтовочной смеси поверхность покрывают изолирующим внешним слоем масляного или глифталевого лака. Существуют функциональные лакокрасочные составы, защищающие от химических реагентов, от бензина, масел. Для получения цветных декоративных конструкций используют молотковые лаки. При некоторых технологиях защиты наносят бакелитовый лак под давлением, чтобы гарантированно заполнить все микропоры. Выбор покрытия обусловлен будущими условиями эксплуатации. Технология нанесения постоянно совершенствуется.
Порошковое окрашивание
Для использования этого метода металл также нужно очистить от слоя жира, других включений. Подготовку проводят погружением в щелочные, слабощелочные (почти нейтральные), кислотные растворы. Для повышения эффективности очистки иногда добавляют смачиватели.
Следующей стадией подготовки некоторых алюминиевых конструкций является формирование конверсионного слоя обработкой хроматными, фосфатными составами. Иногда используют циркониевые, титановые соединения. Необходимость этого этапа определяется специфическими особенностями изделия. Это вопрос компетенции технологов. Выполнение каждого этапа обработки чередуется с обязательным промыванием и сушкой материала.
Затем наносят полимер, выполняющий защитную функцию. Широко используют полиэфиры. Они образуют плотный слой, стойкий к химическому, механическому, термическому воздействию. Покрытия из полимеризованного уретана обладают большей твердостью. Применяют также эпоксидные, полиэфирно-эпоксидные, акриловые порошки – краски. Они формируют поверхность любого заданного цвета, структуры, способностью отражать световые лучи. Красящий порошок наносят электростатическим или трибостатическим методом.
Электростатически частицы пигмента в воздухе (флюиды) заряжают действием электродов. Трибостатически крупинки краски заряжаются благодаря силе трения, продуцируемой специальным пистолетом. Процесс реализуют в камерах. Неиспользованный порошок собирается, возвращается в исходное место. Стадия завершается полимеризацией при высокой температуре.
Оба вида окрашивания алюминия позволяют получать цвета, соответствующие международным стандартам. Некоторые производственные требования обуславливают необходимость последовательного сочетания двух методов: анодного оксидирования и окрашивания. Количество, суть используемых методов определяются специалистами.
Нивелирование влияния соседствующих материалов
Стимулировать коррозию алюминия могут металлы, материалы, находящиеся рядом. Для предотвращения этого эффекта рядом с алюминиевыми конструкциями позволительно нахождение только нержавеющей или оцинкованной стали. Могут предотвратить контакт прокладки из резины, паронита, битума. Алюминиевые конструкции не должны соприкасаться с бетоном, кирпичом, камнем, деревом. Для защиты рекомендован лак, любые другие изолирующие материалы.
Коррозия алюминия и способы борьбы с ней (+22 фото)
Алюминий – широко распространенный в промышленности и быту металл. Окисление алюминия на воздухе не происходит. Его инертность обусловлена тонкой оксидной пленкой, защищающей его. Однако под влиянием определенных факторов из окружающей среды этот метал все же подвергается разрушительным процессам, и коррозия алюминия — не такое уж и редкое явление.
Виды коррозии
Окисляется алюминий в атмосфере быстро, но на небольшую глубину. Этому препятствует защитная окисная пленка. Окисление ускоряется выше температуры плавления алюминия. Если нарушается целостность оксидной пленки, алюминий начинает корродировать. Причинами истончения его защитного слоя могут стать различные факторы, начиная с воздействия кислот, щелочей и заканчивая механическим повреждением.

Коррозия алюминия – саморазрушение металла под воздействием окружающей среды. По механизму протекания выделяют:
- Химическую коррозию – происходит в газовой среде без участия воды.

- Электрохимическую коррозию – протекает во влажных средах.

- Газовое разрушение – но сопровождает нагрев и горячую обработку алюминия. В результате взаимодействия кислорода с металлами возникает плотная окисная пленка. Вот почему алюминий не ржавеет, как и все цветные металлы.

На видео: электрохимическая коррозия металлов и способы защиты.
Причины коррозии алюминия
Коррозионная стойкость алюминия зависит от нескольких факторов:
- чистоты – наличия примесей в металле;
- воздействующей среды – алюминий может одинаково подвергаться разрушению и на чистом сельском воздухе и в промышленно загрязненных районах;
- температуры.
Во многих случаях малоконцентрированные кислоты могут растворить алюминий. От возникновения коррозии не защищает естественная окисная пленка.
Мощные разрушители – фтор, калий, натрий. Алюминий и его сплавы корродируют при воздействии химических соединений брома и хлора, растворов извести и цемента.

Коррозия алюминия и его сплавов происходит в воде, воздухе, оксидах углерода и серы, растворах солей. Морская вода приводит к ускоренному разрушению. Алюминий считается активным металлом, но при этом отличается хорошими коррозионными свойствами.
Выделяют два основных фактора, которые влияют на интенсивность коррозийного процесса:
- степень агрессивности воздействующей окружающей среды – влажность, загрязненность, задымленность;
- химическая структура.
Алюминий не подвергается коррозии в чистой воде. Не влияют на защитную оксидную пленку нагревание и пар.
Проявление коррозии алюминия
Выделяют следующие виды коррозии алюминия и его сплавов:
- Поверхностная – наиболее распространенная, приносит наименьший вред, легко заметна и быстро поддается устранению.
- Локальная – разрушения наблюдаются в виде углублений и пятен. Опасный вид коррозии в силу своей незаметности. Встречается в труднодоступных частях и узлах металлических конструкций.
- Нитеподобная, филигрань – наблюдается под покрытиями из органики, на ослабленных местах поверхности.
Любой из видов коррозии конструкций из алюминия является причиной разрушения.

Это сокращает срок эксплуатации изделий. В гальванической паре алюминий может корродировать, при этом он защищает другой металл.
Естественных антикоррозийных свойств алюминия и его сплавов недостаточно. Поэтому механизмы, агрегаты, конструкции и изделия из металла нуждаются в дополнительной защите.
Способы борьбы с коррозией
Защита от коррозии производится несколькими способами:
- Механическое лакокрасочное защитное покрытие.
- Электрохимическая защита – покрытие более активными металлами;
- Покрытие алюминия порошковыми составами, так называемый процесс аллюминирования;
- Высоковольтное анодирование;
- Химическое оксидирование;
- Применение ингибиторов коррозии.

Механическое покрытие
Как защитить алюминий от коррозии? Чаще всего применяют механический способ – нанесение слоя краски.

Покройте краской изделие и вы убедитесь в действенности этого способа. Окрашивание бывает мокрым и сухим, или порошковым. Эти технологии усовершенствуются. При мокром окрашивании лакокрасочные слои наносят после защиты алюминия составом, содержащим соединения цинка и стронция. Металлическую основу тщательно подготавливают: защищают, шлифуют, сушат. Грунт наносят поэтапно.

Когда растворитель из грунтовочной смеси полностью исчезнет, поверхность можно покрывать изолирующим составом: масляным или глифталиевым лаком.

Специальные составы помогают остановить коррозию и защищают алюминиевые конструкции от химикатов, бензина, различного вида масел. Выбор покрытия зависит от условий последующей эксплуатации металлического изделия:
- молотковые – применяют для получения конструкций различных цветовых оттенков, используемых в декоре;
- бакелитовые – наносят под высоким давлением, заполняя микротрещины и поры.
Порошковое окрашивание требует тщательной очистки поверхности от жира и различных отложений. Это достигается погружением в щелочные или кислотные растворы с добавлением смачивателей. Далее на алюминиевые конструкции наносится слой хроматных, фосфатных, циркониевых или титановых соединений. После этого он не будет окисляться.
После просушки материала на окислившийся участок наносят защитный полимер. Чаще всего используются полиэфиры, стойкие к механическому, химическому и термическому воздействию. Применяют полимеризованный уретан, эпоксидные и акриловые порошки.
Оксидирование алюминия
Оксидирование алюминия протекает при постоянном токе под напряжением 250 В. Наращивание защитной пленки происходит при комнатной температуре с водяным охлаждением. Не требуется импульсного источника. Пленки получаются плотными и прочными в течение 45-60 минут.
На плотность и цвет оксидного покрытия влияет температура электролита:
- пониженная температура образует плотную пленку яркого цвета;
- повышенная – формирует рыхлую пленку, требующую дальнейшей окраски.
Образовать защиту алюминия от коррозии можно электрохимической реакцией. Процесс разделен на несколько этапов:
1. На стадии подготовки алюминиевое изделие обезжиривают, погружая его в раствор щавелевой кислоты.

2. После промывания водой опускают в щелочной раствор, чтобы удалить неравномерно образовавшийся оксидный слой.
3. Для дополнительной окраски алюминиевые изделия погружают в соответствующие растворы солей. Чтобы заполнить образовавшиеся поры, металлический материал обрабатывают паром.

4. Затем изделие подвергают сушке. Анодное оксидирование может проводиться с применением переменного тока.
Для защиты от коррозии применяют химическое оксидирование – менее затратное, не требующее специального электрического оборудования и квалификации исполнителей. Используется несложный химический состав.
В процессе алюминирования полученная оксидная пленка толщиной в 3 мкм имеет салатный цвет, обладает высокими электроизоляционными свойствами, не пориста, не окрашивается.
Коррозия алюминия возникает вследствие находящихся рядом металлов, которые окислились. Предотвращению этот процесса способствует изоляция. Это могут быть прокладки из резины, битума, паронита. При покрытии ржавчиной применяются лак и другие изолирующие материалы. Других способов избавиться от этой проблемы пока нет.
Три способа удалить окисную плёнку с поверхности алюминия (1 видео)
Материалы для обработки алюминия (22 фото)
Что использовать для защиты алюминия от коррозии
 Что использовать для защиты алюминия от коррозии
Что использовать для защиты алюминия от коррозии
Такой металл, как алюминий, а также его сплавы различаются прекрасной устойчивостью к разрушениям разного вида. Но несмотря на это коррозия алюминия является достаточно нередким явлением. Разные типы коррозии представляют собой главную причину порчи подобных материалов.
Для борьбы с процессами разрушения требуется в любом случае понимать условия, которые и представляют собой причины их появления. Коррозия алюминия – это особая реакция, которая имеет место между окружающей средой, а также металлом.
Такой процесс может иметь и химическое, и естественное происхождение. Самой популярной разновидностью уничтожения металла можно с уверенностью называть воздействие на его поверхность процесса ржавления. По этой причине требуется защита алюминия от коррозии.
Общие сведения
Особенностью всех типов металлов можно называть их характеристику входить в реакцию с Н2О, а еще окружающей средой. Различием для всех видов металлом считается лишь интенсивность этого вида процесса. Например, у благородных металлов наподобие золота скорость этой реакции не будет очень быстрой, а вот железо, и алюминий в том числе, будут реагировать на воздействия этого характера крайне быстро. Можно выделить пару факторов, которые оказывают непосредственное воздействие на интенсивность протекания коррозионного процесса. Одним из них можно называть уровень агрессивности окружающей среды, а также химическую или металлургическую структуру. Атмосфере, которая окружает нас, всегда характерен установленный уровень влаги. Помимо этого, ей будет характерен отдельный уровень отходов и загрязнений.
Если учитывать, что атмосферные характеристики часто определяются по региону, а также уровнем индустриализации, на данный момент можно отметить:
 Сельская местность (небольшой уровень загрязнений и средняя степень влажности).
Сельская местность (небольшой уровень загрязнений и средняя степень влажности).- Области около моря (средний уровень загрязненности, а также высокий уровень влаги).
- Городская местность (степень влажности средняя, а также уровень продуктов распадов топлива жидкого типа, окислов углерода и серы тоже средний).
- Индустриальные и промышленные зоны (большое количестве окислов углерода, кислот и серы, а еще средний уровень влаги).
Для большого количества случаев, кислоты неорганического типа, даже при малой концентрации способы растворять алюминий. И даже пленка натурального происхождения оксида алюминия не способа стать достаточной защитой от появления коррозионных процессов. Самыми мощными растворителями можно называть калий, фтор и натрий. Более того, алюминию характерна достаточно низкий уровень сопротивляемости к соединению брома и хрома. Достаточно агрессивные к разным сплавам алюминиевых металлов будут цементные и известковые растворы.
Можно выделить несколько видов коррозионных алюминий и его сплавов:
- Поверхностная. Такой тип разрушений встречается чаще всего и является менее вредоносным, чем остальные. Его лучше поменять на поверхности. Это дает возможность применят предохранительные средства, а поверхностные разрушения крайне часто встречаются на анодированном профиле для строительства.
- Локальная. Эти виды разрушений проявляется в виде форм, пятен и углублений. Такая разновидность коррозии бывает междукристаллического и поверхностного типа. Разрушения этого характера являются крайне опасными, по причине того, что их весьма сложно обнаружить. Такой тип коррозии крайне часто разрушают именно труднодоступные части узлов и конструкций.
- Филигранная или нитеподобная. Этот тип разрушений алюминия часто появляются под покрытием органических видов, а еще на граничных обрабатываемых поверхностях. Коррозия нитеподобного типа появляется в ослабленных местах повреждения покрытия органического вида или краях отверстий.
Достаточно часто, естественных антикоррозийных способностей сплавов и самого алюминия для защиты от разрушений бывает крайне недостаточно. А вот длительный эксплуатационный период изделий из таких металлов, и в обязательно порядке требуется применять дополнительные способы защиты.
К самым популярным методами протекции металлов от коррозии можно относить:
- Анодированное окисление (исследования специалистов из Германии показывают, что такой тип защиты применяется на 15% от основного количества производства строительных профилей в мире).
- Покрытие поверхности металла составами порошкового типа.
- Защита от контактирования с остальными металлами.
Рассмотрим подробнее все способы защиты алюминия от коррозии
Анодирование
Именно анодированное покрытие может представлять собой покрытие, которое создает на поверхности алюминия довольно прочную пленку из алюминия оксида, которая не поддается воздействию агрессивной среды. Подобная обработка дает возможность создавать на поверхности металлов аналогичный слой пленки, который просто не оставит алюминию возможность контактировать со внешней средой и ограждает его пот окислительных процессов.
Защиты от контактов с остальными металлами
 При соприкосновении с остальными металлами, алюминий и сплавы алюминия способы составить гальваническую пару. Такое соприкосновение часто может становиться причиной образования коррозии. Для того, чтобы избежать появления таких процессов, требуется применять на изделиях из такого металла крепления, которые сделаны лишь из оцинкованной и нержавеющей стали.
При соприкосновении с остальными металлами, алюминий и сплавы алюминия способы составить гальваническую пару. Такое соприкосновение часто может становиться причиной образования коррозии. Для того, чтобы избежать появления таких процессов, требуется применять на изделиях из такого металла крепления, которые сделаны лишь из оцинкованной и нержавеющей стали.
Полимерные разновидности покрытий
Одним из самых действенных методов антикоррозионной защиты алюминиевых конструкций, а также изделий из сплавов считается покрытие поверхностей посредством различных красок и полимерных видов составов. Постоянное возрастание спроса на изделия и металла, а также огромная цветовая гамма изделия из такого материала будет являться причиной того, что способы и техника нанесения подобных покрытий постоянно улучшаются и становится совершенными с технологической стороны.
Обратите внимание, что современные материалы, посредством которых на поверхность алюминия наносят защитное покрытие, сделаны из растворителей, вяжущих материалов и красителей. Лакокрасочные материалы, в которых нет растворителя, называют порошковыми, а те, в составе которых все же есть растворитель, называют мокрыми красками.
Методы окрашивания, которые применяют современные компании-изготовители, можно поделить на:
- Покрытие на «мокрые поверхности» проводят посредством применения двухкомпонентного лакокрасочного материала с отвердителем, которая в технической информации к материалам часто называют как РUR-Lасk DD краска.
- Порошковые покрытия, которые наносят способом обычного напыления на один слой или даже насухую.
Также хочется отметить, что алюминий сам по себе обладает прекрасными характеристиками устойчивости к коррозионному процессу. Но при контактировании с электричеством или остальными металлами, все же подвергается разным процессам разрушительного типа. Лучшими методами защиты такого металла и его сплавов будет считаться анодирование и нанесение порошкового вида.
Считается, что алюминий не подвергается воздействию коррозии, но это не так. Алюминий –металл, обладающий высокой реакционной способностью. Под воздействием кислорода и влаги он окисляется. Данный процесс ускоряется за счет агрессивных сред и наличия рядом с алюминием некоторых материалов. В результате металл темнеет и покрывается рыхлым слоем окислов. Попробуем разобраться, как очистить алюминий от окисления и что для этого нужно.
Как правильно мыть алюминиевую посуду
Среди всех видов кухонных принадлежностей большинство хозяек выбирает алюминиевую посуду. Это легко объяснить – этот металл очень быстро нагревается, нагрев равномерный, посуда хорошо выдерживает износ, имеет легкий вес, что очень удобно в процессе эксплуатации.
Алюминиевые изделия отличаются ярким блеском, но со временем этот блеск теряется – металл покрывается жиром, белым налетом или темными пятнами.

Для очистки кухонной утвари большинство женщин использует обычное средство, предназначенное для мыться посуды. Эффект, конечно будет, но незначительный. Есть несколько секретов, позволяющих отмыть алюминий более эффективно:
- Мыть нужно лишь полностью остывшую посуду. Если намочить горячий металл, то существует риск деформаций.
- Если внутри кастрюли имеются пригоревшие остатки продуктов, то кастрюлю заливают теплой водой и добавляют в нее моющее средство. Далее воду нужно оставить примерно на час. После этого пригоревшие остатки пищи легко отойдут.
- Не стоит пытаться очищать посуду кислотами и щелочами – после такой очистки на поверхности могут образовываться темные участки. Нужно помнить, что щелочь и кислота лишают алюминий блеска.
- Отмывать изделия из этого металла лучше вручную – если моют с применением жестких щеток и металлических губок, то на поверхности обязательно останутся следы.

На видео: как отмыть алюминиевую кастрюлю от гари и жира.
Чем очистить алюминий от продуктов коррозии и окиси
Давайте посмотрим, как убирать коррозию, окисления, нагар, налет и прочие загрязнения:
- Для борьбы с темными пятнами пойдет кислое молоко, кефир, а также рассол. Любым из этих средств заливают дно и оставляют на 12 часов. Затем нужно обильно промыть изделие под проточной холодной водой. Далее все потемнения отмоются обычной тряпкой.

- Нагар хорошо убирает кислое яблоко, можно использовать и лимон. Для этого его разрезают пополам и трут половиной поверхность, которую нужно очистить. За счет воздействия кислот нагар можно очень быстро удалить.

- Удалять окись можно с помощью соли и теплой воды. Раствор готовят в одинаковых пропорциях. Температура воды может быть любой, самое главное, чтобы соль в ней полностью растворилась. Далее при помощи этого раствора и губки можно очищать поверхность.

Уксус – эффективное средство
Данный метод ухода за алюминиевой посудой и изделиями достаточно простой и эффективный. Нужно взять уксус или уксусную эссенцию. В жидкости смачивают салфетки и очищают загрязненный участок. Уксус легко уберет окиси разной сложности.

Если грязь не поддается, то обрабатываете деталь в кипящем уксусе. Жидкость доводят до кипения, а затем остужают. Когда уксус остынет, то можно заняться очисткой обрабатываемой детали. Если загрязнение сильное, то изделие кипятят в уксусе.
Сода и клей против застарелых окислов
Чистить окислы и нагар можно при помощи этих веществ. В домашних условиях можно приготовить очень сильное средство, которое не только сделает алюминиевую деталь чистой, но и придаст ей новый вид. В емкость наливают горячую воду, а затем в нее добавляют пищевую соду и клей. Ингредиенты берут в следующих пропорциях – на 10 л воды нужно 100 г соды и 100 г канцелярского клея. Все компоненты нужно тщательно перемешать.

Также нужен небольшой брусок обычного мыла, натрите его на терке и добавьте в воду с клеем и содой. Обрабатываемую деталь кладут в готовый раствор на 2-3 час. Затем, когда пройдет время, нужно промыть изделие в воде и насухо вытереть салфетками. Этот способ позволит удалить окисную плёнку.

Рецепты из гаража
Некоторые детали автомобилей также изготавливаются из алюминия. Нередко они подвергаются окислению и требуют очистки. Автолюбители разработали эффективные способы, позволяющие очистить детали даже от сложных окислов:
- На 2 столовые ложки соды берут литр воды. Изделие погружают в раствор, а затем кипятят. Процесс следует контролировать. Уже после 10 минут очищения появляется видимый эффект. Для придания идеальной чистоты алюминию может понадобиться несколько кипячений.

- Убрать окисную пленку с алюминия можно с помощью буры. На 10 г вещества нужно несколько капель нашатырного спирта. Достаточно нанести раствор на поверхность алюминиевых деталей и дать ему высохнуть (примерно 30 минут). После этого деталь протирают сухой тряпкой.

- Хорошо очищает алюминий едкий натр. Нужно приготовить раствор: на 1 литр воды берут 1-2 чайной ложки едкого натра. В полученную смесь кладут деталь – образуется бурная химическая реакция. Уже через пять минут на поверхности не будет и следа оксидной пленки. Далее остается только промыть водой обработанные детали.

- Также обрабатывают детали из данного металла кока-колой. Очистка займет определенное время, но при этом напиток эффективно удалит ржавчину, окисление, грязь. Если должного эффекта не наступило, можно прокипятить деталь в кока-коле.

На видео: полироль для очистки алюминия.
Анодирование как способ защиты алюминия
Чтобы не приходилось постоянно чистить изделия из алюминия, можно защитить поверхность, применив технологию анодирования. Так, на деталях формируют плёнку из оксидов, а также окрашивают внешний слой. Сначала деталь чистят от налета, для этого ее шкурят, погружают в щавелевую кислоту и промывают водой.
Затем готовят специальный раствор — электролит. Для этого нужно в пластиковую емкость подходящего размера налить дистиллированную воду и серную кислоту в пропорции 1:1. В качестве последней подойдет электролит для свинцового аккумулятора, который можно приобрести в автомагазине.

Важно! При смешивании воды и серной кислоты нужно быть максимально осторожным. Используйте плотные резиновые перчатки и защитные очки, так как в процессе смешивания компонентов происходит бурная реакция.

Дальнейшая обработка будет проводиться электрохимическим методом. Для этого источник питания подключается таким образом: плюсовой провод идет на обрабатываемое изделие, а минусовой контакт — на ванну с электролитом. То есть через раствор пропускают электричество, а на алюминиевой детали начнет оседать оксидная пленка. Время процедуры — примерно 30 минут, после чего деталь достается из емкости и тщательно промывается.

С помощью оксидирования создается надежная защита. Деталь, покрытая такой пленкой, также будет иметь привлекательный внешний вид. Нанести ущерб данному покрытию достаточно сложно, а значит, защита будет максимально долговечной.
Три способа удалить окисную плёнку с поверхности (1 видео)
Все методы и средства (23 фото)
Хотя алюминий является цветным металлом и, в сравнении с обычной сталью, стоит относительно дорого, используется он человеком достаточно широко. Применяться этот прочный и легкий материал может в быту, в строительстве, на производстве. Химическая формула алюминия в таблице Менделеева выглядит так: Al.
Подвержен ли коррозии
Ржавеет алюминий, как известно, очень медленно. По крайней мере, железо и сталь с ним в этом плане сравниться не могут. Объясняется стойкость алюминия к коррозии прежде всего с тем, что при обычных условиях на его поверхности образуется тонкая оксидная защитная пленка. В результате химическая активность алюминия резко снижается.
Факторы, влияющие на устойчивость к ржавлению
К коррозии алюминий устойчив, но в некоторых случаях он все же может начать довольно-таки быстро разрушаться из-за окисления. Происходит это обычно при повреждении по каким-либо причинам пленки или невозможности ее образования.
Чаще всего внешней тонкой защиты алюминий лишается под воздействием кислот или щелочей. Также причиной разрушения пленки могут стать и обычные механические повреждения.
Виды коррозии
После разрушения пленки Al и его сплавы начинают ржаветь, то есть саморазрушаться, как и многие другие металлы. При этом подвергаться может алюминий и коррозии:
Химической. В этом случае ржавление происходит в газовой среде без воды. В этом случае поверхность алюминиевого изделия разрушается равномерно по всей площади.
Электрохимической. Коррозия алюминия в данном случае протекает во влажной среде.
Газовая. Этот вид коррозии возникает тогда алюминий непосредственно контактирует с каким-нибудь химически агрессивным газом.

Уравнение коррозии алюминия (окисления кислородом) на воздухе выглядит следующим образом: 4AI+3O2=2AL2O3.
Химическая формула оксидной защитной пленки – AL2O3.
Сплавы
Самой устойчивой к коррозии разновидностью является технический алюминий. То есть практически чистый 90% металл. Сплавы алюминия, к сожалению, ржавлению подвержены гораздо больше. При этом считается, что меньше всего коррозийную устойчивость этого металла снижают примеси магния, а больше всего — меди.
Сплавы Mg-Al
Такие материалы широко используются в строительстве, пищевой и химической промышленности. Также их очень часто применяют в машиностроении. Считается, что неплохо подобные материалы подходят и для возведения сооружений, подвергающихся воздействию морской воды.
В том случае, если магния в состав сплава входит не более 3%, антикоррозийные свойства он будет иметь практически такие же, как и технический алюминий. Магний в таком сплаве находится в твердом растворе и в виде частиц Al8Mg5, равномерно распределенных по всей матрице.

Если этого металла в сплаве содержится больше 3%, частицы Al8Mg5 начинают выпадать по большей мере не внутри зерен, а по их границам. А это, в свою очередь, крайне негативно сказывается на антикоррозийных свойствах материала. То есть изделие становится гораздо менее устойчивым к ржавлению.
Сплавы с магнием и кремнием
Такие материалы чаще всего применяются в машиностроении и в строительстве. Mg2Si делают сплавы этой разновидности очень прочными. Иногда составляющим подобных элементов является и медь. Ее также вводят в сплав для упрочения. Однако добавляют медь в такие материалы в очень небольших количествах. Иначе антикоррозийные свойства алюминиевого сплава могут сильно понизиться. Межкристаллическое ржавление в них начинается уже при добавлении свыше 0.5% меди.
Также склонность к коррозии у таких материалов может возрастать при неоправданном увеличении количества входящего в их состав кремния. Это вещество добавляют в алюминиевые сплавы обычно в таких пропорциях, чтобы после образования Mg2Si не оставалось ничего лишнего. Кремний в чистом виде содержат лишь некоторые материалы этой разновидности.

Коррозия алюминия и его сплавов с цинком
Ржавеет Al, как уже упоминалось, медленнее, чем его сплавы. Касается это в том числе и материалов группы Al-Zn. Такие сплавы очень востребованы, к примеру, в самолетостроении. Некоторые их разновидности могут содержать медь, другие нет. При этом первый тип сплавов, конечно же, является к коррозии более устойчивым. В этом плане материалы Al-Zn сравнимы с магниево-алюминиевыми.
Сплавы этой разновидности с добавлением меди проявляют признаки некоторой неустойчивости к ржавлению. Но при этом разрушаются из-за коррозии они все же медленнее, чем изготовленные с использованием магния и Cu.

Основные способы борьбы с ржавлением
Конечно же, снизить скорость коррозии алюминия и его сплавов можно в том числе и искусственным путем. Способов защиты таких материалов от ржавления существует всего несколько.
К примеру, исключить контакт этого металла и его сплавов с окружающей средой можно путем окрашивания ЛКМ. Также для защиты алюминия от ржавления часто применяется электрохимический способ. В этом случае материал дополнительно покрывается слоем более активного металла.
Еще один способ защиты Al от ржавления — это высоковольтное оксидирование. Также для предотвращения коррозии алюминия может использоваться методика порошкового окрашивания. Применяют для его защиты, конечно же, и ингибиторы ржавления.
Как производится оксидирование
С использованием такой методики алюминий и его сплавы от коррозии защищают достаточно часто. Выполняют оксидирование под напряжением в 250 В. При применении такой методики на поверхности металла или его сплава образуется прочная оксидная пленка.
Воздействие на материал током в данном случае производится с использованием водяного охлаждения. При низких температурах из-за напряжения пленка на поверхности алюминия образуется очень прочная и плотная. Если же процедура производится при высоких температурах, она получается достаточно рыхлой. Обработанный в такой среде алюминий нуждается в дополнительной защите от контакта с воздухом (окрашивании).

Изделие при использовании такой технологии сначала обезжиривают в растворе щавелевой кислоты. Затем алюминий или сплав опускают в щелочь. Далее, на металл воздействуют током. На заключительном этапе, если оксидирование проводилось при достаточно высокой температуре, материал дополнительно окрашивают с погружением в растворы солей, а затем обрабатывают паром.
Использование ЛКМ
Этот способ, как и оксидирование, применяется для защиты алюминия от ржавления достаточно часто. Окрашиваться такой материал может по сухой, влажной методике или порошковым способом. В первом случае алюминий сначала обрабатывают составом, содержащим цинк и стронций. Далее, на металл наносят собственно сам ЛКМ.
При использовании порошкового способа рабочую поверхность предварительно обезжиривают путем погружения в щелочные или кислотные растворы. Далее, на изделие наносятся хроматные, циркониевые, фосфатные или титановые соединения.
Использование изоляторов
Очень часто стимуляторами начала коррозийных процессов в алюминии и его сплавах становятся другие металлы. Так происходит обычно при прямом контакте изделий или их частей. Чтобы предотвратить ржавление алюминия, в этом случае используются специальные изоляторы. Изготавливаться такие прокладки могут из резины, паронита, битума. Также в данном случае могут использовать лаки и краски. Еще одним способом защитить алюминий от коррозии при контакте с другими материалами является покрытие его поверхности кадмием.

В особенности важно обеспечить изоляцию алюминиевых деталей в разного рода механизмах и узлах от прямого соприкосновения с медью. Также считается, что защищать от контакта с другими металлами следует не только собственно детали, изготовленные из Al. В плане устойчивости к коррозии железо алюминию, как и сталь, к примеру, сильно уступает. Поэтому такие металлы и некоторые другие часто защищают особым образом. Материалы просто покрывают защитным алюминиевым слоем. От контакта с медью или другими металлами, конечно же, нужно беречь и такие изделия.
20 лучших народных и химических средств
В каждом доме можно найти изделия, которые изготавливаются из прочного алюминия. Чаще всего из такого металла делаются сковородки, кастрюльки, фурнитура, раковины и оконные рамы. Со временем алюминиевая поверхность окисляется, и поэтому каждый человек должен знать все особенности очистки алюминия от окислов.
Особенности материала
Алюминием называют металл, поверхность которого окрашена в серебристый цвет с легким белым оттенком. Этот материал имеет определенные особенности, с которыми следует заранее ознакомиться. К ним относят следующее:
- Высокий уровень плотности. Изделия, сделанные из такого металла, очень прочные и не подвергаются механическим повреждениям.
- Хорошая теплопроводность. Этот показатель почти такой же, как у серебра, золота или меди.
- Защищенность от коррозийного налета. Алюминиевые конструкции никогда не ржавеют, однако вместо ржавчины на их поверхности может появиться окись.
Как почистить в домашних условиях
Есть несколько эффективных средств, которые помогут в домашних условиях прочистить алюминиевую поверхность от образовавшегося окисла.
Сода
Чтобы устранить окисление, появившееся на алюминиевой поверхности, можно воспользоваться пищевой содой. Главным достоинством такого средства считается его доступность, так как содовый порошок есть практически в каждом доме.
Прежде чем приступить к устранению окислов, необходимо приготовить раствор. Для этого в 300-400 миллилитров водички добавляется 150 грамм соды. Смесь размешивают до образования густоватой кашицы. Приготовленным составом обрабатывают поврежденную поверхность и смывают ее водой.
Кока-кола
Многие считают, что газированные напитки можно использовать только в качестве питья, но это не так. Домохозяйки используют их для удаления ржавчины и окислений с металлических поверхностей. Среди наиболее эффективных напитков выделяют Кока-колу, которая поможет восстановить алюминиевое изделие. Чтобы устранить окислы, поврежденное покрытие помещают в емкость с шипучей жидкостью и оставляют на 40-60 минут. Если окислений много, процедуру продлевают до 2-3 часов.
Щавель
Некоторые пользуются только щавелевой кислотой, однако устранить окислы помогут даже свежие листочки щавеля. Для начала надо в небольшую кастрюлю поместить пучок с щавельными листками и залить их холодной водичкой. Затем емкость устанавливают на газовую плиту и кипятят на протяжении получаса. Когда жидкость закипит, в ней отмачивают алюминиевое изделие.


Процедура длится полтора часа, после чего отмоченную поверхность прополаскивают и протирают досуха.
Лимонная кислота
К эффективным средствам, которые помогают быстро устранить окисления, относят лимонную кислоту. Ее в количестве двух столовых ложек добавляют в литровую емкость, которая наполнена холодной водой. Затем раствор доводят до кипения, проваривают полчаса и снимают с газовой плиты. Чтобы устранить недавно появившиеся следы окислов, поверхность протирают губкой, смоченной в растворе из лимонной кислоты. Для удаления застарелых окислений изделие придется вымачивать в жидкости.
Яблоко
В свежих яблочках есть микроэлементы, которые способствуют удалению окислившихся пятен с любой металлической поверхности. Пользоваться этим способом очень просто. Достаточно разрезать одно яблочко на две равные части, после чего натереть им окисленный след. Через 40-50 минут обработанное покрытие промывают мыльной жидкостью и высушивают. Если пятна остались, процедуру проводят снова.
Горчичный порошок, уксус и соль
Иногда для устранения почернений на поверхности изделий из алюминия используют средства, приготовленные сразу из нескольких компонентов. Эффективным считается раствор, созданный на основе горчичного порошка, уксуса и соли. Компоненты смешиваются для получения однородной смеси, после чего в ней вымачивают губку и протирают окисление. Через 20 минут после нанесения все смывается подогретой водичкой.


Поваренная соль
Чистка алюминиевой посуды может осуществляться при помощи поваренной соли. Для этого в литр подогретой водички добавляется 85 грамм соли. Компоненты перемешиваются до тех пор, пока частички соли полностью не растворятся в водичке. Затем в жидкости вымачивают тряпочку и протирают загрязненный участок. Перед использованием изделия его надо тщательно сполоснуть, чтобы избавиться от остатков соли.
Кислоты
К эффективным средствам против окислений относят продукты, в составе которых есть натуральные кислоты. Чаще всего люди пользуются огуречным рассолом, простоквашей или обычным кефиром. Любым из перечисленных средств заливают емкость, после чего в ней отмачивают алюминиевую деталь. Через 10-15 часов ее извлекают, прополаскивают и оттирают от остатков окисленных загрязнений.
Винный камень
При устранении потемнений на алюминиевой поверхности часто пользуются винным камнем. Для этого 100 грамм средства растворяют в пяти литрах подогретой водички. В емкость, наполненную жидкостью, помещают изделие и вымачивают его не меньше двух с половиной часов. Затем его достают и протирают сухой губкой, чтобы избавиться от оставшихся следов грязи. Процедуру проводят регулярно, после появления первых темных пятнышек.
Кислое молоко, кефир, рассол
Эти средства содержат в своем составе натуральные кислоты, которые эффективно борются с окислениями. Рассол, скисшее молочко и кефир необязательно смешивать, и поэтому эти средства можно использовать по-отдельности. Их заливают в небольшую кастрюлю, после чего в нее помещается алюминиевая деталь. Она вымачивается около трех часов. Этого достаточно, чтобы устранить даже старые окислы.


Сода и клей
Иногда на металле появляются серьезные окисления, которые сложно устранить. В этом случае лучше пользоваться средством, приготовленным из клея и соды. Чтобы его создать, в кастрюлю заливают четыре литра водички, после чего в нее добавляют 80 грамм соды и 2-3 ложки клеевой жидкости. Приготовленный раствор кипятится сорок минут, а затем созданной жидкостью вытирают деталь из алюминия.
Кетчуп
Убрать незначительные окислившиеся следы поможет обычный кетчуп, приготовленный из томатов. Это необычный метод, которым домохозяйки пользуются не так часто. Главным достоинством этого способа считается то, что после его применения алюминиевая поверхность начнет блестеть.
Чтобы устранить загрязнения, кетчуп наносится на поверхность тонким слоем и оставляется там на 10-15 минут. После этого его смывают проточной водичкой, а деталь протирают сухим полотенцем.
Лук
Окисления, появившиеся на металлической поверхности, можно устранить при помощи обыкновенной луковицы. Чтобы сделать это, в кастрюлю наливают водичку и добавляют несколько головок лучка. Затем смесь кипятят 40-50 минут, после чего в луковой перекипяченной жидкости вымачивают деталь. Также можно не кипятить луковицы, а просто разрезать их и протереть ими загрязненную поверхность.
Гаражные рецепты
Есть несколько гаражных рецептов, которые помогут приготовить средства против окислов.
Кипячение соды
Очистить новые следы окисла поможет обыкновенная кипяченная водичка. Жидкость необходимо заранее закипятить в небольшой кастрюльке. Потом кипяток переливают в тазик, в котором будут отмачиваться все детали, нуждающиеся в очистке. Продолжительность отмачивания длится около 3-4 часов. Затем все изделия промывают и вытирают от остатков водички. Если окислы не исчезли, придется воспользоваться другими, более эффективными средствами.


Бура
Плотную окисленную пленку можно устранить при помощи специальной аптечной буры. Чтобы восстановить алюминиевое изделие, выполняют следующие действия:
- в стаканчик с водой добавляют 10-15 грамм буры;
- размешивают в смеси 3-4 капельки нашатырного спирта;
- обрабатывают металлические покрытие приготовленной жидкостью;
- через сорок минут остатки состава смывают с поверхности.
Едкий натр
Снять слой въевшихся загрязнений можно едким натром. К достоинствам этой процедуры относят то, что ее легко провести в домашних условиях. Средство в количестве 150-200 грамм добавляют в 7-8 литров водички и тщательно перемешивают. Необходимо использовать подогретую водичку, температура которой составляет 60-80 градусов. Приготовленным натровым раствором следует помыть деталь.
Кока-кола
Этот газированный напиток обладает отличными очистительными свойствами, которые помогают восстановить загрязненное алюминиевое покрытие. Несколько литров Колы переливают в кастрюлю. Затем в нее кладут изделие и вымачивают его около часа. За это время потемнение должно полностью исчезнуть.
Если Кола не помогла справиться с окислом, значит, придется применить средство поэффективнее.
Бытовая химия
Наиболее эффективным способом очистки алюминиевой посуды считают использование бытовой химии. Чаще всего используют препарат «Крот», которым пользуются для борьбы с засорами в стоковых трубах. Несколько ложечек порошка добавляют в пол-литра воды. Окислившиеся детали помещают в созданный раствор на две минуты, а затем прочищают их щеткой и мыльным раствором.


Анодирование как способ защиты
При использовании этой методики придется в пластиковую емкость добавить очищенную водичку, смешанную с серной кислотой. Затем специальный источник питания подсоединяют к ванне с электролитом и к обрабатываемой детали. Через электролитический раствор будет пропущено электричество. Процедура длится 35-45 минут, после чего изделие промывают от отслоившейся грязи.
Правила ухода за алюминиевой посудой
Выделяют несколько рекомендаций, которые помогут правильно ухаживать за посудой из алюминия:
- изделия надо мыть после каждого использования;
- храниться посуда должна в помещениях со средним уровнем влажности воздуха;
- во время мытья нельзя пользоваться абразивными средствами.
Заключение
Со временем изделия, изготовленные из алюминия, начинают окисляться и покрываться темными пятнами. Чтобы избавиться от них, придется ознакомиться с распространенными эффективными методами очистки алюминиевых покрытий.
Отраслевая энциклопедия. Окна, двери, мебель
Благодаря превосходному соотношению плотности и механической прочности, а так же достаточно высокой стойкости к коррозии, алюминий широко применяется в строительстве, в том числе при изготовлении светопрозрачных конструкций – окон, дверей, витражей, зимних садов, и так далее. Но, несмотря на коррозионную стойкость алюминиевых конструкций, сам алюминий с точки зрения химической науки – один из самых активных металлов, вступающих в реакцию не только со щелочами и кислотами, но даже с водой. Данное противоречие объясняется тем, что под воздействием кислорода поверхность алюминия покрывается прочной, устойчивой оксидной пленкой (пассивируется), предохраняющей металл от коррозии, то есть от процесса разрушения металлов в результате химического или электрохимического воздействия.

Рис.1. Коррозия алюминиевого профиля
Коррозионная стойкость алюминия
Окись алюминия создает защитный слой, толщина которого составляет 20—100Å, который химически инертен. Чистый алюминий, с поверхностью, очищенной от защитной пленки, реагирует с водой, выделяя при этом водород и создавая оксидную пленку на поверхности. Таким образом, при контакте с окислителями, поверхность алюминия пассивируется. По сути, кислород, содержащийся в воздухе или растворенный в воде, повышает коррозионную стойкость алюминия, которая, в свою очередь, в значительной степени зависит от содержания примесей других металлов. Известно, что при контакте двух металлов, в среде электролита, образуется гальваническая пара, где анодом становится более активный металл, а катодом – менее активный. В результате электрохимической реакции происходит разрушение структуры анода. Большая часть примесей (железо, свинец, медь и т.д.) играют по отношению к алюминию роль катода, способствуя его разрушению. По этой причине чистый алюминий имеет более высокую стойкость к коррозии, чем технический, который, в свою очередь, более стоек к коррозии, чем сплавы алюминия с другими металлами. Так же стойкость алюминия к коррозии зависит от характеристик внешней среды и от реакций, вызываемых этой средой.
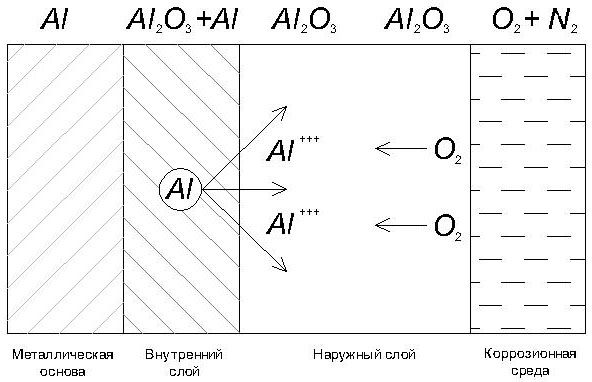 Рис.2. Механизм образования оксидной пленки на алюминии
Рис.2. Механизм образования оксидной пленки на алюминии
Методы защиты от коррозии
Особенно сильно коррозия проявляет себя во влажной среде, а так же при появлении т.н. «блуждающих» токов. Именно поэтому очень важно защищать поверхность алюминия с помощью покраски, анодировки, а стальные изделия, соприкасающиеся с ним необходимо оцинковывать, эмалировать или хотя бы обрабатывать грунтовкой в несколько слоев. Крепеж, применяемый в производстве алюминиевых конструкций должен быть как минимум оцинкованным, но желательно, а для фасадных конструкций просто необходимо, использовать крепеж из нержавеющей стали. Для антикоррозионной защиты алюминиевых конструкций применяют следующие методы:
Порошковая окраска
Порошковое покрытие представляет собой напыленный на поверхность изделия полимерный порошок, который запекается (полимеризуется) в специальной печи при определенной температуре, как правило 180-220°С. Технология порошковой покраски состоит из трех этапов:
- Поверхность алюминиевого профиля обезжиривают и удаляют с нее все загрязнения
- Напыляют слой порошковой краски
- Запекание (полимеризация) порошкового покрытия в печи.
Порошковая покраска алюминиевого профиля и фурнитуры для светопрозрачных конструкций не только защищает металл от коррозии, но так же позволяет покрасить конструкцию в любой цвет по шкале RAL.
Анодирование профиля
Анодированое покрытие – это покрытие, которое создает на поверхности профиля устойчивую и не растворимую в агрессивных средах плёнку из окисла алюминия.
Анодирование позволяет создать такую равномерную толщину плёнки нерастворимой окиси на поверхности, которая уже не позволит контактировать алюминию с внешней средой и происходить дальнейшему окислению.
Технология построена таким образом:
- Сначала профиль обезжиривают в кислоте (например, щавелевой).
- Промывают в чистой воде.
- Далее травление в щелочи для вытравливания поверхностных неравномерно окисленных слоев металла, вместе с которыми снимаются все инородные включения на поверхности.
- Промывка в чистой воде.
- Профиль погружается в ванну с раствором электролита. Здесь в течение 0,5-1,5 часов он подвергается анодированию. На поверхности профиля образуется пленка оксида алюминия.
- Далее для получения цветного анодирования профиль перемещается в ванну с раствором соли какого-либо металла через которые снова пропускается ток. Цветные оттенки профиля зависят от продолжительности обработки. Минимально профиль обрабатывают 45 секунд (светлое шампанское), максимально – 15 минут (черный).
- Изолирование (Ванна упрочнения поверхности) – процесс химического замещения, при котором окисел на поверхности металла превращается в химически более прочную гидратную форму, более устойчивую к воздействию окружающей среды и химических веществ. Покрытие приобретает особую прочность, стойкость к механическим повреждениям.
- В заключение проводится сушка и упаковка.
Защита от контакта с другими металлами
Для того, чтобы алюминий не соприкасался с металлами, с которыми он может составить гальваническую пару, необходимо применять весь крепеж только из нержавеющей или оцинкованной стали.
Все стальные элементы, на которые монтируется конструкция – кронштейны, опорные узлы, анкерные пластины и т.д. – должны быть оцинкованы или прогрунтованны в несколько слоев. Так же для устранения прямого контакта алюминия и стали применяют паронитовые, резиновые, битумные прокладки.
Алюминиевый профиль и фурнитура не должны непосредственно соприкасаться с деревом, цементом, камнем, кирпичом, бетоном, и т. д., особенно в условиях повышенной влажности. Во избежание коррозии в этих случаях необходимо тщательно покрывать эти материалы битумом или другим изоляционным материалом, деревянные детали необходимо пропитывать лаком.

Рис.3. Пример оцинкованного кронштейна с нержавеющим крепежом
Заключение
Алюминий имеет высокую стойкость к коррозии, однако, при контакте с другими металлами или при воздействии электрического тока подвержен коррозии. Мерами по защите алюминиевых светопрозрачных конструкций от коррозии являются нанесение порошкового покрытия или анодирование, а так же использование нержавеющего или оцинкованного крепежа и элементов конструкции.
Примечание
Использованы материалы:
Вклад участников
Грибов Сергей
Мой вклад в развитие этой Вики можно посмотреть здесь
тема 21693
Обсуждение началось в 2003, но продолжается до 2019 года
2003В. Я являюсь производителем изготовленных по индивидуальному заказу алюминиевых деталей, как полированного, так и полированного алюминия, и я хотел бы знать наиболее экономичный способ предотвращения окисления и сохранения стойкой отделки изделия. Все детали, которые я делаю, предназначены для автомобильных деталей / отделки либо для моторных отсеков, либо для интерьера, таких как радиоприемники, решетки динамиков, накладки на пороги, крышки радиаторов и т. Д.
Кайл Уильямс– Омаха, Небраска, США
2003
А. Привет, Кайл. Двумя общими альтернативными подходами могут быть анодирование или прозрачное покрытие (которое, в свою очередь, может состоять из одной или двух частей, наноситься распылением или кистью, или порошковым покрытием). Все они довольно разные, и это может немного зависеть от того, как вы хотите.
Существует несколько подходов, потому что нет единого наилучшего подхода для всех условий. Может случиться так, что анодирование подходит для некоторых деталей, а другие виды прозрачного покрытия – для других…. но так как вы попросили “самый экономичный”, однокомпонентный спрей или прозрачный лак наверняка выиграет от этой меры.
Удачи


Тед Муни, П.Е.
отделка – Pine Beach, Нью-Джерси
Стремление жить Алоха
2003
A. Я использую прозрачное напыление на архитектурном алюминии в течение 2 десятилетий с прекрасными результатами.

Брюс Смит
металлообрабатывающий завод – Hayward, Висконсин, США
2006
Q.Расскажите, пожалуйста, подробнее о химическом веществе, которое можно использовать для герметизации алюминиевого материала.
Спасибо.
– Хошимин, Вьетнам
30 мая 2008 г.
В. Как найти спрей на герметик для алюминия?
Спасибо Роб
Роберт Стаут– Эмбудо, Нью-Мексико, США
Май 2008
A. Привет, Нгуен, Привет, Кайл.
Однокомпонентные прозрачные покрытия для алюминия доступны во многих источниках, включая Everbrite [рекламодатель, работающий с отделкой Finishing.com].Прозрачные двухкомпонентные покрытия выпускаются как «автомобильные прозрачные покрытия»; они отверждаются химической реакцией (например, эпоксидной смолой), а не сушкой, поэтому они обычно используют профессиональное оборудование для распыления, но, по-видимому, их можно выполнять с помощью специальных аэрозольных баллончиков, которые распыляют оба компонента одновременно =>
Удачи.


Тед Муни, П.Е.
отделка – Pine Beach, Нью-Джерси
Стремление жить Алоха
17 ноября 2010 г.
В. Какой прозрачный верхний слой (марка) лучше всего защищает матовый алюминий? Я использовал лак и герметик Rolite Premium, который с некоторым успехом вытирает и вытирает, но я хочу сохранить этот голый металлический вид, поэтому ищу оптимальный герметик / защиту.
Том ПапаФинишер – Клируотер, Флорида, США
16 ноября 2010 г.
А. Привет, Том. Извините, но мы обсуждаем здесь только технический , сравнивая типов лаков и их технологий, , а не конкретные бренды (почему?) 🙂
Но Everbrite [рекламодатель, занимающийся поддержкой Finishing.com), безусловно, является авторитетным брендом.
С уважением,


Тед Муни, П.Е.
отделка – Pine Beach, Нью-Джерси
Стремление жить Алоха
18 января 2012 г.
Q.Что можно использовать для герметизации кромок сварного анодированного алюминия? Я пытаюсь запечатать сварную часть. Коррозия начинает вымываться. Прозрачный или темно-серый герметик?
Армандо Аморанто– Сиэтл, Вашингтон, США
20 января 2012 г.
А. Привет, Армандо. Наилучшей защитой поверхности, вероятно, было бы покрытие для преобразования хроматов с последующим нанесением двухкомпонентного или порошкового покрытия на любую поверхность, которая не была анодирована.
Но когда вы предлагаете заделать, звучит так, будто вы говорите о расщелине капилляра, например, между двумя листами в пачке.Уплотнение остатков кислоты не кажется мне многообещающим, но обычно помогает лучшее полоскание во время процесса анодирования (горячее и холодное, включая разбавленную азотную кислоту или бикарбонат натрия). С другой стороны, герметизация деталей анаэробным клеем перед анодированием также может работать. Удачи.
С уважением,


Тед Муни, П.Е.
отделка – Pine Beach, Нью-Джерси
Стремление жить Алоха
,


Everbrite и ProtectaClear – это простые в применении, прочные, прозрачные защитные покрытия, которые восстанавливают алюминий и защищают от окисления, коррозии и повреждения солью. Используйте Everbrite на архитектурном металле. Используйте ProtectaClear для автомобильного, морского и полированного алюминия.
Многие виды алюминия могут быть защищены. Нажмите на картинку, чтобы увидеть примеры

Алюминиевые танкеры
Найдите то, что вам нужно менее чем за 10 секунд “Здравствуйте, меня зовут Брюс Вестендорф.Моя жена, Диана, и я владеем и занимаемся туристическим бизнесом в Саванне, Джорджия. Наша лодка представляет собой изготовленную на заказ сварную алюминиевую (5086 и 6061) водометную лодку.
Я положил его в соленую воду в марте 2001 года и с тех пор борюсь с пятнами, которые соленая вода делает на алюминии. Кроме того, области вокруг обтекателей приобрели грязно-желтые пятна от паров дизеля, которые действительно плохо выглядели. Я попробовал ассортимент восков, каждый из которых помогает вернуть блеск, когда достаточно времени потрачено, но через день все вышеперечисленные условия вернулись.Вы уже знаете результаты, которые мы достигли от применения вашего продукта. Я очень впечатлен. Мой транец и ствол выглядят абсолютно красивыми после полного месяца воздействия соленой воды и дизельных паров. Просто вымойте и высушите в конце дня. Жизнь с неокрашенным алюминием в соленой воде теперь хороша.
Большое спасибо. “ Брюс
“Уважаемый Everbrite,
Когда я приобрел свой комплектный самолет, я был полон решимости защитить его от коррозии
, так как я живу в Онтарио, Канада.Я не хотел использовать токсичные химикаты и проводил много времени в Интернете, пока не нашел ваш продукт. Когда я впервые получил свой комплект, алюминий уже имел признаки легкого окисления, поэтому нужно было что-то делать немедленно. После очистки внутренней части фюзеляжа я покрыл его Everbrite и вау! Похоже, новый алюминий. Это отличный продукт для самолетов, он прост в применении, не токсичен, не горит, легко наносится и очень легкий.
Я говорю всем своим коллегам по авиастроению и всем, кто будет слушать.”
Майк Джонс
Онтарио, Канада
Коррозия алюминия и алюминиевых сплавов
Коррозия на алюминиевых поверхностях обычно довольно очевидна, поскольку продукты коррозии имеют белый цвет и, как правило, более объемные, чем исходная основа. металл. Даже на ранних стадиях коррозия алюминия проявляется в виде общего травления, точечной коррозии или шероховатости алюминиевых поверхностей.
ПРИМЕЧАНИЕ. Алюминиевые сплавы обычно образуют окисление с гладкой поверхностью от 0.Толщиной от 001 до 0,0025 дюйма Это не считается вредным; покрытие обеспечивает жесткий барьер оболочки для введения коррозийных элементов. Такое окисление не следует путать с сильной коррозией, обсуждаемой в этом пункте.
Общая поверхностная атака алюминия проникает относительно медленно, но ускоряется в присутствии растворенных солей. Значительная атака обычно может иметь место до того, как развивается серьезная потеря прочности конструкции.
Особенно серьезными являются, по крайней мере, три формы воздействия на алюминиевые сплавы: (1) проникающая коррозия типа ямы через стенки алюминиевых трубок, (2) коррозионное растрескивание материалов под действием постоянного напряжения и (3) межзерновой коррозия, характерная для некоторых неправильно обработанных алюминиевых сплавов.В целом, коррозия алюминия может быть более эффективно обработана на месте по сравнению с коррозией, возникающей на других конструкционных материалах, используемых в авиации. Обработка включает в себя механическое удаление как можно большего количества продуктов коррозии и ингибирование остаточных материалов химическими средствами с последующим восстановлением постоянных поверхностных покрытий.
Обработка неокрашенных алюминиевых поверхностей
Относительно чистый алюминий обладает значительно большей коррозионной стойкостью по сравнению с более прочными алюминиевыми сплавами.Чтобы воспользоваться этой характеристикой, поверх базового алюминиевого сплава наносится тонкое покрытие из относительно чистого алюминия. Полученная защита является хорошей, и поверхность из чистого алюминия (обычно называемая «Alclad») может поддерживаться в полированном состоянии. Однако при очистке таких поверхностей необходимо следить за тем, чтобы не допустить окрашивания и появления пятен на открытом алюминии и, что более важно, с точки зрения защиты, чтобы избежать ненужного механического удаления защитного слоя Alclad и воздействия на более восприимчивый базовый материал из алюминиевого сплава. ,Ниже приведена типичная последовательность обработки алюминия от коррозии:
- Удалите масляные и поверхностные загрязнения с алюминиевой поверхности любым подходящим мягким очистителем. Соблюдайте осторожность при выборе чистящего средства; многие коммерческие потребительские товары на самом деле достаточно едкие, чтобы вызвать коррозию, если они зажаты между алюминиевыми стыками. Выберите нейтральный продукт Ph.
- Ручная полировка корродированных участков мелкими абразивами или металлической полировкой. Металлическая полировка, предназначенная для использования на покрытых алюминием поверхностях самолетов, не должна использоваться на анодированном алюминии, поскольку она достаточно абразивна, чтобы фактически удалить защитную анодированную пленку.Эффективно удаляет пятна и обеспечивает высокую полировку и долговечность неокрашенной поверхности Alclad. Если поверхность особенно трудно чистить, перед полировкой можно использовать чистящее и осветляющее соединение для алюминия, чтобы сократить время и уменьшить усилия, необходимые для получения чистой поверхности.
- Лечить любую присутствующую поверхностную коррозию, используя противоизносный материал. Альтернативной обработкой является обработка раствором дихромата натрия и триоксида хрома. Оставьте эти растворы на корродированной области в течение 5-20 минут, а затем удалите излишки, промыв их и вытерев поверхность насухо чистой тканью.
- Покрыть полированные поверхности водостойким воском.
Алюминиевые поверхности, которые должны быть впоследствии окрашены, могут подвергаться более жестким процедурам очистки, а также могут подвергаться более тщательной корректирующей обработке перед окрашиванием. Обычно используется следующая последовательность:
- Тщательно очистите пораженные поверхности от всех загрязнений и остатков жира перед обработкой. Можно использовать любую общую процедуру очистки самолета.
- Если остаются остаточные лакокрасочные пленки, зачистить участок, подлежащий обработкеПроцедуры использования средств для удаления краски и меры предосторожности, которые были соблюдены, были ранее упомянуты в этой главе в разделе «Очистка поверхности и удаление краски».
- Обработать поверхностно корродированные участки 10-процентным раствором хромовой и серной кислот. Нанесите раствор тампоном или кистью. Протрите поврежденную область щеткой, пока она еще влажная. Хотя хромовая кислота является хорошим ингибитором для алюминиевых сплавов, даже когда продукты коррозии не были полностью удалены, важно, чтобы раствор проникал в дно всех ям и под любую коррозию, которая может присутствовать.Тщательная очистка жесткой волокнистой щеткой должна ослабить или удалить большую часть существующей коррозии и обеспечить полное проникновение ингибитора в щели и ямы. Дайте хромовой кислоте оставаться на месте не менее 5 минут, а затем удалите избыток, промыв водой или протерев влажной тканью. Существует несколько коммерческих химических соединений для обработки поверхности, аналогичных описанному выше типу, которые также могут быть использованы.
- Высушите обработанную поверхность и восстановите рекомендуемые постоянные защитные покрытия в соответствии с процедурами изготовителя самолета.Восстановление лакокрасочных покрытий должно следовать сразу за любой выполненной обработкой поверхности. В любом случае, убедитесь, что коррозионная обработка завершена или применяется повторно в тот же день, когда запланировано повторное нанесение краски.
Обработка анодированных поверхностей
Как указывалось ранее, анодирование является обычной обработкой поверхности алюминиевых сплавов. Когда это покрытие повреждено в процессе эксплуатации, его можно восстановить лишь частично химической обработкой поверхности.Поэтому при любой коррозионной коррекции анодированных поверхностей следует избегать разрушения оксидной пленки в неповрежденной области. Не используйте щетки из стальной ваты или стальной проволоки. Не используйте тяжелые абразивные материалы.
Нетканые абразивные прокладки обычно заменяют алюминиевую вату, щетки из алюминиевой проволоки или щетки из волокнистой щетины в качестве инструментов, используемых для очистки корродированных анодированных поверхностей. Необходимо соблюдать осторожность при любом процессе очистки, чтобы избежать ненужного повреждения соседней защитной пленки. Примите все меры предосторожности, чтобы сохранить как можно больше защитного покрытия.В противном случае обработайте анодированные поверхности так же, как и другие алюминиевые покрытия. Хромовая кислота и другие ингибирующие средства могут быть использованы для восстановления оксидной пленки.
Обработка межкристаллитной коррозии под воздействием тепла ‑Обработанные поверхности из алюминиевого сплава
Как было описано ранее, межкристаллитная коррозия – это воздействие вдоль границ зерен неправильно или неадекватно термически обработанных сплавов, возникающее в результате осаждения разнородных компонентов после термической обработки.В самой тяжелой форме происходит фактический подъем металлических слоев (отслаивание, см. Рисунок 6-9).

 Рисунок 6-9. Отшелушивание.
Рисунок 6-9. Отшелушивание.Более серьезная очистка необходима при наличии межкристаллитной коррозии. Механическое удаление всех продуктов коррозии и видимых слоистых металлических слоев должно быть выполнено, чтобы определить степень разрушения и оценить остаточную структурную прочность компонента. Глубина коррозии и пределы удаления были установлены для некоторых самолетов.Любая потеря прочности конструкции должна быть оценена до ремонта или замены детали. Если ограничения производителя не позволяют адекватно устранить ущерб, для оценки ущерба может быть привлечен назначенный инженерный представитель (DER).
Бортовой механик Рекомендует
.Цели обучения
- Для выявления окислительно-восстановительных реакций в растворе.
Термин окисление впервые был использован для описания реакций, в которых металлы реагируют с кислородом в воздухе с образованием оксидов металлов. Например, когда железо подвергается воздействию воздуха в присутствии воды, оно превращается в ржавчину – оксид железа. Под воздействием воздуха металлический алюминий образует на своей поверхности непрерывный прозрачный слой оксида алюминия.В обоих случаях металл приобретает положительный заряд, передавая электроны нейтральным атомам кислорода молекулы кислорода. В результате атомы кислорода приобретают отрицательный заряд и образуют оксидные ионы (O 2-91010). Поскольку металлы потеряли электроны для кислорода, они были окислены; окисление, следовательно, потеря электронов. И наоборот, поскольку атомы кислорода приобрели электроны, они были уменьшены, поэтому уменьшение – это усиление электронов. Для каждого окисления должно быть соответствующее уменьшение.Следовательно, эти реакции известны как окислительно-восстановительные реакции или «окислительно-восстановительные» реакции для краткости.
Любое окисление ВСЕГДА должно сопровождаться восстановлением и наоборот.
Первоначально термин сокращение относился к уменьшению массы, наблюдаемому, когда оксид металла нагревался с монооксидом углерода, реакции, которая широко использовалась для извлечения металлов из их руд. Например, когда твердый оксид меди (I) нагревают с помощью водорода, его масса уменьшается, поскольку образование чистой меди сопровождается потерей атомов кислорода в качестве летучего продукта (водяного пара).Реакция следующая:
\ [\ ce {Cu_2O (s) + H_2 (г) \ rightarrow 2Cu (s) + H_2O (г)} \ label {4.4.1} \]
Реакции окисления-восстановления теперь определяются как реакции, которые демонстрируют изменение состояний окисления одного или нескольких элементов в реагентах в результате переноса электронов, что следует за мнемоническим выражением «окисление – потеря, восстановление – выигрыш», или «нефть буровая установка “. Степень окисления каждого атома в соединении – это заряд, который был бы у атома, если бы все его связывающие электроны были перенесены на атом с большей привлекательностью для электронов.Атомам в их элементарной форме, такой как О 2 или Н 2, присваивается степень окисления, равная нулю. Например, реакция алюминия с кислородом с образованием оксида алюминия составляет
\ [\ ce {4 Al (s) + 3O_2 \ rightarrow 2Al_2O_3 (s)} \ label {4.4.2} \]
Каждый нейтральный атом кислорода получает два электрона и становится отрицательно заряженным, образуя ион оксида; таким образом, кислород имеет степень окисления -2 в продукте и был восстановлен. Каждый нейтральный атом алюминия теряет три электрона, образуя ион алюминия со степенью окисления +3 в продукте, поэтому алюминий окисляется.{2-}} \ label {4.4.3} \]
Уравнение \ (\ ref {4.4.1} \) и Уравнение \ (\ ref {4.4.2} \) являются примерами окислительно-восстановительных (окислительно-восстановительных) реакций. В окислительно-восстановительных реакциях происходит полный перенос электронов от одного реагента к другому. В любой окислительно-восстановительной реакции общее количество потерянных электронов должно равняться общему количеству электронов, полученных для сохранения электрической нейтральности. Например, в уравнении \ (\ ref {4.4.3} \) общее количество электронов, потерянных алюминием, равно общему количеству, полученному кислородом:
\ [\ begin {align *} \ text {потерянные электроны} & = \ ce {4 Al} \, \ text {атомов} \ times {3 \, e ^ – \, \ text {lost} \ over \ ce {Al} \, \ text {atom}} \\ [4pt] & = 12 \, e ^ – \, \ text {lost} \ label {4.- \, \ text {gain} \ label {4.4.4b} \ end {align *} \]
Такая же картина наблюдается во всех реакциях окисления-восстановления: количество потерянных электронов должно равняться количеству полученных электронов. Дополнительный пример окислительно-восстановительной реакции – реакция металлического натрия с хлором – показана на рисунке \ (\ PageIndex {1} \).
Во всех окислительно-восстановительных (окислительно-восстановительных) реакциях количество потерянных электронов равно числу полученных электронов.
Назначение состояний окисления
Назначение состояний окисления элементам в бинарных ионных соединениях является простым: состояния окисления элементов идентичны зарядам на одноатомных ионах.Ранее вы узнали, как прогнозировать формулы простых ионных соединений на основе знака и величины заряда на одноатомных ионах, образованных нейтральными элементами. Примерами таких соединений являются хлорид натрия (NaCl; рис. \ (\ PageIndex {1} \)), оксид магния (MgO) и хлорид кальция (CaCl 2 ). В ковалентных соединениях, напротив, атомы делятся электронами. Тем не менее, мы все еще можем назначить окислительные состояния вовлеченным элементам, обрабатывая их, как если бы они были ионными (то есть, как если бы все связывающие электроны были перенесены в более привлекательный элемент).Окислительные состояния в ковалентных соединениях несколько произвольны, но они полезны для учета, чтобы помочь вам понять и предсказать многие реакции.
Рисунок \ (\ PageIndex {1} \): реакция нейтрального атома натрия с нейтральным атомом хлора. В результате происходит перенос одного электрона с натрия на хлор, образуя ионное соединение NaCl.Ниже следует свод правил для присвоения состояний окисления атомам в химических соединениях.
Правила для назначения состояний окисления
- Степень окисления атома в любом чистом элементе, будь то одноатомный, двухатомный или многоатомный, равна нулю.
- Степень окисления одноатомного иона совпадает с его зарядом, например, Na + = +1, Cl – = -1.
- Степень окисления фтора в химических соединениях всегда -1. Другие галогены обычно имеют также степени окисления -1, за исключением случаев, когда они объединены с кислородом или другими галогенами.
- Водороду присваивается степень окисления +1 в его соединениях с неметаллами и -1 в его соединениях с металлами.
- Кислороду обычно присваивается степень окисления -2 в соединениях, с двумя исключениями: в соединениях, которые содержат связи кислород-фтор или кислород-кислород, степень окисления кислорода определяется состояниями окисления других присутствующих элементов.
- Сумма состояний окисления всех атомов нейтральной молекулы или иона должна равняться заряду молекулы или иона.
Иногда встречаются неинтегральные (фракционные) состояния окисления. Они обычно обусловлены наличием двух или более атомов одного и того же элемента с разными степенями окисления.
В любой химической реакции, чистый заряд должен быть сохранен; то есть в химической реакции общее число электронов является постоянным, как и общее количество атомов.В соответствии с этим правило 1 гласит, что сумма отдельных степеней окисления атомов в молекуле или ионе должна равняться суммарному заряду этой молекулы или иона. Например, в NaCl Na имеет степень окисления +1, а Cl равен -1. Чистый заряд равен нулю, как и должно быть для любого соединения.
Правило 3 требуется, потому что фтор притягивает электроны сильнее, чем любой другой элемент, по причинам, которые вы обнаружите в главе 6. Следовательно, фтор дает справочную информацию для расчета степени окисления других атомов в химических соединениях.Правило 4 отражает разницу в химии, наблюдаемую для соединений водорода с неметаллами (такими как хлор) по сравнению с соединениями водорода с металлами (такими как натрий). Например, NaH содержит ион H – , тогда как HCl образует ионы H + и Cl – при растворении в воде. Правило 5 необходимо, потому что фтор имеет большее притяжение для электронов, чем кислород; это правило также предотвращает нарушения правила 2. Таким образом, степень окисления кислорода составляет +2 в OF 2 , но – 1/2 в KO 2 .Обратите внимание, что степень окисления -O для O в KO 2 является вполне приемлемой.
Восстановление оксида меди (I), показанное в уравнении \ (\ ref {4.4.5} \), демонстрирует, как применять эти правила. Правило 1 гласит, что атомы в их элементарной форме имеют степень окисления, равную нулю, что относится к H , 2 и Cu. Из правила 4 водород в H 2 O имеет степень окисления +1, а из правила 5 кислород в Cu 2 O и H 2 O имеет степень окисления -2.Правило 6 гласит, что сумма состояний окисления в молекуле или формульной единице должна равняться суммарному заряду этого соединения. Это означает, что каждый атом Cu в Cu 2 O должен иметь заряд +1: 2 (+1) + (-2) = 0. Таким образом, степени окисления следующие:
\ [\ overset {\ color {ref} {+ 1}} {\ ce {Cu_2}} \ overset {\ color {ref} -2} {\ ce {O}} (s) + \ overset {\ color {ref} 0} {\ ce {H_2}} (g) \ rightarrow 2 \ overset {\ color {ref} 0} {\ ce {Cu}} (s) + \ overset {\ color {ref} +1} {\ ce {H}} _ 2 \ overset {\ color {ref} -2} {\ ce {O}} (g) \ label {4.- \, \ text {gain} \ label {4.4.6b} \]
Помните, что состояния окисления полезны для визуализации переноса электронов в реакциях окисления-восстановления, но состояние окисления атома и его фактический заряд одинаковы только для простых ионных соединений. Состояния окисления являются удобным способом назначения электронов атомам, и они полезны для предсказания типов реакций, которые испытывают вещества.
Пример\ (\ PageIndex {1} \): степени окисления
Назначьте степени окисления для всех атомов в каждом соединении.
- гексафторид серы (SF 6 )
- метанол (CH 3 OH)
- сульфат аммония [(NH 4 ) 2SO 4 ]
- магнетит (Fe 3 O 4 )
- этановая (уксусная) кислота (CH 3 CO 2 H)
Дано : молекулярная или эмпирическая формула
На вопрос : степень окисления
Стратегия :
Начните с атомов, степень окисления которых может быть однозначно определена из представленных правил (таких как фтор, другие галогены, кислород и одноатомные ионы).Затем определяют степень окисления других атомов, присутствующих в соответствии с правилом 1.
Решение :
а. Из правила 3 мы знаем, что фтор всегда имеет степень окисления -1 в своих соединениях. Шесть атомов фтора в гексафториде серы дают общий отрицательный заряд -6. Поскольку правило 1 требует, чтобы сумма степеней окисления всех атомов в нейтральной молекуле была равна нулю (здесь SF 6 ), степень окисления серы должна составлять +6:
.[(6 атомов F) (- 1)] + [(1 атом S) (+6)] = 0
б.Согласно правилам 4 и 5, водород и кислород имеют степени окисления +1 и -2 соответственно. Поскольку метанол не имеет чистого заряда, углерод должен иметь степень окисления -2:
[(4 атома H) (+ 1)] + [(1 атом O) (- 2)] + [(1 атом C) (- 2)] = 0
в. Обратите внимание, что (NH 4 ) 2 SO 4 является ионным соединением, которое состоит как из многоатомного катиона (NH 4 + ), так и из многоатомного аниона (SO 4 2-) ( см. таблицу 2.4 «Общие многоатомные ионы и их названия»). Мы присваиваем степени окисления атомам каждого многоатомного иона отдельно. Для NH 4 + водород имеет степень окисления +1 (правило 4), поэтому азот должен иметь степень окисления −3:
[(4 атома H) (+ 1)] + [(1 атом N) (- 3)] = +1, заряд на NH 4 + ион
Для SO42- кислород имеет степень окисления -2 (правило 5), поэтому сера должна иметь степень окисления +6:
[(4 атома O) (-2)] + [(атом 1S) (+ 6)] = -2, заряд сульфат-иона
д.Кислород имеет степень окисления -2 (правило 5), что дает общий заряд -8 на единицу формулы. Это должно быть уравновешено положительным зарядом на трех атомах железа, давая степень окисления +8/3 для железа:
[(4 атома O) (- 2)] + [(3 атома Fe) \ (\ left (+ {8 \ over 3} \ right) \)] = 0
Фракционные состояния окисления разрешены, потому что состояния окисления являются несколько произвольным способом отслеживания электронов. Фактически, Fe 3 O 4 можно рассматривать как имеющий два иона Fe 3 + и один ион Fe 2 + на единицу формулы, что дает чистый положительный заряд +8 на единицу формулы ,Fe 3 O 4 – это магнитная железная руда, обычно называемая магнетитом. В древние времена магнетит был известен как магнит, потому что его можно было использовать для изготовления примитивных компасов, которые указывали на Полярис (Полярную звезду), которую называли «звездой».
эл. Первоначально мы назначаем степени окисления компонентам CH 3 CO 2 H таким же образом, как и любое другое соединение. Водород и кислород имеют степени окисления +1 и -2 (правила 4 и 5 соответственно), в результате чего общий заряд водорода и кислорода составляет
.[(4 атома H) (+ 1)] + [(2 атома O) (- 2)] = 0
Таким образом, степень окисления углерода также должна быть нулевой (правило 6).Это, однако, средняя степень окисления для двух присутствующих атомов углерода. Поскольку каждый атом углерода имеет различный набор атомов, связанных с ним, они, вероятно, имеют разные степени окисления. Чтобы определить степени окисления отдельных атомов углерода, мы используем те же правила, что и ранее, но с дополнительным допущением, что связи между атомами одного и того же элемента не влияют на состояния окисления этих атомов. Атом углерода метильной группы (-CH 3 ) связан с тремя атомами водорода и одним атомом углерода.Из правила 4 мы знаем, что водород имеет степень окисления +1, и мы только что сказали, что углерод-углеродная связь может быть проигнорирована при расчете степени окисления атома углерода. Чтобы метильная группа была электрически нейтральной, ее атом углерода должен иметь степень окисления -3. Аналогичным образом, атом углерода группы карбоновой кислоты (-CO 2 H) связан с одним атомом углерода и двумя атомами кислорода. Снова игнорируя связанный атом углерода, мы присваиваем степени окисления -2 и +1 атомам кислорода и водорода соответственно, что приводит к суммарному заряду
[(2 атома O) (- 2)] + [(1 атом H) (+ 1)] = −3
Чтобы получить электрически нейтральную группу карбоновой кислоты, заряд на этом угле должен быть +3.Таким образом, степень окисления отдельных атомов в уксусной кислоте составляет
.\ [\ underset {-3} {C} \ overset {+1} {H_3} \ overset {+3} {C} \ underset {-2} {O_2} \ overset {+1} {H} \]
Таким образом, сумма степеней окисления двух атомов углерода действительно равна нулю.
Упражнение\ (\ PageIndex {1} \): степени окисления
Назначьте степени окисления для всех атомов в каждом соединении.
- фторид бария (BaF 2 )
- формальдегид (CH 2 O)
- дихромат калия (K 2 Cr 2 O 7 )
- оксид цезия (CsO 2 )
- этанол (CH 3 CH 2 OH)
- Ответ
Ва +2; F, -1
- Ответ б
С, 0; H +1; О, -2
- Ответ c
К, +1; Cr +6; О, -2
- Ответ d
Cs +1; О, −½
- Ответ e
С, -3; H +1; С -1; H +1; О -2; H +1
Типы окислительно-восстановительных реакций
Многие типы химических реакций классифицируются как окислительно-восстановительные реакции, и было бы невозможно запомнить их все.Тем не менее, есть несколько важных типов окислительно-восстановительных реакций, с которыми вы, вероятно, столкнетесь и с которыми вам следует ознакомиться. К ним относятся:
- Синтез реакции : Образование любого соединения непосредственно из элементов является окислительно-восстановительной реакцией, например, образование воды из водорода и кислорода: \ [\ ce {2H_2 (г) + O_2 (г) \ rightarrow 2H_2O ( g)} \]
- реакции разложения : наоборот, разложение соединения на его элементы также является окислительно-восстановительной реакцией, как при электролизе воды: \ [\ ce {2H_2O (l) \ rightarrow 2H_2 (g) + O_2 (g)} \]
- Реакции сгорания : Многие химические вещества сгорают (горят) с кислородом.В частности, органические химические вещества, такие как углеводороды, сгорают в присутствии кислорода с образованием диоксида углерода и воды в качестве продуктов: \ [\ ce {CH_4 (г) + 2O_2 (г) \ rightarrow CO_2 (г) + 2H_2O (г)} \]
В следующих разделах описан еще один важный класс окислительно-восстановительных реакций: реакции однократного вытеснения металлов в растворе.
окислительно-восстановительных реакций твердых металлов в водном растворе
Широко распространенным классом окислительно-восстановительных реакций является реакция водных растворов кислот или солей металлов с твердыми металлами.Примером является коррозия металлических предметов, например ржавчина автомобиля (Рисунок \ (\ PageIndex {2} \)). Ржавчина образуется в результате сложной реакции окисления-восстановления, в которой участвуют разбавленные растворы кислот, которые содержат ионы Cl – (эффективно, разбавленную HCl), металлическое железо и кислород. Когда объект ржавеет, металлический железо реагирует с HCl (aq) с образованием хлорида железа (II) и газообразного водорода:
\ [\ ce {Fe (s) + 2HCl (aq) \ rightarrow FeCl_2 (aq) + H_2 (g)} \ label {4.4.81} \]
На последующих этапах \ (\ ce {FeCl2} \) подвергается окислению с образованием красновато-коричневого осадка \ (\ ce {Fe (OH) 3} \).
Рисунок \ (\ PageIndex {2} \): образование ржавчины. Процесс коррозии включает реакцию окисления-восстановления, в которой металлическое железо превращается в Fe (OH) 3 , красновато-коричневое твердое вещество.Многие металлы растворяются в результате реакций этого типа, которые имеют общую форму
\ [\ text {metal} + \ text {acid} \ rightarrow \ text {salt} + \ text {водород} \ label {4.4.82} \]
Некоторые из этих реакций имеют важные последствия. Например, было высказано предположение, что одним из факторов, способствовавших падению Римской империи, было широкое использование свинца в посуде и трубах, по которым перевозилась вода.{2 +} (aq) + H_2 (g)} \ label {4.4.83} \]
Следовательно, было высказано предположение, что и вода, и пища, потребляемая римлянами, содержали токсичные уровни свинца, что привело к широко распространенному отравлению свинцом и возможному безумию. Возможно, это объясняет, почему римский император Калигула назначил своего любимого коня консулом!
Реакции с одним перемещением
Некоторые металлы окисляются водной кислотой, тогда как другие окисляются водными растворами различных солей металлов.{2 +} (aq) + 2Ag (s)} \ label {4.4.85} \]
Реакция в уравнении \ (\ ref {4.4.84} \) широко используется для предотвращения (или, по крайней мере, отсрочки) коррозии железных или стальных объектов, таких как гвозди и листовой металл. Процесс «гальванизации» состоит в нанесении тонкого покрытия из цинка на железо или сталь, что защищает его от окисления, пока цинк остается на объекте.
Рисунок используется с разрешения (CC BY-SA 3.0; Тоби Хадсон).Серия мероприятий
Наблюдая за тем, что происходит, когда образцы различных металлов контактируют с растворами других металлов, химики расположили металлы в соответствии с относительной легкостью или трудностью, с которой они могут окисляться в реакции однократного вытеснения.{2 +} (aq) + Zn (s)} \ label {4.4.11} \]
Магний имеет большую склонность к окислению, чем цинк.
Парные реакции такого рода являются основой ряда активности (Рисунок \ (\ PageIndex {4} \)), в котором перечислены металлы и водород в порядке их относительной тенденции к окислению. Металлы в верхней части ряда, которые имеют наибольшую тенденцию терять электроны, представляют собой щелочные металлы (группа 1), щелочноземельные металлы (группа 2) и Al (группа 13). В отличие от металлов в нижней части серии, которые имеют самую низкую склонность к окислению, являются драгоценные металлы или чеканки металлов – платина, золото, серебро и медь, а также ртуть, которые расположены в правой нижней части металлы в периодической таблице.Вы должны быть в целом знакомы с тем, какие виды металлов являются активными металлами, которые имеют наибольшую склонность к окислению. (расположены в верхней части ряда) и которые являются инертными металлами, которые имеют наименьшую склонность к окислению. (внизу серии).
Рисунок \ (\ PageIndex {4} \): серия действийПри использовании ряда действий для предсказания результата реакции, имейте в виду, что любой элемент уменьшит соединения элементов ниже его в ряду .Поскольку магний выше цинка на рисунке \ (\ PageIndex {4} \), металлический магний будет уменьшать соли цинка, но не наоборот. Точно так же драгоценные металлы находятся в нижней части ряда мероприятий, поэтому практически любой другой металл будет превращать соли драгоценных металлов в чистые драгоценные металлы. Водород включен в серию, и тенденция металла реагировать с кислотой указывается его положением относительно водорода в ряду активности. Только те металлы, которые находятся выше водорода в ряду активности, растворяются в кислотах с образованием H 2 . Поскольку драгоценные металлы находятся ниже водорода, они не растворяются в разбавленной кислоте и поэтому не подвержены коррозии. Пример \ (\ PageIndex {2} \) демонстрирует, как знакомство с сериями упражнений позволяет прогнозировать продукты многих реакций одного смещения.
Пример \ (\ PageIndex {2} \): действие
Используя серию заданий, предсказывайте, что происходит в каждой ситуации. Если реакция происходит, напишите чистое ионное уравнение.
- Полоску алюминиевой фольги помещают в водный раствор нитрата серебра.
- Несколько капель жидкой ртути добавляют к водному раствору ацетата свинца (II).
- Некоторая серная кислота из автомобильного аккумулятора случайно пролилась на клеммы подводящего кабеля.
Дано: реагентов
Запрошено: общее уравнение реакции и ионной чистоты
Стратегия:
- Найдите реагенты в серии действий на рисунке \ (\ PageIndex {4} \) и по их относительным позициям определите, будет ли происходить реакция.Если реакция действительно происходит, определите, какой металл окислен, а какой восстановлен.
- Напишите чистое ионное уравнение для окислительно-восстановительной реакции.
Решение:
- A Алюминий – это активный металл, который находится над серебром в серии активности, поэтому мы ожидаем, что реакция произойдет. В соответствии с их относительным положением алюминий будет окисляться и растворяться, а ионы серебра будут восстанавливаться до металлического серебра. B Чистое ионное уравнение имеет следующий вид:
\ [\ ce {Al (s) + 3Ag ^ + (aq) \ rightarrow Al ^ {3 +} (aq) + 3Ag (s)} \ nonumber \]
Напомним из нашего обсуждения растворимости, что большинство нитратных солей растворимы.В этом случае нитрат-ионы являются ионами-зрителями и не участвуют в реакции.
- A Меркурий находится ниже уровня свинца в серии действий, поэтому никакой реакции не произойдет.
- A Свинец находится выше водорода в ряду активности, поэтому выводы свинца будут окислены, а кислота восстановится до H 2 . B Из нашего обсуждения растворимости напомним, что Pb 2 + и SO 4 2-91010 образуют нерастворимый сульфат свинца (II).{2 -} (aq) \ rightarrow PbSO_4 (s) + H_2 (g)}
\ nonumber \]
Сульфат свинца (II) – это белое твердое вещество, которое образуется на корродированных клеммах аккумулятора.
Разъеданные клеммы аккумулятора. Белое твердое вещество представляет собой сульфат свинца (II), образующийся в результате реакции твердого свинца с раствором серной кислоты.
Упражнение \ (\ PageIndex {2} \)
Используя серию заданий, предсказывайте, что происходит в каждой ситуации. Если реакция происходит, напишите чистое ионное уравнение.
- Полоску металлического хрома помещают в водный раствор хлорида алюминия.
- Полоску цинка помещают в водный раствор нитрата хрома (III).
- Кусок алюминиевой фольги сбрасывают в стакан с уксусом (активный ингредиент – уксусная кислота).
- Ответ
\ (нет \: реакция \)
- Ответ б
\ (3Zn (s) + 2Cr ^ {3 +} (aq) \ rightarrow 3Zn ^ {2 +} (aq) + 2Cr (s) \)
- Ответ c
\ (2Al (s) + 6CH_3CO_2H (aq) \ rightarrow 2Al ^ {3 +} (aq) + 6CH_3CO_2 ^ – (aq) + 3H_2 (g) \
Резюме
Реакции окисления-восстановления уравновешиваются путем разделения общего химического уравнения на уравнение окисления и уравнение восстановления.В реакциях окисления-восстановления электроны переносятся из одного вещества или атома в другое. Мы можем сбалансировать реакции окисления-восстановления в растворе, используя метод состояния окисления (Таблица \ (\ PageIndex {1} \)), в котором общая реакция разделяется на уравнение окисления и уравнение восстановления. Существует много типов окислительно-восстановительных реакций. Реакции однократного замещения – это реакции металлов с кислотами или солью другого металла, которые приводят к растворению первого металла и осаждению второго (или выделению газообразного водорода).Исход этих реакций можно предсказать, используя серию активности (Рисунок \ (\ PageIndex {4} \)), в которой металлы и H 2 расположены в порядке убывания их склонности к окислению. Любой металл уменьшит ионы металла ниже его в серии активности. Активные металлы лежат в верхней части ряда активности, тогда как инертные металлы находятся в нижней части ряда активности.


 Сельская местность (небольшой уровень загрязнений и средняя степень влажности).
Сельская местность (небольшой уровень загрязнений и средняя степень влажности).