Аргон газ инертный – Газ аргон – химические свойства и сфера применения
alexxlab | 10.04.2017 | 0 | Вопросы и ответы
Газ аргон – химические свойства и сфера применения
В переводе с греческого «argon» означает «медленный» или «неактивный». Такое определение газ аргон получил благодаря своим инертным свойствам, позволяющим широко его использовать во многих промышленных и бытовых целях.
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.

На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.

Представлены установки по производству данного химического элемента
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации.
Где применяется газ аргон
Данный элемент имеет достаточно большую сферу применения. Ниже приведены основные области его использования:
- заполнение внутренней полости ламп накаливания и стеклопакетов;
- вытеснение влаги и кислорода для долгого хранения пищевых продуктов;
- огнетушащее вещество в некоторых системах тушения пожара;
- защитная среда при сварочном процессе;
- плазмообразующий газ для плазменной сварки и резки.
В сварочном производстве он применяется как защитная среда в процессе сварки редких металлов (ниобия, титана, циркония) и их сплавов, легированный сталей разных марок, а также алюминиевых, магниевых и хромоникелевых сплавов. Для черных металлов, как правило, применяют смесь Ar с другими газами – гелием, кислородом, углекислотой и водородом.

Вид защитной среды при сварочном процессе, которую создает аргон
Являясь тяжелее воздуха, аргоновая струя надежно защищает металл во время сварки. Инертный газ на протяжении длительного времени является защитой для расплавленной и нагретой металлической поверхности. Больше о сварочном процессе с применением аргоновой защитной среды читайте в статье: сварка аргоном – технология и режимы работы оборудования.
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу. Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Еще мы советуем посмотреть третью часть обучения сварке в защитной среде аргона:
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Заправить баллоны аргоном можно в компании «Промтехгаз», где соблюдается правильная технология заправки и предоставляется качественное обслуживание.
Если вы интересуетесь другими техническими газами, информацию можете найти здесь.
xn--80affkvlgiu5a.xn--p1ai
Аргон инертный газ
Общие сведения об открытиях благородных газов
К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин…
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см 3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит «недеятельный».
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти «микроследы» не улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала «летят» более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли «кто есть кто».
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло название газа «неон», по-древнегречески значит «новый».
После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см
Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия – a-частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222.
Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов. АргонИстория открытия Аргона
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин…
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент!
Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Его предложил председательствовавший на собрании доктор Медан.
Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег…
mirznanii.com
Аргон инертный газ
Общие сведения об открытиях благородных газов
К благородным газам относятся гелий, неон, аргон, криптон, ксенон и
радон. По своим свойствам они не похожи ни на какие другие элементы и в
периодической системе располагаются между типичными металлами и
неметаллами.
История открытия инертных газов представляет большой интерес: во-первых,
как триумф введённых Ломоносовым количественных методов химии(открытие
аргона), а во-вторых, как триумф теоретического предвидения (открытие
остальных инертных газов), опирающегося на величайшее обобщение химии –
периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа –
аргона – произошло в то время, когда построение периодической системы
казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе
какой-то новый газ, необыкновенно устойчивый химически. На долю этого
газа приходилась примерно одна сто двадцатая часть объема воздуха. Но
что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд
Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее,
чем азот, выделенный из соединений. Не найдя достоверного объяснения
аномалии, Рэлей через журнал «Nature» обратился к
коллегам-естествоиспытателям с предложением вместе подумать и поработать
над разгадкой ее причин…
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха
действительно есть примесь неизвестного газа, более тяжелого, чем азот,
и крайне инертного химически. “Воздух при помощи раскалённой меди был
лишён своего кислорода и затем нагрет с кусочками магния в трубочке.
После того как значительное количество азота было поглощено магнием,
была определена плотность остатка. Плотность оказалась в 15 раз больше
плотности водорода, тогда как плотность азота только в 14 раз больше её.
Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока
не достигла 18. Этим было доказано, что воздух содержит газ, плотность
которого больше плотности азота… Я получил 100 см3 этого вещества и
нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда
они выступили с публичным сообщением о своем открытии, это произвело
ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько
поколений ученых, выполнивших тысячи анализов воздуха, проглядели его
составную часть, да еще такую заметную – почти процент! Кстати, именно в
этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое
в переводе с греческого значит «недеятельный».
Гелий впервые был идентифицирован как химический элемент в 1868
П.Жансеном при изучении солнечного затмения в Индии. При спектральном
анализе солнечной хромосферы была обнаружена ярко-желтая линия,
первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и
П.Жансен доказали, что эта линия не относится ни к одному из известных
на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от
греч. «гелиос», что означает солнце. В то время не знали, что гелий –
инертный газ, и предполагали, что это металл. И только спустя почти
четверть века гелий был обнаружен на земле. В 1895, через несколько
месяцев после открытия аргона, У.Рамзай и почти одновременно шведские
химики П.Клеве и Н.Ленгле установили, что гелий выделяется при
нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь
гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного
газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс
установили, что ?-частицы, испускаемые радиоактивными элементами,
представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа
химических элементов, которая располагается в периодической системе
между щелочными металлами и галогенами. Пользуясь периодическим законом
и методом Менделеева, было определено количество неизвестных благородных
газов и их свойства, в частности их атомные массы. Это позволило
осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами,
даже метеоритами. Результаты анализов неизменно оказывались
отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но
методами, существовавшими в конце прошлого века, эти «микроследы» не
улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при
этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а
затем начинали медленно испарять. Сначала «летят» более легкие газы.
После испарения основной массы воздуха рассортировывают оставшиеся
тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из
методов поиска был спектральный анализ: газ помещали в разрядную трубку,
подключали ток и по линиям спектра определяли «кто есть кто».
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую
фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и
аргона были обнаружены новые линии, из них особенно яркими были красные
и оранжевые. Они придавали свету в трубке огненную окраску. В момент,
когда Рамзай наблюдал спектр только что полученного газа, в лабораторию
вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых
работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло
название газа «неон», по-древнегречески значит «новый».
После того как были открыты гелий, неон и аргон, завершающие три первых
периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый,
пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти
их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и
всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде
всего англичанина Траверса, появилась возможность получать значительные
количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря
этому Рамзай совместно с Траверсом смог заняться исследованием наиболее
труднолетучей фракции воздуха, получа
ukrreferat.com
Аргон инертный газ – часть 2
Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
Обобщение истории открытия
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Строение Аргона
Аргон это газ с завершенным последним электронным уровнем
Ar 1S2 2S2 2P6 3S2 3P6
10 электронов
18 протонов
22 нейтрона
Физические свойства
Общие свойства инертных газов
Все благородные газы– бесцветные одноатомные газ без цвета и запаха
обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятсяНасыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления). В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
Как все инертные газы, аргон диамагнитен. Это значит, что его магнитная восприимчивость отрицательна, он оказывает большее противодействие магнитным силовым линиям, чем пустота. Это свойство аргона (как и многие другие) объясняется «замкнутостью» электронных оболочек его атомов.
Под действием электрического тока аргон ярко светится, сине-голубое свечение аргона широко используется в светотехнике.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях.
Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
Химические свойства
Химическая инертность аргона (как и других газов этой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек. Тем не менее разговор о химии аргона сегодня не беспредметен.
Есть основания считать, что исключительно нестойкое соединение Hg – Ar, образующееся в электрическом разряде, – это подлинно химическое (валентное) соединение. Не исключено, что будут получены валентные соединения аргона с фтором и кислородом, которые, скорее всего, будут неустойчивыми, Как нестойки и даже взрывоопасны окислы ксенона – газа, более тяжелого и явно более склонного к химическим реакциям, чем аргон.
Еще в конце прошлого века француз Вийяр, сжимая аргон под водой при 0°C, получил кристаллогидрат состава Аr · 6Н2 О, а в 20…30-х годах XX столетия Б.А. Никитиным, Р.А. Франкраном и другими исследователями при повышенных давлениях и низких температурах были получены кристаллические клатратные соединения аргона с H2 S, SO2 , галогеноводородами, фенолами и некоторыми другими веществами. В 1976 г. появилось сообщение о синтезе гидрида аргона, но пока еще трудно сказать, является ли этот гидрид истинно химическим, валентным соединением.
Вот пока и все успехи химии…
Аргон на Земле и во Вселенной
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот…
Главное «хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы.
Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40 К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40.
Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон.
Период полураспада 40 К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40 Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон «выдыхается» литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками.
Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.).
Соотношение изотопов 40 Аr: 40 К и 40 Ar: 36 Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии.
Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне.
Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше…
Теперь о легких изотопах.
Откуда берутся 36 Аr и 38 Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов.
Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители», но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
3617 Cl β– → 3618 Ar + 0–1 e + ν.
3316 S + 42 He → 3618 Ar + 10n .
3517 Cl + 42 He → 3818 Ar + 10n + 0+1e .
В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле.
В космическом аргоне главенствуют изотопы 36 Аr и 38 Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660 : 1. А раз мало калия, то откуда же взяться аргону-40?!
Применение
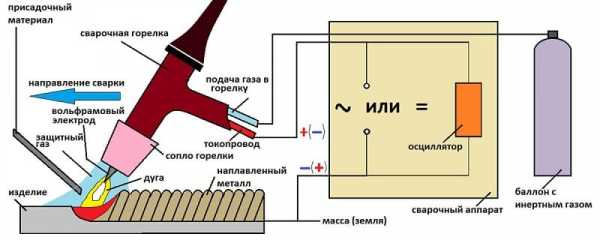
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса
mirznanii.com
Аргон: температура, состояния, сварка
Аргон (обозначается как Ar) — наиболее часто встречающийся в воздухе инертный газ. Он отличается полной химической инертностью. Это свойство позволяет широко применять газ в таких областях, как сварка, упаковка, производство материалов высокой чистоты, а также для тушения пожаров.
 Инертный газ аргон
Инертный газ аргонИстория открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т.е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.
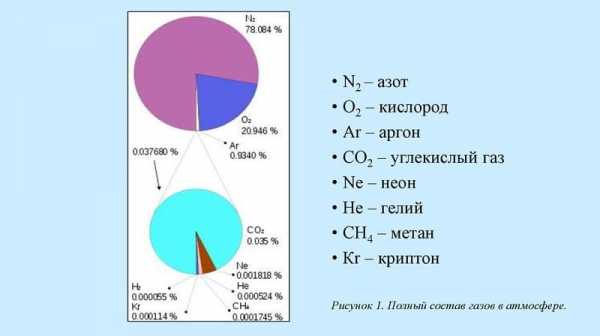
Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.

Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и H2.

Аппарат, получающий ионные пучки аргона
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%.Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др. Используется также для сварки высоконагруженных изделий из конструкционной стали.
- Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м3. Молярная теплоемкость газа- 20,7 Дж/Кмоль.
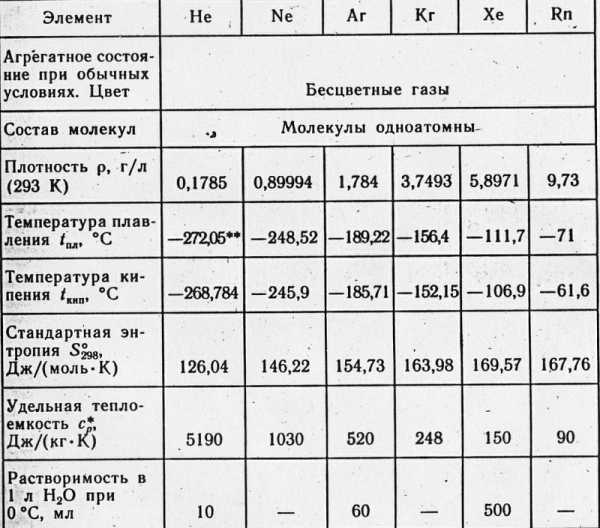
Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.
Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.
Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним. При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
Ионы
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2+.
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
- С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
pV = mRT / M,
проведя преобразования, получим выражение для молярной массы:
M=mRT/pV
где
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.

- Сварка аргоном

- Аргонно-дуговая сварка
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.

- Стеклопакет с аргоном

- Принцип действия стеклопакета с аргоном
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.
- Наполнитель электроламп.
- В рекламных люминесцентных трубках.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 0 | 13,74 |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Техника безопасности при работе с аргоном
Сам по себе не являясь ядовитым, аргон при неправильном использовании может нанести серьезный вред здоровью или даже создать угрозу жизни.
Аргон замещает кислород воздуха и создает смесь, непригодную для дыхания. Человек может пострадать или даже погибнуть от удушья. Сжиженный аргон имеет очень низкую температуру и при контакте с незащищенной кожей приводит к тяжелым обморожениям.

Газоразрядная трубка с аргоном
Во избежание неприятных последствий при работе с газом следует неукоснительно соблюдать следующие правила:
- При работе в атмосфере аргона обязательно использовать изолирующий противогаз.
- При работе на полуавтоматах с подачей аргона обеспечить вентиляцию рабочей зоны.
- Использовать газоанализатор, содержание кислорода в воздухе должно быть не ниже 19%.
- Спецодежда должна полностью закрывать коду, быть чистой и целой.
Перед началом работы также следует осмотреть баллоны, шланги и запорную арматуру на предмет отсутствия механических повреждений и утечек газа.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
Аргон: применение, получение, история
Авторы:
сотрудники компании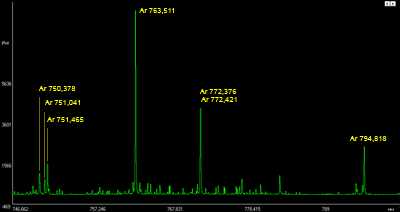
Аналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором – кислород. В процентном отношении это примерно 0,93% по объёму или 1.3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение. Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.
Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
www.iskroline.ru
Реферат – Аргон инертный газ
Общие сведения об открытиях благородных газов
К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин…
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную — почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит «недеятельный».
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a -частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти «микроследы» не улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала «летят» более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли «кто есть кто».
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло название газа «неон», по-древнегречески значит «новый».
После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента! Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу.
Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия — a-частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222.
Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.
Аргон
История открытия Аргона
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин…
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент!
Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Его предложил председательствовавший на собрании доктор Медан.
Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег…
Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
Обобщение истории открытия
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Строение Аргона
Аргон это газ с завершенным последним электронным уровнем
Ar 1S2 2S2 2P6 3S2 3P6
10 электронов
18 протонов
22 нейтрона
Физические свойства
Общие свойства инертных газов
Все благородные газы– бесцветные одноатомные газ без цвета и запаха
обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятсяНасыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления). В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
Как все инертные газы, аргон диамагнитен. Это значит, что его магнитная восприимчивость отрицательна, он оказывает большее противодействие магнитным силовым линиям, чем пустота. Это свойство аргона (как и многие другие) объясняется «замкнутостью» электронных оболочек его атомов.
Под действием электрического тока аргон ярко светится, сине-голубое свечение аргона широко используется в светотехнике.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях.
Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
Химические свойства
Химическая инертность аргона (как и других газов этой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек. Тем не менее разговор о химии аргона сегодня не беспредметен.
Есть основания считать, что исключительно нестойкое соединение Hg – Ar, образующееся в электрическом разряде, – это подлинно химическое (валентное) соединение. Не исключено, что будут получены валентные соединения аргона с фтором и кислородом, которые, скорее всего, будут неустойчивыми, Как нестойки и даже взрывоопасны окислы ксенона – газа, более тяжелого и явно более склонного к химическим реакциям, чем аргон.
Еще в конце прошлого века француз Вийяр, сжимая аргон под водой при 0°C, получил кристаллогидрат состава Аr · 6Н2 О, а в 20…30-х годах XX столетия Б.А. Никитиным, Р.А. Франкраном и другими исследователями при повышенных давлениях и низких температурах были получены кристаллические клатратные соединения аргона с h3 S, SO2, галогеноводородами, фенолами и некоторыми другими веществами. В 1976 г. появилось сообщение о синтезе гидрида аргона, но пока еще трудно сказать, является ли этот гидрид истинно химическим, валентным соединением.
Вот пока и все успехи химии…
Аргон на Земле и во Вселенной
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот…
Главное «хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы.
Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40 К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40.
Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон.
Период полураспада 40 К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40 Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон «выдыхается» литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками.
Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.).
Соотношение изотопов 40 Аr: 40 К и 40 Ar: 36 Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии.
Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне.
Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше…
Теперь о легких изотопах.
Откуда берутся 36 Аr и 38 Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов.
Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители», но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
3617 Cl β– → 3618 Ar + 0–1 e + ν.
3316 S + 42 He → 3618 Ar + 10n .
3517 Cl + 42 He → 3818 Ar + 10n + 0+1e .
В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле.
В космическом аргоне главенствуют изотопы 36 Аr и 38 Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660: 1. А раз мало калия, то откуда же взяться аргону-40?!
Применение
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса
Как добывают аргон
Земная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов.
Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором.
Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10…12% аргона, до 0,5% азота, остальное – кислород. В «аргонной» колонне, присоединенной к основному аппарату, получают аргон с примесью 3…10% кислорода и 3…5% азота. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом.
Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны.
Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов (37 Cl, 36 Аr, 40 Аr, 40 Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37 Аr и 41 Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные.
www.ronl.ru