Формула вуглекислого газу – Формула углекислого газа в химии
alexxlab | 02.08.2020 | 0 | Вопросы и ответы
Формула углекислого газа в химии
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Электронная формула:
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Формула углекислого газа – энциклопедический справочник и словарь для студента от А до Я
ОПРЕДЕЛЕНИЕДвуокись углерода (двуокись углерода, двуокись углерода, моноксид углерода (IV), карбоновый ангидрид, сухой лед) представляет собой бесцветный газ без запаха со слегка кислотным вкусом. Сформировано путем объединения двух элементов: углерода и кислорода.
Химические, структурные и электронные формулы двуокиси углерода
Химическая формула: CO2.
Структурная формула: O = C = O
Электронная формула:
Химические, структурные и электронные формулы двуокиси углерода
Молярная масса: 44,01 г / моль.
Физические свойства двуокиси углерода
В стандартных условиях – газ без цвета и запаха, с кислым вкусом. При атмосферном давлении в жидком состоянии не существует, а сильное охлаждение кристаллизуется в виде «сухого льда» – белой снежной массы. Температура сублимации составляет -78 ° С. В обычных условиях 0,9 объема двуокиси углерода растворяют в одном объеме воды.
Химические свойства двуокиси углерода
Это оксид кислоты.
При растворении в воде образуется угольная кислота:
Он взаимодействует с основными оксидами и основаниями с образованием карбонатов и бикарбонатов (соли углекислоты):
(избыток)
Не поддерживает горение, но при нагревании может окислять активные металлы:
Качественная реакция – мутность извести (Ca (OH) 2) из-за образования белого осадка карбоната кальция:
Углекислый газ образуется гниением и сжиганием органического вещества. Содержится в воздухе и минеральных источниках, высвобождаемых во время дыхания животных и растений.
В промышленности углекислый газ производится термическим разложением карбонатов:
В лаборатории – действием сильных кислот на карбонаты или бикарбонаты:
Примеры решения проблем
ПРИМЕР 1 Рассчитать количество двуокиси углерода (NU), которое может быть получено путем сжигания 12 тонн угля, если выход продукта составляет 90% от теоретически возможного. Напишите уравнение для реакции горения: Рассчитайте количество углеродного вещества по формуле: моль Согласно уравнению реакции моль 1 моль газа в нормальных условиях составляет 22,4 литра. Рассчитайте теоретический объем углекислого газа: Vteor = 22400 м3 Мы вычисляем практический объем углекислого газа: Vpract. м3 Объем производимого диоксида углерода равен 20160 м3. ПРИМЕР 2 Рассчитать объем 20% раствора соляной кислоты (плотность = 1,1 г / мл), что необходимо для получения 5,6 литров диоксида углерода из образца известняка, который содержит 5% примесей. Напишите уравнение реакции: Во время реакции образуется углекислота (h3CO3), которая сразу же разлагается в воду (h3O) и двуокись углерода (CO2). Рассчитайте количество вещества диоксида углерода по формуле: где Vm – молярный объем, т. е. объем, который занимает один моль газа в нормальных условиях. Vm = 22,4 л / моль. Затем: моль Для расчета количества вещества соляной кислоты мы составляем пропорцию в соответствии с уравнением реакции: 2 моля HCl приводят к образованию 1 моль СО2 x моль HCl приводит к образованию 0,25 моль СО2 Отсюда: моль Молярная масса соляной кислоты составляет 36,5 г / моль. Рассчитайте массу соляной кислоты: = 0,5 моль г / моль = 18,25 г Выражение для массовой доли вещества в растворе: Рассчитайте массу раствора соляной кислоты по формуле: Если раствор HCl составляет 20%, то массовая доля соляной кислоты в нем будет равна 0,20. Рассчитайте объем раствора соляной кислоты по формуле: мл Объем 20% -ного раствора соляной кислоты составляет 82,95 мл.
sciterm.ru
Вуглекислий газ — формула, молярна маса, фізичні властивості
Діоксид вуглецю, оксид вуглецю, вуглекислота – всі ці назви однієї і тієї ж речовини, відомої нам як вуглекислий газ. Так якими ж властивостями володіє цей газ, і які сфери його застосування?
Вуглекислий газ і його фізичні властивості
Вуглекислий газ складається з вуглецю і кисню. Формула вуглекислого газу виглядає так
CO2
У природі він утворюється при спалюванні або гнитті органічних речовин. В повітрі і мінеральних джерелах вміст газу також досить великий. Крім того люди і тварини також виділяють діоксид вуглецю при видихання.
Діоксид вуглецю є абсолютно безбарвним газом, його неможливо побачити. Також він не має і запаху. Однак при його великій концентрації у людини може розвинутися гіперкапнія, тобто задуха. Нестача вуглекислого газу також може заподіяти проблеми зі здоров’ям. В результаті нестачі цього газу може розвинутися зворотний стан до задухи – гіпокапнія.
Якщо помістити вуглекислий газ в умови низької температури, то при -72 градусах він кристалізується і стає схожий на сніг. Тому вуглекислий газ в твердому стані називають «сухий сніг».
Вуглекислий газ щільніший за повітря в 1,5 рази.
Його щільність становить 1,98 кг/м3. Хімічний зв’язок в молекулі вуглекислого газу ковалентно-полярний. Полярний він (зв’язок) є через те, що у кисню більше значення електронегативності.
Важливим поняттям при вивченні речовин є молекулярна і молярна маса.
Молярна маса вуглекислого газу дорівнює 44.
Це число формується з суми відносних атомних мас атомів, які входять до складу молекули. Значення відносних атомних мас беруться з таблиці Д. І. Менделєєва і округлюються до цілих чисел.
Відповідно, молярна маса CO2 = 12 + 2 * 16.
Щоб обчислити масові частки елементів в вуглекислому газі необхідно слідувати формі розрахунку масових часток кожного хімічного елемента в речовині.
w = n * Ar/Mr
де
- n – число атомів або молекул;
- Ar – відносна атомна маса хімічного елемента;
- Mr – відносна молекулярна маса речовини.
Розрахуємо відносну молекулярну масу вуглекислого газу.
Mr (CO2) = 14 + 16 * 2 = 44 w (C) = 1 * 12/44 = 0,27 або 27%
Так як в формулу вуглекислого газу входить два атома кисню, то
n = 2 w (O) = 2 * 16/44 = 0,73 або 73%
Відповідь: w (C) = 0,27 або 27%; w (O) = 0,73 або 73%
Хімічні і біологічні властивості вуглекислого газу
Вуглекислий газ має кислотні властивості, так як є кислотним оксидом, і при розчиненні у воді утворює вугільну кислоту:
CO2 + H2O = H2CO3
Вуглекислий газ вступає в реакцію з лугами, в результаті чого утворюються:
- карбонати;
- гідрокарбонати.
Цей газ не схильний до горіння. У ньому горять тільки деякі активні метали, наприклад, магній.
При нагріванні вуглекислий газ розпадається на чадний газ і кисень:
2CO3 = 2CO + O3.
СaO + Co3 = CaCO3.
Вуглекислий газ входить до складу всіх органічних речовин. Кругообіг цього газу в природі здійснюється за допомогою:
- продуцентів;
- консументів;
- редуцентів.
У процесі життєдіяльності людина виробляє приблизно 1 кг. вуглекислого газу на добу.
При вдиху ми отримуємо кисень, проте в цей момент в альвеолах утворюється вуглекислий газ. У цей момент відбувається обмін: кисень потрапляє в кров, а вуглекислий газ виходить назовні.
Отримання вуглекислого газу відбувається при виробництві алкоголю. Також цей газ є побічним продуктом при отриманні:
- азоту;
- кисню;
- аргону.
Застосування вуглекислого газу необхідно в харчовій промисловості, де вуглекислий газ виступає в якості консерванту, а також вуглекислий газ у вигляді рідини міститься в вогнегасниках.
Що ми дізналися?
Вуглекислий газ – це речовина, яка в нормальних умовах не має кольору і запаху. Крім своєї звичайної назви – вуглекислий газ, його також називають:- оксид вуглецю;
- діоксид вуглецю.
moyaosvita.com.ua
Вуглекислий газ
Вуглекислий газ (IV) — безколірний газ, без запаху, володіє злегка кислим смаком. Формується при з’єднанні двох елементів: вуглецю і кисню. Він утворюється в процесі спалювання вугілля або вуглеводневих сполук, при ферментації рідин, а також як продукт дихання людей і тварин. У невеликих кількостях він міститься і в атмосфері, звідки асимілюється рослинами, які, в свою чергу, виробляють кисень.
Вуглекислий газ безбарвний і важчий за повітря. Замерзає при температурі -78,5 °C з утворенням снігу, що складається з двоокису вуглецю. У вигляді водного розчину він утворює вугільну кислоту, проте вона не володіє достатньою стабільністю для того, щоб її можна було легко ізолювати.
Вуглекислий газ – це «ковдра» Землі. Він легко пропускає ультрафіолетові промені, які обігрівають нашу планету, і відбиває інфрачервоні промені, що випромінюються з її поверхні в космічний простір. І якщо раптом вуглекислий газ зникне з атмосфери, то це в першу чергу позначиться на кліматі. На Землі стане набагато прохолодніше, дощі будуть випадати дуже рідко.
Правда, така катастрофа нам поки що не загрожує. Скоріше навіть, навпаки. Спалювання органічних речовин: нафти, вугілля, природного газу, деревини – поступово збільшує вміст вуглекислого газу в атмосфері.
Вуглекислий газ нетоксичний і невибухонебезпечний.
Вуглекислий газ: історія відкриття
Вуглекислий газ був першим між усіма іншими газами, який був протиставленим повітрю під назвою “дикого газу” алхіміком XVI ст. Вант Гельмонтом.
Відкриттям СО2 було покладено початок новій галузі хімії – пневматохімії (хімії газів).
Шотландський хімік Джозеф Блек (1728 – 1799 р.р.) в 1754 році встановив, що вапняний мінерал мармур (карбонат кальцію) при нагріванні розкладається з виділенням газу і утворює негашене вапно (оксид кальцію).
Виділений газ можна було знову з’єднати з оксидом кальцію і знову отримати карбонат кальцію.
Цей газ був ідентичний до відкритого Ван Гельмонтом “дикого газу”, але Блек дав йому нову назву – “зв’язане повітря” – так як його можна було зв’язати і знову отримати тверду субстанцію, а також він мав здатність притягуватися вапняною водою (гідроксидом кальцію) і викликати її помутніння.
Кілька років потому Кавендіш виявив ще два характерні фізичні властивості вуглекислого газу – його високу густину і значну розчинність у воді.
Вуглекислий газ в природі
Вуглекислий газ в атмосфері Землі, станом на 2011 рік, представлений у кількості 392 ppm або 0,0392 %. Роль вуглекислого газу в життєдіяльності біосфери полягає насамперед у підтримці процесу фотосинтезу, який здійснюється рослинами. Будучи парниковим газом, вуглекислий газ в повітрі впливає на теплообмін планети з навколишнім простором і таким чином бере участь у формуванні клімату планети.
У зв’язку з активним використанням людством викопних енергоносіїв в якості палива, відбувається швидке збільшення концентрації цього газу в атмосфері. Вперше антропогенний вплив на концентрацію вуглекислого газу відзначили в середині XIX століття. Починаючи з цього часу, темп її зростання збільшувався і наприкінці 2000-х відбувався зі швидкістю 2,20 ± 0,01 ppm/год або 1,7% за рік. Відповідно до окремих досліджень, сучасний рівень CO2 в атмосфері є максимальним за останні 800 тис років і, можливо, за останні 20 млн років.
Вуглекислий газ: одержання
У промисловості вуглекислий газ отримують з пічних газів, з продуктів розкладання природних карбонатів (вапняк, доломіт). Суміш газів промивають розчином карбонату калію, який поглинає вуглекислий газ, переходячи в гідрокарбонат. Розчин гідрокарбонату при нагріванні розкладається, вивільняючи вуглекислоту. При промисловому виробництві газ закачується у балони.
У лабораторних умовах невеликі кількості отримують взаємодією карбонатів і гідрокарбонатів з кислотами, наприклад мармуру з соляною кислотою.
Вуглекислий газ: застосування
Хімічна галузь
Вуглекислий газ використовується при виробництві синтетичних хімічних речовин та регулюванні реакторних температур. Він також служить для нейтралізації лужних стічних вод. У закритих умовах вуглекислий газ використовується в процесах очищення або осушування полімерів, волокон тваринного або рослинного походження.
Фармацевтика
Вуглекислий газ використовується для створення інертного середовища синтезу хімічних речовин, надкритичної флюїдної екстракції (SFE), підкислення (pH) стічних вод або продукту при їх низькотемпературному транспортуванні (-78 °C).
Харчова галузь
У харчовій галузі виділяються такі основні напрямки застосування вуглекислого газу:
- Насичення вуглекислотою шипучих напоїв, у тому числі безалкогольних напоїв, мінеральної води та пива.
- Упаковка харчових продуктів – інертні і бактерицидні властивості вуглекислого газу успішно використовуються в азотних сумішах (упаковка в модифікованій атмосфері) для збільшення терміну зберігання багатьох продуктів харчування.
- Процеси охолодження або заморожування (у вигляді кріогенної рідини) і контроль температури при розподілі харчових продуктів (у вигляді сухого льоду).
- Видалення кофеїну з кави з використанням вуглекислого газу в надкритичному стані.
Медицина
При проведенні операцій на штучних органах вуглекислий газ служить для створення атмосферних умов, близьких до фізіологічних.
Як один з компонентів кисневої або повітряної суміші вуглекислий газ служить стимулятором глибокого дихання.
Металургійна галузь
Найбільш популярним застосуванням вуглекислого газу в металургії є захист навколишнього середовища:
- CO2 застосовується для осадження бурого диму в процесах завалки брухту і закачування вуглецю, для скорочення об’єму поглинання азоту в процесі відкриття електродугових печей, а також для донного перемішування.
- Галузь переробки кольорових металів використовує вуглекислий газ для осадження диму в процесі ковшового транспортування Штейна (виробництво Cu/Ni) або злитків (виробництво Zn/Pb).
- Невелика кількість рідкого вуглекислого газу може використовуватися при рециркуляції води в процесі відведення кислотних шахтних вод.
- Лазери, що використовують вуглекислий газ, добре відомі ще й як споживачі деяких спеціальних марок діоксиду вуглецю.
Лабораторні дослідження і аналіз
Вуглекислий газ в надкритичному стані є рухливою фазою, що використовується як в процесі хроматографічного аналізу, так і в процесах екстрагування.
Целюлозно-паперова галузь
Після лужного відбілювання деревної маси або целюлози вуглекислий газ дозволяє з високою точністю регулювати рівень pH в переробленій сировині.
CO2 може використовуватися в процесах нейтралізації талової оливи і з метою підвищення продуктивності папероробних машин.
Електроніка
Вуглекислий газ стандартно застосовується для обробки стічних вод, а в якості охолоджуючого середовища він використовується при випробуванні електронних приладів на вплив навколишнього середовища.
Крім цього вуглекислий газ дозволяє підвищувати провідність надчистої води, а у вигляді снігу використовується для абразивного очищення деталей або видалення осадів на кристалічних пластинах.
Додатково вуглекислий газ може використовуватися в якості екологічно чистої надкритичної рідини для видалення матеріалів, які тверднуть під дією світла, з кристалічних пластин без застосування органічних розчинників.
Охорона навколишнього середовища
Додавання вуглекислого газу дозволяє підтримувати необхідний рівень pH у рідких стоках. Як регулятор рН він є прекрасною альтернативою сірчаній кислоті.
Дихання і вуглекислий газ
Вуглекислий газ (СО2), вуглекислота та її сполуки відіграють дуже важливу роль у життєдіяльності організму. Вуглекислота бере участь у розподілі іонів натрію в тканинах, регулюючи тим самим збудливість нервових клітин, впливає на проникність клітинних мембран, активність багатьох ферментів, інтенсивність продукування гормонів і ступінь їх фізіологічної ефективності, процес зв’язування білками іонів кальцію і заліза.
Існує пряма залежність між концентрацією вуглекислоти в крові та інтенсивністю функціонування травних залоз (слинних, підшлункової, печінки), а також залоз слизової шлунка, що утворюють соляну кислоту.
Від вмісту в крові вуглекислоти залежить надходження в тканини кисню. Нарешті, вуглекислота відіграє важливу роль в сталості кислотно-лужної рівноваги, у біосинтезі білка і карбоксилювання амінокислот.
Цей перелік можна продовжувати, але навіть викладеного цілком достатньо, щоб не вважати вуглекислоту простим “шлаком”, який необхідно якомога швидше вивести з організму. Нижче буде описано шкоду надмірного виведення вуглекислого газу (продукту розщеплення вуглекислоти) з організму. Присутність вуглекислоти – це обов’язкова умова існування людини, і склалася вона історично, коли виникло життя на Землі. Відповідно до сучасних поглядів, це сталося кілька мільярдів років тому. Атмосфера нашої планети була тоді перенасичена вуглекислим газом (понад 90%), і він став природним будівельним матеріалом живих клітин. Поступово це привело до зміни складу повітря, але внутрішні умови роботи клітин як і раніше визначалися високим вмістом вуглекислоти. Перші тварини, що з’явилися на Землі і харчувалися рослинами, все ще перебували в атмосфері з високим вмістом вуглекислого газу. Тому їх клітини, а пізніше і створені на базі древньої генетичної пам’яті клітини сучасних тварин і людини, потребують вуглекислого середовища всередині себе (6-8% вуглекислоти і 1-2 % кисню) і в крові (7-7,5 % вуглекислого газу ).
Рослини утилізували майже весь вуглекислий газ повітря, і основна його частина у вигляді вуглецевих сполук разом із загибеллю рослин потрапила в землю, перетворившись на корисні копалини (вугілля, нафта, торф). В даний час в атмосфері міститься близько 0,03 % вуглекислого газу і приблизно 21% кисню. Але для нормальної життєдіяльності в крові має бути 7-7,5 % вуглекислого газу, а в альвеолярному повітрі – 6,5 %. Ззовні його отримати не можна, так як в атмосфері майже не міститься вуглекислого газу. Тварини і людина отримують його при повному розщепленні їжі, так як білки, жири, вуглеводи побудовані на вуглецевій основі, при спалюванні за допомогою кисню в тканинах утворюється вуглекислий газ.
Зараз у людей часто спостерігається явище гіпервентиляції. Найчастіше, оскільки вуглекислий газ життєво необхідний, при його надмірній втраті в тій чи іншій мірі включаються захисні механізми, які намагаються зупинити його видалення з організму. До них відносяться:
- спазм судин, бронхів і спазм гладкої мускулатури всіх органів;
- звуження кровоносних судин;
- збільшення секреції слизу в бронхах, носових ходах, розвиток аденоїдів, поліпів;
- ущільнення мембран внаслідок відкладення холестерину, що сприяє розвитку склерозу тканин;
- підвищення функції щитовидної залози.
Всі ці моменти разом з ускладненням надходження кисню в клітини при зниженні вмісту вуглекислого газу в крові (ефект Веріго-Бора) ведуть до кисневого голодування, уповільнення венозного кровотоку (з подальшим стійким розширенням вен).
Читайте також:
Коментарі:
www.npblog.com.ua
Углекислый газ – это… Что такое Углекислый газ?
| Диоксид углерода | |
|---|---|
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
- Не следует путать с Диоксин.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
biograf.academic.ru
Углекислота – это… Что такое Углекислота?
| Диоксид углерода | |
|---|---|
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
- Не следует путать с Диоксин.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
dic.academic.ru
формула, свойства и области применения :: SYL.ru
Диоксид углерода (углекислый газ) – часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения – гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так: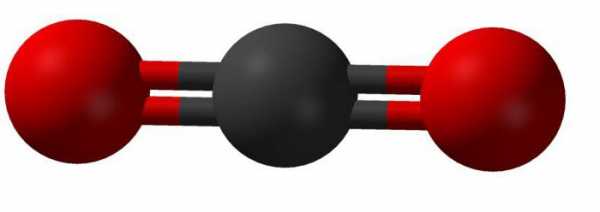
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации – угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + H2O ↔ H2CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3– . В очень небольшом количестве образуются ионы СО3–.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + H2O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2H2O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
www.syl.ru

