Кристаллическая решетка железа картинки – Почему мы видим микроструктуру стали?
alexxlab | 26.02.2020 | 0 | Вопросы и ответы
Почему мы видим микроструктуру стали?
Стали на 95 % состоят из железа. Поэтому хорошим началом для их понимания является изучение природы твердого железа. Небольшой кусок железа состоит из миллионов маленьких кристаллов — зерен. Типичный размер зерна от 30 до 50 микрометров. Границы между кристаллами называют границами зерен. Зерна вместе с границами между ними составляют микроструктуру железа.
Микроструктура железа
Возьмем пруток из чистого железа, например, диаметром 25 мм. Из него вырежем диск в форме большой монеты. Поверхность этого диска отполируем, начиная с самой грубой полировки, и постепенно дойдем до самой тонкой, пока плоскость образца не будет иметь вид зеркала. Затем этот зеркальный диск погружаем приблизительно на 20-30 секунд в смесь с 2-5 % азотной кислоты с метиловым спиртом. Этот процесс называется травлением, после которого зеркальная поверхность нашего образца становится мутного серого цвета. Если на эту поверхность посмотреть в оптическом микроскопе при увеличении 100х, то мы обнаружим картину, показанную справа на рисунке 1 — это и есть
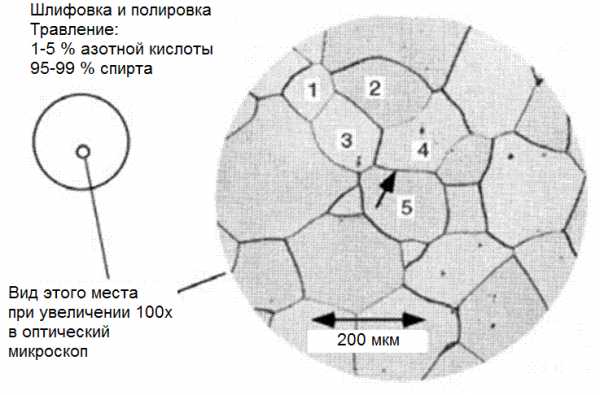 Рисунок 1 — Микроструктура железа
Рисунок 1 — Микроструктура железа
Отдельные области микроструктуры , которые пронумерованы от 1 до 5, называются зернами железа, а границы между ними (такая как между зернами 4 и 5 и на которую указывает стрелка) называются границами зерен. Средний размер зерна весьма мал. При увеличении 100х этой фотографии длина 200 мкм показана обоюдоострой стрелкой.
Средний диаметр зерна в этом образце составляет 125 мкм (напомним, что 1 мкм = 1 микрометр = 0,001 мм). Микрометр (его иногда по старинке называют микроном) довольно маленькая величина. Толщина алюминиевой фольги и человеческого волоса равна приблизительно 50 мкм. Хотя размер зерна нашего образца кажется весьма малым, он намного больше, чем у большинства промышленных железных прутков.
Кристаллическая решетка железа
Основными строительными блоками твердых веществ, таких как соль или лед, являются молекулы. Каждая молекула состоит из двух или более атомов, например, натрий+хлор (NaCl), как у поваренной соли и водород+кислород, как у льда (H2O). В металлах, однако, такими строительными блоками являются отдельные атомы металла: атомы железа (Fe) в железном прутке или меди (Cu) в медной проволоке. Каждое зерно на рисунке 1 есть то, что называется кристаллом. В кристалле, который состоит из атомов, все атомы однородно расположены по слоям. Как показано на рисунке 2, если провести линии, которые соединяют центры атомов, то трехмерные ряды маленьких кубиков заполнят все пространство, занимаемое отдельным зерном. Эту трехмерную структуру и называют кристаллической решеткой атомов.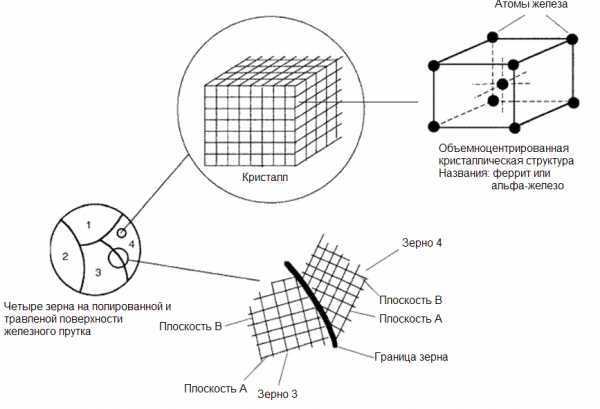 Рисунок 2 — Кристаллическая решетка железа
Рисунок 2 — Кристаллическая решетка железа
Кристаллическая решетка феррита
В железе при комнатной температуре эти кубики имеют атомы в каждой из восьми углов и один атом прямо в центре куба. Эту
Микроструктура железа: как образуются границы зерен
Природа границы зерен показана в нижней части рисунка 2. Эта граница является поверхностью, вообще неплоской, вдоль которой пересекаются два зерна с различной ориентацией. Плоскость А зерна 4 находится под значительно более крутым углом, чем плоскость А зерна 3. Если повернуть зерно 4 по часовой стрелке до совпадения с плоскостью А зерна 3, то граница зерна исчезнет и два зерна станут одним большим зерном.
Почему микроструктура так хорошо видна по микроскопом?
Для выявления микроструктуры железо (или сталь) травится в кислоте, его атомы химически удаляются с поверхности. Скорость удаления атомов железа при травлении образца зависит от ориентации кристалла, с которой он воздействует с кислотой. Поскольку каждое зерно представляет различную ориентацию, каждое зерно стравливается с различной скоростью. Например, плоскости, которые образуют грани объемноцентрированных кубов, травятся намного медленнее, чем другие кристаллические плоскости. Поэтому после некоторого периода травления по границам зерен образуются малые ступеньки, как это показано на рисунке 3. Например, по границе быстро травящегося зерна можно видеть ступеньку к окружающим его зернам. Эта ступенька обычно хорошо рассеивает свет и границы выглядят как темные линии. Так микроструктура становится видимой при наблюдении в микроскоп.
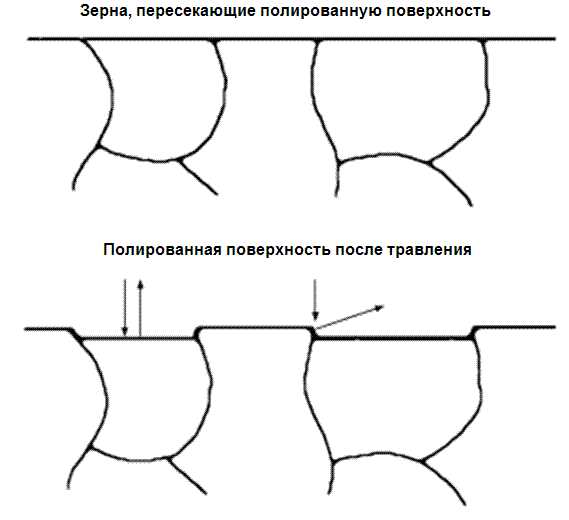 Рисунок 3 — Выявление микроструктуры железа
Рисунок 3 — Выявление микроструктуры железа
Источник: John D. Verhoeven
Кристаллическое строение металлов. Кристаллическая решетка металлов
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным – железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Общее понятие о металлах
“Химия. 9 класс” – это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.

Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность – способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность – одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.

Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение – это науки, которые занимаются изучением особенностей строения таких структур.
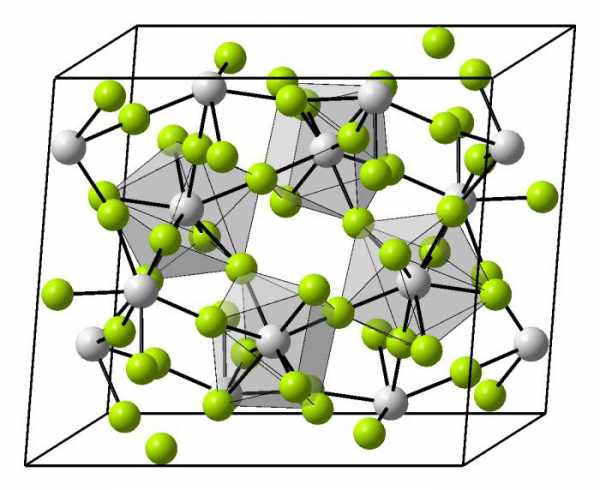
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Типы кристаллических решеток
Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие:
- Объемно-центрированная кубическая.
- Гексагональная плотноупакованная.
- Гранецентрированная кубическая.
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.

Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название “объемно-центрированная”.
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей – высокая степень ковкости и пластичности, твердость и прочность.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства – блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.

Гексагональная решетка
Кристаллическое строение металлов, обладающих данным типом решетки, следующее. В основе элементарной ячейки лежит шестигранная призма. В ее узлах располагается 12 атомов, еще два по основаниям и три атома свободно лежат внутри пространства в центре структуры. Всего семнадцать атомов.
Подобную сложную конфигурацию имеют такие металлы, как:
- альфа-титан;
- магний;
- альфа-кобальт;
- цинк.
Основные свойства – высокая степень прочности, сильный серебристый блеск.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.

Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав – строение – свойства – применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
fb.ru
Кристаллические решетки: виды, свойства
Содержание:
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Железо. Описание, свойства, происхождение и применение металла

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
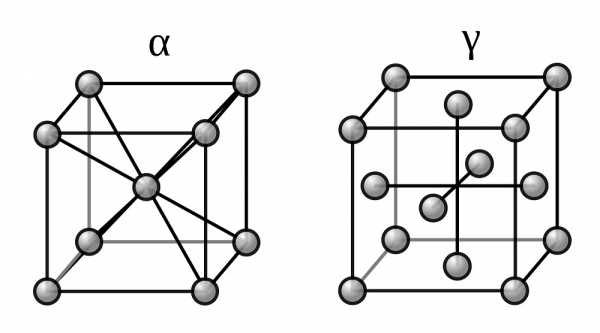
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а 0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
Интересные статьи:
mineralpro.ru 13.07.2016mineralpro.ru
Раздел 6. Металлы Атомно-кристаллическое строение металлов
Металлы – кристаллические вещества, характеризующие высокими электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны и другими специфическими свойствами. Свойства металлов обусловлены их строением: в их кристаллической решётке есть не связанные с атомами электроны, которые могут свободно перемещаться.
Строение металлов представлено в виде мнимой пространственной решетки из пересекающихся стержней, в местах пересечения, которых располагаются атомы, потерявшие свои валентные электроны. Эти электроны становятся общими для всей совокупности атомов. Электроны образуют электронное облако, или электронный газ и хаотически движутся в пространстве между атомами. Атомы в узлах решетки совершают колебательное движение с частотой 1013 колебаний в сек. Скорость хаотического движения электронов, и амплитуда колебаний атомов зависит от температуры (с повышением температуры скорость движения электронов и колебаний атомов увеличивается).
Строение всех металлов характеризуется закономерным и периодически повторяющимся расположением атомов в кристаллической решётке.
Любая решётка характеризуется размером, этот размер носит название период или параметр кристаллической решётки – это расстояние между ближайшими параллельными кристаллическими плоскостями (а). Если а– одинаков во всех направлениях, то решетка кубическая.

Минимальный объём носит название элементарная кристаллическая ячейка – это минимальный объём кристаллической решётки, перемещая которую, можно построить всю решётку.
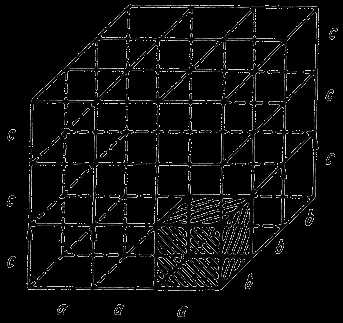
Различают простую элементарную кристаллическую ячейку (1), когда атомы располагаются только в узлах сечения.
Сложная элементарная кристаллическая ячейка, когда атомы располагаются не только в узлах ячейки, но и в между узлиях (2), (3), (4).
Чаще всего это кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная решетки
В объемно-центрированной кубической (ОЦК) решетке восемь атомов располагаются в вершинах куба и один в центре. ОЦК решетку имеют железо при комнатной температуре, ванадий, вольфрам, молибден, хром и др. металлы (рис. 3 а).
В гранецентрированной кубической (ГЦК) решетке атомы расположены в вершинах куба и в центрах шести граней. ГЦК решетку имеют алюминий, медь, никель, свинец, серебро и др. металлы (рис. 3 б).
Гексагональная плотноупакованная (ГПУ) решетка представляет собой шестигранную призму, в основании которой расположены правильные шестиугольники. Атомы расположены в вершинах и центрах этих шестиугольников. ГПУ решетку имеют магний, цинк, титан, цирконий и др. металлы (рис. 3 в).
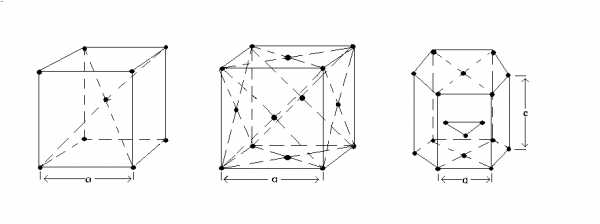
а) б) в)
Рисунок 3 – Типы кристаллических решеток металлов:
А) объемноцентрированная кубическая
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
До 910°С железо Fe существует в модификации α – Feα (ОЦК)
При температуре с 910°С до 1400°С – Feγ (ГЦК)
При температуре 1400°С – 1539°С – Feδ (ОЦК)
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Металлы обладают целым рядом общих свойств:
Высокая электо- и теплопроводимость
Характерный металлический блеск
Положительный коэффициент электросопротивления
Способность к значительной пластической деформации
Все металлы непрозрачны.
studfiles.net
1.Кристаллическое строение металлов. Типы кристаллических решёток.
В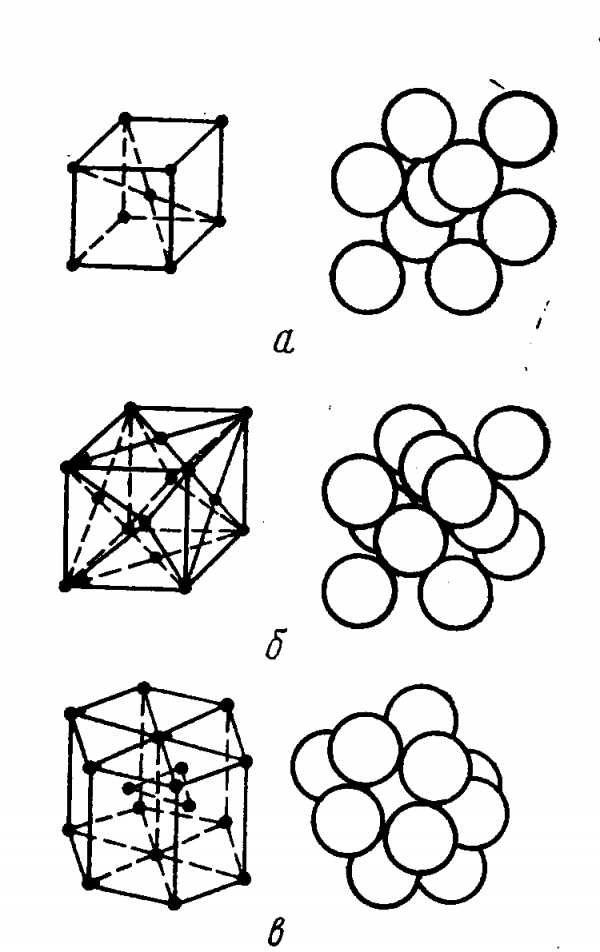 се
тела состоят из атомов. Тела, в которых
атомы расположены беспорядочно, называютаморфными(стекло, канифоль, воск,
смола и др.).Кристаллические тела(все металлы и металлические сплавы),
характеризуются упорядоченным
расположением атомов. В металлах и
металлических сплавах атомы находятся
в узлах пространственных кристаллических
решеток.
се
тела состоят из атомов. Тела, в которых
атомы расположены беспорядочно, называютаморфными(стекло, канифоль, воск,
смола и др.).Кристаллические тела(все металлы и металлические сплавы),
характеризуются упорядоченным
расположением атомов. В металлах и
металлических сплавах атомы находятся
в узлах пространственных кристаллических
решеток.
В процессе кристаллизации металлов и сплавов могут образовываться кристаллические решетки разного типа. Наиболее распространенными являются объемно-центрированная кубическая (рис.1, а) (К,V, Сr,Fеа, Мо,W), гранецентрированная кубическая (рис.1, б) (Аl,Fe, Ni, Сu, Аg, Аu, Рb) и гексагональная решетки(рис.1, а) (Ве, Мg, Со,Zn, Тi). Гранецентрированная кубическая и гексагональная решетки характеризуются наиболее плотной упаковкой атомов и их компактным размещением.
Расстояния между соседними атомами в кристаллической решетке (параметр решётки) Рис.1
исключительно малы. Для их измерения пользуются особой единицей – ангстремом (А°), который равен 1А°=10-8см, или нанометром (1 нм=10-9см).
2. Аллотропические превращения в металлах.
Некоторые металлы в твердом состоянии (железо, марганец, кобальт и др.) в зависимости от температуры нагрева могут иметь кристаллические решетки различного строения и, следовательно, обладать различными свойствами. Это явление называется аллотропией, илиполиморфизмом.Кроме того, известен полиморфизм под влиянием температуры и давления. При нагреве до 2000 °С и давлении ~ 1010Па углерод в форме графита перекристаллизовывается в алмаз.
Аллотропические формы принято обозначать буквами греческого алфавита: альфа, бета, гамма и т. д.
К металлам, не претерпевающим аллотропических превращений в твердом состоянии при нагревании и охлаждении, относятся алюминий, магний, медь и др. Большое число технически важных металлов (олово, цинк, никель, кобальт и др.) подвержено аллотропическим изменениям.
3. Процесс кристаллизации. Дефекты кристаллического строения.
Кристаллизациейназывается образование кристаллов в металлах и сплавах при переходе из жидкого состояния в твёрдое (первичная кристаллизация), а также перекристаллизация в твёрдом состоянии (вторичная кристаллизация).
Процесс кристаллизации металла складывается из двух элементарных процессов: образования центров кристаллизации (зародышей) и роста кристаллов из этих центров. При температуре кристаллизации в жидком металле сначала образуются центры кристаллизации, причем их роль играют разные примеси, мельчайшие шлаковые и неметаллические включения. После образования зародышей атомы жидкого металла, расположенные беспорядочно, начинают располагаться вокруг этих зародышей и образуют кристаллы правильной геометрической формы. Так как кристаллизация начинается одновременно во многих местах и рост кристаллов идет по всем направлениям, то смежные кристаллы, сталкиваясь между собой, мешают свободному росту каждого. Это приводит к тому, что кристаллы приобретают неправильную внешнюю форму, несмотря на их упорядоченное внутреннее строение. Кристаллы неправильной формы принято называть кристаллитами, полиэдрами, или зернами. Образовавшиеся реальные кристаллы имеют те или иные несовершенства (дефекты) кристаллического строения, которые принято классифицировать по характеру их измерения в пространстве на точечные (нульмерные), линейные (одномерные),
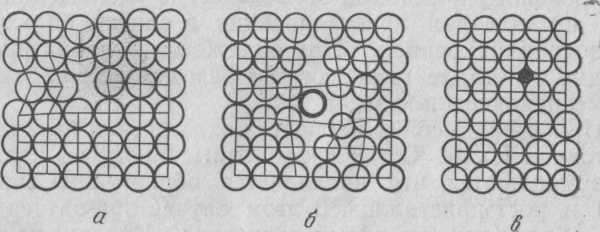
Рис. 2. Точечные дефекты в кристаллической решетке:
а — вакансия; б — межузельный атом; в — примесный атом внедрения
поверхностные (двухмерные), объемные (трехмерные).
Наиболее распространены точечные. К ним относят вакансии(узлы в кристаллической решетке, свободные от атомов),межузельные атомы (атомы, находящиеся вне узлов кристаллической решетки), а такжепримесные атомы(рис.2).
studfiles.net
Кристаллическая решетка – железо – Большая Энциклопедия Нефти и Газа, статья, страница 1
Кристаллическая решетка – железо
Cтраница 1
Кристаллическая решетка железа при комнатной температуре – кубическая объемно центрированная. Это означает, что элементарной ячейкой является куб, во всех вершинах которого, а также в центре – на пересечении пространственных диагоналей – находятся атомы железа. Сколько атомов приходится на объем, равный объему одной элементарной ячейки в кристалле железа. [1]
Кристаллическая решетка железа кубическая. Молярная масса железа А 56 10 – 3 кг / моль. [2]
Кристаллическая решетка железа относится к системе кубических объемно-центрированных решеток. Определите магнитный момент, приходящийся на один атом железа, в магнетонах Бора. [3]
Кристаллическая решетка железа кубическая. [4]
Искажение кристаллической решетки железа, увеличивающееся по мере увеличения разницы в атомных размерах, оказывает влияние на свойства феррита. Практически все элементы при содержании больше 1 % снижают ударную вязкость феррита. Исключение составляет только никель. [5]
Искажение кристаллической решетки железа, увеличивающееся по мере увеличения разницы в атомных размерах, оказывает влияние на свойства феррита. Практически все элементы при содержании больше 1 % снижают ударную вязкость феррита. [7]
Например, кристаллическая решетка железа имеет кубическую форму, причем различают модификации: центрированный куб Fe a ( фиг. Гексагональная форма решетки свойственна цинку, кадмию и другим цветным металлам ( фиг. [8]
Кислород в кристаллической решетке железа не растворяется, поэтому в стали он присутствует в виде зерен оксидов железа FeO, Fe203 и других элементов. Эти неметаллические включения снижают прочностные и пластические свойства стали. [9]
Углерод, растворенный в гранецентрированной кристаллической решетке железа, понижает температуру ее перекристаллизации в объемно-центрированную. Полная перекристаллизация заканчивается при температуре 727 С. Формирование структуры заканчивается при температуре 727 С, когда еше не распавшийся аустенит переходит в перлит. Процесс превращения аустенита в перлит протекает за определенный промежуток времени. Наиболее наглядно этот процесс прослеживается на стали, содержащей 0 8 % углерода. Такая сталь до температуры 727 С состоит из одного аустенита. При температуре 727 С определенное время сталь продолжает иметь структуру аустенита, затем происходит перекристаллизация граиецептрнрованпей кристаллической решетки железа в объемно-центрированную. Сразу же после перекристаллизации внутри объемно-центрированной кристаллической решетки железа остается 0 8 %, углерода, столько же, сколько било внутри гранецентрированной. Однако при температуре 727 С внутри объемно-центрированной кристаллической решетки может быть растворено только 0 025 % углерода. Поэтому избыточный против этого количества углерод выделяется из кристаллической решетки железа. Выделившиеся атомы углерода вступают во взаимодействие с железом, образуя цементит. [10]
Вследствие значительной разницы в кристаллических решетках железа и графита и наличия сильных связей в растворе между железом и углеродом энергетически выгоднее, чем графиту, кристаллизоваться из раствора промежуточной фазе – цементиту. При наличии готовой зародышевой фазы ( с размером не меньше критического) возможна при длительных выдержках, повышенных температурах и медленном охлаждении непосредственная кристаллизация графита ив пересыщенных растворов. [11]
Различие размеров протонов и параметров кристаллической решетки железа ( не менее чем на пять порядков) обусловливает протекание диффузии путем перемещения протонов через междоузлия. [12]
Любое внедрение атомов углерода в кристаллическую решетку железа энергетически не выгодно, так как это приводит к ее деформации и искажению. Скопления атомов углерода могут привести к образованию не пластинчатого, а замкнутого, в виде фуллеренов, строения. [14]
Образовавшийся перенасыщенный раствор углерода в объемно-центрированной кристаллической решетке железа называют мартенситом. [15]
Страницы: 1 2 3 4
www.ngpedia.ru

