Защита от коррозии металлов – промышленные и бытовые способы (+32 фото)
alexxlab | 10.11.2020 | 0 | Вопросы и ответы
Защита от коррозии металла: катодная, анодная, покрытия
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.
 Защита от коррозии
Защита от коррозииВиды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.
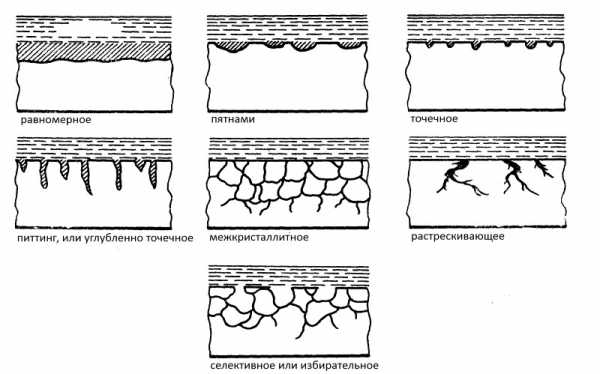
Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

Грунт-преобразователь ржавчины
При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Краска-серебрянка
Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
основные методы и их особенности
 Одной из серьезных угроз для инструментов и конструкций, выполненных из металла, является коррозия. По этой причине большую актуальность приобретает проблема их защиты от столь неприятного процесса. При этом сегодня известно немало методов, которые позволяют достаточно эффективно решить эту проблему.
Одной из серьезных угроз для инструментов и конструкций, выполненных из металла, является коррозия. По этой причине большую актуальность приобретает проблема их защиты от столь неприятного процесса. При этом сегодня известно немало методов, которые позволяют достаточно эффективно решить эту проблему.
Антикоррозионная защита — зачем она нужна
Коррозия представляет собой процесс, сопровождающийся разрушением поверхностных слоев конструкций из стали и чугуна, возникающий в результате электрохимического и химического воздействия. Негативным следствием этого становится серьезная порча металла, его разъедание, что не позволяет использовать его по назначению.
Экспертами было проведено достаточно доказательств тому, что ежегодно порядка 10% от общего объема добычи металла на планете уходит на устранение потерь, связанных с воздействием коррозии, из-за которой происходит расплавление металлов и полная потеря эксплуатационных свойств металлическими изделиями.
При первых признаках воздействия коррозии изделия из чугуна и стали становятся менее герметичными, прочными. В то же время ухудшаются такие качества, как теплопроводность, пластичность, отражательный потенциал и некоторые иные важные характеристики. В дальнейшем конструкции и вовсе нельзя применять по назначению.
Вдобавок к этому именно с коррозией связывают большинство производственных и бытовых аварий, а также и некоторые экологические катастрофы. Трубопроводы, используемые для транспортировки нефти и газа, имеющие значительные участки, покрытые ржавчиной, могут в любой момент лишиться своей герметичности, что может создать угрозу для здоровья людей и природы в результате прорыва подобных магистралей. Это дает понимание того, почему так важно предпринимать меры по защите конструкций из металла от коррозии, прибегая к помощи традиционных и новейших средств и методов.
К сожалению, пока не удалось создать такой технологии, которая бы смогла полностью защитить стальные сплавы и металлы от коррозии. При этом имеются возможности для задержания и уменьшения негативных последствий подобных процессов. Эта задача решается посредством использования большого количества антикоррозионных средств и технологий.
Предлагаемые сегодня методы борьбы с коррозией могут быть представлены в виде следующих групп:
- Использование электрохимических методов защиты конструкций;
- Создание защитных покрытий;
- Разработка и производство новейших конструкционных материалов, демонстрирующих высокую стойкость к коррозионным процессам;
- Добавление в коррозионную среду особых соединений, благодаря которым можно замедлить распространение ржавчины;
- Грамотный подход к выбору подходящих деталей и конструкций из металлов для сферы строительства.
Защита изделий из металла от коррозии
Обеспечить способность защитного покрытия выполнять поставленные перед ним задачи можно за счет
- Устойчивость к износу и высокий уровень твердости;
- Повышенные характеристики прочности сцепления с поверхностью обрабатываемого изделия;
- Наличие коэффициента теплового расширения, предусматривающего незначительное отклонение от расширения защищаемой конструкции;
- Высокий уровень защиты от негативного воздействия со стороны вредных факторов внешней среды.
Создавать подобные покрытия следует тем расчетом, чтобы они располагались на всей площади конструкции в виде максимально равномерного и сплошного слоя.
Доступные сегодня защитные покрытия для металла могут быть классифицированы на следующие типы:
- металлические и неметаллические;
- органические и неорганические.
Подобные покрытия получили широкое распространение во многих странах. Поэтому им будет уделено особое внимание.
Борьба с коррозией при помощи органических покрытий
Чаще всего для защиты металлов от коррозии прибегают к такому эффективному методу, как использование лакокрасочных составов. Этот метод на протяжении многих лет демонстрирует высокую эффективность и несложность в плане реализации.
Использование подобных соединений в борьбе против ржавчины предусматривает достаточно преимуществ, среди которых простота и доступная цена не являются единственными:
- Используемые покрытия могут придавать обрабатываемому изделию различный цвет, в результате это позволяет не только надежно защитить изделие от ржавчины, но и обеспечить конструкциям более эстетичный внешний вид;
- Отсутствие сложностей с реставрацией защитного слоя в случае его повреждения.
Увы, однако у лакокрасочных составов имеются и определенные недостатки, к числу которых нужно отнести следующие:
- низкий коэффициент термической стойкости;
- низкая устойчивость в водной среде;
- низкая стойкость к воздействию механического характера.
Это вынуждает, чему не противоречат требования действующих СНиП, прибегать к их помощи в ситуации, когда изделия подвергаются воздействию со стороны коррозии с максимальной скоростью 0,05 мм в год, при этом расчетный срок службы не должен превышать 10 лет.
Ассортимент предлагаемых сегодня на рынке лакокрасочных составов может быть представлен в виде следующих элементов:
-
 Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой;
Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой; - Лаки. Представлены в виде растворов и масел, присутствующих в растворителях органического происхождения. При их использовании эффект достигается лишь по завершении полимеризации смолы или масла или же в момент испарения, вызванного воздействием дополнительных катализаторов или же нагревом;
- Пленкообразователи. Речь идет о природных и искусственных соединениях. Среди них наибольшую известность получила олифа, которую используют в целях защиты конструкций из стали и чугуна;
- Эмали. Имеют вид лаковых растворов, содержащих группу подобранных пигментов в измельченном виде;
- смягчители и разнообразные пластификаторы. Сюда следует отнести адипиновую кислоту, представленную в виде эфира, дибутилфтолат, касторовое масло, трикрезилфосфат, каучук, а также иные элементы, благодаря которым можно повысить эластичность защитного слоя;
- этилацетат, толуол, бензин, спирт, ксилол, ацетон и другие. К помощи перечисленных компонентов прибегают для улучшения адгезии используемых лакокрасочных составов;
- Инертные наполнители. Представлены в виде мельчайших частиц асбеста, талька, мела и каолина. Благодаря их применению пленки приобретают повышенную устойчивость к коррозии, при этом удается добиться уменьшения расхода иных компонентов лакокрасочных покрытий;
- Пигменты и краски;
- Катализаторы, которые в среде специалистов именуются как сиккативы. Их польза заключается в сокращении времени, необходимого для высыхания защитных составов. Наибольшее распространение получили кобальтовые и магниевые соли жирных органических кислот.
При выборе того или иного лакокрасочного состава следует обращать внимание на условия эксплуатации обрабатываемых конструкций из металла. Применять материалы на основе эпоксидных элементов желательно для тех изделий, которые будут эксплуатироваться в атмосферах, содержащих испарения хлороформа, двухвалентного хлора, а также для обработки изделий, которые планируется использовать в разных типах кислот.
Высокую стойкость к кислотам демонстрируют и лакокрасочные материалы, содержащие полихлорвинил. Вдобавок к этому к ним прибегают в целях обеспечения защиты металла, который будет контактировать с маслами и щелочами. Если же возникает задача в обеспечении защиты конструкций, которые будут взаимодействовать с газами, то обычно выбор останавливают на материалах, содержащих полимеры.
Решая вопрос с предпочтительным вариантом защитного слоя, следует обращать внимания на требования отечественных СНиП, предусмотренных для конкретной отрасли промышленности. Подобные саннормы содержат перечень таких материалов и способов защиты от коррозии, к которым допускается прибегать, а также те, которые не следует применять. Скажем, если обратиться к СНиПу 3.04.03-85, то там представлены рекомендации по защите строительных сооружений различного назначения:
- систем трубопроводов, используемых для транспортировки газа и нефти;
- обсадных стальных труб;
- тепломагистралей;
- конструкций, выполненных из стали и железобетона.
Обработка неметаллическими неорганическими покрытиями
 Метод электрохимической или химической обработки позволяет создавать на изделиях из металла особые пленки, не допускающие негативное воздействие со стороны коррозии. Обычно для этой цели применяются
Метод электрохимической или химической обработки позволяет создавать на изделиях из металла особые пленки, не допускающие негативное воздействие со стороны коррозии. Обычно для этой цели применяются
Фосфатные пленки
Останавливать выбор на фосфатных пленках рекомендуется, если необходимо обеспечить защиту от коррозии изделий из цветных и черных металлов. Если обратиться к технологии подобного процесса, то он сводится к помещению изделий в раствор цинка, железа или марганца в виде смеси с кислыми фосфорными солями, которые предварительно нагреты до отметки 97 градусов. Создаваемая пленка представляется отличной основой, чтобы в дальнейшем можно было покрыть ее лакокрасочным составом.
Важным моментом является то, что долговечность фосфатного слоя находится на довольно низком уровне. Также он обладает и другими недостатками — низкой эластичностью и прочностью. К фосфатированию прибегают в целях обеспечения защиты деталей, эксплуатация которых проходит в условиях высоких температур или соленой водной среды.
Оксидные пленки
Свою сферу применения имеют и оксидные защитные пленки. Они создаются при воздействии на металлы растворами щелочей посредством использования тока. Довольно часто для оксидирования применяют такой раствор, как едкий натр. Среди специалистов процесс создания оксидного слоя часто именуется воронением. Это обусловлено созданием на поверхности мало и высокоуглеродистых сталей пленки, имеющей привлекательный черный цвет.
Способ оксидирования является востребованным в тех случаях, когда возникает задача по сохранению изначальных геометрических размеров. Чаще всего защитное покрытие подобного типа создается на точных приборах и стрелковом вооружении. Обычно пленка имеет толщину не более 1,5 микрона.
Дополнительные способы
Существуют и другие способы защиты от коррозии, которые основываются на использовании неорганических покрытий:
- Пассивирование. Суть его сводится к помещению обрабатываемого изделия из металла в растворы нитратов или хроматов.
- Анодирование. Для этого метода применяют специальные ванны, для приготовления которых используют щавелевую кислоту (5-10%), хромовый ангидрид (3%) и серную кислоту (190 грамм на литр раствора).
- Эмалирование. В основе этого метода лежит использование сочетания компонентов, представленных сплавленным полевым шпатом, цинком, мелом, песком, титаном и иными веществами.
Заключение
У каждого инструмента и конструкции, которая выполнена из стали, имеется ограниченный срок службы. При этом не всегда изделие может демонстрировать его в том виде, который заложен изначально производителем. Этому могут помешать различные негативные факторы, в том числе и коррозия. В целях защиты от неё приходится прибегать к различным методам и средствам.
Учитывая всю важность процедуры по защите от коррозии, необходимо правильно подобрать метод, а для этого важно учитывать не только условия эксплуатации изделий, но и их изначальные свойства. Подобный подход позволит обеспечить надежную защиту от ржавчины, в результате изделие сможет гораздо дольше использоваться по своему прямому назначению.
Оцените статью: Поделитесь с друзьями!stanok.guru
«Защита металлов от коррозии» Учебные вопросы
Коррозия в естественных условиях
Основные способы защиты металлов от коррозии
Электрохимическая защита
1. Коррозия в естественных условиях
К данному виду коррозии относится атмосферная, подземная и морская. Атмосферная коррозия – это разрушение поверхности металлов во влажных средах при температуре окружающей среды. Атмосферная коррозия протекает, в основном, с кислородной деполяризацией. В условиях промышленной атмосферы (загрязненной CO2, SO2, NO2 HCl и др.) она может протекать и с водородной деполяризацией.
Коррозионное разрушение металлических конструкций в почвах и грунтах называют подземной коррозией. Ей подвержены различные трубопроводы, кабели, опоры и др. Почва и грунты представляют одну из наиболее сложных по химическому составу и структуре коррозионных сред. К характеристикам почв и грунта относятся влажность, пористость, кислотность, солевой состав и др. Поры занимают электролиты, содержащие минеральные соли и растворенные газы (O2, CO2, N2). Для подземной коррозии характерны язвенные и точечные разрушения. Пористые грунты агрессивнее глинистых, так как легко аэрируются и сохраняют влагу в течение длительного времени. Повышение влажности грунтов до 20 % уменьшает сопротивление, а следовательно, способствует увеличение скорости коррозии.
Максимальные
значения наблюдаются при влажности
15…25 %. Дальнейшее увеличение влажности
затрудняет доступ кислорода. На скорость
коррозии влияет и рН почвы. Особенно
велика коррозия в торфяных и болотистых
грунтах, имеющих рН 3,
в которых она протекает с водородной
деполяризацией. Как правило, скорость
коррозии возрастает с увеличением
глубины залегания металлических
конструкций и разрушению подвергаются
те участки, к которым затруднен доступ
кислорода (рис. 7.). Борьбу с подземной
коррозией осуществляют либо нанесением
защитных и изолирующих покрытий, либо
электрохимической (катодной, протекторной)
защитой.
3,
в которых она протекает с водородной
деполяризацией. Как правило, скорость
коррозии возрастает с увеличением
глубины залегания металлических
конструкций и разрушению подвергаются
те участки, к которым затруднен доступ
кислорода (рис. 7.). Борьбу с подземной
коррозией осуществляют либо нанесением
защитных и изолирующих покрытий, либо
электрохимической (катодной, протекторной)
защитой.
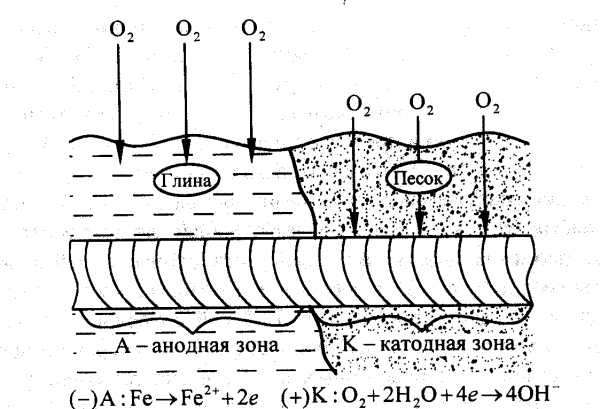
Рис. 1. Схема подземной коррозии при неравномерной аэрации почвы различной пористости.
Коррозия
в морской воде. Морская вода обладает хорошей электрической
проводимостью из-за содержания в ней
растворенных солей и газов; рН морской
воды изменяется в пределах 7,2…8,6.
Концентрация растворенного кислорода
достигает до 8 мг/л. В ней содержится
большое количество микроорганизмов,
способствующих ускорению коррозии.
Наиболее опасным является то, что морская
вода содержит значительное количество
Cl– –
ионов, являющихся ионами-активаторами,
препятствующими образованию пассивных
пленок на поверхности металла. Коррозия
на аэрируемых участках протекает с
поглощением кислорода на катодных
участках (2Н2О
+ О2 +
4
 4ОН–),
а на деаэрированных – с водородной
деполяризацией (2Н2О
+ 2
4ОН–),
а на деаэрированных – с водородной
деполяризацией (2Н2О
+ 2
 Н2
Н2 +
2 ОН–).
Коррозия в морской воде наиболее
интенсивно развивается в зоне,
располагающейся выше ватерлинии, где
происходит периодическое смачивание
поверхности металла.
+
2 ОН–).
Коррозия в морской воде наиболее
интенсивно развивается в зоне,
располагающейся выше ватерлинии, где
происходит периодическое смачивание
поверхности металла.
Для защиты корпусов морских судов применяют лакокрасочные покрытия на виниловой, фенолформальдегидной, каменноугольной и битумной основах. Подводную часть судов защищают специальными покрытиями, в состав которых входят токсичные для микроорганизмов вещества (CuO, HgO и др. соединения). Для борьбы с морской коррозией используют также протекторную и катодную защиты.
Защита от коррозии – это комплекс мер, закладывающихся на стадии конструирования, осуществляемых в процессе изготовления и проводимых в ходе эксплуатации различных конструкций. В связи с этим защиту можно осуществить путем воздействия либо на материал, либо на конструкцию, либо на коррозионную среду.
studfiles.net
какие есть и что лучше?
Коррозия оказывает разрушительное действие на изделия из металла и сплавы. При взаимодействии с окружающей средой металлические изделия покрываются пятнами в виде ржавчины. Чем более активный металл, тем он сильнее подвержен коррозии.

Коррозия оказывает разрушительное действие на автомобили, суда, коммуникации и другие металлические изделия, что может привести к утечке нефти, газа и другим негативным последствиям. Она отрицательно влияет на здоровье человека, а продукты окисления загрязняют окружающую среду.
Недопустима коррозия в авиационной, химической и атомной промышленности. Порой затраты на ремонт металлических изделий превышают стоимость материала, который был израсходован на их изготовление.
Основные виды коррозионных процессов
Виды коррозии металлов можно разделить по следующим признакам: характеру разрушения, коррозионной среде и механизму действия.

Исходя из характера разрушений, коррозия может быть:
- сплошной. При этом она может быть равномерной и неравномерной. При равномерной разрушается вся поверхность изделия. При неравномерной появляются пятна и точечные углубления;
- межкристаллитной. В этом случае она проникает вглубь изделия по границам зерен металла;
- транскристаллитной, при этом металл рассекается трещиной через зерно;
- избирательной. Происходит разрушение одной из составляющих сплава. Например, в латуни может разрушаться цинк.
- подповерхностной. Начинается на поверхности и постепенно проникает в верхние слои металла.
Существуют следующие виды коррозионной среды:
- атмосфера;
- газ;
- почва;
- жидкость (щелочь, кислота или солевые растворы).
Механизм действия разделяет коррозию на химическую и электрохимическую.
Химической коррозией называется процесс, при котором происходит самопроизвольное разрушение металлов. Он происходит при взаимодействии металлических изделий с активно-коррозионной средой, чаще всего газовой. Эти процессы сопровождаются высокими температурами.

В результате происходит одновременное окисление металла и восстановление коррозионной среды. Химическая коррозия происходит также при взаимодействии с органическими жидкостями, например, с нефтепродуктами, спиртом и др.

Электрохимическая коррозия возникает в электролитах, например, в водных растворах. Электрохимическая реакция вызывает электрический ток, который способствует разрушению металла. В этом случае происходят как химические процессы, при которых происходит отдача электронов, так и электрические, при которых движутся электроны.
Разрушение происходит, если соприкасаются разнородные металлы. Поэтому больше подвержены разрушению металлы, в которых много примесей.
Разнородность строения металла приводит к тому, что при электрохимической коррозии образуются по законам гальваники катодно-анодные пары. Если металлические изделия отличаются друг от друга химическим составом, то на поверхности металлических изделий образуется слой ржавчины.
Эта коррозия чаще всего является причиной разрушения металлов. Ниже приведены рисунки, на которых изображен механизм действия электрохимической коррозии.

Во внешней среде наиболее активно на металлические изделия действует кислород, повышенная влажность, оксиды серы, азота, углекислый газ, грунтовые воды. Соленая вода ускоряет процесс окисления, поэтому морские суда ржавеют быстрее, чем речные.
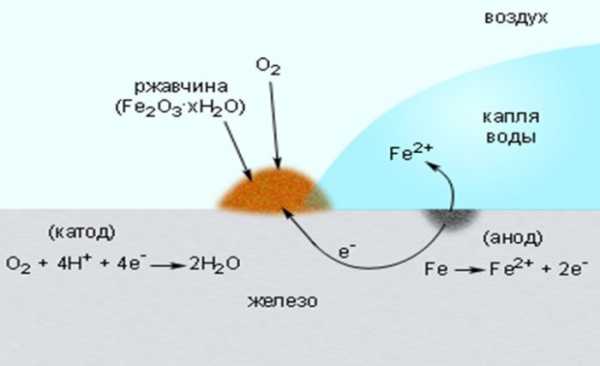
Остановить этот природный процесс невозможно, остается только найти способы защиты от коррозии. Правда, избавиться полностью от коррозионного процесса невозможно, но эти способы помогают замедлить сам процесс.
Методы противостояния коррозионным процессам
Для защиты металлов от коррозии существуют следующие методы:
- повышение сопротивляемости металлов за счет увеличения химического состава;
- изоляция металлических покрытий от агрессивного воздействия окружающей среды;
- снижение агрессивности среды, в которой происходит эксплуатация металлических изделий;
- электрохимические, которые, благодаря законам гальваники, снижают коррозионные процессы.
Эти методы можно разделить на две большие группы. Первые два метода применяются до того, как металлические изделия будут эксплуатироваться, то есть на стадии их производства. При этом выбираются определенные конструкционные материалы для производства изделия, наносятся различные гальванические и защитные покрытия.

Последние два метода применяются при эксплуатации металлических изделий. При этом для защиты пропускается ток через изделие, снижается агрессивность среды путем добавления различных ингибиторов, таким образом, до эксплуатации само изделие предварительно никак не обрабатывается.
Методы повышения сопротивляемости
Эти методы защиты основаны на создании сплавов, которые обладают антикоррозионными свойствами. К металлу добавляются компоненты, повышающие его коррозионную стойкость. Примером может служить легирование стали хромом.
Метод применяется при изготовлении стали. В результате получаются хромистые нержавеющие стали, которые устойчивы к коррозии. Повышают антикоррозионные характеристики сталей добавкой никеля, меди и кобальта.
На этих поверхностях не появляется ржавчина, но коррозия присутствует. Замедляется коррозия благодаря тому, что к восьми атомам железа добавляется один атом легирующей добавки, а это упорядочивает расположение атомов в кристаллической решетке твердого раствора, что и препятствует коррозии.

Коррозионную устойчивость можно повысить, удалив из металлов или сплавов примеси, которые ускоряют коррозию. Например, железо удаляют из сплавов магния или алюминия, серу из сплавов железа и т.д.
Снижение агрессивности внешней среды и электрохимическая защита
Снижение агрессивности внешней среды достигается путем удаления из нее веществ, которые являются деполяризаторами, или путем изоляции металлов от деполяризатора. Удаление кислорода из среды называется раскислением.

Для замедления коррозионного процесса в окружающую среду вводятся специальные вещества – ингибиторы. Они могут быть как органическими, так и неорганическими. Молекулы ингибиторов поглощаются поверхностью металла и, тем самым, способствуют резкому снижению скорости растворения металла и препятствуют протеканию электродных процессов.
При электрохимической защите с помощью внешнего электрического тока, который проходит через металл, сдвигается потенциал металла и, тем самым, изменяться скорость его коррозии.
В зависимости от сдвига потенциала электрохимическая защита может быть катодной и анодной. Эти способы применяют для защиты буровых платформ, сварных металлических оснований, трубопроводов, проходящих под землей, а также защищают подводные части морских судов.
Пленочная защита
Для того чтобы защитить металлические изделия от коррозии, можно нанести защитное покрытие. В качестве покрытия можно использовать лаки, краски, эмали, пластмассы и др.

Лакокрасочные покрытия легко наносятся, недорогие по стоимости, обладают водоотталкивающими свойствами, не вступают в химическую реакцию с металлом, хорошо заполняют поры и трещины. Они служат для защиты металлов от компонентов внешней среды, вызывающих коррозионные процессы.
Если правильно подобрать лакокрасочные материалы и соблюдать технологию их нанесения, то они могут прослужить в качестве покрытия до 5 лет.
Часто под лакокрасочное покрытие наносится грунтовка, проходя через которую, вода растворяет некоторые пигменты и становится не такой корррозионноактивной. Вместо грунтовки может проводится фосфатирование поверхности. Они наносятся кистью или распылителем. Для стальных изделий большинство таких препаратов состоит из смесей фосфатов марганца и железа.

Защитить металлическое изделие можно путем нанесения слоя металла, который более коррозионностойкий. В этом случае коррозия разрушает само покрытие. Такими металлами является хром, никель, цинк. Например, железо покрывается хромом.
Цинком покрываются изделия из меди, латуни, а также листовая сталь. Такие покрытия называются анодными, они обеспечивают электрохимическую защиту. Срок их службы зависит от толщины нанесенного покрытия. Существуют также катодные покрытия.
Они служат для механической защиты основного металла. Если такое покрытие нарушается, антикоррозионная защита перестает действовать. Кроме того, при этом ускоряется коррозионный процесс.

Примером такого покрытия является покрытие железа оловом. Сравнивая эффективность анодного и катодного покрытия, лучше использовать анодное, так как оно действует даже при нарушении целостности покрытия.
Существуют различные способы получения металлических покрытий. При горячем способе покрытие получается путем опускания изделия в горячий металл.

Если изделие покрывается оловом, этот процесс называется лужением, если цинком – оцинкованием. Покрытие может наносится гальваническим методом путем осаждения на изделии солей из электролита.
При использовании метода напыления распыляется плазменная струя расплавленного металла и наносится на поверхность, которую надо защитить. Для распыления используются металлизаторы.
При плакировании осуществляется совместная горячая прокатка основного и защитного металла. Металлы сцепляются между собой благодаря диффузии.
strojkarkas.com
Коррозия металлов.Способы защиты от коррозии — Мегаобучалка
Коррозия – самопроизвольный процесс и соответственно протекающий с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т. п. Безвозвратные потери металлов от коррозии составляют 15 % от ежегодного их выпуска. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены. Изучение коррозиии разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народнохозяйственное значение.
Ржавление железа на воздухе, образование окалины при высокой температуре, растворение металлов в кислотах – типичные примеры коррозии. В результате коррозии многие свойства металлов ухудшаются: уменьшается прочность и пластичность, возрастает трение между движущимися деталями машин, нарушаются размеры деталей. Различают химическую и электрохимическую коррозию.
Химическая, коррозия – разрушение металлов путем их окисления в сухих газах, в растворах неэлектролитов. Например, образование окалины на железе при высокой температуре. В этом случае образующиеся на металле оксидные плёнки часто препятствуют дальнейшему окислению, предотвращая дальнейшее проникновение к поверхности металла как газов, так и жидкостей.
Электрохимической коррозией называют разрушение металлов под действием возникающих гальванических пар в присутствии воды или другого электролита. В этом случае наряду с химическим процессом – отдача электронов металлами, протекает и электрический процесс – перенос электронов от одного участка к другому.
Этот вид коррозии подразделяют на отдельные виды: атмосферную, почвенную, коррозию под действием «блуждающего» тока и др.
Электрохимическую коррозию вызывают примеси, содержащиеся в металле, или неоднородность его поверхности. В этих случаях при соприкосновении металла с электролитом, которым может быть и влага, адсорбируемая на воздухе, на его поверхности возникает множество микрогальванических элементов. Анодами являются частицы металла, катодами – примеси и участки металла, имеющие более положительный электродный потенциал. Анод растворяется, а на катоде выделяется водород. В то же время на катоде возможен процесс восстановления кислорода, растворённого в электролите. Следовательно, характер катодного процесса будет зависеть от некоторых условий:
кислая среда: 2Н+ + 2ē = Н2 (водородная деполяризация),
О2 + 4Н+ + 4ē → 2Н2О
нейтральная среда: O2+2H2O+4e − =4OH− (кислородная деполяризация).
В качестве примера рассмотрим атмосферную коррозию железа в контакте с оловом. Взаимодействие металлов с каплей воды, содержащей кислород, приводит к возникновению микрогальванического элемента, схема которого имеет вид
(-)Fe|Fe2+|| O2, H2O| Sn (+).
Более активный металл (Fе) окисляется, отдавая электроны атомам меди и переходит в раствор в виде ионов (Fe2+). На катоде протекает кислородная деполяризация.
Способы защиты от коррозии. Все методы защиты от коррозии можно условно разделить на две большие группы: неэлектрохимические (легирование металлов, защитные покрытия, изменение свойств коррозионной среды, рациональное конструирование изделий) и электрохимические (метод проектов, катодная защита, анодная защита).
Легирование металлов – это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов, при котором в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, титан, вольфрам и др.
Защитные покрытия – это слои, искусственно создаваемые на поверхности металлических изделий и сооружений. Выбор вида покрытия за- висит от условий, в которых используется металл.
Материалами для металлических защитных покрытий могут быть чистые металлы: цинк, кадмий, алюминий, никель, медь, олово, хром, серебро и их сплавы: бронза, латунь и т. д. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные (например, на стали Cu, Ni, Ag) и анодные (цинк на стали). Катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. В случае анодного покрытия защищаемый металл играет роль катода и поэтому не корродирует. Но потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие таких покрытий сводится в основном к изоляции металла от окружающей среды.
Электрохимический метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции (корпус судна, подземный трубопровод), находящейся в среде электролита (морская, почвенная вода), металла с более отрицательным значением электродного потенциала – протектора.
megaobuchalka.ru
Способы зашиты металлов от коррозии: выбор самого эффективного
Как только человек научился обрабатывать руду и плавить металл, он сразу же столкнулся с проблемой его разрушения от неожиданного врага — коррозии.
 С коррозией боролись различными методами, но все они сводились к защите поверхности металлических поверхностей от воздействия факторов, которые вызывают возникновения коррозии. Простые методы не всегда были эффективными. Чтобы разработать действенные способы защиты металлов от коррозии, необходимо было изучить её природу и выяснить основные причины возникновения.
С коррозией боролись различными методами, но все они сводились к защите поверхности металлических поверхностей от воздействия факторов, которые вызывают возникновения коррозии. Простые методы не всегда были эффективными. Чтобы разработать действенные способы защиты металлов от коррозии, необходимо было изучить её природу и выяснить основные причины возникновения.
Коррозия — это химический процесс разрушения металлов, который протекает при химическом или электрохимическом воздействии факторов окружающей среды. Выглядит она как плёнка из полученных продуктов коррозии.
Важно! Если плёнка плотная, без разломов, она может служить защитой от дальнейшего разрушения металла.
Имеют плотное коррозийное покрытие алюминий, свинец, никель, хром, олово.
Полностью избежать возникновения коррозии не удаётся, но есть ряд способов, которые замедляют её распространение. Специалисты выделяют основные способы:
- покрытия, защищающие от внешних факторов;
- обработка поверхности с признаками коррозии для снижения её активности;
- изменение свойств среды, вызывающей коррозию;
- электрохимический.
Так же существуют мероприятия, для снижения риска появления коррозии. К ним относятся:
- создание материалов, имеющих более высокую коррозионную устойчивость;
- замена металлических частей на элементы из пластика, стекла, керамики;
- рациональность эксплуатации, что означает использование материалов с соответствующей коррозионной устойчивостью для данного вида факторов.
Защитные покрытия
 Один из самых древних и распространенных способов — это защитные покрытия. Классификация защитных покрытий:
Один из самых древних и распространенных способов — это защитные покрытия. Классификация защитных покрытий:
- металлические, которые имеют не только защитные свойства, но ещё и делают покрываемый металл более твёрдым и износоустойчивым. Они обеспечивают большую электропроводность, повышают отражательную способность. Наносятся покрытия методом гальванопластики, термодиффузией, при погружении в расплав, механотермическим;
- неметаллические, имеют несколько вариантов такие как неорганические, органические, эмали. Принцип заключается в создании искусственной плёнки при химической или электрохимической обработке металла. Обычно применяют оксидные и фосфатные плёночные покрытия.
 Используют несколько способов нанесения металлической защиты от коррозии металлов:
Используют несколько способов нанесения металлической защиты от коррозии металлов:
- гальванический, считающийся самым экономичным и простым в процессе нанесения. Легко регулируется толщина и подбирается состав. Можно получить даже сплав металлов с необходимыми свойствами. При этом способе покрытия обеспечивается высокая адгезия металла и покрытия. В качестве защитных в процессе гальванопластики выступают такие металлы как цинк, кадмий, никель, хром, олово, свинец, золото, серебро и сплавы медь-цинк, медь-олово;
- термодиффузионные, основанные на методе легирования основного металла атомами покрытия, которое происходит за счёт диффузии. Одним из условий протекания такого процесса является высокая температура. Металл может выступать в качестве такого покрытия, если у него атомный радиус не превышает атомный радиус покрываемого металла. Один из видов — плакирование. При плакировании накладываются с двух сторон защитные листы и такой сэндвич прокатывается, в результате получается прочное и защищённое соединение.
Обратить внимание! Существует ещё несколько методов нанесения металлической защиты: погружение в расплавленный металл, напыление.
Обработка коррозийных сред
Коррозия может не только разрушать основное вещество конструкции, но восстанавливать коррозионную среду. Такой вид называют химической, которая не имеет сходства с электрохимической. Вызывают химическую коррозию газы при высоких температурах и жидкости-неэлектролиты.
Часто подвергают обработке коррозионную среду, для уменьшения химической коррозии металлов. Такой способ применяется при промышленной эксплуатации конструкций. Из среды могут выводиться вещества, который вызывают коррозию. Или же наоборот, вводятся вещества (ингибиторы), снижающие скорость коррозионного процесса.
Для обработки используется азот, который удаляет кислород, гашеная известь и едкий натр для нейтрализации кислот. Соли из воды выводятся при обработке ионообменными смолами.
Электрохимическая защита
Для металлических конструкций актуальна электрохимическая коррозия. Для её уменьшения конструкцию поляризуют. Поляризация бывает катодная и анодная. Основанием для применения электрохимической защиты является очень быстрое растворение металла. Можно так же использовать протекторы, которые имеют потенциал более низкий чем у материала конструкции.
stroitel5.ru
Защита от коррозии
Металлические изделия с течением времени постепенно покрываются ржавым налетом. Конструкции разрушаются, практически превращаются в труху. Чтобы избежать подобных печальных результатов, необходимо знать, что такое коррозия металлов и способы защиты от нее. Металл подвергается разрушению вследствие воздействия на него внешней среды, которое бывает электрохимическим или химическим. Химическая коррозия появляется в средах, не способных проводить электрический ток (нефтепродукты, газы, спирты). Ей подвержены абсолютно все металлы. Электрохимическая коррозия возникает из-за появления на металле электролитической пленки вследствие влияния окружающей среды. В частности, оказывают воздействие технические и бытовые соли, применяемые на дорогах в зимнее время, и блуждающие токи. Способов и методов, с помощью которых производится защита от коррозии, существует много.
Самым популярным и распространенным является использование лакокрасочных покрытий. Они бывают металлические и неорганические неметаллические. Большую эффективность обеспечивают покрытия, в основе создания которых лежат синтетические полимеры. Неорганические неметаллические покрытия отличаются большим разнообразием. К ним относятся краски (масляные, алкидные и эмали), а также лаки (дегтевые, синтетические, битумные). При нанесении такая защита от коррозии создает тонкую пленку, ограждающую металл от влаги и влияния внешней среды. Лаки и краски очень легко наносятся, доступны по цене. В начале работы необходимо строго следовать технологии их нанесения. Покрывать ими металлическую поверхность надо в несколько слоев, чтобы лучше защитить конструкции от атмосферного влияния.
Металлические покрытия-ингибиторы различают двух типов. К первому относят протекторные покрытия кадмием, цинком, алюминием. Ко второму – коррозионностойкие покрытия медью, серебром, свинцом, никелем и хромом.
В зависимости от того, каким механизмом действия обладает защита от коррозии, ее называют катодной или анодной. Есть металлические покрытия-ингибиторы, обладающие большей электроотрицательностью, и покрытия, имеющие большую электроположительность. Анодные покрытия относятся к первому типу, катодные – ко второму. В качестве анодных покрытий используют алюминий и цинк, в качестве катодных – никель, медь, олово.

Различные способы защиты металлов от коррозии предполагают и несколько вариантов нанесения покрытий. Например, для нанесения ингибиторов используют химический способ покрытия металлических конструкций другими металлами: алюминием, цинком.
Если металлическая конструкция уже подвергается коррозии, тогда замедлить процесс разрушения помогут добавки в виде пассиваторов и ингибиторов. Способствуют торможению коррозийных процессов в щелочных и нейтральных средах такие сильные окислители, как соли щелочноземельных и щелочных металлов. Чтобы защитить арматуру в железобетоне, применяют нитрит-нитрат кальция.
Когда необходима защита от коррозии, возникающей под влиянием внешней среды и атмосферных осадков, применяют летучие ингибиторы, представляющие собой вещества, которые адсорбируются на поверхности металла из воздуха или конденсируются на ней, образуя тонкий слой.
fb.ru


 Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой;
Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой;