Ацетилен формула химическая: Ацетилен, C2H2, химические свойства, получение, применение
alexxlab | 09.06.2023 | 0 | Разное
Ацетилен, C2h3, химические свойства, получение, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ацетилен: свойства и способы получения
Автор статьи Лебедев Юрий Агафонович
Дата публикации:
14.03.2022
Дата обновления:
17.01.2023
Заместитель директора
Работает в отрасли c 1999 г.
Ацетилен (этин) — это вещество, относящееся к классу алкинов, непредельный углеводород. Записывается с использованием химической формулы C2H2. Представляет собой газ без цвета. Создает повышенную огнеопасность.
В этом материале мы рассмотрим получение ацетилена, особенности его использования и виды, в которых может встречаться такое вещество.
Содержание статьи
- Особенности получения ацетилена
- Преимущества ацетилена
- Виды производимого ацетилена
- Особенности и свойства
- Физические свойства
- Область использования
- Особенности хранения
Особенности получения ацетилена
В зависимости от конкретных условий, доступно получение промышленно или лабораторно. При выработке в лаборатории применяется химическая реакция от соединения воды и карбида кальция. Это позволяет получить небольшое количество вещества, которого оказывается вполне достаточно для применения в этой области. Реакция становится более управляемой, когда в нее вводится поваренная соль — это помогает значительно уменьшить скорость протекания.
При выработке в лаборатории применяется химическая реакция от соединения воды и карбида кальция. Это позволяет получить небольшое количество вещества, которого оказывается вполне достаточно для применения в этой области. Реакция становится более управляемой, когда в нее вводится поваренная соль — это помогает значительно уменьшить скорость протекания.
Промышленное производство предполагает выработку большого количества вещества. Основной метод в таком случае — пиролиз. Он применяется к метану, бутану и пропану.
Использование карбидного метода направлено на то, чтобы получить чистый газ. Он проигрывает пиролизу, потому что связан с применением большого количества электроэнергии.
Использование пиролиза позволяет уменьшить затраты энергии, повысить КПД применяемого оборудования.
В промышленности также распространен электрический крекинг. В таком случае удается получить ацетилен из метана. Вещество помещается в электродуговую печь. Температура прогрева при этом составляет от 2000 до 3000 °С.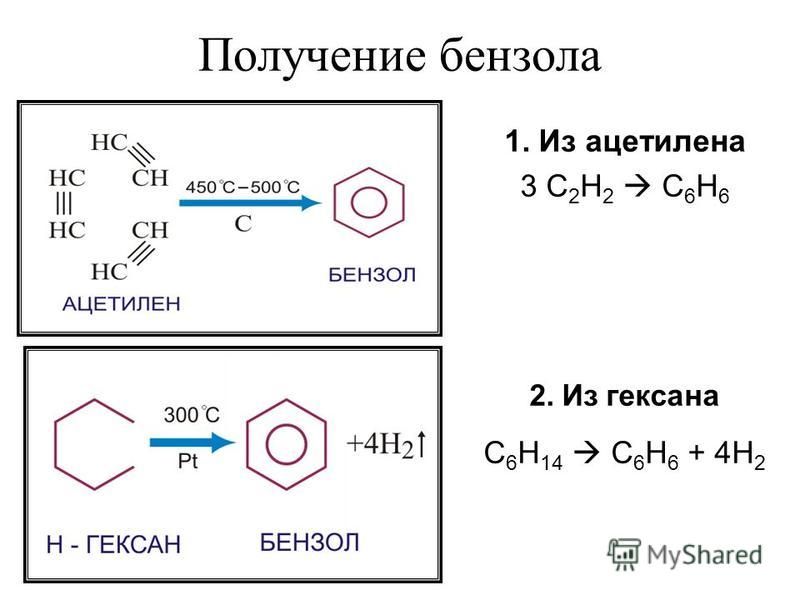 Важным требованием становится формирование напряжения 1 кВ.
Важным требованием становится формирование напряжения 1 кВ.
Чтобы выработать большое количество готового продукта, можно применять окислительный пиролиз. Средство связано с нагнетанием температуры 16000 °С.
Преимущества ацетилена
Такое вещество как ацетилен применяется в сварке. При использовании с кислородом таким образом удается значительно увеличивать температуру прогрева дуги.
Несмотря на уменьшение применения такого средства в сварке в последнее время, его по-прежнему выбирают по причине наличия нескольких важных преимуществ. К ним относятся такие, как:
- Значительное повышение температуры пламени.
- Доступность формирования ацетилена в месте его использования.
- Стоимость применения подобного вещества во время работы.
Недостаток — ограниченное использование и повышенная опасность появления взрыва при высоких концентрациях. Строгое соблюдение прописанных мер безопасности — это важное требование для нормальной работы с ацетиленом.
Нужно хранить и использовать такое средство исключительно в том случае, если пространство хорошо проветривается. Также требуется регулярно проверять тару, внутри которой содержится газ.
Не допускается использование баллонов с большими вмятинами, коррозией. Регулярно проводится освидетельствование и ремонт, может потребоваться дополнительное окрашивание, замена запорной арматуры и других элементов конструкции.
Хотите получить консультацию?
Позвоните нам по телефону!+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Виды производимого ацетилена
В промышленности такое вещество может использоваться в разных состояниях. Выпускается два варианта продукта:
- Газообразный. Вещество имеет резкий запах. Это становится преимуществом — в отличие от азота или кислорода, можно быстро определить наличие утечки и принять нужные меры.
- Жидкий. Бесцветное вещество, способное преломлять цвет. Также нельзя допускать утечки — сохраняется высокий уровень взрывоопасности и пожароопасности.

Особенности и свойства
Химические свойства такого вещества связаны с особенностями его химической формулы. В частности, на параметры влияет наличие в нем атомов водорода и углерода.
Вот несколько наиболее важных химических свойств:
- Возможность превращения в бензол. Это происходит при сильном прогревании до 4000 °С и смешивании с графитом.
- Доступность получения уксусного альдегида. Создается при смешивании с водой и при параллельном введении ряда катализаторов.
- Заметные кислотные свойства. Меняются в зависимости от уровня содержания водорода.
Физические свойства
Важны физические свойства продукта:
- Основное состояние — бесцветный газ.
- Плохо растворяется в воде.
- Температура кипения −830 °С.
- При сжимании запускается реакция разложения со стремительным выделением энергии.
Область использования
Вещество применяется не только при выполнении сварки. Среди других решаемых задач:
- Производство карбидных ламп.

- Изготовление взрывчатки.
- Получение множества химических веществ — от полимеров до уксуса.
- Создание ракетного топлива.
Требования к такому веществу указываются в стандарте ГОСТ 5457-75.
Особенности хранения
Так как газ представляет повышенную угрозу возгорания и взрыва, нужно правильно хранить его. Среди основных требований:
- Использование баллонов в хорошем состоянии. Они должны проходить регулярное освидетельствование. Проверяется текущее состояние емкости, анализируется, нет ли на ней повреждений. Не допускается применение тары со следами коррозии, большими вмятинами и другими механическими повреждениями на поверхности.
- Правильное складирование. Баллоны должны находиться в фиксированном положении без сильного давления и риска механических ударов.
- Исключение контакта с катализаторами горения. Не допускается размещения рядом с источниками высоких температур или под прямыми солнечными лучами.
Также нужно соблюдать осторожность во время перевозки, следить за тем, чтобы емкости не падали и не получали механические повреждения. Рекомендуем обратить особое внимание на оборудование места для хранения. Это должен быть удобный склад с хорошей системой вентиляции.
Рекомендуем обратить особое внимание на оборудование места для хранения. Это должен быть удобный склад с хорошей системой вентиляции.
Источники:
- https://ru.wikipedia.org/wiki/Ацетилен
- Ацетилен, его свойства, получение и применение. С. А. Миллер
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как получают ацетилен?
Возможно промышленное и лабораторное производство. Для получения большого количества вещества используют метод пиролиза или электрического крекинга. Для получения небольшого количества в лабораторных условиях соединяют воду и карбид кальция.
Что такое электрический крекинг?
Метод получения ацетилена из метана.
Где используют ацетилен?
При сварке, на производстве карбидных ламп, при изготовлении взрывчатки, для создания ракетного топлива и др.
В каком состоянии может находиться ацетилен?
Жидком и газообразном.
Если вам понравилась статья, поделитесь ей в социальных сетях
Ацетилен – определение, формула, структура, производство и свойства
Ацетилен также может называться этином, также известным как нарсилен, а также винилен. Он широко используется в качестве химических строительных блоков и в качестве топлива. В своей основной форме он нестабилен и используется в качестве раствора. Соединение является ненасыщенным и. Два атома углерода, образующие его, связаны двумя связями.
Он широко используется в качестве химических строительных блоков и в качестве топлива. В своей основной форме он нестабилен и используется в качестве раствора. Соединение является ненасыщенным и. Два атома углерода, образующие его, связаны двумя связями.
Винилен представляет собой бесцветный газ со слабым запахом, напоминающим запах эфира. Легко растворяется в хлороформе, воде, ацетоне и бензоле. Он несколько растворяется в сероуглероде, а также в спирте. Он легче воздуха и способен воспламеняться. Длительное воздействие пламени или тепла может привести к быстрому растрескиванию контейнеров.
Основные виды применения
Освещение, кислородно-ацетиленовая сварка, резка и пайка металлов; сигнализация; осаждение меди, в частности, и ацетальдегида; Производство уксусной кислоты.
Применяется для металлизации пайки, а также для закалки, факельной сварки и локального нагрева в металлургических процессах. Пламя также используется в производстве стекла. В химическом отношении ацетилен можно использовать в производстве искусственного каучука, бутиролактона, винилалкилового эфира и пирролидона. Он используется для пайки, локального нагрева и в стекольной промышленности.
В химическом отношении ацетилен можно использовать в производстве искусственного каучука, бутиролактона, винилалкилового эфира и пирролидона. Он используется для пайки, локального нагрева и в стекольной промышленности.
В химической промышленности ацетилен может быть использован в качестве исходного сырья при производстве акрилонитрила, винилхлорида, синтетического каучука, винилацетата, бутиролактона, акрилата, трихлорэтилена, 1,4-бутандиола, винилалкиловых эфиров и пирролидона и так далее.
Применяется для резки, сварки, металлизации, пайки, изготовления поврежденных материалов, поверхностной закалки, локальной закалки и закрепления, надрезов местного нагрева (термоусадочная и т.п.).
Производство винилхлорида, винилацетата, акрилатов, акрилонитрила Ацетальдегид; пер- и трихлорэтилен 1,4-бутандиол, циклооктатетраен черный; а также резка и сварка металлов.
Междунар. хим. для хлорированных растворителей акриловой кислоты и тетрагидрофурана и других химических соединений.
Продукты, изготовленные из ацетилена, включают мономер винилхлорида, ацетиленовую чернь, винилфторид, N-винилкарбазол, N-винилкапролактам и другие производные, такие как 1,4-бутандиол, виниловые эфиры, N-винил-2-пирролидон и винил сложные эфиры.
Ацетилен использовался в 1900-х годах в качестве анестетика (под именем Марселин). Он больше не используется в качестве анестетика, поскольку теперь доступны более эффективные и менее взрывоопасные альтернативы.
Ключевой промышленный сырьевой материал, ацетилен, может быть использован для получения алкенов и растворителей, которые затем используются в качестве мономеров при производстве пластика. Он также используется при резке, пайке, пламенной зачистке, металлургическом нагреве и закалке, а также в стекольной промышленности. В оптометрии это компонент контактных линз. Как и этилен, ацетилен можно использовать для созревания фруктов и взрослых деревьев, цветов.
При черном процессе ацетилена ацетилен и воздух воспламеняются, чтобы нагреть сосуд, в котором он используется.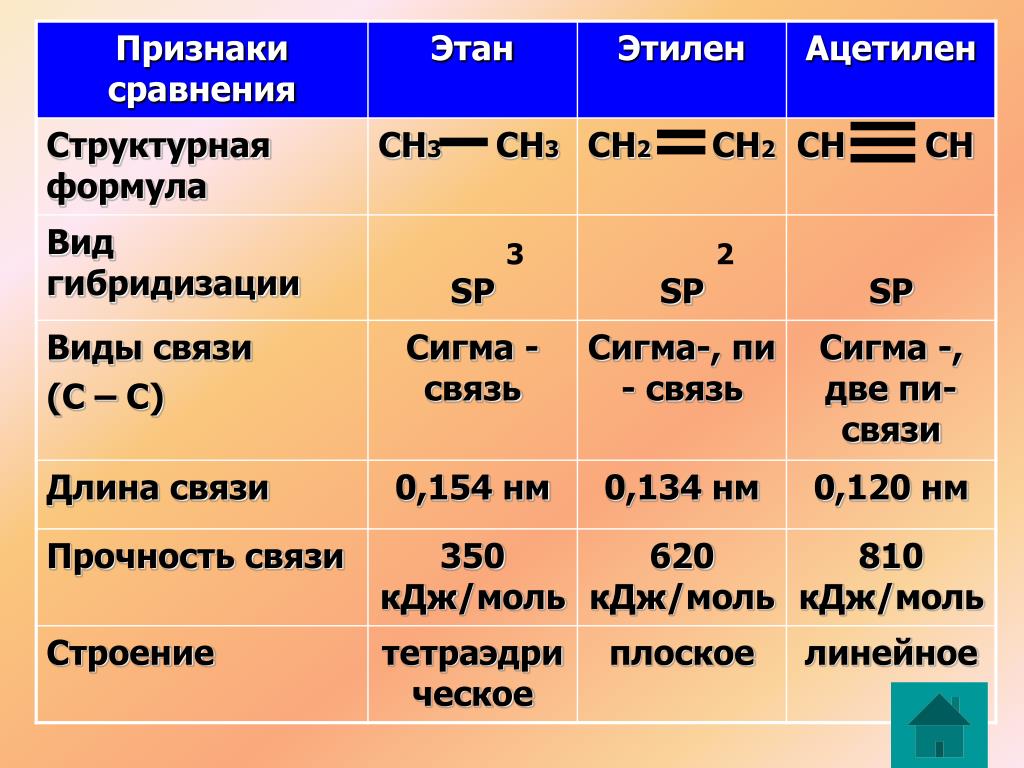 Он отключается, позволяя ацетилену распадаться на водород и углерод при недостатке кислорода. Это приводит к… одной из самых «чистых» саж.
Он отключается, позволяя ацетилену распадаться на водород и углерод при недостатке кислорода. Это приводит к… одной из самых «чистых» саж.
Прочие детали
Ацетилен – выбрасываемый газ (C 2 H 2 ), состоящий из водорода и углерода. Ацетилен известен как D.A. — растворенный ацетилен. Цилиндр имеет темно-бордовый цвет. кислород (коммерческий) находится в баллоне черного цвета. Химическая формула ацетилена может быть описана как C 2 H 2 .
Образуется при контакте карбида кальция с водой. Карбид кальция представляет собой химическое соединение, состоящее из углерода и металлов кальция. Углерод – это атом углерода. один атом кальция из металла можно найти в одной молекуле карбида кальция. Химическая формула карбида кальция может быть описана как CaC 2 .
Если карбонат кальция вступает в контакт с водой, углерод в карбиде реагирует с одним атомом водорода из воды и образует газообразный ацетилен. CaC 2 + H 2 O = CaO +C 2 H 2 . Основная примесь присутствует в товарной форме карбида кальция СаО, реагирующего с водой по реакции СаО + Н 2 О = Са(ОН) 2 +15,1 кг ккал/гмоль.
CaC 2 + H 2 O = CaO +C 2 H 2 . Основная примесь присутствует в товарной форме карбида кальция СаО, реагирующего с водой по реакции СаО + Н 2 О = Са(ОН) 2 +15,1 кг ккал/гмоль.
Газообразный ацетилен может быть нестабильным при высоких давлениях, он находится внутри баллона, растворенный в кислоте, называемой ацетоном. Ацетон содержится в пористом асбесте, древесном угле или любом другом веществе.
Ацетилен представляет собой смесь водорода и углерода в соотношении 24 части углерода и 2 части водорода – 92,3 процента углерода и 7,7 процента водорода. Углерод и водород способны создавать высокие температуры от 3100 до 3300°C. Имеет самую высокую температуру пламени.
Причиной его нагревательной способности является выделение огромного количества тепла, которое было поглощено в процессе производства карбида кальция. Ацетилен растворяют в цилиндрических цилиндрах при оптимальном давлении 250 фунтов/кв. дюйм. Тепло, производимое комбинацией карбида кальция и воды внутри генератора, называется «скрытым теплом».
дюйм. Тепло, производимое комбинацией карбида кальция и воды внутри генератора, называется «скрытым теплом».
Подробнее об ацетоне
Ацетилен — это химическое соединение, имеющее формулу C 2 H 2 . Это простейший алкин и представляет собой углеводород. Ацетилен представляет собой бесцветный газ (как правило, низшие углеводороды газообразны по своей природе), который широко используется в качестве химического строительного материала, а также в качестве топлива. В чистом виде ацетилен нестабилен, поэтому с ним обычно обращаются в виде раствора. Чистый ацетилен не имеет запаха, но, как правило, товарные марки имеют выраженный запах из-за примесей. Систематический C 2 H 2 название может быть указано как этин.
Ацетилен является ненасыщенным алкином, поскольку два его атома углерода связаны тройной связью. Тройная связь углерод-углерод размещает все четыре атома на одной прямой линии с валентными углами CCH, равными 180 °.
Формула и структура ацетилена
Химическая формула ацетилена C 2 H 2 , расширенная формула CH≡CH. Молярная масса ацетилена может быть равна 26,04 г/моль-1. Кроме того, это простейшая молекула алкина, представляющая собой охарактеризованную учеными функциональную группу, имеющую тройные связи.
Его молекулы линейны на 180 градусов, следовательно, его атомы углерода гибридизованы sp. Кроме того, оба атома углерода имеют 2 sp-орбитали, на которых одна связана с водородом, а другая связана с простой связью углерода. С другой стороны, тройная связь, то есть 2 связи, образующиеся между четырьмя орбиталями P без гибридизации, лежит ортогонально линейной системе.
В обычном представлении, используемом для органических молекул, его химическая структура представляется как C 2 H 2 , а структура ацетилена или структура C 2 H 2 может быть представлена следующим образом.
Наличие ацетилена
Мы можем обнаружить присутствие ацетилена в природе, особенно растворенного в воде. Несколько бактерий используют его в качестве основного источника в производстве ацетальдегида. Мы также можем найти это соединение в природном газе и в нефтяных скважинах вместе с сырой нефтью и другими газами. Более того, он также является частью некоторой атмосферы солнечной планеты.
Производство ацетилена
С 1950 года ацетилен синтезируют частичным сжиганием CH 4 (метан). До 1983 года было произведено около 4 00 000 тонн.
Он был получен по реакции, открытой Фридрихом Вёлерте в 1862 году. Реакция гидролиза карбида кальция может быть представлена следующим образом:
\[ CaC_{2} + 2H_{2}O → Ca(OH)_{2 } + C_{2}H_{2} \]
Реакция, представленная выше, протекает при чрезвычайно высокой температуре, приблизительно 2000°С, с использованием электродуговой печи.
Свойства ацетилена
Рассмотрим физические и химические свойства ацетилена.
Физические свойства
Ацетилен представляет собой бесцветный газ с чесночным запахом, но в самой чистой форме он не имеет запаха. Растворяем соединение в ацетоне для отправки. Точки плавления (точнее тройной точки, обусловленной равновесием между тремя фазами) и сублимации (процесс превращения твердого вещества в газообразное и наоборот без перехода через жидкое состояние) составляют -80,7 0С и -84,7 0С соответственно.
Плотность ацетилена может быть равна 1,097 г/мл-1. Можно легко зажечь закопченное пламя. Однако ацетилен смешивается с ацетоном, водой, бензолом и хлороформом. Он также слабо растворим в этаноле.
Химические свойства
Ацетилен является высокореактивным химическим соединением благодаря наличию у него электронов в тройной связи С-С. Вот почему ацетилен — блестящий нуклеофил. Таким образом, он может подвергаться широкому спектру реакций для получения коммерческих продуктов, таких как акриловая кислота, ацетилид, спирт и виниловое соединение. Мы также можем использовать его для получения металлоорганических соединений при взаимодействии с таким металлом, как медь.
Таким образом, он может подвергаться широкому спектру реакций для получения коммерческих продуктов, таких как акриловая кислота, ацетилид, спирт и виниловое соединение. Мы также можем использовать его для получения металлоорганических соединений при взаимодействии с таким металлом, как медь.
Использование ацетилена
Многие отрасли промышленности широко используют ацетилен в процессах сварки из-за высокой температуры ацетиленового пламени (3300°C). Некоторые менее развитые страны используют это пламя в качестве ламп накаливания. Кроме того, он может давать промежуточные продукты, такие как этилен, который очень полезен при производстве полипропилена, получаемого в пластмассовой промышленности.
Применение ацетилена
Портативное освещение
Карбид кальция использовался для производства ацетилена, который используется в лампах для переносных или удаленных применений. Он использовался для спелеологов и горняков до широкого использования ламп накаливания; он до сих пор используется горнодобывающей промышленностью в нескольких странах без законов о безопасности на рабочем месте; много лет спустя маломощное или яркое светодиодное освещение. Кроме того, карбидные лампы широко использовались в качестве фар в первых автомобилях и в качестве источника света для маяков.
Кроме того, карбидные лампы широко использовались в качестве фар в первых автомобилях и в качестве источника света для маяков.
Опасности для здоровья и безопасности
Давайте рассмотрим некоторые важные опасности для здоровья и безопасности, связанные с ацетиленом.
Это соединение легче воздуха и просто токсично, если производится методами, которые могут оставить другие химические соединения в виде примесей. Кроме того, он легко воспламеняется сажевым пламенем. Кроме того, его нельзя хранить вместе с окислителями. В частности, он взрывается при воздействии тепла или огня.
Ацетилен (C₂H₂) – свойства, применение, структура и формулы
Дата последнего обновления: 18 апр 2023
•
Всего просмотров: 151,8k
•
Просмотров сегодня: 3,50k
Любая группа органических химических соединений состоит только из атомов углерода (C) и водорода (ЧАС). Атомы углерода связываются вместе, образуя каркас соединения, а атомы водорода прилипают к нему различными способами.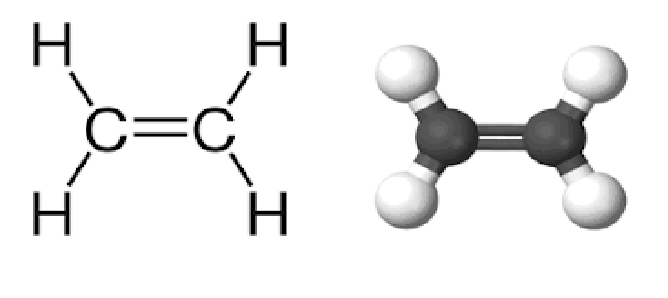 Нефть и природный газ в основном состоят из углеводородов.
Нефть и природный газ в основном состоят из углеводородов.
Алканы, алкены и алкины представляют собой три основных семейства алифатических углеводородов в зависимости от видов связей, которые они включают. Алканы имеют только одинарные связи, тогда как алкены и алкины имеют двойную углерод-углеродную связь и тройную углерод-углеродную связь соответственно.
Теперь у нас есть общее представление об углеводородах, и мы готовы исследовать ацетилен. Далее в этой теме мы пройдемся по некоторым свойствам ацетилена и формулам ацетилена.
Что такое ацетилен?
Ацетилен является простейшей химической молекулой алкина с формулой C 2 H 2 . Ацетилен также известен под названиями этин, нарсилен и винилен. Он широко используется в качестве химического компонента и топлива. С ним обращаются как с раствором в чистом виде, который нестабилен. Это ненасыщенная молекула, в которой два атома углерода соединены тройной связью.
Формула ацетилена
Как мы уже говорили, ацетилен является первым простейшим алкином. Поскольку это ненасыщенный углеводород, он должен иметь по крайней мере два атома углерода, связанных друг с другом, чтобы образовать ненасыщенный углеводород, или, можно сказать, тройную связь. Поскольку это простейший алкин, в нем ровно два атома углерода.
Как мы знаем, алкин имеет общую формулу C n H 2n-2 .
Итак, для ацетилена n=2.
Отсюда формула ацетилена =× C 2 H 2×2-2 =C 2 H 2
число атомов углерода в молекуле.
Таким образом, согласно этому правилу, название ацетилена в ИЮПАК звучит как «Eth (префикс для двух атомов углерода) + yne (суффикс для алкина)». Название ацетилена ИЮПАК — «Этин».
Свойства ацетилена
Винилен представляет собой бесцветный газ со слабым запахом эфира. Вода, хлороформ, ацетон и бензол легко растворяются в этом соединении. Сероуглерод и этанол незначительно его растворяют. Он легко горит и легче воздуха. Контейнеры могут сильно разрушиться при длительном воздействии тепла или огня.
Вода, хлороформ, ацетон и бензол легко растворяются в этом соединении. Сероуглерод и этанол незначительно его растворяют. Он легко горит и легче воздуха. Контейнеры могут сильно разрушиться при длительном воздействии тепла или огня.
Ацетилен не может существовать в виде жидкости при атмосферном давлении и не имеет точки плавления. Температура плавления (80,8 °С) при минимальном давлении, при котором может существовать жидкий ацетилен, показана тройной точкой на фазовой диаграмме (1,27 атм). Сублимация может преобразовать твердый ацетилен в пар (газ) при температурах ниже тройной точки. При атмосферном давлении температура сублимации составляет 84,0 °С.
Ацетилен 27,9 г на кг растворяется в ацетоне при нормальной температуре. Растворимость такого же количества диметилформамида (ДМФА) составляет 51 г. При 20,26 бар растворимость ацетона и ДМФА возрастает до 6890,0 и 628,0 г соответственно. Эти растворители используются в баллонах со сжатым газом.
Ацетилен C
2 H 2 Структура (Изображение будет загружено в ближайшее время) для кислородно-ацетиленовой газовой сварки и резки. Ацетилен производит пламя почти 3600 К (3330 ° C; 6020 ° F) в сочетании с кислородом, выделяя 11,8 кДж / г. Наиболее распространенным горючим газом является оксиацетилен. Формула оксиацетилена также C 2 Н 2 . После 5260 К (4990 ° C; 9010 ° F) дицианоацетилена и 4798 К (4525 ° C; 8177 ° F) цианоацетилена является третьим по температуре природным химическим пламенем. В прежние десятилетия основным методом сварки была кислородно-ацетиленовая сварка. Для многих применений развитие и преимущества методов дуговой сварки сделали кислородно-топливную сварку устаревшей. Сварка с использованием ацетилена стала гораздо менее распространенной. В регионах, где электричество недоступно, можно использовать кислородно-ацетиленовую сварку. Многие мастерские по производству металлоконструкций используют кислородно-ацетиленовую резку.
Ацетилен производит пламя почти 3600 К (3330 ° C; 6020 ° F) в сочетании с кислородом, выделяя 11,8 кДж / г. Наиболее распространенным горючим газом является оксиацетилен. Формула оксиацетилена также C 2 Н 2 . После 5260 К (4990 ° C; 9010 ° F) дицианоацетилена и 4798 К (4525 ° C; 8177 ° F) цианоацетилена является третьим по температуре природным химическим пламенем. В прежние десятилетия основным методом сварки была кислородно-ацетиленовая сварка. Для многих применений развитие и преимущества методов дуговой сварки сделали кислородно-топливную сварку устаревшей. Сварка с использованием ацетилена стала гораздо менее распространенной. В регионах, где электричество недоступно, можно использовать кислородно-ацетиленовую сварку. Многие мастерские по производству металлоконструкций используют кислородно-ацетиленовую резку.
Переносное освещение
Ацетилен, используемый в переносных или удаленных лампах, был получен с использованием карбида кальция.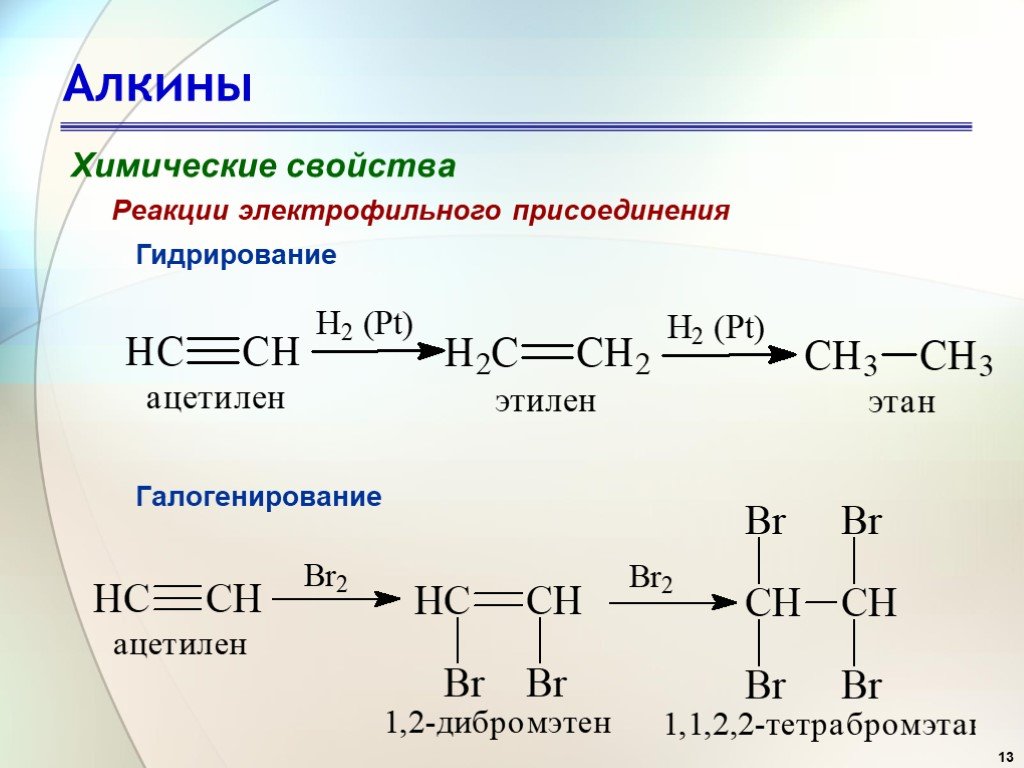 Он использовался для горняков и спелеологов до широкого использования ламп накаливания; или, много лет спустя, маломощное светодиодное освещение с большим световым потоком; и в настоящее время он используется в горнодобывающей промышленности в некоторых странах, где не существует стандартов безопасности на рабочем месте. Карбидные лампы также широко использовались в качестве фар в первых автомобилях и в качестве источника света для маяков в начале 19 века.00с.
Он использовался для горняков и спелеологов до широкого использования ламп накаливания; или, много лет спустя, маломощное светодиодное освещение с большим световым потоком; и в настоящее время он используется в горнодобывающей промышленности в некоторых странах, где не существует стандартов безопасности на рабочем месте. Карбидные лампы также широко использовались в качестве фар в первых автомобилях и в качестве источника света для маяков в начале 19 века.00с.
Пластмассы и производные акриловой кислоты
Ацетилен может быть преобразован в этилен и использован в качестве исходного сырья для ряда полиэтиленовых полимеров. Преобразование ацетилена в производные акриловой кислоты является еще одним важным применением, особенно в Китае. Акриловые волокна, стекла, краски, смолы и полимеры производятся из этих соединений.
Применение в нишах
Когда стальная деталь слишком велика для помещения в печь, иногда для ее науглероживания (закалки) используется ацетилен.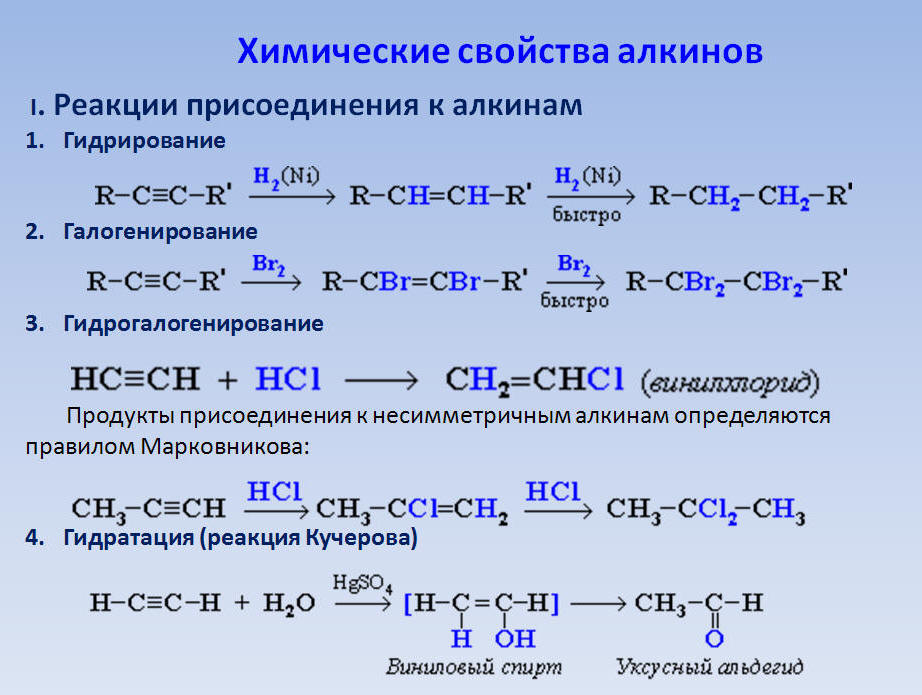 При радиоуглеродном датировании ацетилен используется для улетучивания углерода. В небольшой специализированной исследовательской печи углеродистый материал в археологическом образце обрабатывается металлическим литием для получения карбида лития (также известного как ацетилид лития). Затем карбид можно обработать водой для получения газообразного ацетилена, который можно подавать в масс-спектрометр для определения соотношения изотопов углерода-14 и углерода-12.
При радиоуглеродном датировании ацетилен используется для улетучивания углерода. В небольшой специализированной исследовательской печи углеродистый материал в археологическом образце обрабатывается металлическим литием для получения карбида лития (также известного как ацетилид лития). Затем карбид можно обработать водой для получения газообразного ацетилена, который можно подавать в масс-спектрометр для определения соотношения изотопов углерода-14 и углерода-12.
Получение ацетилена
Это химическое вещество производится путем частичного сжигания CH 2 с 1950 г. (метан). До 1983 года было произведено около 4 00 000 тонн. Фридрих Велер открыл эту реакцию в 1862 году, и она была использована для ее получения. Реакция гидролиза карбида кальция протекает следующим образом:
Ca(OH) 2 + C 2 H 2 → CaC 2 + 2H 2 O
В электрической дуге протекает описанная выше реакция.

