Ацетилен химическая связь: Образование химической связи в молекуле ацетилена. Вопрос 2 параграф 13 химия 10 класс Рудзитис – Рамблер/класс
alexxlab | 21.03.2023 | 0 | Разное
Образование химической связи в молекуле ацетилена. Вопрос 2 параграф 13 химия 10 класс Рудзитис – Рамблер/класс
Образование химической связи в молекуле ацетилена. Вопрос 2 параграф 13 химия 10 класс Рудзитис – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания “Останкино”?
Доброго дня! Подскажите, может кто уже сталкивался, как основываясь на современных представлениях об электронных орбиталях и их перекрывании, пояснить, как образуются химические связи в молекуле ацетилена, и сравните их с химическими связями в молекуле этилена.
ответы
И тебе не хворать) Тут вот какой ответ:
В молекуле этилена между атомами углерода образуется двойная связь. Одна из связей – σ-связь, другая – π-связь. σ-Связь образуется при перекрывании гибридных sр2-орбиталей атомов углерода. π-Связь образуется при перекрывании негибридизованных р-орбиталей атомов углерода.
В молекуле ацетилена атомы углерода имеют sp-гибридизацию. Из одной s-орбитали и одной р-орбитали образуются две одинаковых гибридных sp-орбитали. За счет одной из sp-орбиталей образуются связи с атомами водорода. Еще по одной орбитали перекрываются с образованием σ-связи между атомами углерода. У каждого из атомов углерода остается по две р-орбитали. За счет перекрывания р-орбиталей образуется еще две π-связи, лежащие во взаимно перпендикулярных плоскостях.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
9 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
(Подробнее…)
Химия
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Разница между Ацетиленом и Этиленом
Ключевое различие между Ацетиленом и Этиленом состоит в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
Содержание
- Обзор и основные отличия
- Что такое Ацетилен
- Что такое Этилен
- Сходство между Ацетиленом и Этиленом
- В чем разница между Ацетиленом и Этиленом
- Заключение
Что такое Ацетилен?
Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2H2. Это самый простой алкин среди углеводородов. Алкин это соединение, имеющее тройную связь между двумя атомами углерода и соответственно ацетилен, также имеет тройную связь между двумя атомами углерода. Между этими атомами углерода есть две пи-связи и одна сигма-связь.
Молекула ацетилена имеет линейную геометрию, так как один атом углерода может образовывать только четыре ковалентные связи (ацетилен имеет тройную связь и одинарную связь СН, что делает молекулу линейной). Следовательно, атомы углерода молекулы ацетилена sp-гибридизованы.
Химические свойства Ацетилена:
- Химическая формула: C2H2
- Молярная масса: 26,04 г/моль
- Физическое состояние при комнатной температуре: бесцветный газ
- Наличие запаха: без запаха
- Температура плавления: -80,8 °С
- Температура кипения: -84 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этин
Ацетилен не может существовать в виде жидкости при атмосферном давлении. Таким образом, он не имеет фактической температуры плавления. Приведенная выше температура плавления фактически является тройной точкой ацетилена. Поэтому твердая форма ацетилена подвергается сублимации, а не плавлению. при этом твердый ацетилен превращается в пар.
при этом твердый ацетилен превращается в пар.
Основное применение ацетилена в резке металла, а также в сварочных процессах. Кислородно-ацетиленовое пламя — это высокотемпературное пламя, которое нагревается до 3150 °С и используется для резки металла и его сварки.
Что такое Этилен?
Этилен является органическим соединением, имеющим химическую формулу C2H4. У этилена два атома углерода, связанные друг с другом через двойную связь (пи-связь и сигма-связь). Следовательно, молекула этилена имеет два sp2-гибридизованных атома углерода. Молекула этилена имеет плоскую структуру.
Химическая и молекулярная структура ЭтиленаХимические свойства Ацетилена Этилена:
- Химическая формула: C2H4
- Молярная масса: 28,05 г/моль
- Физическое состояние при комнатной температуре: бесцветный, легковоспламеняющийся газ
- Запах: сладковатый запах
- Температура плавления: −169,2 °C
- Точка кипения: −103,7 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этен
Лабораторным путём Этилен получают при нагревании этилового спирта с серной кислотой (концентрированной)
Основным источником промышленного этилена является сырая нефть и природные газы. Существует три основных способа производства этилена:
Существует три основных способа производства этилена:
- Паровой крекинг этана и пропана
- Паровой крекинг нафты
- Каталитический крекинг газойля
Этилен применяется в качестве мономеров для производства полимеров, таких как полиэтилен, который производится путем аддитивной полимеризации. Полиэтилен является распространенным упаковочным материалом. Кроме того, в биологических системах этилен выполняет функции растительного гормона. Кроме того он стимулирует процесс созревания плодов, что имеет практическое применение в растениеводстве. Например при перевозке бананов применяется их газация этиленон для дозревания в процессе доставки и тем самым потребителю они приходят зрелые и в свежем виде.
Каковы сходства между Ацетиленом и Этиленом?
- Оба являются простейшими углеводородами.
- Ацетилен и этилен состоят только из атомов углерода и атомов водорода.
- Оба бесцветные газы.
- И ацетилен, и этилен являются легковоспламеняющимися газами.

- Ацетилен и этилен имеют плоскую структуру.
В чем разница между Ацетиленом и Этиленом?
| Ацетилен против Этилена | |
| Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2h3 | Этилен является органическим соединением, имеющим химическую формулу C2h5 |
| Количество атомов водорода | |
| Ацетилен имеет два атома водорода в одной молекуле ацетилена | Этилен имеет четыре атома водорода в одной молекуле этилена |
| Молярная масса | |
| Молярная масса ацетилена составляет 26,04 г/моль | Молярная масса этилена составляет 28,05 г/моль |
| Химическая связь | |
| Ацетилен имеет тройную связь между двумя атомами углерода и двумя одинарными связями СН | Этилен имеет двойную связь между двумя атомами углерода и четырьмя одинарными связями СН |
| Гибридизация атомов углерода | |
| Атомы углерода молекулы ацетилена sp-гибридизованы | Атомы углерода молекулы этилена sp2-гибридизованы |
Основная информация — Ацетилен против Этилена
Ацетилен и Этилен являются углеводородными соединениями с широким спектром применения. Разница между Ацетиленом и Этиленом заключается в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
Разница между Ацетиленом и Этиленом заключается в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
СВЯЗЫВАНИЕ В ЭТИНЕ (АЦЕТИЛЕНЕ) | ||
Важно! Подход на этой странице следует из аналогичного (но немного более простого) объяснения связи в этилене. Если вы еще не знакомы с этим, вам следует сначала прочитать страницу об ethene. Чтобы понять этен, вы также должны понимать орбитали и связи в метане – извините, коротких путей нет! В зависимости от того, на сколько других страниц вам, возможно, придется ссылаться, вернитесь сюда позже, используя кнопку НАЗАД в браузере, меню GO или файл HISTORY, или через меню органического связывания (ссылка внизу каждой страницы в этом разделе). ). | ||
Этин, C 2 H 2 Простой вид соединения в этине Этин имеет тройную связь между двумя атомами углерода. Если вы читали страницу об этене, вы ожидаете, что этин будет более сложным, чем предполагает эта простая структура. Орбитальная проекция связи в этине Этин состоит из атомов водорода (1s 1 ) и атомов углерода (1s 2 2s 2 2p x 1 2p y 1 ). У атома углерода недостаточно неспаренных электронов для образования четырех связей (1 с водородом и три с другим углеродом), поэтому ему необходимо продвинуть одну из пар 2s 2 на пустую орбиталь 2p z . Это в точности то же самое, что происходит всякий раз, когда углерод образует связи — с чем бы он ни соединился. | ||
Важно! Если вам это не совсем понятно, вы должны пойти и прочитать статью о связи в метане. | ||
Каждый углерод соединяется только с двумя другими атомами, а не с четырьмя (как в метане или этане) или тремя (как в этене), поэтому, когда атомы углерода гибридизуют свои внешние орбитали перед образованием связей, на этот раз они гибридизируют только два орбиталей. Они используют 2s-электрон и один из 2p-электронов, но оставляют остальные 2p-электроны без изменений. Образовавшиеся новые гибридные орбитали называются sp 1 гибридами , потому что они состоят из s-орбитали и одиночной p-орбитали, реорганизующихся друг с другом. | ||
Примечание Более современное название того, что я называю гибридами sp 1 , — просто гибриды sp. Я предпочитаю старое название, потому что оно подчеркивает тот факт, что задействована только одна p-орбиталь, даже если 1 технически не нужна. Если ваша программа или учитель хочет, чтобы вы использовали только sp, вы так и поступаете. | ||
Как они выглядят в атоме (используя ту же цветовую кодировку): Обратите внимание, что два зеленых лепестка представляют собой две разных гибридных орбитали, расположенных как можно дальше друг от друга. Два атома углерода и два атома водорода выглядели бы так до того, как соединились вместе: Различные атомные орбитали, которые направлены друг к другу, теперь сливаются, образуя молекулярные орбитали, каждая из которых содержит связывающую пару электронов. это сигма-связи — такие же, как те, которые образуются при сквозном перекрытии атомных орбиталей, скажем, в этане. Сигма-связи показаны оранжевым цветом на следующей диаграмме. Различные p-орбитали (теперь они показаны немного другим красным цветом, чтобы избежать путаницы) теперь расположены достаточно близко друг к другу, чтобы перекрываться по бокам. Боковое перекрытие двух наборов р-орбиталей приводит к образованию двух пи-связей, каждая из которых похожа на пи-связь, обнаруженную, скажем, в этилене. Эти пи-связи равны 90° друг к другу — один над и под молекулой, а другой впереди и позади молекулы. | ||
Примечание: Прости мои художественные (не)способности! В частности, эти диаграммы имеют масштаб , а не . Чтобы заставить p-орбитали перекрываться и все еще видеть, что происходит в задней части молекулы, вы должны полностью сократить углерод-углеродное расстояние. На самом деле длина связи углерод-водород короче тройной связи углерод-углерод. | ||
© Джим Кларк, 2006 г. (изменено в марте 2013 г.) | ||
Структура тройной связи (этин)
В химии тройная связь представляет собой химическую связь между двумя атомами, в которой участвуют шесть связывающих электронов, а не два, как обычно в ковалентной одинарной связи. При порядке связи три тройные связи сильнее, чем эквивалентные одинарные или двойные связи. Алкины содержат наиболее распространенную тройную связь между двумя атомами углерода. Цианиды и изоцианиды — две другие функциональные группы, содержащие тройную связь. Некоторые двухатомные молекулы также имеют тройные связи, такие как диазот и монооксид углерода. Тройная связь представлена в скелетных формулах тремя параллельными линиями, соединяющими два соединенных атома. Тройная связь образуется между двумя атомами углерода, когда между ними находятся три пары электронов. Алкины отличаются от других углеводородов наличием тройной связи между атомами углерода. Атомы углерода с тройной связью ацетилена гибридизованы.
Алкины отличаются от других углеводородов наличием тройной связи между атомами углерода. Атомы углерода с тройной связью ацетилена гибридизованы.
Прямое перекрытие двух гибридизованных sp-орбиталей приводит к образованию сигма-связи между атомами углерода. Оставшиеся орбитали атомов углерода перекрываются друг с другом на 1s-орбитали каждого атома водорода вдоль межъядерной оси, что приводит к образованию одной сигма-связи CH и двух более слабых пи-связей. Эти связи образуются в результате перекрытия орбит. Каждый атом углерода использует только одну из своих трех р-орбиталей. В результате один электрон занимает две оставшиеся p-орбитали. Поскольку он такой же, как и другой атом углерода, это позволяет спаривать электроны, что приводит к образованию двух пи-связей.
Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебные материалы
+91
Подтвердите OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Наличие одной сигма-связи усиливает тройную углерод-углеродную связь. Ацетилен представляет собой прямолинейную молекулу с расстоянием углерод-углерод 1,21°. Поскольку sp-гибридизированный углерод имеет больше s-характеристик, чем sp2-гибридный углерод, расстояние C-H в ацетилене в 1,08 меньше, чем в алкенах.
Ацетилен представляет собой прямолинейную молекулу с расстоянием углерод-углерод 1,21°. Поскольку sp-гибридизированный углерод имеет больше s-характеристик, чем sp2-гибридный углерод, расстояние C-H в ацетилене в 1,08 меньше, чем в алкенах.
Этин, также известный как ацетилен, представляет собой химическое соединение, имеющее формулу C2h3. Это соединение является углеводородом, потому что весь его химический состав состоит только из атомов водорода и углерода. Многие считают этин самым основным алкином, потому что он состоит всего из двух атомов углерода, связанных друг с другом тройной связью. Чистый этин, как известно, нестабилен. В результате этин нередко используется в растворе. Этин можно получить путем частичного сжигания метана. Это соединение также можно получить путем гидролиза карбида кальция (химическое соединение с формулой CaC2, также известное как ацетилид кальция). Химическое уравнение для этой реакции карбида кальция и воды показано ниже.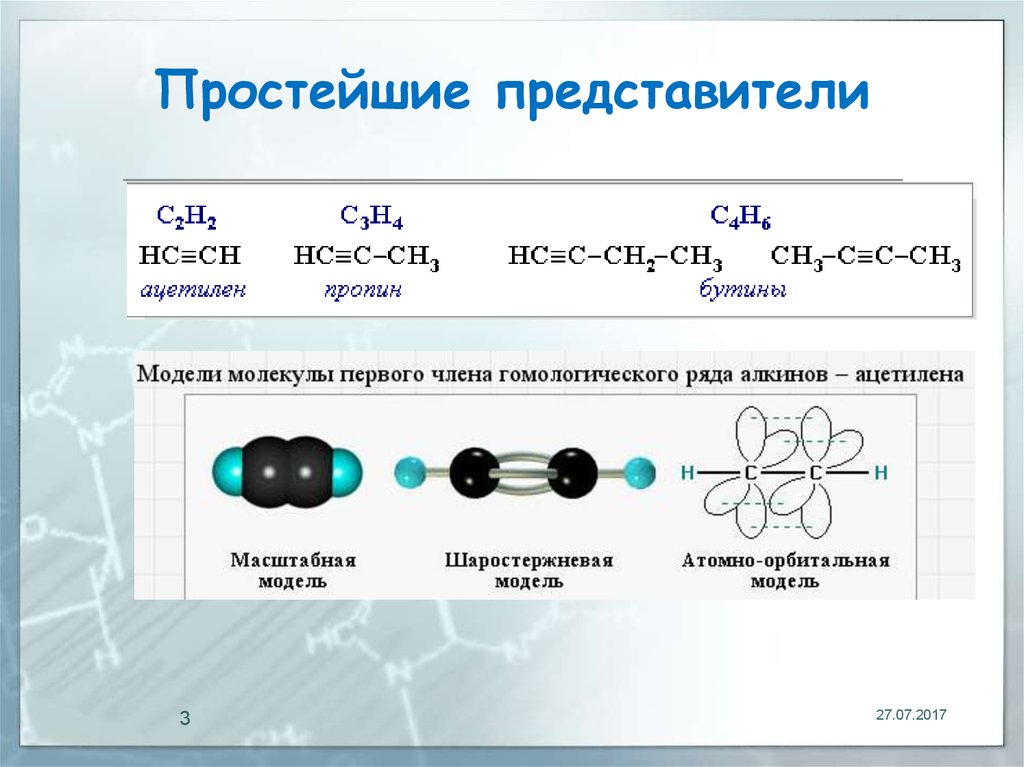 Поскольку он содержит тройную углерод-углеродную связь, этин (или ацетилен) является ненасыщенным углеводородом.
Поскольку он содержит тройную углерод-углеродную связь, этин (или ацетилен) является ненасыщенным углеводородом.
H 2 O + CaC 2 → C 2 H 2 + Ca(OH) 2
этин.
Формула этинаЭтин, также известный как ацетилен, представляет собой самое основное 2-углеродное органическое соединение с тройной связью. Название ацетилена по ИЮПАК — этин. Слово «eth» означает «два», а «yne» относится к тройной связи, образованной двумя атомами углерода. Они объединяются, чтобы сформировать название ИЮПАК и значение этина. C2h3 – это формула ацетилена. Формула ясно указывает на то, что это углеводород, потому что в молекулярной структуре нет других элементов, кроме углерода и водорода. Ацетилен — другое название этина. Этин является самым основным двухуглеродным алкином с формулой HC≡CH и молекулярной формулой C2h3
Структурная формула этина Молекула этина имеет тройную связь, образованную двумя атомами углерода, каждый из которых одинарно связан с одним атомом водорода. Стоит отметить, что все четыре атома выстраиваются по прямой линии с валентными углами около 180°. Следует также отметить, что длина связи углерод-водород в молекуле этина составляет примерно 106 пикометров, тогда как длина связи углерод-углерод в молекуле составляет примерно 120,3 пикометра. Структура молекулы этина изображена ниже.
Стоит отметить, что все четыре атома выстраиваются по прямой линии с валентными углами около 180°. Следует также отметить, что длина связи углерод-водород в молекуле этина составляет примерно 106 пикометров, тогда как длина связи углерод-углерод в молекуле составляет примерно 120,3 пикометра. Структура молекулы этина изображена ниже.
Электронно-точечная структура этина — еще один интересный аспект, о котором можно узнать на этой концептуальной странице. Вам нужно будет тщательно изучить и попрактиковаться в структуре электронных точек ацетилена, чтобы понять, как электроны распределяются в каждой связи в молекуле. Студенты лучше поймут, как образуется соединение, практикуя структуру электронных точек. Этиновая структура Льюиса – другое название для этого. Эта концепция идеально подходит для студентов, которые хотят узнать, как образуются органические связи путем обмена электронами. Вы также узнаете, как образовать связь углерод-водород и как электроны распределяются между двумя атомами разных элементов.
Простейшей молекулой в ряду алкинов является этин. В этом случае каждый атом углерода подвергается sp-гибридизации, что приводит к образованию двух sp-гибридных орбиталей. Эти две sp-гибридные орбитали параллельны и имеют валентный угол 180 градусов.
Две негибридные p-орбитали перпендикулярны друг другу и оси гибридизированных орбиталей. При образовании тройной связи sp-гибридная орбиталь одного атома углерода аксиально перекрывается с аналогичной sp-гибридной орбиталью другого атома углерода, образуя сигма-связь. Каждая из двух негибридных орбиталей одного атома углерода перекрывается сбоку с аналогичной орбиталью другого атома углерода, образуя две слабые -связи. Для образования связи C-H оставшаяся sp-гибридная орбиталь каждого атома углерода перекрывается с 1s-орбиталью водорода. Орбитальная структура этина, как показано на рисунке ниже, иллюстрирует структуру тройной связи:
В результате тройная связь углерод-углерод состоит из одной сигма-связи и двух пи-связей. Если одно пи-электронное облако изображается лежащим выше и ниже межъядерной оси, представляющей сигма-связь, другое пи-электронное облако изображается лежащим впереди и позади линии, как показано на рисунке:
Если одно пи-электронное облако изображается лежащим выше и ниже межъядерной оси, представляющей сигма-связь, другое пи-электронное облако изображается лежащим впереди и позади линии, как показано на рисунке:
Читайте также : Важная тема химии: Номенклатура алкинов
Часто задаваемые вопросыВозможна ли тройная связь?
В химии тройная связь — это химическая связь между двумя атомами, в которой участвуют шесть связывающих электронов, а не два обычных в одинарной ковалентной связи. Наиболее распространенная тройная связь между двумя атомами углерода встречается в алкинах. Другие функциональные группы с тройной связью включают цианиды и изоцианиды.
Почему тройные связи самые прочные?
Тройные связи прочнее двойных, потому что они содержат две пи-связи, а не одну. Каждый атом углерода имеет две гибридные sp-орбитали, одна из которых перекрывается, образуя sp-sp сигма-связь с соответствующей связью от другого атома углерода.



 На диаграмме каждая линия представляет одну пару общих электронов.
На диаграмме каждая линия представляет одну пару общих электронов.
 Не путайте их с формой р-орбитали.
Не путайте их с формой р-орбитали.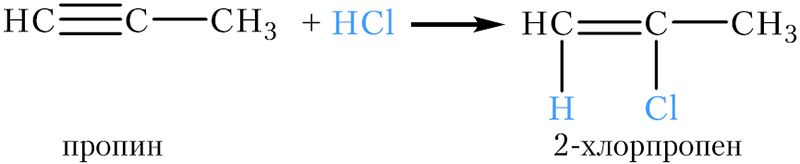 Обратите внимание на разные оттенки красного для двух разных пи-связей.
Обратите внимание на разные оттенки красного для двух разных пи-связей. . .
. .