Ацетилен плюс вода: C2H2 + H2O = ? уравнение реакции
alexxlab | 18.06.2023 | 0 | Разное
Химические свойства алкинов | CHEMEGE.RU
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединенияТройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. ГидрированиеГидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например , уравнение сгорания пропина: |
C3H4 + 4O2 → 3CO2 + 2H2O
2.
 2. Окисление алкинов сильными окислителями
2. Окисление алкинов сильными окислителями Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно).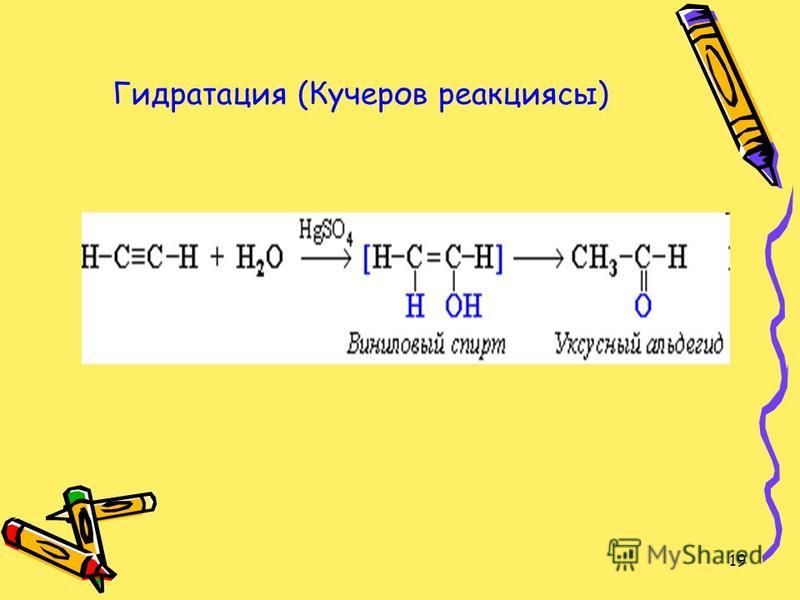
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т. д.
д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Понравилось это:
Нравится Загрузка…
ICSC 0089 – АЦЕТИЛЕН
ICSC 0089 – АЦЕТИЛЕН« back to the search result list(ru)
Chinese – ZHEnglish – ENFinnish – FIFrench – FRGerman – DEHebrew – HEHungarian – HUItalian – ITJapanese – JAKorean – KOPersian – FAPolish – PLPortuguese – PTRussian – RUSpanish – ES
| АЦЕТИЛЕН | ICSC: 0089 (Август 2003) |
| ЭТИН | |
| CAS #: 74-86-2 |
| UN #: 1001 |
| EINECS #: 200-816-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Чрезвычайно легковоспламеняющееся. Смеси газа с воздухом взрывоопасны. Смеси газа с воздухом взрывоопасны. |
НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, вентиляция, взрывозащищенное электрическое оборудование и освещение. Предотвращать образование электростатического заряда (например, используя заземление). Использовать ручной инструмент, не образующий искры. Пламегаситель для предотвращения обратного пламени от горелки в баллон. | Перекрыть поступление; если невозможно и нет риска для окружения, дать огню прогореть. В других случаях тушить порошком, двуокисью углерода. В случае пожара: охлаждать баллон распыляя воду. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Головокружение. Вялость. Головная боль. Удушье. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. |
Свежий воздух, покой. Может потребоваться искусственное дыхание. Обратиться за медицинской помощью. |
| Кожа | |||
| Глаза | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. | ||
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | ||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Удалить все источники воспламенения. Покинуть опасную зону! Проконсультироваться со специалистом! Индивидуальная защита: автономный дыхательный аппарат.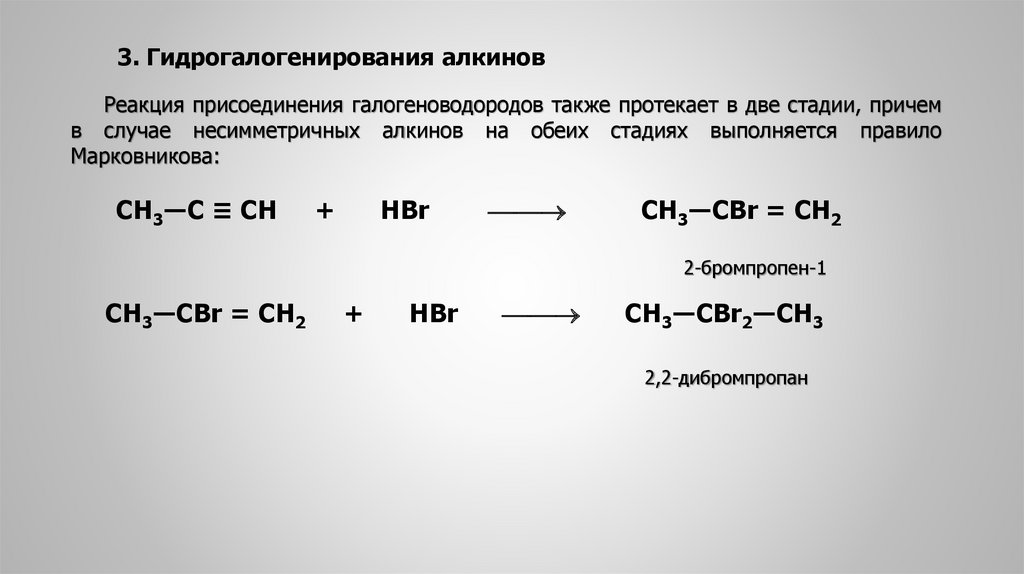 Вентилировать. Вентилировать. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. См. химические опасности. Прохладное место. | |
| УПАКОВКА | |
| Специальный изолированный баллон. |
| АЦЕТИЛЕН | ICSC: 0089 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C2H2 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Piping material for this gas must not contain over 63% of copper. Проверьте содержание кислорода перед тем, как войти. After use for welding, turn valve off; regularly check tubing, etc., and test for leaks with soap and water. The technical product may contain impurities which alter the health effects; for further information see ICSC0694 Phosphine. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F+; R: 5-6-12; S: (2)-9-16-33 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Ацетилен сгорает в кислороде с образованием углекислого газа и воды. Напишите скелетное уравнение реакции и уравновесьте его.

Вопрос
Вопрос
Dinesh Publication-Mole-Mole Concept-Matrix Match
5 видеоРеклама
AB Padhai Karo Bina Ads KE
Khareedo DN Pro и Dekho Sari Videos Bina Kisi Ad Ki Rukaavat Ke!
Обновлено: 27-06-2022
লিখিত জবাব
Решение
Скелетное уравнение реакции:
C2h3+O2→CO2+h3O
Балансировка завершается в следующие этапы:
(i) Запишите кислород в атомном состоянии
C2h3+O→CO2+h3O
(ii) Баланс атомов C
C2h3+O→ 2CO2_h3O
(iii) Сбалансируйте атомы O
C2h3+5O→2CO2+h3O
После проверки атомы H уже сбалансированы
(iv) Сделайте уравнение молекулярным или замените O на O2. Для этого умножьте уравнение на коэффициент 2
2C2h3+5O2→4CO2+2h3O
Окончательное сбалансированное уравнение:
2C2h3+5O2→4CO2+2h3O.
Пошаговое решение от экспертов, которое поможет вам избавиться от сомнений и получить отличные оценки на экзаменах.
সংশ্লিষ্ট ভিডিও
Напишите сбалансированное уравнение для следующей реакции: Метан сгорает в кислороде из углекислого газа и воды.
28395118
(a) Почему необходимо сбалансировать химическое уравнение?
(b) Напишите сбалансированные химические уравнения для следующих реакций:
(i) Природный газ сгорает на воздухе и соединяется с кислородом с образованием углекислого газа и воды.
(ii) При дыхании глюкоза соединяется с кислородом и образует углекислый газ и воду с выделением энергии.
34639827
Напишите сбалансированное химическое уравнение для следующей реакции:
Природный газ сгорает на воздухе и соединяется с кислородом с образованием углекислого газа и воды.
34639862
Ацетилен сгорает в кислороде с образованием углекислого газа и воды. Напишите сбалансированное уравнение этой реакции.
141192200
Напишите скелетное уравнение для следующих реакций:
Метан при сжигании соединяется с кислородом с образованием углекислого газа и воды.
565379876
Напишите сбалансированное химическое уравнение для следующих химических реакций. Этен сгорает в присутствии кислорода с образованием углекислого газа, воды и выделяет тепло и свет.
Этен сгорает в присутствии кислорода с образованием углекислого газа, воды и выделяет тепло и свет.
565379910
Напишите химическое уравнение для следующего: Метан при горении соединяется с кислородом с образованием углекислого газа и воды. В чем необходимость уравновешивания уравнения?
565379983
Напишите скелетное уравнение для следующих реакций: (i) Сероводород реагирует с диоксидом серы, образуя серу и воду. (ii) Метан при сжигании соединяется с кислородом с образованием углекислого газа и воды. Для чего нужны уравнения баланса?
628692350
Этан сгорает в кислороде с образованием углекислого газа и водяных паров. Напишите сбалансированное уравнение.
643652824
Напишите сбалансированные химические уравнения для следующих реакций: Метан + Кислород rarr Углекислый газ + Вода
644294369
निम्नलिखित के लिए संतुलित रासायनिक समीकरण लिखें-
644926177
Напишите сбалансированное уравнение для следующей реакции:
Метан сгорает в кислороде с образованием углекислого газа и воды.
646832870
Напишите сбалансированные химические уравнения для этих уравнений:
Горение бензола (C6H6) в кислороде с образованием углекислого газа и воды.
647239249
Напишите сбалансированные химические уравнения с символами состояний для следующих реакций:
Этан сгорает в кислороде с образованием углекислого газа и воды (газа).
647239265
Напишите сбалансированное уравнение для следующей реакции: Метан сгорает в кислороде с образованием углекислого газа и воды.
6472
Реакционная способность алкинов
Реакции алкинов |
|---|
Тройная углерод-углеродная связь может располагаться в любом неразветвленном участке углеродной цепи или на конце цепи, и в этом случае ее называют концевой . Из-за своей линейной конфигурации (угол связи sp-гибридизованного углерода составляет 180º) десятичленное углеродное кольцо является наименьшим, которое может выполнять эту функцию без чрезмерного напряжения. Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
1. Каталитическое гидрирование
Каталитическое присоединение водорода к 2-бутину не только служит примером такой реакции присоединения, но также предоставляет данные о теплоте реакции, которые отражают относительную термодинамическую стабильность этих углеводородов, как показано на диаграмме справа. Из теплоты гидрирования, показанной синим цветом в единицах ккал/моль, видно, что алкины термодинамически менее стабильны, чем алкены, в большей степени, чем алкены менее стабильны, чем алканы. Стандартные энергии связи для углерод-углеродных связей подтверждают этот вывод. Таким образом, двойная связь прочнее одинарной связи, но не в два раза прочнее.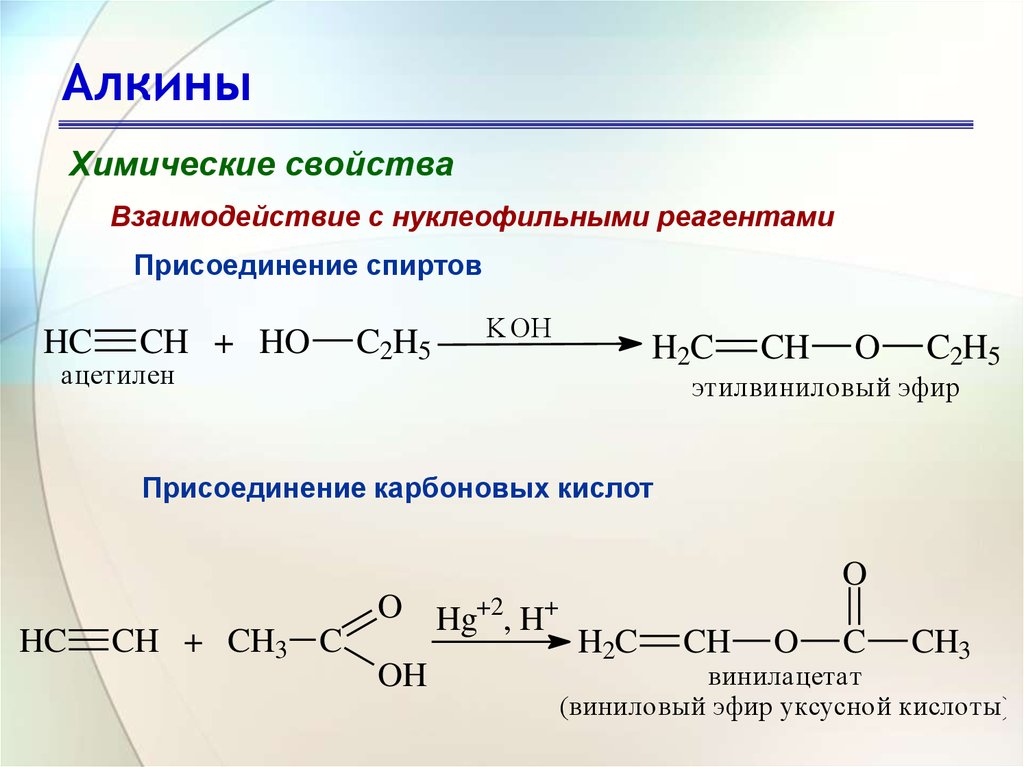 Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 – 28,3 = 8,4).
Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 – 28,3 = 8,4).
Поскольку алкины термодинамически менее стабильны, чем алкены, можно ожидать, что реакции присоединения первых будут более экзотермическими и относительно более быстрыми, чем эквивалентные реакции последних. В случае каталитического гидрирования обычные катализаторы гидрирования Pt и Pd настолько эффективны в промотировании присоединения водорода как к двойным, так и к тройным углерод-углеродным связям, что алкеновое промежуточное соединение, образованное присоединением водорода к алкину, не может быть выделено. Менее эффективный катализатор, Катализатор Линдлара , приготовленный дезактивацией (или отравлением) обычного палладиевого катализатора путем обработки его ацетатом свинца и хинолином, позволяет превращать алкины в алкены без дальнейшего восстановления в алкан. Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
| R-C≡C-R + H 2 & Lindlar Catalyst-> CIS R-CH = CH-R | |
R-C≡C-R + 2 NA In NH 3| R-CHOTC-R + 2 NA In NH 3 9013-LIA > транс R-CH=CH-R + 2 NaNH 2 | |
Алкены и алкины обнаруживают любопытную разницу в поведении при каталитическом гидрировании. Независимые исследования скорости гидрирования для каждого класса показывают, что алкены реагируют быстрее, чем алкины. Однако осторожное гидрирование алкина происходит исключительно до алкена до тех пор, пока первый не будет израсходован, после чего алкен продукта очень быстро гидрируется до алкана. Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.
Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.
2. Добавление электрофильных реагентов
При изучении реакций присоединения электрофильных реагентов, таких как сильные кислоты Бренстеда и галогены, к алкинам обнаруживается любопытный парадокс. Реакции даже более экзотермичны, чем присоединения к алкенам, и все же скорость присоединения к алкинам в 100–1000 раз медленнее, чем присоединение к эквивалентно замещенным алкенам. Реакция одного эквивалента брома с 1-пентен-4-ином, например, дает в качестве основного продукта 4,5-дибром-1-пентин.
Реакции даже более экзотермичны, чем присоединения к алкенам, и все же скорость присоединения к алкинам в 100–1000 раз медленнее, чем присоединение к эквивалентно замещенным алкенам. Реакция одного эквивалента брома с 1-пентен-4-ином, например, дает в качестве основного продукта 4,5-дибром-1-пентин.
Хотя эти электрофильные присоединения к алкинам медленны, они происходят и обычно проявляют региоселективность по правилу Марковникова и антистереоселективность. Одной из проблем, конечно, является то, что продукты этих присоединений сами по себе являются замещенными алкенами и поэтому могут подвергаться дальнейшему присоединению. Из-за своей высокой электроотрицательности галогеновые заместители на двойной связи снижают ее нуклеофильность и тем самым снижают скорость реакций электрофильного присоединения. Следовательно, существует тонкий баланс относительно того, будет ли продукт первоначального присоединения к алкину подвергаться дальнейшему присоединению к насыщенному продукту. Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Реакции электрофильного присоединения к алкенам и алкинам, как правило, протекают с начальным образованием пи-комплекса , в котором электрофил принимает электроны от кратной связи и слабо связывается с ней. Такие комплексы образуются обратимо и затем могут реорганизоваться в реакционноспособный промежуточный продукт на более медленной, определяющей скорость стадии. Реакции с алкинами более чувствительны к смене растворителя и каталитическим воздействиям, чем реакции с эквивалентными алкенами. Для примеров и обсуждения механизмов нажмите здесь.
Почему реакции алкинов с электрофильными реагентами протекают более вяло, чем соответствующие реакции алкенов? В конце концов, реакции присоединения к алкинам, как правило, более экзотермичны, чем присоединения к алкенам, и кажется, что плотность π-электронов вокруг тройной связи выше (две π-связи против одной). Два фактора важны для объяснения этого кажущегося парадокса. Во-первых, хотя с тройной связью связано больше π-электронов, sp-гибридизованные атомы углерода оказывают сильное притяжение к этим π-электронам, которые, следовательно, более прочно связаны с функциональной группой, чем π-электроны двойной связи. . Это видно по потенциалам ионизации этилена и ацетилена.
Два фактора важны для объяснения этого кажущегося парадокса. Во-первых, хотя с тройной связью связано больше π-электронов, sp-гибридизованные атомы углерода оказывают сильное притяжение к этим π-электронам, которые, следовательно, более прочно связаны с функциональной группой, чем π-электроны двойной связи. . Это видно по потенциалам ионизации этилена и ацетилена.
| Ацетилен | HC≡CH + Energy —— > [HC≡CH • (+) + e (–) | ΔH = +264 kcal/mole | |
|---|---|---|---|
| Ethylene | H 2 C=CH 2 + Энергия —— > [H 2 C=CH 2 ] • (+) + 9014 (–) 9014 | ΔH = +244 ккал/моль | |
| Этан | H 3 C–CH 3 + Энергия —— > [H 3 C–CH 3 ] • (+) + 4 9194 9014 (–) 9014 | ΔH = +296 ккал/моль |
Как определено предыдущими уравнениями, потенциал ионизации — это минимальная энергия, необходимая для отрыва электрона от молекулы соединения. Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Предполагается, что вторым фактором является стабильность промежуточного карбокатиона, образованного сигма-связью протона или другого электрофила с одним из атомов углерода тройной связи. Положительный заряд этого интермедиата локализован на ненасыщенном углероде, и такие 90–125 винильные катионы 90–126 менее стабильны, чем их насыщенные аналоги. Действительно, мы можем модифицировать наш предыдущий порядок устойчивости карбокатионов, включив в него эти виниловые катионы, как показано ниже. Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
|
Применение постулата Хаммонда указывает на то, что энергия активации для образования промежуточного соединения винилового катиона будет выше, чем для промежуточного соединения с более низкой энергией. Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Несмотря на эти различия, электрофильные присоединения к алкинам оказались исключительно полезными синтетическими преобразованиями. Например, добавление HCl, уксусной кислоты и синильной кислоты к ацетилену дает соответственно полезные мономеры винилхлорид, винилацетат и акрилонитрил, как показано в следующих уравнениях. Обратите внимание, что в этих и многих других подобных реакциях переходные металлы, такие как соли меди и ртути, являются эффективными катализаторами.
| HC≡CH + HCL + HGCL 2 (на углероде) – > H 2 C = CHCL Vinyl Chlorid —— > H 2 C=CClCH 2 Cl 2,3-dichloropropene |
| HC≡CH + CH 3 CO 2 H + HgSO 4 —— > H 2 C=CHOCOCH 3 vinyl acetate |
| HC≡CH + HCN + Cu 2 Cl 2 —— > H 2 C=CHCN acryonitrile |
Complexes formed by alkenes and alkynes with transition металлы отличаются от простых пи-комплексов, отмеченных выше.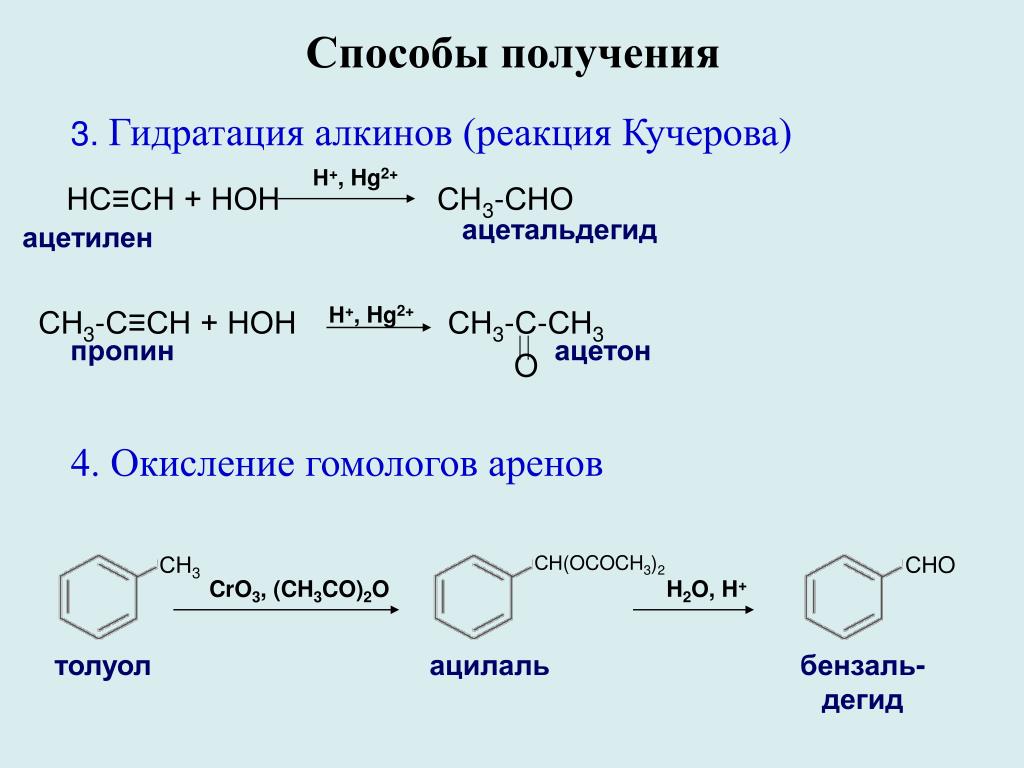 Здесь синергетический процесс, включающий донорство электронов с заполненной π-орбитали органического лиганда на пустую d-орбиталь металла вместе с обратным донорством электронов с другой d-орбитали металла на пустую π*-разрыхляющую орбиталь лиганда.
Модель комплекса Pt(II) с ацетиленом можно посмотреть, нажав здесь
Здесь синергетический процесс, включающий донорство электронов с заполненной π-орбитали органического лиганда на пустую d-орбиталь металла вместе с обратным донорством электронов с другой d-орбитали металла на пустую π*-разрыхляющую орбиталь лиганда.
Модель комплекса Pt(II) с ацетиленом можно посмотреть, нажав здесь
3. Гидратация алкинов и таутомерия
Как и в случае с алкенами, для присоединения воды к алкинам требуется сильная кислота, обычно серная кислота, и этому способствует сульфат ртути. Однако, в отличие от присоединения к двойным связям, которое дает спиртовые продукты, присоединение воды к алкинам дает кетоновые продукты (за исключением ацетилена, который дает ацетальдегид). Объяснение этого отклонения лежит в енол-кето-таутомеризации , иллюстрируемой следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), который немедленно перегруппировывается в более стабильный кето-таутомер.
Таутомеры определяются как быстро взаимопревращающиеся конституциональные изомеры, обычно отличающиеся другим расположением связи для лабильного атома водорода (здесь окрашены красным) и другим расположением двойной связи. Равновесие между таутомерами не только быстрое в нормальных условиях, но часто сильно благоприятствует одному из изомеров (например, ацетон на 99,999% состоит из кето-таутомера). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов. Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
| HC≡CH + H 2 O + HGSO 4 & H 2 SO 4 —— > [H 2 C = CHOH]-> H 9 399 399 3 9 3 . О |
| Rc≡CH + H 2 O + HGSO 4 & H 2 SO 4 —— > [RC (OH) = CH 2 ] – > RC (o). 3 |
| RC≡CR’ + H 2 O + HgSO 4 & H 2 SO 4 —— > [ RHC=C(OH)R’ + 2 RC(OH)=CHR’ 0] > RCH 2 -C(=O)R’ + RC(=O)-CH 2 R’ |
Два фактора оказывают важное влияние на описанную здесь енол-кето-таутомеризацию. Во-первых, это разность потенциальных энергий между таутомерными изомерами. Этот фактор определяет положение равновесного состояния . Второй фактор — это энергия активации взаимного превращения одного таутомера в другой. Этот фактор определяет скорость перегруппировки . Поскольку потенциальная энергия или стабильность соединения в значительной степени зависит от энергии его ковалентной связи, мы можем оценить относительную энергию кето- и енольных таутомеров, рассматривая связи, которые изменяются при перегруппировке. Из следующей диаграммы мы видим, что происходят только три значительных изменения, и стандартные энергии связи для этих изменений приведены справа от уравнения. Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии.
Во-первых, это разность потенциальных энергий между таутомерными изомерами. Этот фактор определяет положение равновесного состояния . Второй фактор — это энергия активации взаимного превращения одного таутомера в другой. Этот фактор определяет скорость перегруппировки . Поскольку потенциальная энергия или стабильность соединения в значительной степени зависит от энергии его ковалентной связи, мы можем оценить относительную энергию кето- и енольных таутомеров, рассматривая связи, которые изменяются при перегруппировке. Из следующей диаграммы мы видим, что происходят только три значительных изменения, и стандартные энергии связи для этих изменений приведены справа от уравнения. Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии.
Скорость, с которой происходит енол-кето-таутомеризация, свидетельствует о низкой энергии активации этого процесса. Мы отметили, что перегруппировка катализируется кислотой и основанием, и очень тщательные эксперименты показали, что взаимное превращение таутомеров происходит намного медленнее, если такие катализаторы отсутствуют. Ярким примером влияния энергии активации на такие превращения может служить следующая гипотетическая перегруппировка. Здесь мы заменили метильную группу (окрашенную темно-бордовым цветом) на протон обычной таутомерии, и метил переходит от кислорода к углероду точно так же, как протон переходит от енола к кетону.
Ярким примером влияния энергии активации на такие превращения может служить следующая гипотетическая перегруппировка. Здесь мы заменили метильную группу (окрашенную темно-бордовым цветом) на протон обычной таутомерии, и метил переходит от кислорода к углероду точно так же, как протон переходит от енола к кетону.
H 2 C=CH-O-CH 3 –X– > CH 3 -CH 2 -CH=O
Изменение потенциальной энергии для этой перегруппировки даже более выгодно, чем для енол-кето-таутомерии, и оценивается более чем в 25 ккал/моль от изменения энергии связи. Несмотря на эту термодинамическую движущую силу, описанный выше эфир енола полностью устойчив к обработке основанием и подвергается быстрому кислотно-катализируемому гидролизу с потерей метанола, а не перегруппировке. Определяющим отличием в этом случае должна быть непозволительно высокая энергия активации для описанной перегруппировки в сочетании с альтернативными путями реакции с более низкой энергией.
4. Реакции гидроборирования
Диборан легко реагирует с алкинами, но образование замещенных алкеновых продуктов оставляет открытой возможность второй реакции присоединения. Умный метод предотвращения этого события использует тот факт, что алкины обычно не страдают от стерических затруднений вблизи тройной связи (конфигурация этой функциональной группы линейна). Следовательно, большие или громоздкие электрофильные реагенты легко присоединяются к тройной связи, но образующийся алкен обязательно более скучен или стерически затруднен и сопротивляется дальнейшему присоединению. Объемный реагент гидроборирования, необходимый для этой стратегии, получают реакцией диборана с 2-метил-2-бутеном, сильно разветвленным алкеном. Из-за алкильного разветвления только два алкена присоединяются к BH 3 фрагмент (снова стерические затруднения), оставляя одну ковалентную связь BH доступной для реакции с алкином, как показано ниже. Полученный диалкилборан называется дисиамилбораном, сокращением от ди-вторичного изоамилборана (амил — это старое название пентила).
Важным применением дисиамилборана является его реакция присоединения к концевым алкинам. Как и в случае с алкенами, группа реагентов BH добавляется явно антимарковниковским образом из-за того, что электрофилом является бор, а не водород. Дальнейшее присоединение к образующемуся борзамещенному алкену не происходит, и обычное окислительное удаление бора щелочной перекисью водорода дает енол, который быстро перегруппировывается в альдегидный таутомер. Таким образом, при правильном выборе реагентов терминальные алкины могут быть превращены либо в метилкетоны (гидратация, катализируемая ионами ртути), либо в альдегиды (гидроборирование с последующим окислением).
Гидроборирование внутренних алкинов не является особенно полезной процедурой, поскольку часто будет получена смесь продуктов, если тройная связь не замещена симметрично. Аналогичные результаты дает гидратация, катализируемая ионами ртути.
5. Окисления
Реакции алкинов с окислителями, такими как перманганат калия и озон, обычно приводят к разрыву тройной связи с образованием продуктов карбоновой кислоты. Общее уравнение для такого рода преобразования следует. Символ [O] часто используется в общем для обозначения окисления.
Реакции нуклеофильного присоединения и восстановление |
|---|
Реакции нуклеофильного присоединения и восстановление
sp-гибридные атомы углерода тройной связи делают алкины более электрофильными, чем алкены с аналогичным замещением. В результате алкины иногда вступают в реакции присоединения, инициированные связыванием с нуклеофилом. Этот способ реакции, показанный ниже, обычно не проявляется для алкенов, если только двойная связь не активируется электроотрицательными заместителями, напр. F 2 C=CF 2 или путем сопряжения с электроноакцепторной группой.
В результате алкины иногда вступают в реакции присоединения, инициированные связыванием с нуклеофилом. Этот способ реакции, показанный ниже, обычно не проявляется для алкенов, если только двойная связь не активируется электроотрицательными заместителями, напр. F 2 C=CF 2 или путем сопряжения с электроноакцепторной группой.
Самым маленьким и наиболее реакционноспособным нуклеофильным веществом, вероятно, является электрон. Присоединение электрона к функциональной группе по определению является восстановлением, и мы отмечали ранее, что алкины восстанавливаются растворами натрия в жидком аммиаке до транс-алкенов. Чтобы понять, как происходит это восстановление, нам сначала нужно идентифицировать две различные реакции натрия с жидким аммиаком (температура кипения -78 ºC). В первом случае натрий растворяется в чистой жидкости с образованием темно-синего раствора, состоящего из очень подвижных и слабо связанных электронов вместе с сольватированными катионами натрия (первое уравнение ниже). В практических целях мы можем рассматривать такие растворы как источник «свободных электронов», которые можно использовать в качестве мощных восстановителей. Во втором случае соли трехвалентного железа катализируют реакцию натрия с аммиаком с выделением водорода и образованием бесцветной соли амида натрия (второе уравнение). Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания.
Чтобы понять, как происходит это восстановление, нам сначала нужно идентифицировать две различные реакции натрия с жидким аммиаком (температура кипения -78 ºC). В первом случае натрий растворяется в чистой жидкости с образованием темно-синего раствора, состоящего из очень подвижных и слабо связанных электронов вместе с сольватированными катионами натрия (первое уравнение ниже). В практических целях мы можем рассматривать такие растворы как источник «свободных электронов», которые можно использовать в качестве мощных восстановителей. Во втором случае соли трехвалентного железа катализируют реакцию натрия с аммиаком с выделением водорода и образованием бесцветной соли амида натрия (второе уравнение). Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания.
| Na + NH 3 (жидкость, –78 ºC) —— > Na (+) + e (–) (синий раствор) | ||||||||
| Na + NH 3 (жидкость, –78 ºC) + Fe —— > H 2 + NaNH 2 (бесцветный раствор) |
Кислотность терминальных алкинов |
|---|
Кислотность терминальных алкинов
Алканы, несомненно, являются самыми слабыми кислотами Бренстеда, обычно встречающимися в органической химии. Трудно измерить такие слабые кислоты, но по оценкам pK a этана составляет около 48. Гибридизация углерода для увеличения s-характера C-H увеличивает кислотность, при этом наибольшее изменение происходит для sp- Группы C-H обнаружены в терминальных алкинах. Таким образом, рК a этена оценивается в 44, а pK a этина (ацетилена) равно 25, что делает его кислотой в 10 23 раз более сильной, чем этан. Это увеличение кислотности позволяет выделить нерастворимые соли серебра и меди таких соединений.
Трудно измерить такие слабые кислоты, но по оценкам pK a этана составляет около 48. Гибридизация углерода для увеличения s-характера C-H увеличивает кислотность, при этом наибольшее изменение происходит для sp- Группы C-H обнаружены в терминальных алкинах. Таким образом, рК a этена оценивается в 44, а pK a этина (ацетилена) равно 25, что делает его кислотой в 10 23 раз более сильной, чем этан. Это увеличение кислотности позволяет выделить нерастворимые соли серебра и меди таких соединений.
Несмотря на резкое увеличение кислотности терминальных алкинов по сравнению с другими углеводородами, они по-прежнему являются очень слабыми кислотами, особенно по сравнению с водой, которая примерно в миллиард раз более кислая. Если мы хотим получить нуклеофильные соли терминальных алкинов для использования в синтезе, поэтому необходимо будет использовать гораздо более сильное основание, чем гидроксидный (или этоксидный) анион. Таким основанием является амид натрия (NaNH 2 ), обсуждавшийся выше, и его реакции с концевыми алкинами можно проводить в жидком аммиаке или эфире в качестве растворителей. Продуктами этой кислотно-щелочной реакции являются аммиак и соль ацетилида натрия. Поскольку ацетилид-анион является мощным нуклеофилом, он может вытеснять ионы галогенидов из 1º-алкилгалогенидов с образованием более сильно замещенного алкина в качестве продукта (S N 2 реакции). Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
Если мы хотим получить нуклеофильные соли терминальных алкинов для использования в синтезе, поэтому необходимо будет использовать гораздо более сильное основание, чем гидроксидный (или этоксидный) анион. Таким основанием является амид натрия (NaNH 2 ), обсуждавшийся выше, и его реакции с концевыми алкинами можно проводить в жидком аммиаке или эфире в качестве растворителей. Продуктами этой кислотно-щелочной реакции являются аммиак и соль ацетилида натрия. Поскольку ацетилид-анион является мощным нуклеофилом, он может вытеснять ионы галогенидов из 1º-алкилгалогенидов с образованием более сильно замещенного алкина в качестве продукта (S N 2 реакции). Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
| H-C≡C-H + NANH 2 (в аммиаке или эфире)-> H-C≡C-NNA (ацетилид натрия) + NH 3 | ||
| H-C≡C-NA + CH 3 -I -I-I -I-I -I-I -I-I-I -I-I -I-I -I -I-I -I-I -I -I -I -I -I- | H-C≡C-NA + CH 3 -I -I-I-I-I -I -I -I- | H-CHOT. — > H-C≡C-CH 3 + NaI — > H-C≡C-CH 3 + NaI |
| CH 3 -C титк -H + NANH 2 (в аммиаке или эфире) –> CH 3 -Cспеющих. -C≡C-Na + C 2 H 5 -Br —— > CH 3 -C≡C-C 2 H 5 + NaBr |
Потому что RC≡C: (-) Na (+) является очень сильным основанием (примерно в миллиард раз сильнее, чем NaOH), его использование в качестве нуклеофила в реакциях S N 2 ограничено 1º-алкилгалогенидами; 2º и 3º-алкилгалогениды отщепляются по механизму Е2.
Повышенная кислотность концевых алкинов по сравнению с алканами также приводит к реакциям металлообмена при обработке этих соединений литийорганическими реактивами или реактивами Гриньяра. Этот обмен, показанный ниже в уравнении 1, можно интерпретировать как кислотно-основную реакцию, которая, как и ожидалось, протекает в направлении более слабой кислоты и более слабого основания. Этот фактор явно ограничивает применимость реагентов Гриньяра или литиевых реагентов, когда присутствует концевая тройная связь, как в уравнении 2.
Этот фактор явно ограничивает применимость реагентов Гриньяра или литиевых реагентов, когда присутствует концевая тройная связь, как в уравнении 2.
| 1) RC≡C-H + C 2 H 5 MgBr (in ether) —— > RC≡C-MgBr + C 2 H 6 |
| 2) HC≡C-CH 2 CH 2 BR+MG (в эфире)-> [HC≡C-CH 2 CH 2 MGBR]-> BrmGGC. 2 CH 2 H |
Кислотность концевых алкинов также играет роль в определении продукта, когда вицинальные (или геминальные) дигалогениды подвергаются реакциям бис-элиминирования, индуцированным основанием. Следующий пример иллюстрирует отщепление такого типа, исходя из 1,2-дибромпентана, полученного из 1-пентена добавлением брома. Первоначальное отщепление предположительно приводит к образованию 1-бром-1-пентена, поскольку следует отдавать предпочтение атаке основания на более кислый и менее затрудненный 1º-углерод. Затем второе удаление дает 1-пентин. Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.
Затем второе удаление дает 1-пентин. Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.




 5-100
5-100