Ацетилен связь: В молекуле ацетилена имеется 1) тройная связь 2) двойная связь 3) одинарная связь 4) полуторная…
alexxlab | 31.12.2022 | 0 | Разное
Ацетилен, строение, физические и химические свойства — Информио
Дисциплина: Органическая химия
Тема: Ацетилен, строение, физические и химические свойства.
Учебная цель: Продолжить формирование у студентов понятия о кратных связях, познакомить с тройной связью между атомами углерода и её электронным строением. Сформировать представление о физических и химических свойствах ацетилена на основе его строения и в сопоставлении со свойствами этилена. Закрепить умения выводить формулы органических веществ по массовым долям элементов.
Развивающая цель: Продолжить развитие представлений о взаимном влиянии атомов в молекулах ацетиленовых углеводородов.
Воспитательная цель: Воспитание убеждённости в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде.
Оборудование: Мультимедийный проектор. Диск “Строение органических веществ”, таблица “Строение С2Н2

Реактивы: CaC2, воронка делительная, колба 250 мл, оборудование для получения ацетилена, кристаллизатор со снегом, штатив, раствор KMnO4, Br2 /Н2О.
Ход урока
Опрос. 3 студентов работают у доски.
Карточка № 1
1. Какой объем водорода выделится при каталитическом получении дивинила из 1 м3бутана (н.у.).
2. Будут ли иметь цис- транс – формы каучуки СКД (дивиниловый) и фторкаучук.
доказать, написав цис- транс формы.
Карточка № 2
1. Перечислить основные направления в развитии производства синтетических каучуков. Назвать виды сырья для получения каучука (подтвердить уравнениями реакций).
Карточка № 3.
1. Вулканизация каучука (изобразить схемой).
(С места по карточкам работают 2 студентов).
Карточка № 4.
1. Свойства
и строение натурального каучука.
Свойства
и строение натурального каучука.
Карточка № 5.
1. Дать определение диеновых углеводородов, перечислить их свойства.
Фронтальный опрос:
- Какие вам известные синтетические каучуки?
- В чем отличие каучуков стереорегулярного строения и нестереорегулярного? Примеры.
- Какие различия в свойствах резины и каучука вы можете отметить? Чем объяснить это различие?
- Что такое эбонит?
Подведение итогов опроса.
Изучение нового материала.
Беседа по вопросам.
- Как построена молекула С2Н4?
- Какой тип гибридизации электронных облаков углеродных атомов в молекуле этилена?
- Чем отличается сигма-связь от пи-связи?
- Какова длина связи С=С в молекуле этилена и валентный угол между направлениями связей?
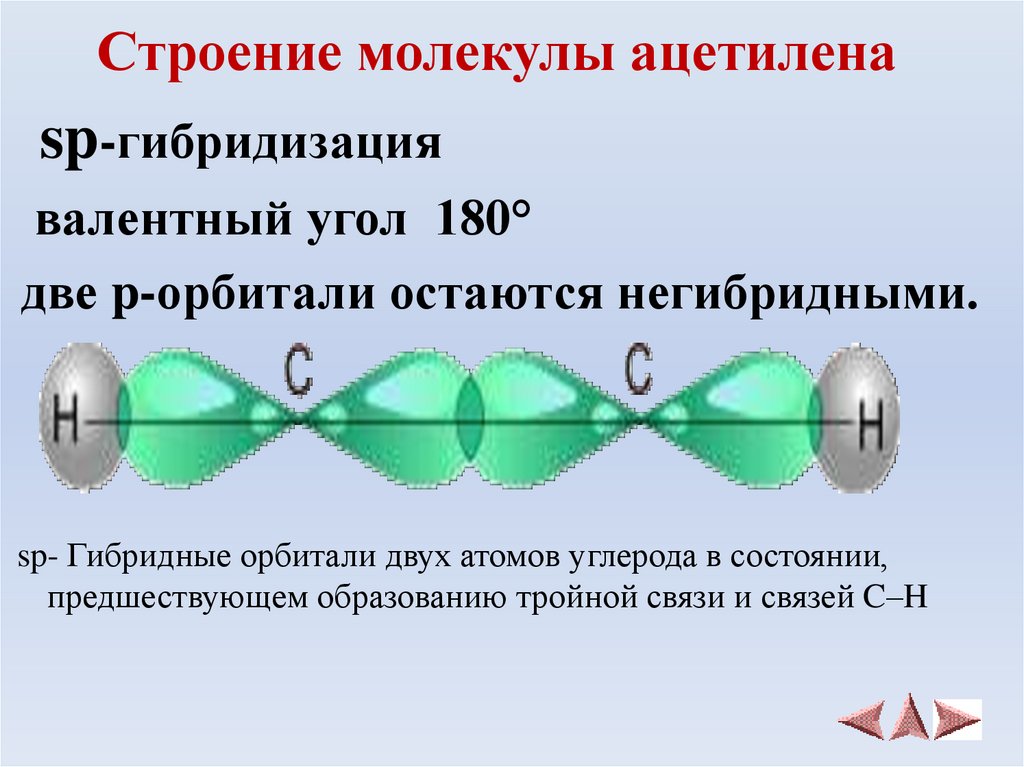
Ацетилен.
Вывод
молекулярной формулы ацетилена. Задачу студент решает у доски.
Задачу студент решает у доски.
При горении 5,2 г газообразного вещества образовалось 8,96 л СО2 (н.у.) и 0,2 M h3O. Д (Н)=13. Найти молекулярную формулу вещества.
Ответ:молекулярная формула ацетилена – С2Н2.
Демонстрация электронной и структурной формул молекулы С2Н2, проволочной модели С2Н2. Студенты делают сравнения со строением молекулы этилена.
В молекуле ацетилена у каждого атома углерода по 1 электрону идет на образование сигма- связи и по 2 электрона на образование 2 пи-связей. Тип гибридизации -sp.
Самостоятельная работа: Студенты изготавливают из пластилина шаростержневую модель С2Н2.
Вопрос: Изменяется ли расстояние между атомами углерода по сравнению со связями С – С в этане , С=С в этилене С2Н4? (студенты показывают сближение атомов углерода, большее сплющивание шариков).
Для
сравнения студенты заполняют самостоятельно таблицу. Один студент работает у
доски.
Один студент работает у
доски.
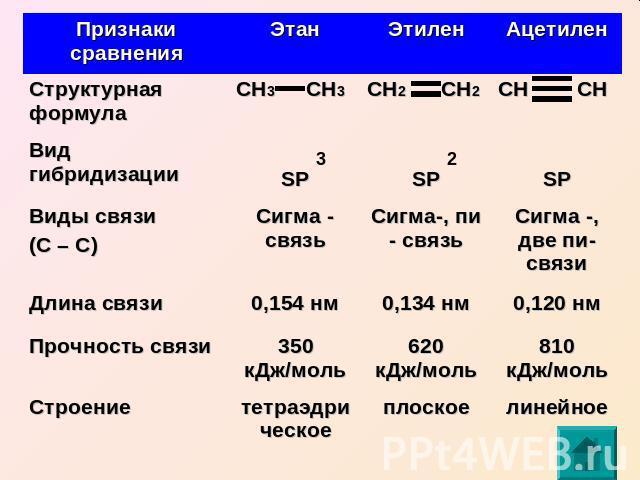
Углеводород | Тип связи | Длина связи | Валентный Угол | Тип гибридизации | |
Этан | С-С | 1,54 | 109° 28י | SP3 | Трёхмерная тетраэдрическая |
Этилен | С=С | 1,34 | 120° | SP2 | Плоская |
Ацетилен | С≡С | 1,2 | 180° | SP | Линейная |
После рассмотрения таблицы, студенты
переходят к изучению физических и
химических свойств ацетилена.
Демонстрация опытов.
Опыт 1. «Горящий снег». В кристаллизатор со снегом опускаем карбид кальция. Выделяющийся газ поджигаем.
Студенты самостоятельно записывают уравнение реакции получения ацетилена из карбида кальция и реакцию его горения.
СаС2 +НОН= С2Н2+ Са(ОН)2
С2Н2+О2=4СО2+2Н2
Ацетилен горит коптящим пламенем (повышенное содержание углерода в молекуле).
Опыт 2. Растворимость в воде.
Ацетилен пропускается через пробирку с Н2О, Наблюдение: выделение газа. Вода как бы кипит.
Вывод: ацетилен плохо растворим в воде.
Опыт 3. Окисление ацетилена водным раствором перманганата калия KMnО4.
Через подкисленный раствор KMnO4 попускаем ацетилен, происходит обесцвечивание раствора перманганата калия.
Вывод: ацетилен относится к непредельным
углеводородам.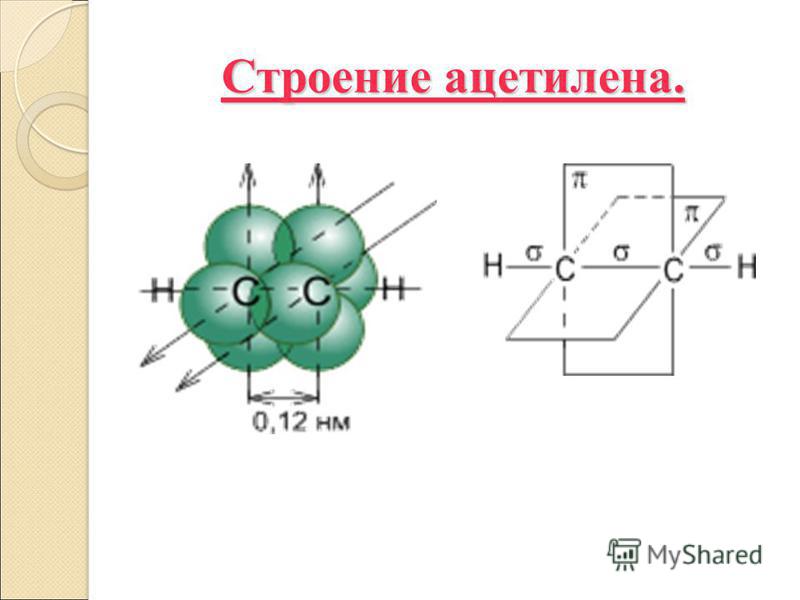 Это качественная реакция на соединения с кратной связью.
Это качественная реакция на соединения с кратной связью.
Опыт 4. Обесцвечивание Br2 /Н2О ацетиленом.
Пропускаем ацетилен через бромную воду, она обесцвечивается.
Реакции присоединения идут по месту разрыва тройной связи.
Далее студенты работают с материалом учебника. Продолжают изучать химические свойства ацетилена.
Свойства аналогичны с этиленом, а есть ли отличие?
Влияние тройной связи на подвижность водорода в С2Н2.
Электронная плотность концентрируется между С-С связями и в С→H связи электронная плотность смещена к атому водорода. Если в ацетиленовых при тройной связи имеется атом водорода, в отличие от других атомов углеводородов, то они проявляет свойства очень слабых кислот в присутствии солей меди, серебра (AgNO3, NH3, H2O).
H─C≡C─H → Ag+2[Ag(NH3 )2]OH→AgC≡CAg↓+4NH3+2H2O ацетиленид серебра
Серый осадок.
CaC2 ─ продукт замещения атомов водорода в молекуле ацетилена. Ацетилениды щелочных и щелочноземельных металлов называются карбидами.
R-C≡C-H + [Cu(NH3)2]Cl → R-C≡C-Cu↓ + NH4Cl +NH3
Красный осадок.
Реакция полимеризации.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl2 и NH4Cl ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
Закрепление пройденного материала.
- Перечислите
физические свойства ацетилена.

- Перечислите химические свойства ацетилена.
- Назовите отличия химических свойств ацетилена от предельных и этиленовых углеводородов.
- Рассмотрим реакцию присоединения брома к С2Н2, которая идет по ионному механизму аналогично этилену.
Подведение итогов урока.
Литература:
- О.С. Габриелян Химия. 10 кл. Москва. Дрофа.
5. Алкины — ЗФТШ, МФТИ
Общая формула гомологического ряда алкинов `”C”_n”H”_(2n-2)`. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
1. Реакции электрофильного присоединения `”A”_”E”` для алкинов протекают медленнее, чем в случае алкенов. Продукты реакции определяются правилом Марковникова.
а) гидрогалогенирование проходит в две стадии, использование катализатора `”AlCl”_3` облегчает протекание реакции:
б) при гидратации алкинов (реакция Кучерова) на первой стадии образуется неустойчивый непредельный спирт, который затем изомеризуется в альдегид или кетон:
в) галогенирование также проходит в две стадии с промежуточным образованием производных этилена, а затем этана:
`”HC”≡”CH” + “Br”_2 -> “CHBr”=”CHBr”`
`”CHBr”=”CHBr”+”Br”_2 -> “CHBr”_2 – “CHBr”_2`.
Обесцвечивание бромной воды является качественной реакцией на тройную связь.
2. Алкины, содержащие тройную связь в конце цепи, проявляют очень слабые кислотные свойства. Ацетилен и алкины-`1` способны образовывать соли (ацетилениды) при реакции с одновалентными металлами или их ионами:
$$ {\mathrm{CH}}_{3}-\mathrm{C}\equiv \mathrm{CH}+\left[\mathrm{Cu}{\left({\mathrm{NH}}_{3}\right)}_{2}\right]\mathrm{Cl}\to {\mathrm{CH}}_{3}-\mathrm{C}\equiv \mathrm{C}-\mathrm{Cu}+{\mathrm{NH}}_{4}\mathrm{Cl}+{\mathrm{NH}}_{3}\uparrow $$
$$ \mathrm{R}-\mathrm{C}\equiv \mathrm{CH}+\mathrm{NaH}\to \mathrm{R}-\mathrm{C}\equiv \mathrm{C}-\mathrm{Na}+{\mathrm{H}}_{2}\uparrow $$
При взаимодействии ацетилена с аммиачным раствором оксида серебра образуется жёлтый осадок диацетиленида серебра:
`”HC”-=”CH”+2[“Ag(NH”_3)_2]”OH” ->`
`->”Ag” – “C”-=”C” – “Ag”darr + 4″NH”_3 + 2″H”_2″O”`.
Ацетилениды легко гидролизуются растворами кислот:
`”CH”_3 – “C”-=”C” – “Ag” + “HCl” -> “CH”_3 – “C”-=”CH” + “AgCl”darr`.
3. Алкины вступают в реакции окисления и восстановления.
а) При действии сильных окислителей в кислой среде ацетилен окисляется до щавелевой кислоты:
5HC≡CH+8KMnO4+12h3SO4→→5HCOO-COOH+8MnSO4+4K2SO4+12h3O5\mathrm{HC}\equiv \mathrm{CH}+8{\mathrm{KMnO}}_{4}+12{\mathrm{H}}_{2}{\mathrm{SO}}_{4}\to \phantom{\rule{0ex}{0ex}}\to 5\mathrm{HCOO}-\mathrm{COOH}+8{\mathrm{MnSO}}_{4}+4{\mathrm{K}}_{2}{\mathrm{SO}}_{4}+12{\mathrm{H}}_{2}\mathrm{O}
б) В водном растворе перманганат калия окисляет ацетилен до оксалата калия:
$$ 3\mathrm{HC}\equiv \mathrm{CH}+8{\mathrm{KMnO}}_{4}\to 3\mathrm{KOOC}-\mathrm{COOK}+8{\mathrm{MnO}}_{2}\downarrow +2\mathrm{KOH}+2{\mathrm{H}}_{2}\mathrm{O}$$
в) Использование в качестве окислителя раствора KMnO4 в серной кислоте при нагревании приводит к расщеплению тройной связи и образованию карбоновых кислот, в молекулах которых число атомов углерода соответствует числу атомов углерода в «осколках» после разрыва тройной связи:
5Ch4-C≡C-Ch3-Ch4+6KMnO4+9h3SO4→→5Ch4COOH+5Ch4-Ch3-COOH+3K2SO4+6MnSO4+4h3O5{\mathrm{CH}}_{3}-\mathrm{C}\equiv \mathrm{C}-{\mathrm{CH}}_{2}-{\mathrm{CH}}_{3}+6{\mathrm{KMnO}}_{4}+9{\mathrm{H}}_{2}{\mathrm{SO}}_{4}\to \phantom{\rule{0ex}{0ex}}\to 5{\mathrm{CH}}_{3}\mathrm{COOH}+5{\mathrm{CH}}_{3}-{\mathrm{CH}}_{2}-\mathrm{COOH}+3{\mathrm{K}}_{2}{\mathrm{SO}}_{4}+6{\mathrm{MnSO}}_{4}+4{\mathrm{H}}_{2}\mathrm{O}
г) Горение алкинов в кислороде – сильно экзотермическая реакция:
$$ {\mathrm{CH}}_{3}-\mathrm{C}\equiv \mathrm{CH}+4{\mathrm{O}}_{2}\to 3{\mathrm{CO}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}$$
д) Гидрирование алкинов протекает при нагревании с металлическими катализаторами (Ni, Pt, Pd). Реакция может идти в две стадии:
Реакция может идти в две стадии:
$$ {\mathrm{CH}}_{3}-\mathrm{C}\equiv \mathrm{CH}+{\mathrm{H}}_{2}\underset{t°\mathrm{C}}{\overset{\mathrm{кат}.}{\to }}{\mathrm{CH}}_{3}-\mathrm{CH}={\mathrm{CH}}_{2}$$
$$ {\mathrm{CH}}_{3}-\mathrm{CH}={\mathrm{CH}}_{2}+{\mathrm{H}}_{2}\underset{t°\mathrm{C}}{\overset{\mathrm{кат}.}{\to }}{\mathrm{CH}}_{3}-{\mathrm{CH}}_{2}-{\mathrm{CH}}_{3}$$
`4. Алкины способны к полимеризации.
а) Ацетилен димеризуется при пропускании через водно-аммиачный раствор `”CuCl”`:
$$ \mathrm{HC}\equiv \mathrm{CH}+\mathrm{HC}\equiv \mathrm{CH}\stackrel{\mathrm{кат}.}{\to }{\mathrm{CH}}_{2}=\mathrm{CH}-\mathrm{C}\equiv \mathrm{CH} \left(\mathrm{винилацетилен}\right)$$
Присоединение к винилацетилену хлороводорода приведёт к образованию хлоропрена
– исходного сырья для производства хлоропренового каучука.
б) Тримеризация ацетилена на активированном угле приводит к образованию бензола.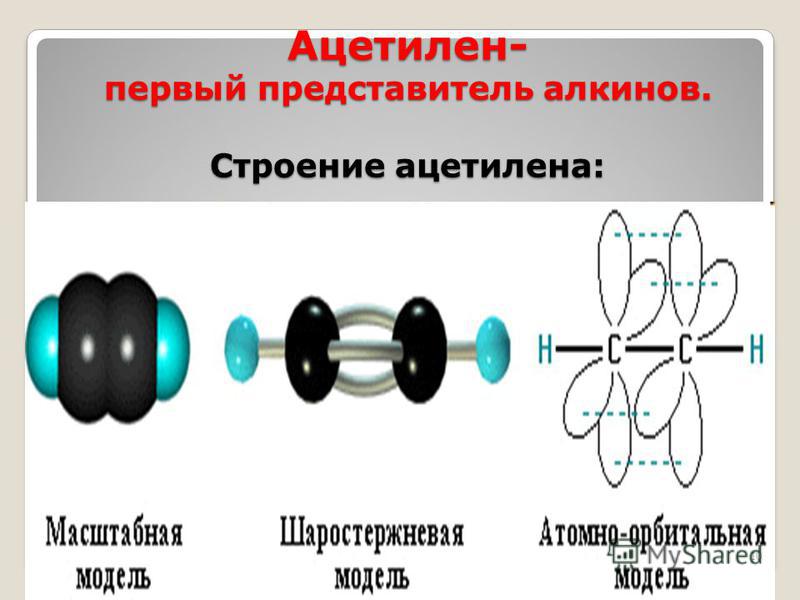
Аналогичная реакция пропина приводит к образованию смеси гомологов бензола:
1.9: sp-гибридные орбитали и структура ацетилена
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31376
Цели
После завершения этого раздела вы сможете
- используют концепцию гибридизации sp для объяснения образования тройных углерод-углеродных связей и описывают тройную углерод-углеродную связь как состоящую из одной σ-связи и двух π-связей.
- перечислены приблизительные длины связей, связанных с типичными одинарными, двойными и тройными связями углерод-углерод. [Возможно, вам придется просмотреть разделы 1.
 7 и 1.8.]
7 и 1.8.] - список приблизительных валентных углов, связанных с sp 3 -, sp 2 – и sp ‑гибридизировали атомы углерода и предсказывают ожидаемые валентные углы в данных органических соединениях. [При необходимости просмотрите разделы 1.6, 1.7 и 1.8.]
- учитывают различия в длине связи, прочности связи и валентных углах, обнаруженные в соединениях, содержащих sp 3 -, sp 2 – и sp-гибридизированные атомы углерода, такие как этан, этилен и ацетилен.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- sp гибридный орбитальный
Study Notes
Валентные углы, связанные с sp 3 -, sp 2 – и sp ‑гибридизированными атомами углерода, составляют приблизительно 109,5° и 1800° соответственно.
Связывание в ацетилене
Наконец, концепция гибридных орбит хорошо применима к группам с тройными связями, таким как алкины и нитрилы. Рассмотрим, например, строение этина (другое распространенное название — ацетилен), простейшего алкина.
этин
(ацетилен)
Эта молекула линейна: все четыре атома лежат на одной прямой. Тройная связь углерод-углерод имеет длину всего 1,20Å. В картине гибридной орбиты ацетилена оба атома углерода являются sp -гибридизированными . В гибридном углероде sp орбиталь 2 s объединяется с орбиталью 2 p x , образуя две гибридные орбитали sp , ориентированные под углом 180° друг к другу (например, , вдоль оси х). 2 9Орбитали 0029 p y и 2 p z остаются негибридизированными и ориентированы перпендикулярно оси y и z соответственно.
С-С сигма-связь образуется путем перекрывания одной sp -орбитали каждого атома углерода, а две C-H сигма-связи образуются путем перекрытия второй sp -орбитали каждого атома углерода с 1 s орбиталь на водороде.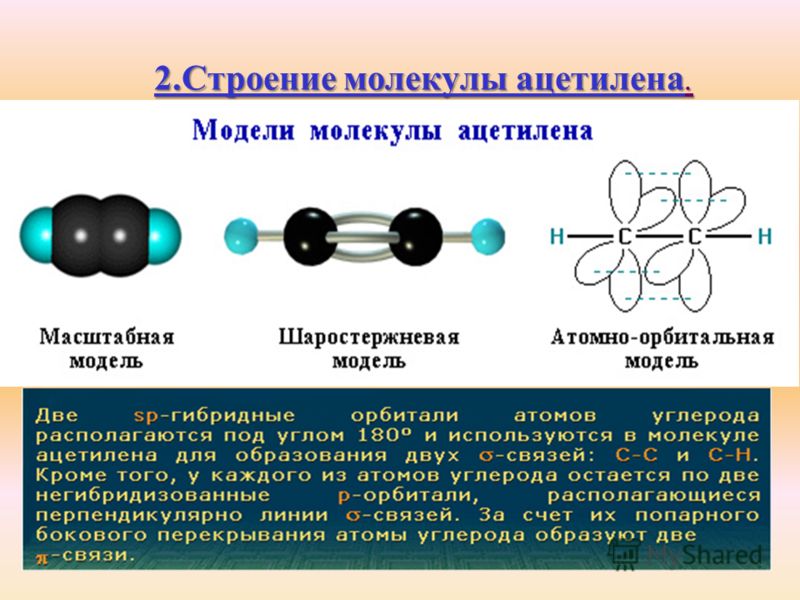 У каждого атома углерода еще есть два наполовину заполненных 2 p y и 2 p z орбитали, которые перпендикулярны как друг другу, так и линии, образованной сигма-связями. Эти две перпендикулярные пары орбиталей p образуют две пи-связи между атомами углерода, что в целом дает тройную связь (одна сигма-связь плюс две пи-связи).
У каждого атома углерода еще есть два наполовину заполненных 2 p y и 2 p z орбитали, которые перпендикулярны как друг другу, так и линии, образованной сигма-связями. Эти две перпендикулярные пары орбиталей p образуют две пи-связи между атомами углерода, что в целом дает тройную связь (одна сигма-связь плюс две пи-связи).
| сигма-соединение в этилене | связывание пи в этилене |
Ацетилен имеет три сигма-связи и две пи-связи. Тройная связь углерод-углерод в ацетилене является самой короткой (120 пм) и самой прочной (965 кДж/моль) из всех типов связи углерод-углерод. Поскольку каждый углерод в ацетилене имеет две электронные группы, VSEPR предсказывает линейную геометрию и валентный угол H-C-C, равный 180 o .
| Молекула | Бонд | Прочность связи (кДж/моль) | Длина соединения (пм) |
|---|---|---|---|
| Этан, CH 3 CH 3 | ( сп 3 ) К-К ( сп 3 ) | 376 | 154 |
| Этилен, H 2 C=CH 2 | ( сп 2 ) С=С ( сп 2 ) | 728 | 134 |
| Ацетилен, HC≡CH | ( сп ) К≡К ( сп ) | 965 | 120 |
Обратите внимание, что по мере увеличения порядка связи длина связи уменьшается, а прочность связи увеличивается.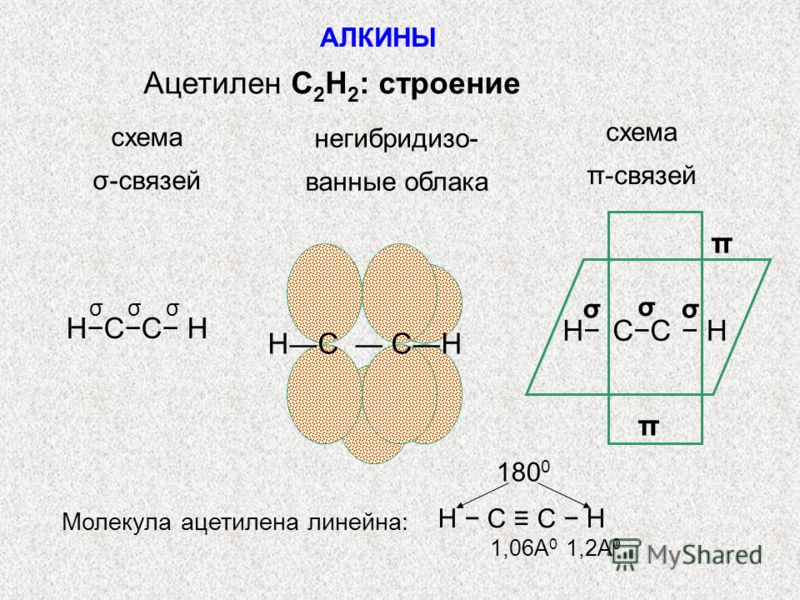
Концепция гибридных орбиталей прекрасно объясняет другое экспериментальное наблюдение: одинарные связи, соседствующие с двойными и тройными связями, становятся все короче и прочнее, чем «нормальные» одинарные связи, такие как в простом алкане. Связь углерод-углерод в этане (структура A ниже) возникает в результате перекрывания двух sp 3 орбиталей.
Однако в пропене (B) одинарная связь углерод-углерод является результатом перекрытия между орбиталью sp 2 и орбиталью sp 3 , тогда как в пропине (C) одинарная связь углерод-углерод является результат перекрытия между sp-орбиталью и sp-орбиталью 3 . Все это одинарные связи, но одинарная связь в молекуле C короче и прочнее, чем в молекуле B, которая, в свою очередь, короче и прочнее, чем в A.
Объяснение здесь относительно простое. sp-орбиталь состоит из одной s орбитальный и один p орбитальный, и, таким образом, он имеет 50% s символов и 50% p символов. Для сравнения, орбитали sp 2 имеют 33% s признаков и 67 % p признаков, в то время как sp 3 орбиталей имеют 25 % s признаков и 75 % p признаков. Из-за своей сферической формы орбитали 2 s меньше и удерживают электроны ближе и «плотнее» к ядру по сравнению с 2 p орбиталей. Следовательно, связи с перекрытием sp + sp 3 (как в алкине C) короче и прочнее, чем связи с перекрытием sp 2 + sp 3 (как в алкене B). Связи, включающие перекрывание sp 3 – sp 3 (как в алкане А), являются самыми длинными и слабыми в группе из-за 75-процентного « p » характера гибридов.
Для сравнения, орбитали sp 2 имеют 33% s признаков и 67 % p признаков, в то время как sp 3 орбиталей имеют 25 % s признаков и 75 % p признаков. Из-за своей сферической формы орбитали 2 s меньше и удерживают электроны ближе и «плотнее» к ядру по сравнению с 2 p орбиталей. Следовательно, связи с перекрытием sp + sp 3 (как в алкине C) короче и прочнее, чем связи с перекрытием sp 2 + sp 3 (как в алкене B). Связи, включающие перекрывание sp 3 – sp 3 (как в алкане А), являются самыми длинными и слабыми в группе из-за 75-процентного « p » характера гибридов.
Сводка по гибридизации
- Одинарная связь является сигма-связью.
- Двойная связь состоит из сигма-связи и пи-связи.
- Тройная связь состоит из сигма-связи и двух пи-связей.
- Сигма-связи образованы перекрытием двух гибридных орбиталей или перекрытием гибридной орбитали и s-орбитали водорода.
 Связи
Связи - Pi образованы перекрыванием двух негибридных p-орбиталей.
- Электроны неподеленной пары обычно содержатся на гибридных орбиталях.
Используемые гибридные орбитали (и, следовательно, гибридизация) зависят от того, сколько электронных групп окружает рассматриваемый атом. Электронная группа может означать либо связанный атом, либо неподеленную пару. Молекулярная геометрия также определяется количеством электронных групп, поэтому она напрямую связана с гибридизацией.
| Количество электронных групп | Гибридный орбитальный Бывший в употреблении | Пример | Базовая геометрия | Базовый соединительный уголок |
|---|---|---|---|---|
| 2 | сп | Линейный | 180 или | |
| 3 | сп 2 | Тригональная планарная | 120 или | |
| 4 | сп 3 | Тетраэдрический | 109,5 или |
Упражнения
1) Для молекулы ацетонитрила:
а) Сколько в ней сигма- и пи-связей?
б) Какие орбитали перекрываются, образуя сигма-связи C-H?
в) Какие орбитали перекрываются, образуя сигма-связь С-С?
г) Какие орбитали перекрываются, образуя сигма-связь C-N?
д) Какие орбитали перекрываются, образуя пи-связи C-N?
е) Какая орбиталь содержит неподеленную пару электронов азота?
Растворы
1)
a) 5 сигма и 2 пи
b) An sp 3 гибридная орбиталь из углерода и a s-орбиталь из водорода.
c) An sp 3 Гибридная орбиталь из одного углерода и a sp 3 орбиталь от другого углерода.
d) Гибридная sp-орбиталь из углерода и a-орбиталь из азота.
e) Орбитали An p y и p z из углерода и орбитали p y и p z из азота.
f) Гибридная sp-орбиталь.
Вопросы
Q1.9.1
1-Циклогексин представляет собой очень напряженную молекулу. Глядя на молекулу, объясните, почему существует такое межмолекулярное напряжение, используя знания о гибридизации и валентных углах.
Растворы
S1.9.1
Алкин представляет собой sp-гибридную орбиталь. Глядя на sp-орбиталь, мы видим, что валентный угол равен 180°, но в циклогексане правильные углы составляют 109,5°. Следовательно, молекула будет напряжена, чтобы превратить 180° в 109°.
1.9: sp Hybrid Orbitals and the Structure of Acetylene распространяется по лицензии CC BY-SA 4. 0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем, Тим Содерберг, Уильям Рейш и Уильям. Реуш.
0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем, Тим Содерберг, Уильям Рейш и Уильям. Реуш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- автор@Дитмар Кеннеполь
- автор@Криста Каннингем
- автор@Стивен Фармер
- автор @ Тим Содерберг
- автор@William Reusch
- sp гибридный орбитальный
Связывание в этине (ацетилене) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3638
- Джим Кларк
- Школа Труро в Корнуолле
Этин, C 2 H 2 , имеет тройную связь между двумя атомами углерода. На диаграмме каждая линия представляет одну пару общих электронов.
На диаграмме каждая линия представляет одну пару общих электронов.
Если вы читали страницу об этене, вы ожидаете, что этин будет более сложным, чем предполагает эта простая структура.
Орбитальный вид связи в этине
Этин построен из атомов водорода (1s 1 ) и атомы углерода (1s 2 2s 2 2p x 1 2p y 1 ). У атома углерода недостаточно неспаренных электронов для образования четырех связей (1 с водородом и три с другим углеродом), поэтому ему необходимо продвинуть одну из пар 2s 2 на пустую орбиталь 2p z . Это в точности то же самое, что происходит всякий раз, когда углерод образует связи — с чем бы он ни соединился.
Каждый углерод соединяется только с двумя другими атомами, а не с четырьмя (как в метане или этане) или тремя (как в этене), поэтому, когда атомы углерода гибридизуют свои внешние орбитали перед образованием связей, на этот раз они гибридизируют только два орбиталей.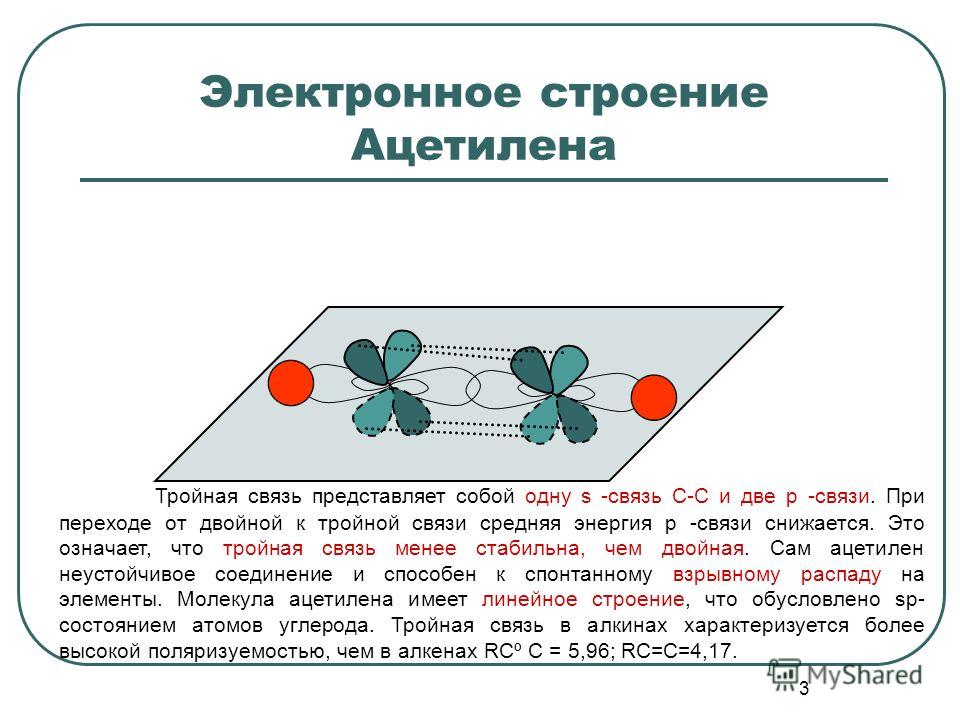 Они используют 2s-электрон и один из 2p-электронов, но оставляют остальные 2p-электроны без изменений. Образующиеся новые гибридные орбитали называются sp 1 гибридов (иногда просто sp-гибридов), потому что они образуются путем самоорганизации s-орбитали и одной p-орбитали.
Они используют 2s-электрон и один из 2p-электронов, но оставляют остальные 2p-электроны без изменений. Образующиеся новые гибридные орбитали называются sp 1 гибридов (иногда просто sp-гибридов), потому что они образуются путем самоорганизации s-орбитали и одной p-орбитали.
Вот как они выглядят в атоме (используя ту же цветовую кодировку):
Обратите внимание, что две зеленые доли представляют собой две разные гибридные орбитали, расположенные как можно дальше друг от друга. Не путайте их с формой р-орбитали. Два атома углерода и два атома водорода выглядели бы так до того, как соединились вместе:
Различные атомные орбитали, направленные друг к другу, теперь сливаются, образуя молекулярные орбитали, каждая из которых содержит связывающую пару электронов. Это сигма-связи — такие же, как те, которые образуются при сквозном перекрытии атомных орбиталей, скажем, в этане.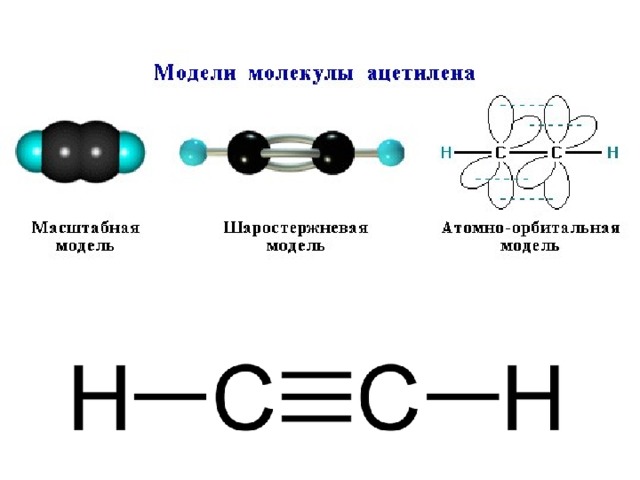 Сигма-связи показаны оранжевым цветом на следующей диаграмме. Различные p-орбитали (теперь показанные немного другим красным цветом, чтобы избежать путаницы) теперь расположены достаточно близко друг к другу, чтобы перекрываться по бокам.
Сигма-связи показаны оранжевым цветом на следующей диаграмме. Различные p-орбитали (теперь показанные немного другим красным цветом, чтобы избежать путаницы) теперь расположены достаточно близко друг к другу, чтобы перекрываться по бокам.
Боковое перекрытие между двумя наборами р-орбиталей приводит к образованию двух пи-связей, каждая из которых похожа на пи-связь, обнаруженную, скажем, в этилене. Эти пи-связи расположены под углом 90° друг к другу — одна выше и ниже молекулы, а другая впереди и позади молекулы. Обратите внимание на разные оттенки красного для двух разных пи-связей.
Авторы
Джим Кларк (Chemguide.co.uk)
Эта страница под названием Bonding in Ethyne (Acetylene) распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.



 7 и 1.8.]
7 и 1.8.]