Алюминий физ свойства: Горная энциклопедия онлайн
alexxlab | 22.03.1985 | 0 | Разное
Алюминий, его физические и химические свойства. Применение алюминия
Цели урока: продолжить формирование ключевых компетенций: учебно-познавательных, информационных, ценностно-смысловых, общекультурных, коммуникативных и личностного самосовершенствования учащихся.
Основные задачи урока:
- создать условия для исследования учащимися физических и химических свойств алюминия на основе его положения в ПСХЭ, строения атома;
- совершенствовать логические умения устанавливать причинно-следственную связь между строением и свойствами;
- продолжить развитие умений наблюдать, анализировать, сравнивать, выделять главное, выполнять химический эксперимент, делать аргументированные умозаключения, формулировать выводы;
- продолжить формирование навыков составления молекулярных и ионных уравнений химических реакций; электронного баланса, развитие химического языка;
- показать практическое значение химических знаний, в т.
 ч. раскрыть военно-прикладное значение изучаемых соединений;
ч. раскрыть военно-прикладное значение изучаемых соединений; - развивать коммуникативные качества личности;
- в целях развития творчества, интеллектуальных способностей и мыслительных умений использовать выполнение и представление индивидуальных творческих заданий (презентации, синквейны).
Оборудование и реактивы:
- интерактивная доска, компьютер, презентация к уроку,
- видеоматериал (электронное пособие к учебнику О.С.Габриеляна, 9 класс, видеоопыты), маршрутная карта;
- наборы реактивов и оборудование на столах учащихся: алюминиевая проволока, фольга, гранулы алюминия, пробирки с водой, в которые помещены железный гвоздь и алюминиевая проволока, растворы соляной и серной кислот, раствор хлорида меди (II), раствор гидроксида натрия, вода, пробирки, держатели для пробирок, спиртовки.
Этапы урока
I. Мотивация. Актуализаций знаний.Учитель: Мы продолжаем изучать металлы, а какой металл мы будем изучать сегодня,
предстоит определить вам.
В самолетах – это Я.
На Свердловской ТЭЦ, друзья,
Самый важный тоже Я.
Кто здесь лампочки зажег?
Я несу в проводке ток.
Я с коррозией на «ты».
Я добрался до звезды.
В космос я людей унес…
Учащиеся: Алюминий.
Учитель: Совершенно верно, алюминий. И тема нашего урока «Алюминий, его физические и химические свойства. Применение алюминия». Запишите название темы урока в тетради. Давайте вместе с вами определим задачи урока.
Учащиеся: Предлагают свои варианты.
Учитель: Комментирует, дополняет, обобщает.
II. Изучение нового материала.Учитель: Сейчас вы отправитесь в путешествие, чтобы познакомиться с удивительным химическим элементом и образованном им простом веществе – алюминии. Ознакомьтесь с маршрутной картой.
Учащиеся: Знакомятся с маршрутной картой.
Станция 1. Визитная карточка химического элемента
Учитель: Работая в паре, определите местонахождение элемента в Периодической системе, составьте электронную формулу. В тетради отметьте: порядковый номер, период, группу, подгруппу, электронную формулу элемента, его валентность и возможные степени окисления.
Учащиеся: выполняют задание, затем один ученик выполняет задание у доски, остальные проверяют, при необходимости вносят коррективы, оценивают ответ.
Станция 2. Физические свойства простого вещества
Учитель: Ознакомьтесь с образцами алюминия (гранула, проволока, фольга). Запишите в тетради физические свойства: цвет, запах, металлический блеск, твердость, пластичность, тепло- и электропроводность, плотность, температура плавления. За необходимой информацией обратитесь к материалу учебника.
Учащиеся: Знакомятся с образцами, изучают материал учебника, делают записи.
Учитель: Легким или тяжелым металлом является алюминий, легкоплавким или тугоплавким; мягким или твердым, что можно сказать о его тепло- и электропроводности?
Учащиеся: Используя знания об общих свойствах металлов, отвечают на вопрос.
Станция 3. Химические свойства простого вещества
Учитель: Зная электронное строение атома алюминия, его положение в электрохимическом ряду напряжений металлов, как вы можете характеризовать химическую активность алюминия, предсказать возможность его взаимодействия с простыми и сложными веществами?
Учащиеся: Опираясь на знание общих химических свойств металлов, предсказывают возможность его взаимодействия с простыми веществами, сложными (водой, кислотами, солями).
Учитель: Сделайте подзаголовок «Химические свойства алюминия».
1. Взаимодействие с простыми веществами.
В соответствии с маршрутной картой напишите уравнения химических реакций, характеризующих взаимодействие алюминия с простыми веществами (1 вариант – с серой, кислородом; 2 вариант – с хлором, углеродом), назовите продукты реакции, составьте сокращенный электронный баланс). Обменяйтесь тетрадями с соседом, проверьте правильность выполнения, при необходимости внесите коррективы, объясните допущенные ошибки.
Обменяйтесь тетрадями с соседом, проверьте правильность выполнения, при необходимости внесите коррективы, объясните допущенные ошибки.
Учащиеся: Выполняют задание с последующей проверкой у доски (оба варианта).
Учитель: Запишите:
2. Взаимодействие со сложными веществами.
Как вы правильно определили, алюминий – активный металл, в электрохимическом ряду напряжений находится сразу после активных металлов, а за ним стоят также достаточно активные металлы, следовательно, алюминий должен взаимодействовать с водой, но в реальной жизни мы в алюминиевой посуде кипятим воду, готовим пищу, и никаких видимых изменение не наблюдаем. Как вы можете объяснит это противоречие? У вас на столах находятся две пробирки с водой, в которые несколько дней назад поместили алюминиевую проволоку и железный гвоздь. Какой металл активнее? Что вы наблюдаете?
Учащиеся: Отвечают, что железный гвоздь вступил во взаимодействие с водой, а алюминиевая проволока не изменилась, хотя более активным металлом является алюминий. Высказывают различные предположения.
Высказывают различные предположения.
Учитель: В учебнике говорится о характерном серебристо-белом цвете алюминия. Еще раз внимательно ознакомьтесь с представленными образцами. Что вы видите?
Учащиеся: Тусклый матовый цвет.
Учитель: Как вы можете объяснить этот факт?
Учащиеся: Высказывают свои предположения.
Учитель: Такой цвет и малая активность алюминия при комнатной температуре объясняется образованием на его поверхности тонкой оксидной пленки, которая и защищает металл от химического воздействия. Как можно разрушить эту пленку?
Учащиеся: Высказывают свои предположения о физическом или химическом удалении пленки.
Учитель: Познакомиться с химическими свойствами алюминия нам поможет эксперимент. Сейчас вам предстоит работа в парах. Напоминаю о необходимости соблюдения правил техники безопасности (напоминает о правилах ТБ).
Ознакомьтесь с заданиями маршрутной карты и выполните опыты, характеризующие взаимодействие алюминия с растворами соляной и серной кислот, раствором хлорида меди (II). Запишите в тетради название свойства, составьте молекулярное и ионное уравнения взаимодействия алюминия с соляной кислотой, сокращенный электронный баланс для уравнений реакций взаимодействия алюминия с серной кислотой, раствором соли и водой (при удалении оксидной пленки).
При необходимости пробирки слегка нагрейте, соблюдая правила ТБ.
Учащиеся: Выполняют химический эксперимент, составляют уравнения реакций, делают вывод о химической активности алюминия, осуществляют взаимопроверку. Два ученика составляют уравнения у доски.
Учитель: Следит за выполнением опытов, соблюдением правил ТБ, проверяет правильность составления уравнений химических реакций, при необходимости оказывая помощь.
Как мы убедились, для алюминия характерны общие химические свойства металлов. Отметьте, концентрированные серная и азотная кислоты пассивируют алюминий.
Отметьте, концентрированные серная и азотная кислоты пассивируют алюминий.
Но алюминий, как и его оксид и гидроксид, взаимодействует не только с кислотами, но и со щелочами. О проявлении каких свойств это говорит?
Учащиеся: Амфотерных свойств.
Учитель: В соответствии с заданием маршрутной карты выполните опыт, характеризующий взаимодействие алюминия с раствором щелочи. При необходимости пробирку слегка нагрейте, соблюдая правила ТБ. Напишите название свойства, составьте соответствующее уравнение реакции, отметьте признак реакции.
Учащиеся: осуществляют взаимопроверку, затем сверяются с доской.
Ознакомьтесь с видеоопытом (взаимодействие алюминия с оксидом железа (III) – электронное пособие). Напишите названия свойства, составьте уравнение реакции, приведите электронный баланс. Где используется это свойство?
Учащиеся: Знакомятся с видеоопытом, составляют уравнение, отвечают на вопрос, что это свойство лежит в основе получения металлов из их оксидов – способ алюминотермии.
Учитель: Сформулируйте и запишите вывод о химических свойствах алюминия.
Учащиеся: Формулируют и записывают вывод.
Станция 4. Получение алюминия
Учитель: Алюминий – самый распространенный из металлов в земной коре. Встречается ли алюминий в свободном виде в природе? Дайте обоснованный ответ.
Учащиеся: Дают аргументированный ответ о невозможности существования алюминия в свободном виде.
Учитель: Основные месторождения алюминиевого сырья: Урал, Казахстан, Сибирь, Башкирия. Ознакомьтесь с природными соединениями алюминия (демонстрация видеофрагмента – электронного пособия, коллекции минералов). Запишите названия важнейших природных соединений, при необходимости обратитесь к материалу учебника.
Учащиеся: Знакомятся с природными соединениями, делают записи.
Учитель: Как вы считаете, почему в конце 19 века резко снизилась стоимость алюминия (в несколько десятков раз)?
Учащиеся: Высказывают различные предположения.
Учитель: Выбирает верное – открыт способ получения алюминия электролизом расплава оксида алюминия. Составьте уравнение реакции, укажите условия протекания, ознакомьтесь с электролизной установкой (электронное пособие).
Учащиеся: Знакомятся с электролизной установкой, составляют уравнение реакции.
Учитель: Какие предприятия, связанные с производством алюминия, имеются в нашем регионе?
Учащиеся: Отвечают (Полевской криолитовый завод, Уральский алюминиевый завод, Богословский алюминиевый завод и т.д.).
Учитель: Какие еще алюминиевые предприятия вы знаете?
Учащиеся: Волховский, Красноярский, Братский, Саяногорский алюминиевые заводы и т.д.
Учитель: А почему именно там расположены эти предприятия?
Учащиеся: Предприятия расположены рядом с ГЭС (энергозатратное производство).
Станция 5. Применение алюминия
Учитель: Какие области применения, исходя из знания свойств алюминия, можно назвать?
Учащиеся: Называют конкретное свойство и возможную область применения.
Учитель: А сейчас мы более подробно познакомимся с важнейшими областями применения алюминия и его соединений, сделав акцент на использование в военных целях. Вам необходимо, знакомясь с презентацией, сделать краткие записи, дать оценку работе своих одноклассников.
Учащиеся: Двое учащихся представляют презентацию, отвечая на заданные вопросы. Остальные ученики делают краткие записи, при желании задают вопросы, оценивают представленную работу (содержание, требования к оформлению, представление и т. д.).
III. Первичная проверка усвоения знанийУчитель: Сегодня на уроке мы расширили представления о металлах. Какие вопросы (при наличии отвечает на вопросы учащихся)?
Ответьте на предложенные вопросы:
- Почему в алюминиевой посуде нельзя хранить кислые и щелочные растворы?
- Какие свойства алюминия позволяют широко применять его в качестве упаковочного материала (фольги)?
- Какая реакция алюминия является основой бенгальских огней и фейерверков?
- Какие реакции подтверждают амфотерность алюминия и его соединений?
- Подвергается ли алюминий коррозии? Аргументируйте.

Учащиеся: Отвечают на вопросы.
IV. Подведение итогов. РефлексияУчитель: Подведем итоги сегодняшнего урока. Какие задачи мы поставили в начале урока? Удалось ли нам их решить? Я прошу вас выбрать из предложенного перечня свой вариант и ответить:
Учащиеся: Выбирают вариант, отвечают.
V. Домашнее задание Учитель: Дает инструктаж по домашнему заданию, включая творческое задание (синквейн на слово «алюминий»). Благодарит учащихся за работу, выставляет оценки (за презентацию, работу у доски, устные ответы и т.д.) с комментариями.
Благодарит учащихся за работу, выставляет оценки (за презентацию, работу у доски, устные ответы и т.д.) с комментариями.
* * *
Приложение к домашнему заданию
Слово «синквейн» – французское, обозначающее «пять строк». При его написании существуют определенные правила, которые в незначительной мере варьируют от автора к автору.
Правила написания синквейна:
- 1 строка заключает в себе одно слово, обычно существительное или местоимение, которое обозначает объект или предмет, о котором пойдет речь.
- 2 строка – два слова, чаще всего прилагательные или причастия. Они дают описание признаков и свойств выбранного в синквейне предмета или объекта
- 3 строка – образована тремя глаголами или деепричастиями, описывающими характерные действия объекта.
- 4 строка – фраза из четырех слов, выражает личное отношение автора синквейна к описываемому предмету или объекту.

- 5 строка – одно слово, характеризующее суть предмета или объекта.
Основные физические и химические свойства алюминия
Физические и химические свойства
Серебристый металл быстро окисляется на воздухе, поэтому покрывается оксидной пленкой через некоторое время. От длительного воздействия концентрированной кислотой происходит то же самое. Уникальность алюминия — прочность, мягкость и легкость, эти качества редко встречаются вместе. Пластичность, высокая температура плавления позволяют делать из него тонкую фольгу или добавлять для создания проволоки.
Активный амфотерный металл обладает оксидной пленкой, от которой и зависит прочность. При ее разрушении алюминий выполнит функции восстановителя. В раздробленном виде начнется взаимодействие с кислородом.
В раздробленном виде начнется взаимодействие с кислородом.
Гидроксид алюминия Al (ОН)3
Представляет собой белое вещество, которое при нагревании теряет воду, превращаясь оксид алюминия. Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.
Высушенный гидроксид алюминия теряет часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.
Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
Химические свойства
Являясь довольно химически активным металлом, алюминий активно сопротивляется коррозии. Это происходит благодаря образованию на его внешней поверхности очень прочной оксидной пленки под действием кислорода.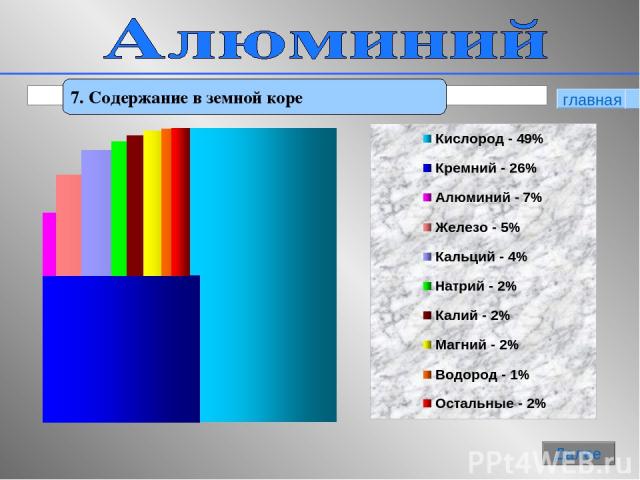
Прочная пленка оксида хорошо защищает поверхность даже от таких сильных кислот, как азотная и серная. Это качество нашло распространение в химии и промышленности для транспортировки концентрированной азотной кислоты.
Химические свойства алюминия
Разрушить пленку можно сильно разбавленной азотной кислотой, щелочами при нагреве или при контакте с ртутью, когда на поверхности образуется амальгама. В перечисленных случаях оксидная пленка не является защитным фактором и алюминий активно взаимодействует с кислотами, щелочами и окислителями. Оксидная пленка также легко разрушается в присутствии галогенов (хлор, бром). Таким образом, соляная кислота HCl, хорошо взаимодействует с алюминием при любых условиях.
Химические свойства алюминия зависят от чистоты металла. Использование состава легирующих присадок некоторых металлов, в частности марганца, позволяет увеличить прочность защитной пленки, повысив, таким образом, коррозионную устойчивость алюминия. Некоторые металлы, к примеру, никель и железо, способствуют снижению коррозионную стойкость, но повышают жароустойчивость сплавов.
Оксидная пленка на поверхности алюминиевых изделий играет отрицательную роль при проведении сварочных работ. Мгновенное окисление ванны расплавленного металла при сварке не позволяет сформировать сварочный шов, поскольку окись алюминия имеет очень высокую температуру плавления. Для сварки алюминия используют специальные сварочные аппараты с неплавящимся электродом (вольфрам). Сам процесс ведется в среде инертного газа – аргона. При отсутствии процесса окисления сварочный шов получается прочным, монолитным. Некоторые легирующие добавки в сплавы дополнительно улучшают сварочные свойства алюминия.
Чистый алюминий практически не образует ядовитых соединений, поэтому активно используется в пищевой промышленности при производстве кухонной посуды, упаковки пищевых продуктов, тары для напитков. Оказывать негативное действие могут лишь некоторые неорганические соединения. Исследованиями также установлено, что алюминий не используется в метаболизме живых существ, его роль в жизнедеятельности ничтожна.
Оказывать негативное действие могут лишь некоторые неорганические соединения. Исследованиями также установлено, что алюминий не используется в метаболизме живых существ, его роль в жизнедеятельности ничтожна.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
История открытия
Свое название серебристо-белый металл получил от латинского языка, в переводе оно означает квасцы. В 1825 году датский физик Ганс Эрстед нагрел амальгаму калия, восстановил хлорид вещества и выделил новый металл. Затем этот эксперимент повторил и улучшил Фридрих Велер. Он применил чистый металлический калий и первый описал химические особенности алюминия.
Затем этот эксперимент повторил и улучшил Фридрих Велер. Он применил чистый металлический калий и первый описал химические особенности алюминия.
Полупромышленный способ выделения открыл Сент-Клер Девиль в 1854 году, но он использовал безопасный натрий. Полученный алюминиевый слиток ученый представил на Парижской выставке. А затем он провел еще один эксперимент — электролиз расплава двойной соли хлорида вещества.
До развития технологий алюминий, созданный электролитическим способом из глинозема, был слишком дорогим. Его слиток стоил больше, чем аналогичный кусок золота. Именно поэтому в 1889 году британские ученые подарили Менделееву аналитические весы. Чаши в них были изготовлены из разных металлов — золота и алюминия. В то время в России последнее вещество называли серебром из глины.
Физические свойства алюминия зависят от его чистоты
Таблица физических свойств алюминия | |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99. 97 97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl + 6Н+ = 2Аl3+ + 3H2;
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде – кислород:
В результате процесса алюминий выделяется на катоде, на аноде – кислород:
2Al2O3 → 4Al + 3O2
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C – проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Свойства алюминия
В алюминии заложено редкое сочетание таких свойств, как:
- небольшой вес;
- пластика, электропроводность;
- возможность образовывать сплавы с другими металлами.

Поверхность алюминия всегда покрыта тончайшей оксидной плёнкой, которая является очень прочной и не позволяет алюминию подвергаться коррозии. Этот материал и в горячем, и в холодном состоянии легко поддаётся обработке давлением. Такие методы обработки, как прокатка, штамповка, волочение часто производятся на предприятии при производстве тех или иных деталей.
Ещё одна ценность алюминия заключается в том, что он не токсичен, не подвержен горению и не нуждается в дополнительной окраске: это делает его применение в авто- и авиастроении незаменимым элементом. Ковкость алюминия удивляет: из него удалось изготовить лист и очень тонкую проволоку толщиной всего в 4 микрона, а толщины фольги — добиться в три раза тоньше волоса человека.
Благодаря возможности алюминия образовывать соединения с большой группой химических элементов появилась большая группа сплавов. Например, сочетание алюминия и цинка используется в создании корпусов различных видов планшетов и телефонов, алюминий в сочетании магния и кремния используется при производстве различных типов двигателей, в составе элементов шасси и всевозможных двигателей. Различные сплавы применяются и в электроэнергетике.
Различные сплавы применяются и в электроэнергетике.
Современная наука продолжает изучать и изобретать новейшие типы алюминиевых сплавов. Сегодня не существует ни одной отрасли промышленности, где бы не использовался алюминий. Можно с уверенностью сказать, что такие виды промышленности, как авиационная, космическая, энергетическая, автомобильная, пищевая, электронная получили своё современное развитие благодаря алюминию и его сплавам.
Нельзя не упомянуть о таком важном свойстве, как теплопроводность. Ведь именно это свойство металла требуется при производстве систем отопления, электропродукции, в авто- и авиастроении, при изготовлении тормозных систем и тому подобных
Теплоёмкость — это процесс переноса тепловой энергии в физических телах или их частицах от горячих объектов к холодным на основе закона Фурье. Конкурентом алюминия в данной области является медь.
Так какой же металл имеет большую теплопроводность? Это не совсем однозначный вопрос. Известно, что алюминий по теплопроводности уступает меди при средних температурах, но когда заходит речь о низких температурах, а именно при 50 К, тогда теплопроводность алюминия значительно возрастает, в то время как у меди теплопроводность становится ниже. Температура плавления алюминия составляет 933,61 К, это примерно 660 °C, в этот момент свойства Al, такие как теплопроводность и плотность, уменьшаются.
Температура плавления алюминия составляет 933,61 К, это примерно 660 °C, в этот момент свойства Al, такие как теплопроводность и плотность, уменьшаются.
Плотность серебристого металла определяется его температурой и зависит от его состояния. Так, при температуре в 27 °C, плотность алюминия соответственно равна 2697 кг/м3, а при температуре плавления, равной 660 °C, его плотность равняется 2368 кг/м3. Снижение плотности метала в зависимости от температуры обуславливается его расширением при непосредственном нагревании.
Нахождение в природе
Распространённость
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %.
Природные соединения алюминия
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
- Каолинит — Al2O3·2SiO2 · 2H2O
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.

Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия.
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л.
Изотопы алюминия
Основная статья: Изотопы алюминия
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Arпротонами космических лучей с высокими энергиями.
Циклическая прочность
Циклическая прочность деформируемых сплавов при симметричном изгибе на базе 5*108циклов составляет 3,5 кГ/мм2 для сплава А ДМ, 4,2—6,3 кГ/мм2 для сплава АДН, 5—6,5 кГ/мм2 для сплава АМцАМ, 15 кГ/мм2 для сплава В95.
Области применения литейных сплавов различны. Сплавы группы I рекомендуют для литья в песчаные формы, кокиль и для литья под давлением. Сплав АЛ22 обычно применяют в закаленном состоянии, а сплав АЛ23 и АЛ29 — в литом. Сплавы группы II имеют высокие литейные свойства благодаря наличию в сплавах двойной эвтектики, которая уменьшает также литейную усадку и склонность к образованию горячих трещин. Сплавы AЛ2, АЛ4 и АЛ9 обладают повышенной коррозионной стойкостью, поэтому их применяют для изделий, работающих во влажной и морской средах. С целью получения заданных механических свойств отливки подвергают термической обработке по различным режимам.
Сплавы группы III обладают высокими механическими свойствами, особенно пределом текучести и повышенной жаропрочностью. У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплавы группы IV применяют для всех способов литья. По литейным свойствам они менее технологичны, чем сплавы II.
Сплавы группы V применяют для самых разнообразных деталей, работающих при высоких температурах. К этой группе относятся также самозакаливающиеся сплавы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.
Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления – 660 0 С.
- Температура кипения – 2450 0 С.
- Плотность – 2,7 г/см 3 .
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи – металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении
Поэтому эти свойства очень важно знать
[править] Источники
- Bassam Z. Shakhashiri. Chemical of the Week: Aluminum. Science is Fun
- Ludwig Darmstaedter; René Du Bois-Reymond, D.
 Carl Schaefer (1908). Handbuch zur geschichte der naturwissenschaften und der technik: In chronologischer darstellung. J. Springer. с. 43.
Carl Schaefer (1908). Handbuch zur geschichte der naturwissenschaften und der technik: In chronologischer darstellung. J. Springer. с. 43. - Сент-Клер Девиль
- Колодин Э. А.; Свердлин В. А., Свобода Р. В. (1980). Производство обожженных анодов алюминиевых электролизеров. М.: Металлургия. с. 84.
- Кравчук П. А. Рекорды природы. — Любешов: Эрудит, 1993, 216 с.
- https://www.cmmarket.ru/markets/alworld.htm
- George E. Totten, D. Scott Mackenzie (2003). Handbook of Aluminum: Physical metallurgy and processes (англ.). CRC Press. с. 38.
- Клубович, Владимир Владимирович; Тявловский, Михаил Доминикович; Ланин, Владимир Леонидович (1985). Ультразвуковая пайка в радио- и приборостроении. Минск: Наука и техника.
- Виноградов Н. В. (1970). Производство электрических машин. Москва: Энергия. с. 244—246.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т. е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl + 6Н+ = 2Аl3+ + 3H2;
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
Оксид алюминия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Металлические нанопорошки
19 Мая 2020 КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМ
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМПандемия коронавируса COVID-19 показала, что существует неотложная потребность в эффективных мерах по предотвращению распространения вирусных инфекций различных нозологий. Последние случаи вспышек вируса атипичной пневмонии, птичьего гриппа, гриппа h2N1, и наконец, коронавируса COVID-19 показали, что высокоэффективные бытовые технические средства, позволяющие прервать пути распространения инфекций, отсутствуют. На данный момент известно, что есть два главных пути передачи вирусов. Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.
В настоящее время для прерывания путей передачи вирусов в быту в качестве индивидуальных защитных средств используются маски, защищающие органы дыхания, перчатки и различные антисептики, которыми обрабатываются руки и окружающие предметы и поверхности.
Защитные маски позволяют уменьшить распространение респираторных вирусов, особенно при использовании в замкнутом пространстве или при тесном контакте с человеком с симптомами заражения [1, 2]. Однако сами маски также могут быть источником инфекции [3]. Маска примерно через два часа становится влажной и уже в ней начинают размножаться микроорганизмы. По мнению ВОЗ, маски не гарантируют защиты от COVID-19. Установлено, что эффективность хирургических масок даже самого высокого класса защиты FFP3 недостаточна (гриппом заражается не менее 23 % медицинских сестер, носивших хирургические маски класса FFP3).
Вирус COVID-19 передается не только воздушно-капельным, но и контактным путем, и может сохраняться на поверхностях до 72 часов. Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Одним из путей решений вышеуказанных проблем является придание натуральным и искусственным, в т.ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5]. Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Например, импрегнация биоактивных наночастиц оксида меди в фильтрующий материал позволяет придать одноразовым респираторным маскам мощные биоцидные свойства без изменения их барьерных свойств [6]. При контакте с вирусом ионы меди вызывают массовое повреждение компонентов клеточной стенки, вирусных генов и ключевых белков [7].
Таким образом, с использованием нанопорошков оксидов меди и цинка, возможно разработать ряд продуктов, позволяющих прервать пути передачи вирусов в быту и в медицинских учреждениях – лицевых масок, одежды медицинского персонала, перчаток, больничных простыней, корпусов медицинского оборудования, контейнеры для хранения продуктов, клавиатуру компьютеров, корпуса мобильных телефонов и др.
Компания «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» может изготовить нанопорошки оксидов меди и цинка для разработки новых антимикробных материалов.
1. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2008) Physicalinterventions to interrupt or reduce the spread of respiratory viruses: systematicreview. BMJ 336: 77–80.
2. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2007) Interventions for the interruption or reduction of the spread of respiratoryviruses. Cochrane Database Syst Rev 6207.
3. Zhiqing L. et al. Surgical masks as source of bacterial contamination during operative procedures //Journal of orthopaedic translation.2018; 14: 57-62.
4. Borkow, G. and Gabbay, J. (2004). Putting Copper into Action:Copper-impregnated Products with Potent Biocidal Activities, FASEB Jounal,18(14): 1728–1730.
5. Akter M. et al. A systematic review on silver nanoparticles-induced cytotoxicity: Physicochemical properties and perspectives //Journal of advanced research. – 2018. – Т. 9. – С. 1-16.
– 2018. – Т. 9. – С. 1-16.
6. Gadi Borkow et al. A Novel Anti-Influenza Copper Oxide Containing Respiratory Face Mask // PLoS ONE, June 2010, Volume 5, Issue 6.
7. Borkow & Gabbay (2005) Copper as a biocidal tool. Current Medicinal Chemistry12:2163-75
ООО “ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ”
Адрес: 634055, Российская Федерация, Томск, проспект Академический, 8/8
Телефон/Факс: +7 (3822) 28-68-72 , 8-961-888-16-24
http://www.nanosized-powders.com
Свойства металлов и сплавов: химические, физические, механические, технологические
Главная » Сплавы » Какими свойствами обладают металлы и сплавы
На чтение 5 мин
Содержание
- Признаки металлов
- Классификация металлов
- Черные
- Цветные
- Основные виды сплавов
- Цинковые сплавы
- Алюминиевые сплавы
- Медные сплавы
- Свойства сплавов
- Физические свойства
- Химические свойства
- Механические свойства
- Технологические свойства
Металлические изделия и детали используются в разных сферах промышленности. Существует множество видов металлов и каждый из них обладает сильными и слабыми сторонами. При изготовлении деталей для машин, самолётов или промышленного оборудования мастера обращают внимание на характеристики материала. Поэтому требуется знать свойства металлов и сплавов.
Существует множество видов металлов и каждый из них обладает сильными и слабыми сторонами. При изготовлении деталей для машин, самолётов или промышленного оборудования мастера обращают внимание на характеристики материала. Поэтому требуется знать свойства металлов и сплавов.
Признаки металлов
У металлов есть признаки, которые их характеризуют:
- Высокие показатели теплопроводности. Металлические материалы хорошо проводят электричество.
- Блеск на изломе.
- Ковкость.
- Кристаллическая структура.
Не все материалы прочные и обладают высокими показателя износоустойчивости. Это же касается плавления при высоких температурах.
Классификация металлов
Металлы разделяются на две большие группы — черные и цветные. Представители обоих видов различаются не только характеристиками, но и внешним видом.
Черные
Представители этой группы считаются самыми распространёнными и недорогими. В большинстве своем имеют серый или тёмный цвет. Плавятся при высокой температуре, обладают высокой твердостью и большой плотностью. Главный представитель этой группы — железо. Эта группа разделяется на подгруппы:
Плавятся при высокой температуре, обладают высокой твердостью и большой плотностью. Главный представитель этой группы — железо. Эта группа разделяется на подгруппы:
- Железные — к представителям этой подгруппы относится железо, никель и кобальт.
- Тугоплавкие — сюда входят металлы температура плавления которых начинается с 1600 градусов. Их применяют при создании основ для сплавов.
- Редкоземельные — к ним относятся церий, празеодим и неодим. Обладают низкой прочностью.
Существуют урановые и щелочноземельные металлы, однако они менее популярны.
Цветные
Представители этой группы отличаются яркой окраской, меньшей прочностью, твердостью и температурой плавления (не для всех). Разделяется эта группа на следующие подгруппы:
- Лёгкие — подгруппа, включающая в себя металлы с плотностью до 5000 кг/м3. Это такие материалы, как литий, натрий, калий, магний и другие.
- Тяжёлые — сюда относится серебро, медь, свинец и другие. Плотность превышает 5000 кг/м3.

- Благородные — представили этой подгруппы имеют высокую стоимость и устойчивость к коррозийным процессам. К ним относятся золото, палладий, иридий, платина, серебро и другие.
Основные виды сплавов
Человечество знакомо с различными металлическими сплавами. Самыми многочисленными из них являются соединения на основе железа. К ним относятся ферриты, стали и чугун. Ферриты имеют магнитные свойства, в чугуне содержится более 2,4% углерода, а сталь — это материал с высокой прочность и твердостью.
Отдельное внимания требуют металлические сплавы из цветных металлов.
Производство сталиЦинковые сплавы
Соединения металлов, которые плавятся при низких температурах. Смеси на основе цинка устойчивы к воздействию коррозийных процессов. Легко обрабатываются.
Алюминиевые сплавы
Популярность алюминий и сплавы на его основе получили во второй половине 20 века. Этот материал обладает такими преимуществами:
Этот материал обладает такими преимуществами:
- Устойчивость к низким температурам.
- Электропроводность.
- Малый вес заготовок в сравнении с другими металлами.
- Износоустойчивость.
Однако нельзя забывать про то, что алюминий плавится при низких температурах. При температуре около 200 градусов характеристики ухудшаются.
Алюминий применяется при изготовлении комплектующих к машинам, производстве деталей для самолётов, составляющих промышленного оборудования, посуды, инструментов. Не многие знают, что алюминий популярен в сфере производства оружия. Связано это с тем, что детали из алюминия не искрят при сильном трении.
Медные сплавы
Сплавы на основе меди — марки латуни. Из этого материала изготавливаются детали высокой точности, так как латунь легко обрабатывать. В составе сплава может содержаться до 45% цинка.
Свойства сплавов
Чтобы изготавливать детали и конструкции, нужно знать основные свойства металлов и сплавов. При неправильной обработке готовая деталь может быстро выйти из строя и разрушить оборудование.
Двигатель внутреннего сгоранияФизические свойства
Сюда относятся визуальные параметры и характеристики материала, изменяющиеся при обработке:
- Теплопроводность. От этого зависит насколько поверхность будет передавать тепло при нагревании.
- Плотность. По этому параметру определяется количество материла, которое содержится в единице объёма.
- Электропроводность. Возможность металла проводить электрический ток. Этот параметр называется электрическое сопротивление.
- Цвет. Этот визуальный показатель меняется под воздействием температур.
- Прочность. Возможность материала сохранять структуру при обработке. Сюда же относится твердость. Эти показатели относятся и к механическим свойствам.
- Восприимчивость к действию магнитов.
 Это возможность материала проводить через себя магнитные лучи.
Это возможность материала проводить через себя магнитные лучи.
Физические основы позволяют определить в какой сфере будет использоваться материал.
Химические свойства
Сюда относятся возможности материала противостоять воздействию химических веществ:
- Устойчивость к коррозийным процессам. Этот показатель определяет на сколько материал защищён от воздействия воды.
- Растворимость. Устойчивость металла к воздействию растворителей — кислотам или щелочным составам.
- Окисляемость. Параметр указывает на выделение оксидов металлом при его взаимодействии с кислородом.
Обуславливаются эти характеристики химическим составом материала.
Механические свойства
Механические свойства металлов и сплавов отвечают за целостность структуры материала:
- прочность;
- твердость;
- пластичность;
- вязкость;
- хрупкость;
- устойчивость к механическим нагрузкам.
Технологические свойства
Технологические свойства определяют способность металла или сплава изменяться при обработке:
- Ковкость.
 Обработка заготовки давлением. Материал не разрушается. Структура изменяется.
Обработка заготовки давлением. Материал не разрушается. Структура изменяется. - Свариваемость. Восприимчивость детали к работе сварочным оборудованием.
- Усадка. Происходит этот процесс при охлаждении заготовки после её разогрева.
- Обработка режущим инструментом.
- Ликвация (затвердевание жидкого металла при понижении температуры).
Основной способ обработки металлических деталей — нагревание.
window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-57’, blockId: ‘R-A-1226522-57’ })})”; cachedBlocksArray[266488] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-52’, blockId: ‘R-A-1226522-52’ })})”; cachedBlocksArray[266497] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-49’, blockId: ‘R-A-1226522-49’ })})”; cachedBlocksArray[266495] = “window. yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-48’, blockId: ‘R-A-1226522-48’ })})”;
cachedBlocksArray[277810] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-43’, blockId: ‘R-A-1226522-43’ })})”;
cachedBlocksArray[266499] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-32’, blockId: ‘R-A-1226522-32’ })})”;
cachedBlocksArray[266496] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-31’, blockId: ‘R-A-1226522-31’ })})”;
cachedBlocksArray[266487] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-29’, blockId: ‘R-A-1226522-29’ })})”;
cachedBlocksArray[266490] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-27’, blockId: ‘R-A-1226522-27’ })})”;
cachedBlocksArray[266489] = “window.
yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-48’, blockId: ‘R-A-1226522-48’ })})”;
cachedBlocksArray[277810] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-43’, blockId: ‘R-A-1226522-43’ })})”;
cachedBlocksArray[266499] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-32’, blockId: ‘R-A-1226522-32’ })})”;
cachedBlocksArray[266496] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-31’, blockId: ‘R-A-1226522-31’ })})”;
cachedBlocksArray[266487] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-29’, blockId: ‘R-A-1226522-29’ })})”;
cachedBlocksArray[266490] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-27’, blockId: ‘R-A-1226522-27’ })})”;
cachedBlocksArray[266489] = “window. yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-26’, blockId: ‘R-A-1226522-26’ })})”;
cachedBlocksArray[266492] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-5’, blockId: ‘R-A-1226522-5’ })})”;
cachedBlocksArray[266491] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-3’, blockId: ‘R-A-1226522-3’ })})”;
cachedBlocksArray[266500] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-11’, blockId: ‘R-A-1226522-11’ })})”;
yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-26’, blockId: ‘R-A-1226522-26’ })})”;
cachedBlocksArray[266492] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-5’, blockId: ‘R-A-1226522-5’ })})”;
cachedBlocksArray[266491] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-3’, blockId: ‘R-A-1226522-3’ })})”;
cachedBlocksArray[266500] = “window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-1226522-11’, blockId: ‘R-A-1226522-11’ })})”;( 3 оценки, среднее 3.67 из 5 )
Поделиться
Каковы физические свойства алюминия?
Что такое алюминий?
Алюминий (или алюминий в американском английском и канадском английском) — это химический элемент с символом Al и атомным номером 13. Алюминий имеет плотность ниже, чем у других распространенных металлов, примерно на одну треть плотности стали.
Имеет большое сродство к кислороду и образует защитный слой оксида на поверхности при контакте с воздухом. Алюминий визуально напоминает серебро как по цвету, так и по способности отражать свет. Он мягкий, немагнитный и пластичный.
Алюминиевый лист 3 мм aa1050 h24
Алюминий — мягкий и легкий металл с умеренными химическими свойствами. Он имеет тусклый серебристый вид, потому что быстро образует тонкий слой оксида при воздействии воздуха. Алюминий не токсичен (как и сталь), не магнитится и не искрит.
История алюминия
Об открытии алюминия было объявлено в 1825 году датским физиком Гансом Христианом Эрстедом.
Первое промышленное производство алюминия было начато французским химиком Анри Этьеном Сент-Клер Девилем в 1856 году.
Алюминий стал гораздо более доступным для общественности благодаря процессу Холла-Эру, независимо разработанному французским инженером Полем Эру и американским инженером Чарльзом Мартином Холлом в 1886 году, а массовое производство алюминия привело к его широкому использованию в промышленности и повседневной жизни.
Во время Первой и Второй мировых войн алюминий был важнейшим стратегическим ресурсом для авиации. В 1954 году алюминий стал самым производимым цветным металлом, обогнав медь. В 21 веке большая часть алюминия потреблялась в транспорте, машиностроении, строительстве и упаковке в США, Западной Европе, Китае и Японии.
Мировое производство алюминия с 1900 г.
На протяжении 20 века производство алюминия быстро росло: в то время как мировое производство алюминия в 1900 г. составляло 6 800 метрических тонн, годовое производство впервые превысило 100 000 метрических тонн в 1916 г.; 1 000 000 тонн в 1941 году; 10 000 000 тонн в 1971 году. В 1970-х годах возросший спрос на алюминий сделал его биржевым товаром; она вышла на Лондонскую биржу металлов, старейшую в мире биржу промышленных металлов, в 1978.[86] Объем производства продолжал расти: в 2013 году годовой объем производства алюминия превысил 50 000 000 метрических тонн.
Чистый алюминий
Алюминий используется во многих отраслях промышленности для производства десятков миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию многочисленных комбинаций его ключевых свойств, включая электрическую мощность, легкий вес, коррозионную стойкость, восстанавливаемость и формуемость, алюминий используется во все большем числе приложений. Этот класс товаров варьируется от структурных материалов до тонкой упаковочной пленки.
Благодаря использованию многочисленных комбинаций его ключевых свойств, включая электрическую мощность, легкий вес, коррозионную стойкость, восстанавливаемость и формуемость, алюминий используется во все большем числе приложений. Этот класс товаров варьируется от структурных материалов до тонкой упаковочной пленки.
Common different alloy aluminum plates:
1050 Aluminum Sheet
1060 Aluminum Sheet
1100 Aluminum Sheet
3003 Aluminum Sheet
3004 Aluminum Sheet
3105 Aluminum Sheet
5005 Aluminum Sheet
5052 Aluminum Sheet Plate
5083 Aluminum Sheet Plate
5754 aluminum листовая пластина
6061 алюминиевый лист
6082 алюминиевый лист
5 бар алюминиевая пластина в шахматном порядке
алюминиевая алмазная пластина
5X10 алюминиевый лист и пластина
4X8 алюминиевый лист
Физические свойства алюминия
Каковы физические свойства алюминия? Физический дом обычно представляет собой характеристику, которую можно определить с помощью наших органов чувств, включая цвет, плотность, твердость, коррозионную стойкость, теплопроводность, электропроводность и т. д. Физические свойства алюминия следующие.
д. Физические свойства алюминия следующие.
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет примерно одну треть плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Чистый алюминий не обладает очень высокой прочностью на растяжение. Однако легирующие элементы, в том числе марганец, кремний, медь и магний, могут повышать прочность алюминия и производить сплавы для конкретных применений. Алюминий хорошо подходит для холодных условий. Он имеет преимущество перед металлами в том, что его прочность на растяжение увеличивается при понижении температуры, сохраняя при этом свою долговечность. Опять же металл хрупкий при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом алюминий с небольшой задержкой образует на своей поверхности оксид алюминия. Это покрытие обладает отличной коррозионной стойкостью. Обладает широкой стойкостью к большинству кислот, но слабо устойчив к щелочам. Это покрытие обладает отличной коррозионной стойкостью. Обладает широкой стойкостью к большинству кислот, но слабо устойчив к щелочам. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий является ключевой тканью для охлаждения и обогрева (наряду с теплообменниками). В сочетании с его нетоксичностью этот выбор привел к тому, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Проводимость | Алюминийобладает достаточно высокой электропроводностью и может использоваться в качестве электрических проводников. |
| Отражающая способность | От ультрафиолетового до инфракрасного, алюминий является исключительным отражателем лучистой энергии. Те же свойства отражательной способности делают алюминий изоляционной тканью, которая блокирует солнечный свет летом и даже останавливает потерю тепла при замерзании. |
Алюминий является превосходным тепловым и электрическим проводником, его проводимость примерно на 60 % меньше, чем у меди, как тепловая, так и электрическая, при этом плотность меди составляет всего 30 %.
Химическое свойство – это реакция вещества с другими веществами, т. е. вещество реагирует с разными веществами или превращается из одного вещества в другое. В стандартных случаях химические вещества легче всего идентифицировать в какой-то момент химической реакции. Реакцией вещества может быть изменение вследствие горения, ржавчины, нагревания, взрыва, изменения цвета и т. д. Ниже приведены химические свойства алюминия.
| Свойства | Описание |
| Окисление | Обычно алюминиевые металлы не реагируют на воздух, потому что их поверхность покрыта тонким слоем оксидов, которые помогают защитить металл от воздушной эрозии. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой она пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция с щелочью | Алюминий вступает в реакцию с основанием, образуя алюминат с выделением водорода. |
| Реакция с водой | Реагирует с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря своим физическим и химическим свойствам алюминий можно смешивать с другими металлами для получения алюминиевых сплавов, которые используются в различных областях.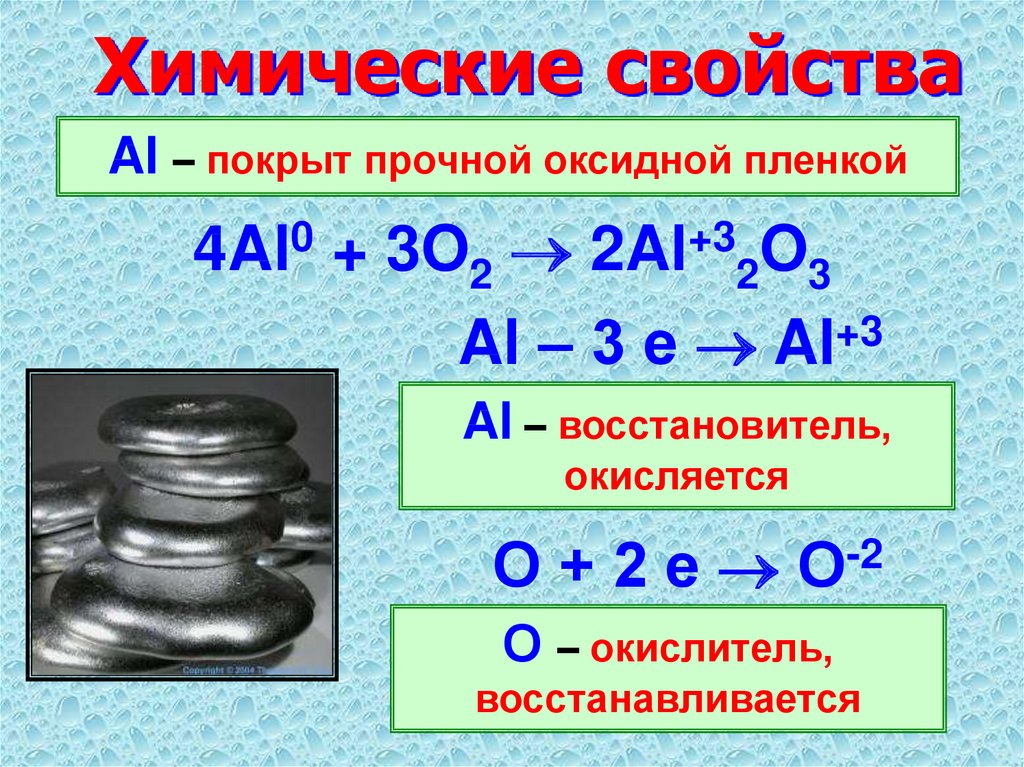 Алюминиевые сплавы имеют свойства, отличные от свойств одного металла, и алюминиевые сплавы классифицируются в соответствии с другими элементами, которые они содержат. Ниже приводится ряд алюминиевых сплавов и их основные области применения:
Алюминиевые сплавы имеют свойства, отличные от свойств одного металла, и алюминиевые сплавы классифицируются в соответствии с другими элементами, которые они содержат. Ниже приводится ряд алюминиевых сплавов и их основные области применения:
| Серия | Элемент из сплава | Применение |
| 1ххх | Почти чистый алюминий | Декорация, химическое оборудование, теплоотражатель |
| 2ххх | Медь | Панель грузовика, детали самолета |
| 3ххх | Марганец | Посуда, дорожный знак, холодильник |
| 4ххх | Кремний | Корабль, мостик |
| 5ххх | Магний | Топливный бак самолета |
| 6ххх | Магний + кремний | Оружие низкого давления, авиационный разъем |
| 7ххх | Цинк | Конструкция самолета |
| 8ххх | Прочие элементы являются главными элементами сплава | Алюминиевая фольга, радиатор |
Алюминий не теряет своих свойств после сильной деформации. Это позволяет превращать алюминий в различные формы алюминиевых изделий, таких как алюминиевые трубы, пластины, диски и фольга, с помощью механических процессов, таких как прокатка, экструзия, волочение и механическая обработка. Легирование, холодная обработка и термическая обработка могут использоваться для настройки свойств алюминия.
Это позволяет превращать алюминий в различные формы алюминиевых изделий, таких как алюминиевые трубы, пластины, диски и фольга, с помощью механических процессов, таких как прокатка, экструзия, волочение и механическая обработка. Легирование, холодная обработка и термическая обработка могут использоваться для настройки свойств алюминия.
Блог — Superior Industries International, Inc.
Оглянитесь в любом автосалоне, и вы заметите, что большинство автомобилей, продаваемых в США, имеют диски из алюминиевого сплава или «диски», как их иногда называют. Когда-то довольно редкий вариант, легкосплавные диски имеют…
Подробнее…
Алюминиевые колесные диски, может быть непросто поддерживать в чистоте и блеске. Грязь и грязь накапливаются быстро; Ваш автомобиль собирает много грязи с дорог и тормозных колодок автомобиля. Конечно, можно…
Грязь и грязь накапливаются быстро; Ваш автомобиль собирает много грязи с дорог и тормозных колодок автомобиля. Конечно, можно…
Подробнее…
Автомобильные колеса подвергаются наибольшему воздействию на дороге, чем любая другая часть автомобиля. Столкновение с выбоинами, бордюрами и другими объектами может привести к повреждению сторон алюминиевых колес. Если эти повреждения устранить, они могут привести к тому, что колесо…
Подробнее…
Независимо от того, каким транспортным средством вы управляете и где бы вы ни находились, поддержание колес в хорошем состоянии может быть непростой задачей. Более того, когда у вас алюминиевые колеса, требуется довольно много обслуживания для тех, кто хочет сохранить их. ..
..
Подробнее…
Целью очистки окисленных алюминиевых дисков является предотвращение точечной коррозии, которую трудно исправить или восстановить. Вам нужно немного потрудиться, чтобы изменить внешний вид колес. Этот метод очистки очень эффективен и надежен. Вещи, которые вам требуются: Несколько…
Подробнее…
Алюминиевые колеса в семь раз дороже, чем стальные. Только по этой причине легко понять, почему так много производителей автомобилей предпочитают производить свою продукцию со стальными колесами, а также почему так много людей заменят…
Подробнее…
Независимо от того, купили ли вы новую тачку, и вам не нравятся заводские колеса, которые поставлялись с ней, или восстанавливаете стареющую красавицу, вам не нужно выкладывать сотни долларов за комплект совершенно новых алюминиевых колес. Можно восстановить…
Можно восстановить…
Подробнее…
Алюминиевые диски могут сиять как хром, если их очистить и отполировать до совершенства. Поскольку алюминий является одним из самых мягких металлов, он хорошо поддается полировке. Если вы хотите, чтобы ваши алюминиевые диски были в хорошем состоянии, вам следует чистить и…
Подробнее…
Алюминиевые диски становятся все более популярными на легковых и грузовых автомобилях всех марок и моделей. На это есть ряд веских причин. Вот пять причин, по которым вам следует заменить эти стальные диски на алюминиевые. Коррозия…
Подробнее…
В настоящее время алюминий является вторым наиболее широко используемым металлом в мире после железа. Алюминий представляет собой пластичный металлический элемент серебристо-белого цвета. Это самый распространенный металлический элемент в земной коре, хотя в концентрированном виде он обычно не встречается…
Алюминий представляет собой пластичный металлический элемент серебристо-белого цвета. Это самый распространенный металлический элемент в земной коре, хотя в концентрированном виде он обычно не встречается…
Подробнее…
Прочнее и легче Алюминиевые или легкосплавные диски, изготовленные в основном из алюминия, определенно могут быть дороже по цене, чем другие варианты, но вы получаете что-то более прочное и легкое. Хотя вряд ли…
Подробнее…
Глядя на автомобили, вы часто видите различные типы колес – стальные, легкосплавные, алюминиевые и магниевые (сплав магния). В этой статье мы поговорим о плюсах и минусах последних двух. Конечно, есть ряд причин, по которым вы можете…
Конечно, есть ряд причин, по которым вы можете…
Подробнее…
Колеса многих транспортных средств, которые вы видите, изготовлены из литого алюминия, так как сплав в них легкий и прочный. Алюминиевые сплавы, используемые для колес, обычно содержат 97% алюминия. Второй металл добавляется для обеспечения долговечности, так как чистый алюминий слишком…
Подробнее…
Окружающая среда может быть острой проблемой, но это не означает, что люди хорошо понимают, как лучше защитить то, что их окружает. Ситуация усложняется тем, что компании могут отказываться от стандартов из-за того, что это может отразиться на их прибыли.
Подробнее. ..
..
Мы добавили новые замечательные функции и обновили наш контент, чтобы предоставить вам самую последнюю информацию о нашей компании. Чаще проверяйте наличие обновлений.
Подробнее…
6061 Алюминий: знакомство с его свойствами и применением
Одно из важных решений, которое вы должны принять при работе над проектом экструзии, — это выбор сплава.
Возможно, вы рассматриваете алюминий 6061, так как это один из наиболее часто экструдируемых сплавов. Это сплав с многовековой историей. Разработанный в 1935 году, он первоначально назывался Alloy 61s.
Сегодня люди также называют его «конструкционным алюминием». Его механические свойства делают его идеальным для широкого спектра применений. Тем не менее, он особенно подходит для таких применений, как строительные изделия, электротехнические изделия, трубопроводы и товары для отдыха.
Это деформируемый сплав, а не литейный сплав. Таким образом, он может быть экструдирован, свернут или выкован в различные формы.
Вот некоторые общие характеристики сплава 6061
Этот сплав имеет среднюю и высокую прочность. Он также обладает хорошей коррозионной стойкостью, свариваемостью, обрабатываемостью и обрабатываемостью.
Его прочность и коррозионная стойкость улучшены за счет отпуска.
Свойства материалов алюминия 6061-T4 и 6061-T6
Как правило, алюминий 6061 подвергается термообработке на твердый раствор, а затем старению. Алюминий закалки Т4 подвергается естественному старению, а алюминий закалки Т6 искусственно состаривается для достижения максимальной прочности.
Физические свойства алюминия 6061
Здесь мы можем видеть плотность сплава. Обратите внимание, что нет разницы в плотности между состояниями Т4 и Т6.
Механические свойства алюминия 6061
Здесь мы можем увидеть предел прочности при растяжении, предел текучести и модуль упругости как для состояний Т4, так и для состояний Т6.
| Собственность | 6061-Т4 | 6061-Т6 |
|---|---|---|
| Прочность на растяжение | 241 МПа | 35000 фунтов на квадратный дюйм | 310 МПа | 45000 фунтов на квадратный дюйм |
| Предел текучести | 145 МПа | 21000 фунтов на квадратный дюйм | 276 МПа | 40000 фунтов на квадратный дюйм |
| Модуль упругости | 68,9 ГПа | 10000 фунтов на квадратный дюйм | 68,9 ГПа | 10000 фунтов на квадратный дюйм |
Тепловые свойства алюминия 6061
Здесь мы можем увидеть некоторые тепловые свойства сплава, включая коэффициент теплового расширения и теплопроводность. Включены режимы T4 и T6.
| Собственность | 6061-Т4 | 6061-Т6 |
|---|---|---|
| Коэффициент теплового расширения при температуре 20,0–100 °C | 23,6 мкм/м-°C | 13,1 мкдюйм/дюйм-°F | 23,6 мкм/м-°C | 13,1 мкдюйм/дюйм-°F |
| Теплопроводность | 154 Вт/м-К | 1070 БТЕ-дюйм/час-фут²-°F | 167 Вт/м-К | 1160 БТЕ-дюйм/час-фут²-°F |
Примечание. Приведенные выше свойства материала взяты из Matweb, здесь и здесь. Обратите внимание, что они не могут быть проверены на 100%.
Приведенные выше свойства материала взяты из Matweb, здесь и здесь. Обратите внимание, что они не могут быть проверены на 100%.
Возможно, вас интересует состав сплава 6061.
Химический состав алюминия 6061
Этот сплав является частью серии сплавов 6000. Таким образом, его основными легирующими элементами являются магний и кремний. Магний добавляют для повышения прочности, а кремний добавляют для снижения температуры плавления металла. Здесь мы можем увидеть рекомендации по химическому составу алюминия 6061.
| Элемент | Минимум % | Максимум % |
|---|---|---|
| Магний | 0,8 | 1,2 |
| Кремний | 0,4 | 0,8 |
| Железо | Нет Мин. | 0,7 |
| Медь | 0,15 | 0,4 |
| Марганец | Нет Мин. | 0,15 |
| Хром | 0,04 | 0,35 |
| Цинк | Нет Мин. | 0,25 |
| Титан | Нет Мин. | 0,15 |
| Прочие элементы | Нет Мин. | 0,05 шт. 0,15 всего |
Теперь, когда мы увидели химический состав 6061, давайте поговорим о том, как этот сплав сравнивается с некоторыми другими ключевыми вариантами.
Сравнение алюминия 6061 с другими сплавами
Сплав 6061 является одним из наиболее распространенных для экструзии, но вы можете рассмотреть другие варианты для вашего конкретного применения. Ниже приведены некоторые другие распространенные сплавы, которые часто рассматриваются в качестве альтернативы.
6061 по сравнению с 7075
Одной из основных причин выбора алюминия 7075 является его высокая прочность. Легированный цинком, это один из самых прочных доступных сплавов, более прочный, чем 6061. Но он обеспечивает более низкий уровень коррозионной стойкости, чем 6061, а также его труднее сваривать. 7075 используется в морской, автомобильной и аэрокосмической промышленности, где прочность является очень высоким приоритетом. Он также используется в производстве огнестрельного оружия и даже используется в рамах дельтапланов. Узнать больше »
7075 используется в морской, автомобильной и аэрокосмической промышленности, где прочность является очень высоким приоритетом. Он также используется в производстве огнестрельного оружия и даже используется в рамах дельтапланов. Узнать больше »
6061 против 6063
6061 и 6063 — два самых популярных сплава для экструзии. Алюминий 6063 занимает первое место, а 6061 занимает второе место. Оба сплава серии 6000 содержат магний и кремний в качестве основных легирующих элементов. Таким образом, они имеют много схожих свойств. Однако 6061 предлагает более высокую прочность. Таким образом, он часто используется для более структурных приложений. 6063, с другой стороны, используется для таких применений, как перила или отделка, окна и двери, из-за его лучшего внешнего вида и коррозионной стойкости.
6061 против 5052
Как и 6061, алюминий 5052 содержит магний в качестве основного легирующего элемента. В случае 5052 это единственный основной легирующий элемент. 6061 тоже содержит кремний. Одним из ключевых преимуществ этого сплава является его высокая свариваемость по сравнению с другими сплавами. Для проектов, где свариваемость имеет ключевое значение, это стоит учитывать. Однако у 5052 есть один недостаток: он не поддается термообработке. Он подходит для различных сварочных работ и хорошо работает в морских условиях благодаря своей высокой коррозионной стойкости.
Одним из ключевых преимуществ этого сплава является его высокая свариваемость по сравнению с другими сплавами. Для проектов, где свариваемость имеет ключевое значение, это стоит учитывать. Однако у 5052 есть один недостаток: он не поддается термообработке. Он подходит для различных сварочных работ и хорошо работает в морских условиях благодаря своей высокой коррозионной стойкости.
6061 по сравнению с 2024
Сплав 2024, используемый в основном в аэрокосмической промышленности, известен своей высокой прочностью. Его основным легирующим элементом является медь, и хотя он прочен и обладает хорошей усталостной прочностью, он хуже поддается механической обработке и труднее сваривается, чем 6061. Он также обладает плохой коррозионной стойкостью и часто используется в конструкциях крыла и фюзеляжа, которые подвергаются высоким напряжениям. .
Резюме
Алюминиевый сплав 6061 является одним из наиболее распространенных и универсальных сплавов для экструзии. Его обычно называют конструкционным алюминием, поскольку его прочность делает его идеальным для конструкционных применений. Однако благодаря хорошему сочетанию свойств его также можно использовать в различных типах проектов.
Однако благодаря хорошему сочетанию свойств его также можно использовать в различных типах проектов.
Загрузите наш PDF-файл о свойствах алюминия 6061, чтобы сохранить его в качестве справочного материала.
Кроме того, если вы хотите узнать больше о том, как оптимизировать конструкцию детали для процесса экструзии, загрузите наше Руководство по проектированию экструзии алюминия.
Металл, свойства, открытия, использование, соединения
Что такое металлический алюминий?
Алюминий (обозначение Al ) или алюминий — химический элемент или серебристо-белый, блестящий, легкоплавкий, мягкий металл группы 13 (IIIA) или семейства бора таблицы Менделеева, широко используемый в нашей повседневной жизни . Алюминий является третьим наиболее распространенным химическим элементом после кислорода и кремния.
Это самый распространенный металлический элемент в земной коре (8 процентов по весу).
Al отличается от первого представителя группы 13 (бора) своими химическими свойствами, высокой реакционной способностью и катионным составом в водном растворе.
Он сочетает в себе большинство неметаллических элементов, таких как азот, сера и галогены. Образует интерметаллические соединения алюминия с большим количеством металлов.
Свойства алюминия
Гранецентрированная кубическая кристаллическая решетка (ГЦК), алюминий имеет химический символ Al, атомный номер 13. Название алюминия происходит от латинского слова alumen, которое описывает сульфат алюминия-калия, KAl(SO 4 ) 2 , 12H 2 O.
| Алюминий | |||
| Символ | Ал | ||
| Дискавери | Ганс Эрстед в 1825 году | ||
| Название производное от | Латинское слово, обозначающее квасцы, означает «горькая соль». | ||
| Обычный изотоп | 13 Ал 27 | ||
| Степени окисления | -2, -1, +1, +2, +3 | ||
| Номер CAS | 7429-90-5 | ||
| Периодические свойства | |||
| Атомный номер | 13 | ||
| Относительная атомная масса | 26,982 | ||
| Электрон на ячейку | 2, 8, 3 | ||
| Электронная конфигурация | [Ne] 3s 2 3p 1 | ||
| Блок | р-блок | ||
| Группа | 13 | ||
| Период | 3 | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Температура плавления | 660,3 °С, 1220,6 °F, 933,5 К | ||
| Температура кипения | 2519 °С, 4566 °F, 2792 К | ||
| Молярная теплоемкость | 16,443 Дж моль −1 К − 1 | ||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) | ||
| Плотность | 2,70 г/см 3 | ||
| Удельное электрическое сопротивление | 26,5 нОм·м | ||
| Атомные свойства | |||
| Атомный радиус (несвязанный) | 1,84 Å | ||
| Ковалентный радиус | 1,24 Å | ||
| Электроотрицательность | 1,61 (шкала Полинга) | ||
| Сродство к электрону | 41,762 кДж моль −1 | ||
| Энергия ионизации (кДж/моль) | 1-й | 2-й | 3-й |
| 577,54 | 1816,68 | 2744,78 | |
Обычная степень окисления или состояния металла +1 +2 и +3. Из-за уменьшения энергии решетки с увеличением размера алюминий, вероятно, должен образовывать Al +3 ион. Из-за большой энергии ионизации, не компенсируемой слабой энергией решетки, он обычно достигает состояния +3 за счет ковалентной связи.
Из-за уменьшения энергии решетки с увеличением размера алюминий, вероятно, должен образовывать Al +3 ион. Из-за большой энергии ионизации, не компенсируемой слабой энергией решетки, он обычно достигает состояния +3 за счет ковалентной связи.
Алюминий в периодической таблице
Алюминий находится в группе 13 и периоде 3 периодической таблицы. Это металлоид, который находится между бором и галлием.
Где добывают алюминий?
Наиболее распространенный элемент, алюминий, содержащийся в различных силикатных минералах, таких как слюда, полевой шпат, каолинит и глина. Единственным фторидным минералом является криолит (Na 3 AlF 6 ), найден в Гренландии.
Наиболее важные минералы, встречающиеся в природе в виде оксидов и безводных гидратированных оксидов. Оксид, подобный корунду (Al 2 O 3 ), используется в драгоценных камнях (рубин, сапфир) из-за его твердости.
Где добывают бокситы?
Основным коммерческим источником металлического алюминия является гидроксооксид, такой как Al 2 O 3 , xH 2 O или боксит. Рабочий образец боксита содержит от 40 до 60 процентов металлического оксида алюминия (Al 2 O 3 ), от 12 до 30 процентов воды, от 1 до 15 процентов оксида железа (Fe 2 O 3 ) и от 3 до 4 процентов оксида титана (TiO 2 ).
Рабочий образец боксита содержит от 40 до 60 процентов металлического оксида алюминия (Al 2 O 3 ), от 12 до 30 процентов воды, от 1 до 15 процентов оксида железа (Fe 2 O 3 ) и от 3 до 4 процентов оксида титана (TiO 2 ).
Богатые месторождения бокситов обнаружены в Австралии, Бразилии, Гвинее, Ямайке, Франции, США, России, Индии и ряде африканских стран.
Кто открыл алюминий?
Квасцы — соединение алюминия, широко использовавшееся в Риме для производства различных лекарств и красителей для текстиля.
Британский химик сэр Хамфри Дэви не смог выделить металл, но предложил название элемента алюминий или алюминий.
В 1825 году датский физик Ханс Кристиан Орстед впервые открыл металл, восстановив хлорид алюминия (AlCl 3 ) амальгамой калия. Коммерческое производство элемента началось в 1954 году путем электролиза NaAlCl 4 .
Процесс производства алюминия
Может быть получен электролитическим путем из боксита в электрохимических ячейках.
Очищенный боксит (температура плавления 2050 °С) растворяют в криолите и подвергают электролизу при 950 °С в стальных ячейках с углеродистой футеровкой.
Смесь криолита, CaF 2 , AlF 3 , Al 2 O 3 , Li 2 CO 3 в электролите с более низкой температурой плавления, допускает более низкую температуру плавления потока и снижает выброс фтора.
Электродная реакция для производства алюминия,
Катод : 2 Al +3 + 6e → 2 Al
Анод : 3 O −2 → 3 O + 6e
Расплавленный алюминий опускается на дно электролизера и сливается. Поверхность электролита была покрыта слоем кокса, который окислял выделяющийся кислород для защиты ценных электродов.
Химические свойства
Не подвергается воздействию воды благодаря наличию защитного покрытия. Если пленку удалить амальгамированием, вода образует [Al(OH) 3 + H 2 ]. Все элементы группы 13 имеют разные химические свойства и реакционную способность.
Все элементы группы 13 имеют разные химические свойства и реакционную способность.
- Например, Al и Ga растворяются в водной соляной кислоте с образованием ионов M +3 , но Tl не растворяется из-за нестабильности TlCl.
- Al практически не подвергается воздействию разбавленной серной кислоты, но концентрированная кислота восстанавливается до двуокиси серы.
- Разбавленная и концентрированная азотная кислота делает алюминий пассивным, образуя защитный оксидный слой. Al растворяется в горячей водной щелочи (литий, натрий и калий) с образованием [Al(OH) 4 ] − и водород.
Химические соединения
Электронная структура Al предполагает, что он образует в основном трехвалентные химические соединения. Соединения алюминия в состоянии +3 преимущественно связаны ковалентной химической связью. В подходящих условиях они образовывали соединения +2 и +1, такие как AlCl, Al 2 O и AlO.
При изучении химии триположительные ионы (Al +3 ) могут быть стабилизированы в водных растворах за счет сильной энергии гидратации, обычно шесть молекул воды прочно удерживаются Al +3 ион.
Гидрид алюминия
Гидрид Al представляет собой бесцветное нелетучее твердое вещество, термически неустойчивое при температуре выше 150-200 °C. Это сильный восстановитель и аддукты с сильными основаниями Льюиса.
Тетрагидрокомплекс алюминия, такой как LiAlH 4 , является очень важным химическим соединением, широко используемым в органической химии или восстановлении углеводородов.
Галогениды алюминия
Все четыре тригалогенида алюминия имеют общую формулу AlX 3 , где X = фтор, хлор, бром и йод. Все соединения могут быть получены прямым соединением металла с галогенидами.
Свойства тригалогенидов очень широки. Например, фторид представляет собой ионное кристаллическое твердое вещество.
Что такое глинозем?
Глинозем представляет собой важное химическое соединение алюминия с двумя структурными формами: α-Al 2 O 3 и ϒ-Al 2 O 3 .
Альфа-алюминий 2 О 3 встречается в природе в виде корунда, стойкого к воде и кислотам и используемого в драгоценных камнях.
Гамма-оксид алюминия деформирован, менее плотный и мягкий с высоким поверхностным натяжением в жидкой форме. Эти качества γ-оксида алюминия являются отличными реагентами для обезвоживания, обесцвечивания и абсорбции хронографа.
Бета-оксид алюминия в настоящее время разрабатывается как керамический ионный проводник, пригодный для высокоэнергетических батарей. Большое количество глинозема используется для промышленного производства алюминия.
Использование алюминия
В последние годы алюминий занял высокое положение среди металлов благодаря своим исключительным свойствам,
- легко поддается ковке и нетоксичен
- достаточно устойчив к коррозии в сухих условиях
- хорошие тепловые и электрические проводники.
- дешево в цене
Антикоррозийные свойства обусловлены защитным оксидным слоем в металле. Чистый алюминий довольно мягкий и непрочный, но промышленная форма содержит небольшое количество кремния, а углерод твердый и прочный.
Механическая прочность алюминия значительно повышается при легировании его такими металлами, как железо, медь, марганец, кремний, магний или цинк. Алюминиевые сплавы используются в строительстве, транспорте, таре и упаковке, линиях электропередач, машиностроении и лакокрасочной промышленности.
- Этот металл и его сплавы в настоящее время широко используются в самолетах, ракетном топливе, грузовых автомобилях, прицепах и автомобильных рамах.
- При изготовлении окон, дверей и строительных панелей мы также использовали его.
- При изготовлении машин, посуды и других бытовых изделий, включая мебель, также из алюминиевого сплава.
Свойства, положение в периодической таблице и применение
Введение
Алюминий — легкий металл серебристо-белого цвета [1]. Обозначается символом «Al». В чистом виде металлический алюминий имеет синевато-белый цвет.
Позиция в периодической таблице
Принадлежит к 13 группе периодической таблицы. Эта группа имеет 3 электрона на внешней оболочке. Элементы этой группы, в том числе алюминий, являются металлическими по своей природе. Среди всех элементов бор и алюминий имеют большую коммерческую ценность, чем другие в той же группе [2].
Эта группа имеет 3 электрона на внешней оболочке. Элементы этой группы, в том числе алюминий, являются металлическими по своей природе. Среди всех элементов бор и алюминий имеют большую коммерческую ценность, чем другие в той же группе [2].
Информация периодической таблицы
- Атомный номер
Атомный номер алюминия 13.
- Атомный вес
- Электронная конфигурация
- Степени окисления
- Встречаемость
- Земная кора:
- Открытие:
- Номенклатура:
- Извлечение алюминия:
- Реакция с воздухом:
- Реакция с кислотами
- Реакция с галогенами:
- Реакция с основаниями:
- DENSEIN
имеет плотность 2,7 г/см 3
- Температура плавления
Имеет плавление точка 660 градусов Цельсия.

- Температура кипения
Алюминий имеет температура кипения 2470 градусов по Цельсию.
- Изотопы :
Алюминий имеет около 22 изотопов. Среди этих изотопов 27 Al является стабильный.
- Кристалл структура
Твердый алюминий имеет кристаллическую структуру куба с центром в центре.
- Специальный гравитация
Удельный вес алюминия 2,7.
- Легкий вес
Атомный вес алюминия 26,9.
- Коррозионная стойкость:
Процесс самозащиты и покрытия помогает алюминию достичь максимальной устойчивость к коррозии.
- Электропроводность
Алюминий превосходный проводник электричества. По этой причине он встречается в различных проводках. Особенно он используется для передачи электроэнергии на большие расстояния.
 Электрический
проводимость алюминия примерно в два раза больше, чем у меди [15].
Электрический
проводимость алюминия примерно в два раза больше, чем у меди [15]. - Термический проводимость
Алюминий имеет относительно более высокую теплопроводность. Там около 50% -60% повышенной проводимости алюминия по сравнению с медью.
- Отражающая способность:
Отражающая Сочетание алюминия с другими сплавами делает его хорошим источником для зеркал. полировка.
- Пластичность:
Алюминий в его самая чистая форма очень пластична. По этой причине его нельзя использовать в чистом виде. Форма строительного назначения. Добавление кремния или железа делает его идеальным для использовать в качестве строительного материала.
- Непроницаемый:
Алюминиевые листы полностью непроницаемы для тепла и света, что делает его хорошим вариантом для хранения и транспортировки продуктов питания.
- Переработка:
Материалы из алюминия можно легко перерабатывается, чтобы вернуть алюминий.
 Этот цикл переработки делает его хорошим источником
материал для использования в быту [16].
Этот цикл переработки делает его хорошим источником
материал для использования в быту [16].Сплавы алюминия:
Когда к алюминию добавляют какой-либо элемент или группу элементов для улучшения физических свойств, они называются сплавами алюминия. Алюминий обычно используется в виде сплава, так как чистый алюминий непрочен. С этой целью производятся некоторые сплавы для повышения прочности алюминиевых изделий, но с учетом того, что легкий вес металла остается прежним. Некоторые сплавы показаны в таблице ниже:
Применение алюминия
Физические свойства алюминия позволяют использовать в различных целях. Некоторые из этих применений делают его действительно важный в нашей повседневной жизни [17].
- Посуда
Алюминий хорошо проводит тепло и легкий вес. Эти два качества делают его хорошим выбором для кухонной утвари. [18].
- Материалы для дома
Строительные материалы для дома, такие как окна, состоят из алюминия.

- Автомобильная промышленность
В последние годы алюминий используется в автомобилестроении. отрасли. Основные области применения в этой области включают в себя: автомобильный кузов, шасси и другие конструктивные элементы. Легкие автомобили, состоящие из алюминиевых деталей, с максимальной коррозионной стойкостью может помочь снизить расход топлива. это этот металл легче чистить, поэтому он используется в автомобильной промышленности. Если используется алюминий, защита поверхности не требуется.
- Морское применение
С прогресс в алюминиевой промышленности и изобретение новых алюминиевых сплавов, теперь он используется в морских приложениях. Это связано с тем, что алюминий имеет более высокую коррозионную стойкость. Так что для морского путешествия это качество имеет большое значение. значение, наряду с легким весом [19].
- Пищевая упаковка
Алюминий используется в пищевой упаковке, такой как банки, и в алюминиевой фольге для кухни.
 использовать.
использовать.- Спортивные товары
Некоторые виды спорта Оборудование в настоящее время состоит из алюминия. Пример: тележки для гольфа и велосипеды.
- Мебель
Некоторые мебель, такая как кровати, также сделана из алюминия.
- Наркотики
Алюминий в виде гидроксида алюминия применяют как антацидные препараты.
- Печатные формы
Алюминий в виде тонких листов используется для печатных форм.
- Производство бумаги
Сульфат алюминия бумажная промышленность. Производители бумаги используют его как связующее для красителей и клеев.
- Нанотехнологии
Анодный оксид алюминия (ААО) представляет собой соединение алюминия с действительно отличные свойства. Он имеет уникальную структуру, которая делает его доступным для использоваться в нанотехнологиях.

- Авиационная промышленность:
Брат Райт, открывая первый самолет, в котором также использовался алюминий в качестве основного компонента авиационного двигателя. Это связано с его легким весом. В настоящее время благодаря благоприятному физические свойства, он широко используется в авиационной промышленности. Алюминий при взаимодействии с кислородом образует защитное покрытие, препятствующее металл от коррозии.
Алюмниум широко используемый металл. Он имеет большое количество приложений в зависимости от его Физические и химические свойства.
ССЫЛКИ
- https://www.britannica.com/science/aluminum https://rsc.org/periodic-table/element/13/aluminiumhttps://www.saburchill.com/chemistry/visual/ atomics/013.htmlhttps://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Moduleshttp://science.marshall.edu/castella/chm448/elements1.pdf(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_pBlock_Elements/Group_13%3A_The_Boron_Family %3D013_Chemistry_of_Aluminum_(Z%3D13)www.
 aalco.co.ukRoesky,
Герберт и Кумар, Шраван. (2005). Химия алюминия (I). Химическая
связи (Кембридж, Англия). 32. 4027-38. 10.1039/b505307b.Guyton de Morveau, L.B. (1782), «Mémoire sur les denominations chimiques, la
necessité d’en perfectionner le systeme et les règles pour y
parvenir», Observations sur la Physique, 19: 370–382 . Сэр Хамфри Дэви. Элементы
Химическая философия. Часть 1. Том 1 (1812 г.) https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_p
Block_Elements/Group_13%3A_The_Boron_Family/Z%3D013_Chemistry_of_Aluminum_(Z%3D13)/Aluminium_MetallurgyПроизводство первичного алюминия Х. Кванде, в Основах металлургии алюминия, 2011https://www.webelements.com/aluminium/chemistry.htmlhttps://www.asminternational .org/документы/10192/1849770/06787G_Sample.pdf
https://www.thoughtco.com/aluminum-or-aluminium-3980635Коррозия алюминия и алюминиевых сплавов (#06787G)
Редактор(ы): Дж.
aalco.co.ukRoesky,
Герберт и Кумар, Шраван. (2005). Химия алюминия (I). Химическая
связи (Кембридж, Англия). 32. 4027-38. 10.1039/b505307b.Guyton de Morveau, L.B. (1782), «Mémoire sur les denominations chimiques, la
necessité d’en perfectionner le systeme et les règles pour y
parvenir», Observations sur la Physique, 19: 370–382 . Сэр Хамфри Дэви. Элементы
Химическая философия. Часть 1. Том 1 (1812 г.) https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_p
Block_Elements/Group_13%3A_The_Boron_Family/Z%3D013_Chemistry_of_Aluminum_(Z%3D13)/Aluminium_MetallurgyПроизводство первичного алюминия Х. Кванде, в Основах металлургии алюминия, 2011https://www.webelements.com/aluminium/chemistry.htmlhttps://www.asminternational .org/документы/10192/1849770/06787G_Sample.pdf
https://www.thoughtco.com/aluminum-or-aluminium-3980635Коррозия алюминия и алюминиевых сплавов (#06787G)
Редактор(ы): Дж. Р. Дэвис https://www.aluminum.org/industries/production/recyclingm. Дж. freiría gándara: алюминий: предпочтительный металл.
материалы в технологии / материалы и технологии 47 (2013) 3, 261–265 https://aluminiuminsider.com/aluminium-alloys-in-shipbuilding-a-fast-growing-trend/https://opportunitymuse.com/5- преимущества использования алюминиевой посуды.https://www.azom.com/article.aspx?ArticleID=4193
Р. Дэвис https://www.aluminum.org/industries/production/recyclingm. Дж. freiría gándara: алюминий: предпочтительный металл.
материалы в технологии / материалы и технологии 47 (2013) 3, 261–265 https://aluminiuminsider.com/aluminium-alloys-in-shipbuilding-a-fast-growing-trend/https://opportunitymuse.com/5- преимущества использования алюминиевой посуды.https://www.azom.com/article.aspx?ArticleID=4193
Оценок пока нет.
Все об алюминии 7075 (свойства, прочность и применение)
Алюминиевые сплавы — это прочные, но легкие металлы, которые нашли применение практически на всех рынках. Сплав представляет собой смесь металлов, которые вместе более полезны, чем их составляющие по отдельности. Можно считать, что основной металл (в данном случае алюминий) «улучшается» небольшими количествами различных металлов, известных как легирующие элементы. Сплавы были изобретены, чтобы обеспечить более прочные, более проводящие и/или более эластичные материалы для разработки новых идей, и произвели революцию в наших инженерных возможностях.
 Алюминий — очень распространенный металл, который имеет множество полезных сплавов; на самом деле так много, что Алюминиевая ассоциация определила классы этих сплавов, используя схему нумерации на основе легирующих элементов. Тема этой статьи относится к серии 7ххх или сплавам, в которых в качестве основного легирующего элемента используется цинк, и его название – алюминиевый сплав типа 7075. Остальные три цифры в его названии определяют отдельные сплавы друг от друга в пределах своей серии (более подробное объяснение этого соглашения об именах см. В нашей статье об алюминиевом сплаве 6061). Эта статья призвана показать свойства и области применения алюминия 7075, а также подчеркнуть его сильные стороны как конструкционного материала.
Алюминий — очень распространенный металл, который имеет множество полезных сплавов; на самом деле так много, что Алюминиевая ассоциация определила классы этих сплавов, используя схему нумерации на основе легирующих элементов. Тема этой статьи относится к серии 7ххх или сплавам, в которых в качестве основного легирующего элемента используется цинк, и его название – алюминиевый сплав типа 7075. Остальные три цифры в его названии определяют отдельные сплавы друг от друга в пределах своей серии (более подробное объяснение этого соглашения об именах см. В нашей статье об алюминиевом сплаве 6061). Эта статья призвана показать свойства и области применения алюминия 7075, а также подчеркнуть его сильные стороны как конструкционного материала.Физические свойства алюминия 7075
Алюминий7075 состоит из 90,0% Al, 5,6% Zn, 2,5% Mg, 0,23% Cr и 1,6% Cu, хотя эти цифры номинально колеблются в зависимости от производственных факторов. Его плотность составляет 2,81 г/см3 (0,102 фунта/дюйм³), что относительно легко для металла.
Алюминиевый сплав Алюминиевый сплав 7075 является одним из самых прочных доступных алюминиевых сплавов, что делает его ценным в ситуациях с высокими нагрузками. Содержание меди в алюминии 7075 повышает его восприимчивость к коррозии, но эта жертва необходима, чтобы сделать такой прочный, но пригодный для обработки материал.
Алюминиевый сплав 7075 является одним из самых прочных доступных алюминиевых сплавов, что делает его ценным в ситуациях с высокими нагрузками. Содержание меди в алюминии 7075 повышает его восприимчивость к коррозии, но эта жертва необходима, чтобы сделать такой прочный, но пригодный для обработки материал.7075 можно дополнительно улучшить, укрепив его с помощью процесса, известного как термообработка, иногда называемого «отпуском». В этом методе используется высокая температура (300-500 ºC) для реконфигурации кристаллической структуры металла для усиления его общих механических свойств, и он может буквально создать или разрушить материал. Существует множество методов закалки алюминия 7075, но для упрощения этой статьи мы выделим закаленный алюминиевый сплав 7075 T6 (7075-T6). 7075-T6 – это обычный сплав для алюминиевых пластин и прутков; однако важно знать, что каждый процесс закалки придает алюминию 7075 свои особые значения и характеристики.
Механические свойства
Мера сопротивления материала деформации определяется его модулем упругости и модулем сдвига.
 Модуль упругости алюминия 7075 составляет 71,7 ГПа (10 400 фунтов на квадратный дюйм), а его модуль сдвига составляет 26,9 ГПа (3900 фунтов на квадратный дюйм) (см. сводку в таблице 1). Как правило, этот сплав прочен и хорошо противостоит деформации, что подходит для применений, где требуется прочный, но легкий металл.
Модуль упругости алюминия 7075 составляет 71,7 ГПа (10 400 фунтов на квадратный дюйм), а его модуль сдвига составляет 26,9 ГПа (3900 фунтов на квадратный дюйм) (см. сводку в таблице 1). Как правило, этот сплав прочен и хорошо противостоит деформации, что подходит для применений, где требуется прочный, но легкий металл.При определении сплава одним из наиболее важных показателей является его предел текучести. Предел текучести материала определяется как максимальное напряжение (или сила на некоторой площади), которое не приводит к необратимой деформации материала. Это легче понять с точки зрения пластиковой соломинки; если вы слегка согните соломинку, она естественным образом вернется к своей первоначальной форме. Предел текучести указывает на максимальное количество «сгибаний», которое может быть выполнено до того, как соломинка (или металл) останется постоянно согнутой. Алюминиевый сплав 7075 имеет предел текучести при растяжении 503 МПа (83 000 фунтов на квадратный дюйм), что означает, что на кусок сплава 7075 приходится 503 МПа, прежде чем он не сможет вернуться к своей первоначальной форме.
 Это значение показывает огромное преимущество легирования алюминия и то, почему 7075 лучше всего подходит для конструкционных материалов, таких как алюминиевые трубы для рам.
Это значение показывает огромное преимущество легирования алюминия и то, почему 7075 лучше всего подходит для конструкционных материалов, таких как алюминиевые трубы для рам.Другим полезным параметром является предел прочности материала. Этот параметр представляет собой максимальное напряжение, при котором соломинка не «сломается», как упоминалось выше (в инженерных терминах это известно в «точке перелома»). До этой точки разрушения материал будет подвергаться пластической (или постоянной) деформации и не вернется к своей первоначальной форме. Это значение полезно для случаев, когда такая деформация возможна, например, в приложениях с высоким риском (военные, небоскребы), где обычно используется 7075. Алюминий 7075 имеет предел прочности при растяжении 572 МПа (83000 фунтов на квадратный дюйм), что является впечатляюще высоким показателем, учитывая его низкую плотность (см. сводку в таблице 1).
Прочность на сдвиг измеряет максимальное напряжение «сдвига», которое может испытать материал, прежде чем он окончательно деформируется.
Алюминий Чтобы лучше понять, что такое напряжение сдвига, ознакомьтесь с нашей статьей об алюминиевом сплаве 6061. Прочность на сдвиг алюминиевого сплава 7075 составляет 331 МПа (48000 фунтов на квадратный дюйм, сводку см. в Таблице 1).
Чтобы лучше понять, что такое напряжение сдвига, ознакомьтесь с нашей статьей об алюминиевом сплаве 6061. Прочность на сдвиг алюминиевого сплава 7075 составляет 331 МПа (48000 фунтов на квадратный дюйм, сводку см. в Таблице 1).типа 7075 часто используется в аэрокосмической промышленности, что вызывает повышенную озабоченность усталостным разрушением. Материал все еще может выйти из строя, даже если он испытывает силу, намного меньшую, чем его предел текучести. Если это напряжение является циклическим, то есть материал периодически нагружается этой силой достаточное количество раз, могут возникать микротрещины, которые ослабляют материал и в конечном итоге приводят к его разрушению. Усталостная прочность является мерой способности материала выдерживать эту циклическую нагрузку и полезна для приложений, где деталь, созданная с использованием этого материала, подвергается повторяющимся циклам нагрузки (например, в самолетах или автомобилях). Усталостная прочность алюминиевого сплава 7075 составляет 159.
 МПа (23 000 фунтов на кв. дюйм). Это значение рассчитано с использованием 500 000 000 циклов непрерывной периодической нагрузки ниже предела текучести, что просто показывает, как меньшие усилия могут разрушить такой прочный сплав при достаточном времени (см. сводку в Таблице 1).
МПа (23 000 фунтов на кв. дюйм). Это значение рассчитано с использованием 500 000 000 циклов непрерывной периодической нагрузки ниже предела текучести, что просто показывает, как меньшие усилия могут разрушить такой прочный сплав при достаточном времени (см. сводку в Таблице 1).Таблица 1: Сводка механических свойств алюминиевого сплава 7075.
Механические свойства
Метрическая система
Английский
Предельная прочность на растяжение
572 МПа
83000 фунтов на кв. дюйм
Предел текучести при растяжении
503 МПа
73000 фунтов на кв. дюйм
Прочность на сдвиг
331 МПа
48000 фунтов на кв. дюйм
Усталостная прочность
159 МПа
23000 фунтов на кв.
 дюйм
дюймМодуль упругости
71,7 ГПа
10400 тысяч фунтов на квадратный дюйм
Модуль сдвига
26,9 ГПа
3900 тысяч фунтов на квадратный дюйм
Применение алюминия 7075
АлюминийТип 7075 является одним из самых прочных алюминиевых сплавов. Благодаря высокому пределу текучести (> 500 МПа) и низкой плотности этот материал подходит для таких применений, как детали самолетов или детали, подверженные сильному износу. Хотя он менее устойчив к коррозии, чем другие сплавы (например, алюминиевый сплав 5052, обладающий исключительной устойчивостью к коррозии), его прочность более чем оправдывает недостатки. Некоторые основные области применения алюминиевого сплава 7075 включают:
- Арматура для самолетов
- Шестерни и валы
- Части ракет
- Детали регулирующего клапана
- Червячные передачи
- Применение в аэрокосмической и оборонной промышленности
Резюме
В этой статье представлен краткий обзор свойств, прочности и областей применения алюминия 7075.

аму.
Алюминий имеет 13 электронов и 14 нейтронов. Число протонов также равно 13. Электронная конфигурация алюминия: 1s 2 2s 2 2p 6 3s 2 3 шт. 1 . Алюминий имеет 3 электрона в валентности оболочка [3] [6].
Три степени окисления алюминия +3, +1 и +2. В соединении Al 2 O 3, Алюминий имеет степень окисления +3 [4].
Алюминий Редко
встречается в природе свободно. В основном он связывается с кислородом с образованием глинозема. Это связано
Форма алюминия присутствует в природе. Однако он является одним из самых распространенных
металлов на земле. Обычно он присутствует в форме бокситов и криолитов. Это
в основном алюмосиликаты [5]. Больше форм алюминия, присутствующих в природе
слюды, полевой шпат, вермикулит, гиббсит, гранат и изумруд.
В основном он связывается с кислородом с образованием глинозема. Это связано
Форма алюминия присутствует в природе. Однако он является одним из самых распространенных
металлов на земле. Обычно он присутствует в форме бокситов и криолитов. Это
в основном алюмосиликаты [5]. Больше форм алюминия, присутствующих в природе
слюды, полевой шпат, вермикулит, гиббсит, гранат и изумруд.
Алюминий является третьим по распространенности металлом присутствует в земной коре. Он покрывает почти 7–8 % земной коры [ 7] [8].
Алюминий был уже использовался древними греками и римлянами и получил название глинозем. Это в дальнейшем был обнаружен и назван «квасцами» [9]. Дэви определил его существование, но она не была успешно изолирована им.
Алюминий получил это название от слова латинского происхождения «Alumen или квасцы». Гайтон де Морво дал ему название «глинозем» в 1761 году. После этого ему дали название
«Алюминий» Хамфри Дэви 1807 года. Через некоторое время он переименовал
это как «Алюминий» [10]. Через какое-то время в соответствии с именем многих других элементов, он был
переименован в алюминий. Это название было впоследствии принято IUPAC и используется до сих пор.
во всем мире, кроме Северной Америки. Таким образом, оба написания «алюминий» и «алюминий»
считаются правильными в периодической таблице.
Гайтон де Морво дал ему название «глинозем» в 1761 году. После этого ему дали название
«Алюминий» Хамфри Дэви 1807 года. Через некоторое время он переименовал
это как «Алюминий» [10]. Через какое-то время в соответствии с именем многих других элементов, он был
переименован в алюминий. Это название было впоследствии принято IUPAC и используется до сих пор.
во всем мире, кроме Северной Америки. Таким образом, оба написания «алюминий» и «алюминий»
считаются правильными в периодической таблице.
Впервые он был выделен Гансом Эрстедом в 1825 году. Он нагрел и смешал безводный Хлорид алюминия с амальгамой калия для получения незначительного количества алюминия.
Затем он был выделен в 1827 году Фредриком Вёлером. Он нагрел и смешал хлорид алюминия с калий в платиновом сосуде для получения алюминия.
Боксит представляет собой вещество, содержащее большее количество встречающегося в природе алюминия
а примеси, присутствующие в бокситах, могут быть удалены из алюминия. 90 % бокситов используется для производства алюминия.
Боксит представляет собой гидратированный оксид алюминия. Примеси, присутствующие в бокситах,
кремнезем, оксид железа и глина. Бокситы используются для извлечения алюминия [11]. Это сложный процесс. Когда этот процесс осуществляется на промышленных
масштабе, это дает максимальный выход алюминия.
90 % бокситов используется для производства алюминия.
Боксит представляет собой гидратированный оксид алюминия. Примеси, присутствующие в бокситах,
кремнезем, оксид железа и глина. Бокситы используются для извлечения алюминия [11]. Это сложный процесс. Когда этот процесс осуществляется на промышленных
масштабе, это дает максимальный выход алюминия.
Карл Йозеф Байер (Австрия) в 1888 году запатентовал способ производства алюминия и процесс, известный как процесс Байера. Другой процесс был изобретен в 1886 году Шарлем Мартином Холлом и Полем-Луи Туссеном Эру, и этот процесс известен как «Процесс Холла-Эрольта». растворяется в криолите при 950 ºC и подвергают электролизу по методу Байера [12].
Химические свойства [13].
Алюминий не обязательно реагирует с кислородом воздуха из-за присутствия
защитного оксидного покрытия на металлической поверхности. Тем не менее, если какая-то поверхность остается
незащищенный, то он будет реагировать с кислородом с образованием оксида алюминия в качестве продукта.
4Al (т) + 3O 2 (л) → 2Al 2 O 3 (т)
Алюминий быстро растворяется в концентрированных соляная кислота.
2Al(s) + 3H 2 SO 4 (водн.) → 2Al 3+ (водн.) + 2SO 4 2- (водн.) + 3H 2 (g)
Алюминий металл реагирует с галогенами с образованием галогенидов. Обычно это бурная реакция.
2Al(т) + 3Cl 2 (л) → 2AlCl 3 (s)
Алюминий реагирует с основаниями по следующим реакциям.
2Al(s) + 2NaOH(aq) + 6H 2 O → 2NA + (aq) + 2 [al (OH) 4 ] – + 3H 2 (G)






 Carl Schaefer (1908). Handbuch zur geschichte der naturwissenschaften und der technik: In chronologischer darstellung. J. Springer. с. 43.
Carl Schaefer (1908). Handbuch zur geschichte der naturwissenschaften und der technik: In chronologischer darstellung. J. Springer. с. 43.
 Это возможность материала проводить через себя магнитные лучи.
Это возможность материала проводить через себя магнитные лучи. Обработка заготовки давлением. Материал не разрушается. Структура изменяется.
Обработка заготовки давлением. Материал не разрушается. Структура изменяется.