Алюминий физические и химические свойства: Химические свойства алюминия, его применение
alexxlab | 20.06.2023 | 0 | Разное
Химия в действии, Ч.2
Химия в действии, Ч.2
Оглавление11. ПЕРИОДИЧЕСКИЙ ЗАКОН11.1 Периодичность СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ПЕРИОДИЧНОСТЬ ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 12. ВОДОРОД И ВОДА 12.1. ВОДОРОД ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА 12.2 Вода ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ КАЧЕСТВО ВОДЫ ЗАГРЯЗНЕНИЕ ВОДЫ ОЧИСТКА И ПОДГОТОВКА ВОДЫ ОКЕАНЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 13.  s-Металлы s-Металлы13.1 Структура и свойства s-металлов СТРУКТУРА ФИЗИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ 13.2 Соединения, образуемые s-металлами ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ ГИДРОКСИДЫ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ 13.3. Распространенность в природе, получение и применение ПОЛУЧЕНИЕ S-МЕТАЛЛОВ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ ПРИМЕНЕНИЕ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 14. d-ЭЛЕМЕНТЫ 14.1. Структура и свойства d-элементов d-ЭЛЕМЕНТЫ ФИЗИЧЕСКИЕ СВОЙСТВА ХИМИЧЕСКИЕ СВОЙСТВА 14.2 Химия семи d-элементов МАРГАНЕЦ ЖЕЛЕЗО КОБАЛЬТ НИКЕЛЬ МЕДЬ ЦИНК ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 15.  ЭЛЕМЕНТЫ III-VI ГРУПП ЭЛЕМЕНТЫ III-VI ГРУПП15.1. Алюминий и другие элементы III группы БОР ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 15.2. IV группа периодической системы СОЕДИНЕНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД ПРИМЕНЕНИЯ УГЛЕРОДА ПРИМЕНЕНИЯ КРЕМНИЯ ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА 15.3. Элементы V группы РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА СОЕДИНЕНИЯ АЗОТА СОЕДИНЕНИЯ ФОСФОРА 15.4. Элементы VI группы. Кислород и сера КИСЛОРОД СОЕДИНЕНИЯ КИСЛОРОДА СЕРА СОЕДИНЕНИЯ СЕРЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ 16.1. Галогены ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ 16.2. Соединения галогенов ГАЛОГЕНОВОДОРОДЫ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ 16.  3. Распространенность, получение и применение галогенов и их соединений 3. Распространенность, получение и применение галогенов и их соединенийПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ 16.4. Благородные газы СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ 7.1. Органическая химия НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ УГЛЕВОДОРОДЫ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 17.2. Молекулярная структура органических соединений КОНФОРМАЦИИ СТЕРЕОИЗОМЕРИЯ 17.3. Механизмы органических реакций ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 18. УГЛЕВОДОРОДЫ 18.1. Алифатические углеводороды АЛКАНЫ АЛКЕНЫ АЛКИНЫ 18.2. Арены БЕНЗОЛ МЕТИЛБЕНЗОЛ 18. 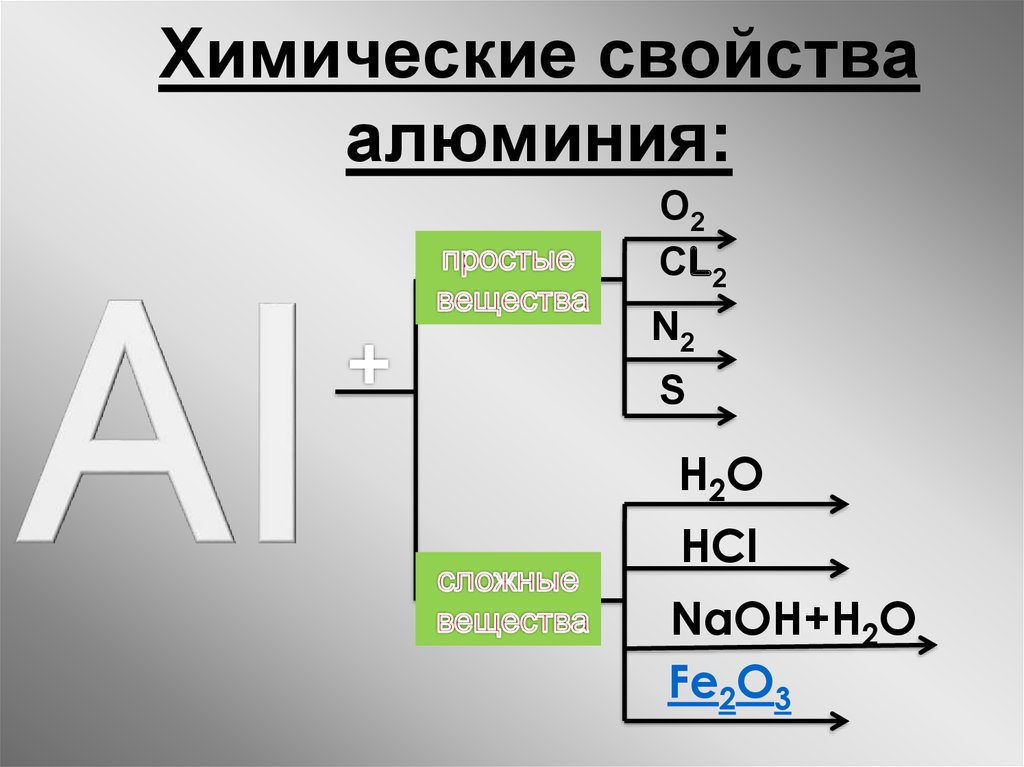 3. Природные источники, получение и применения 3. Природные источники, получение и примененияПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ ПЕРЕРАБОТКА НЕФТИ ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ 19.1. Органические галогенсодержащие соединения ГАЛОГЕНОАЛКЕНЫ ГАЛОГЕНОАРЕНЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ 19.2. Спирты, фенолы и эфиры ФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ 19.3. Карбонильная группа ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ КАРБОНОВЫЕ КИСЛОТЫ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ АМИДЫ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ 19.4 Амины и родственные соединения СОЛИ ДИАЗОНИЯ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ 20.  1. Аминокислоты, пептиды и белки 1. Аминокислоты, пептиды и белкиАМИНОКИСЛОТЫ ПЕПТИДЫ БЕЛКИ 20.2. Углеводы и нуклеиновые кислоты НУКЛЕИНОВЫЕ КИСЛОТЫ 20.3. Жиры, масла и другие природные соединения ВОСКИ ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ ВИТАМИНЫ АЛКАЛОИДЫ 20.4. Полимеры ПОЛИМЕРИЗАЦИЯ НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО ВОПРОСЫ ДЛЯ ПРОВЕРКИ ПРИЛОЖЕНИЯ |
Алюминий: физические и химические свойства
Тема: «Алюминий: физические и химические свойства»
Учитель химии: Леоненко Н.В.
Урок изучения нового материала с мультимедийным сопровождением.
Цели:
• сформировать знания о физико-механических и химических свойствах алюминия на основе его положения в периодической системе, строения атома и кристалла;
• установить причинно-следственную связь между строением и свойствами при сравнении металлов I, II, III групп главных подгрупп;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых веществ;
•
показать
практическое значение химических знаний.
Оборудование: схема-кластер; видеоматериалы с демонстрационными опытами; презентация, компьютер, экран, проектор, наборы реактивов на столах (алюминиевая проволока, фольга, растворы соляной кислоты, гидроксида натрия).
Ход урока
Учитель: Из глины я обыкновенной,
Но я на редкость современный,
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока-
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я…………..(алюминием).
Сообщение темы и целей урока (запись темы в тетради)
Учитель: «Однажды
к древнеримскому императору Тиберию пришел ремесленник и принес чашу невиданной
красоты, изготовленную из серебристого и на удивление легкого металла. На
вопрос императора о названии чудесного металла ремесленник ответил, что металл
получен им из … глины и пока не имеет названия. Император, испугавшись, что
новый металл, который можно получать из обыкновенной глины, обесценит серебро и
подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить,
его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не
можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским
историком Плинием Старшим в своей «Естественной истории», но значительная доля
правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от
серебра, на удивление легкий металл, который в принципе можно получить даже из
глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
На
вопрос императора о названии чудесного металла ремесленник ответил, что металл
получен им из … глины и пока не имеет названия. Император, испугавшись, что
новый металл, который можно получать из обыкновенной глины, обесценит серебро и
подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить,
его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не
можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским
историком Плинием Старшим в своей «Естественной истории», но значительная доля
правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от
серебра, на удивление легкий металл, который в принципе можно получить даже из
глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
Сегодня нам предстоит знакомство с алюминием как химическим элементом, так и простым веществом.
Обратите внимание: на ваших столах находятся схемы-кластеры. Именно по ним мы
будем поэтапно изучать самый распространенный металл на земле.
Каждому ряду предлагается самостоятельная работа.
Самостоятельная работа.
1 ряд.
Дать характеристику элементу №13 по положению в периодической таблице.
2 ряд.
Указать состав ядра алюминия и строение электронной оболочки.
3 ряд.
Сопоставить строение атомов натрия, магния, алюминия и сделать вывод о химической активности этих металлов.
Ответы учащихся:
• Алюминий-металл, находится в 3 группе главной подгруппе, третьем малом периоде; порядковый номер-13, Аr(Аl)=27.
• Строение атома: Z(Аl)=13, е(Аl)=13, N(Аl)= Аr-Z= 27-13=14
Аl 1s2,2s2,2р6,3s2,3р1
Аl 1s2,2s2,2р6,3s1,3р2
Выводы: Степень окисления: +3, следовательно, алюминий в реакциях будет восстановитель.
Тип химической связи: металлическая.
Тип кристаллической решетки: металлическая.
•
Металлические
свойства ярче выражены у кальция и еще сильнее у натрия по сравнению с
алюминием, так как в ряду Na—Са—Аl число электронов на внешнем энергетическом
уровне увеличивается, сила притяжения между ядром и электронами внешнего
энергетического уровня увеличивается, атомный радиус уменьшается, энергия
ионизации увеличивается, электроотрицательность увеличивается. Следовательно,
химическая активность в ряду уменьшается.
Следовательно,
химическая активность в ряду уменьшается.
Учитель: Но в электрохимическом ряду напряжения металлов алюминий расположен сразу после щелочноземельных металлов. Следовательно, можно предположить о его достаточной химической активности. Поэтому в природе алюминий в свободном виде не встречается. В природе алюминий встречается в виде:
– бокситов,
– каолина,
– нефелина и т. д. (Слайд- )
Месторождения алюминиевого сырья имеются на Урале, в Казахстане, Башкирии.
Учитель: Рассмотрев особенности химического элемента алюминия, перейдем к изучению простого вещества.
Лабораторная работа по теме:
«Физические свойства алюминия»
Инструктивная карта.
1. Рассмотрите алюминиевую проволоку и фольгу.
2. Определите агрегатное состояние вещества алюминия.
3. Какого цвета образцы металла?
4. Определите, имеет ли блеск металл?
5. Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
6. Кратко запишите свои наблюдения согласно плану:
– агрегатное состояние,
– цвет,
– блеск,
– пластичность,
– растворимость в воде.
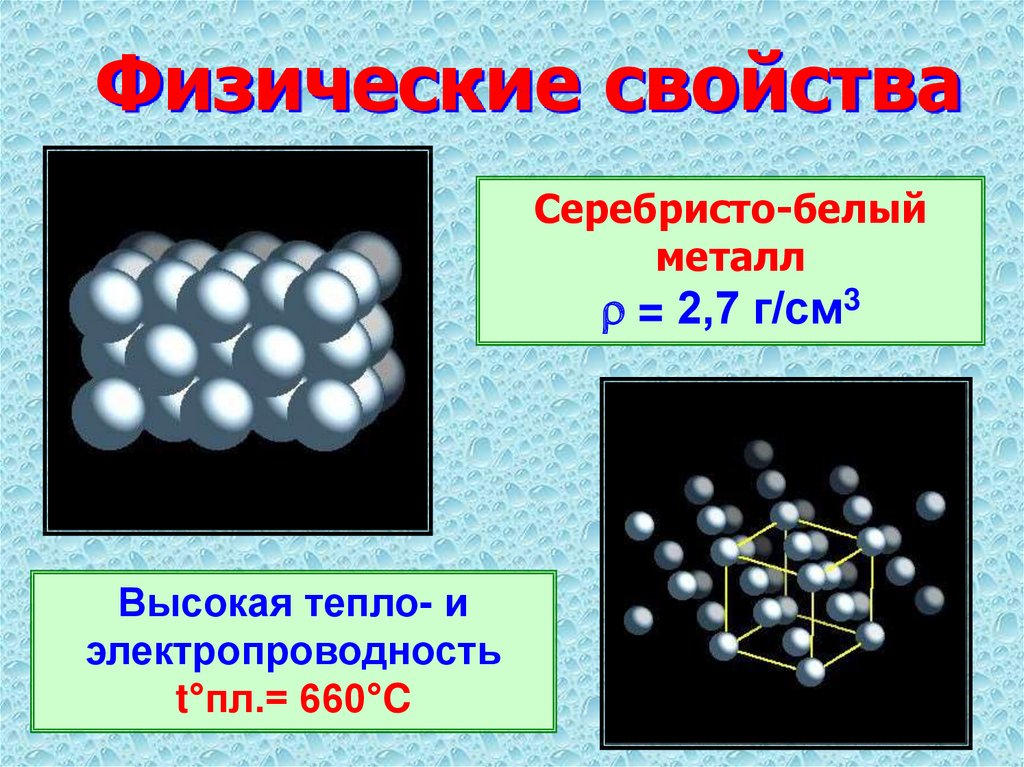
Дополнение учителя:
– легкий металл; плотность=2,7г/см3
– легкоплавкий металл: tпл.=660оС
– электропроводен (3-е место по электропроводности),
– алюминий в воде не растворяется, т.к. на его поверхности образуется оксидная пленка.
(Слайд-физические свойства алюминия).
Учитель: Мы с вами выяснили, что в химических реакциях алюминий будет проявлять восстановительные свойства. С какими же веществами он должен взаимодействовать?
Учащиеся: Как с простыми, так и со сложными веществами.
Учитель: Записываем: Химические свойства алюминия.
I. Алюминий взаимодействует с простыми веществами- неметаллами.
Опыт: Сгорание
порошка алюминия.
Горение бенгальской свечи.
Учитель: Пока горит бенгальская свеча, записываем уравнение химической реакции и разбираем его, как ОВР. 4Аl+3О2=2Аl2О3
Опыт: Взаимодействие алюминия с йодом: смешиваем порошок алюминия с йодом в соотношении 1:15, в середину смеси капаем две капли воды. Врезультате реакции образуется иодит алюминия и фиолетовые пары йода.
Учитель: Записываем уравнение реакции и разбираем его как ОВР.
2Аl+3I2=2АlI3
Видео: – взаимодействие алюминия с бромом;
– взаимодействие алюминия с серой.
Учитель: Записываем уравнения реакций и разбираем как ОВР.
2Аl+3Вr2=2АlВr3
2Аl+3S=Аl2S3
Учитель: Уравнения реакций взаимодействия алюминия с азотом, углеродом и фосфором записываем в молекулярном виде, а дома разбираем как ОВР.
2Аl+N2=2АlN(t800оС)
4Аl+3С=Аl4С3(t2000оС)
Аl+Р=АlР(t500оС)
II.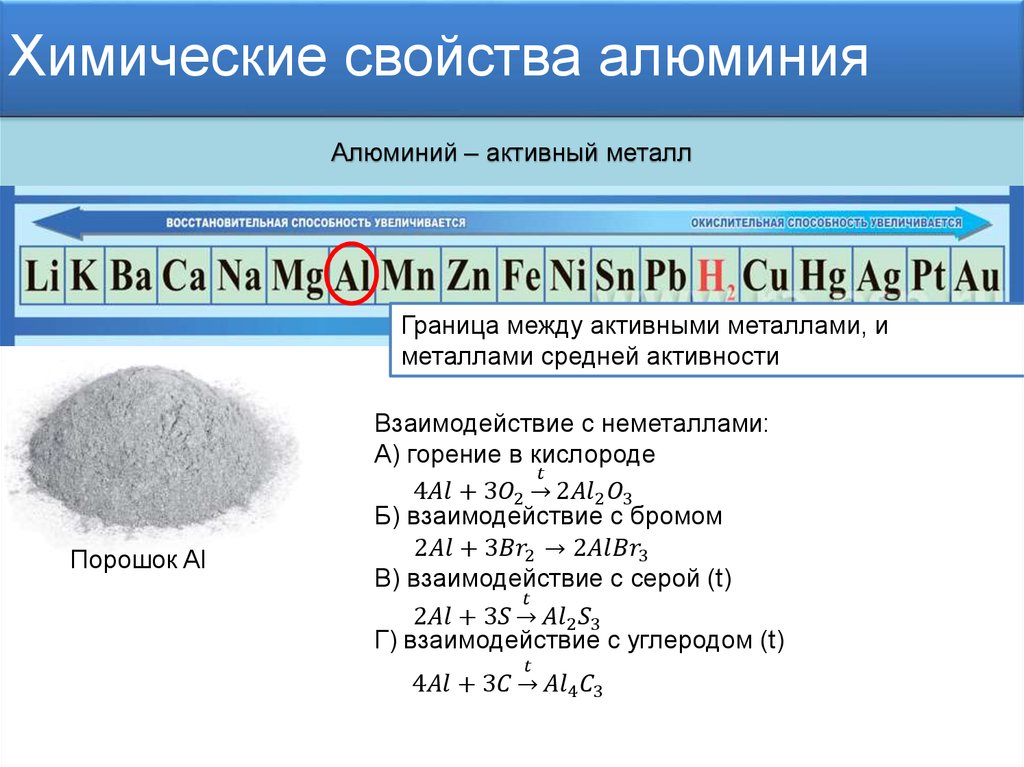 Алюминий
взаимодействует со сложными веществами.
Алюминий
взаимодействует со сложными веществами.
Лабораторная работа по теме:
«Взаимодействие алюминия с кислотами и щелочами».
Инструктивная карта.
1. Возьмите две пробирки. В каждую положите по кусочку алюминия. Прилейте в одну из них 1-2 мл. раствора соляной кислоты, а в другую столько же раствора щелочи (NаОН). Что наблюдаете? Пробирки слегка нагрейте.
2. Запишите уравнения соответствующих реакций.
3. Сделайте выводы.
Учащиеся записывают уравнения реакций на доске и разбирают их в свете ОВР.
2Аl+6HCl=2AlCl3+3h3
2Al+2NaOH+2h3O=2NaAlO2+3h3
Вывод: Алюминий проявляет амфотерные свойства, так как взаимодействует как с растворами кислот, так и с растворами щелочей.
Учитель: Для алюминия характерными являются реакции взаимодействия с солями, в состав которых входит менее активный металл: (Cлайд )
2АL+3СиSO4=Al2(SO4)3+3Cu,
а также алюминотермия- взаимодействие более активного металла с оксидом менее активного металла: 8Аl+ 3Fe3O4=9Fe+4Al2O3
Учитель: Алюминий взаимодействует с водой (без оксидной пленки):
2 Аl+6h3O=2Al(OH)3+3h3
Записанные
уравнения реакций дома разобрать как окислительно-восстановительные.
Алюминий не реагирует с коцентрированными азотной и серной кислотами на холоде.
Учитель: Получение алюминия:
Из минералов в промышленности алюминий может быть получен в основном электролизом расплава:
2Аl2О3—–4Аl+3О2
При получении алюминия используют также металлический натрий:
АlCl3+3Na=Al+3NaCl (метод датского ученого Г.Эрстеда, впервые получившего алюминий).
Опираясь на физические и химические свойства, а также получение, рассмотрим применение алюминия.
Учащий ся.
Применение алюминия и его сплавов во всех видах транспорта, а в особенности воздушного, привело к уменьшению собственной массы транспортных средств и к резкому увеличению эффективности их использования.
Авиаконструкции, моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из алюминия и его сплавов.
Алюминий и его сплавы применяют также при отделки железнодорожных вагонов,
изготовлении корпусов и дымовых труб, спасательных лодок, радарных матч,
трапов. Активно используют алюминий и его сплавы в электротехнической
промышленности для изготовления кабелей, шинопроводов, конденсаторов,
выпрямителей переменного тока. В приборостроении алюминий и его сплавы
используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры.
Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Активно используют алюминий и его сплавы в электротехнической
промышленности для изготовления кабелей, шинопроводов, конденсаторов,
выпрямителей переменного тока. В приборостроении алюминий и его сплавы
используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры.
Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Закрепление.
Тест.
1
ряд.
1.Какова
электронная конфигурация атома алюминия?
А) 1s22s22p1 Б)1s22s22p3
B) 1s22s22p63s23p1 Г) 1s22s22p63s23p63d14s2
2. С
какими из указанных веществ реагирует алюминий?
А) СаО Б) HCl
B) Cl2 Г) NaOH
2
ряд.
1.
Какие из указанных металлов являются более активными, чем алюминий?
А) Na Б) Cu
B) Ca Г) Fe
2. Наиболее характерная степень окисления алюминия:
Наиболее характерная степень окисления алюминия:
А) +1 Б) +2
В) +3 Г) +4
3 ряд.
1. Алюминий в химических реакциях проявляет свойства:
А) окислителя Б) инертного соединения
В) восстановителя Г) окислителя и восстановителя
2. В промышленности алюминий получают:
А) используя в качестве восстановителя металлический натрий
Б) электролизом расплава оксида алюминия
В) используя в качестве восстановителя оксид углерода (П)
Г) электролизом раствора солей алюминия
• Правильные ответы:
1 ряд. | 1 ряд | 2 ряд | 2 ряд | 3 ряд | 3 ряд |
1 | 2 | 1 | 2 | 1 | 2 |
Выводы:
1. Алюминий- самый распространенный химический элемент- метал в земной коре.
Алюминий- самый распространенный химический элемент- метал в земной коре.
2. В химических реакциях алюминий является восстановителем, его степень окисления равна +3.
3. Алюминий- активный металл, взаимодействует как с простыми, так и со сложными веществами.
4. Алюминий- амфотерный металл, так как реагирует и с кислотами и со щелочами.
5. В промышленности алюминий получают электролизом расплава оксида алюминия.
Это интересно!!!
Металлический алюминий первым выделил в 1825 году датский химик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года Фридрих Велер усовершенствовал метод, заменив амальгаму калия чистым калием.
Домашнее задание: параграф 13, упр.2-5.
Типы химических
реакций.
Фрагмент урока: Проведение лабораторной работы по теме «Типы химических реакций».
Цели:
• сформировать знания об основных типах химических реакций, выполнив лабораторную работу и, закрепив имеющиеся знания на примере демонстрационного эксперимента;
• установить причинно-следственную связь между строением и свойствами веществ при определении типов химических реакций и составлении уравнений реакций;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых и сложных веществ;
• показать практическое значение химических знаний.
Оборудование: схема-кластер;
видеоматериалы с демонстрационными опытами; презентация, компьютер, экран,
проектор, наборы реактивов на столах (пероксид водорода, оксид марганца (IV),
лучинка, спички, цинк, раствор соляной кислоты, магниевая лента).
Методы: обучения– 1. эвристический,
• диалогический,
• программированный;
преподавания- 1. побуждающий,
• стимулирующий,
• инструктивный,
• объяснительный;
учения- 1. частично-поисковый,
• практический,
• репродуктивный.
Ход урока.
Актуализация знаний.
Дать определения реакциям соединения, замещения, разложения.
Предполагаемый ответ. Реакции соединения– это реакции, в результате которых из нескольких простых или сложных веществ
образуется одно более сложное вещество.
Реакции разложения– это реакции, в результате которых из одного сложного вещества образуется несколько простых или сложных веществ.
Реакции
замещения–
это реакции между простым и сложным веществами, в результате которых атомы
простого вещества замещают атомы в сложном веществе.
Лабораторная работа по теме “Типы химических реакций”.
Задание 1.
В химический стакан налить пероксид водорода, далее добавить оксид марганца (IV) и внести в верхнюю часть стакана тлеющую лучинку. Что наблюдаете? Какой газ выделился? Написать уравнение реакции разложения пероксида водорода. Слить воду из стакана в пустую емкость, добавив к твердому остатку перосид водорода и внести тлеющую лучинку. Что наблюдаете? Сделайте вывод.
Задание 2.
В пробирку поместите таблетки цинка и прилейте раствор соляной или хлороводородной кислоты. Что наблюдаете? Запишите уравнение реакции. Сделайте вывод.
Задание 3.
Сожгите магниевую ленту. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Проверь свои знания по теме “Типы химических реакций”.
Опыт
1.
В один цилиндр помещаем раствор аммиака, а в другой цилиндр немного
концентрированной соляной кислоты. Соединяем отверстия цилиндров и наблюдаем
появление “дыма”- хлорида аммония. Написать уравнение реакции. Вывод?
Соединяем отверстия цилиндров и наблюдаем
появление “дыма”- хлорида аммония. Написать уравнение реакции. Вывод?
Опыт 2. Взаимодействие натрия с водой. Что наблюдаете? Написать уравнение реакции. Вывод?
Опыт 3. Разложение перманганата калия. Что наблюдаете? Напишите уравнение реакции. Вывод?
Написать уравнения реакций.
Задания на экране.
Распределить предложенные уравнения реакций по типам:
соединения;
замещения;
разложения.
Выводы:
1. Химическая реакция- это процесс превращения исходных веществ в продукты реакции.
2. Уравнение реакции- это условная запись химической реакции.
3. Реакции классифицируются по исходным веществам и продуктам реакции на р. соединения, р. замещения и р. разложения; по тепловому эффекту: на экзотермические и эндотермические.
4. Все химические реакции находят большое применение в народном хозяйстве.
Домашнее задание: Параграф 29,30,31.
Физические свойства алюминия
25 августа 2022 г. 25 августа 2022 г.
| 9:29
25 августа 2022 г.
| 9:29
Первый факт об алюминии заключается в том, что он является 13-м элементом в периодической таблице и имеет атомный символ Al. Это серебристо-белый, немагнитный, пластичный металл в естественном состоянии. На его долю приходится 8% земной коры по массе, что делает его самым распространенным металлом на планете.
Внешний вид алюминия может варьироваться в зависимости от обработки поверхности. Полированная алюминиевая поверхность отражает примерно 92 процента видимого света. Его также можно использовать для отражения среднего и дальнего инфракрасного излучения.
Плотность большинства коммерческих сортов алюминия составляет 0,0975 фунта/дюйм3. Это примерно треть плотности стали. Это связано с тем, что алюминиевое ядро намного легче, но не заметно меньше. На практике единственные металлы, которые легче алюминия, относятся к группам 1 и 2, которые слишком реакционноспособны для конструкционного использования. Бериллий и магний являются единственными исключениями.
Бериллий и магний являются единственными исключениями.
- За исключением магния, алюминий имеет самую низкую плотность среди всех промышленных металлов. Алюминий, при правильном покрытии, является отличным отражателем, особенно ультрафиолетового света.
- Алюминий — серебристо-белый металл без запаха и вкуса. С увеличением кремния он становится пластичным и мягким. Кубическая структура кристалла алюминия гранецентрирована.
- Образование примесных выделений вызывает концентрацию решетки в менее чистом металле. На большинство других физических свойств также влияет чистота.
- За исключением магния, алюминий имеет самую низкую плотность среди всех коммерческих металлов. Алюминий
- также используется в качестве выборочной холодной или горячей стенки, а также в качестве корпуса, который приближается к эффекту черного тела.
 Отражательная способность алюминия в инфракрасном диапазоне лишь немного выше, чем у золота и серебра.
Отражательная способность алюминия в инфракрасном диапазоне лишь немного выше, чем у золота и серебра. - Температура плавления технически чистого алюминия составляет приблизительно 1220°F, а температура кипения составляет приблизительно 4478°F. При легировании алюминия эти свойства изменяются.
- Реакция алюминия с воздухом:
В целом металлический алюминий не вступает в реакцию с воздухом, поскольку его поверхность покрыта тонким слоем оксида, защищающим металл от воздушных атак. Если оксидный слой поврежден и оголен металлический алюминий, он снова реагирует с кислородом, образуя амфотерный оксид (оксид алюминия (II)), Al2O3.
2Al2O3 = 4Al (т) + 3O2 (ж) (т)
- Реакция алюминия с кислотами:
Алюминий легко реагирует с минеральными кислотами с образованием растворов, содержащих водный ион Al(II), а также с выделением газообразного водорода, h3. Он растворяется в соляной кислоте (HCl), например, выделяя газообразный водород.
Он растворяется в соляной кислоте (HCl), например, выделяя газообразный водород.
2Al(т) + 6HCl (водн.) + 3h3 2Al3+ (водн.) + 6Cl- (водн.) (г)
В присутствии азотной кислоты реагирует пассивно, образуя на своей поверхности защитный оксидный слой оксида алюминия .
2Al(NO3)3 + 3h3O = Al2O3 + 6 HNO3
- Алюминий Реакция со щелочами:
Алюминий реагирует со щелочами с образованием алюминатов с выделением газообразного водорода и h3. Поскольку кислород и алюминий имеют сравнимую электроотрицательность, алюминий может образовывать ковалентные связи с кислородом. Это важная причина образования алюминатов. Алюминий, например, реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия с выделением газообразного водорода.
2Al(s) + 2NaOH(aq) + 6h3O(g)
Piping Mart
Pipingmart – B2B портал, специализирующийся на промышленной, металлической и трубопроводной продукции. Кроме того, делитесь последней информацией и новостями, касающимися продуктов, материалов и различных типов марок, чтобы помочь бизнесу в этой отрасли.
Кроме того, делитесь последней информацией и новостями, касающимися продуктов, материалов и различных типов марок, чтобы помочь бизнесу в этой отрасли.
Свойства алюминия
| ||||||||||||||||||||||||||||||||||||||||||||



 Отражательная способность алюминия в инфракрасном диапазоне лишь немного выше, чем у золота и серебра.
Отражательная способность алюминия в инфракрасном диапазоне лишь немного выше, чем у золота и серебра. Наиболее распространенные вещества существуют в виде состояний материи, таких как твердые тела, жидкости, газы и плазма. Обратитесь к статье об алюминии для получения дополнительной информации и фактов об этом веществе.
Наиболее распространенные вещества существуют в виде состояний материи, таких как твердые тела, жидкости, газы и плазма. Обратитесь к статье об алюминии для получения дополнительной информации и фактов об этом веществе. Каковы химические свойства алюминия?
Каковы химические свойства алюминия? 