Анодная и катодная защита от коррозии – Электрохимическая защита
alexxlab | 02.08.2019 | 0 | Разное
Анодная защита от коррозии
Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах.
При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии.
Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла.
Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией. Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду.
При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле.
Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону.
Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта.
Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области.
Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина.
Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы. Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально.
Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием:
– все сварные швы должны быть выполнены качественно;
– в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние;
– количество воздушных карманов и щелей должно быть минимальным;
– на конструкции не должно присутствовать заклепочных соединений;
– в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе.
Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму.
Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников.
Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты.
studfiles.net
5.4 Катодная защита.
Катодная защита конструкций от коррозии применяется преимущественно в условиях следующих агрессивных сред: морской и жесткой речной воды, почвы и т.д. Эта защита основана на использовании основных законов процесса электролиза.
Суть катодной защиты заключается в том, что защищаемую деталь присоединяют к отрицательному полюсу источника постоянного тока. Анодом служит обычный электрод из железа, установленный на определенном расстоянии от объекта (Рис.8). Такие железные бруски применяются в качестве анодов для береговых сооружений. Такое решение приводит к загрязнению водной среды окислами Fе, а поэтому оно не всегда может применяться (анод лучше не растворимый). Анода расходуют до 9кг в год и поэтому его периодически заменяют. Из-за неравномерности распределения тока на поверхности защищаемого сооружения величина защитного тока превышает расчетную.

Рис.8 Катодная защита для берегового сооружения
Нужно следить, чтобы не произошла “перезащита металла” это приводит к интенсивному выделению водорода. Она очень опасна для Zn, РЬ, А1,Sn, т.к. произойдет подщелачивание прикатодного участка:
О2+2Н2О+4е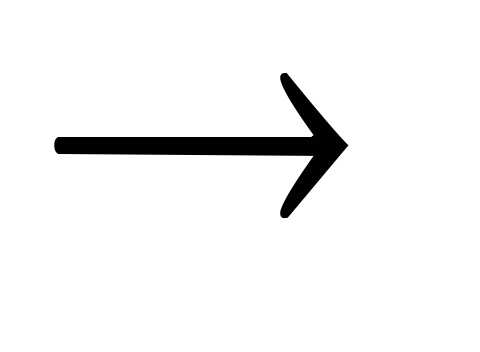 4ОН
4ОН
эти металлы в щелочной среде разрушаются.
Катодная защита, по-видимому, наиболее важный метод борьбы с коррозией. С ее помощью коррозию фактически сводят к нулю, и поверхность Ме не подвергается разрушению при выдержке в агрессивной среде в течение неограниченного времени. Электрохимическая защита применяется для борьбы с коррозией таких металлов как сталь, Сu, Рb, А1, латунь во всех видах грунтовых и особенно в водных средах. Она может эффективно использоваться для предотвращения коррозионного растрескивания, коррозионной усталости (но не просто усталости) межкристаллитной коррозии.
Элементы системы катодной защиты:

3
Рис.9: катодная защита на судах
1. электрод сравнения
2. щит управления системы катодной защиты
3. анодный экран
Конструкция делается катодом (корпус), а в электропроводную среду (морскую воду) помещается анод и подключается источник тока. Источник питания(1) служит для преобразования энергии судовой (или береговой) сети переменного тока напряжением 220 или 380В в постоянный ток с напряжением 12-24В-такое напряжение обычно используется в системах катодной защиты.
В отечественном судостроении в качестве источников питания в настоящее время применяются полупроводниковые выпрямители типа ПАК (преобразователь автоматический катодный). Электроды сравнения служат для измерения потенциала подводной части корпуса судна или любой защищаемой конструкции.
В практике электрохимической защиты морских судов от коррозии наиболее широкое применение получили хлорсеребряные электроды сравнения.
Аноды в системах катодной защиты служат для обеспечения стекания защитного тока в морскую воду. Стационарные аноды устанавливаются на наружной обшивке корпуса судна. В береговых системах применяются подвесные аноды.
Для катодной защиты корпуса корабля применение растворимых анодов не эффективно, т.к. процесс их замены громоздкая и дорогая операция. Поэтому в судостроении применяются нерастворимые аноды.
В настоящее время наиболее распространены Рt- аноды для
систем катодной защиты судов. Однако дороговизна платины заставляет искать способы, возможности ее экономии. Она применяется в виде тонкого покрытия на подложке из пассивирующих металлов – Тi, Та, Nb.
Нанесение тонких слоев Рtосуществляется способами: гальваническим осаждением, напылением расплавленного металла и приваркой платиновой фольги. Рtи платинированный Тi могут применяться в широком интервале плотностей тока до 5000 а/м2. Расход Рtпри этой плотности тока составляет 6 мг/м.кв. Ориентировочный срок службы анодов из Рt и платинированного Тi -15-20 лет.Околоанодные экраны применяются с целью обеспечения более равномерного распределения тока по защищаемой поверхности корпуса (т.е. чтобы электрическое поле анода не влияло на распределение тока), а также с целью защиты лакокрасочного покрытия вблизи анодов от разрушения кислородом, хлором, кислотами (НС1, НСlO).
Материалы околоанодных экранов должны обладать достаточной химической стойкостью, механической прочностью и диэлектрическими свойствами. Материалы околоанодных экранов используются стеклопластики холодного отверждения на эпоксидной смоле. Они наформовываются непосредственно на обшивку судна и в этом случае обеспечивается плотное прилегание экрана к обшивке при любом радиусе кривизны.
Катодная защита имеет преимущества:
возможность применения к объекту, где уже есть очаги коррозии;
длительный срок службы;
снижается обрастание корпуса судна.
Недостатки: наличие дополнительного персонала.
studfiles.net
Мир современных материалов – Электрохимическая защита от коррозии
1. Изменение скорости коррозии под действием внешней ЭДС
Даже если омическое сопротивление пренебрежимо мало, существует предельное значение скорости коррозии, соответствующей току коррозии Iкорр. Этот предел определяется несколькими факторами. В частности, разностью потенциалов катода и анода, а также природой коррозионной среды. При очень большом омическом сопротивлении проблемы коррозии чаше всего не возникает. В этом случае никакой особой защиты не требуется. Однако, когда омическое сопротивление невелико, как это чаше всего и бывает, сильнее всего значение Iкорр определяется наклонами прямых Тафеля катода и анода, соответствующими их поляризационным сопротивлениям Rp.
Электрохимическая природа коррозии позволяет предложить способы сделать её быстрее, медленнее, и даже остановить почти полностью. По определению, в процессе коррозии происходит потеря электронов анодом, который при этом приобретает некоторый потенциал. Если повысить потенциал анода, наложив внешнюю ЭДС с помощью вспомогательного катода, помещенного в одну проводящую среду с анодом, как показано на рис. 1(a), следует ожидать, что скорость коррозии возрастет. Предложенный метод обычно используется при выполнении ускоренных коррозионных испытаний. При полном подавлении высвобождения электронов коррозия прекращается. Этот факт лежит в основе метода электрохимической катодной защиты.
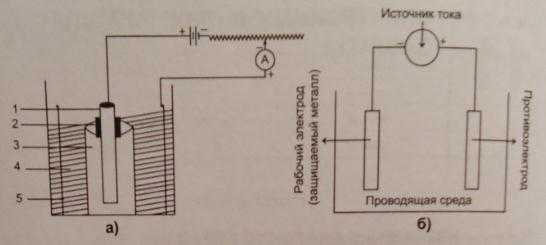
Рис. 1. Влияние внешней ЭДС на скорость коррозии:
(а) ускоренная коррозия; б) катодная зашита
1 – испытываемый образец; 2 – изолирующее покрытие; 3 – пористое покрытие анода; 4 – коррозионная среда; 5 – вспомогательный катод.
Ясно, что и в том, и в другом случае необходим противоэлектрод (его ещё называют вспомогательным электродом), который замыкал бы электрическую цепь. Кроме того, для применения катодной зашиты, т е для образования электрохимической ячейки необходимо, чтобы среда, в которой металл подвергается коррозии, обладала хорошей электрической проводимостью. Поскольку при отсутствии проводимости нанесение изолирующего покрытия обеспечивает надлежащий уровень защиты, катодная защита рассматривается только в случае пребывания металла в проводящей среде. Примерами попадания металла в проводящую среду могут служить морские суда, морские платформы и буровые установки. В этих случаях применение катодной защиты оправдано. Метод, в котором используется вспомогательный анод, а ток возникает под действием внешней ЭДС, называется катодной зашитой с внешним наложенным током (англ. ICCP). Примерами применения этого метода могут служить системы ICCP транспортных трубопроводов, проложенных глубоко под землёй или пересекающих болотистую местность.
2. Растворимый анод.
Данный способ электрохимической защиты подразумевает наличие вспомогательного анода и внешнего источника ЭДС. Иногда использование внешнего источника затруднено. Например, в случае зашиты подвижных частей установки или корпуса морского судна. Тем не менее, катодная защита может быть достигнута и 6ез внешнего источника ЭДС. Для этого необходимо взять анод из материала, который стоит ниже защищаемого металла в ряду электрохимических напряжений. В этом случае растворение анода вызывает появление потенциала, которого может оказаться достаточно для подавления высвобождения электронов с поверхности защищаемой конструкции. Важно, чтобы и катод, и анод в гальваническом элементе, частью которого является защищаемый металл, были закреплены на движущейся конструкции. Так как анод в процессе такой зашиты постепенно растворяется, метол получил название коррозионной зашиты с растворимым анодом.
Хотя анод в подобных системах и находится в активном состоянии, существует естественный предел напряжения, которое способен развивать элемент. Предельной разности потенциалов в гальваническом элементе должно хватать, чтобы преодолеть омическое сопротивление электролита и поляризационное сопротивление электродов. Все это накладывает определённые рамки на протекающий через металлический провод, замыкающий элемент накоротко, ток. По этой причине системы катодной защиты с растворимым анодом оказываются предпочтительными в средах с высокой электрической проводимостью, например в морской воде.
В случае электрохимической защиты стали или других сплавов на основе железа растворимые аноды могут быть изготовлены из цинка, алюминия или магния.
Стандартный электродный потенциал цинка равен -0,760 В. Считая ионные активности цинка и железа одинаковыми, получаем 0,3 В для осуществления зашиты. Цинковые аноды не проявляют пассивности, поэтому можно использовать высокие плотности тока. Анодный выход по току в случае цинка высок. Распределение тока вдоль защищаемой конструкции такое же, как и в случае наложенного тока. Следовательно, из-за небольшой разности потенциалов и омического сопротивления электролита необходимо размещать аноды как можно ближе друг к другу. Применение цинковых анодов может оказаться неприемлемым в средах с высоким удельным сопротивлением, например в сухом грунте.
Стандартный потенциал алюминия составляет -0,85 В, что делает его более подходящим для анодной защиты металлом, чем цинк. Но поскольку оксидная пленка алюминия крайне пассивна, то алюминий довольно стоек к растворению. Для устранения этой проблемы алюминий легируют цинком, кадмием, оловом или индием. Кроме этого, малые добавки этих элементов снижают потенциал алюминия до -1,0 В.
Наиболее отрицательным стандартным потенциалом обладает магний, что делает его наиболее подходящим кандидатом для растворимых анодов. Чтобы избежать риска его пассивации при высокой плотности тока, его легируют, например, цинком.
3. Требования к напряжению.
Почти все катодные системы предназначены для коррозии конструкций из стали или других материалов на основе железа. Основным продуктом коррозии в этом случае является гидроксид железа (II). Принято считать, что для полной защиты железа необходим катодный потенциал 0,52 В.
Диаграммы коррозии показывают, что в катодно-контролируемых системах для защиты требуется более слабый ток. Это позволяет сэкономить мощность. Прикладываемое напряжение должно преодолевать поляризационное сопротивление электродов и омическое сопротивление среды. Площадь поверхности катода должна быть меньше площади анода. Катодные системы представляют собой хорошую защиту от тех видов коррозии, в которых площадь поверхности анодных центров невелика. Для примера можно назвать коррозионное растрескивание под напряжением и питтинг-коррозию.
Ток, необходимый для полной защиты конструкции, можно уменьшить нанесением антикоррозийного покрытия.
Подробности о роли защитных покрытий, расположении анодов и значениях тока, необходимого для электрохимической защиты стали в различных средах приведены в статье «Защита конструкций от коррозии».
4. Защитные покрытия
Площадь поверхности конструкции, которую необходимо защитить от коррозии, можно уменьшить, нанеся на неё антикоррозийное покрытие. Хотя нанесение антикоррозийного покрытия повышает плотность тока, общий ток, необходимый для защиты от коррозии, уменьшается. В случае нанесения покрытий воздействию коррозии подвергается только неокрашенная часть поверхности и пропуски. Прикладываемое напряжение защищает именно эти участки. Производство высококачественного покрытия без пропусков сопряжено с огромным повышением его стоимости. С другой стороны, катодная защита абсолютно незащищённой поверхности также экономически нецелесообразна. Таким образом, существует оптимальное сочетание обоих видов защиты от коррозии.
Со временем, по мере износа покрытия необходимо повышать значение тока для поддержания его защитных функций на необходимом уровне. Когда степень износа достигает предельной величины и повышение тока невозможно, то покрытие необходимо нанести заново.
Рис. 2. Возрастание тока при наличии покрытия, необходимого для электрохимической защиты, с течением времени.
В конце статьи приведем таблицу сравнения методов электрохимической защиты, их достоинства и недостатки.
Таблица 1. Сравнение методов электрохимической защиты [1].
|
Системы с растворимым анодом |
Системы с внешним источником тока |
|
Преимущества |
|
|
Нет необходимости в источнике тока |
Одна и та же система может быть использована дли защиты конструкций разных размеров |
|
Отсутствует риск «перезащиты», а с ним и водородного охрупчивания |
Можно использовать в средах с высокой удельной проводимостью |
|
Легко устанавливаются |
Легче управлять |
|
Недостатки |
|
|
Бесполезны в средах с высоким удельным сопротивлением |
Риск «перезащиты», как следствие водородное растрескивание и ослабление адгезии покрытий |
|
Фиксированный потенциал электрода вынуждает контролировать правильность размещения анодов |
Могут вызывать коррозию от блуждающих токов |
|
Требуются меры, направленные на смягчение процесса растворения. Может потребоваться добавление тех или иных легирующих элементов |
Стоимость содержания высока, хотя капитальные затраты относительно |
|
В море аппаратура может препятствовать движению судна, корпус которого она защищает от коррозии |
Системы требуют тщательного контроля. Контроль необходимо усиливать при смене времён года и условий внешней среды |
|
Капитальные затраты высоки, хотя стоимость содержания низкая |
|
Литература:
Р. Ангал. Коррозия и защита от коррозии. Изд-во «Интеллект», 2013. – 344 с.
Вас также может заинтересовать:
worldofmaterials.ru
Катодная и анодная защита внешним током
Катодная защита – способ защиты сооружений принудительной катод- ной поляризацией с помощью внешнего источника постоянного тока (рис.13.8).
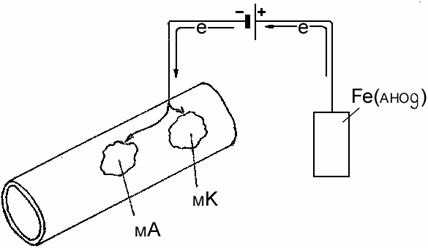
Рис.13.8 Катодная защита
Катодная поляризация трубопроводов должна осуществляться таким образом, чтобы стационарные потенциалы металла находились в пределах от
-0,85 до -1,15 В по медно-сульфатному электроду сравнения.
Отрицательный полюс внешнего источника тока подключают к защи- щаемому сооружению, которое выполняет роль катода. Анод электрической цепи – специальное анодное заземление, подключенное к положительному полюсу источника тока. Данная установка работает по закону электролиза.
При катодной защите внешним током на аноде из железа идет процесс растворения: Fe = Fe2+ + 2e, а на защищаемом изделии, которое поляри- зуется катодно, на микрокатоде идет либо процесс восстановления водорода
2Н+ + 2е = Н2 (кислая среда), либо ионизация кислорода О2 + Н2О + 4е = 4ОН– (нейтральная или щелочная среда). На микроанодах происходит подав- ление анодного процесса, т. е. коррозия сооружения.
Катодная защита внешним током по принципу действия аналогична протекторной, но более эффективна и применяется для ликвидации анодных зон трубопроводов. Она используется, как правило, для предохранения под- земных сооружений от почвенной коррозии, в ряде случаев – для защиты от коррозии блуждающим током, когда применение устройства электрического дренажа нецелесообразно по технико-экономическим данным.
Для защиты протяженных трубопроводов используют несколько ка- тодных установок (станций). Катодные станции имеют плавную или струк- турную регулировку постоянного тока.
В табл. 13.2 приведены технические характеристики некоторых катод- ных станций.
Таблица 13.2
| Тип станции | Мощность, кВт | Напряжение, В | Сила тока, А |
| КСГ (КСК) – 500 | 0,5 | 10 – 50 | |
| КСГ (КСК) –1200 | 1,2 | 10 – 60 | |
| КСС – 150 | 0,15 | 24 / 12 | 6 / 12 |
| ТСКЗ – 3 | 3,0 | 60 / 30 | 25 / 50 |
| ТСКЗ – 6 | 6,0 | 120 / 60 | 50 / 100 |
Выпускаются автоматические катодные станции, которые снабжены специальными блоками, обеспечивающими автоматическое регулирование электрических параметров защиты (величины тока или напряжения). Авто- матическое регулирование позволяет ограничивать и поддерживать в задан- ных пределах разность потенциалов между подземным сооружением и зем- лей.
В качестве анодов при катодной защите на практике широкое распро- странение получили заземлители из черных металлов (изношенные рельсы, трубы, уголки, прутки и др.), т.е. растворимые аноды.
Находят применение анодные заземлители с использованием малорас- творимых материалов: железокерамические сплавы (ферросилициды), гра- фитопласт, искусственный графит, углеграфит, прорезиненный графит и др.
По конструктивному исполнению анодные заземлители подразделяют- ся на протяженные и сосредоточенные. Обычно применяют сосредоточенные комбинированные анодные заземлители, выполненные из вертикальных электродов, горизонтально соединенных металлической полосой. Основной качественный показатель заземлителей – стабильность сопротивления расте- кания тока. Анодные заземлители рекомендуется размещать на участках с минимальным удельным сопротивлением грунта.
Анодная защита внешним током – защита металла от коррозии с по- мощью постоянного электрического тока от внешнего источника, при кото- рой защищаемый металл присоединяют к положительному полюсу (т.е. в ка- честве анода), а к отрицательному полюсу присоединяют дополнительный электрод, поляризуемый катодно. При этом поверхность защищаемого ме- талла поляризуется анодно; ее потенциал при этом смещается в положитель- ную сторону, что обычно приводит к увеличению электрохимического рас- творения металла; однако, при достижении определенного значения потен- циала может наступить пассивное состояние металла (это наблюдается при отсутствии депассиваторов в коррозионной среде и приводит к значительно- му снижению скорости электрохимической коррозии металла), для длитель-
ного сохранения которого требуется незначительная плотность анодного то- ка. На дополнительном электроде – катоде при этом протекает преимущест- венно катодный процесс. При больших плотностях анодного тока возможно достижение значений потенциала, при которых наступает явление перепас- сивации – растворение металла с переходом в раствор ионов высшей валент- ности, в результате чего образуются растворимые или неустойчивые соеди-
нения (железо и хром образуют ионы FeO 2-
и CrO 2-
), что приводит к нару-
шению пассивного состояния и увеличению скорости растворения металла.
Анодная защита применяется для защиты химического оборудования, изготовленного из коррозионностойких сталей от питтинговой коррозии в производстве сложных удобрений, содержащих KCl и HNO3. Область за- щитных потенциалов для стали 12Х18Н10Т 0,15 – 1,0В. Результаты опытов по защите сварной емкости из этой стали при температуре 40°С показали высокую эффективность анодной защиты: снизилась скорость общей коро- зии и была предотвращена питтинговая коррозия.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
Анодная защита кузова от корозии » Полезные самоделки
Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
О катодной защите кузова ранее писалось в здесь>>> но в этот раз немного дополним эту статью.
Ржавчина – враг номер один почти любого металла. «Рыжая чума», с завидным упорством и постоянством превращающая сотни тонн сверкающей высокосортной, легированной стали в груды коричневого порошка. Болезнь, для которой не существует преград… Но существуют лекарства и от нее: гальванические покрытия, лаки и краски, битумы и мастики – все они в принципе должны защитить металл. Но на деле все не так просто.
Очень остро проблема защиты от коррозии стоит, к примеру, перед автомобилистами. Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
Электродный потенциал? А какое он, собственно, имеет отношение к коррозии металлов? Оказывается, самое непосредственное.
Если опустить в сосуд с электролитом два электрически связанных между собой металлических электрода, то один из них начнет растворяться, другой же останется в неприкосновенности. Так вот, оказывается, растворяется металл, электродный потенциал которого выше. Это свойство гальванической пары и дало возможность использовать эффект сохранения катода для предохранения от электрохимической коррозии кузова автомобиля.
Судостроители давно уже используют этот принцип предохранения внутренней части трюма от коррозии – они размещают внутри корпуса специальные металлические аноды (из металла с более высоким электродным потенциалом, чем у металла корпуса). Этот способ недавно взяли на вооружение и автомобилисты.
Для анодной защиты применяют оребренные (для увеличения поверхности) куски цинка С помощью вделанных в них постоянных магнитов они прикрепляются в наиболее труднодоступных и загрязняемых местах кузова. Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоединяется к кузову.
На его ребрах собирается дорожная грязь, влага, поваренная соль и комплект «цинк – сталь» начинает работать так, как работает всем известный гальванический элемент. При работе такой «батареи» происходит растворение цинкового анода, катод в данном случае не расходуется.

Рис. 1. Комплект для анодной защиты кузова автомобиля:
1 – оребренный цинковый электрод, 2 – соединительный провод.
Процесс коррозии напоминает работу гальванического элемента, поскольку сталь представляет собой, в основном, сплав железа и углерода, то есть веществ с различными электродными потенциалами. При попадании на поверхность такого сплава электролита между молекулами железа и углерода начинает идти электрохимическая реакция, сопровождающаяся растворением анода (железа) и переходом его в гидраты, а затем и в окислы.

Рис. 2. Установка электрода в колесной нише.
Присутствие же электрически связанного с основным металлом цинкового электрода в корне меняет картину. По отношению, как к железу, так и к углероду цинк представляет собой металл с более высоким электродным потенциалом, то есть выступает в роли анода. Поэтому при наличии электропроводной среды, которая практически всегда присутствует на поверхностях автомобильного кузова, электрохимическая реакция идет с растворением анода (цинка), при сохранении катода, то есть металла кузова.
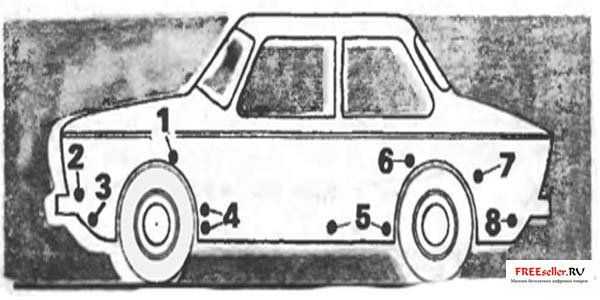
Рис. 3. Установка электродов в этих точках наиболее эффективна:
1 – коробчатые усилители брызговиков, 2 – места крепления корпусов фар и подфарников, 3 – нижняя часть передней панели, 4 – полости за щитками-усилителями передних крыльев, 5 – внутренние поверхности дверей, 6, 7 – передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 – фартук задней панели.
Как показали эксперименты, цинкового электрода величиной со спичечную коробку хватает на 3-5 лет.
Обманите «рыжую чуму». Подсуньте ей приманку – кусочек металла с электродным потенциалом выше, чем у стали. Коррозия охотно вцепится в него, забыв про кузов вашего автомобиля как минимум на три год.
Категория: Авто самоделки / Авто доработки
www.freeseller.ru
Защита от коррозии кузова (катодная защита).
Защита от коррозии кузова (катодная защита). Рубрики сайтаЗащита от коррозии кузова (катодная защита).
Теория и практика установки на автомобиль магниевых жертвенных анодов. Они разрушаются, а кузов перестает ржаветь.

Коррозия – основной враг металлоконструкций. Рассмотрим применение электрохимической протекторной защиты. Наиболее применима в настоящий момент защита методом «оцинковки». Однако этот способ при ремонте сложно применим и дорогостоящ, и вообще не применим к готовым покрашенным конструкциям. Интерес вызвал катодно-протекторный способ защиты с «жертвенными» анодами. К готовой конструкции прикрепляем эти аноды и коррозируют они, а конструкция перестаёт ржаветь. Способ издавна применяют в судостроении.
Сначала немного теории:
Коррозия ни что иное как электрохимическая реакция на поверхности металлоконструкции. Электрохимическая защита, должна создать на поверхности защищаемой конструкции электрический потенциал препятствующий этой реакции. Оптимальный защитный потенциал для металлоконструкции из низколегированной стали 0,85В при выходе из диапазона от 0,75 до 1,05В, начинается коррозия (ориентировочная плотность тока защиты 0,04А/м2), повышение потенциала выше 1,05В приведет к отслоению лакокрасочного покрытия. По сути, управляем направление движения электронов. Необходимо обеспечит направление от «жертвенного» анода к защищаемой металлоконструкции. Из чего сделать «жертвенный» анод? Рассмотрим электрохимический ряд активности доступных металлов:
- Следовательно:
- Медные детали на металлоконструкции недопустимы (например медные трубки тормозных магистралей)! Сдвигают электрический потенциал конструкции в положительную область и «жертвенным» анодом становится сама металлоконструкция.
- Цинк – хороший вариант при покрытии большими площадями, но из-за небольшой разницы в электрохимическом потенциале с железом плохо применим в качестве «жертвенного» анода в протекторной защите на воздухе. Т.е. хорош в качестве покрытия, но слаб для точечного применения.
- Остаётся алюминий и магний. (Получается, что алюминиевые силовые конструкции, например вытяжные заклёпки, не стоит применять в стальных металлоконструкциях в агрессивных средах.) Магний значительно активнее и следовательно более предпочтителен для «жертвенного» анода.
- электростамеска
- ножовка по металлу
- дрель
Инструменты:
- магниевый анод для водогрейных котлов (продаётся в магазинах сантехники)
- резиновые прокладки для водопроводных кранов
- самозасверливающиеся саморезы по металлу
Материалы:
-
Материалы, которые будем использовать:

-
Нарезаем магниевый анод дольками по 5-6 мм и сверлим отверстие под саморез.


-
Собираем комплекты “жертвенных” анодов из расчета 6 на один борт.

-
Устанавливаем аноды под порогами автомобиля:


-
Прошел год:
Насколько снизилась коррозия сказать сложно, но через год эксплуатации аноды частично разрушились (похоже еще год выдержат и под замену):


Порядок выполнения работ:
Ссылки по теме
- Электрохимический ряд активности металлов.
- Катодная защита.
- Схемы размещения протекторов ‘Анодъ’ на автотранспорте.
Комментарии к статье:
Гость2019-02-25 17:16:19саморез не смог защититьГость2019-02-25 17:16:19Саморез проржавелАдмин2019-03-10 09:58:16Согласен, саморез поржавел. Но если посмотреть внимательно, только та чать, что закручена в полость (за резинкой). Головка самореза чистая, значит защищает там где есть контакт жидкости между магнием и сталью.Гость2019-03-20 04:34:08Крепитесь анод без резинки так крепят на лодках и катерах и будет Вам счастье. foler.ru
2. Методы защиты металлов от коррозии
Каждая шестая доменная печь работает на коррозию таков итог действия коррозии, приводящей к разрушению конструкций, понижению качества продукции, а также к авариям и несчастным случаям на производстве. Это наносит народному хозяйству огромный ущерб.
Любой метод защиты изменяет ход коррозионного процесса, уменьшая его скорость. Однако, выбирая способ защиты металла, необходимо учитывать контроль коррозионного процесса.
Разрушение металла совместное протекание двух процессов: окисления (анодный процесс) и восстановления (катодный процесс) и общая скорость коррозии определяется скоростью более медленнотекущего процесса (медленно текущая реакция называется л и м и т и р у ю щ е й). Катодный контроль коррозионного процесса имеет место, если лимитирующей является катодная реакция. Анодный контроль если лимитирующей является анодная реакция. При выборе метода защиты это необходимо учитывать. Если разрушение металла протекает с анодным контролем, необходимо подобрать метод защиты усиливающий анодную поляризацию. Если разрушение металла протекает с катодным контролем метод усиливающий катодную поляризацию. Напомним, что п о л я р и з а ц и е й называется смещение потенциала электрода при протекании через систему электрического тока. Анодная поляризация сме щение потенциала в положительную сторону. Нижеприведенные диаграммы иллюстрируют снижение скорости коррозии при усилении анодной (рис. 1) и катодной (рис. 2) поляризации.
Рис. 1. Анодный контроль Рис. 2. Катодный контроль
Все методы защиты условно делятся на четыре группы:
электрохимические методы;
методы, связанные с изменением свойств корродирующего металла;
методы, связанные с изменением свойств коррозионной среды;
комбинированные методы.
Электрохимические методы защиты основаны на изменении электро
химических свойств металла под действием поляризующего тока. Катодная защита применяется для повышения коррозионной стойкости металлов в условиях почвенной, морской коррозии, при контакте металла с агрессивными химическими средами. Защита обеспечивается в этом случае наложением тока от внешнего источника питания (защищаемая поверхность соединяется с отрицательным полюсом этого источника) на защищаемой поверхности протекают только восстановительные процессы. Протекторная защита (частный случай катодной защиты) создание макрогальванической пары с менее благородным металломпротектором. П р о т е к т о р играет роль анода и растворяется со скоростью, достаточной для создания в системе тока необходимой силы. В качестве протектора могут быть использованы цинк, алюминий, магний и их сплавы. Анодная защита применима к металлам и сплавам, способным пассивироваться при смещении их электродного потенциала в положительную сторону и достижении состояния полной пассивации (здесь защищаемая поверхность соединяется с положительным полюсом внешнего источника питания). Электрохимические методы защиты можно использовать только в хорошо проводимой среде в морской воде, почве, растворах электролитов.
Группа методов защиты, основанная на изменении свойств металлов, осуществляется либо специальной обработкой их поверхности, либо легированием. Легированием называется введение в защищаемый металл легирующих элементов, повышающих термодинамическую устойчивость анодной фазы (например: легирование стали – никелем, никеля – медью, меди – золотом и т. д.), либо содействующих пассивированию анодной фазы (легирование сталей хромом или кремнием, никеля – хромом). Кроме того, для увеличения коррозионной стойкости металлов широко используются различные покрытия. Предназначение защитного покрытия создание барьерного слоя, препятствующего проникновению коррозионной среды к поверхности металла. Материал покрытия прежде всего должен обладать высокой химической устойчивостью, сла бой проницаемостью для воды, газов, агрессивных ионов (Cl, SO42), хорошей адгезией к металлу, механической прочностью и др. Покрытия делятся на две группы: металлические и неметаллические. Неметаллические покрытия в свою очередь бывают неорганические (оксидные, солевые, силикатные, асбоцементные и др.) и органические (лакокрасочные, битумные, резиновые, полимерные). Металлические покрытия бывают анодными и катодными. Анодное металлическое покрытие имеет место в случае нанесения на защищаемый металл другого металла с более отрицательным электродным потенциалом, например железо (0,44 В), покрытое цинком (0,76 В). Катодное металлическое покрытие на защищаемый металл наносят другой металл с более положительным электродным потенциалом, например железо (0,44 В), покрытое медью (+0,345 В). Если нарушается целостность защитного металлического покрытия в процессе эксплуатации, начинают работать гальванопары. В случае анодного покрытия разрушается металл покрытия (анод), защищаемый металл (катод) остается без изменения. В случае катодного покрытия разрушается защищаемый металл (анод, т.к. его электродный потенциал отрицательнее потенциала покрытия), металл покрытия (катод) не изменяется.
Для повышения защитного эффекта часто используют системы из нескольких покрытий: фосфатное покрытие перед нанесением лакокрасочного, цинковое покрытие с последующим фосфатированием и нанесением лака, многослойные металлические покрытия, лакокрасочные покрытия с наполнителем из металлического порошка и др.
Скорость коррозии можно уменьшить также изменением свойств коррозионной среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок замедлителей коррозии ингибиторов. Обработка среды заключается в уменьшении влажности и запыленности воздуха производственного помещения, деаэрировании (уменьшении концентрации кислорода) жидких сред и т. д. Ингибиторы коррозии в зависимости от условий их применения делят на летучие и жидкостные, которые в свою очередь бывают кислотные, щелочные и нейтральные (замедляющие скорость коррозии соответственно в кислых, щелочных или нейтральных средах). Ингибиторы широко используются для защиты от разрушений внешних и внутренних поверхностей труб и аппаратов, в циркуляционных охладительных системах, коммуникационных системах, в различных емкостях для хранения жидких продуктов и др. Их большое преимущество состоит в том, что они пригодны при защите уже пораженных коррозией систем без замены материала или конструкции. Механизм действия ингибиторов обусловлен их адсорбцией на границе раздела «металл – коррозионная среда». Защитное действие ингибитора тем больше, чем больше размер ингибирующей молекулы. Кроме того, защитный эффект наступает при более низких концентрациях, если молекулы ингибитора полярны, чем в случае неполярных молекул. Здесь при растворении ингибитора образуются положительно заряженные ионы. При растворении металла его положительно заряженные ионы переходят в раствор, а на поверхности металла скапливается избыток отрицательных зарядов. Отрицательно заряженная поверхность металла притягивает положительные ионы ингибитора, которые, адсорбируясь, блокируют дальнейшее его растворение. В настоящее время в качестве ингибиторов используются глицерин (СН2ОНСНОН СН2ОН), ацетальдегид (СН3СОН), анилин (С6Н6NН2), уротропин и многие другие.
studfiles.net









