Аргон газ свойства: Газ аргон — свойства, сферы применения, температура плавления и замерзания, технический состав, давление
alexxlab | 21.02.2023 | 0 | Разное
Заправка аргоном в/с 40л | Норд Газ
Компания «Норд Газ» предлагает купить аргон в/с в баллонах любого объёма. Это простой и относительно недорогой инертный одноатомный газ.
Главные свойства аргона в/с
По уровню летучести аргон стоит между азотом и кислородом. Он не вступает в химические соединения. У газа нет ни вкуса, ни цвета, ни запаха. Он не является опасным. Однако при значительном сосредоточении в атмосфере может нести опасность для жизни людей.
Предназначение и использование аргона
Аргон высшего сорта применяют во многих сферах. В металлургической промышленности он используется при обработке металла, чтобы предотвратить окисление, поддержать однородность и температуру. Жидкий и газообразный аргон в/с применяют как защитную среду во время сварки, для быстрой резки металлов и при рафинировании металлов в металлургии. К примеру, им часто пользуются как защитным газом во время дуговой электросварки.
Обычно аргон применяют в приборостроении и электронике: им заполняют газоразрядные лампы, лампы накаливания, лампы дневного света. Он нередко используется для создания наружной светящейся рекламы. Кроме того, его применяют для электровакуумной техники. В пищевой промышленности аргон высшего сорта применяют в качестве упаковочного газа, а ещё его признали пищевой добавкой Е938. Реже его используют в дайвинге для поддува гидрокостюмов. Таким образом уменьшается их теплопроводность. Чтобы увеличить теплоизоляцию покупают аргоновый баллон, в таких случаях он выполняет роль наполнителя стеклопакетов пластиковых окон. В наше время его широко используют для установок газового пожаротушения.
Заправка в баллоны
Немалый спрос у баллонов аргоновых 40л, хотя наша фирма продаёт их в разных объёмах.
Где осуществляется заправка аргоном в СПб? В компании «Норд Газ», ещё и по выгодной цене! Вы можете приобрести 40 литров аргона или заказать баллоны с любой другой ёмкостью у нас на сайте. Мы осуществляем розничную и оптовую доставку в пределах Санкт-Петербурга и Ленинградской области. Если хотите, то можете вывезти баллоны с газом самостоятельно. Мы гарантируем безопасность и качество нашего товара.
Звоните нам или оформляйте у нас заявку, если нужно заправить баллон аргоном. Кстати, у нас также есть в продаже аргон высокой чистоты.
Химические свойства аргона (23 факта, которые вы должны знать)
By Адити Рой
Аргон — бесцветный газ без запаха, который проявляет фиолетовое свечение после помещения в электрическое поле. Давайте подробно обсудим различные химические свойства аргона.
Давайте подробно обсудим различные химические свойства аргона.
Аргон это 3rd самый распространенный элемент в земной атмосфере и считается химически инертным газом. Большая часть газообразного аргона образуется в процессе распада калия-40 в атмосфере, но в промышленности его извлекают фракционной перегонкой жидкого воздуха. Он в 2.5 раза лучше растворим в воде, чем N2.
Давайте подробно сосредоточимся на изотопах, температуре плавления и кипения, энергиях ионизации, радиусе и положении аргона в периодической таблице.
Символ АргонаСимвол аргона, используемый в химии, — «Ar», который представляет собой первые два алфавита слова «аргон». Оно происходит от греческого слова «аргос», что означает ленивый или бездеятельный.
Группа аргона в периодической таблицеАргон относится к группе 18, которая является группой благородных газов. Он находится между неоном (Ne) и криптоном (Kr).
Аргон относится к 3rd период в периодической таблице между хлором (Cl) и калием (K).
Блок аргона в периодической таблицеАргон является p-блочным элементом, потому что он имеет заполненную p-орбиталь, и последний электрон аргона входит в p-орбиталь.
Атомный номер аргонаАргон имеет атомный номер 18, потому что в его ядре 18 протонов и 20 нейтронов.
Атомный вес аргонаАргон имеет атомную массу 39.948 а.е.м. (атомная единица массы), которая считается массой одного атома аргона.
Электроотрицательность аргона по ПолингуЗдесь нет электроотрицательность данные аргона по шкале Полинга. Но он показывает разную электроотрицательность 3.31 и 3.20 по шкале электроотрицательности Сандерсона и шкале электроотрицательности Оллреда Рохова соответственно.
Аргон имеет атомную плотность 1.40 мг/м.3.
Температура плавления аргонаАргон имеет очень низкую температуру плавления 83.81 К или -189.34 К.0 C.
Температура кипения аргонаТемпература кипения аргона также очень низкая: 87.302 К или -185.848 К.0 C, как его температура плавления.
Аргон Ван-дер-Ваальс РадиусАргон имеет Радиус Ван-дер-Ваальса (половина расстояния между двумя неограниченными атомами) 188 пм и имеет атомный радиус 98 пм.
Аргон Ионный/Ковалентный РадиусАргон имеет ковалентный радиус (половина расстояния между двумя атомами, соединенными ковалентными связями) 106 вечера. Но у него нет ионного радиуса, потому что он не образует ионов в стандартных условиях.
Изотопы имеют одинаковое количество протонов, но отличаются количеством нейтронов. Они также занимают одинаковое положение в периодической таблице. Выясним изотопы аргона.
| Изотопы | Численность (в %) | Режим затухания |
| 36Ar | 0.334 | стабильный |
| 37Ar | син | ε |
| 38Ar | 0.063 | стабильный |
| 39Ar | прослеживать | β– |
| 40Ar | 99. 604 604 | стабильный |
| 41Ar | син | β– |
| 42Ar | син | β– |
Электронные оболочки определяются как различные энергетические состояния для размещения электронов вне ядра. Выясним электронные оболочки аргона.
Аргон имеет в общей сложности 18 электронов на трех электронных оболочках. Они расположены в этих трех оболочках по 2,8, 8 и 1 способами. Это означает, что первые два электрона входят в XNUMXst оболочке, за которой следуют 8 электронов во 2nd и последние 8 электронов в его 3rd ракушка.
Аргон Энергия первой ионизацииАргон имеет энергию первой ионизации 1520.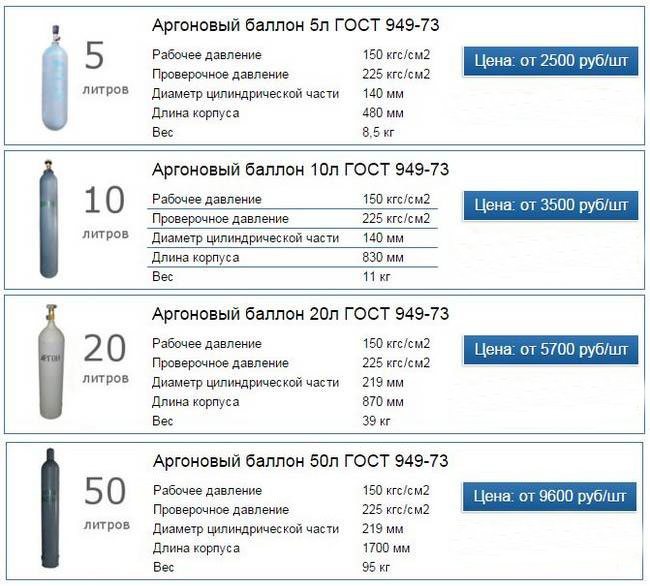 6 кДж/моль.
6 кДж/моль.
Аргон имеет 2nd энергия ионизации 2665.8 кДж/моль, что означает, что для удаления 2665.8 требуется энергия 2 кДж/мольnd электрон со своей валентной оболочки.
Аргон Энергия третьей ионизацииАргон имеет третью энергию ионизации 3931 кДж/моль. Из-за полной электронной конфигурации оболочки все энергии ионизации аргона очень высоки.
Степени окисления аргонаАргон может существовать только в одном степень окисления что равно 0. Следовательно, образование соединений аргона невозможно.
Конфигурации электронов аргонаАргон имеет электронную конфигурацию с замкнутой оболочкой, которая представляет собой [Ne] 3s.2 3p6. Поэтому он считается химически инертным.
Номер CAS аргонаArgon имеет регистрационный номер CAS (аутентичный числовой идентификатор, который может содержать до 10 цифр) 7440-37-1.
Аргон имеет ChemSpider ID (ChemSpider это бесплатная база данных химической структуры) 22407.
Химическая классификация аргонаАргон можно химически классифицировать как элемент p-блока, который также известен как благородный газ или инертный газ.
Состояние аргона при комнатной температуреАргон представляет собой газообразное соединение при комнатной температуре (200 С). это 3rd Самый распространенный газ в земной атмосфере.
Является ли аргон парамагнитным?Парамагнетизм доказывается наличием неспаренных электронов и эти электроны слабо притягиваются внешним магнитным полем. Давайте объясним это подробно.
Аргон не является парамагнитным веществом, потому что все его электроны спарены. Поэтому он известен как диамагнитный соединение. Спаренные электроны аргона
Спаренные электроны аргона
Аргон используется при сварке и других высокотемпературных промышленных методах для создания инертной атмосферы, например, в графитовых электропечах, чтобы предотвратить возгорание графита. Он также применяется в лампах накаливания наряду с люминесцентными лампами и газоразрядными трубками.
Argon – Thermophysical Properties
Argon phase diagram
Chemical, physical and thermal properties of Argon – Ar :
| Molecular Weight | 39.948 |
| Specific Gravity | 1.38 |
| Specific Объем ( футов 3 /фунт, м 3 /кг ) | 9,8, 0,622 |
| Плотность жидкости при атмосферном давлении ( фунтов/фут 3 , кг/м 3 ) | 87,0, 1400 |
| Абсолютная вязкость ( фунт М /FT S, Sentipoise ) | 50 M /FT S, Sentipoise )0 M /FT S, Sentipoise )|
| Скорость звука в газе ( м/с ) | 322 |
| Специфическое тепло – C P – ( BTU/LB O F или Cal/G 7 C, 7 C, C, 7 C, C, 777. Дж/кгК ) | 0,125, 523 |
| Удельное тепловое соотношение – C P /C V | 1,67 |
| ГАЗНАЯ ПРОСТОКА – R – ( FT LB/LB O R, J/KG 6277 C O R, J/KG 6277 C O R, J/KG 6277). | 38,7, 208 |
| Теплопроводность ( BTU/HR FT O F, W/M O C ) | 0,0102, 0,0172 | . Hg – ( или F, o C ) | -303, -186 |
| Латентная теплота испарения в точке кипения ( BTU/фунт, J/кг ) | 70, 163000 | -308. 5, -189.2 5, -189.2 |
| Critical Temperature ( o F, o C ) | -187.6, -122 |
| Критическое давление ( фунтов на квадратный дюйм, МН/м 2 ) | 707, 4.87 |
| Critical Volume ( ft 3 /lb, m 3 /kg ) | 0.0299, 0.00186 |
| Flammable | no |
Перейдите по ссылке ниже, чтобы получить значения перечисленных свойств аргона при различных давлении и температуре :
- Плотность и удельный вес
Давление и NTP – Нормальная температура и давление,
, а также Теплофизические свойства : Ацетон, Ацетилен, Воздух, Аммиак, Бензол, Бутан, Углекислый газ, Угарный газ, Этан, Этанол, Этилен, Гелий, Водород, Сероводород, Метан, Метанол, Азот, Кислород, Пентан , Пропан, Толуол, Вода и тяжелая вода, D 2 O.
Наверх
Аргон является газом при стандартных условиях. Однако при низкой температуре и/или высоком давлении газ становится жидким или твердым.
Фазовая диаграмма аргона показывает фазовое поведение при изменении температуры и давления. Кривая между критической точкой и тройной точкой показывает температуру кипения аргона при изменении давления. Он также показывает давление насыщения при изменении температуры.
В критической точке не происходит изменения состояния при увеличении давления или подводе тепла.
Тройная точка вещества — это температура и давление, при которых три фазы (газ, жидкость и твердое тело) этого вещества сосуществуют в термодинамическом равновесии.
Вернуться к началу
Аргон — Sciencemadness Wiki
Аргон — благородный газ с символом Ar и атомным номером 18. Из-за своей инертности он не образует соединений, доступных домашнему химику. подходит для инертной атмосферы.
подходит для инертной атмосферы.
Содержание
- 1 Свойства
- 1.1 Физический
- 1.2 Химическая
- 2 Наличие
- 3 Подготовка
- 4 варианта использования
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Физические свойства
Аргон представляет собой бесцветный газ без запаха при стандартных условиях с температурой кипения -185,848 °C и температурой плавления -1890,34 °С. Он тяжелее воздуха с плотностью 1,784 г/л. В отличие от азота, аргон в 2,5 раза лучше растворяется в воде, растворимость аналогична растворимости кислорода.
Химический
Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре. При 8 К аргон реагирует с фтористым водородом на поверхности иодида цезия, в результате чего образуется фторгидрид аргона, HArF, который стабилен только при температуре 17 К. Эти соединения недоступны для химика-любителя и не имеют никакого другого применения. кроме исследований.
Эти соединения недоступны для химика-любителя и не имеют никакого другого применения. кроме исследований.
Доступность
Аргон используется в качестве защитного газа при сварке, поэтому многие магазины газовых или сварочных материалов продают и сдают в аренду баллоны с чистым аргоном или смесью аргона и углекислого газа (чем больше аргона в смеси, тем она дороже). является).
Неочищенный аргон, доступный большинству людей, можно получить из ламп накаливания, которые могут содержать аргон или смесь аргона и азота. Это можно сделать, подержав лампочку под водой и надев на лампочку открытый пластиковый пакет, чтобы в пакете не было воздуха. После запечатывания пакета лампочка может разбиться, в результате чего инертный газ внутри поднимется вверх, оставаясь в пакете.
Подготовка
Аргон можно отделить от сжиженного воздуха, хотя этот процесс очень трудоемок и сложен из-за узкого диапазона температур жидкого аргона. Лучше всего купить баллоны с аргоном.
Использование
Поскольку аргон не играет никакой роли ни в одной химии, его можно использовать в качестве инертной атмосферы.
Создать инертную атмосферу в условиях домашней химии сложно, и это не часто делается. Азот обычно используется в редких случаях, а аргон используется, когда азот и двуокись углерода не подходят, поскольку и двуокись углерода, и азот являются более дешевыми газами, чем аргон. Для некоторых процессов, которые нельзя проводить ни в одной из этих атмосфер, необходимо использовать более дорогой и труднодоступный аргон. Поскольку аргон тяжелее воздуха, любой контейнер, который должен содержать атмосферу аргона, должен иметь отверстие сверху.
Аргон является предпочтительным газом для линий Schlenk и перчаточных боксов.
Наиболее распространенное использование аргона, вероятно, связано с сохранением образцов или презентацией в коллекциях элементов, особенно для элементов, чувствительных к воздуху.
Обращение
Безопасность
Аргон инертен и не вступает в реакцию ни с какими соединениями, что делает его безопасным в использовании.


