Аргон металл или нет: Аргон | это… Что такое Аргон?
alexxlab | 19.11.2020 | 0 | Разное
Аргон | это… Что такое Аргон?
| 18 | Аргон |
Ar 39,948 | |
| 3s23p6 | |
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440-37-1) — инертный одноатомный газ без цвета, вкуса и запаха.
Содержание
|
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[3][4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[3].
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос[3][4].
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)[4].
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[3].
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа[3].
Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа[3].
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[3].
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[3].
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[3].
%)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[3].
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии[3].
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность[3].
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе[6].
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения[7].
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе[4][7], его запасы в атмосфере оцениваются в 4·1014 т[2][4]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона)[4][7].
Содержание аргона в литосфере — 4·10−6 % по массе[2]. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10−5 — 9,7·10−5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т[7].
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа[2].
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. Плотность при нормальных условиях составляет 1,7839 кг/м3
Плотность при нормальных условиях составляет 1,7839 кг/м3
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO[8]. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Основная статья: Изотопы аргона
Спектр аргона
Аргон представлен в земной атмосфере тремя стабильными изотопами: [4][7]. Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона[7].
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
Применение
Заполненная аргоном и парами ртути газоразрядная трубка
Ниже перечислены области применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
- в медицине во время операций для очистки воздуха и разрезов, так как аргон почти не образует химических соединений
- в качестве составной части атмосферы эксперимента Марс-500[9] с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс
- из-за низкой теплопроводности аргон применяется в дайвинге для поддува сухих гидрокостюмов, однако есть ряд недостатков:
- высокая цена газа (кроме этого нужна отдельная система для аргона)
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа[10].
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания)[11].
Примечания
- ↑ 1 2 3 Size of argon in several environments (англ.). www.webelements.com. Проверено 6 августа 2009.
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 194. — 623 с. — 100 000 экз.
- ↑ 1 2
 Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз. - ↑ 1 2 3 4 5 6 7 8 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3-13. — 352 с. — 2400 экз.
- ↑ Mary Elvira Weeks. XVIII. The inert gases // Discovery of the elements : collected reprints of a series of articles published in the Journal of Chemical Education. — 3rd ed. rev. — Kila, MT: Kessinger Publishing, 2003. — P. 286-288. — 380 p. — ISBN 0766138720 9780766138728
- ↑ Argon: geological information (англ.). www.webelements.
 com. Проверено 9 августа 2009.
com. Проверено 9 августа 2009. - ↑ 1 2 3 4 5 6 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76-110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Science Magazine: Sign In | Science/AAAS
- ↑ Снежана Шабанова
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 21 августа 2011. Проверено 6 августа 2009.
- ↑ Argon (Ar) – Chemical properties, Health and Environmental effects (англ.
 ). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
Ссылки
- Аргон // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907. Статья Вуколова С. П.
- CTPETT (Strutt), Дж. У., лорд Рэлей (Lord Rayleigh)
- Аргон на Webelements
- Аргон в Популярной библиотеке химических элементов
- Химия инертных газов — библиотечка журнальных статей «Всякая всячина»
- Термодинамические и переносные свойства аргона
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Аргон | это.
 .. Что такое Аргон?
.. Что такое Аргон?| 18 | Аргон |
Ar 39,948 | |
| 3s23p6 | |
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом
Содержание
|
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[3][4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов.![]() Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[3].
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос[3][4].
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)[4].
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[3].
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа[3].
Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа[3].
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[3].
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен.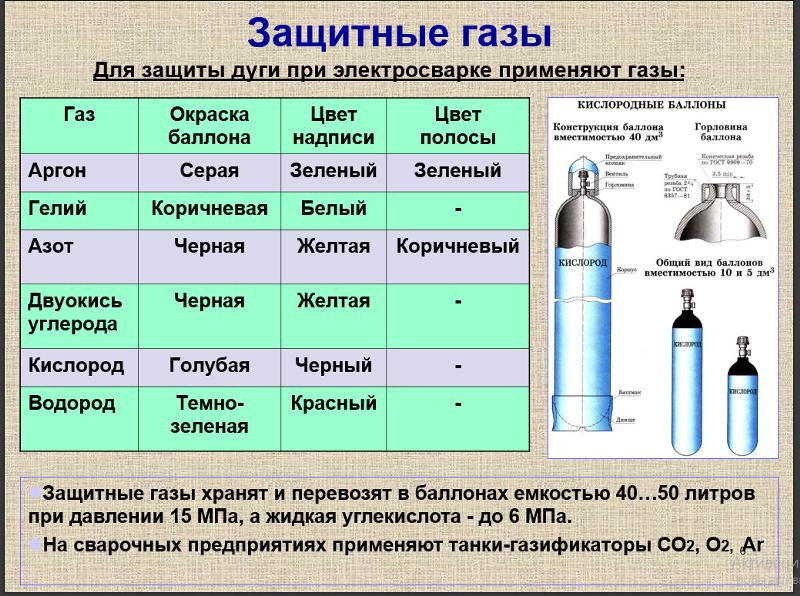 Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[3].
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[3].
%)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[3].
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии[3].
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность[3].
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе[6].
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения[7].
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе[4][7], его запасы в атмосфере оцениваются в 4·1014 т[2][4]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона)[4][7].
Содержание аргона в литосфере — 4·10−6 % по массе[2]. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10−5 — 9,7·10−5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т[7].
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа[2].
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. Плотность при нормальных условиях составляет 1,7839 кг/м3
Плотность при нормальных условиях составляет 1,7839 кг/м3
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO[8]. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Основная статья: Изотопы аргона
Спектр аргона
Аргон представлен в земной атмосфере тремя стабильными изотопами: [4][7]. Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона[7].
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
Применение
Заполненная аргоном и парами ртути газоразрядная трубка
Ниже перечислены области применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
- в медицине во время операций для очистки воздуха и разрезов, так как аргон почти не образует химических соединений
- в качестве составной части атмосферы эксперимента Марс-500[9] с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс
- из-за низкой теплопроводности аргон применяется в дайвинге для поддува сухих гидрокостюмов, однако есть ряд недостатков:
- высокая цена газа (кроме этого нужна отдельная система для аргона)
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа[10].
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания)[11].
Примечания
- ↑ 1 2 3 Size of argon in several environments (англ.). www.webelements.com. Проверено 6 августа 2009.
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 194. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Финкельштейн Д.
 Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз. - ↑ 1 2 3 4 5 6 7 8 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3-13. — 352 с. — 2400 экз.
- ↑ Mary Elvira Weeks. XVIII. The inert gases // Discovery of the elements : collected reprints of a series of articles published in the Journal of Chemical Education. — 3rd ed. rev. — Kila, MT: Kessinger Publishing, 2003. — P. 286-288. — 380 p. — ISBN 0766138720 9780766138728
- ↑ Argon: geological information (англ.). www.webelements.
 com. Проверено 9 августа 2009.
com. Проверено 9 августа 2009. - ↑ 1 2 3 4 5 6 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76-110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Science Magazine: Sign In | Science/AAAS
- ↑ Снежана Шабанова Инертные опыты на людях. Проект «Марс-500» (16 апреля 2008). Архивировано из первоисточника 28 мая 2012. Проверено 26 февраля 2012.
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 21 августа 2011. Проверено 6 августа 2009.
- ↑ Argon (Ar) – Chemical properties, Health and Environmental effects (англ.
 ). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
Ссылки
- Аргон // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907. Статья Вуколова С. П.
- CTPETT (Strutt), Дж. У., лорд Рэлей (Lord Rayleigh)
- Аргон на Webelements
- Аргон в Популярной библиотеке химических элементов
- Химия инертных газов — библиотечка журнальных статей «Всякая всячина»
- Термодинамические и переносные свойства аргона
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Аргон (Ar) – Атомный номер 18
Произносится
AR-gon
Аргон (Ar) существует в виде бесцветного газа без запаха и химически инертен.
 Он имеет атомный номер 18 в периодической таблице и принадлежит к группе 18, благородные газы. Это неметалл с символом Ar.
Он имеет атомный номер 18 в периодической таблице и принадлежит к группе 18, благородные газы. Это неметалл с символом Ar. Аргон был первым благородным газом, который был открыт сэром Генри Кавендишем в ходе его работы по идентификации неизвестного соединения в воздухе. После идентификации кислорода он приступил к реакции кислорода и азота в воздухе с образованием закиси азота. После химической обработки гидроксидом натрия остался небольшой пузырек газа, который Кавендиш идентифицировал как нереакционноспособный газ, в то время это был аргон. Не было до 1895 и с помощью спектрального анализа лорд Рэлей и Уильям Рэмси открыли уникальный спектр Аргона, названный в честь греческого «Аргос», что означает «неактивный». Аргон находит широкое применение в металлургической промышленности благодаря своему инертному поведению. Он часто используется при сварке и резке металлов, а также для создания защитных слоев на таких металлах, как титан. Первоначально символ аргона был A до 1957 года, когда IUPAC решил изменить символ на A. Аргон составляет 1% земной атмосферы, но подавляющее большинство аргона образуется в результате радиоактивного распада калия-40. Он расположен в группе 18 как неметаллический газ, не имеющий запаха и цвета. Имеет температуру плавления -189°С и температура кипения -185°С.
Аргон составляет 1% земной атмосферы, но подавляющее большинство аргона образуется в результате радиоактивного распада калия-40. Он расположен в группе 18 как неметаллический газ, не имеющий запаха и цвета. Имеет температуру плавления -189°С и температура кипения -185°С.
Загрузите аргон в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления аргона?
Температура плавления аргона составляет -189,2°C, то есть при -189,2°C он превращается в жидкость.
Какова температура кипения аргона?
Температура кипения аргона -185,7°C, то есть при -185,7°C он превращается в газ.
Что такое электроотрицательность аргона?
Электроотрицательность аргона равна 0. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Сэром Уильямом Рэмси, бароном Рэлеем
Дата открытия
1894
Что такое Теплота испарения аргона?
Аргон имеет теплоту испарения 6,447 кДж/моль.
Применение
Используется в осветительных приборах. Его часто используют для наполнения ламп накаливания. Некоторые смешиваются с криптоном в люминесцентных лампах. Кристаллы в полупроводниковой промышленности выращивают в атмосфере аргона.
Источники
Постоянно выбрасывается в воздух при распаде радиоактивного калия-40. Чистый вид получают фракционной перегонкой жидкого воздуха.
Об авторе
Натан М.
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Citation
“Argon”, опубликованная 30 декабря 2019 г. https://breakeatom.com/elements/argon
18
Protons
18
Электроны
22
Нейтроны
Символ
22
Символ
22
Символ
22
. AR
AR
Атомный вес
39,948
Атомный номер
18
Состояние
Газ
Плата
Неизвестно
-189.2
° C
Точка кипячения
-189.2
° C
.0003
-185.7
Unknown
°C
Heat of Vaporization
6.447
Unknown
kJ/mol
Crystal Structure
Cubic: Face centered
Thermoconductivity
0.0001772
Unknown
W/ CMK
Shells
2,8,8
Группа
Noble Gas
ПЕРИОД
3
Блок
P Блок
ORBITALS
[NE] 3S2 3P6
-1Ковалентный радиус
0,98 Å
Плотность при 293K
0,0017824 г/см
Электрическая проводимость
–
Потенциал первой ионизации
15.7596 V
Second Eonitiz Потенциал ионизации
40,74 В
Ионный радиус
—
Степени окисления
Параметр решетки
—
Параметр решетки 2
–
Параметр решетки 3
5,2735 Å
Орбитальная конфигурация
2,8,8
Скачать Периорическая таблица
Исследуйте другие Noble Gass
2 2949992.
 Изучите другие Noble Gass2 294
Изучите другие Noble Gass2 294.
Oganesson
4.003
2
HE
Helium
131.293
54
XE
83.798
9000 269999999999999999999999999000 9000 26..0003
Kr
Криптон
20.18
10
Ne
Благородные газы – семь химических элементов, которые составляют периодическую группу 18 (Гелий: NIII), гелий: N18, (VIIIa) аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганесон (Og). Это бесцветные газы без запаха и вкуса, негорючие газы.
Аргон | Encyclopedia.com
Примечание. Эта статья, первоначально опубликованная в 1998 г., была обновлена в 2006 г. для выпуска электронной книги.
Обзор
Аргон — благородный газ. Благородные газы — это шесть элементов 18-й группы (VIIIA) периодической таблицы. Периодическая таблица представляет собой диаграмму, которая показывает, как химические элементы связаны друг с другом. Инертные газы иногда называют инертными газами, потому что элементы группы 18 (VIIIA) реагируют с очень небольшим количеством других элементов. Фактически, ни одно соединение аргона никогда не производилось.
Инертные газы иногда называют инертными газами, потому что элементы группы 18 (VIIIA) реагируют с очень небольшим количеством других элементов. Фактически, ни одно соединение аргона никогда не производилось.
Аргон был открыт в 1894 году английским химиком Джоном Уильямом Струттом, наиболее известным как лорд Рэлей (1842-1819 гг.).19) и шотландский химик Уильям Рамзи (1852-1916). Это был первый из благородных газов, который был выделен.
Рэлей и Рамзи открыли аргон фракционной перегонкой жидкого воздуха. Фракционная перегонка — это процесс медленного нагревания жидкого воздуха. Когда воздух нагревается, различные элементы снова превращаются из жидкости в газ. Часть воздуха, которая снова превращается в газ при температуре -185,86°C (-302,55°F), представляет собой аргон.
СИМВОЛ
Ar
АТОМНЫЙ НОМЕР
18
АТОМНАЯ МАССА
39,948
СЕМЕЙСТВО
Группа 18 (VIIIA)
Благородный газ
ПРОИЗНОШЕНИЕ
AR-гон
Аргон используется в качестве инертной оболочки для некоторых промышленных операций. Инертная газовая оболочка предотвращает взаимодействие любых химических веществ в процессе эксплуатации с кислородом и другими веществами.
присутствует в воздухе. Аргон также используется для изготовления «неоновых» ламп и лазеров.
Инертная газовая оболочка предотвращает взаимодействие любых химических веществ в процессе эксплуатации с кислородом и другими веществами.
присутствует в воздухе. Аргон также используется для изготовления «неоновых» ламп и лазеров.
Открытие и наименование
Аргон был открыт в 1894 году. Однако английский ученый Генри Кавендиш (1731-1810) предсказал существование аргона на 200 лет раньше. Когда Кавендиш удалил кислород и азот из воздуха, он обнаружил, что осталось очень небольшое количество газа. Он предположил, что в воздухе витает еще один элемент, но не смог определить, что это было.
Когда Рамзи повторил эксперименты Кавендиша в 1890-х годах, он тоже обнаружил в воздухе крошечное количество неизвестного газа. Но у Рамзи было преимущество перед Кавендишем: он мог использовать спектроскопию, которой во времена Кавендиша не существовало. Спектроскопия — это процесс анализа света, возникающего при нагревании элемента. Спектр (множественное число: спектры) элемента состоит из серии цветных линий и отличается для каждого элемента.
Рамзи изучил спектр неизвестного газа. Он нашел ряд линий, которые не принадлежали ни одному другому элементу. Он был убежден, что нашел новый элемент. Тем временем Рэлей почти в то же время проделывал аналогичную работу. Он сделал свое открытие примерно в то же время, что и Рамзи. Два ученых решили сделать свое заявление вместе. Название аргон происходит от греческого слова аргос, «ленивый». Название основано на неспособности аргона реагировать с чем-либо.
Открытие аргона создало проблему для химиков. Это был первый обнаруженный благородный газ. Где он должен находиться в периодической таблице? В то время таблица заканчивалась группой 17 (VIIA) справа. Рамзи предположил, что периодическую таблицу, возможно, придется расширить. Он предложил добавить в таблицу целую новую группу. Эта группа будет размещена справа от группы 17 (VIIA).
Предложение Рамзи было принято, но создало новую интересную проблему для химиков. Если в периодической таблице была новая группа, то где были другие элементы, принадлежавшие этой группе?
К счастью, химики хорошо представляли, как могут выглядеть эти отсутствующие элементы.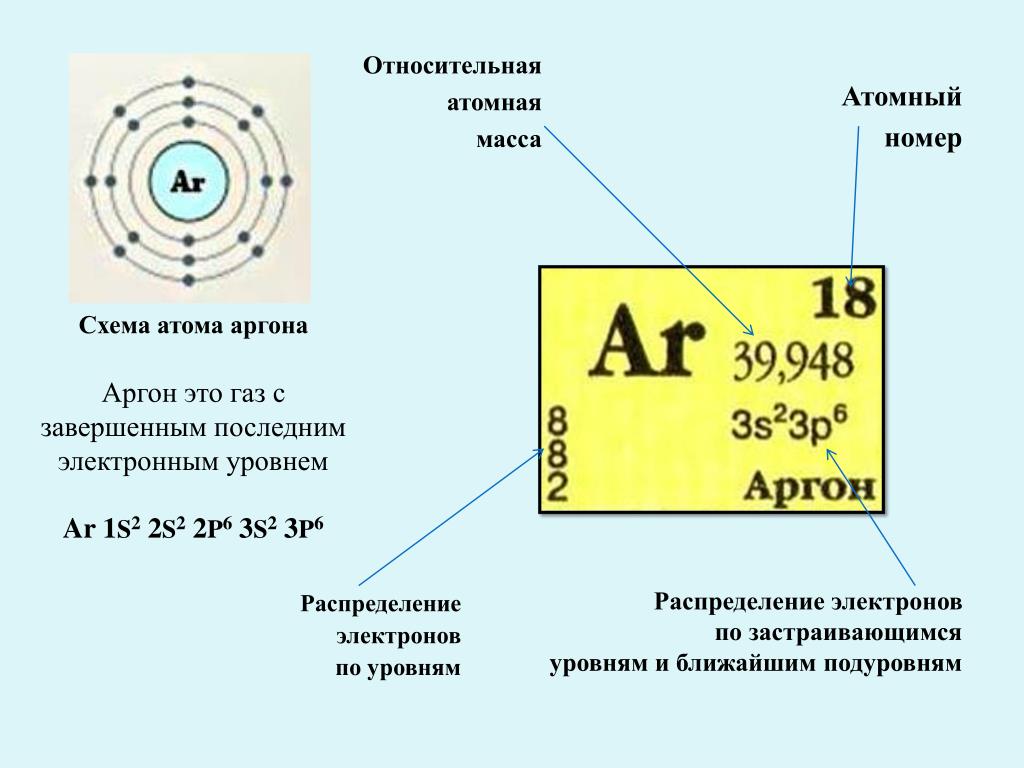 Все элементы в одной группе очень похожи друг на друга. Химики искали более неактивные
газы. В течение следующих пяти лет были найдены остальные члены группы: гелий , криптон, неон, радон, и ксенон .
Все элементы в одной группе очень похожи друг на друга. Химики искали более неактивные
газы. В течение следующих пяти лет были найдены остальные члены группы: гелий , криптон, неон, радон, и ксенон .
Символ A использовался для обозначения аргона до 1950-х годов, когда химики согласились использовать двухбуквенный символ Ar для обозначения элемента.
Физические свойства
Аргон — бесцветный газ без запаха и вкуса. Его плотность составляет 1,784 грамма на литр. Плотность воздуха, для сравнения, составляет около 1,29 грамма на литр. Аргон переходит из газа в жидкость при температуре -185,86°C (-302,55°F). Затем он переходит из жидкого состояния в твердое при температуре -189,3°C (-308,7°F).
Химические свойства
Аргон химически неактивен. В редких случаях и в экстремальных условиях он образует слабые, сложные структуры.
Встречаемость в природе
Содержание аргона в атмосфере составляет около 0,93 процента. Он также содержится в земной коре в количестве около 4 частей на миллион.
Он также содержится в земной коре в количестве около 4 частей на миллион.
Экстракция
Аргон может быть получен из жидкого воздуха путем фракционной перегонки. Его также можно получить путем нагревания газообразного азота из атмосферы с горячим магнием или кальцием. Магний или кальций соединяется с азотом с образованием нитрида:
Небольшое количество аргона всегда встречается как примесь с азот. Остается, потому что не вступает в реакцию с магнием или кальцием.
Аргон также встречается в скважинах с природным газом. При очистке природного газа некоторое количество аргона может быть извлечено в качестве побочного продукта.
Изотопы
В природе существуют три изотопа аргона. Это аргон-36, аргон-38 и аргон-40. Изотопы представляют собой две или более формы элемента. Изотопы отличаются друг от друга массовым числом. Число, написанное справа от элемента
название – массовое число. Массовое число представляет собой количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация является изотопом.
Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация является изотопом.
Известны также шесть радиоактивных изотопов аргона. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обстреливают атомы. Эти частицы впиваются в атомы и делают их радиоактивными.
Никакие радиоактивные изотопы аргона не имеют практического применения. Однако для определения возраста очень старых пород используется один нерадиоактивный изотоп. Этот метод датирования горных пород описан в исследовании калия 9.0276 запись.
Использование
Аргон используется в ситуациях, когда материалы должны быть защищены от кислорода или других газов. Хорошим примером является лампа накаливания, состоящая из металлической проволоки внутри колбы из прозрачного стекла. Электрический ток проходит через провод, заставляя его сильно нагреваться и излучать свет.
Кислород очень легко соединяется с горячим металлом, образуя соединение металла и кислорода. Это соединение не будет очень хорошо проводить электрический ток, поэтому лампочка перестанет излучать свет.
Однако для предотвращения этого используется аргон. Поскольку аргон инертен, он не вступает в реакцию с горячей проволокой, оставляя металл горячим в течение очень длительного периода времени. Лампочка перестанет светить только тогда, когда металл сломается. Тогда он больше не может проводить электрический ток.
Аргон также используется при сварке. Сварка – это процесс соединения двух металлов друг с другом. В большинстве случаев два металла нагреваются до очень высоких температур. При нагревании они сливаются вместе.
Однако, когда металлы нагреваются, они начинают реагировать с кислородом. В этой реакции образуется соединение металла и кислорода. Становится очень трудно соединить два металла, если они образовали соединения, но введение аргона в сварочную среду улучшает соединение.
Аргон также используется в аргоновых лазерах и аргоновых лазерах на красителях. Лазер — это устройство, излучающее очень яркий свет одного цвета (частоты). Аргоновый лазер используется для лечения кожных заболеваний. Лазер освещает пораженный участок кожи сине-зеленым светом. Энергия лазера поглощается гемоглобином и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов. Он переносит кислород к тканям и углекислый газ из них.) Кровеносные сосуды повреждаются, но затем закупориваются, побуждая их разлагаться и реабсорбироваться в организме. Нежелательные наросты сглаживаются, а темные пятна осветляются с небольшим риском образования рубцов.
Аргоновый лазер на красителе используется в глазной хирургии. Цвет света, излучаемого лазером, можно регулировать с высокой точностью. Его можно заставить излучать свет в диапазоне от зеленого до синего. Каждый оттенок зеленого или синего имеет немного другую частоту. Он может проникать более или менее глубоко в глаз.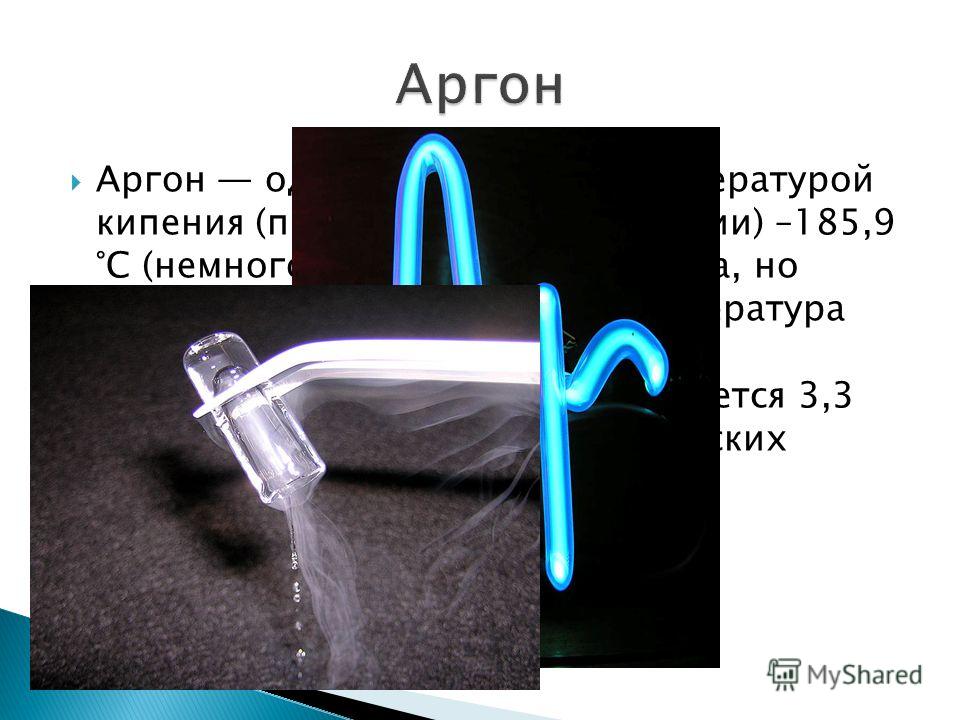


 1 Физиологическое действие
1 Физиологическое действие 1 Физиологическое действие
1 Физиологическое действие