Аргон молекулярная масса: Молярная масса аргона (Ar), формула и примеры
alexxlab | 05.03.2023 | 0 | Разное
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H |
58,08 |
|
Н-бутан (C4h20) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (h3) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10h32) |
142,30 |
|
Дифенил ( C12h20) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
| Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2h5) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
|
64,52 |
Атомная масса – аргон – Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Атомная масса аргона ( 39 9) больше, чем калия ( 39 1), а атомная масса кобальта ( 58 9) больше, чем никеля ( 58 7), однако Д. И. Менделеев поставил в периодической системе аргон перед калием, а кобальт перед никелем. Докажите, что они правильно размещены в системе.
[1]
И. Менделеев поставил в периодической системе аргон перед калием, а кобальт перед никелем. Докажите, что они правильно размещены в системе.
[1]
Отсюда видно, что атомная масса аргона в основном определяется тяжелым изотопом, а атомная масса калия – легким изотопом. Заряды же их ядер ( чем, собственно, и определяются свойства элементов) соответствуют расположению в таблице Менделеева. [2]
Так как молекула его одноатомна, атомная масса аргона равна молекулярной. [3]
В 1894 г английский химик Уильям Рамзай открыл новый химиче ский элемент аргон Этот благородный газ не взаимодействовал ни с каки ми известными к тому времени элементами, получил прозвище химический мертвец и задал химикам немало загадок В Периодической системе места для него не было, ведь атомная масса аргона больше, чем у калия, и меньше, чем у кальция Рамзай считал, что аргон следует помес тить в Периодическую систему после хлора и он должен предшествовать калию, но это была только догадка, в то время ничем конкретным не под твержденная Предложение Рамзая разместить аргон и открытые им вслед за этим элементом другие благородные газы в VIII группе поначалу не встретило поддержки Менделеева – ведь у этих химических индиви дуумов не было известно ни одного соединения Только в 1900 г Рамзай и другой английский химик Трэверс убедительно доказали, что аргон и другие благородные газы образуют отдельную группу химических элементов между галогенами и щелочными металлами Как они это сделали.
Изотопы аргона и калия приведены на с. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он встречается в природе в большом количестве), тогда как у калия преобладает изотоп с меньшим массовым числом. Таким образом, недостатков в периодической системе нет, с точки зрения величины зарядов атомных ядер элементы расположены правильно. [5]
Как известно, атомная масса элемента получается как средняя величина из массовых чисел его изотопов. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он встречается в природе в большем количестве), тогда как у калия преобладает изотоп с меньшим массовым числом. Таким образом, недостатков в периодической системе нет, и с точки зрения величины зарядов атомных ядер элементы расположены правильно. [6]
Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он встречается в природе в большом количестве), тогда как у калия преобладает изотоп с меньшим массовым числом.
Как известно, атомная масса элемента получается как средняя величина из массовых чисел его изотопов. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он встречается в природе в большем количестве), тогда как у калия преобладает изотоп с меньшим массовым числом ( см. с. Таким образом, недостатков в периодической системе нет, и с точки зрения величины зарядов атомных ядер элементы расположены правильно. [8]
Изотопы аргона и калия приведены на с. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он встречается в природе в большом количестве), тогда как у калия преобладает изотоп с меньшим массовым числом. [9]
Все величины выражены в приведенных единицах. При вычислении химической постоянной использована атомная масса аргона. [10]
[10]
Они дают возможность объяснить их аномальное размещение в периодической системе. Действительно, аргон характеризуется высоким содержанием тяжелого изотопа igAr, в то время как калий содержит очень высокий процент своего наиболее легкого изотопа igK – Поэтому средняя табличная атомная масса аргона оказалась выше, чем атомная масса калия. [11]
Изотопы этих элементов приведены на стр. Там же указано, что атомная масса элемента есть средняя величина из массовых чисел его изотопов. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом ( он находится в большем количестве), тогда как у калия преобладает изотоп с меньшим массовым числом. Таким образом, недостатков в периодической системе нет и с точки зрения величины зарядов атомных ядер элементы расположены правильно. [12]
Следовательно, эти две подгруппы должны составлять единую группу. Менделеевым было принято, что сопоставление элементов или их групп по величине атомных масс соответствует так называемой валентности их и, до некоторой степени, различию химических свойств соединений. Им отмечена особенность: в группах все элементы с малыми атомными массами резко отличаются по свойствам, поэтому они суть типические элементы групп. Нужно отметить, что для Менделеева атомные массы элементов служили канвой при составлении периодической системы. Истинной основой системы для него являются свойства веществ, образуемых элементами. Так, атомная масса аргона больше, чем у калия, но по свойствам калий – аналог натрия и лития, и Менделеев располагает калий после аргона. Точно так же он поступает, располагая кобальт перед никелем.
[13]
Им отмечена особенность: в группах все элементы с малыми атомными массами резко отличаются по свойствам, поэтому они суть типические элементы групп. Нужно отметить, что для Менделеева атомные массы элементов служили канвой при составлении периодической системы. Истинной основой системы для него являются свойства веществ, образуемых элементами. Так, атомная масса аргона больше, чем у калия, но по свойствам калий – аналог натрия и лития, и Менделеев располагает калий после аргона. Точно так же он поступает, располагая кобальт перед никелем.
[13]
Страницы: 1
Как найти молярную массу аргона?
Последняя обновленная дата: 31 декабря 2022 г.
•
Общее представление: 226,2K
•
Просмотр сегодня: 22,60K
Ответ
Проверено
226,2K+ виды
Hint
020202 226,2K+ виды
Hint 20202020202 226,2K+. к весу ядра.
к весу ядра.
Молярная масса Ar не является целым числом, а атомный номер Ar равен 18.
Полный ответ:
Итак, в вопросе задан вопрос, как мы будем определять или вычислять молярную массу аргона.
С того времени, как мы изучаем периодическую таблицу, мы очень хорошо знакомы с двумя терминами, относящимися к элементу, атомным номером и молярной массой элемента.
Атомный номер — это уникальный номер элемента, который является идентификатором элемента. Никакие два элемента не будут иметь одинаковый атомный номер. Атомный номер дает количество протонов и количество электронов, присутствующих в элементах, поскольку атомный номер будет равен количеству протонов и количеству электронов в элементе.
Здесь нас интересует элемент Ar, атомный номер которого равен 18. Таким образом, число присутствующих протонов и электронов также равно 18.
Теперь мы обсудим молярную массу или атомный вес элемента. Атомный вес равен весу ядра атома. Атомная масса равна сумме протонов и нейтронов, присутствующих в ядре.
Мы можем легко найти молярную массу с помощью таблицы Менделеева, атомная масса будет указана слева внизу химического символа элемента в таблице Менделеева. 9{40}}$ и мы берем среднюю массу этих изотопов, чтобы получить молярную массу Ar, и мы получим значение 39,948.
Примечание: Мы также можем найти значение атомной массы, если количество нейтронов и протонов присутствует в атоме, оно будет примерно равно атомной массе, поскольку многие атомы существуют как комбинация их изотопов в реальном мире. .
Если число молей аргона в взятой пробе и масса пробы известны, то мы можем найти молярную массу аргона, изменив уравнение
$\text{Нет}\text{.}\,\text{из}\,\text{кротов}\,\text{=}\dfrac{\text{Дано}\,\text{масса}}{ \text{Молярная}\,\text{масса}}$
$\text{Молярная}\,\text{масса=}\dfrac{\text{Данная}\,\text{масса}}{\text{Нет }\text{.}\,\text{of}\,\text{moles}}$
Молярная масса также называется молекулярной массой, молекулярной массой в граммах, формулой массы и т.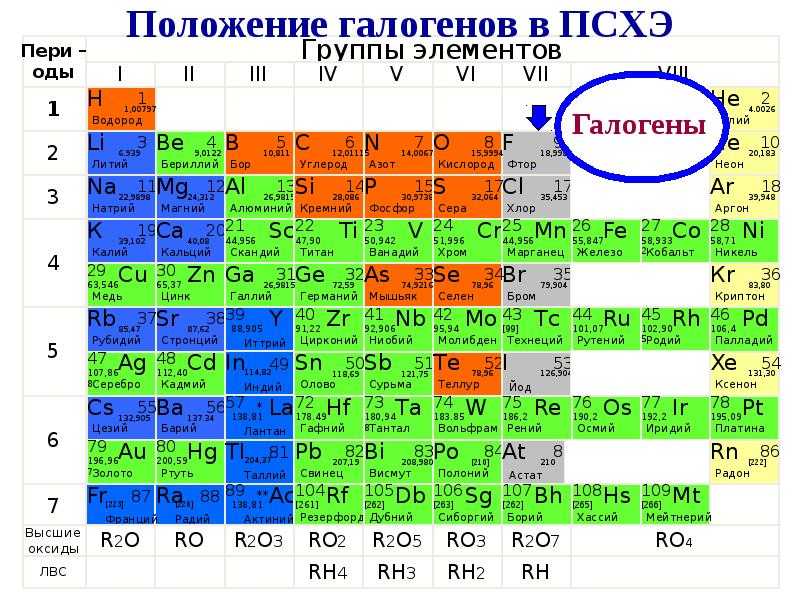 д.
д.
Единицей молекулярной массы является $\text{g /mol}$
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Тенденции сомнения
аргон
аргон –
Имена и идентификаторы| Name | Argon |
| Synonyms | Argon argongas argon-40 argon atom argonliquid ARGON ULTRAPLUS ARGON SPUTTERING argon,compressed argon,highpurity ARGON GIGAPLUS(TM) argon, охлажденнаяжидкость ARGON, PRESSURE TIN WITH 1 L argon,refrigeratedliquid(cryogenicliquid) |
| CAS | 7440-37-1 |
| EINECS | 231-147-0 |
| InChI | InChI= 1/Ar |
аргон –
Физико-химические свойства| Молекулярная формула | Ar |
| Молярная масса | 39.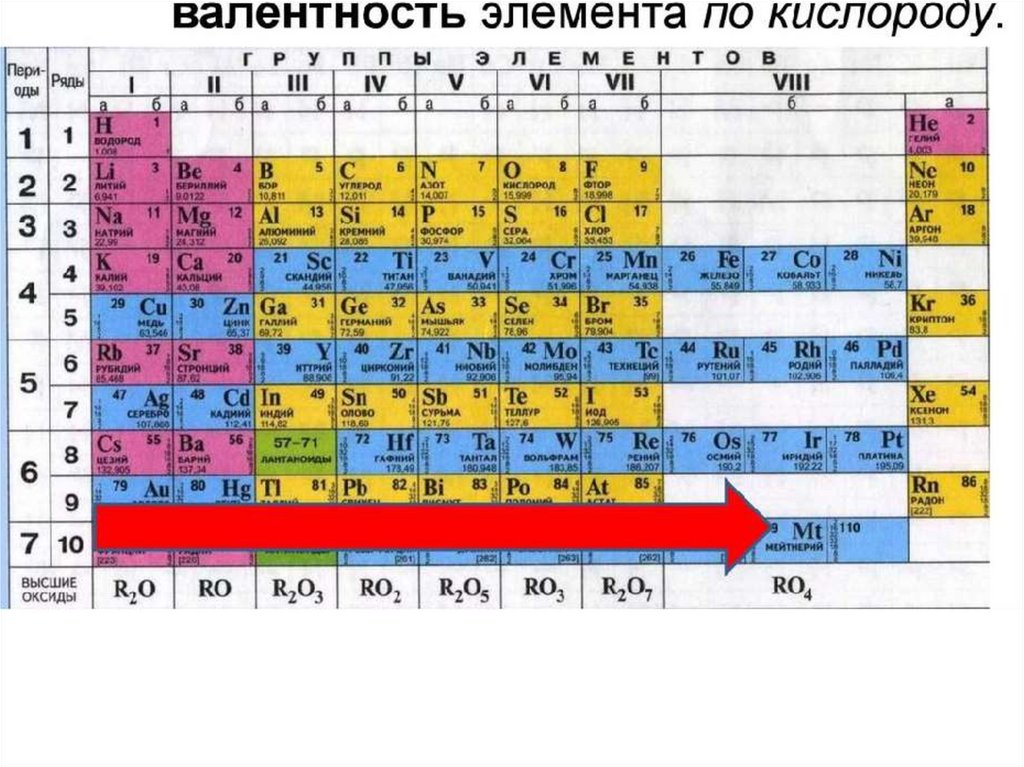 95 95 |
| Плотность | 1,784 (0 ℃) |
| Петиция | -189.2 ° C (Lit.) |
| . Точка болинг | |
| . Точка болинг | |
| . Растворимость в воде | 33,6 мл/1000 г ч3О (20°C) [KIR78]; Константы закона Генри, k×10?4: 3,974 (25,0°С), 5,359 (65,1°С), 5,342 (91,1°С), 3,812 (222,7°С), 2,541 (267,3°С), 1,870 (287,9°С). ) [POT78] |
| Давление пара | 343000 мм рт.ст. при 25°C |
| Плотность паров | 1,38 (21 ° C, VS AIR) |
| Внешний вид | Бесплатный газ |
| Merck | 13,788 | . Инертный. |
| Физические и химические свойства | Инертный газ с самым высоким содержанием в воздухе. Бесцветный, безвкусный, без запаха. точка плавления -189,2 ℃ температура кипения -185,7 ℃ относительная плотность 1,784 (0 ℃) растворим в воде, растворимость 5,6 г/см3 воды при 0 °C.  Также растворим в этаноле. Также растворим в этаноле. |
| Использование | Обычно используется в качестве инертного защитного газа, наполненного различными типами баллонов |
аргон –
Риск и безопасность| Описание техники безопасности | 38 – В случае недостаточной вентиляции наденьте подходящее респираторное оборудование. |
| UN ID | UN 1006 2.2 |
| WGK Германия | – |
| RTECS | CF2300000 |
| FLUKA BRAND F CODES | 4.5-31 |
| Hazard Class | 2.2 |
argon –
Upstream Downstream Industry| Сырье | Аммиак Аргон |
аргон –
Природа бесцветный, безвкусный, без запаха, нетоксичный газ, очень инертный газ. Относительная плотность газа составляла 21,1 при 101 °C и 1,38,3 кПа. Плотность газа 1-21,1. м-3 (101°С, 185,9. 3кПа), а плотность жидкости 101кг.м-3 (-°С, 3кПа). Температура кипения -185,9°С. Температура плавления -189,2°С. Критическая температура -122,3С, критическое давление 4.893МПа. Растворим в органических растворителях. Не горит, не токсичен, но при вдыхании легко удушает организм человека. Не вызывает коррозии.
Относительная плотность газа составляла 21,1 при 101 °C и 1,38,3 кПа. Плотность газа 1-21,1. м-3 (101°С, 185,9. 3кПа), а плотность жидкости 101кг.м-3 (-°С, 3кПа). Температура кипения -185,9°С. Температура плавления -189,2°С. Критическая температура -122,3С, критическое давление 4.893МПа. Растворим в органических растворителях. Не горит, не токсичен, но при вдыхании легко удушает организм человека. Не вызывает коррозии.
При высокой температуре повышается внутреннее давление в контейнере, возникает риск растрескивания и взрыва.
Последнее обновление:2022-01-01 08:54:51
аргон –
Метод подготовкиаргон извлекается путем разделения воздуха, то есть сжиженный воздух ректифицируется для получения аргона-сырца, а аргон-сырец может быть дополнительно очищен для получения аргона высокой чистоты.
Последнее обновление:2022-01-01 08:54:52
аргон –
Использование Аргон высокой чистоты используется в полупроводниковой промышленности в качестве защитного газа для производства кристаллов кремния и германия высокой чистоты; Может использоваться в качестве инертного газа для очистки, защиты и наддува системы; При химическом осаждении из паровой фазы применяют напыление, отжиг и другие процессы. Аргон высокой чистоты можно использовать в качестве газа-носителя для хроматографии, а также в качестве разбавляющего газа для газовых смесей в крупномасштабных интегральных схемах. Аргон широко используется для наполнения дуговых ламп, люминесцентных ламп и электронных ламп; Сварочный защитный газ; Используется в качестве защитного газа в производстве титана, кобальта и других активных металлов; В черной металлургии аргон применяют для продувки специальных сталей, с целью повышения качества стали, особенно расход большого количества аргона при производстве нержавеющей стали.
Аргон высокой чистоты можно использовать в качестве газа-носителя для хроматографии, а также в качестве разбавляющего газа для газовых смесей в крупномасштабных интегральных схемах. Аргон широко используется для наполнения дуговых ламп, люминесцентных ламп и электронных ламп; Сварочный защитный газ; Используется в качестве защитного газа в производстве титана, кобальта и других активных металлов; В черной металлургии аргон применяют для продувки специальных сталей, с целью повышения качества стали, особенно расход большого количества аргона при производстве нержавеющей стали.
Последнее обновление:2022-01-01 08:54:52
аргон –
Безопасность нетоксичен, является своего рода удушающим газом, высокая концентрация, парциальное давление кислорода снижено и удушье, концентрация аргона более 50%, вызывающие серьезные симптомы; Более 75% смерть может наступить в течение нескольких минут. Когда концентрация аргона в воздухе увеличивается, дыхание ускоряется, а концентрация не концентрируется, так что наступает смерть. Избегайте вдыхания высоких концентраций. Доступ к резервуарам, ограниченным пространствам или другим местам с высокой концентрацией должен контролироваться. Жидкий аргон может вызвать обморожение кожи; Попадание в глаза может вызвать воспаление. Хранить в прохладном вентилируемом складе. Хранить вдали от огня и источников тепла. Температура хранения не должна превышать 30 ℃. Должны храниться отдельно от легко (возможно) горючих, не смешанного хранения.
Избегайте вдыхания высоких концентраций. Доступ к резервуарам, ограниченным пространствам или другим местам с высокой концентрацией должен контролироваться. Жидкий аргон может вызвать обморожение кожи; Попадание в глаза может вызвать воспаление. Хранить в прохладном вентилируемом складе. Хранить вдали от огня и источников тепла. Температура хранения не должна превышать 30 ℃. Должны храниться отдельно от легко (возможно) горючих, не смешанного хранения.
Последнее обновление: 2022-01-01 08:54:53
Аргорон-
Справочная информация| NIST Chemical Information | Информация, предоставленная: webbook.nist.gov (Внешняя ссылка) | |
| информация предоставлена: ofmpeb.epa.gov (внешняя ссылка) | ||
| Введение | химический символ элемента аргона Ar, атомный порядок 18, расположен в 18 группе периодической таблицы, это редкий газ. Аргон составляет 0,934% от объема атмосферы (9340 частей на миллион по объему), является третьим по величине газом в атмосфере Земли, более чем в два раза превышает водяной пар (в среднем около 4000 частей на миллион по объему, но изменение очень велико), углекислый газ (400 частей на миллион по объему). ) в 23 раза больше, чем у неона (18 ppmv) более чем в 500 раз. Аргон является наиболее распространенным инертным элементом в земной коре, на его долю приходится 0,00015% земной коры. Известно 14 изотопов аргона, в том числе от аргона 33 до аргона 46. Большая часть аргонового элемента в земной атмосфере представляет собой аргон-40 (от распада калия-40 в земной коре). Аргон-36 является наиболее распространенным изотопом аргона во Вселенной, потому что он легче всего образуется при слиянии сверхновых. ) в 23 раза больше, чем у неона (18 ppmv) более чем в 500 раз. Аргон является наиболее распространенным инертным элементом в земной коре, на его долю приходится 0,00015% земной коры. Известно 14 изотопов аргона, в том числе от аргона 33 до аргона 46. Большая часть аргонового элемента в земной атмосфере представляет собой аргон-40 (от распада калия-40 в земной коре). Аргон-36 является наиболее распространенным изотопом аргона во Вселенной, потому что он легче всего образуется при слиянии сверхновых. | |
| История открытия | аргон (от греческого варианта), номенклатура связана с его химической активностью. Химические свойства этого первого открытого благородного газа впечатляли номенклатуру. В 1785 году Генри Квендиш заподозрил, что редкие газы входят в состав атмосферы. В 1849 году в Университетском колледже Лондона Джон Стрэт, бароны в третьем поколении Рэлей и Уильям Рамзил, путем удаления кислорода, углекислого газа, воды и азота в пробах чистого воздуха, впервые выделили аргон из воздуха. Они подтвердили, что азот, образующийся из химических соединений, на 0,5% легче, чем азот в атмосфере, с небольшими отличиями, но достаточно важный, чтобы привлечь их внимание на несколько месяцев. Они пришли к выводу, что в воздухе был другой газ, смешанный с азотом. Аргон также был случайно открыт в 1882 году в ходе исследования Х. Ф. Ньюолла и Уотта Нора Хертли. Они обнаружили новые эмиссионные спектры, которые не соответствовали уже известным в то время элементам. До 1957, химический символ аргона был «А», который позже был изменен на «Ar» до сих пор. Они подтвердили, что азот, образующийся из химических соединений, на 0,5% легче, чем азот в атмосфере, с небольшими отличиями, но достаточно важный, чтобы привлечь их внимание на несколько месяцев. Они пришли к выводу, что в воздухе был другой газ, смешанный с азотом. Аргон также был случайно открыт в 1882 году в ходе исследования Х. Ф. Ньюолла и Уотта Нора Хертли. Они обнаружили новые эмиссионные спектры, которые не соответствовали уже известным в то время элементам. До 1957, химический символ аргона был «А», который позже был изменен на «Ar» до сих пор. | |
| Источник | Аргон является 56-м наиболее распространенным элементом на Земле. Это самый распространенный из всех благородных газов в атмосфере. Фактически единственным источником аргона является атмосфера, в которой объем аргона составляет чуть менее 1%. | |
| Применение | Аргон используется, когда требуется инертная атмосфера. Его можно использовать отдельно или в смеси с другими инертными газами для заполнения ламп накаливания, люминесцентных ламп, лазеров и т. д. Заменяя кислород в лампе накаливания, можно предотвратить коррозию нити накала лампы кислородом. Он также используется в качестве неокисляющего газа при сварке и в качестве обезуглероживающего агента для стали, а также в качестве инертной атмосферы для выращивания в ней полупроводниковых кристаллов. д. Заменяя кислород в лампе накаливания, можно предотвратить коррозию нити накала лампы кислородом. Он также используется в качестве неокисляющего газа при сварке и в качестве обезуглероживающего агента для стали, а также в качестве инертной атмосферы для выращивания в ней полупроводниковых кристаллов. | |
| подготовка | существует более одного метода подготовки аргона. Наиболее распространенным является фракционирование жидкого воздуха. Аргон является побочным продуктом этого крупномасштабного коммерческого процесса. Во время фракционирования аргон кипит при фиксированной температуре. Затем его собирают и очищают древесным углем, чтобы отфильтровать гелий и другие газы, в результате чего образуется значительное количество аргона. | |
| Воздействие на здоровье | Аргон не токсичен, но действует как удушающий газ, он может вызывать удушье, замещая кислород в легких. Пары аргона могут вызвать головокружение и даже удушье. | |
| растворимость в воде (г/100 мл) | грамм растворяется на 100 мл воды: 4 г/20 ℃ следует погасить. | |
| токсичность | аргон сам по себе нетоксичен, но в воздухе наблюдается высокая концентрация аргона, то есть эффект удушья. | |
| назначение | обычно используется в качестве инертного защитного газа, наполненного различными типами колб используется в качестве защитного газа для плавки редких металлов, газа-носителя , газа нулевой точки, стандартного газа, калибровочного газа для химических, металлургических, газовых хроматографических и других приборов, также может использоваться для производства полупроводниковых устройств. используется в качестве заполняющего газа в производстве ламп. в основном используется для сварки и резки металлов, таких как легкие металлы, сварка и резка нержавеющей стали или специальной легированной стали, является наиболее широко используемой аргонно-дуговой сваркой в атмосфере тумана аргона. Для очистки полупроводников в промышленности обычно используется 5% водорода и 95% газовая смесь аргона в качестве защитной атмосферы для очистки кремниевых полупроводников.  Для плавки металлов, при плавке титана, циркония и других металлов, требуется аргон и другая инертная защитная атмосфера для реакции восстановления, но также используется в качестве дегазатора для плавки специальной стали. При применении плазмы смесь аргона и водорода в качестве плазмы может использоваться для производства электроэнергии с помощью магнитной жидкости и в качестве источника электрического света. Для плавки металлов, при плавке титана, циркония и других металлов, требуется аргон и другая инертная защитная атмосфера для реакции восстановления, но также используется в качестве дегазатора для плавки специальной стали. При применении плазмы смесь аргона и водорода в качестве плазмы может использоваться для производства электроэнергии с помощью магнитной жидкости и в качестве источника электрического света. инертный газ для упаковки. | |
| метод производства | аргонсодержащая фракция, извлекаемая из воздуха для получения кислорода, превращается в сырой аргон через аргоновую колонну, кислород из сырого аргона удаляется путем повторного гидрирования, и аргон высокой чистоты 99,99% ~ 99,999% получен после ректификации и денитрификации. Извлечение аргона из хвостового газа синтеза аммиака можно разделить на две категории: низкотемпературное разделение хвостового газа, отводимого после синтеза, и промывка жидким азотом, а также низкотемпературное разделение синтез-газа перед входом в колонну синтеза. |

