Атомная масса аргон: Вычислите абсолютную массу атома аргона, зная, что его относительная атомная масса равна 39,948 (66,314×10-24)
alexxlab | 08.03.2023 | 0 | Разное
Калий и аргон:
Отсюда видно, что атомная масса аргона в основном определяется тяжелым изотопом, а атомная масса калия – легким изотопом. Заряды же их ядер ( чем, собственно, и определяются свойства элементов) соответствуют расположению в таблице Менделеева.
А́томная едини́ца ма́ссы (обозначение а. е. м.), она же дальто́н, — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
Атомная,
или, точнее, внутриядерная энергия,
как и энергия химическая, представляет
собой энергию связи. Однако если в основе
химической энергии лежат электрические
силы связи между электронной оболочкой
и ядром атома, то атомная энергия есть
проявление действия иных сил связи,
существующих внутри атомного ядра. Эти
внутриядерные силы, природа Которых не
является электрической и до сих пор еще
не до конца изучена, соединяют, связывают
воедино, все внутриядерные частицы, так
называемые нуклоны.
Дефе́кт ма́ссы. В связи с различием в советской и зарубежной номенклатуре понятие дефекта масс не является однозначно определенным.
Советская номенклатура:
Дефе́кт ма́ссы — разность между массой покоя атомного ядра данного изотопа, выраженной в атомных единицах массы, и массовым числом данного изотопа. В современной науке для обозначения этой разницы пользуются термином избыток массы (англ. mass excess). Как правило, избыток массы выражается в кэВ.
Зарубежная номенклатура:
Дефе́кт
ма́ссы (англ. mass defect) — разность между
суммой масс покоя нуклонов, составляющих
ядро данного нуклида, и массой покоя
атомного ядра этого нуклида, выраженная
в атомных единицах массы. Обозначается
обычно .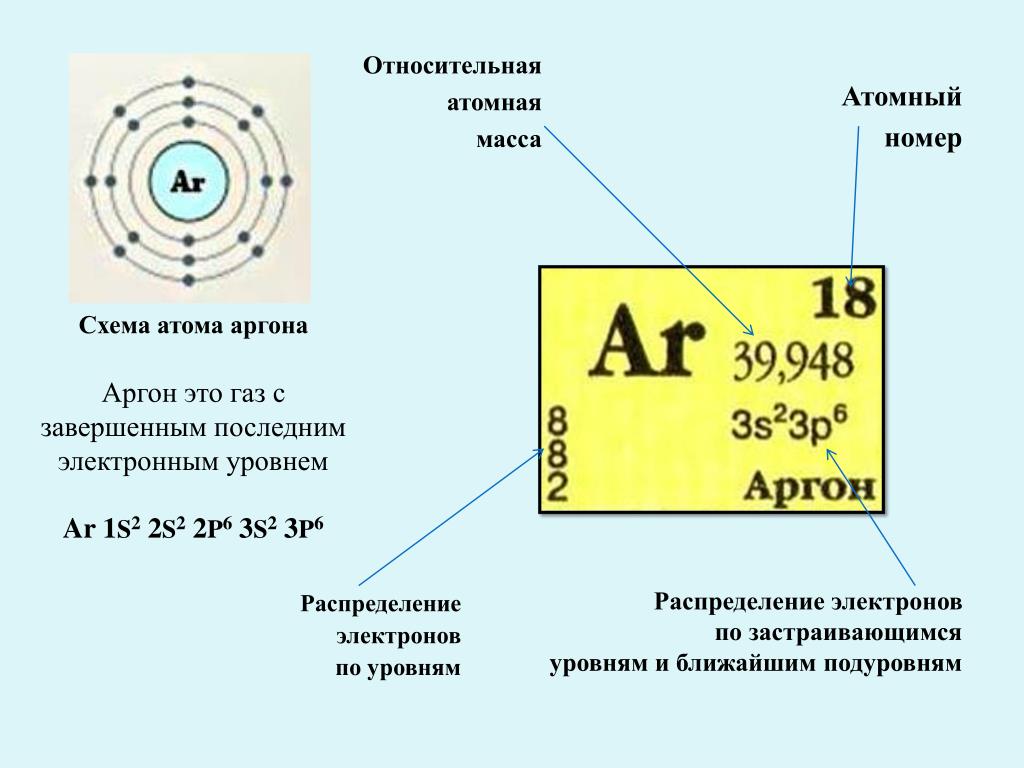
Радиоакти́вный распа́д— спонтанное изменение состава нестабильных атомных ядер (заряда Z, массового числа A) путём испускания элементарных частиц или ядерных фрагментов. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие элементы радиоактивными. Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Естественная радиоактивность — самопроизвольный распад ядер элементов, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции.
Распад, сопровождающийся испусканием альфа-частиц, назвали альфа-распадом; распад, сопровождающийся испусканием бета-частиц, был назван бета-распадом (в настоящее время известно, что существуют типы бета-распада без испускания бета-частиц, однако бета-распад всегда сопровождается испусканием нейтрино или антинейтрино). Термин
 Гамма-излучение часто
сопровождает другие типы распада.
Гамма-излучение часто
сопровождает другие типы распада.На практике получила большее распространение другая временная характеристика — период полураспада , равная времени, в течение которого число радиоактивных атомов или скорость распада уменьшаются в 2 раза.
Термоядерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые за счет кинетической энергии их теплового движения.
В общем виде уравнение радиоактивного распада может быть записано так: х -> у + а, где х – материнское ядро; у – дочернее ядро, а – прочие частицы.
Билет 19.Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Классическая теория электролитической
диссоциации основана на предположении
о неполной диссоциации растворённого
вещества, характеризуемой степенью
диссоциации α, т. е. долей распавшихся
молекул электролита. Динамическое
равновесие между недиссоциированными
молекулами и ионами описывается законом
действующих масс . Например, электролитическая
диссоциация бинарного электролита KA
выражается уравнением типа:
Например, электролитическая
диссоциация бинарного электролита KA
выражается уравнением типа:
Теория вернера????
Различают обратимый и необратимый гидролиз солей:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
, где — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
, где — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
Что значит аргон – Значения слов
аргон в словаре кроссвордиста
аргон
- Газ, соблюдающий нейтралитет
- Газ для сварки цветных металлов
- Химический элемент с позывным Ar
- Газ для заполнения ламп
- “сварочный” газ
- Предшественник калия в таблице
- Последыш хлора в таблице
- Газ из таблицы
- Идущий следом за хлором в таблице
- Восемнадцатый в таблице химических элементов
- Газ
- 18-й в химической таблице
- Мешанина из слова “онагр”
- 18-я графа химической таблицы
- Этот инертный газ не вступает практически ни в какие химические реакции, за что и получил своё название
- «Недеятельный» среди газов
- Какой газ замыкает третий период таблицы Менделеева?
- Инертный газ
- Третий элемент по распространённости в атмосфере после азота и кислорода
- Какой химический элемент можно получить, если к названию древнегреческого корабля добавить одну букву?
- Химический элемент, инертный газ
- 18-й в менделеевском строю
- Преемник хлора в таблице
- 18-й в таблице химическ.

- химическ. элемент под номером 18
- Газ с синим свечением
- 18-й в химическом строю
- В таблице он после хлора
- Этот газ используется и в установках пожаротушения, и в оперативной медицине, и в световой рекламе
- «Ar» в периодической таблице
- Мешанина из слова «онагр»
- «Сварочный» газ
- Наименование химического элемента
- Ar, химический элемент, благородный газ
- Газ, дающий синеватое свечение в электрических лампах и осветительных трубках
- Инертный газ, используется при сварке алюминия
- Сосед хлора
- “недеятельный” среди газов
- Газ из благородных
- Элемент, Ar
- Благородный газ
- Менделеев его назначил двадцатым
- Вслед за хлором в таблице
- Предтеча калия в таблице
- Следом за хлором в таблице
- Между хлором и калием в таблице
- Двадцатая графа Менделеева
- Менделеев его определил двадцатым
- Рекламный газ
- Инертный благородный газ
- Двадцатый в таблице Менделеева
- “Ar” в периодической таблице
- №18 согласно Менделееву
- Один из инертных газов
- Последователь хлора в таблице
- Между хлором и калием
- Менделеев его назначил двадцатым в таблице
- Перед калием в таблице
- Газ в синеголубых лампах
- В таблице он между хлором и калием
- Двадцатый инертный газ
- Его благородие газ
- После хлора в таблице
- В таблице он перед калием
- Восемьнадцатый элемент
Словарь медицинских терминов
аргон (Argon, Ar; греч.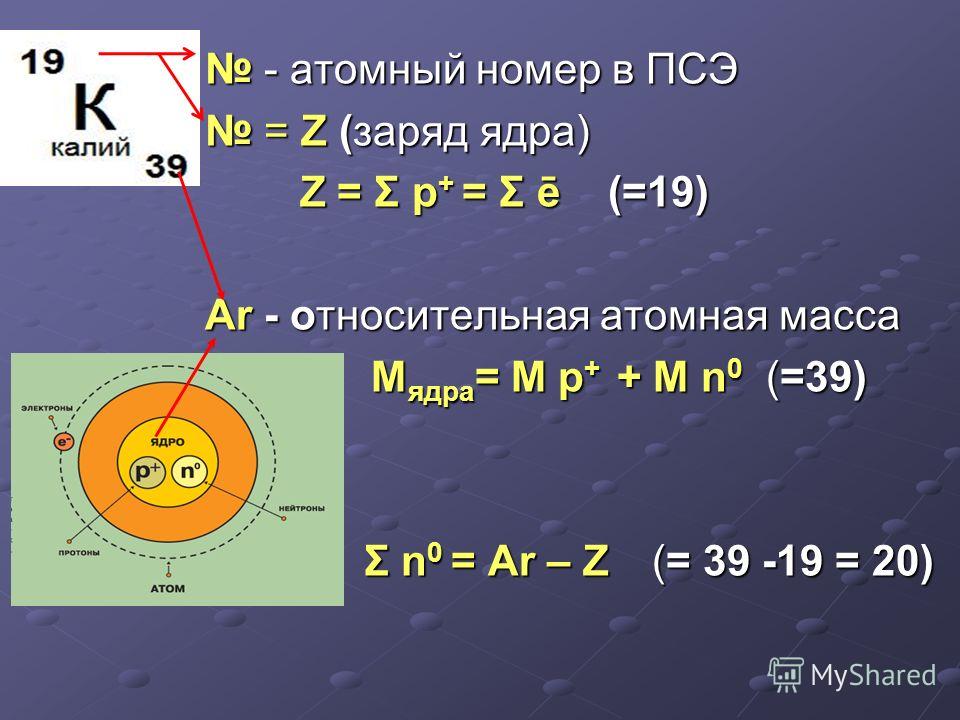 средн. род от argos бездеятельный, инертный)
средн. род от argos бездеятельный, инертный)
химический элемент восьмой группы периодической системы элементов Д. И. Менделеева, ат. номер 18, ат. вес (масса) 39,948; инертный газ, используется в анестезиологии при приготовлении дыхательных наркотических смесей.
Толковый словарь русского языка. С.И.Ожегов, Н.Ю.Шведова.
аргон
-а, м. Химический элемент, инертный газ без цвета и запаха, в электрических лампах и осветительных трубках дающий синеватое свечение.
прил. аргоновый, -ая, -ое.
Новый толково-словообразовательный словарь русского языка, Т. Ф. Ефремова.
аргон
м. Химический элемент, инертный газ без цвета и запаха, входящий в состав воздуха.
Химический элемент, инертный газ без цвета и запаха, входящий в состав воздуха.
Энциклопедический словарь, 1998 г.
аргон
АРГОН (лат. Argon) Ar, химический элемент VIII группы периодической системы, атомный номер 18, атомная масса 39,948, относится к благородным газам. Название от греческого argos – недеятельный. Плотность 1,784 г/л, tкип = 185,86°C. Применяют как инертную среду при сварке алюминия и других металлов и при получении сверхчистых веществ, для заполнения электрических ламп и газоразрядных трубок (сине-голубое свечение).
Большая Советская Энциклопедия
Аргон
(лат. Argon), Ar, химический элемент VIII гр. периодической системы Менделеева, относится к инертным газам ; атомный номер 18, атомная масса 39,948. При обычных условиях А. ≈ газ без цвета, запаха и вкуса. К открытию А. привело обнаруженное в 1892 Дж. Рэлеем превышение на 0,0016 г/л (при 0╟С и 101 325 н/м2) плотности азота из воздуха по сравнению с плотностью азота, полученного из его соединений. В 1894 Рэлей и У. Рамзай выделили из азота воздуха газ, обладающий химической инертностью (греч. argys ≈ бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII гр.
периодической системы Менделеева, относится к инертным газам ; атомный номер 18, атомная масса 39,948. При обычных условиях А. ≈ газ без цвета, запаха и вкуса. К открытию А. привело обнаруженное в 1892 Дж. Рэлеем превышение на 0,0016 г/л (при 0╟С и 101 325 н/м2) плотности азота из воздуха по сравнению с плотностью азота, полученного из его соединений. В 1894 Рэлей и У. Рамзай выделили из азота воздуха газ, обладающий химической инертностью (греч. argys ≈ бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII гр.
В природе А. присутствует только в свободном виде. Атмосфера содержит 16-1012т А., земная кора 0,165╥1012т, вода 0,752╥1012т. Объёмная концентрация А. в воздухе 0,93%. Атмосферный А. состоит из трёх стабильных изотопов: 36Ar (0,337% ), 38Ar (0,063% ) и 40Ar (99,600% ). Преобладание тяжёлого изотопа связано с его образованием при радиоактивном распаде природного калия 40K (в результате общее количество А. в атмосфере непрерывно возрастает). Вследствие высокого содержания 40Ar атомная масса Ar больше, чем у следующего за ним в таблице Менделеева К. Из искусственно полученных радиоактивных изотопов А. для радиоактивной метки наиболее пригоден 37Ar с периодом полураспада 35,0 дней. Плотность А. (при 0╟С и 101 325 н/м2) 1,7839 кг/м3, tпл ≈189,3╟C, tkип ≈185,9╟C. В 1 л воды при нормальных условиях растворяется 51,9 см3 А. В металлах А. практически не растворим. Молекула А. одноатомна. Энергия первичной ионизации А. велика (15,755 эв или 2,5241╥10-18адж), сродством к электрону А. не обладает. Все попытки получить валентные соединения А. оканчивались неудачей. А. способен образовывать соединения включения (клатраты) с веществами, имеющими в своих кристаллических решётках полости с размерами, приблизительно соответствующими диаметру атома А. (h3O, D2O, фенол, гидрохинон). Наиболее полно изучен Ar╥6h3O, впервые синтезированный в 1896 П. Вийаром при кристаллизации воды в атмосфере А. (давление А.
в атмосфере непрерывно возрастает). Вследствие высокого содержания 40Ar атомная масса Ar больше, чем у следующего за ним в таблице Менделеева К. Из искусственно полученных радиоактивных изотопов А. для радиоактивной метки наиболее пригоден 37Ar с периодом полураспада 35,0 дней. Плотность А. (при 0╟С и 101 325 н/м2) 1,7839 кг/м3, tпл ≈189,3╟C, tkип ≈185,9╟C. В 1 л воды при нормальных условиях растворяется 51,9 см3 А. В металлах А. практически не растворим. Молекула А. одноатомна. Энергия первичной ионизации А. велика (15,755 эв или 2,5241╥10-18адж), сродством к электрону А. не обладает. Все попытки получить валентные соединения А. оканчивались неудачей. А. способен образовывать соединения включения (клатраты) с веществами, имеющими в своих кристаллических решётках полости с размерами, приблизительно соответствующими диаметру атома А. (h3O, D2O, фенол, гидрохинон). Наиболее полно изучен Ar╥6h3O, впервые синтезированный в 1896 П. Вийаром при кристаллизации воды в атмосфере А. (давление А. 15,5 Мн/м2). температура разложения Ar╥6h3O при 101 325 н/м2 42,0╟C. А. с фенолом даёт соединение Ar╥3С6Н5ОН. В соединениях включения, например в SO2╥6h3O, можно SO2 изоморфно заместить Ar (работы Б. А. Никитина и др.), что даёт возможность синтезировать Ar╥6h3O при нормальном давлении.
15,5 Мн/м2). температура разложения Ar╥6h3O при 101 325 н/м2 42,0╟C. А. с фенолом даёт соединение Ar╥3С6Н5ОН. В соединениях включения, например в SO2╥6h3O, можно SO2 изоморфно заместить Ar (работы Б. А. Никитина и др.), что даёт возможность синтезировать Ar╥6h3O при нормальном давлении.
В промышленности А. получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение А. из продувочных газов колонн синтеза аммиака. Отделять А. от других инертных газов лучше всего газохроматографическими методами. А. широко используется при термической обработке легко окисляющихся металлов. В защитной атмосфере из А. проводят, например, сварку и резку различных редких и цветных металлов, плавку Ti, W, Zr и т.д. В атмосфере А. выращивают кристаллы полупроводниковых материалов. А. заполняют электрические лампочки (А. снижает скорость испарения вольфрама и позволяет увеличить светоотдачу). Аргоновые трубки применяют для рекламы (сине-голубое свечение). На определении отношения 40Ar : 40K. основан один из методов определения возраста минералов (см. Геохронология ). Радиоактивный А. иногда применяют для контроля вентиляционных систем.
основан один из методов определения возраста минералов (см. Геохронология ). Радиоактивный А. иногда применяют для контроля вентиляционных систем.
Лит: Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., Инертные газы, М., 1964; Головко Г. А., Аппараты и установки для производства аргона, М.≈Л., 1965; Финкельштейн Д. Н., Инертные газы, М., 1961; Бердоносов С. С., Инертные газы вчера и сегодня, М., 1966.
С. С. Бердоносов.
Википедия
Аргон
Арго́н — элемент 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 18. Обозначается символом Ar . Третий по распространённости элемент в земной атмосфере (после азота и кислорода ) — 0,93 % по объёму. Простое вещество аргон ( CAS-номер : ) — инертный одноатомный газ без цвета, вкуса и запаха.
Простое вещество аргон ( CAS-номер : ) — инертный одноатомный газ без цвета, вкуса и запаха.
Примеры употребления слова аргон в литературе.
Накануне вечером Аргон вызвал тех, кому предстояло принять участие в вылазке.
Она предпочла бы возглавлять отряд сама, однако вскоре убедилась: Аргон ведет людей уверенно, тропинка, от которой осталось одно название, мало его волновала.
Вскоре он обнаружил, что аргон еще более инертен, чем азот, и, очевидно, вообще не реагирует с каким-либо другим химическим веществом, то есть справедливо оправдывает свое греческое имя аргон — инертный.
Когда Рамзай разместил благородные газы в нулевой группе по их атомной массе — гелий 4, аргон 40, то обнаружил, что между ними есть место еще для одного элемента.
В этом кабинете ей не раз приходилось выслушивать из уст Аргона, коменданта легиона в Громбе, суровые нотации.
Взгляду Аргона предстали свежие, глубокие и кровоточащие раны – следы когтей стервятника.
Увидев Аргона утром, в наброшенном на кольчугу простом мундире десятника, с арбалетом за спиной и коротким гвардейским мечом на боку, она не поверила собственным глазам.
Армектанка беспокойно поглядывала на Аргона, но, к ее удивлению, он справлялся не хуже остальных.
Можно говорить, конечно, о таком же состоянии и в больших количествах, например для аргона, для йода.
Нужно обязательно спектрографическим путем изучить изотопный состав аргона из газов калийных месторождений, — наказывал Владимир Иванович.
Нашлось немало критиков, отрицавших элементарный характер нового элемента аргона именно потому, что его некуда поместить в периодической системе.
Ночь наступила, за нею день появился, но не дошел до ушей моих ни Аргона глас, ни Руро.
Ввиду всего этого мы решили взять несколько более северное направление в сторону Стена или даже Седана, чтобы проникнуть в Аргону, избегая дорог, по которым, по всей вероятности, движутся имперские войска.
Шампань, готовился подняться к Седану, имея в виду обойти Аргону с севера.
Изолированное пространство наполнилось аргоном, и на плутоний брызнула струйка фреона, чтобы все находилось в необходимом изотермическом состоянии.
Источник: библиотека Максима Мошкова
4.5: Исключения из Периодического закона
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49305
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
В процессе построения первой периодической таблицы Менделеев столкнулся с несколькими ситуациями, когда свойства элементов были несовместимы с тем положением, которое они вынуждены были бы занимать в порядке возрастания атомного веса. В таком случае Менделеев решил подчеркнуть свойства, потому что в 1870-х годах было трудно точно определить атомный вес. Он предположил, что некоторые атомные веса были ошибочными и что порядок элементов должен быть изменен, чтобы соответствовать химическому поведению.
В таком случае Менделеев решил подчеркнуть свойства, потому что в 1870-х годах было трудно точно определить атомный вес. Он предположил, что некоторые атомные веса были ошибочными и что порядок элементов должен быть изменен, чтобы соответствовать химическому поведению.
Один пример возникает при рассмотрении валентности калия (K) и аргона (Ar). Хотя калий имеет меньший атомный вес, чем аргон (39,10 против 39,95), валентные свойства калия предполагают, что он должен следовать за аргоном в периодической таблице. Менделееву не пришлось с этим спорить, потому что аргон, один из благородных газов, еще не был открыт в 1872 году, но он прекрасно иллюстрирует трудности. Когда мы подходим к K и Ar, в регулярной последовательности валентностей первых 24 элементов происходит разрыв.
Сравнение аргона и калия. Аргон с атомным номером 18 имеет атомную массу 39,95 ед. Калий с атомным номером 19 имеет атомную массу 39,10 ед.
Щелочной металл имеет меньший атомный вес, чем благородный газ, и стоит перед благородным газом в последовательности атомных весов. Все другие щелочные металлы следуют сразу за благородными газами (их атомный вес немного на больше ). Если бы мы не сделали исключения из порядка возрастания атомного веса для Ar и K, таблица Менделеева содержала бы странную аномалию. Одним из элементов в вертикальном столбце благородных газов будет чрезвычайно реактивный металл серебра, изображенный ниже, калий (K). Точно так же реактивная группа щелочных металлов будет содержать газ аргон, изображенный ниже, который не является металлом и очень нереакционноспособен.
Все другие щелочные металлы следуют сразу за благородными газами (их атомный вес немного на больше ). Если бы мы не сделали исключения из порядка возрастания атомного веса для Ar и K, таблица Менделеева содержала бы странную аномалию. Одним из элементов в вертикальном столбце благородных газов будет чрезвычайно реактивный металл серебра, изображенный ниже, калий (K). Точно так же реактивная группа щелочных металлов будет содержать газ аргон, изображенный ниже, который не является металлом и очень нереакционноспособен.
Предположение Менделеева о том, что более точные определения атомного веса исключат только что описанные ситуации, оказалось неверным. Атомные веса, используемые для K до Ar, являются современными, очень точными значениями, но они по-прежнему предсказывают неправильный порядок для Ar и K. Та же проблема возникает в случае Co и Ni и Te и I. По-видимому, атомный вес, хотя и связан к химическому поведению, не так фундаментален, как думали Менделеев и другие ранние разработчики периодической таблицы.
Эта страница под названием 4.5: Исключения из Периодического закона распространяется по лицензии CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон У. Мур, Джастин Шорб, Ксавьер Прат-Ресина. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Изменение земного изотопного состава и атомного веса аргона
Автор: Джон Карл Бёльке
https://doi.org/10.1515/pac-2013-0918
Твит
Ссылки
- Дополнительная информация: Индексная страница издателя (через DOI)
- Версия открытого доступа: Индекс издателя Страница
- Скачать цитату как: РИС | Дублин Ядро
Аннотация
Изотопный состав и атомный вес аргона (Ar) в земных материалах различны. Эти вариации являются источником неопределенности в определении стандартных свойств Ar, но они дают полезную информацию во многих областях науки. Изменения стабильного изотопного состава и атомного веса Ar вызваны несколькими различными процессами, в том числе (1) образованием изотопов из других элементов путем радиоактивного распада (радиогенные изотопы) или другими ядерными превращениями (например, нуклеогенные изотопы) и (2) изотопными изотопами. фракционирование с помощью физико-химических процессов, таких как диффузия или фазовое равновесие. Физико-химические процессы вызывают коррелированные зависящие от массы вариации изотопно-количественных отношений Ar ( 40 Ar/ 36 Ar, 38 Ar/ 36 Ar), тогда как процессы ядерных превращений вызывают изменения, не зависящие от массы. В то время как атмосферный Ar может служить обильным и однородным изотопным эталоном, отклонения от соотношений атмосферных изотопов в других проявлениях Ar ограничивают точность, с которой может быть указан стандартный атомный вес для Ar.
Эти вариации являются источником неопределенности в определении стандартных свойств Ar, но они дают полезную информацию во многих областях науки. Изменения стабильного изотопного состава и атомного веса Ar вызваны несколькими различными процессами, в том числе (1) образованием изотопов из других элементов путем радиоактивного распада (радиогенные изотопы) или другими ядерными превращениями (например, нуклеогенные изотопы) и (2) изотопными изотопами. фракционирование с помощью физико-химических процессов, таких как диффузия или фазовое равновесие. Физико-химические процессы вызывают коррелированные зависящие от массы вариации изотопно-количественных отношений Ar ( 40 Ar/ 36 Ar, 38 Ar/ 36 Ar), тогда как процессы ядерных превращений вызывают изменения, не зависящие от массы. В то время как атмосферный Ar может служить обильным и однородным изотопным эталоном, отклонения от соотношений атмосферных изотопов в других проявлениях Ar ограничивают точность, с которой может быть указан стандартный атомный вес для Ar. Опубликованные данные указывают на изменение атомного веса Ar в обычных земных материалах между примерно 39,7931 и 39..9624. Верхняя граница этого интервала дается атомной массой 40 Ar, так как некоторые образцы содержат почти чистый радиогенный 40 Ar. Нижняя граница получена на основе анализа настурана (уранового минерала), содержащего большое количество нуклеогенных 36 Ar и 38 Ar. В этом интервале измерения различных изотопных отношений ( 40 Ar/ 36 Ar или 38 Ar/ 36 Ar) с разным уровнем точности широко используются для исследований в области геохронологии, взаимодействия вода–порода, эволюции атмосферы. , и другие поля.
Опубликованные данные указывают на изменение атомного веса Ar в обычных земных материалах между примерно 39,7931 и 39..9624. Верхняя граница этого интервала дается атомной массой 40 Ar, так как некоторые образцы содержат почти чистый радиогенный 40 Ar. Нижняя граница получена на основе анализа настурана (уранового минерала), содержащего большое количество нуклеогенных 36 Ar и 38 Ar. В этом интервале измерения различных изотопных отношений ( 40 Ar/ 36 Ar или 38 Ar/ 36 Ar) с разным уровнем точности широко используются для исследований в области геохронологии, взаимодействия вода–порода, эволюции атмосферы. , и другие поля.
| Тип публикации | Артикул |
|---|---|
| Подтип публикации | Журнальная статья |
| Название | Изменение земного изотопного состава и атомного веса аргона |
| Название серии | Чистая и прикладная химия |
| DOI | 10. |


