Атомная масса медь: Молярная масса меди (Cu), формула и примеры
alexxlab | 20.01.2023 | 0 | Разное
МЕДЬ (Cu)
Основные параметры и свойства Меди
Свойства атома Меди |
|
|
Название |
Медь / Cuprum |
|
Символ |
Cu |
|
Номер |
29 |
|
Атомная масса (молярная масса) |
63,546 (3)а. е. м. (г/моль) |
|
Электронная конфигурация |
[Ar] 3d10 4s1 |
|
Радиус атома |
128 пм |
Химические свойства Меди |
|
|
Ковалентный радиус |
117 пм |
|
Радиус иона |
(+2e) 73 (+1e) 77 (K=6) пм |
|
Электроотрицательность |
1,90 (шкала Полинга) |
|
Электродный потенциал |
+0,337 В/ +0,521 В |
|
Степени окисления |
3, 2, 1, 0 |
|
Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
Термодинамические свойства простого вещества |
|
|
Плотность (при н. |
8,92 г/см3 |
|
Температура плавления |
1356,55 K (1 083,4 °С) |
|
Температура кипения |
2840,15 K |
|
Уд. теплота плавления |
13,01 кДж/моль |
|
Уд. теплота испарения |
304,6 кДж/моль |
|
Молярная теплоёмкость |
24,44 Дж/(K·моль) |
|
Молярный объём |
7,1 см3/моль |
Кристаллическая решётка простого вещества |
|
|
Структура решётки |
кубическая гранецентрированая |
|
Параметры решётки |
3,615 Å |
|
Температура Дебая |
315 K |
Прочие характеристики Меди |
|
|
Теплопроводность |
(300 K) 401 Вт/(м·К) |
|
Номер CAS |
15158-11-9 |
формула меди, масса меди, температура плавления, плотность, распределение электронов в атоме меди.

Медь (Cuprum, синонимы: сopper, cuprum, формула Cu, торговые названия: медь; медь черновая; порошок медный электролитический, регистрационный номер CAS 7440-50-8, порядковый номер в таблице Д.И. Менделеева 29, атомная масса 63.546, Тплавл.1083 0С, Ткип.2543 0С, плотн.8,92-8,94г/см3. Распределение электронов в атоме меди 1s22s22p63s23p63d104s1. Существуют два природных изотопа меди 63Cu и 65 Cu.)
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (СиOН) 2СO3. При нагревании на воздухе в интервале температур 200—375°С медь окисляется до черного оксида меди(II) СиО. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди(II), а внутренний — красный оксид меди(I)| Си2O. Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
При нагревании на воздухе в интервале температур 200—375°С медь окисляется до черного оксида меди(II) СиО. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди(II), а внутренний — красный оксид меди(I)| Си2O. Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди, изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Получение меди в лаборатории:
Порошкообразную медь можно получить восстановлением из соединений меди металлами или водородом: CuSO4+Zn→Cu+ZnSO4
Очень мелкодисперсную медь можно получить восстановлением оксида меди водородом:
CuO+H2→Cu+H2O
Токсикологические свойства меди:
Клиническая картина острого отравления: при вдыхании – першение в горле, чихание, кашель, сладкий вкус во рту, головная боль, слабость, покраснение зева и конъюнктивы, тошнота, боли в мышцах, рвота, диарея, разбитость, озноб, высокая температура.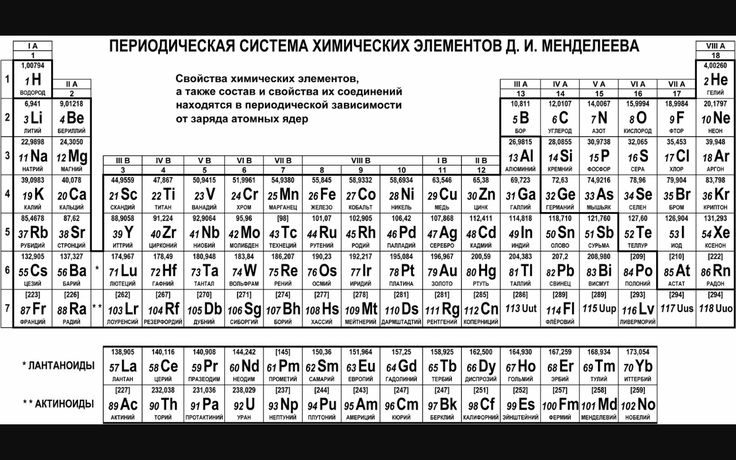
Наиболее поражаемые органы и системы: нервная, сердечно-сосудистая и дыхательная системы, желудочно-кишечный тракт, фосфорно-кальциевый обмен, печень, почки, кровь.
Раздражающее действие:
на кожу: нет. На глаза: нет.Первая помощь при отравлениях: при вдыхании – свежий воздух, покой, тепло. При попадании через рот – прополоскать ротовую полость водой, обильное питье воды, активированный уголь, солевое слабительное. При попадании на кожу – смыть проточной водой с мылом. При попадании в глаза – промыть проточной водой. В случае необходимости обратиться за медицинской помощью.
Нормативы : ПДК хоз.питьевой –0.1мг/дм3; ПДК рыб. хоз.–0.001 мг/дм3, класс опасности–3
Сплавы меди
Реакции с медью(взаимодействие меди)
Оксиды меди
Сульфат меди
Хлорид меди
Нитрат меди
Гидроксид меди
Анализ сточных вод определение меди
ГОСТ 859- 2001 Медь. Марки.;
Марки.;
ГОСТ52998-2008 Концентрат медный ТУ.;
ГОСТ27981.5-88 Медь высокой чистоты фотометрические методы анализа.;
ГОСТ 27981.1-88 Медь высокой чистоты методы атомно-спектрального анализа.;
ГОСТ 24048-80 Медь. Методы определения стойкости против водородной хрупкости.
Как рассчитать атомную массу меди?
Последняя обновленная дата: 15 января 2023 г.
•
Общее представление: 230,4K
•
Просмотр сегодня: 3,28K
Ответ
Проверено
230.4K+ виды
HINT: 20202 элемента зависит от ядра этого элемента. Итак, атомная масса любого элемента рассчитывается путем сложения общего количества протонов и нейтронов, присутствующих в ядре этого элемента. 9{63.5}Cu$, где верхнее значение дает информацию об атомной массе (${\text{A}}$), а нижнее количество дает информацию об атомном номере (${\text{Z}}$).
-Значит, атомная масса меди равна $63,5$, а атомный номер $29$.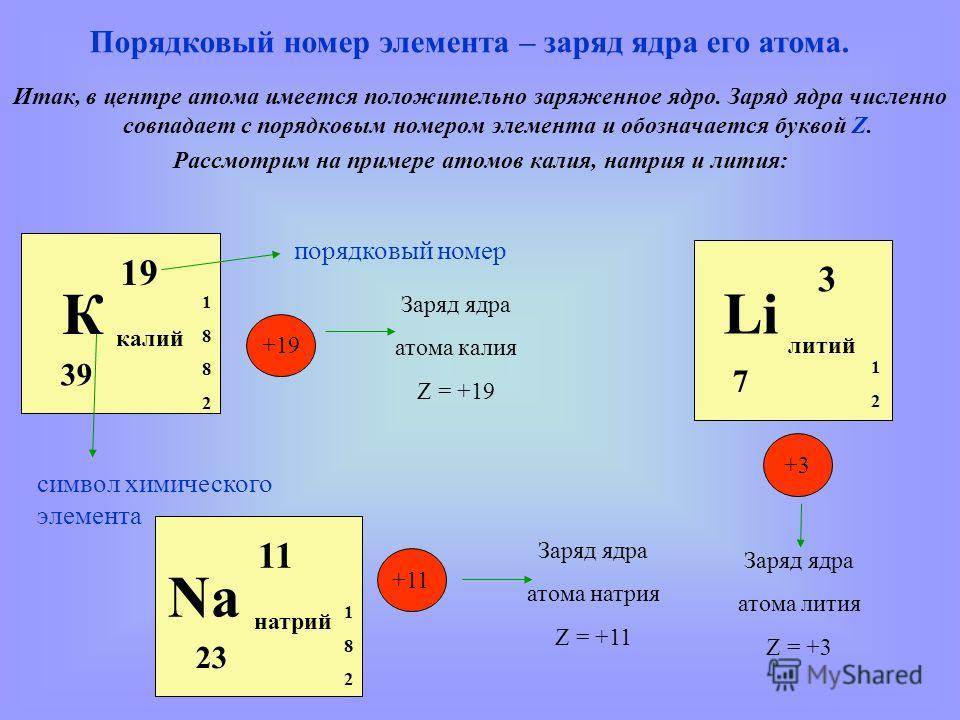
– Атомный номер всегда равен количеству электронов или протонов, присутствующих в нейтральном элементе.
-От ${\text{A = Z + }}$ нет. нейтронов, формула, мы можем рассчитать количество нейтронов следующим образом:{65}Cu$, нет. нейтронов составляет $36$. Медь является переходным металлом и присутствует в d-блоке периодической таблицы.
Примечание: Здесь некоторые из вас могут запутаться в предсказании атомной массы и атомного номера, увидев символ элемента, и сделать неверный расчет. Таким образом, всегда имейте в виду, что большое значение представляет собой атомную массу, а низкое значение представляет собой атомный номер.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Сомнения в тренде
Медь (Cu) состоит из двух встречающихся в природе изотопов с mas.
 ..
..3m
Воспроизвести видео:
Всем привет, в этом примере нам сказали, что у магния есть три стабильных изотопа со следующими атомными массами. Нам нужно определить количество протонов и нейтронов для каждого из этих изотопов и определить символ изотопа. Наш первый шаг — вспомнить, как выглядит символ изотопа. Таким образом, у нас будет наш элемент, представленный X. У нас будет наш атомный номер, представленный символом Z. И затем над этим у нас будет символ, представляющий нашу атомную массу. Итак, мы должны помнить, что Z — это наш атомный номер, а А — наша атомная масса. А. К. А — наше массовое число. Мы хотим напомнить, что также наш атомный номер Z равен нашему количеству протонов. И мы также хотим вспомнить тот факт, что мы можем найти атомную массу, взяв наше количество протонов и добавив это к нашему количеству нейтронов. Итак, когда мы найдем магний в периодической таблице, мы найдем его во второй группе а. И мы видим, что это соответствует атомному номеру или Z, равному значению 12.
 Итак, это наш первый ответ для нашего количества протонов и нашего количества нейтронов, а также наш изотопный символ для нашего первого изотопа здесь. Мы возьмем эту вторую массу с учетом 24 часов и вычтем ее из нашего числа протонов в магнии, которое, как мы подтвердили, равно 12 протонам. И эта разница дает нам значение в 13 нейтронов. Итак, чтобы завершить наш изотопный символ для нашего второго изотопа, у нас все еще был бы магний, у нас все еще был бы атомный номер 12. Однако теперь у нас будет масса, которую мы можем округлить до 24,9.. Так что мы можем округлить это до 25. Таким образом, наше массовое число для нашего второго изотопа теперь равно 25. И это наш второй ответ, который включает наше количество протонов, число нейтронов и наш изотопный символ для второго изотопа. И теперь у нас есть эта третья заданная масса, указанная как 25 м, вычтенная из 12 протонов, что дает нам разницу в 14 нейтронов. Итак, чтобы завершить наш третий символ изотопа, у нас все еще есть магний, у нас все еще есть количество протонов или атомный номер 12.
Итак, это наш первый ответ для нашего количества протонов и нашего количества нейтронов, а также наш изотопный символ для нашего первого изотопа здесь. Мы возьмем эту вторую массу с учетом 24 часов и вычтем ее из нашего числа протонов в магнии, которое, как мы подтвердили, равно 12 протонам. И эта разница дает нам значение в 13 нейтронов. Итак, чтобы завершить наш изотопный символ для нашего второго изотопа, у нас все еще был бы магний, у нас все еще был бы атомный номер 12. Однако теперь у нас будет масса, которую мы можем округлить до 24,9.. Так что мы можем округлить это до 25. Таким образом, наше массовое число для нашего второго изотопа теперь равно 25. И это наш второй ответ, который включает наше количество протонов, число нейтронов и наш изотопный символ для второго изотопа. И теперь у нас есть эта третья заданная масса, указанная как 25 м, вычтенная из 12 протонов, что дает нам разницу в 14 нейтронов. Итак, чтобы завершить наш третий символ изотопа, у нас все еще есть магний, у нас все еще есть количество протонов или атомный номер 12.


 у.)
у.)