Азот металл: Азот — степени окисления, свойства и реакции
alexxlab | 14.04.2023 | 0 | Разное
Азот — степени окисления, свойства и реакции
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.

Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.

Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода.
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
Азот и кислород в лазерной резке – Статьи компании «АГС»
С чего все начинается?
Поиск лазерного станка начинается с выбора типа и толщины металла, который необходимо обработать. После уточнения всех параметров Клиент получает долгожданный станок, но зачастую многие забывают о том, что станок необходимо обеспечить подачей вспомогательного газа (азота, кислорода или воздуха).
После уточнения всех параметров Клиент получает долгожданный станок, но зачастую многие забывают о том, что станок необходимо обеспечить подачей вспомогательного газа (азота, кислорода или воздуха).
Сегодня мы подробнее остановимся о том, какое оборудование следует приобрести для обеспечения вспомогательным газом лазерного станка.
Но сначала немного теории
Когда речь заходит о качестве газа, то как правило, говорят о процентном содержании основной молекулы в газе. Для азота и кислорода чистота, как правило, составляет 99% и несколько важных цифр после десятичной запятой. Соответственно, чем выше цифра после запятой – тем выше чистота (концентрация) газа. Таким образом, мы получаем всем знакомую систему записи чистоты газа, состоящую из N, X, Y, где Х – общее количество «девяток» в проценте чистоты, Y – последняя значащая цифра цифра после десятичной запятой в процентной записи:
|
Обозначение |
|
Концентрация газа |
|
N27 |
|
99. |
|
N48 |
|
99.998 |
|
N50 |
|
99.9999 |
Лазерная резка с использованием азота
Основную роль для достижения максимальной скорости при наилучшем качестве в лазерной резке с использование вспомогательного газа азота играют мощность лазерного излучения, диаметр фокального пятна и качество пучка. Азот используется для «выдувания» расплавленного металла из зоны резки и защиты металла от окисления.
Применение азота целесообразно, если окисление разрезаемого металла недопустимо, или по крайней мере нежелательно. Именно поэтому в технологическом процессе важно использование азота более высокой концентрации, так как даже малейшее присутствие кислорода может негативно сказаться на финальной заготовке. Хорошим маркером, говорящим о низкой концентрации используемого азота, является изменение цвета конечного среза.
Именно поэтому в технологическом процессе важно использование азота более высокой концентрации, так как даже малейшее присутствие кислорода может негативно сказаться на финальной заготовке. Хорошим маркером, говорящим о низкой концентрации используемого азота, является изменение цвета конечного среза.
Также стоит учитывать, что для достижения более качественного результата используется азот высокого давления (до 40 бар).
Лучшим решением для получения газообразного азота является адсорбционная азотная станция серии АВС. Из прошлых статей мы знаем, что мембранная технология не подходит для получения азота, с концентрацией выше 99.6%.
Для получения азота высокого давления используется азотный поршневой компрессор, диапазон сжатия которого от 15 до 40 бар. На популярных лазерных станках Trumph используется давление азота, не превыщающее 30-35 бар.
Однако существует множество нюансов, связанных с подбором азотной станции. Самая популярная ошибка, допускаемая инженерами, отвечающими за подбор адсорбционной азотной станции с дожимным компрессором высокого давления, состоит в следующем (расскажем на реальном примере):
Самая популярная ошибка, допускаемая инженерами, отвечающими за подбор адсорбционной азотной станции с дожимным компрессором высокого давления, состоит в следующем (расскажем на реальном примере):
Клиенту требуется 32 нм3/ч газообразного азота, концентрацией 99.9995%, давлением 30 бар.
После запуска станции выходные параметры строго соответствуют входному техническому заданию, однако после запуска лазерного станка происходит падение давления азота на входе в станок, и, как следствие, падение концентрации продуктового азота на выходе из азотной установки, что непременно ведет к ухудшению реза.
Чтобы такой ситуации не происходило, необходимо изначально учитывать, что каждому дожимному компрессору необходим буферный объем. Простыми словами, после дожимного компрессора необходимо установить несколько азотных ресиверов, объемом 0.25 нм3, рабочим давлением 40 бар (соответствующие ресиверы не попадают под регистрацию в Ростехнадзоре), либо подключить несколько газовых баллонов высокого давления (в конкретном случае необходимо установить 4 ресивера, либо моноблок из 16-20 баллонов).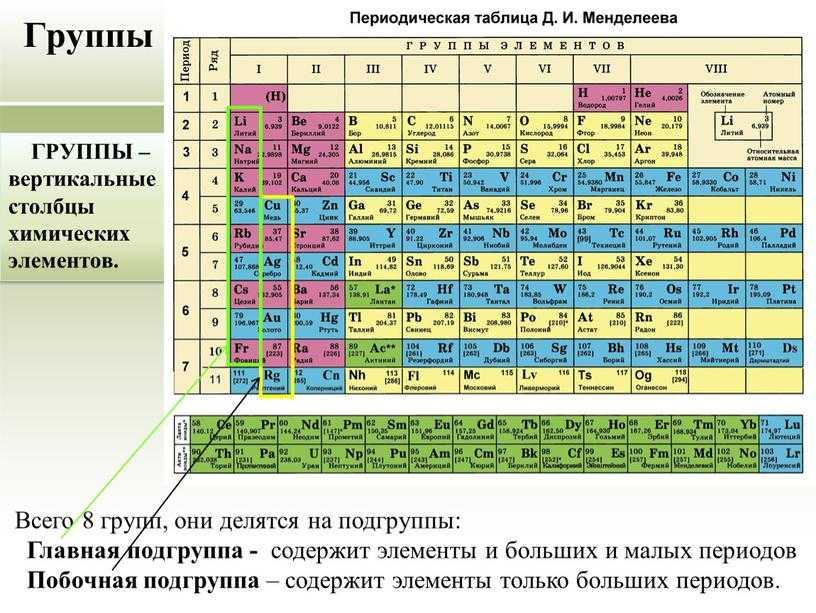 Таким образом решается несколько проблем, связанных с постоянной работой дожимного компрессора (любое оборудование, работающее на износ, требует повышенных затрат на обслуживание), а также появляется запасной объем продуктового азота, который будет выполнять роль буфера во время работы всей системы.
Таким образом решается несколько проблем, связанных с постоянной работой дожимного компрессора (любое оборудование, работающее на износ, требует повышенных затрат на обслуживание), а также появляется запасной объем продуктового азота, который будет выполнять роль буфера во время работы всей системы.
Преимущество лазерной резки с использованием азота – в отсутствии окислительных и экзотермических реакций (выделении большого количества тепла). Скорость реза при этом невелика, а также требуется более высокое давление сопутствующего газа. Металл не испарятся, а только плавится, что позволяет делать более качественный продукт.
|
Толщина разрезаемого листа, мм |
Мощность лазера, Вт |
Фокусное расстояние, дюймы |
Диаметр сопла, мм |
Давление азота, бар |
Скорость резки, м/мин |
|
2 |
1400-1500 |
5. |
1.40 |
8-10 |
2.00-4.00 |
|
4 |
1400-1500 |
7.50 |
1.70 |
12-15 |
1.00-1.20 |
|
2 |
3000 |
7. |
2.50 |
17-19 |
0.30-0.40 |
Лазерная резка с использованием кислорода
Кислород, в отличии от азота, более химически активный газ. В ходе резки с использованием кислорода образуется около 97% FeO и 3% Fe2O3, а также выделяется большое количество тепла. Это позволяет существенно увеличить скорость процесса резки, а также позволяет обрабатывать более толстый металл.
|
Толщина разрезаемого листа, мм |
Мощность лазера, Вт |
Фокусное расстояние, дюймы |
Диаметр сопла, мм |
Давление кислорода (избыточное), бар |
Скорость резки, м/мин |
|
2 |
800-1000 |
2. |
0.50-1.20 |
2.50-5.00 |
7 |
|
8 |
1200-1500 |
5.00 |
1.10-1.60 |
0.50-1.00 |
5 |
|
20 |
2200-2600 |
7. |
2.10-2.50 |
0.40-0.60 |
0.7 |
Чем толще металл, тем ниже давление кислорода необходимо подавать на лазерный станок. Однако, чем больше в кислороде примесей (чем ниже концентрация), тем медленнее происходит процесс резки и хуже результат.
Если в кислороде резать алюминий, то получаемые детали имеют неровные срезы с множеством заусениц, поэтому алюминий режется только в азоте. Низкосплавные стали тоже желательно подвергать лазерной резке с использованием азота, иначе детали, подлежащие окраске, будут плохо удерживать слой красящего вещества.
Адсорбционные азотные и кислородные станции позволяют отказаться от использования баллонного газа и от емкостей с жидкой азотом и кислородом.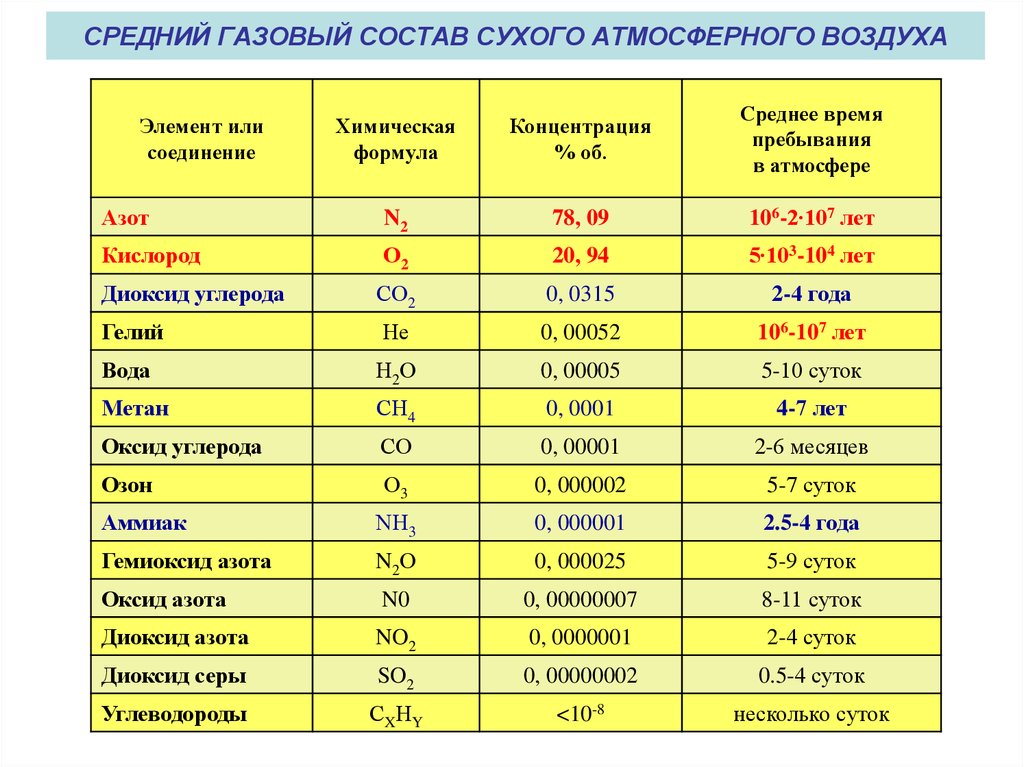 Оборудование работает в автоматическом режиме без присутствия оператора. Станция запускается от сигнала датчика давления в накопительном ресивере, который сообщает, что начался процесс отбора азота/кислорода станком. Контроль за технологическим процессом ведется на панели оператора Siemens, на которую выводятся все основные параметры.
Оборудование работает в автоматическом режиме без присутствия оператора. Станция запускается от сигнала датчика давления в накопительном ресивере, который сообщает, что начался процесс отбора азота/кислорода станком. Контроль за технологическим процессом ведется на панели оператора Siemens, на которую выводятся все основные параметры.
Мы часто встречаемся с ситуацией, когда на производстве Клиента присутствует действующее высокобарное компрессорное оборудование (дожимные бустеры до 400 бар), которое можно использовать в технологическом процессе получения газообразного азота для лазерного станка. Соответственно, имеются и ресиверы высокого давления. Таким образом можно установить только адсорбционную азотную станцию, подключив ее к существующей сети. Азот будет закачиваться в имеющийся ресиверный парк, а из него через редуктор поступать на лазерный станок.
Такая система позволяет иметь большое количество запасного газообразного азота, который может потребоваться в случае внезапного отключения электроэнергии или на время технического обслуживания компрессорного оборудования или адсорбционного генератора азота.
Заключение
В заключении хочется сказать, что за последнее время спрос на адсорбционные азотные станции с дожимным компрессором для производств, занимающихся лазерной резкой, значительно вырос. Этому способствует постепенный переход Клиентов на современные иностранные лазерные станки и осведомленность о современных методах получения азота. Баллонный газ остается востребованным только в тех случаях, где требуются небольшие объемы (5-30 нм3/сутки).
За последние годы нашей компанией было поставлено десятки азотных станций, отвечающих за бесперебойную работу лазерных станков на производствах России, производительностью от 30 до 400 нм3/ч при концентрации азота от 99.9995% и выше.
ВАРИАНТЫ ИСПОЛНЕНИЯ
|
РАМНОЕ ИСПОЛНЕНИЕ |
РАЗДЕЛЬНОЕ РАЗМЕЩЕНИЕ |
БЛОЧНО-МОДУЛЬНОЕ РАЗМЕЩЕНИЕ |
|
Оборудование изготавливается и монтируется на общую раму, на которой выполнена вся необходимая технологическая обвязка. |
Все оборудование доставляется на площадку Заказчика и размещается в помещении, согласно плана размещения. Далее оборудование обвязывается, подключается к электричеству и запускается в работу |
Блок-контейнер доставляется на площадку Заказчика в полной заводской готовности, размещается на заранее подготовленный фундамент, подключается к питанию и запускается в работу. |
Азот | Определение, символ, использование, свойства, атомный номер и факты
азот
Посмотреть все средства массовой информации
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- азотный цикл азотная кислота воздух биогенный газ жидкий азот
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
азот (N) , неметаллический элемент группы 15 [Va] периодической таблицы. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и входит в состав всего живого.
Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и входит в состав всего живого.
| атомный номер | 7 | |
|---|---|---|
| атомный вес | 14,0067 | |
| −209.86 °C (−345.8 °F) | ||
| boiling point | −195.8 °C (−320.4 °F) | |
| density (1 atm, 0° C) | 1.2506 grams/litre | |
| usual oxidation states | −3, +3, +5 | |
| electron configuration | 1 s 2 2 s 2 2 p 3 |
История
Примерно четыре пятых атмосферы Земли составляет азот, который был выделен и признан особым веществом во время первых исследований воздуха. Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в.
Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0073 азот .
Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0073 азот .
Возникновение и распространение
Среди элементов азот занимает шестое место по распространенности в космосе. Атмосфера Земли состоит из 75,51% по весу (или 78,09% по объему) азота; это основной источник азота для торговли и промышленности. В атмосфере также содержатся в различных небольших количествах аммиак и соли аммония, а также оксиды азота и азотная кислота (последние вещества образуются при грозах и в двигателе внутреннего сгорания). Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также встречается в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти залежи существуют в количествах, совершенно недостаточных для нужд человека. Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Индия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Коммерческое производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. В жидком состоянии азот имеет важные криогенные применения; кроме газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление паров при температуре кипения азота и поэтому существуют в виде кристаллических твердых тел при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого ухудшения качества продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора возгорания или взрыва. В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для лиофильной сушки и в холодильных системах. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для герметизации оболочек кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке твердым припоем, где он помогает предотвратить окисление, науглероживание и обезуглероживание. В качестве нереакционноспособного газа азот используется для изготовления вспененной или расширенной резины, пластмасс и эластомеров, в качестве пропеллента для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реактивных двигателей. В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
Азот | Определение, символ, использование, свойства, атомный номер и факты
азот
Посмотреть все средства массовой информации
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- азотный цикл азотная кислота воздух биогенный газ жидкий азот
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
азот (N) , неметаллический элемент группы 15 [Va] периодической таблицы. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и входит в состав всего живого.
| атомный номер | 7 |
|---|---|
| атомный вес | 14,0067 |
| Точка плавления | −209,86 ° C (−345,8 ° F) |
| Точка кипячения | −195. 8 ° C (−320,4 ° F) 8 ° C (−320,4 ° F) |
| DENELS (1 ATH ATH 0 ° C) | |
| (1 ATH ATH, 0 ° C). /litre | |
| usual oxidation states | −3, +3, +5 |
| electron configuration | 1 s 2 2 s 2 2 p 3 |
История
Примерно четыре пятых атмосферы Земли составляет азот, который был выделен и признан особым веществом во время ранних исследований воздуха. Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0073 азот .
Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0073 азот .
Возникновение и распространение
Среди элементов азот занимает шестое место по распространенности в космосе. Атмосфера Земли состоит из 75,51% по весу (или 78,09% по объему) азота; это основной источник азота для торговли и промышленности. В атмосфере также содержатся в различных небольших количествах аммиак и соли аммония, а также оксиды азота и азотная кислота (последние вещества образуются при грозах и в двигателе внутреннего сгорания).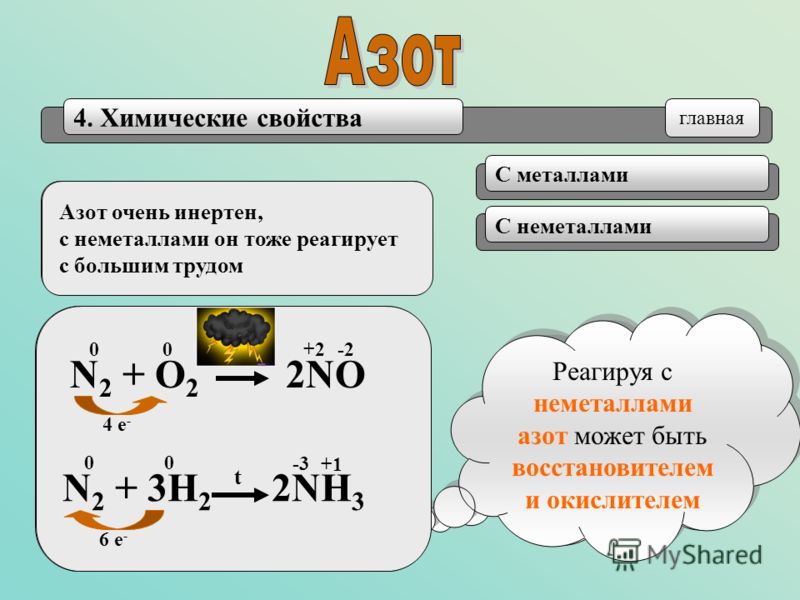 Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также встречается в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти залежи существуют в количествах, совершенно недостаточных для нужд человека. Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Индия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Коммерческое производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. В жидком состоянии азот имеет важные криогенные применения; кроме газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление паров при температуре кипения азота и поэтому существуют в виде кристаллических твердых тел при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого ухудшения качества продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора возгорания или взрыва. В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для лиофильной сушки и в холодильных системах.


 7
7
 00
00
 50
50
 50
50
 50
50