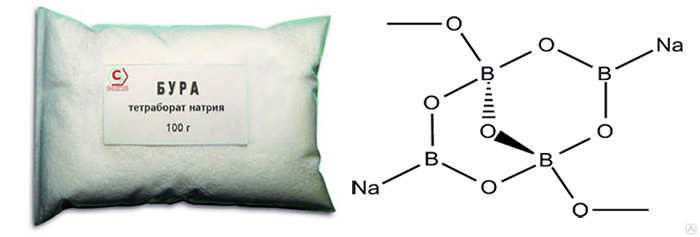
Бура формула химическая: Бура — полезное вещество для промышленности и быта
alexxlab | 29.05.2023 | 0 | Разное
Тетраборат натрия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Бура | химическое соединение | Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Britannica Beyond
Мы создали новое место, где вопросы находятся в центре обучения. Вперед, продолжать. Просить. Мы не будем возражать. - Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полёта на Луну до управления космосом — мы исследуем широкий спектр тем, которые подпитывают наше любопытство к космосу!
Содержание
- Введение
Краткие факты
- Факты и сопутствующий контент
Метанол — Sciencemadness Wiki
Метанол или метиловый спирт — простейший спирт с формулой CH 3 OH , также сокращенно MeOH . Это легкая, бесцветная, летучая, легковоспламеняющаяся жидкость. Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Это легкая, бесцветная, летучая, легковоспламеняющаяся жидкость. Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.1.1 Идентификация метанола
- 5.2 Хранение
- 5.3 Утилизация
- 5.1 Безопасность
- 6 ссылок
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Метанол является исходным продуктом для многих органических соединений, таких как формальдегид, который получают путем окисления метанола.
- CH 3 OH + [O] → CH 2 O + H 2 O
Метанол горит при воспламенении на воздухе с образованием двуокиси углерода и паров воды. В качестве побочного продукта образуются мельчайшие следы формальдегида, если при горении не происходит избытка кислорода.
В качестве побочного продукта образуются мельчайшие следы формальдегида, если при горении не происходит избытка кислорода.
- 2 канала 3 OH + 3 O 2 → 2 CO 2 + 4 H 2 O
Реакция метанола с галогеновой кислотой, такой как йодистоводородная кислота, дает йодистый метил.
- CH 3 OH + HI → CH 3 I + H 2 O
В отличие от этанола, добавление аниона гипохлорита к метанолу дает не хлороформ, а метилгипохлорит, очень опасный и нестабильный соединение, которое быстро разлагается и может даже взорваться при высоких концентрациях.
- CH 3 OH + 2 NaClO → CH 3 ClO + NaCl + NaOH
Пары метанола в воздухе разлагаются в течение нескольких дней с образованием углекислого газа и водяного пара. [2]
Метанол также используется в производстве биодизеля.
Физический
Метанол представляет собой бесцветную летучую легковоспламеняющуюся жидкость со спиртовым запахом. Он имеет молекулярную массу 32,04, температуру кипения 65 °С и плотность 0,7914 г/см 9 .0152 3 . [3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
Он имеет молекулярную массу 32,04, температуру кипения 65 °С и плотность 0,7914 г/см 9 .0152 3 . [3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
Доступность
Метанол доступен по низкой цене у большинства поставщиков химикатов.
Тип антифриза и автомобильного очистителя, известный как Heet, можно найти на большинстве заправочных станций в Соединенных Штатах, и он содержит метанол на 99% или выше. Некоторые альтернативные виды топлива полностью или в основном состоят из метанола, и из-за обычно продаваемых больших количеств это может быть очень эффективным способом его покупки.
Метанол иногда продается в магазинах красок в виде древесного спирта или метилового спирта. [4] Его также можно купить у научных поставщиков в более высоких классах. Поставки оборудования иногда продают метанол как «метилгидрат». Наконец, некоторые домашние камины используют в качестве топлива метанол, поэтому его также можно найти таким образом. Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
Наконец, некоторые домашние камины используют в качестве топлива метанол, поэтому его также можно найти таким образом. Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
В некоторых странах продажа «чистого» (высокочистого) метанола может регулироваться, поскольку он классифицируется как яд или из-за его использования в поддельном спирте. С мая 2018 года продажа средств для мытья окон, содержащих более 0,6% метанола, ограничена в странах ЕС, хотя во многих странах этот запрет, по-видимому, в значительной степени игнорируется, или средства для мытья окон на основе метанола были перемаркированы как технический спирт для общего использования и целей. . [5]
Подготовка
В промышленности метанол получают реакцией монооксида углерода и водорода на катализаторе (обычно это смесь оксидов меди и цинка) при высоких температурах и давлениях.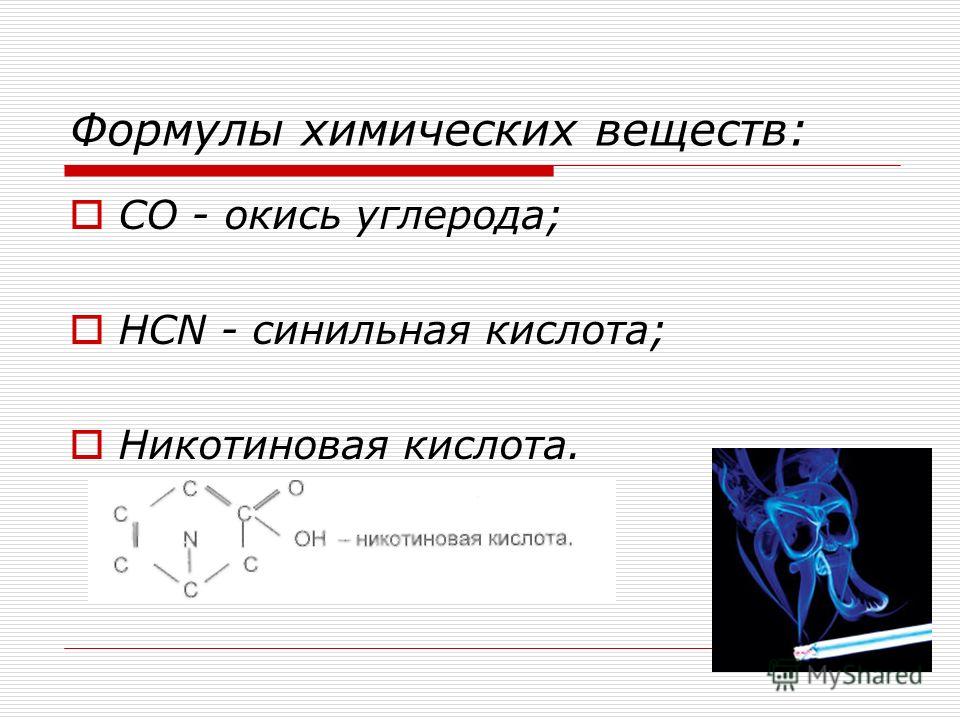 Этот маршрут не практичен в лабораторных масштабах.
Этот маршрут не практичен в лабораторных масштабах.
Неочищенный метанол можно получить деструктивной перегонкой древесины. Этот процесс экономически нецелесообразен в небольших масштабах и дает много побочных продуктов / загрязняющих веществ, в том числе уксусную кислоту, ацетон и смолы. Тем не менее, это все еще интересный процесс, и его можно было бы попробовать исключительно в образовательных целях. [6]
Другой возможный способ получения включает гидролиз метиловых эфиров, таких как метилбензоат. [7] Этот способ позволяет получить гораздо более чистый метанол.
Проекты
- Производство формальдегида
- Сделать триметилборат
- Получение метилсалицилата и других метиловых эфиров
- Синтез йодистого метила
- Синтез диметилового эфира
- Топливный элемент прямого действия на метаноле
- Отделение мочевины от солей аммония (мочевина хорошо растворяется в метаноле, но сульфат аммония, например, нет)
Обращение
Безопасность
Метанол значительно более токсичен, чем другие распространенные спирты, такие как этанол или изопропанол, поскольку он метаболизируется к муравьиной кислоте в организме, вызывая слепоту и смерть при высоких дозах. По возможности следует избегать вдыхания паров и контакта с кожей.
По возможности следует избегать вдыхания паров и контакта с кожей.
Случайное проглатывание большого количества метанола приведет к слепоте, а дозы выше 10 мл могут оказаться смертельными. При случайном употреблении метанола первая помощь заключается в том, чтобы дать больному этанол, перорально, водку или другой пищевой спиртосодержащий напиток, а затем немедленно вызвать скорую помощь. Этанол не нейтрализует действие метанола, а конкурирует с ним и препятствует его немедленному метаболизму, что дает врачам больше времени для спасения пациента.
Пламя метанола, как правило, имеет чрезвычайно низкую видимость, особенно в дневное время или в хорошо освещенных помещениях, что затрудняет обнаружение горящего метанола и создает большой риск. Если он используется в случаях, когда возможно возгорание, добавление небольшого количества борной кислоты окрашивает пламя в зеленый цвет и позволяет его увидеть.
Идентификация метанола
Учитывая, что метанол очень похож на этанол по свойствам (запах практически идентичен, их плотность также очень похожа), важно иметь хороший метод различения метанола и этанола.
Поскольку даже минимальное количество примесей в метаноле окрашивает пламя, сжигание спирта — не лучший способ определить, метанол ли у вас там.
Грубый способ обнаружения метанола заключается в том, чтобы поместить раскаленный кусок медной проволоки в спирт. Если пары имеют резкий запах типа «морга» (запах формальдегида), то спирт может содержать метанол. Однако этот метод не очень надежен, так как многие другие соединения могут давать похожий запах, и не каждый человек воспринимает запах формальдегида одинаково, обычно из-за генетики или других биологических факторов.
Лучший способ проверить, содержит ли ваш спирт метанол или это метанол, это добавить небольшое количество вашего спирта к легкому алкану, такому как пентан, гексан или гептан, к спирту, так как алканы смешиваются с этанолом, а метанол не смешивается. . Если ваш спирт образует отдельный слой, это не вода, то это метанол. Это лучше всего работает с почти безводным спиртом, но не подходит для пищевого спирта, который обычно содержит воду или некоторые другие органические соединения, которые мешают тесту.
Хранение
Метанол лучше всего хранить в стеклянных или пластиковых бутылях вдали от открытого огня, так как он очень летуч и легко воспламеняется. Убедитесь, что вы четко обозначили бутылку, чтобы отличить ее от менее токсичного и аналогичного этанола.
Утилизация
Сжигание метанола — хороший способ его уничтожения. Делайте это на улице или в вытяжном шкафу. Поскольку метанол горит почти невидимым пламенем, что может представлять серьезную опасность, рекомендуется сделать пламя видимым, смешав метанол с другим растворителем, таким как этанол или ацетон. Старайтесь не сжигать слишком много сразу, чтобы предотвратить его испарение в воздухе или вдыхание продуктов парциального окисления, таких как формальдегид, муравьиная кислота или окись углерода.
Ссылки
- ↑ http://en.wikipedia.org/wiki/Метанол
- ↑ http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=887&loc=ec_rcs#itabs-2d
- ↑ Справочник CRC по химии и физике, 66-е издание, 1985 г.