Бура химическая формула: Бура — полезное вещество для промышленности и быта
alexxlab | 09.04.2023 | 0 | Разное
Бура (натрия тетраборат 10-водный), 200гр
INCI Name: Sodium tetraborate
Химическая формула: Na2B4O7*10h3O
Синонимы: натрий тетраборат декагидрат, бура, натрия тетраборат
Внешний вид: бесцветный кристаллический порошок, в массе белого цвета
Химические характеристики:
Температура плавления 742°C
Плотность 2,37 г/см3 (20°C)
Для рук:
При сильной потливости рук рекомендуют подержать их в такой ванночке: в 3-х стаканах воды растворить 1 ч.л. буры, положить в полученный раствор туалетное мыло, чуть подождать, чтобы оно размокло, слегка помешать воду. В полученной ванночке держат руки 5 минут, вытаскивают, стряхивают капли (при этом руки не вытирают) и сразу же смазывают глицерином. Спустя несколько минут избыток глицерина можно вытереть полотенцем.
Стоит отметить, что после прямого контакта с бурой необходимо тщательно мыть руки и не допускать ее попадания внутрь, поскольку препарат признан токсическим и запрещен в качестве пищевой добавки, потому что губительно воздействует на клетки почек и печени.
Для лица:
Использование буры в косметологии для лица помогает хорошо очищать поры от загрязнений и устранять пигментные пятна.
Для чистки кожи можно смешать перемолотую в «пудру» буру и каолин в соотношении 2:1 и добавить воды до получения пастообразной консистенции. Лицо сначала протирают спиртом, кожу под глазами обильно смазывают маслом или же кремом, а затем наносят пасту на лицо ровным слоем (можно использовать шпатель) и выдерживают около 25 мин. По прошествии времени массу снимают шпателем и тщательно умываются водой. Досуха вытираются и наносят питательный крем.
В качестве отбеливающей маски можно использовать следующий рецепт: 0,25 кг. творога, 1 ст.л. камфорного спирта, 1 ст.л. борной кислоты и буры, по 1 ч.л. перекиси и нашатыря. Все хорошо смешать и нанести на лицо на 15-20 мин, а затем удалить теплой водой.
Рецепты для волос:
Бура в косметологии прекрасно справляется с грязными волосами. К тому же она сводит на нет шелушение, зуд кожного покрова головы, а также уменьшает активность имеющихся бактерий на нем.
В качестве шампуня для волос можно использовать косметическую буру, которую необходимо добавить в воду в соотношении 1/8 стакана буры на 4 л. воды. Брать большую концентрацию не рекомендуется, поскольку это негативно скажется на состоянии волос. Полученный шампунь хорошо взболтать и разлить по емкостям. Вымытые бурой волосы нужно будет сполоснуть лимонной кислотой.
Также можно приготовить еще вот такой шампунь: в емкость вливают 0,25 л. горячей воды, всыпают 1 ч.л. буры, и 1 ст.л. мыльного порошка. Все хорошо смешивается и наносится на волосы. Вместо воды можно воспользоваться ромашковым раствором, предварительно профильтровав его.
Применение в косметике: бура – натуральный минерал, широко применяемый в косметической промышленности. Используется в кремах, лосьонах, шампунях, гелях, соли и бомбочках для ванны.
В сочетании с лимонной кислотой в бомбочках для ванн даёт эффект бурления, в смеси с водой и гуаровой камедью может применятся в качестве геля для душа.
Лечебное применение: наружно, как антисептическое средство у взрослых для полосканий, смазывания кожи (при опрелостях, пролежнях).
Концентрация и способы применения:
- В косметических средствах – не более 5%. Развести в горячей (75 С) воде, после чего добавить в крем.
Бура используется в приготовлении крема, как эмульгатор, для получения густой консистенции, то есть делает из жидких фаз собственно крем. Плюс как легкий консервант, т.к. является антисептиком.
Бура сушит кожу, поэтому ее лучше добавлять в крем для жирной и пористой кожи.
Производитель: Турция
Годен до 09.2024 года
Борная кислота
Главная / Кислоты / Борная кислота – Н3ВО3
%D
%d.%M.%y
%h~:~%m
Бо́рная кислота́ (ортоборная кислота) — слабая кислота, имеющая химическую формулу H3BO3.
структура плоского слоя в ортоборной кислоте
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трех модификациях — наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Ее кислотные свойства обусловлены не отщеплением протона Н+, а присоединением гидроксильного аниона:
- Ka = 5.8·10−10 моль/л; pKa = 9.24.
Она легко вытесняется из растворов своих солей большинством других кислот. Соли ее, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная. Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
Соли ее, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная. Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
- Избытком щелочи они могут быть переведены в метабораты:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведенным).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
Наиболее распространенной солью борной кислоты является декагидрат тетрабората натрия Na2B4O7·10H2O (техническое название — бура).
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Применение
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе.
- Борное удобрение
- В лабораториях применяют для приготовления буферных растворов
- В медицине — как самостоятельное дезинфицирующее средство, а также в виде 2% раствора – для промывки кожи после попадания щелочей
- Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.

- В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В пищевой промышленности — зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[1]).
- В игре Новус борной кислотой натирают игровой стол для лучшего скольжения фишек.
- В ювелирном деле — как основа флюсов для пайки золотосодержащих сплавов.
- В промышленности – связующее при кислой футеровке печей.
Бура — Sciencemadness Wiki
Бура или борат натрия , тетраборат натрия , является важным соединением бора. Он имеет химическую формулу Na 2 B 4 O 7 .
Содержание
- 1 Свойства
- 1.1 Химическая промышленность
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.

- 5.2 Хранение
- 5.3 Утилизация
- 5.
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Борат натрия реагирует с сильной кислотой с выделением борной кислоты.
- NA 2 B 4 O 7 · 10H 2 O + 2 HCL → 4 H 3 BO 3 + 2 NACL + 5 H 2 O
Добавление перекиси водорода, гидроксида натрия к пентагидрату бората натрия дает перборат натрия.
- NA 2 B 4 O 7 · 5 H 2 O + NAOH + 2 H 2 O 2 → NA 2 B 2 O 4 (OH). 4 + NaOH + 5 H 2 O + 3/2 O 2
Когда буру добавляют в пламя, она окрашивается в желто-зеленый цвет. Поскольку желтое пламя натрия нежелательно, борная кислота используется в фейерверках вместо буры для зеленого пламени и в виде раствора в метаноле для чистого зеленого пламени.
Поскольку желтое пламя натрия нежелательно, борная кислота используется в фейерверках вместо буры для зеленого пламени и в виде раствора в метаноле для чистого зеленого пламени.
Бура — основной материал для производства боросиликатного стекла. В отличие от борной кислоты он не летуч и может использоваться в высокотемпературных химических реакциях в качестве источника бора.
Физический
Бура представляет собой белое кристаллическое твердое вещество. Он не имеет запаха и имеет неприятный вкус. Бура плавится при 743°С и кипит при 1575°С. Он имеет плотность 1,73 г/см 3 . Бура плохо растворима в холодной воде, но ее растворимость увеличивается с повышением температуры. Он растворим в некоторых органических растворителях, таких как этиленгликоль, глицерин, и умеренно растворим в диэтиленгликоле, метаноле. Бура лишь немного растворима в более распространенных растворителях, таких как ацетон, этанол, этилацетат.
Растворимость буры в воде
Наличие
Бура продается различными поставщиками химикатов. Также можно приобрести онлайн.
Также можно приобрести онлайн.
Также продается в различных аптеках и железных подделках.
Приготовление
Борат натрия можно получить путем взаимодействия борной кислоты с гидроксидом натрия при постоянном перемешивании.
- 4 H 3 BO 3 + 2 NaOH → Na 2 B 4 O 7 + 7 H 2 O
Проекты
- Производство борной кислоты
- Вырастить кристаллы буры, снежинки из буры
- pH-буфер
- Средство для смягчения воды
- Флюс для плавки металлов
- Бурный метод (извлечение золота)
- Огнестойкий
- Приготовление пербората натрия
- Отвердитель (кожа)
Обращение
Безопасность
Бура малотоксична. Это только слегка раздражает кожу.
Бура была добавлена в список веществ, вызывающих очень большую озабоченность (SVHC), 16 декабря 2010 г. в ЕС.
Хранение
Буру следует хранить в закрытых бутылях.
Утилизация
Тетраборат натрия можно выбрасывать в мусор.
Каталожные номера
- ↑ http://www.paulslab.com/img/che/borax-graph-1-720.jpg
Соответствующие темы Sciencemadness
- Тесты на содержание бора в буре
- Отделение буры от смеси?
- re: перекристаллизация буры
глицерин — Sciencemadness Wiki
Глицерин , альтернативно пишется глицерин или глицерин , представляет собой простой сахарный спирт, иногда используемый в качестве растворителя. Это полиол, состоящий из молекулы пропана с одним водородом на каждом из атомов углерода, замещенным гидроксильной группой.
Глицерин иногда используется в качестве лабораторного растворителя, хотя это затруднено из-за его высокой вязкости. Он также используется в производстве известного взрывчатого нитроглицерина.
Содержание
- 1 Свойства
- 1.1 Химическая промышленность
- 1.
 2 Физический
2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химические вещества
Глицерин имеет несколько нишевых применений в бытовой химии. Смесь глицерина и щавелевой кислоты можно перегнать для получения муравьиной кислоты. Эта реакция протекает в несколько стадий при температуре выше 100°С.
При нагревании глицерина до 280 °C он разлагается на акролеин:
- (CH 2 OH) 2 CHOH → CH 2 =CHCHO + 2 H 2 O
Возможно, наиболее известно, что он может быть азотирован с использованием ледяной азотной кислоты и азотной кислоты. нитроглицерин, чувствительная жидкая взрывчатка, используемая для изготовления динамита.
Может также использоваться в качестве инертного растворителя для получения экстрактов растений или проведения органических реакций.
Физический
Глицерин представляет собой бесцветную, вязкую жидкость без запаха при комнатной температуре с мягким сладким вкусом, похожим на искусственные подсластители. Он растворим в воде, но имеет ограниченную растворимость в большинстве органических растворителей, таких как ацетон, хлороформ и диэтиловый эфир. Он гигроскопичен.
Доступность
Глицерин можно найти во многих аптеках и продуктовых магазинах, где он используется в качестве «защитного средства для кожи». Как и многие другие медицинские товары и товары для здоровья, он продается с очень высокой наценкой, а это означает, что покупка глицерина в Интернете у определенных оптовиков на самом деле намного дешевле.
Препарат
Глицерин получают путем гидролиза или омыления растительных и животных жиров с использованием сильного основания, такого как гидроксид натрия. Однако обычно его проще купить, чем проходить процесс очистки продукта от этой реакции.
Проекты
- Изготовление муравьиной кислоты
- Сделать нитроглицерин
- Сделать аллиловый спирт
- Сделать акролеин
- Антифриз
- Сделать медно-полиольный комплекс [1]
Обращение
Безопасность
Глицерин более или менее нетоксичен, так как является важным биологическим химическим веществом.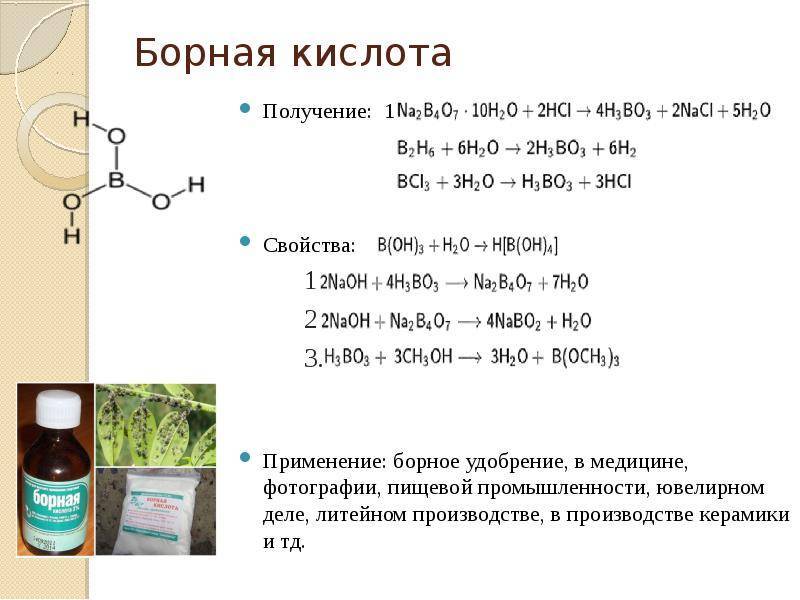


 2 Физический
2 Физический