Чем обусловлена температура плавления металлов: ᐉ Температуры плавления металлов разных групп — как происходит процесс плавления
alexxlab | 20.02.2023 | 0 | Разное
Свойства – HimHelp.ru
Физические свойства. d—элементы в целом характеризуются высокими температурами плавления и кипения. Их твердость и высокие температуры плавления и кипения объясняются прочными металлическими связями в этих элементах. Наличие прочной металлической связи обусловлено способностью d-элементов поставлять на образование связи электроны не только из внешней, но и из предшествующей ей внутренней подоболочки. Например, металлы первого переходного ряда используют для образования связей одновременно 3d— и 4s-электроны.
Физические свойства d-металлов
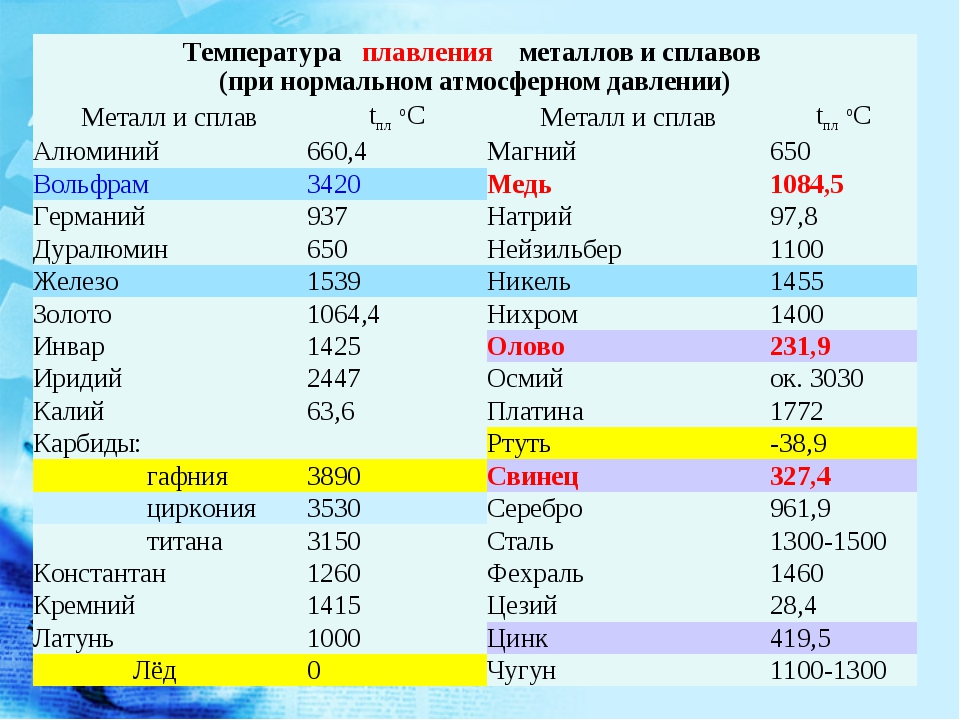
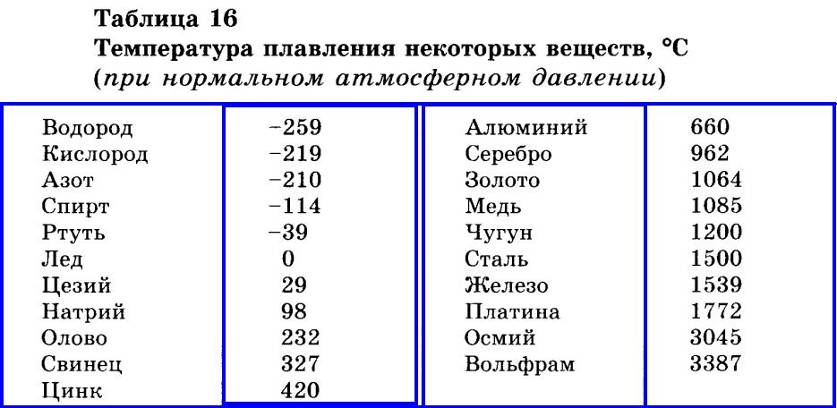
Элемент | Атомный радиус, нм | ПИ, эВ | ЭО по Полингу | Энергия связи, эВ | ρ, г/см3 | tпл, оС | Tкип, оС |
Cr Mn Fe Cu Zn Ag | 0,125 0,124 0,124 0,128 0,133 0,144 | 6,77 7,44 7,87 7,73 9,39 7,58 | 1,6 1,5 1,8 1,9 1,7 1,9 | 4,11 2,91 4,31 3,51 1,35 2,95 | 7,19 7,44 7,87 8,96 7,13 10,5 | 1857 1244 1535 1083 420 962 | 2672 1962 2750 2567 907 2212 |
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s—электрон сверх полузаполненной или заполненной d—оболочки. Металлы с заполненной s-оболочкой обладают меньшей электропроводностью. Например, медь, серебро золото, обладающие внешней электронной конфигурацией d
Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении.
Стандартные окислительно-восстановительные потенциалы всех металлов первого переходного ряда за исключением меди (и серебра во втором переходном ряду) в системах М2+/М отрицательны. Согласно этим отрицательным значениям, металлы первого переходного ряда должны располагаться в электрохимическом ряду напряжений выше водорода. Поэтому они должны вытеснять водород из минеральных кислот и образовывать водные растворы, содержащие ионы этих металлов. Однако некоторые из них реагируют с кислотами медленно, потому что на поверхности металла образуется защитный слой оксида. Это объясняет пассивность таких металлов, как хром, в коррозионных средах.
11 фактов, которые вы должны знать
Мы знаем о температуре плавления и проводимости по отдельности, но как точка плавления и проводимость связаны друг с другом и их факты, мы обсудим в этом посте.
Температура плавления – это температура, при которой твердое тело начинает переходить из своего состояния в жидкое. В то же время проводимость представляет собой температурный градиент для описания теплообмена. Поскольку и температура плавления, и проводимость зависят от температуры, они связаны друг с другом.
Не у каждого объекта есть точка плавления, потому что некоторые объекты, такие как дерево, не плавятся. Что касается проводимости, то в зависимости от свойств твердого тела они подразделяются на тепловые, электрические, ионные и т. д. Здесь вы найдете знать связь между температурой плавления тепло- и электропроводность.
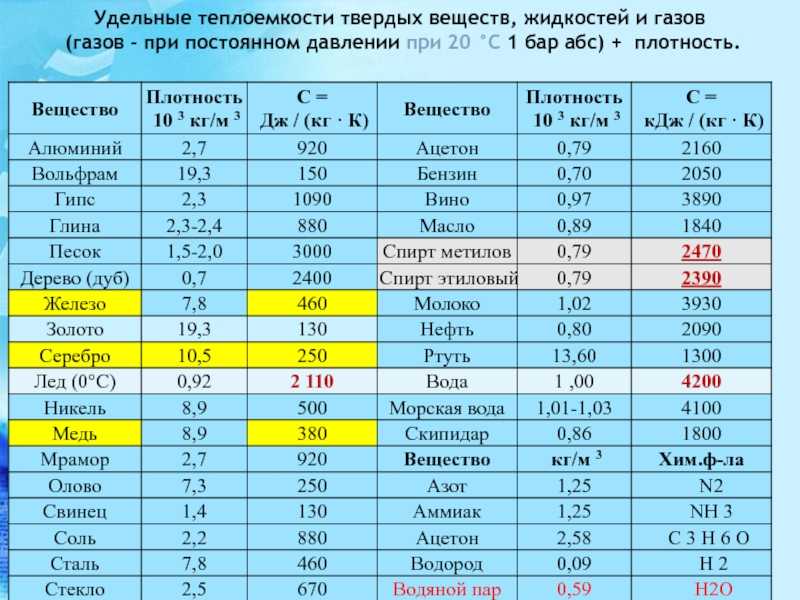
Температура плавления и теплопроводностьТеплопроводность – это способность соединения проводить тепло. Как правило, поток тепла от более высоких температур к более низким происходит при теплопроводности. Теплопроводность лежит между наличием температуры плавления и кипения данного вещества.
Когда температура повышается за счет теплопередачи, внутренняя энергия твердого тела увеличивается, вызывая диффузию, затем твердое тело начинает плавиться.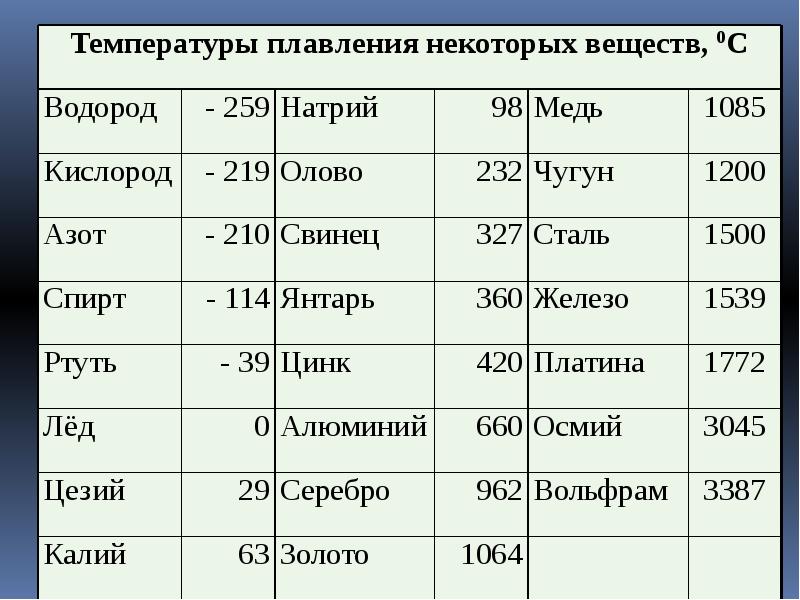 Свойства температуры плавления различаются для металлических и неметаллических веществ. Теплопроводность в твердом теле за счет упругих колебаний решетки приводит к передаче энергии в виде тепла.
Свойства температуры плавления различаются для металлических и неметаллических веществ. Теплопроводность в твердом теле за счет упругих колебаний решетки приводит к передаче энергии в виде тепла.
Температура плавления и теплопроводность являются индивидуальными свойствами вещества, но в некоторых случаях, таких как сварка, плавление вещества происходит за счет теплопроводности. Металлы более чувствительны к температуре, поэтому металл обладает высокой температурой плавления, а теплопроводность металла больше.
Температура плавления и теплопроводностьСвязь температуры плавления и теплопроводностиТемпература плавления твердых тел зависит от их энергии связи. Если твердое тело имеет высокую энергию связи, температура плавления твердого тела также высока. Однако теплопроводность зависит только от эффективного теплового потока в веществе.
Температура плавления и теплопроводность тесно связаны с некоторыми твердыми телами, поскольку оба они зависят от температуры.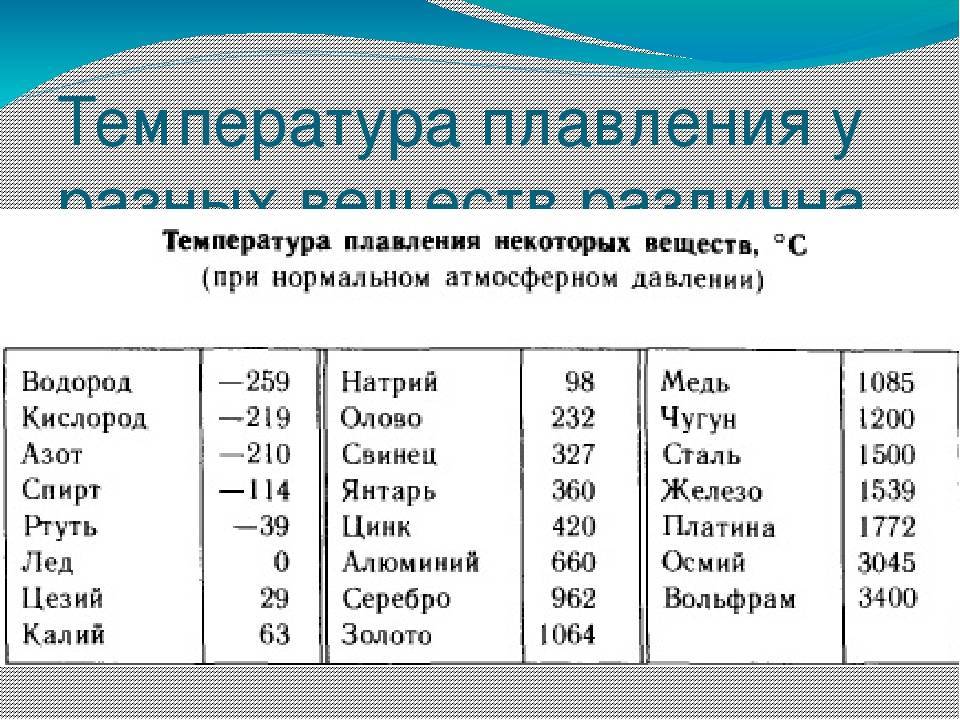 Повышение и понижение температуры влияет как на температуру плавления, так и на проводимость.
Повышение и понижение температуры влияет как на температуру плавления, так и на проводимость.
В металлах рост температура повышает температуру плавления, что приводит к снижению теплопроводности металла. Это означает, что температура плавления и теплопроводность в случае металла обратно пропорциональны. Но для неметалла все наоборот. Температура плавления неметалла ниже, но его теплопроводность значительно выше.
Отсюда видно, что температура плавления и теплопроводность имеют обратную зависимость.
Почему теплопроводность обратно пропорциональна температуре?Теплопроводность твердых тел в значительной степени зависит от движения свободных электронов частиц и колебаний молекул. Изменение температуры в значительной степени влияет на них обоих; таким образом, теплопроводность обратно пропорциональна температуре.
Для лучшего понимания рассмотрим в качестве примеров два случая металлов и неметаллов.
Теплопроводность металла обусловлена движением свободного электрона. По мере повышения температуры молекулярная вибрация возрастает, что приводит к уменьшению скорости потока свободного электрона, блокируя его путь, что, следовательно, снижает теплопроводность.
По мере повышения температуры молекулярная вибрация возрастает, что приводит к уменьшению скорости потока свободного электрона, блокируя его путь, что, следовательно, снижает теплопроводность.
Вышеупомянутая теория обратна в случае неметалла. Поскольку в неметаллах нет свободного электрона, теплопроводность обусловлена молекулярными колебаниями. При повышении температуры молекулы приобретают кинетическую энергию и вызывают колебания молекул; таким образом, теплопроводность у неметаллов высока.
Изменение проводимости в зависимости от температурыИзображение кредита: Бесплатный SVGТемпература плавления и электропроводность
Электропроводность — это свойство материала, которое измеряет способность пропускать ток или проводить электричество через материал. Так как для проведения электрического тока необходим свободный электрон; следовательно, в этом случае могут быть включены только металлы.
В случае щелочных металлов имеется только один свободный валентный электрон; следовательно, энергия, необходимая для связывания атома в кристаллической решетке, невелика, поэтому металлическая связь не такая прочная, что приводит к низкой температуре плавления. Но они хорошие проводники электричества..
Но они хорошие проводники электричества..
Свободные валентные электроны позволяют электрическим зарядам течь свободно и побуждают атомы получать или терять один из электронов от элемента в результате более слабого ядерного взаимодействия. При этом электропроводность больше.
Связь температуры плавления и электропроводностиВ отличие от теплопроводности зависимость между температурой плавления и электропроводностью является линейной. Так как повышение температуры приводит к увеличению как электропроводности, так и температуры плавления.
Но есть некоторые последствия, при которых некоторые металлы имеют высокую температуру плавления, но их электропроводность очень низкая. Некоторые металлы являются хорошими проводниками электричества, но имеют низкую температуру плавления. Таким образом, нелегко установить надлежащее связь между температурой плавления и электропроводность.
Что увеличивает электропроводность?Электропроводность зависит от температуры. Таким образом, изменение температуры может увеличить температуру.
Таким образом, изменение температуры может увеличить температуру.
На электропроводность сильно влияют подвижность ионов и валентные электроны; таким образом, если будет положительное изменение ионной подвижности и валентного электрона, электропроводность может быть увеличена.
Поскольку металлы являются хорошими проводниками, электрическая проводимость увеличивается линейно, если число свободных электронов приходится на атом металла. Если делокализованный электрон увеличивается, электропроводность также увеличивается. Для полупроводников увеличение примесей может увеличить электропроводность.
Влияет ли температура плавления на электропроводность?Для некоторых металлов температура плавления в значительной степени влияет на электропроводность. Электропроводность возникает с температурой. Когда температура достигает точки плавления, она начинает падать, и, таким образом, электропроводность полностью исчезает. Это свойство наблюдается в эксперименте по взрыву электрического провода, осуществляемого фаза переходный процесс металлов.
Механизм плавления усиливается за счет выделения энергии кристаллической решетке металла, что приводит к увеличению числа высокоэнергетических электронов на решетке, создавая дефект в структуре решетки.
Поскольку проводимость является функцией температуры, которая также повышает температуру плавления, то точка плавления влияет на электрическую проводимость.
Что имеет высокую температуру плавления и не проводит электричество?Некоторые соединения имеют высокую температуру плавления, но не влияют на электропроводность. Эти соединения являются ионными. Ионные соединения в твердом состоянии не обладают электропроводностью, но в расплавленном или водном состоянии обладают.
В твердом состоянии молекулы ионных соединений удерживаются прочной связью и фиксируются на своем месте. Возможность образования свободных электронов меньше, поэтому они не могут двигаться, но у них высокая температура плавления, т. е. они так легко плавятся при некоторой подаче температуры.
При повышении температуры твердое ионное тело начинает плавиться, и ионы становятся свободными для проведения электричества.
Увеличивается ли электропроводность с температурой?Зависимость электропроводности от температуры зависит от свойства материала.
- Для проводников температура имеет обратную зависимость. Таким образом, уменьшая температуру, можно увеличить электропроводность.
- Для изоляторов электрическая проводимость может быть увеличена за счет повышения температуры.
- В случае полупроводников с повышением температуры электропроводность полупроводника увеличивается.
Поскольку электропроводность обусловлена свободным движением электронов с одной стороны на другую, электрон может двигаться свободно, если потоку не будет сопротивления.
По мере повышения температуры вибрация решетки заставляет электрон совершать беспорядочное движение в боковом направлении, поэтому существует некоторое сопротивление потоку электронов; таким образом проводник проявляет низкую проводимость при высокой температуре.
Некоторые металлы, такие как гафний, ниобий и тантал, имеют высокую температуру плавления, но они плохо электризуются. проводники. Например, вольфрам имеет высокую температуру плавления, но плохо проводит электропроводность в нормальных условиях.
Тем не менее, вольфрам используется в качестве нити накаливания в лампах, потому что он обладает электропроводностью при высокой температуре, что обеспечивает поток электронов.
Существование примесей в чистом металле ограничивает поток электронов для проведения электричества; таким образом, даже если они имеют высокую температуру плавления, они не влияют на электропроводность. Некоторые соединения, такие как нержавеющая сталь, имеют относительно высокую температуру плавления, но не проводят электричество из-за своей сплавообразной структуры.
Вольфрамовая лампочкаИзображение кредита: PixabayПочему проводимость полупроводников увеличивается с температурой?
В полупроводниках валентная зона заполнена валентными электронами, а зона проводимости либо пуста, либо частично заполнена при нуле градусов Кельвина.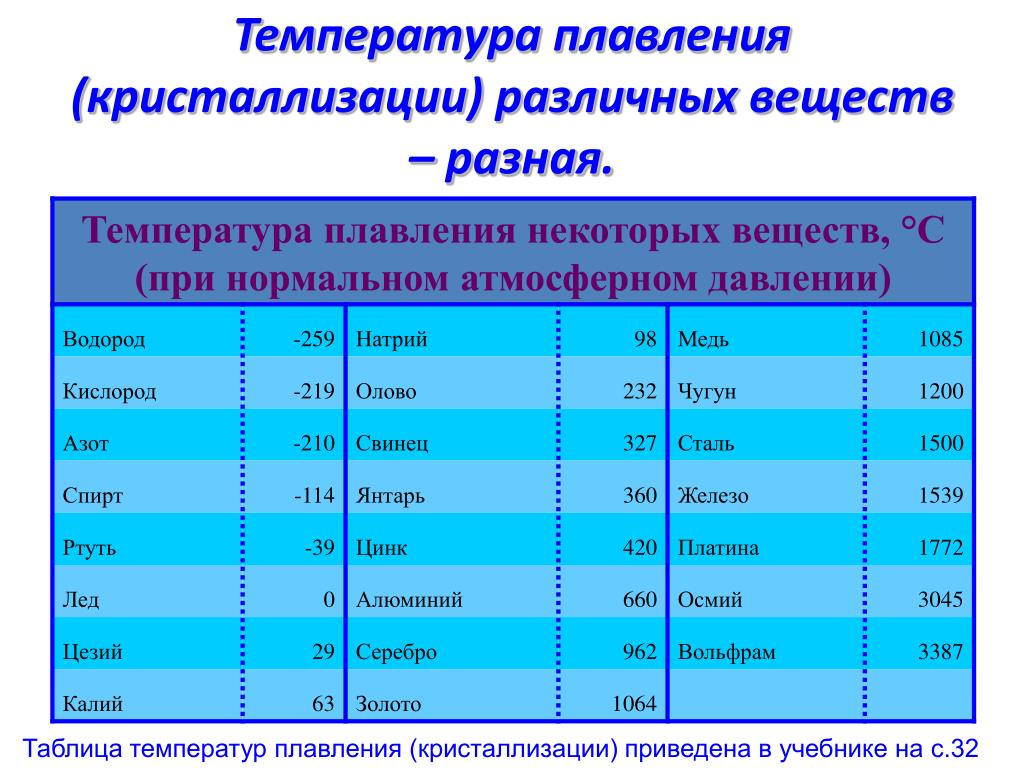 Таким образом, свободный электрон, вносящий вклад в электропроводность, недоступен в зоне проводимости для образования электронно-дырочной пары.
Таким образом, свободный электрон, вносящий вклад в электропроводность, недоступен в зоне проводимости для образования электронно-дырочной пары.
Когда прикладывается небольшое количество энергии в виде тепла, электрон может легко стать доступным для проводимости. С повышением температуры концентрация электронов в зоне проводимости увеличивается. Таким образом, проводимость полупроводников также увеличивается.
Ширина запрещенной зоны между зоной проводимости и валентной зоной сравнительно меньше; таким образом, свободные электроны могут пересекать валентную зону из-за тепловых колебаний при повышении температуры, приобретая кинетическую энергию. Электрон становится свободным в структуре решетки и, естественно, вносит свой вклад в электрическую проводимость.
Структура энергетических зон полупроводника увеличивается с температуройИзображение кредита: Wikimedia CommonsЗаключение
Давайте завершим этот пост, заявив, что температура плавления и проводимость — это свойства материала, сопровождаемые температурой. Таким образом, они косвенно коррелированы, и проводимость различается для разных соединений.
Таким образом, они косвенно коррелированы, и проводимость различается для разных соединений.
. Что заставляет некоторые металлы плавиться при более высокой температуре?
спросил
Изменено 3 года, 1 месяц назад
Просмотрено 57 тысяч раз
$\begingroup$
Я смотрю на температуру плавления металлических элементов и замечаю, что все металлы с высокой температурой плавления сгруппированы в левом нижнем углу блока $\mathrm{d}$. Если я возьму, например, периодическую таблицу с физическим состоянием, указанным в $\pu{2165 K}$:
Я вижу, что (кроме бора и углерода) единственные элементы, остающиеся твердыми при этой температуре, образуют довольно четкий блок вокруг вольфрама (который плавится при $\pu{3695 K}$). Так что же заставляет эту группу металлов плавиться при такой высокой температуре?
Так что же заставляет эту группу металлов плавиться при такой высокой температуре?
- температура плавления
- металл
$\endgroup$
5
$\begingroup$
На некоторые факторы намекнули, но позвольте мне расположить их в порядке важности и упомянуть еще некоторые:
металлы обычно имеют высокую температуру плавления, потому что металлическая межатомная связь делокализованными электронами ($\ce{Li}$ имеет лишь несколько электронов для этого «электронного моря») между атомами ядра довольно эффективна в этих чистых твердые тела элементов по сравнению с альтернативными типами связи (ионная энергия связи $\pu{6-20 эВ/атом}$, ковалентная 1-7, металлическая 1-5, ван-дер-ваальсова значительно ниже). Также ионные решетки типа $\ce{NaCl}$ имеют более высокую решетку и энергию связи, у них слабая межатомная дальнодействующая связь, в отличие от большинства металлов.

кристаллическая структура и масса играют второстепенную роль среди отфильтрованных элементов (просто посмотрите на кристаллическую структуру этих элементов), поскольку металлическая связь не является направленной, в отличие от ковалентной связи (орбитальная симметрия). Металлы часто имеют наполовину заполненные зоны $\mathrm{s}$ и $\mathrm{p}$ (более сильно делокализованные, чем $\mathrm{d}$ и $\mathrm{f}$) на краю Ферми (что означает высокую проводимость). ) и, следовательно, много делокализованных электронов, которые могут переходить в незанятые энергетические состояния, образуя самое большое электронное море с заполнением зон наполовину или меньше.
благородных металлов, таких как $\ce{Au,Ag}$, имеют полную $\mathrm{d}$-орбиталь, поэтому имеют низкую реакционную способность/электроотрицательность и часто используются в качестве контактных материалов (высокая проводимость из-за “очень жидкого” электронного моря, состоящего из только из $\mathrm{s}$-орбитальных электронов.
В отличие от вольфрама с половиной или менее занятыми $\mathrm{d}$-орбиталями они не обнаруживают межатомных $\mathrm{d-d}$-связей за счет делокализованных $\mathrm{d}$ -электронов, и что более важно, наполовину заполненная $\mathrm{d}$-орбиталь вносит в энергетическую зону 5 электронов, тогда как $\mathrm{s}$ только 1, $\mathrm{p}$ только 3, электронное море больше среди $\mathrm{d}$-группы.
“упаковка” атомов ядра в решетке (межатомное расстояние) среди высших атомов $Z$ (по сравнению с , например, $\ce{Li}$) более плотная (больше протонов, сильнее притяжение электронов оболочки , меньший межатомный радиус), означает более сильную межатомную связь, передаваемую электронным морем:
Здесь видно, что в каждой серии ($\ce{Li,\ Na,\ K}$) температуры плавления увеличиваются до максимума, а затем уменьшаются с увеличением атомного номера (отсутствуют незанятые энергетические состояния для делокализованных $\ mathrm{d}$-электронов), большее электронное море здесь является более сильным фактором, чем чуть более плотная упаковка.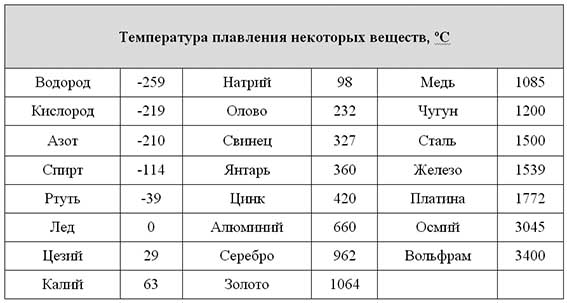
- Бор как полуметалл демонстрирует металлическую и ковалентную связь, углерод имеет сильную направленную ковалентную связь и способен образовывать сеть связей, в отличие от других неметаллических элементов, демонстрирующих ковалентную внутримолекулярную связь, например. , в двухатомных молекулах, но не в сильной межмолекулярной связи в макромолекулах из-за отсутствия неспаренных электронов.
Таким образом, существуют более серьезные тенденции для температур плавления, объясняющие высокие температуры плавления $\mathrm{d}$-металлов, но также и некоторые незначительные исключения из этого правила, такие как $\ce{Mn}$.
$\endgroup$
1
$\begingroup$
Думаю, здесь играют роль два свойства: скорость атомов и стабильность структуры решетки.
Напомним, что температура является мерой средней кинетической энергии молекул, поэтому $v \propto \sqrt{\frac{T}{m}}$, или для достижения той же скорости $T \propto m$. Таким образом, при одинаковой температуре два более тяжелых атома будут двигаться друг относительно друга медленнее, чем две более легкие молекулы, что дает им больше времени для взаимодействия.
Таким образом, при одинаковой температуре два более тяжелых атома будут двигаться друг относительно друга медленнее, чем две более легкие молекулы, что дает им больше времени для взаимодействия.
Теперь вспомним, что в твердом теле молекулы удерживаются в решетке межмолекулярными силами, а в жидкости атомы обладают достаточной энергией, чтобы силы между ними уже не были достаточно сильны, чтобы удерживать атомы в решетке. Таким образом, чем большую стабильность приобретают атомы вещества, находясь в твердом, кристаллическом расположении, тем выше будет его температура плавления. Теперь, почему металлы в этой области приобретают большую стабильность в своей твердой форме? Я совершенно уверен, что ответ связан с полнотой орбиталей и полуорбиталей. Я не уверен в деталях делокализованного электронного облака в металлах, но я думаю, вполне вероятно, что оно позволяет этим металлам каким-то образом заполнять или освобождать свои неполные орбитали.
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Тенденция плавления неметаллов?
спросил
Изменено 6 лет, 2 месяца назад
Просмотрено 6к раз
$\begingroup$
Я заметил, что точка плавления неметаллов уменьшается в течение периода (т.е. температура плавления азота выше, чем у кислорода, кислорода выше, чем у фтора и т. д.). Он значительно более заметен для хлора и аргона. Почему это? Кроме того, в моем домашнем задании возник вопрос о сере (S 8 ) имеет более высокую температуру плавления, чем фосфор (P 4 ). Их объяснение заключалось в том, что сера — это более крупная молекула, но я не понимаю, как это влияет на температуру плавления. Есть ли лучшее объяснение?
Есть ли лучшее объяснение?
Примечание. Это график, на который я ссылался для точки плавления: http://antoine.frostburg.edu/chem/senese/101/periodic/images/meltingpoint.gif
$\endgroup$
$\begingroup$
при движении по периоду атомные радиусы уменьшаются. Видите ли, это уменьшение приводит к увеличению чистого Z-эффективного и, следовательно, электроны подходят очень близко. В случае азота, который существует в виде двухатомной молекулы, это уменьшение в размерах меньше, чем у кислорода и фтора.
температура плавления определяется межмолекулярными взаимодействиями, а также геометрией молекул. чем больше разрывных связей, тем выше температура плавления. Для кислорода и особенно фтора может быть вынужденное сжатие, но опять же – эти маленькие атомы отталкиваются друг от друга из-за их высокой электронной плотности. Это отталкивание снижает температуры плавления и кипения.