Что такое коррозия в химии: Коррозия металлов — урок. Химия, 9 класс.
alexxlab | 19.05.1988 | 0 | Разное
ЛЕКЦИЯ № 7. Коррозия металлов. Физическая химия: конспект лекций
ЛЕКЦИЯ № 7. Коррозия металлов
1. Основные понятия и терминология
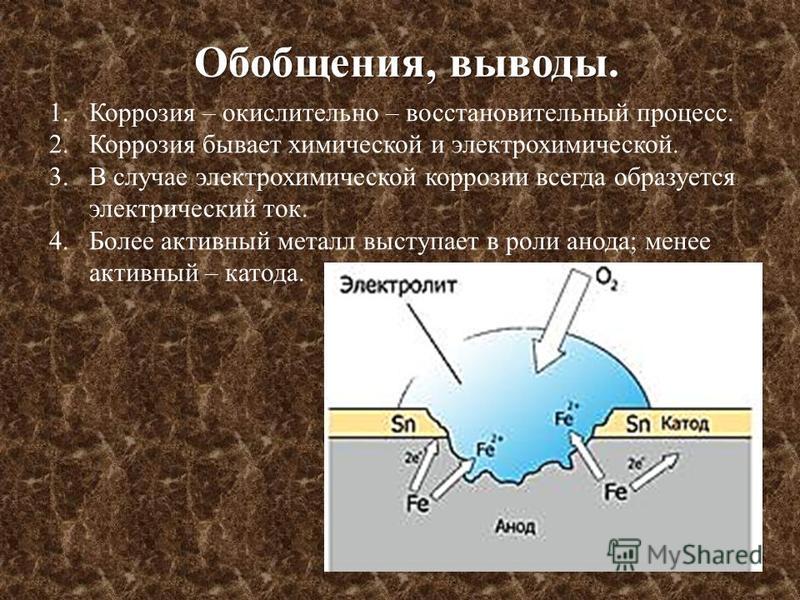
Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной или агрессивной. При этом образуются продукты коррозии: химические соединения, содержащие металл в окисленной форме. В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин «коррозия» употреблять не следует. Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окисляться, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется. Следовательно, термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин
Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется. Следовательно, термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин
Объекты воздействия коррозии – металлы, сплавы (твердые растворы), металлопокрытия, металлоконструкции машин, оборудования и сооружений. Процесс коррозии представляют как коррозионную систему, состоящую из металла и коррозионной среды.
 Коррозионные потери единицы поверхности металла в единицу времени характеризуют скорость коррозии. Эффект повреждений, связанный с потерями механической прочности металла, определяют термином – коррозионное разрушение, глубину его в единицу времени называют скоростью проникновения коррозии. Важнейшее понятие – коррозионная стойкость. Она характеризует способность металла сопротивляться коррозионному воздействию среды. Коррозионную стойкость определяют качественно и количественно – скоростью коррозии в данных условиях, группой или баллом стойкости по принятой шкале, с помощью оптических приборов. Металлы, обладающие высокой коррозионной стойкостью, называют коррозионно стойкими. Факторы, влияющие на скорость, вид, рас-пределение коррозии и связанные с природой металла (состав, структура, внутренние напряжения, состояние поверхности), называют внутренними факторами коррозии. Факторы, влияющие на те же параметры коррозии, но связанные с составом коррозионной среды и условиями процесса (температура, влажность, обмен среды, давление и т.
Коррозионные потери единицы поверхности металла в единицу времени характеризуют скорость коррозии. Эффект повреждений, связанный с потерями механической прочности металла, определяют термином – коррозионное разрушение, глубину его в единицу времени называют скоростью проникновения коррозии. Важнейшее понятие – коррозионная стойкость. Она характеризует способность металла сопротивляться коррозионному воздействию среды. Коррозионную стойкость определяют качественно и количественно – скоростью коррозии в данных условиях, группой или баллом стойкости по принятой шкале, с помощью оптических приборов. Металлы, обладающие высокой коррозионной стойкостью, называют коррозионно стойкими. Факторы, влияющие на скорость, вид, рас-пределение коррозии и связанные с природой металла (состав, структура, внутренние напряжения, состояние поверхности), называют внутренними факторами коррозии. Факторы, влияющие на те же параметры коррозии, но связанные с составом коррозионной среды и условиями процесса (температура, влажность, обмен среды, давление и т. п.), называют внешними факторами коррозии. В ряде случаев факторы коррозии целесообразно делить в соответствии с таблицей 4.
п.), называют внешними факторами коррозии. В ряде случаев факторы коррозии целесообразно делить в соответствии с таблицей 4.Таблица 4
Факторы коррозии
Данный текст является ознакомительным фрагментом.
Лекция 3. Великие законы сохранения
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы. Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г.
ЛЕКЦИЯ № 5. Химическое равновесие
ЛЕКЦИЯ № 5. Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический,
Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический,
ЛЕКЦИЯ № 6. Химическая кинетика
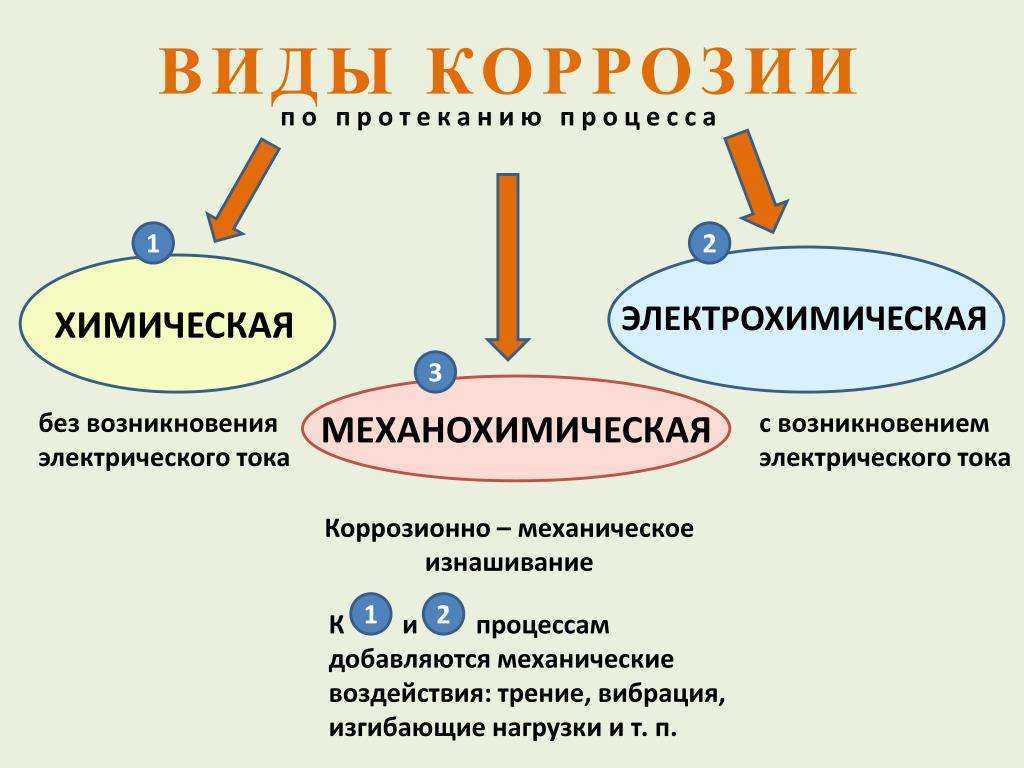
2. Классификация процессов коррозии металлов
2. Классификация процессов коррозии металлов Классифицировать коррозию принято по механизму, условиям протекания процесса и характеру разрушения. По механизму протекания коррозионные процессы, согласно ГОСТ 5272-68, подразделяются на два типа: электрохимические и
ЛЕКЦИЯ № 8.
 Физико-химический анализ
Физико-химический анализЛЕКЦИЯ № 8. Физико-химический анализ 1. Суть физико-химического анализа Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру.
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 10. Гальванические элементы
ЛЕКЦИЯ № 10. Гальванические элементы
1. Понятие гальванического элемента
Гальванический элемент – прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов:
Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов:
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
ЛЕКЦИЯ № 13. Электрохимическая кинетика
ЛЕКЦИЯ № 13. Электрохимическая кинетика
1. Основные кинетические характеристики и методы их расчетов
i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
Электрохимическая кинетика
1. Основные кинетические характеристики и методы их расчетов
i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
3. Кинетические особенности электроосаждения металлов и сплавов
3. Кинетические особенности электроосаждения металлов и сплавов Процесс электроосаждения металлов, сплавов протекает через последовательность стадий: диффузия катионов металлов к поверхности электрода из объема раствора, вхождение катионов в ДЭС (двойной
ЛЕКЦИЯ № 15. Третий закон термодинамики
ЛЕКЦИЯ № 15. Третий закон термодинамики
Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует
Исходя из этого, вывели предположение, что между веществами существует
Цветные сигналы металлов
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.

- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
3Fe + 2O2 = Fe3O4
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
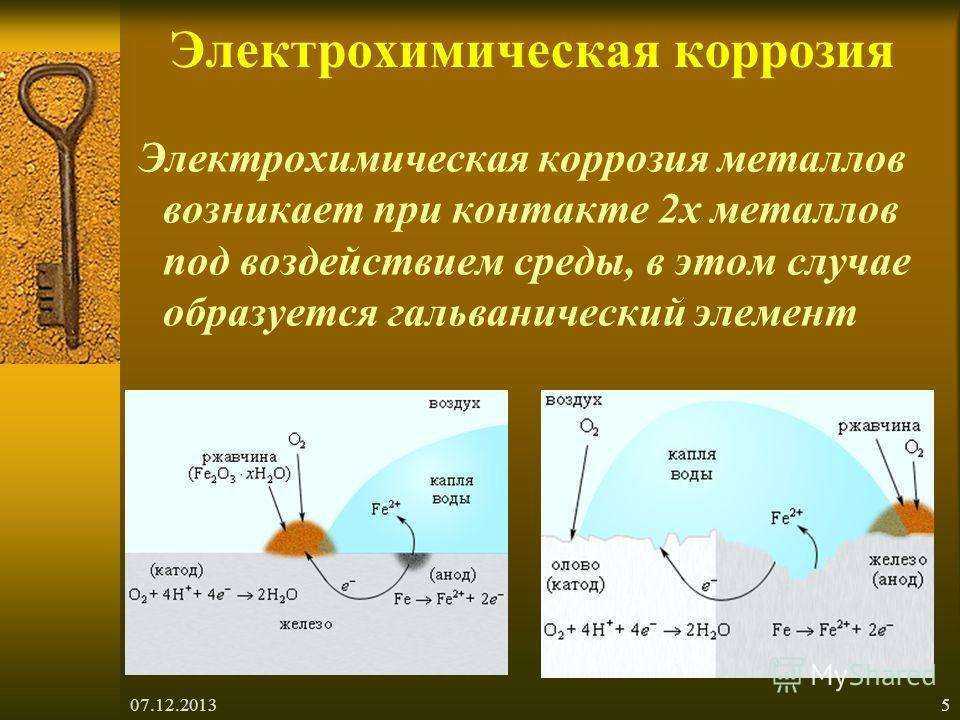
Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
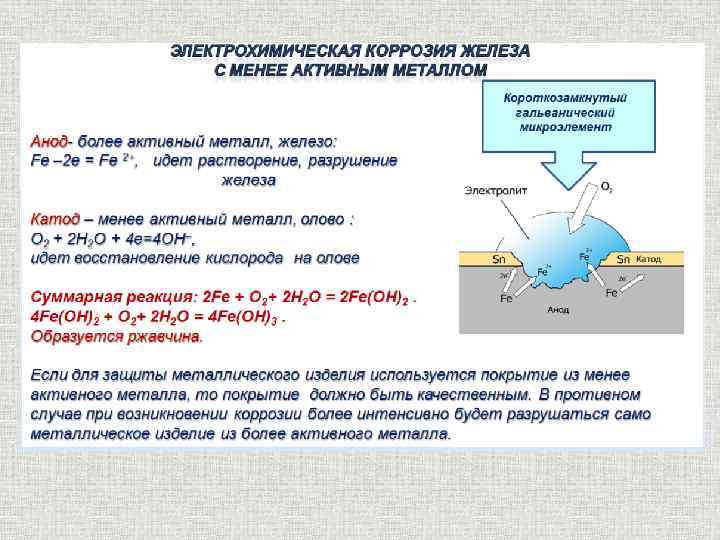
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H+ + 2e → H2
O2 + 2H2O + 4e → 4OH–
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H+ + 2e → H2
Суммарная реакция: Fe + 2H+ → H2 + Fe2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH–
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Понравилось это:
Нравится Загрузка…
Открытый урок по химии в 10 классе на тему:”коррозия металлов и способы её устранения”
Тема урока: Коррозия металлов и меры её предупреждения.
Задачи урока:
1.Образовательная: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
2.Развивающая:
развить умение проведения химического эксперимента с соблюдением правил техники безопасности, строить логические цепочки и выводы из наблюдений, прогнозировать решение некоторых проблем.
3.Воспитательная: совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Оборудование: компьютер, интерактивная доска , оборудование и реактивы для лабораторного эксперимента, презентация к уроку.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Тип урока: изучение нового материала.
Ход урока:
I. Мобилизирующий момент.
II. Проверка ЗУН:
1.Какова доля железа в земной коре: 5%
2.Минералы, содержащие железо: красный железняк, магнитный железняк, пирит
3.Где в Казахстане имеется запасы железных руд: в Торгайском железорудном бассейне,
Центр. Казахстане
4.Сколько граммов железа в теле человека: 4-5г
5.Где содержится железо в организме человека; в клетках крови
6. Болезнь, связанная с недостатком железа в крови: анемия
Болезнь, связанная с недостатком железа в крови: анемия
7.В каких продуктах большое содержание железа: в печени, мясе (кролика, индейки), крупах, чернике, персиках, икре осетровых рыб.
Задание: Из предложенных формул соединений составьте генетический ряд Fe 2+ (для первого варианта) и генетический ряд Fe 3+(для второго варианта)
Fe(OH)2, Fe, Fe(OH)2, FeCl3, Fe2O3, FeCl2, FeO
Задание: Написать уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
Fe → FeCl3 →Fe(OH)3 →Fe2O3 →Fe →FeSO4 →Fe(OH)2 →FeO → Fe → Fe3O4
Задача 1. Железную пластинку массой 5 г поместили в раствор, содержащий 1,6 г сульфата меди. Найти массу пластинки после окончания реакции.
Задание: В уравнении химической реакции расставить коэффициенты методом электронного баланса: Fe2O3 + KOH + KNO3 →K2FeO4 + KNO2 + H2O
III. Объяснение материала:
Объяснение материала:
31 января 1951 г. обрушился железнодорожный мост в Квебеке (Канада ), введенный в эксплуатацию в 1947 г. В 1964 г. рухнуло одно из самых высотных сооружений в мире – 400-метровая антенная мачта в Гренландии.
Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
Что же объединяет эти примеры? (разрушение металлических изделий)
Железо – элемент, всем хорошо известный. Железо используют как в чистом виде, так и в составе различных сплавов. О значении железа очень ярко сказал академик А.Е.Ферсман: «Я хочу поразить читателя и нарисовать картину того, что было бы с человеком, если бы он вдруг узнал, что все железо на поверхности земли исчезло и что его ниоткуда больше достать нельзя. Правда, он узнал бы это довольно решительным образом, ибо исчезли бы его кровать, распалась бы вся мебель, уничтожились все гвозди, обвалились потолки и уничтожилась крыша. На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей, ни экипажей, ни решеток не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла.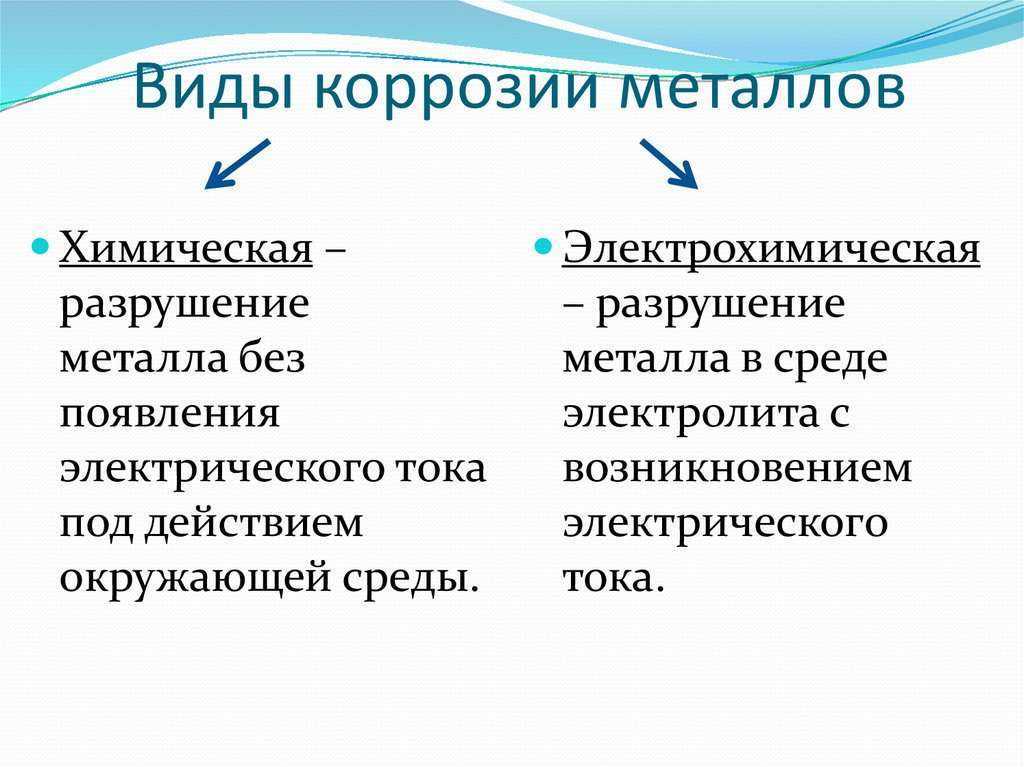 Разрушение ураганом прошло бы по всей Земле, и гибель человека сделалась бы неминуемой».
Разрушение ураганом прошло бы по всей Земле, и гибель человека сделалась бы неминуемой».
О коррозии упоминается даже в Ветхом Завете: «не сотвори себе кумира на земле, ибо ржавчина и моль его разрушат»
Хвастается новенький металл:
«Как силен я, смел и как удал! Неподвластен никакой угрозе Кроме рыжей крысы с именем «коррозия».
Итак, тема нашего урока: «Коррозия металлов». Слово коррозия происходит от латинского «corrodere», что означает разъедать.
Коррозия – самопроизвольное разрушение металлов вследствие химического или электрохимического взаимодействия их с окружающей средой. «Поедают» металл все вещества, которые могут с ним реагировать: кислород и вода, кислоты и щелочи, растворы солей (морская вода).
Аппетит у «металлоедов» чудовищный – ежегодно они уносят до 30% производимого металла; 2/3 этого количества в виде металлолома возвращаются в промышленность, а 1/3 теряется безвозвратно. Но убытки этим не ограничиваются. ? Какие еще расходы возникают в результате коррозии?
Стоимость деталей и конструкций, вышедших из строя вследствие коррозии, выше стоимости самого металла. По причине коррозии случаются аварии. Коррозия увеличивает расходы на ремонт машин, на бензин. Значительные средства требует профилактика коррозии. Таким образом, коррозия порождает своеобразную цепную реакцию расходов, которые растут как снежный ком, причем косвенные расходы во много раз превышают прямые.
По причине коррозии случаются аварии. Коррозия увеличивает расходы на ремонт машин, на бензин. Значительные средства требует профилактика коррозии. Таким образом, коррозия порождает своеобразную цепную реакцию расходов, которые растут как снежный ком, причем косвенные расходы во много раз превышают прямые.
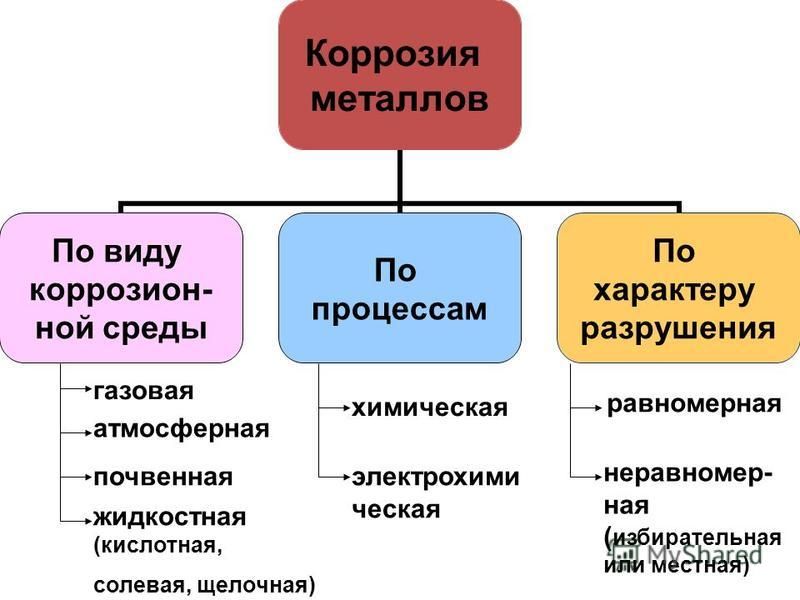
В зависимости от вызываемых коррозией повреждений поверхности металлов различают следующие ее виды:
равномерную (сплошную),
язвенную,
точечную (питтинг).
Как вы думаете какой вид коррозии самый опасный?Почему? (Питтинг – большая глубина поражения и малая площадь)
По механизму протекания коррозия делиться на два вида: химическую и электро-химическую.
Коррозия – это окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идет процесс окисления)
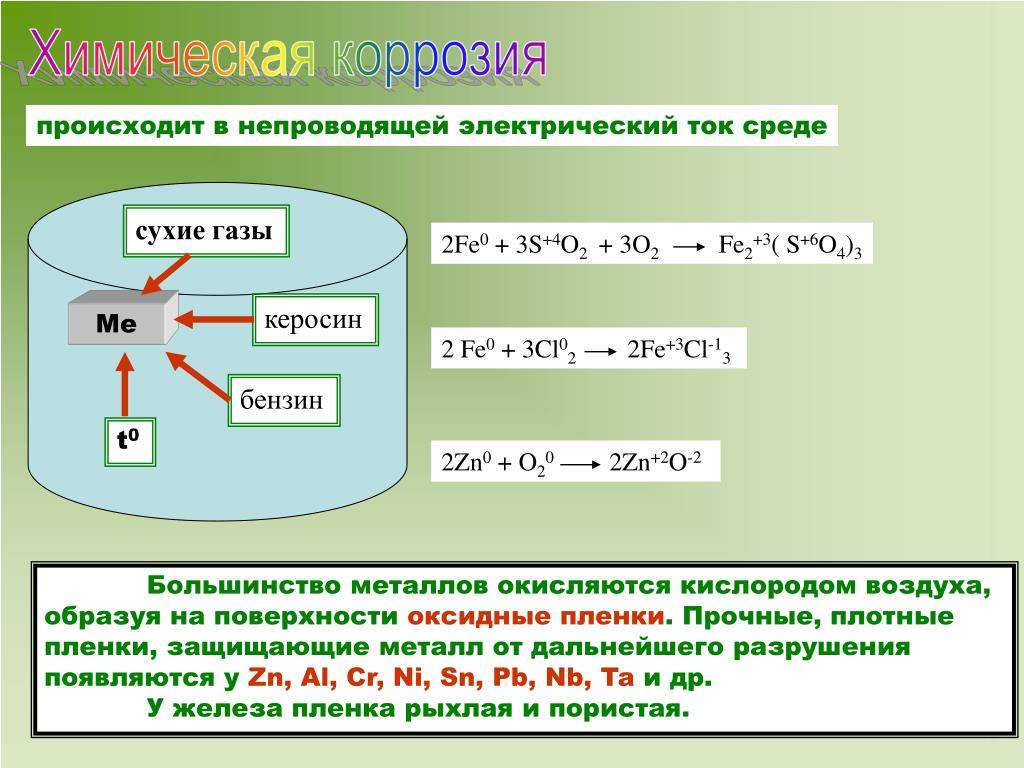
Химическая коррозия – разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрический ток (например, нефть).
Ей подвергается арматура печей, детали двигателей внутреннего сгорания и аппаратура химической промышленности. При этом происходит окислительно-восстановительные реакции, в ходе которой металл окисляется, а присутствующий в среде окислитель восстанавливается, электроны переходят от металла к окислителю без возникновения в цепи электрического тока.
Демонстрация. Прокалим медную проволоку на воздухе. Что наблюдаете.
Уч-ся: изменение окраски – появление черного налета, значит произошла химическая реакция.
При взаимодействии меди с кислородом идет реакция:
2Cu + O2 → 2CuO (запись в тетради и на доске)
Cu0 – 2e → Cu2+ | 2| – восстановитель, процесс окисления
O20 + 4e → 2O2- | 1| – окислитель, процесс восстановления
Некоторые металлы на воздухе покрываются плотной оксидной пленкой, например алюминий, и металл не корродирует. Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь. Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Мы рассмотрели с вами химическую коррозию, а теперь рассмотрим электрохимическую.
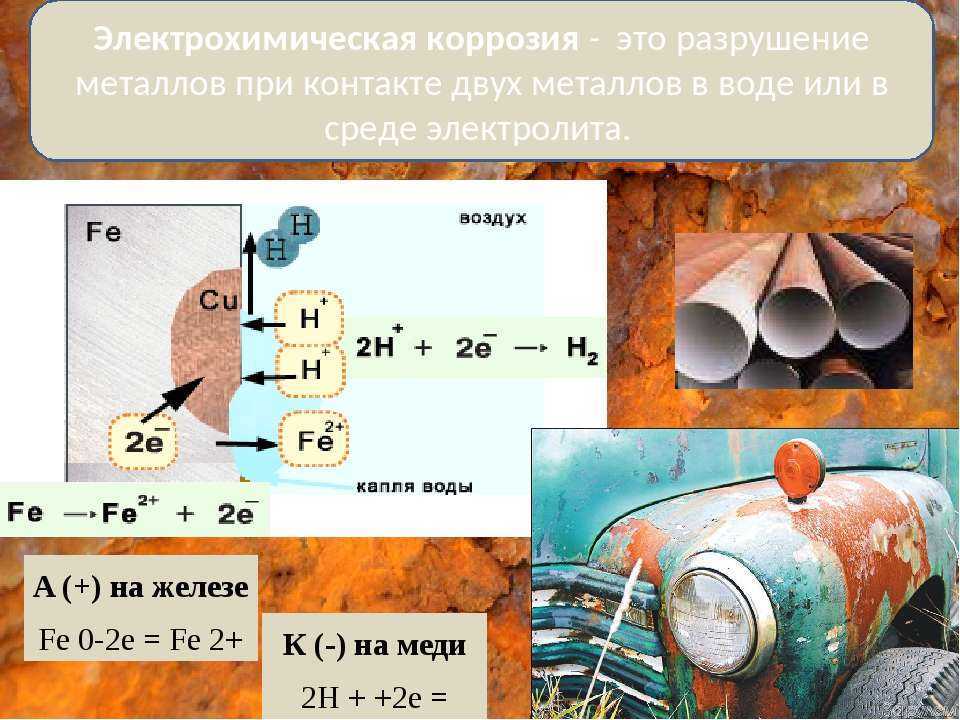
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде другого электролита.
В данном случае наряду с химическим процессом идет электрический – перенос электрона, т.е. возникает электрический ток. Этот вид приносит большой вред.
Коррозия металлов в нейтральной и (или) щелочной среде
А(+) Fe0 – 2e → Fe2+
К(-) O2+2H2O+4e →4OH–
2Fe0 + O2 + 2H2O→ 2 Fe(OH)2 4Fe(OH)2 + O2 + 2H2O→ 4 Fe(OH)3
Вывод: Кислород – окислитель
Коррозия металлов в кислой среде
Запись в тетрадях:
А(+) Fe0 – 2e → Fe2+
К(-) 2H+ + 2e → H20
Fe0 + 2H+ → Fe2+ + H20
Вывод: Окислителем являются ионы водорода.
Скорость электрохимической коррозии зависит от природы примесей в металле, природы электролита .Электрохимическая коррозия происходит тем быстрее, чем больше расстояние между металлами в ряду напряжения металлов.
Очень важен вопрос об условиях, при которых коррозия протекает особенно интенсивно
Перед вами четыре пронумерованных стакана. Сейчас каждая группа получит стакан с заложенным опытом и, внимательно рассмотрев результаты, ответит на поставленные вопросы. После этого каждая группа даст пояснения своим наблюдениям и сделает соответствующий вывод.
Гвоздь в дистиллированной воде.
Гвоздь в растворе хлорида натрия.
Гвоздь в контакте с медью растворе соли.
Гвоздь в контакте с цинком в растворе соли.
Опыт №1. Железный гвоздь + чистая вода.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Насколько сильно корродировал гвоздь в чистой воде?
Сделайте вывод о скорости коррозии в чистой воде.
Опыт №2. Железный гвоздь + раствор хлорида натрия NaCl.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Насколько сильно корродировал гвоздь в растворе хлориде натрия?
Что из себя представляет по внешнему виду ржавчина?
Сделайте вывод о скорости коррозии в растворе соли.
Опыт №3. Железный гвоздь + медная проволока + раствор NaCl.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Рассмотрите медную проволоку, произошли ли с ней какие либо изменения?
Насколько сильно корродировал гвоздь в контакте с медной проволокой?
Почему из двух металлов в первую очередь корродирует железо?
Сделайте вывод о скорости коррозии железа при контакте его с медью.
Опыт №4. Железный гвоздь + цинковая пластинка + раствор NaCl
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Какие изменения произошли с цинковой пластинкой?
Какой из металлов (железо или цинк) подвергся коррозии?
Почему железо осталось не измененным?
Сделайте вывод о скорости коррозии железа при контакте его с цинком.
Наблюдения:
1. Железо слабо корродировало, в чистой воде коррозия идет медленнее, т.к. вода слабый электролит.
2. Железо корродирует сильнее, т. к. хлорид натрия более сильный электролит и это увеличивает скорость коррозии.
3. Скорость коррозии велика. Образовалось много ржавчины. Железо сильно корродирует в контакте с менее активным металлом – медью.
В данном опыте образовалась активная гальваническая пара. Fe2+ переходит в раствор. Избыток электронов переходит от железа к меди в местах контакта и восстанавливает на ней атомы кислорода в виде О2 до ОН– (в плёнке электролита на металле).
Анод(Fe): Fe0 – 2ē → Fe2+
Катод(Cu): 4ē + O2 + 2H2O → 4OH–
OH– образует с ионами Fe2+ гидрат закиси железа
Fe2+ + 2ОН– → Fe(ОН)2↓, который окисляется до гидрата окиси железа (ІІІ):
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3↓
Последний можно наблюдать в виде ржавых отложений
4. Наблюдаем коррозию не железа, а цинка, т.к. железо в контакте с более активным металлом даже в сильно коррозионной среде – растворе хлорида натрия – не корродирует, остается защищенным до тех пор, пока не прокорродирует весь цинк. Возникает гальваническая пара, причём цинк переходит в раствор в виде ионов. На железе образуются гидроксильные группы. Цинк в данной гальванической паре, как более активный металл, будет являться анодом и в присутствии среды, проводящей электрический ток, будет разрушаться, железо же не ржавеет. Поэтому оцинкованные ведра сравнительно недороги и служат долго.
Наблюдаем коррозию не железа, а цинка, т.к. железо в контакте с более активным металлом даже в сильно коррозионной среде – растворе хлорида натрия – не корродирует, остается защищенным до тех пор, пока не прокорродирует весь цинк. Возникает гальваническая пара, причём цинк переходит в раствор в виде ионов. На железе образуются гидроксильные группы. Цинк в данной гальванической паре, как более активный металл, будет являться анодом и в присутствии среды, проводящей электрический ток, будет разрушаться, железо же не ржавеет. Поэтому оцинкованные ведра сравнительно недороги и служат долго.
Анод(Zn): Zn0 – 2ē → Zn2+
Катод(Fe): 4ē + O2 + 2H2O → 4OH–
Гидроксильные ионы, взаимодействуя с ионами цинка, образуют гидрат окиси цинка в виде белого нерастворимого осадка:
Zn2+ + 2OH– → Zn(OH)2↓
Способы защиты от коррозии
1. легирование металлов, т.е. получение сплавов. Если хром добавить в сталь, когда она варится, получается очень твердый сплав, из которого можно делать и танки, и броню для боевых кораблей, и стволы пушек. А если побольше хрома прибавить, тогда получится сталь для подводных лодок. Она не ржавеет и называется нержавеющей сталью. Если в сталь добавить никель, то такую сталь ржавчина никогда не съест. Нержавеющая сталь, содержащая хром или никель, вероятно, есть у многих дома. Из такой стали делают ложки, вилки, ножи. Они довольно легкие, по цвету немного темнее серебра.
Если хром добавить в сталь, когда она варится, получается очень твердый сплав, из которого можно делать и танки, и броню для боевых кораблей, и стволы пушек. А если побольше хрома прибавить, тогда получится сталь для подводных лодок. Она не ржавеет и называется нержавеющей сталью. Если в сталь добавить никель, то такую сталь ржавчина никогда не съест. Нержавеющая сталь, содержащая хром или никель, вероятно, есть у многих дома. Из такой стали делают ложки, вилки, ножи. Они довольно легкие, по цвету немного темнее серебра.
2. нанесение на поверхность металлов защитных пленок: лака, краски, эмали, других металлов.
Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки. И то и другое получают главным образом протягиванием листа железа через расплав соответствующего металла.
Покрытия из цинка и олова (так же, как и других металлов) защищают железо от коррозии при сохранении сплошности. При нарушении покрывающего слоя (трещины, царапины) коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется «работой» гальванического элемента железо – цинк и железо – олово.
При нарушении покрывающего слоя (трещины, царапины) коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется «работой» гальванического элемента железо – цинк и железо – олово.
3. введение ингибиторов (замедлителей коррозии) Известно более 5 тыс. ингибиторов
Проведение эксперимента. В пробирку на 1/5 объема налили разбавленную серную кислоту, затем поместили в нее железные стружки. Довели до кипения. Наблюдали выделение пузырьков газа водорода.
Затем в эту же пробирку добавили ингибитор уротропин (1 измельченную таблетку). Уротропин можно заменить тиомочевиной или сухим горючим. Реакция с кислотой прекратилась.
4. протекторный метод защиты от коррозии. Протекторная защита – это электрохимический способ защиты металлов. Он заключается в том, что защищаемый металл, например железо, соединяют с протектором – более активным металлом (цинк, алюминий, магний). Чтобы спасти стальные конструкции, «приносят в жертву» магниевые блоки, расположенные во влажном грунте на некотором расстоянии друг от друга. Примерно также защищают цинковыми пластинами стальные корпуса морских судов. При контакте двух металлов протектор, сделанный из более активного металла будет разрушаться, защищая конструкцию. Протекторную защиту используют для металлических конструкций, соприкасающихся с морской и речной водой. В быту – пример электрохимической защиты – это оцинкованное ведро. Цинковый слой может иметь дефекты, царапины, он может даже не покрывать полностью все ведро – защитное действие все равно будет обеспечено.
Примерно также защищают цинковыми пластинами стальные корпуса морских судов. При контакте двух металлов протектор, сделанный из более активного металла будет разрушаться, защищая конструкцию. Протекторную защиту используют для металлических конструкций, соприкасающихся с морской и речной водой. В быту – пример электрохимической защиты – это оцинкованное ведро. Цинковый слой может иметь дефекты, царапины, он может даже не покрывать полностью все ведро – защитное действие все равно будет обеспечено.
Эйфелеву башню красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
IV.Закрепление:
1.Отметьте верные высказывания:
1) Корродирует только железо.
2) Причиной коррозии является только вода.
3) Коррозия – окислительно-восстановительный процесс.
4) Чтобы защитить металл от коррозии, надо убрать одно из условий возникновения коррозии.
5) При повышении температуры скорость коррозии уменьшается.
2. По отдельности алюминий и титан устойчивы к действию морской воды. Почему, если они контактируют в одном изделии, например в боксе для подводной фототехники, алюминий очень быстро разрушается, и бокс протекает?
Почему, если они контактируют в одном изделии, например в боксе для подводной фототехники, алюминий очень быстро разрушается, и бокс протекает?
3. Более полутора тысяч лет назад в Индии была изготовлена железная колонна весом в 6,5 т, высотой 7,3 м, диаметром у основания 41,6 см, у верха 29,5 см, стоящая ныне на одной из площадей индийской столицы .Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии. Почему на нее не действует коррозия?
4. Иногда зубные коронки, изготовленные из различных металлов (золота и стали) и близко расположенные друг к другу, доставляют их носителям неприятнейшие болевые ощущения. С чем это связано?
5. Один из американских миллионеров, не жалея денег, решил построить самую шикарную яхту. Ее днище было обшито дорогим монель металлом (сплав 70% никеля и 30% меди), а киль, форштевень и раму руля изготовили из стали. Однако яхта еще до завершения отделочных работ вышла из строя, ни разу не побывав в море. Интересно, что яхте было дано имя «Зов моря». В чем причина недолговечности яхты?
Интересно, что яхте было дано имя «Зов моря». В чем причина недолговечности яхты?
Самостоятельная работа:
Вариант №1
Что такое коррозия? Какие факторы способствуют замедлению коррозии?
На стальной крышке поставлена медная заклепка. Что раньше разрушится – крышка или заклепка? Почему?
Вариант №2
Какие виды коррозии вам известны?
Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Вариант №3
Какие факторы способствуют усилению коррозии?
Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются медь или цинк; Алюминий или железо? Почему?
Вариант №4
Перечислите способы борьбы с коррозией металлов.
Почему на оцинкованном баке, на месте царапины, цинк разрушается, а железо не ржавеет?
V. Домашнее задание: § 6.6, упр.3,4,5.
VI. Подведение итогов.
Итак, на сегодняшнем уроке мы с вами изучили один из важнейших вопросов химической промышленности – коррозию металлов. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
VII. Комментирование оценок.
Дополнительный материал по теме.
О том, сколь коварна и прожорлива коррозия, знают все автомобилисты. Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение. В январе 1986 г в Брюсселе проходил международный автосалон, на котором демонстрировалось более 1300 автомобилей из трех десятков стран. Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет. Чтобы ни у кого на этот счет не возникало сомнений, фирма придумала оригинальную рекламу: на одном из ее стендов был установлен гигантский аквариум с водой, в котором, пока функционировал салон, все время находился автомобильный остов, прошедший перед этим специальную антикоррозионную обработку. «Не знаем, как насчет 8 лет, но за дни работы салона, – шутила одна из бельгийских газет, – металлическая рыбка «Вольво» не проржавела».
Чтобы ни у кого на этот счет не возникало сомнений, фирма придумала оригинальную рекламу: на одном из ее стендов был установлен гигантский аквариум с водой, в котором, пока функционировал салон, все время находился автомобильный остов, прошедший перед этим специальную антикоррозионную обработку. «Не знаем, как насчет 8 лет, но за дни работы салона, – шутила одна из бельгийских газет, – металлическая рыбка «Вольво» не проржавела».
20.8: Коррозия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21797
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за заметным исключением золота и платины.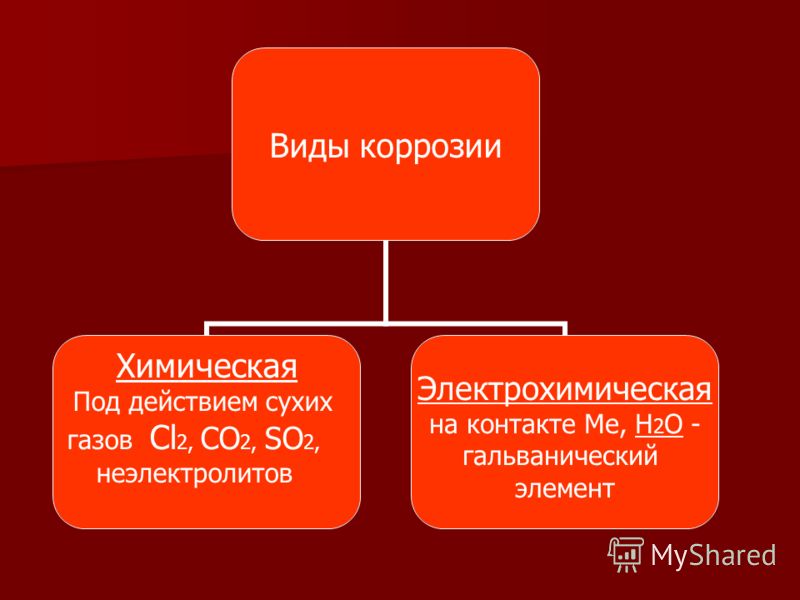 Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), широко известный как ржавчина, который не образует плотной защитной пленки (рис. \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
 В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.
В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн. ) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
 \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
\(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]Более активный металл реагирует с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита – это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь). В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
 Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).

Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме – из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.

Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
20.8: Коррозия распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- коррозия
- Профилактическая защита
- протекторный анод
- жертвенный электрод
Коррозия – определение, виды, предотвращение, примеры
Электрохимия – дисциплина физической химии, изучающая связь между электрическим потенциалом как количественным и количественным явлением и распознаваемым химическим изменением, с электрическим потенциалом в результате определенного химического изменить или наоборот. Электроны перемещаются между электродами через электронно-проводящую фазу (обычно, но не всегда, внешнюю электрическую цепь, например, при гальваническом покрытии), которая разделена ионопроводящим и электроизолирующим электролитом (или ионными частицами в растворе).
Коррозия
Коррозия описывается как химическое и электрохимическое разрушение металлов или сплавов окружающей влажной и влажной средой. Коррозия является окислительным процессом, так как она происходит в присутствии кислорода. Почти все металлы подвержены коррозии, однако скорость коррозии зависит от металла.
Металлы образуют стабильные соединения, такие как оксиды, гидроксиды и сульфиды, в результате коррозии, которая является спонтанным и необратимым процессом.
Факторы, влияющие на коррозию
- Положение металлов в электрохимическом ряду – В коррозии чрезвычайно важен электрохимический ряд. Активные металлы быстрее теряют электроны и быстрее подвергаются коррозии. Железо, например, быстро окисляется, а золото не потому, что оно менее реакционноспособно, чем железо.
- Примеси в металлах – В общем, присутствие загрязняющих веществ в металлах ускоряет коррозию, поскольку эти примеси действуют как микроскопические электрохимические ячейки, вызывающие коррозию.

- Наличие электролитов – Поскольку они переносят ионы, растворенная в воде соль действует как электролит. Коррозия ускоряется, когда в воде присутствуют электролиты.
- Концентрация кислорода – Коррозия ускоряется при увеличении содержания кислорода. Анод — это место с меньшей концентрацией кислорода, тогда как катод — это область с более высокой концентрацией кислорода. В результате происходит коррозия.
- Влажность воздуха – Когда погода влажная, присутствие влаги с высокой температурой ускоряет коррозию, потому что ионы приобретают энергию и начинают двигаться быстрее при более высокой температуре, что приводит к более частым столкновениям.
Типы коррозии
- Равномерная коррозия- Коррозия этого типа довольно распространена. Этот вид коррозии приводит к однородной потере металла по всей поверхности. Примерами являются ржавчина, потускнение серебра и т. д.
- Точечная коррозия — Точечная коррозия — это тип локальной коррозии, которая повреждает поверхность металла, что приводит к образованию пятен или ямок.
 В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия.
В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия. - Щелевая коррозия- Щелевая коррозия вызывается застойным раствором в щелях по краям металлических поверхностей, таких как гайки и головки заклепок. Это может произойти при столкновении двух металлов или при столкновении металла с неметаллом. Например, коррозия металлических или неметаллических прокладок, муфт и соединений.
- Гальваническая коррозия- Когда два разнородных материала соединяются и вступают в электрический контакт с коррозионно-активным электролитом, возникает гальваническая коррозия. Например, в оцинкованном железе лист железа или стали покрыт цинком.
- Коррозионное растрескивание под напряжением — Это форма коррозии, при которой на поверхности металла появляются трещины в результате комбинированного воздействия прочности на растяжение и агрессивной среды.
 Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах.
Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах. - Межкристаллитная коррозия — Это разновидность коррозии, которая возникает вокруг границ зерен металла или сплава, содержащего примеси, а не внутри металла или сплава. Литые под давлением цинковые сплавы, содержащие алюминий, подвергающиеся воздействию пара в морской среде, проявляют межкристаллитную коррозию.
- Делегирование – Это редкий вид коррозии, который затрагивает только определенные металлы, такие как медные сплавы и серый чугун. Металл сплава теряет свой реактивный элемент и создает более стабильный коррозионностойкий элемент в пористом состоянии в процессе удаления сплава. Деникелирование, децинкификация и графитовая коррозия — все это случаи удаления сплавов.
- Эрозионная коррозия- Эрозионная коррозия представляет собой механическое разрушение металлической поверхности.
 В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии.
В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии.
Различные примеры коррозии
Металлы с более высокой реакционной способностью, такие как железо, медь и цинк, подвергаются коррозии быстрее. Коррозия может проявляться по-разному.
Ржавление железа
Ржавление – это процесс коррозии железа в присутствии воздуха и воды, в результате чего поверхность становится красновато-коричневой. Это происходит, когда железо окисляется в присутствии кислорода и воды. Ржавчина — это новое вещество с химической формулой Fe 2 O 3 .xH 2 O, представляющее собой гидратированную форму оксида железа (III) (где x варьируется).
Хотя ржавление железа является естественным явлением, этот процесс очень похож на реакцию электрохимической ячейки.
Анод образуется, когда железо теряет электроны и становится Fe 2+ .
999. Медьна катоде:
H + +E– → H
4H +O 2 → 2H 2 O
4H + +O 2 +4E – 400414. 400414. – 400414. – 400414. – 400414. – . 2 O
Оксиды железа далее окисляются до ионов железа, которые затем объединяются с H 2 O с образованием комплекса.
Полуреакция окисления
Fe(s)→Fe 2 +(aq) +2e – × 2 (E ∘ = –0,44 В)
Полуреакция снижения
4H + +O 2 +4E – + +O 2 +4E – + +O 2 +4E – + +O 2 +4E – + +O 2
4H + +O 2
2 O(E ∘ =1.23V)
Overall Cell reaction
E ∘ cell = E ∘ red – E ∘ oxd
E ∘ ячейка = 1,23–(–0,44)В
E ∘ ячейка = 1,67В
2FE (S)+4H ++O 2 → 2FE 2+ (AQ)+2H 2 O (E ∘ = 1,67 В)
2FE 3 ++ 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O 3O.
2 → 2FE 2 O 3
FE 2 O 3 +XH 2 O → FE 2 O 3 .XH 2 O (Rust)
Под воздействием окружающей среды медные материалы или медные сплавы подвергаются коррозии. Когда медь окисляется, блестящая медная поверхность тускнеет, становясь темно-коричневой или черной, а затем зеленой. В результате этого выщелачивания медь подвергается коррозии.
Сине-зеленый цвет «Статуи Свободы» является примером коррозии медного металла. Он не был окрашен в тот же цвет, что и сейчас, когда был построен. Скорее, он был коричневого цвета. Медь, с другой стороны, со временем окислялась и взаимодействовала с триоксидом серы, углекислым газом и водой в атмосфере, образуя новое химическое вещество, которое придавало ей характерный сине-зеленый налет.
Ниже приводится химическое уравнение коррозии медного металла:
Потускнение серебра
Химическое взаимодействие между серебром и серосодержащими соединениями в воздухе вызывает потускнение серебра. Сульфид серебра образуется при смешивании серебра с серой. Потускнение – это процесс, при котором металлическое серебро становится черным из-за покрытия сульфидом серебра.
Сульфид серебра образуется при смешивании серебра с серой. Потускнение – это процесс, при котором металлическое серебро становится черным из-за покрытия сульфидом серебра.
Ниже приводится химическое уравнение потускнения металлического серебра:
2Ag+H 2 S → Ag 2 S+H 2
Методы предотвращения коррозии
Коррозия — нежелательное явление, которого следует избегать, поскольку она наносит значительный ущерб металлическим конструкциям, таким как мосты, скульптуры, памятники, металлическая посуда и т. д.
Все методы предотвращения коррозии основаны на одной и той же базовой концепции: прекращение подачи воды и воздуха к металлу. Ниже приведены некоторые меры по предотвращению коррозии:
- Окраска- Окраска металлических изделий, таких как ворота и перила, предотвращает контакт металла с воздухом и водой. Покраска металлических изделий защищает их от коррозии.
- Смазка маслом и смазкой- Смазка маслом и смазкой, как и покраска, создает на металлической поверхности защитное покрытие, защищающее ее от коррозии.

- Гальванизация- Гальванизация – это процесс покрытия железных и стальных изделий тонким слоем цинка для их защиты. Оцинкованные изделия защищены от коррозии или ржавчины даже после разрушения цинкового покрытия.
- Легирование- Сплавы состоят из однородной комбинации металлов и неметаллов. Требуемых характеристик металлов можно добиться путем их легирования. Железо, например, очень полезный металл, но оно быстро ржавеет. В результате, когда это железо соединяется с никелем и хромом, создается нержавеющая сталь. Нержавеющая сталь в настоящее время широко используется в производстве посуды.
Примеры вопросов
Вопрос 1: Что такое коррозия?
Ответ
Коррозия – это химическое и электрохимическое разрушение металлов или сплавов, вызванное окружающей влажной и влажной средой. Коррозия является окислительным процессом, так как она происходит в присутствии кислорода.
Вопрос 2: Как предотвратить коррозию?
Ответить
- Покраска, смазка и смазка изделий из железа предотвращает контакт металла с воздухом и водой. Таким образом, предотвращается коррозия.
- Гальванизация — это процесс покрытия изделий из железа и стали тонким слоем цинка для их защиты. Оцинкованные изделия защищены от коррозии или ржавчины даже после разрушения цинкового покрытия.
- Мы можем добиться требуемых качеств металлов и предотвратить коррозию путем их легирования.
Вопрос 3: Какие факторы влияют на коррозию?
Ответ
Положение металлов в электрохимическом ряду, примеси в металлах, наличие электролитов, концентрация кислорода, атмосферная влажность и другие факторы окружающей среды, такие как высокая температура, наличие в атмосфере различных газов, вызывающих коррозия и т. д.
— все это факторы, влияющие на коррозию.
Вопрос 4: Какие существуют типы коррозии?
Ответ
Различные типы коррозии включают равномерную коррозию, точечную коррозию, щелевую коррозию, гальваническую коррозию, коррозионное растрескивание под напряжением, межкристаллитную коррозию, расслаивание, эрозионную коррозию.
Вопрос 5: Что такое потускнение серебра?
Ответ
Серебро тускнеет из-за химической реакции между серебром и серосодержащими химическими веществами в воздухе. При соединении серебра с серой образуется сульфид серебра. Потускнение происходит, когда слой сульфида серебра покрывает серебряный металл, делая его черным.
2Ag+H 2 S → Ag 2 S+H 2
Вопрос 6: Что такое ржавление железа?
Ответ
В присутствии воздуха и воды железо подвергается коррозии, образуя оксид железа и ржавчину.
Fe 2 O 3 +xH 2 O→Fe 2 O 3 .xH 2 O
Вопрос Что такое порок 7 Crerosion:?Ответ
Застой раствора в зазорах по краям металлических поверхностей, таких как гайки и головки заклепок, вызывает щелевую коррозию. Это может произойти, когда сталкиваются два металла или когда металл сталкивается с неметаллом. Например, коррозия металлических или неметаллических прокладок, муфт и соединений.
Введение в коррозию и процесс
Что такое коррозия?
Коррозия – это разрушение материалов в результате химического взаимодействия с окружающей средой.
Большинство металлов подвержены коррозии при контакте с водой (и влагой в воздухе), кислотами, основаниями, солями, маслами, агрессивными полиролями для металлов и другими твердыми и жидкими химическими веществами. Металлы также подвергаются коррозии при воздействии газообразных материалов, таких как пары кислот, формальдегид газ, газообразный аммиак и серосодержащие газы.
Термин «коррозия» иногда также применяется к разложению пластмасс, бетона и дерева, но обычно относится к металлам.
Как возникает коррозия?
Коррозия представляет собой электрохимическую реакцию. Для реакции необходимы четыре условия:
- Анод
- Катод А
- Электронный путь
- Электролит (ионный путь)
Электрохимия коррозии
Процесс коррозии (анодная реакция) металла, растворяющегося в виде ионов, генерирует некоторое количество электронов, как показано здесь, которые потребляются вторичным процессом (катодная реакция).Эти два процесса должны сбалансировать свои расходы.
Участки, в которых происходят эти два процесса, могут быть расположены близко друг к другу на поверхности металла или далеко друг от друга в зависимости от обстоятельств.
Электроны (e- на этом рисунке), образующиеся в результате реакции коррозии, должны быть поглощены катодной реакцией в непосредственной близости от самой реакции коррозии.
Железо в деаэрированном нейтральном растворе
Анодная реакция
- площадь поверхности = 1 см2
- Fe -> Fe2+ + 2 e-
- E0 = -0,44 В по сравнению с SHE
- для корродирующего металла можно принять, что Eeq = E0 · i0 = 10-6 А см-2
- I0 = 1×10-6 А
- ба = 0,120 В декада-1
Катодная реакция
- площадь поверхности = 1 см2
- [Н+] = 10-5 (pH = 5)
- 2 Н+ + 2 е- –> h3
- Eeq = E0 + 0,059 log10 [H+] = 0,0 – 0,059x(-5) = -0,295 В по сравнению с SHE
- i0 = 10-6 А см-2
- I0 = 1×10-6 А
- bc = -0,120 В декада-1
Последовательность коррозии (питтинг)
Типы коррозии
Типы коррозии делятся на три основные группы. Группа 1 – это те, которые легко идентифицировать при обычном визуальном осмотре. Группа 2 — это особые состояния, при которых могут потребоваться дополнительные средства обследования.
Наконец, группа 3 подвергается проверке и обычно требуется микроскопией (оптической, электронной микроскопией и т. д.). Это также выделяет атмосферную коррозию и высокотемпературную коррозию.
Группа 1 — это типы коррозии, легко идентифицируемые при обычном визуальном осмотре. Сюда входят равномерная коррозия, точечная коррозия, щелевая коррозия (под которой подразумеваются: щелевая модель, нитевидная коррозия и пакетная ржавчина), гальваническая коррозия, пластинчатая коррозия.Для типов группы 2 обычно могут потребоваться дополнительные средства проверки. Эрозионная коррозия, кавитация, фреттинг-коррозия, межкристаллитная коррозия, расслоение и расслаивание (выборочное выщелачивание или селективная атака) определяют глубину определенной коррозии в этой категории.
Группа 3 — это место, где коррозия проверяется и обычно требуется с помощью микроскопии (оптической, электронной микроскопии и т. д.). Определенные типы могут относиться к растрескиванию под воздействием окружающей среды, коррозионному растрескиванию под напряжением (SCC), коррозионной усталости и водородному охрупчиванию.
Равномерная коррозия
Этот тип коррозии происходит на большей части поверхности металла с постоянной и часто предсказуемой скоростью. Как наиболее распространенная форма коррозии, она обычно характеризуется химической или электрохимической реакцией, которая протекает равномерно по всей открытой поверхности или на большой площади.Точечная коррозия
Точечная коррозия возникает в материалах, имеющих защитную пленку, например, в продуктах коррозии, или при разрушении покрытия. Это локальная форма коррозии, при которой в материале образуются полости или «отверстия».
Желобовые ямы
Боковые ямы
Щелевая коррозия
Щелевая коррозия представляет собой локализованную форму коррозии на микросредовом уровне, обычно связанную с застойной средой.Щелевая коррозия инициируется изменениями местного химического состава в щели:
- Истощение ингибитора в щели
- Истощение кислорода в расщелине
- Переход к кислотным условиям в расщелине
- Накопление агрессивных ионов (например, хлорида) в щели
Нитевидная коррозия
Особая форма щелевой коррозии, при которой накопление агрессивных химических веществ происходит под прорванной защитной пленкой.Обычно начинается с небольших, иногда микроскопических дефектов покрытия. Наиболее подвержены этой проблеме лаки и «быстросохнущие» краски. Их использования следует избегать, если отсутствие неблагоприятного воздействия не доказано полевым опытом. Там, где требуется покрытие, оно должно обладать низкими характеристиками паропроницаемости и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
Пакетная ржавчина
Пакетная ржавчина представляет собой форму локализованной коррозии, типичную для стальных компонентов, которая образует трещину в открытой атмосферной среде. Это выражение часто используется при осмотре мостов для описания сборных элементов стальных мостов, на которых видны следы ржавчины между стальными пластинами.Гальваническая коррозия
Это происходит, когда два разных металла соприкасаются друг с другом, и вызвано большей готовностью одного из них отдавать электроны, чем другим.Это одна из наиболее распространенных форм коррозии, а также одна из самых разрушительных. Вот классический пример гальванической коррозии; винт из нержавеющей стали, контактирующий с шайбой из стали, покрытой кадмием.
Чемодан со статуей Свободы
Первоначально гальваническая реакция между железом и медью была смягчена путем изоляции меди от железного каркаса с помощью асбестовой ткани, пропитанной шеллаком. Однако целостность и герметизирующие свойства этого импровизированного изолятора нарушились в течение многих лет воздействия высоких уровней влажности, обычных для морской среды.
Пластинчатая коррозия или расслоение
Расслаивающая коррозия представляет собой особую форму межкристаллитной коррозии, связанную с высокопрочными алюминиевыми сплавами. Сплавы, подвергшиеся экструдированию или другой интенсивной обработке, с микроструктурой удлиненных, сплющенных зерен, особенно подвержены этому повреждению.
В сплавах черных металлов расслоение характеризуется чрезмерным внутренним ростом оксида, объем которого примерно в семь раз превышает объем стали.
Чрезмерный внутренний рост оксида может повысить температуру, а отслоившийся материал может повредить турбины. Расслоение происходит в ферритных материалах, когда происходит многослойный рост.
Напряжения вызваны температурными циклами и разницей теплового расширения шкалы и трубки. Расслоение также может происходить в аустенитных нержавеющих сталях, опять же из-за разницы в тепловом расширении между металлом и оксидом.
Эрозионная коррозия
Эрозионная коррозия – это ускорение скорости коррозионного воздействия на металл из-за относительного движения агрессивной жидкости и поверхности металла.
Повышенная турбулентность, вызванная изъязвлением внутренней поверхности трубы, может привести к быстрому увеличению скорости эрозии и, в конечном итоге, к утечке.
Эрозионная коррозия также может усугубляться некачественной работой.
Кавитационная эрозия
Кавитация возникает, когда рабочее давление жидкости падает ниже давления пара, вызывая образование и разрушение газовых карманов и пузырьков.
Эта форма коррозии разъедает улитки и рабочие колеса центробежных насосов сверхчистой воды, поскольку жидкость разъедает седла клапанов.
Он будет способствовать другим формам эрозионной коррозии, например, в отводах и тройниках.
Фреттинг-коррозия
Фреттинг-коррозия относится к коррозионным повреждениям на неровностях контактных поверхностей.
Это повреждение возникает под нагрузкой и при наличии повторяющихся относительных движений поверхности, например, вызванных вибрацией.
Ямы или канавки и оксидные частицы характеризуют это повреждение, обычно встречающееся в машинах, болтовых соединениях и шариковых или роликовых подшипниках.
Межкристаллитная коррозия
Межкристаллитная коррозия представляет собой локализованное воздействие вдоль границ зерен или непосредственно рядом с границами зерен, в то время как основная масса зерен остается практически незатронутой.
Делегирование (выборочное выщелачивание) Избранное воздействие
Это происходит в таких сплавах, как латунь, когда один компонент или фаза более восприимчивы к коррозии, чем другие, и корродирует преимущественно, оставляя пористый материал, который крошится.
Делегирование или селективное выщелачивание относится к селективному удалению одного элемента из сплава в результате процессов коррозии.
Растрескивание под воздействием окружающей среды
Растрескивание под воздействием окружающей среды относится к коррозионному растрескиванию, вызванному сочетанием условий, которые могут привести к одной из следующих форм коррозионного повреждения:
- Коррозионное растрескивание под напряжением
- Коррозионная усталость
- Водородное охрупчивание
Коррозионное растрескивание под напряжением
(SCC) – это растрескивание, вызванное комбинированным воздействием растягивающего напряжения и агрессивной среды.Коррозионная усталость
Коррозионная усталость является результатом совместного действия переменных или циклических напряжений и коррозионной среды.
Считается, что процесс усталости вызывает разрыв защитной пассивной пленки, что ускоряет коррозию.
Если металл одновременно подвергается воздействию агрессивной среды, разрушение может произойти при еще меньших нагрузках и по истечении более короткого времени.
Водородное охрупчивание
Включает проникновение водорода в компонент, событие, которое может серьезно снизить пластичность и несущую способность, вызвать растрескивание и катастрофические хрупкие разрушения при напряжениях ниже предела текучести восприимчивых материалов.Атмосферная коррозия
Металлы могут подвергаться коррозии при воздействии атмосферного воздуха на открытом воздухе в результате чередования влажных и сухих циклов, вызванных дождями и конденсацией.
Коррозия более значительна, когда в атмосфере присутствуют загрязняющие вещества, такие как диоксид серы или хлорид.
Факторы, способствующие атмосферной коррозии
- Ощутимая влага
- Высокая относительная влажность (выше 70-80%)
- Соляной туман
- Поверхностные загрязнения (пыль, остатки пота, паяльные флюсы и т.
д.)
- Атмосферные загрязнители (SO2, HCl, органические кислоты)
- Высокая температура
Высокотемпературная коррозия
Это форма коррозии, не требующая присутствия жидкого электролита. Этот тип повреждения называется «сухой коррозией» или «шелушением». Окисление металла/сплава произошло в результате воздействия высокой температуры.Коррозионная высокотемпературная среда
- Коррозионно-активные газы
- Ясень
- Расплавленные соли
- Расплавленные металлы
Последствия коррозии
- Уменьшение толщины металла, ведущее к потере механической прочности и разрушению или разрушению конструкции. Когда металл теряется в локализованных зонах, образуя структуру, похожую на трещину, очень значительное ослабление может быть результатом весьма незначительной потери металла.
- Опасности или травмы людей в результате разрушения или поломки конструкции (например, мостов, автомобилей, самолетов)
- Потеря времени наличия профильного производственного оборудования.
- Снижение стоимости товара из-за ухудшения внешнего вида.
- Загрязнение жидкостей в сосудах и трубах (например, пиво мутнеет, когда небольшое количество тяжелых металлов выделяется в результате коррозии)
- Перфорация сосудов и труб, позволяющая вытекать их содержимому и причиняющая вред окружающей среде. Например, протекающий бытовой радиатор может привести к дорогостоящему повреждению ковров и украшений, а вызывающая коррозию морская вода может попасть в котлы электростанции, если трубки конденсатора продырявятся.
Другие факторы, ускоряющие коррозию
- Кислотный дождь
- Прибрежный фактор
- Противообледенительные средства – например, дорожная соль, MgCl
- Эффект зеленого дома
Влияние кислотных дождей на поверхность краски
Скорость коррозии для железа наси
Приблизительное расстояние от прибоя (м)
Содержание солей в воздухе (мг NaCl/дм2)
Скорость коррозии (мм/год)
50
11.





 В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия.
В нейтральных или кислых растворах, содержащих галогениды, таких как соленая вода, содержащая NaCl, в нержавеющих сталях может наблюдаться точечная коррозия. Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах.
Коррозионное растрескивание под напряжением (SCS) — это разновидность коррозии, которая возникает в авиационных компонентах. В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии.
В агрессивной среде это вызвано относительной подвижностью частиц жидкости и твердых поверхностей. Например, заусенцы, оставленные на концах труб трубопровода, могут нарушить плавный поток воды, вызывая локальную турбулентность и высокие скорости потока, что приводит к эрозии-коррозии. 2 → 2FE 2 O 3
2 → 2FE 2 O 3 

 — все это факторы, влияющие на коррозию.
— все это факторы, влияющие на коррозию.


 Наконец, группа 3 подвергается проверке и обычно требуется микроскопией (оптической, электронной микроскопией и т. д.). Это также выделяет атмосферную коррозию и высокотемпературную коррозию.
Наконец, группа 3 подвергается проверке и обычно требуется микроскопией (оптической, электронной микроскопией и т. д.). Это также выделяет атмосферную коррозию и высокотемпературную коррозию. 


 Чрезмерный внутренний рост оксида может повысить температуру, а отслоившийся материал может повредить турбины. Расслоение происходит в ферритных материалах, когда происходит многослойный рост.
Чрезмерный внутренний рост оксида может повысить температуру, а отслоившийся материал может повредить турбины. Расслоение происходит в ферритных материалах, когда происходит многослойный рост.


 д.)
д.)