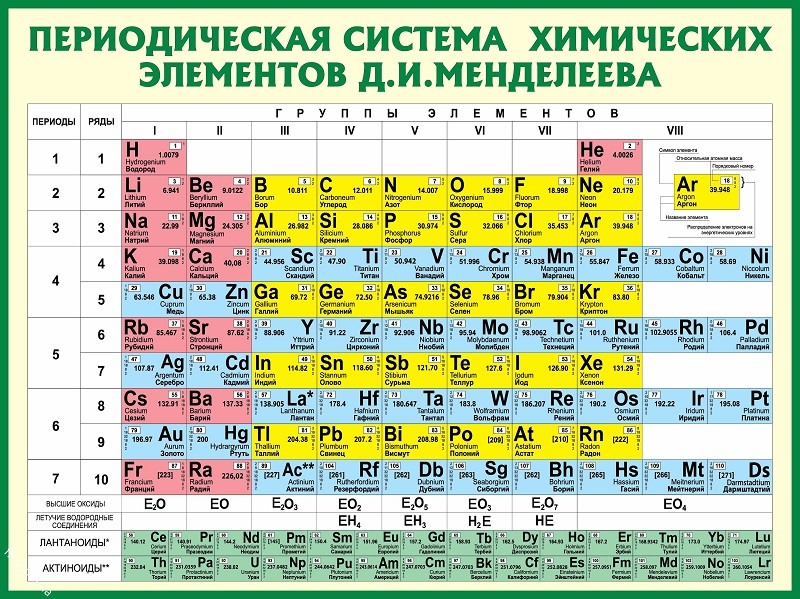
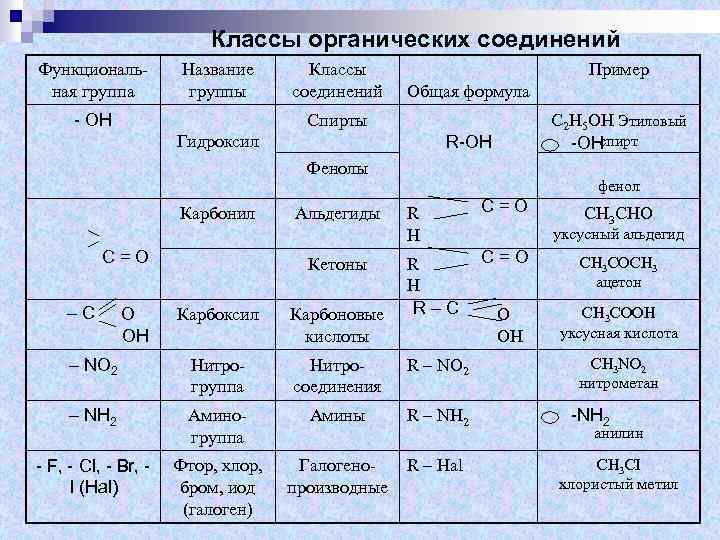
Что значит hv в химии: Что означает знак hv над стрелкой в химической реакции?
alexxlab | 23.04.2023 | 0 | Разное
Что такое E = hv в химии?
E = hv используется для расчета энергии электромагнитного излучения и называется соотношением Планка-Эйнштейна. «E» – энергия электромагнитного излучения, «h» – постоянная Планка. а «v» – частота электромагнитного излучения.
В 1900 году Планк выдвинул гипотезу о том, что энергия излучается квантами, а не непрерывным излучением. Он предложил уравнение E = hv, в котором говорится, что квант энергии связан с частотой. Он утверждал, что процессы поглощения и испускания излучения не имеют ничего общего с физической реальностью самого излучения. В 1905 году Эйнштейн переосмыслил гипотезу Планка и использовал ее для объяснения фотоэлектрического эффекта.
Похожие посты
Что такое энергия, которая может перемещаться через пустое пространство?
Из чего сделан свет?
Блокирует ли стекло УФ-лучи?
Что означает аббревиатура ЛАЗЕР?
Другие интересные посты
Чему равен один кулон в секунду?
Что такое коэффициент скорости?
Что такое МА в электричестве?
Правда ли, что уши и нос у людей продолжают расти?
Какова функция мочевого пузыря?
Видно ли полное солнечное затмение из любой точки Земли?
Как долго вы сможете прожить после того, как у вас отключится печень?
Что представляет собой молекула, состоящая из двух атомов водорода и одного атома кислорода?
Каковы основные источники углекислого газа в атмосфере?
Сколько времени нужно, чтобы вкусовые рецепторы отрастали?
Какие примеры горючих материалов?
Какова молекулярная форма CF4?
Ch3O полярный или неполярный?
Уравнения химических реакций – Основы химии на Ида Тен
Содержание статьи
Схема химической реакцииДля характеристики определенной химической реакции необходимо уметь составить запись, которая будет отображать условия протекания химической реакции, показывать какие вещества вступили в реакцию, а какие образовались.
Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции Рассмотрим в качестве примера реакцию взаимодействия угля и кислорода. Схема данной реакции записывается следующим образом:
С + О2 → СО2
уголь взаимодействует с кислородом с образованием углекислого газа
Углерод и кислород – в данной реакции реагенты, а полученный углекислый газ – продукт реакции. Знак «→» обозначает протекание реакции. Часто над стрелкой пишут условия, при которых происходит реакция
- Знак « t° → » обозначает, что реакция протекает при нагревании.
- Знак
- Знак « hv → » – что реакция протекает под действием света. Также над стрелкой могут указывать дополнительные вещества, участвующие в реакции.

- Например, « О2 → ». Если в результате химической реакции образуется газообразное вещество, то в схеме реакции, после формулы этого вещества записывают знак «→». Если при протекании реакции образуется осадок, его обозначают знаком «→».
- Например, при нагревании порошка мела (он содержит вещество с химической формулой CaCO3), образуются два вещества: негашеная известь CaO и углекислый газ. Схема реакции записывается так:
СaCO3 t° → CaO + CO2↑
Так, природный газ, в основном состоит из метана Ch5, при его нагревании до 1500°С он превращается в два других газа: водород Н2 и ацетилен С2Н2. Схема реакции записывается так:
Ch5 t° → C2h3 + h3.
Важно не только уметь составлять схемы химических реакций, но и понимать, что они обозначают. Рассмотрим, еще одну схему реакции:
h3O эл.
ток → Н2↑ + О2↑
Данная схема означает, что под действием электрического тока, вода разлагается на два простых газообразных вещества: водород и кислород. Схема химической реакции является подтверждением закона сохранения массы и показывает, что химические элементы во время химической реакции не исчезают, а только перегруппировываются в новые химические соединения.
Уравнения химических реакцийСогласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества.
СaCO3 t° → CaO + CO2↑
С + О2 ↑ СО2.
В данных схемах реакций знак «→» можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
Записи будут иметь следующий вид:
СaCO3 = CaO + CO2↑
С + О2 = СО2.
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Ch5 t° → C2h3 + h3.
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ. Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
2Ch5 t° → C2h3 + h3
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
2Ch5 = C2h3 + 3h3
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое. Закон сохранения массы выполняется! Рассмотрим другой пример. Схему реакции Na + h3O → NaOH + h3 необходимо превратить в уравнение. В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Na + h3O → 2NaOH + h3
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Na + 2h3O → 2NaOH + h3
Уравняем и количество атомов натрия:
2Na + 2h3O = 2NaOH + h3
Теперь количество всех атомов до и после реакции одинаковое. Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ. Подведем итоги об Уравнения химических реакций
- Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
- В схемах реакций используют обозначения, указывающие на особенности их протекания
- Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
- Схему химической реакции превращают в уравнение путем расстановки коэффициентов перед формулами веществ
различных определений – химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3807
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице объясняется, что такое изменение энтальпии, а затем даются определения и краткие комментарии для трех различных видов изменения энтальпии, с которыми вы столкнетесь.
Изменения энтальпии
Изменение энтальпии — это количество тепла, выделяемого или поглощаемого в реакции, проводимой при постоянном давлении. Ему дается символ ΔH, читаемый как «дельта H».
Стандартные изменения энтальпии
Стандартные изменения энтальпии относятся к реакциям, проводимым в стандартных условиях, когда все присутствует в их стандартных состояниях. Стандартные состояния иногда называют «эталонными состояниями».
Стандартные условия
Стандартные условия:
- 298 K (25°C)
- при давлении 1 бар (100 кПа).
- если речь идет о растворах, концентрация 1 моль дм -3
Стандартные состояния
Для стандартного изменения энтальпии все должно присутствовать в своем стандартном состоянии. Это физическое и химическое состояние, в котором вы ожидаете найти его в стандартных условиях.
Это означает, что стандартное состояние воды, например, жидкая вода, H 2 O(l) – кроме пара или водяного пара или льда.
Стандартное состояние кислорода – газ, O 2 (g) – не жидкий кислород или атомы кислорода.
Для элементов, имеющих аллотропы (две разные формы элемента в одном и том же физическом состоянии), стандартное состояние является наиболее энергетически стабильным из аллотропов.
Например, углерод существует в твердом состоянии как в виде алмаза, так и графита. Графит энергетически несколько более стабилен, чем алмаз, поэтому графит принимается за стандартное состояние углерода.
Точно так же в стандартных условиях кислород может существовать как O 2 (называемый просто кислородом) или как O 3 (называемый озоном, но это всего лишь аллотроп кислорода). Форма O 2 гораздо более энергетически стабильна, чем O 3 , поэтому стандартным состоянием кислорода является обычное состояние O 2 (g).
Символ для стандартных изменений энтальпии
Символ для стандартных изменений энтальпии – ΔH°, что читается как «стандарт дельта H» или, возможно, чаще как «нулевая дельта H».
Стандартное изменение энтальпии реакции, ΔH°
rПомните, что изменение энтальпии – это теплота, выделяемая или поглощаемая при протекании реакции при постоянном давлении. Стандартное изменение энтальпии реакции — это изменение энтальпии, которое происходит, когда количества веществ по уравнению реагируют в стандартных условиях и когда все находится в стандартном состоянии.
Это нужно немного изучить. Вот простая реакция между водородом и кислородом для получения воды:
- Во-первых, обратите внимание, что символом стандартного изменения энтальпии реакции является ΔH° r . Для изменения энтальпии реакции буква «r» (для реакции) часто упускается – это просто предполагается.
- «кДж моль -1 » (килоджоули на моль) не относится к какому-либо конкретному веществу в уравнении. Вместо этого он относится к количествам всех веществ, указанных в уравнении. В этом случае выделяется 572 кДж тепла, когда 2 моля газообразного водорода реагируют с 1 молем газообразного кислорода с образованием 2 молей жидкой воды.

- Обратите внимание, что все находится в стандартном состоянии. В частности, вода должна быть сформирована в виде жидкости.
- И есть скрытая проблема! Цифра приведена для реакции в стандартных условиях, но водород и кислород не реагируют в стандартных условиях.
Всякий раз, когда указывается стандартное изменение энтальпии, предполагаются стандартные условия. Если реакцию необходимо проводить в других условиях, будет зарегистрировано другое изменение энтальпии. Это должно быть рассчитано обратно к тому, что было бы в стандартных условиях. К счастью, вам не нужно знать, как это сделать на этом уровне.
Стандартное изменение энтальпии образования, ΔH°
fСтандартное изменение энтальпии образования соединения – это изменение энтальпии, которое происходит, когда один моль соединения образуется из его элементов в стандартных условиях, и все в его стандартное состояние.
Уравнение, показывающее стандартное изменение энтальпии образования воды:
Когда вы пишете одно из этих уравнений для изменения энтальпии образования, вы должны получить 1 моль соединения. Если вам нужно записать дроби в левой части уравнения, это нормально. (На самом деле, это не просто нормально, это необходимо, потому что в противном случае вы получите более 1 моля соединения, иначе уравнение не будет сбалансировано!)
Если вам нужно записать дроби в левой части уравнения, это нормально. (На самом деле, это не просто нормально, это необходимо, потому что в противном случае вы получите более 1 моля соединения, иначе уравнение не будет сбалансировано!)
Из уравнения видно, что при образовании 1 моля жидкой воды из ее элементов при стандартных условиях выделяется 286 кДж тепловой энергии.
Стандартные изменения энтальпии образования можно записать для любого соединения, даже если вы не можете получить его непосредственно из элементов. Например, стандартное изменение энтальпии образования жидкого бензола составляет +49 кДж моль -1 . Уравнение:
Если углерод не будет реагировать с водородом с образованием бензола, в чем смысл этого, и откуда кто-нибудь знает, каково изменение энтальпии?
Цифра +49 показывает относительное положение бензола и его элементов на энергетической диаграмме:
Откуда мы это знаем, если реакции не происходит? На самом деле очень просто вычислить его из других значений, которые мы можем измерить, например, из изменений энтальпии сгорания (будет дальше). Мы вернемся к этому снова, когда будем рассматривать расчеты на другой странице.
Мы вернемся к этому снова, когда будем рассматривать расчеты на другой странице.
Зная изменения энтальпии образования соединений, вы можете рассчитать изменения энтальпии целого ряда реакций, и, опять же, мы рассмотрим это более подробно на другой странице.
И последнее замечание об изменениях энтальпии образования:
Стандартное изменение энтальпии образования элемента в его стандартном состоянии равно нулю. Это важный факт. Причина очевидна. . .
Например, если вы «сделаете» один моль газообразного водорода, начиная с одного моля газообразного водорода, вы никак не измените его, поэтому вы не ожидаете никакого изменения энтальпии. Это в равной степени относится и к любому другому элементу. Изменение энтальпии образования любого элемента должно быть равно нулю из-за способа определения изменения энтальпии образования.
Стандартное изменение энтальпии сгорания, ΔH°
c Стандартное изменение энтальпии сгорания соединения – это изменение энтальпии, которое происходит, когда один моль соединения полностью сгорает в кислороде при стандартных условиях и при стандартное состояние.
Изменение энтальпии сгорания, конечно, всегда будет иметь отрицательное значение, потому что при горении всегда выделяется тепло. Два примера:
Примечание:
- Уравнения энтальпии сгорания часто содержат дроби, потому что вы должны начать с 1 моля всего, что вы сжигаете.
- Если вы говорите о стандартных изменениях энтальпии сгорания, то все должно быть в стандартном состоянии. Одним из важных результатов этого является то, что любая вода, которую вы пишете среди продуктов, должна быть там в виде жидкой воды.
Точно так же, если вы сжигаете что-то вроде этанола, который при стандартных условиях является жидкостью, вы должны указать его как жидкость в любом уравнении, которое вы используете.
- Обратите также внимание, что уравнение и количество тепла, выделяемого в случае с водородом, точно такие же, как вы уже встречались выше на странице. В то время он иллюстрировал энтальпию образования воды. Это может произойти в некоторых простых случаях.
 Говорить об изменении энтальпии образования воды точно так же, как говорить об изменении энтальпии сгорания водорода.
Говорить об изменении энтальпии образования воды точно так же, как говорить об изменении энтальпии сгорания водорода.
Авторы и авторство
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Ассорти определений» распространяется под лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Признаки химических реакций Учебное пособие
Инструменты Creator скоро будут вдохновлять!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия.
Общая химия.
ВВЕДЕНИЕ:
Вы когда-нибудь задумывались, что означает стрелка в химической реакции? Почему две разные группы химических веществ, такие как CH₄(г) + 2O₂(г) → CO₂(г) + 2H₂O(г) разделены стрелкой?
Это химическое уравнение. Символическим представлением химического изменения является химическое уравнение. Реагенты (химические вещества, которые инициируют химическую реакцию) представлены слева, а продукты (вещества, образующиеся в результате реакции) представлены справа. Знак стрелки («→», обычно читаемый вслух как «урожайность») разделяет их.
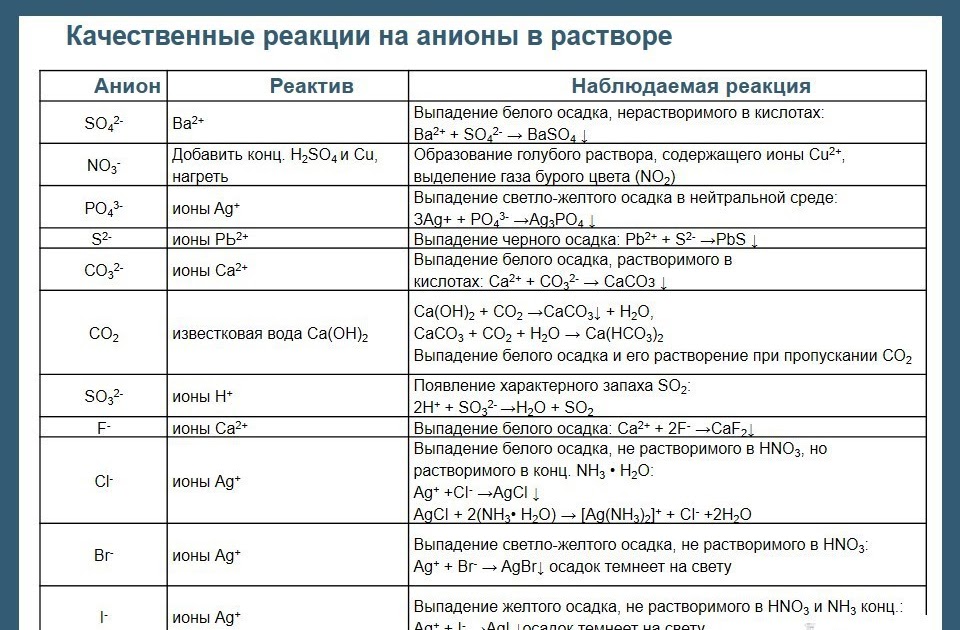
Признаки состояния продуктов и реагентов, будь то водные (растворенные в воде — aq), твердые (s), жидкие (l) или газообразные, должны быть включены в химические уравнения.
ИСПОЛЬЗОВАНИЕ СТРЕЛКИ В ХИМИЧЕСКИХ УРАВНЕНИЯХ
Когда реакция требует затрат энергии, это часто указывается над стрелкой. Если энергия поступает в реакцию в виде тепла, над стрелкой реакции ставится заглавная греческая буква дельта (Δ); если энергия подводится в виде света, вписано hv.
Источник
В нашей повседневной жизни возможны самые разные реакции: элементы могут образовывать соединения (как показано в реакции), соединения могут генерировать элементы (вода разделяется в присутствии электрического тока с выделением газообразного водорода и газообразный кислород), или соединения могут смешиваться, разделяться или реорганизовываться с образованием новых соединений.
Источник
ТИПЫ СТРЕЛОК В РЕАКЦИИ:
1. Стрелка вправо: Стрелка вправо является наиболее распространенной стрелкой в формуле химической реакции. Направление указывает направление реакции.
Направление указывает направление реакции.
Источник
2. Двойная стрелка: Двойной стрелкой обозначена обратимая реакция.
Источник
3. Стрелка равновесия: Когда реакция находится в равновесии, две стрелки с одиночными шипами, направленные в противоположные стороны, указывают на обратимую реакцию.
Источник
4. Сломанная или перечеркнутая стрелка: Стрелка с двойной чертой или крестом в центре указывает, что ответ не может быть получен. Сломанные стрелки также могут указывать на попытки, которые были предприняты, но не увенчались успехом.
Источник
ВЫВОД:
- Химическое уравнение представляет собой эмпирическое представление химического процесса.
- Основные материалы представлены в левой части уравнения как реагенты.
- Правая часть уравнения содержит продукты, являющиеся результатом реакции.
- Химический или физический переход представлен стрелкой.

- В формулах химических реакций правая стрелка является наиболее распространенной стрелкой. Направление указывает направление реакции.
Часто задаваемые вопросы:
1. Что такое стрелка в химическом уравнении?
Химические уравнения записываются в стандартном формате. Реагенты перечислены в левой части уравнения, а продукты — в правой. Направление реакции показано стрелкой, указывающей от реагентов к продуктам.
2. Что означает перечеркнутая стрелка в химии?
Стрелка с двойной чертой или крестиком по центру указывает, что ответ невозможен. Сломанные стрелки также можно использовать для обозначения реакций, которые были предприняты, но не увенчались успехом.
Мы надеемся, что вам понравился этот урок и вы узнали что-то интересное о Что означает стрелка в химическом уравнении ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности – мы обещаем, это делает учебу намного веселее! 😎
Продолжить обучение
Узнать о состояниях вещества
Узнать о структуре воды
Посмотреть 3D-модель водорода
ИСТОЧНИКИ:
- Реагенты и продукты.



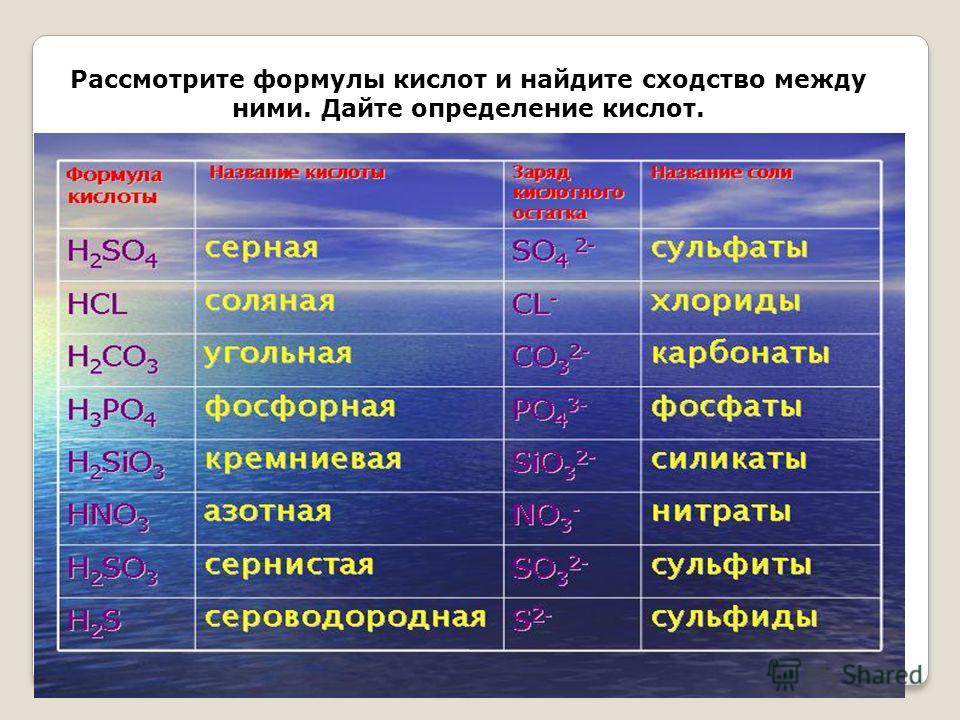
 ток → Н2↑ + О2↑
ток → Н2↑ + О2↑
 Говорить об изменении энтальпии образования воды точно так же, как говорить об изменении энтальпии сгорания водорода.
Говорить об изменении энтальпии образования воды точно так же, как говорить об изменении энтальпии сгорания водорода.