Cu характеристика элемента – Медь, свойства, соединения, сплавы, производство, применение
alexxlab | 05.03.2020 | 0 | Разное
Свойства элементов Iв группы: Cu, Ag, Au.
Значение темы: медь является необходимым микроэлементом растительных и животных организмов содержится в живых организмах в небольших количествах – около 100 мг в организме взрослого человека. Она входит в состав белков: гемокупреина, церулоплазмина, купрпротеина, ряда ферментов и концентрируется преимущественно в печени, головном мозге, в крови. Средняя дневная доза потребления меди для человека 4–5 мг. Соединения меди необходимы для синтеза гемоглобина и фосфолипидов.
Например, медьсодержащий белок плазмы крови – церулоплазмин (98% меди, содержащейся в плазме крови) выполняет в организме многопрофильную функцию, выполняя роль не только резервуара для меди, но и транспортную функцию, регулирующую баланс меди в организме. Недостаток меди ведет к развитию анемии (разрушению эритроцитов), нарушению остеогенеза, нарушается нормальное развитие соединительных тканей и кровеносных сосудов, а избыток может повлечь перерождение печени.
Важную физиологическую роль выполняет фермент супероксиддисмутаза, ускоряющий реакцию разложения супероксид-иона – О2–, возникающего в клетках вследствие свободнорадикального окисления веществ.
Не менее важную роль выполняет фермент цитохромоксидаза в дыхательной цепи.
У моллюсков и членистоногих кислород переносится медьсодержащим белком гемоцианином, находящимся только в плазме, а процесс связывания и освобождения кислорода происходит за счёт окисления и восстановления ионов меди (Сu+, Cu2+) в гемоцианине, что объясняет голубой цвет крови у этих организмов.
Сульфат меди CuSO4 ּ5H2O применяется в качестве антисептического, вяжущего, прижигающего средства для наружного применения в глазной и урологической практике. При приеме внутрь оказывает рвотное действие. В малых дозах соли меди входят в состав препаратов, улучшающих кроветворение.
В организме взрослого человека обнаруживается около 1 мг серебра. Ионы серебра бактерицидны. Они убивают грамположительные и грамотрицательные микроорганизмы, а также вирусы, инактивируя их ферментативные центры. Бактерицидные свойства серебра использовали еще в Древнем Египте: для лечения ран накладывали на их поверхность металлические серебряные пластины. В настоящее время применяется «серебряная вода», «серебряная марля», нитрат серебра, который обладает антисептическим и прижигающим действием. Последнее обусловлено способностью AgNO3 свертывать белки, превращая их в нерастворимые соединения при прижигании ран и язв. Для этих целей в медицине применяют нитрат серебра в виде палочек (Stilus Argenti
В организме взрослого человека обнаруживается до 10 мг золота. Препараты золота применяют также в качестве эффективных противовоспалительных средств. Золото, как благородный металл, устойчивый к окислению в различных средах, используют в стоматологии для изготовления зубных протезов. Все растворимые соединения меди, серебра и золота токсичны, особенно соединения меди.
Цель: изучить свойства меди, серебра, золота, необходимые для усвоения последующего материала и свойства их соединений, имеющих важное медико-биологическое значение.
Опыт 1. Получение гидроксида меди (II) и изучение его свойств
В четырёх пробирках получите гидроксид меди действием 1–2 капель раствора NaOH c с(1/1 NaOH) = 0,2 моль/дм3 на 3–5 капель раствора соли меди (II). Каков цвет осадка?
В одну пробирку добавьте избыток раствора NaOH, в другую – 30% раствор H2SO4, в третью – раствор аммиака, а четвёртую – нагрейте до кипения. Запишите наблюдения, обратите внимание на цвет растворов. Составьте уравнения реакций в молекулярной и ионной форме. Сделайте вывод о способе получения и свойствах гидроксида меди (II).
Опыт 2. Гидролиз солей меди (II)
а) Испытайте лакмусовой или универсальной индикаторной бумагой раствор соли меди (II). Какова реакция среды?
б) К 2–3 каплям раствора сульфата меди (II) прилейте равный объем раствора карбоната натрия. Какова реакция среды? Опишите наблюдения.
Составьте уравнение реакции гидролиза и уравнение реакции взаимодействия сульфата меди (II) с карбонатом натрия при участии воды, объясните образование осадка основного карбоната меди (II). Сделайте выводы.
Опыт 3. Получение комплексных соединений меди (II)
В пробирку с 1–2 каплями раствора сульфата меди (II) прибавляйте по каплям раствор аммиака до растворения выпадающего в начале осадка основной соли (CuOH)2SO4.
Опишите наблюдения, составьте уравнения реакций, учитывая, что в избытке раствора аммиака образуется одновременно комплексное основание и комплексная соль меди (II) с координационным числом 4. Напишите уравнения диссоциации гидроксида меди (II) и гидроксида тетрааминмеди (II). Какое основание сильнее? Почему? Сделайте выводы.Опыт 4. Получение серебряного зеркала.
В
пробирке нагрейте до кипения 1–2 мл
воды, добавьте в нее 1 каплю раствора
нитрата серебра и 1–2 капли (встряхивая
пробирку после добавления каждой капли)
2,0 моль/дм3 раствора аммиака до растворения выпавшего
в начале осадка Ag2O. Следует
избегать избытка раствора аммиака. К полученному прозрачному раствору
добавьте такой же объем 10% раствора
глюкозы, перемешайте и поставьте пробирку
в стаканчик с горячей водой на 2–3 мин.
Какое вещество выделяется на стенках
пробирки? Напишите уравнение реакции,
учитывая, что глюкоза переходит в
глюконовую кислоту – С
studfiles.net
1. Общая характеристика s-элементов.
s-ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
К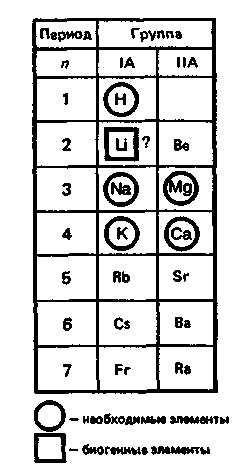 блокуs-элементов
относятся 13 элементов, общим для которых
является застраивание в их атомах
s-подуровня
внешнего энергетического уровня.
Электронная формула внешней оболочки
элементов IА-группы
и водорода ns1,
а элементовIIА-группы
и гелия ns2.
Хотя водород и гелий относят кs-элементам,
из-за специфики свойств их целесообразно
рассматривать отдельно.
блокуs-элементов
относятся 13 элементов, общим для которых
является застраивание в их атомах
s-подуровня
внешнего энергетического уровня.
Электронная формула внешней оболочки
элементов IА-группы
и водорода ns1,
а элементовIIА-группы
и гелия ns2.
Хотя водород и гелий относят кs-элементам,
из-за специфики свойств их целесообразно
рассматривать отдельно.
Как следует из электронных формул, элементы IА-группы имеют на внешнем энергетическом уровне по одному s-электрону, а элементы IIА-группы — по два электрона.
Химические свойства s-элементов IА- и IIА-групп сходны. s-Элементы легко отдают валентные s-электроны, т. е. они представляют собой сильные восстановители. Элементные вещества — типичные металлы, обладающие блеском, высокой электрической проводимостью и теплопроводностью, химически весьма активны.
s-Элементы имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило, они образуют соединения с ионным типом связи, исключение составляет водород, для которого в соединениях даже с самыми электроотрицательными элементами (например, в воде) характерна преимущественно ковалентная связь. Частично ковалентный характер связи в соединениях в известной мере имеет место у лития, бериллия и магния.
Большинство природных соединений натрия, калия, кальция, стронция растворимы в воде и слабых кислотах, и поэтому ионы этих металлов могут мигрировать из водных растворов в организм растений, животных и человека.
Водород, натрий, калий, магний, кальций — жизненно необходимы для живых и растительных организмов.
2. Водород и его соединения.
Водород — наиболее легкий s-элемент. Электронная формула валентной оболочки 1s1Водород относится к макроэлементам и играет важную роль в живых организмах. В периодической системе водород помещают как вместе с щелочными металлами, так и с галогенами. Действительно, водород сходен с элементамиIА-группы — щелочными металлами (образование иона Н+, восстановительная способность, взаимодействие с неметаллами).
Однако гораздо большее сходство водород имеет с галогенами: газообразное состояние при обычных условиях, двухатомная молекула простого вещества Н2, неполярная связь в молекуле Н2, полярные связи в соединениях с неметаллами, образование гидрид-иона Н– в соединениях с металлами NаН, СаH2 (подобно иону Г – в галогенидах металлов NаГ, СаГ2).
Таким образом, водород является элементом со специфическими свойствами и его следует рассматривать отдельно.
Основная особенность атома водорода заключается в том, что в отличие от других элементов его валентный электрон непосредственно находится в поле действия атомного ядра, так как отсутствуют промежуточные электронные оболочки, имеющиеся у других элементов. Другое отличие водорода — ионизированный атом — ион Н+ представляет собой элементарную частицу — протон весьма малых размеров (10-15 м).
Водород является одним из самых распространенных элементов Вселенной.
Концентрирование водорода в организме человека — около 10% (7 кг) по сравнению с его содержанием в земной коре (1%)—свидетельствует об исключительной роли водорода в биологических процессах. На 100 атомов водорода в организме человека приходится всего 58 атомов остальных элементов. В организме человека водород содержится в виде различных биоорганических соединений и воды.
Известны три изотопа водорода: протий (H), дейтерий (D), тритий (Т). Протий и дейтерий — стабильные изотопы, тритий — радиоактивен (период полураспада 12,5 лет).
В настоящее время дейтерий широко используют в качестве метки, вводимой в различные лекарственные препараты для исследования их фармако-кинетики.
Широкое применение находит и тритий, являющийся излучателем β-частиц. Этот изотоп используется в качестве метки для изучения различных метаболических реакций и для диагностики ряда заболеваний. Особенно часто реагенты, меченные тритием, используются при исследованиях механизма действия ферментов.
Тритий используют для определения общего количества воды в организме. Для этого в организм вводят определенное количество воды, содержащей известную долю трития. После полного усвоения введенной воды отбирают образец сыворотки крови и определяют в нем радиоактивность трития. Зная радиоактивность вводимой порции воды и радиоактивность сыворотки крови, можно рассчитать общее количество воды в организме.
Хотя дейтерий не радиоактивен, при работе с дейтерированными соединениями необходимо учитывать токсическое действие дейтерия на живые организмы.
Простые вещества. Водород образует двухатомные молекулы. Наличие трех изотопов обусловливает способность водорода образовывать молекулы протия Н2, дейтерия D2, трития Т2, протодейтерия НD, прототрития НТ, дейтеротрития DТ.
Наибольший интерес в связи с большой распространенностью в земной коре и живых организмах изотопа протия представляют свойства простого вещества протия Н2 — диводорода, в дальнейшем именуемого просто водородом.
Водород — самый легкий из всех газов. Малорастворим в воде, но хорошо растворим в некоторых металлах: Рt, Рd и др. Вследствие неполярности и большой прочности молекулы Н2 при комнатной температуре водород малоактивен и взаимодействует только с фтором. При нагревании водород реагирует со многими неметаллами — хлором, бромом, серой, кислородом и др. Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галогенидов. Так, например, при высокой температуре происходит восстановление оксида меди (II):
СuО(т) + Н2(г) = Сu(т) + Н2О(г)
Вследствие высокого поляризующего действия протон никогда не существует как таковой, он обязательно соединяется с другими атомами и молекулами, например, с водой ион водорода Н+ образует ион оксония Н3О+. В организме человека в соединениях с углеродом, азотом, серой водород ковалентно связан. Небольшая часть водорода находится в виде иона оксония Н3О+ (например, в желудочном соке). Содержащиеся в желудочном соке ионы оксония проявляют, с одной стороны, противомикробное действие — убивают многие микроорганизмы, занесенные в желудок с пищей. С другой стороны, ионы Н3О+ оказывают каталитическое действие — при их участии гидролизуются белки, полисахариды и другие биоорганические соединения.
Спецификой строения атома водорода обусловлено образование водородной связи. В живых организмах водородные связи имеются как в самом растворителе — воде, так и в растворенных в ней веществах — сахарах, белках, нуклеиновых кислотах и др.
Во всех соединениях, содержащихся в живых организмах, водород имеет степень окисления +1.
Наряду со способностью отдавать электрон атом водорода может присоединять электрон. При этом образуется отрицательный ион водорода — гидрид — Н–, имеющий устойчивую электронную конфигурацию благородного газа гелия. В виде иона Н– водород находится в соединениях с активными металлами — гидридах. При взаимодействии водорода с такими металлами проявляется его окислительная способность.
Биологическая роль важнейших соединений водорода и их применение в медицине. Вода — одно из самых важных и распространенных на Земле соединений водорода. Водное пространство занимает почти 75% поверхности земного шара. В организме взрослого человека в среднем содержится 65—67% воды, у эмбрионов (4-месячных) — 94, у новорожденных — 74%.
Все химические реакции в организме протекают только в водной среде. Жизнь без воды невозможна. Дистиллированная вода — фармакопейный препарат.
Тяжелую воду D2О широко применяют для изучения движения воды в растениях и скорости всасывания воды в человеческом организме. Например, использование D2О позволило установить, что в тканях некоторых растений вода двигается со скоростью 14 м в час, а вода, выпитая человеком, за 2 ч полностью распределяется по органам и тканям организма, и лишь через две недели полностью выводится из него.
В медицинской практике находит применение еще одно соединение водорода — пероксид водорода Н2О2. Это соединение является важным побочным продуктом метаболизма.
П ероксид
водорода — бесцветная, прозрачная
жидкость. При попадании на кожу и
слизистые вызывает жжение. Строение
молекулы Н2О2 показано на рис. 6.1. Молекула Н2О2 полярна, дипольный момент р =7,1 D.
Наличие неподеленных пар электронов у
атомов кислорода делает возможным
образование донорно-акцепторных связей
пероксида водорода с лигандами —
акцепторами электронов.
ероксид
водорода — бесцветная, прозрачная
жидкость. При попадании на кожу и
слизистые вызывает жжение. Строение
молекулы Н2О2 показано на рис. 6.1. Молекула Н2О2 полярна, дипольный момент р =7,1 D.
Наличие неподеленных пар электронов у
атомов кислорода делает возможным
образование донорно-акцепторных связей
пероксида водорода с лигандами —
акцепторами электронов.
Степень окисления кислорода в Н2О2 равна -1, т.е. имеет промежуточное значение между степенью окисления кислорода в воде (—2) и в элементном кислороде О2 (0). Из этого следует, что пероксид водорода может проявлять как свойства окислителя, так и свойства восстановителя (окислительно-восстановительная двойственность). Однако, для пероксида водорода более характерны окислительные свойства. Большинство встречающихся на практике веществ имеет более низкие окислительно-восстановительные потенциалы и Н2О2 может их окислять. Восстанавливать пероксид водорода может лишь относительно небольшую группу веществ.
В качестве примера реакции, в которой Н2О2 выступает окислителем, можно привести реакцию окисления сульфида никеля (II) в кислой среде до элементной серы:
NiS + H2O2 + 2CH3COOH = Ni(СНзСОО)2 +S + 2H2O
При взаимодействии с очень сильными окислителями, например с РbО2 в кислой среде, Н2О2 выступает в качестве восстановителя:
РbО2 + Н2O2 + 2СН3СООН = Рb(СН3СОО)2 + О2 + 2Н2О
Чистый пероксид водорода термодинамически нестабилен и при стоянии разлагается со взрывом на воду и кислород с выделением большого количества теплоты:
2Н2О2(ж) = 2Н2О + О2
Такое разложение Н2О2 является реакцией диспропорционирования (самоокисления — самовосстановления).
Водные растворы пероксида водорода более устойчивы, в прохладном месте они могут сохраняться длительное время. В продажу пероксид водорода обычно поступает в виде 30%-ного водного раствора — пергидроля.
Обычно в митохондриях атомы водорода, отщепленные от субстратов дегидрогеназами, передают свои электроны через цепь переносчиков кислороду О2, который восстанавливается при этом до воды:
О2 + 4Н+ + 4е~ = 2Н2О
Для клетки очень важно, чтобы, присоединив 4 электрона, молекула кислорода восстанавливалась до двух молекул воды. При неполном восстановлении кислорода, например в случае присоединения 2 электронов, образуется пероксид водорода:
О2 + 2Н+ + 2е– = Н2О2
а при присоединении 1 электрона — надпероксидный (супероксидный) радикал О2–:
О2 + е– = О2–
Процесс разложения пероксида водорода значительно ускоряется в присутствии солей тяжелых металлов. Катализируемое ионом металла разложение пероксида водорода может приводить к образованию радикалов, наиболее важными из которых являются гидроксидный НО• и гидропероксидный НО2•. Например, под действием Fе2+ происходит разрыв связи НО—ОН:
Fе2+ + Н2О2 → •ОН + ОН– + Fе3+
Важные промежуточные продукты восстановления элементного кислорода до воды — пероксид водорода и супероксидный радикал очень токсичны для клетки. Токсичность связана с тем, что Н2О2 и О2 взаимодействуют с липидным слоем клеточных мембран и повреждают их.
Аэробные клетки могут защитить себя от вредного действия водородпероксида и супероксид-радикала с помощью ферментов каталазы и, супероксиддисмутазы. Под действием медьсодержащего фермента супероксиддисмутазы (СОД) супероксидный радикал превращается в водородпероксид и элементный кислород, а под действием каталазы пероксид водорода превращается в воду и элементный кислород:
2Н2О2 → 2Н2О + О2
Освободившийся кислород принимает участие в дальнейших процессах биологического окисления.
В медицинской практике пероксид водорода применяют в основном как наружное бактерицидное средство. Действие Н2О2 основано на окислительной способности пероксида водорода и безвредности продукта его восстановления — воды. При обработке ран выделяющийся кислород играет двойную роль:
1) оказывает противомикробное, дезодорирующее и депигментирующее действие, убивая микробные тела;
2) образует пену, способствуя переходу частиц тканевого распада во взвешенное состояние и очищению ран.
В качестве фармакопейного препарата используется 3%-ный водный раствор пероксида водорода, 6%-ный раствор пероксида водорода применяют для обесцвечивания волос. В виде 30%-ного раствора пероксида водорода применяют при лечении бородавчатой формы красного плоского лишая и для удаления юношеских бородавок.
Наряду с окислительно-восстановительными свойствами Н2О2 проявляет и кислотно-основные. В молекуле пероксида водорода связи между атомами водорода и кислорода полярны, поэтому в водном растворе пероксида водорода ведет себя как очень слабая двухосновная кислота, т.е. отщепляет протоны. Н2О2 в незначительной степени ионизирует по первой ступени:
Н2О2 ⇄ Н+ + НО2-1
Ионизация по второй ступени:
НО2-1 ⇄ Н+ + О22-
в водной среде практически не протекает. Вода — более сильная кислота и ионы водорода, образующиеся при диссоциации воды, подавляют ионизацию НО2-1 (смещение влево по принципу Ле Шателье).
3. Общая характеристика s-элементов IА-группы. Щелочные металлы.
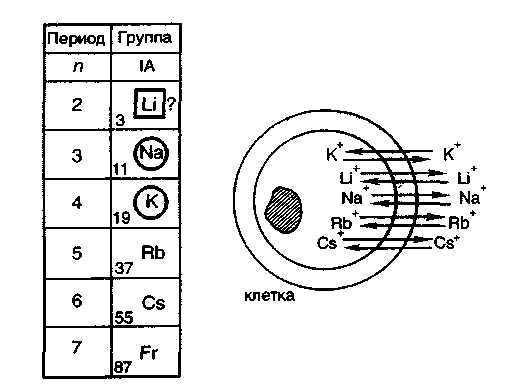
В IА-группу входят s-элементы — щелочные металлы, исключительно важные для нормальной жизнедеятельности животных и человека. Наибольшее значение для живых организмов имеют макроэлементы натрий, калий.
Электронная формула валентной оболочки, атомов щелочных металлов ns1, т.е. атомы этих элементов имеют по одному валентному электрону на s-подуровне внешнего энергетического уровня. Соответственно, устойчивая степень окисления щелочных металлов равна +1.
Все элементы IА-группы очень сходны по свойствам, что объясняется однотипным строением не только валентной электронной оболочки, но и предвнешней (за исключением лития).
С ростом радиуса атома в группе Li—Nа—К—RЬ—Сs—Fr ослабевает связь валентного электрона с ядром. Соответственно, в этом ряду энергия ионизации атомов щелочных металлов уменьшается. Имея на валентных оболочках один электрон, расположенный на большом расстоянии от ядра, атомы щелочных металлов легко отдают электрон. Это обусловливает низкую энергию ионизации. В результате ионизации образуются катионы Э+, имеющие устойчивую электронную конфигурацию атомов благородных газов.
В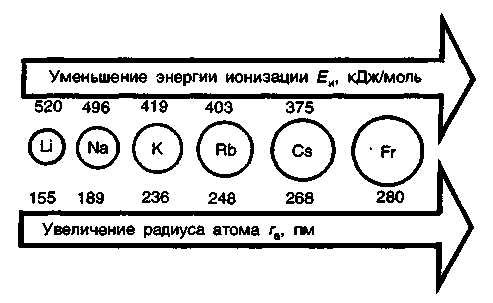 се
щелочные металлы имеют отрицательные
стандартные окислительно-восстановительные
потенциалы, большие по абсолютной
величине. Это характеризует их как очень
сильные восстановители. По химической
активности литий уступает многим
металлам, несмотря на то, что его
стандартный ОВ-потенциал наиболее
отрицателен. Такое значение лития
обусловлено большей энергией гидратации
ионовLi+ по сравнению с ионами других щелочных
металлов.
се
щелочные металлы имеют отрицательные
стандартные окислительно-восстановительные
потенциалы, большие по абсолютной
величине. Это характеризует их как очень
сильные восстановители. По химической
активности литий уступает многим
металлам, несмотря на то, что его
стандартный ОВ-потенциал наиболее
отрицателен. Такое значение лития
обусловлено большей энергией гидратации
ионовLi+ по сравнению с ионами других щелочных
металлов.
Вследствие незначительного поляризующего действия (устойчивая электронная структура, большие размеры, малый заряд ядра) комплексообразование для ионов щелочных металлов, в особенности для ионов К+, Rb+, Сs+, Fr+, малохарактерно. Тем не менее, они способны образовать комплексные соединения с некоторыми биолигандами.
Несмотря на общность свойств, натрий и в особенности литий отличаются от других щелочных металлов. Последнее, прежде всего, обусловлено существенным различием радиусов их атомов и строения электронных оболочек.
Сходство электронного строения ионов щелочных металлов, а, следовательно, и физико-химических свойств соединений определяет и близость их действия на биологические процессы. Различия в электронной структуре обусловливают их разную биологическую роль. На этой основе можно прогнозировать поведение щелочных металлов в живых организмах.
Так, натрий и литий накапливаются во внеклеточной жидкости, а калий, рубидий и цезий — во внутриклеточной. Вследствие близких значений радиусов ионов, энергий ионизации, одинаковых координационных чисел в живых организмах натрий и литий ведут себя сходным образом. Эти элементы, как правило, близки по оказываемому биологическому действию. Например, они очень похожи по ферментоактивирующим свойствам.
Близость свойств натрия и лития обусловливает их взаимозамещаемость в организме. В связи с этим при избыточном введении ионов натрия или лития в организм они способны эквивалентно замещать друг друга. На этом основано введение натрия хлорида при отравлении солями лития. В соответствии с принципом Ле Шателье равновесие между ионами натрия и лития в организме сдвигается в направлении выведения ионов Li+, что приводит к снижению его концентрации и достижению лечебного эффекта. Известные примеры влияния взаимозамещения натрия и лития на активность ферментативных процессов показывают, что в четырех случаях из пяти натрий является синергистом лития и только в одном случае антагонистом.
Рубидий и цезий близки по физико-химическим свойствам к иону калия, поэтому в живых организмах они ведут себя сходным образом. В изученных системах калий, рубидий и цезий являются синергистами, а с литием — антагонистами. На сходстве рубидия и калия основано введение в организм солей калия при отравлении солями рубидия.
Натрий и калий, как правило, являются антагонистами, но в ряде случаев близость многих физико-химических свойств обусловливает их взаимозамещение в живых организмах. Так, например, при увеличении количества натрия в организме усиливается выведение калия почками, т. е. наступает гипокалиемия.
Щелочные металлы относятся к числу наиболее активных в химическом отношении элементов. Химическая активность щелочных металлов закономерно увеличивается с ростом радиуса атомов.
При взаимодействии с кислородом литий образует оксид Li2О, а остальные щелочные металлы — пероксиды Nа2О2 и надпероксиды КО2, RbО2, СsО2. Например:
4Li(т) + O2(г) = 2Li2O(т)
2Nа(т) + О2(г) = Nа2О2(т)
К(т) + O2(г) = КO2(т)
П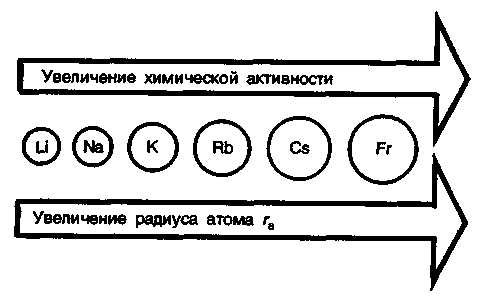 ероксиды
и надпероксиды щелочных металлов —
сильные окислители. Натрий пероксид и
калий надпероксид применяют в замкнутых
объектах (подводных лодках, космических
кораблях) для поглощения углерода
диоксида и регенерации кислорода:
ероксиды
и надпероксиды щелочных металлов —
сильные окислители. Натрий пероксид и
калий надпероксид применяют в замкнутых
объектах (подводных лодках, космических
кораблях) для поглощения углерода
диоксида и регенерации кислорода:
2Nа2О2(т) + 2СО2(г) = 2Nа2СО3(т) + О2(г)
4КО2(т) + 2СО2(г) = 2К2СО3(т) + 3О2(г)
Активно взаимодействуют щелочные металлы с галогенами, образуя галогениды ЭГ; с серой — с образованием сульфидов Э2S. Непосредственно с азотом щелочные металлы, за исключением лития, не реагируют.
Все щелочные металлы непосредственно взаимодействуют с водой, образуя гидроксиды ЭОН (щелочи):
2Э(т) + 2Н2О(ж) = 2ЭОН(р) + Н2(г)
Интенсивность взаимодействия с водой значительно увеличивается в ряду Li — Сs. Гидроксиды образуются и при взаимодействии с водой оксидов щелочных металлов:
Э2О(т) + Н2О(ж) = 2ЭОН(р)
Щелочи — относительно легкоплавки и хорошо растворимы в воде (за исключением LiOН). Твердые щелочи и их концентрированные растворы разъедающе действуют на живые ткани вследствие обезвоживания и щелочного гидролиза белков:
Поэтому работа с ними требует защитных мер предосторожности.
Большинство солей щелочных металлов хорошо растворимы в воде (исключение составляют соли лития: Li2СОз, LiF, Li3РО4). С многоосновными кислотами щелочные металлы образуют как средние (Э2SО4, Э3РО4, Э2СО3, Э2SО3 и др.), так и кислые (ЭНSО4, ЭН2РО4, Э2НРО4, ЭНСО3 и т.д.) соли.
studfiles.net
ЭЛЕМЕНТЫ ГРУППЫ I В
54
Лекция 5
ТЕМА: ЭЛЕМЕНТЫ ГРУППЫ I В
Вопросы, изучаемые на лекции:
- Общая характеристика элементов группы I В.
- Нахождение в природе и получение меди, серебра и золота.
- Физические и химические свойства простых веществ.
- Важнейшие соединения элементов подгруппы меди.
Общая характеристика элементов группы I В
К элементам группы I В относятся медь (Cu), серебро (Ag) и золото (Au). Эти элементы в своем периоде являются предпоследними d-элементами и вроде бы должны на предпоследнем d-подуровне иметь по 9 электронов. Однако вследствие устойчивости d10-конфигурации энергетически более выгодным оказывается переход (проскок) одного S-электрона на d-подуровень. Поэтому электронная валентная конфигурация этих атомов такова: (n I)d10nSI.
Таблица 6
Основные параметры атомов элементов I В группы
Валент-ная структура | Радиус атома ra, нм | ЕЭо → Э+, эВ. | Радиус иона rЭ+, нм | ЕЭ+→Э2+ эВ. | Ео, В Э++1е→Эо | Химическая активность | |
Cu | 3d104S1 | 0,128 | 7,73 | 0,098 | 20,29 | 0,52 | │ ↓умень- шается |
Ag | 4d105S1 | 0,144 | 7,57 | 0,113 | 21,5 | 0,799 | |
Au | 5d106S1 | 0,144 | 9,23 | 0,137 | 20,5 | 1,692 |
Как видно из таблицы, закономерности изменения основных параметров атомов обычные для подгруппы d-элементов, а именно:
- радиус атома сверху вниз в подгруппе увеличивается, но незначительно и у Ag и Au одинаков;
- энергия ионизации (ЕЭо → Э+) атома сверху вниз в подгруппе в целом увеличивается, поэтому химическая активность и восстановительные свойства уменьшаются. Самый сильный восстановитель (и самый активный металл) это Cu, хотя тоже – слабый восстановитель. Стандартный электродный потенциал атомов (Ео) больше нуля, поэтому Н2 из кислот они не вытесняют и в ряду стандартных электродных потенциалов металлов все находятся после водорода.
В то же время d-подуровень предвнешнего уровня хотя и завершен, но не может считаться вполне стабилизированным и способен к отдаче одного или двух электронов. И действительно, вторая энергия ионизации (ЕЭ+ → Э2+) намного меньше, чем у щелочных металлов (у лития ее значение равно 75,5 эв), поэтому Cu, Ag, Au могут проявлять С.О. не только +1, но и +2, +3. При этом наиболее характерная С.О. для Cu равна +2, для Ag равна +1 и для Au равна +3.
Особая устойчивость С.О. = +1 у серебра объясняется большой устойчивостью конфигурации 4d10, так как эта конфигурация образуется уже у палладия Pd, предшествующего серебру в таблице Менделеева Д.И.
Нахождение в природе и получение меди, серебра и золота
Содержание Cu, Ag, Au в земной коре невелико: содержание меди равно 0,01% (масс), серебра 10-5% (масс) и золота 5 ∙ 10-7% (масс). Все они встречаются в свободном состоянии в виде самородков, так как малоактивны.
Медь в земной коре встречается в основном в виде сульфидных руд: главные минералы халькопирит (медный колчедан) CuFeS2, медный блеск Cu2S, ковеллин CuS, малахит (CuOH)2CO3.
Самой важной серебряной рудой является аргентит (серебряный блеск) Ag2S. В качестве примеси Ag входит в медные и свинцовые руды, из них добывают примерно 80% Ag.
Золото почти исключительно в самородном состоянии в виде вкраплений в кварц. В малых количествах Au есть в сульфидных рудах железа, свинца и меди. Следы его открыты в морской воде.
Для получения меди чаще применяют пиро- и гидрометаллургические процессы. Пирометаллургические методы: из сернистых руд окислением получают оксиды меди, которые затем восстанавливаются, реагируя с избытком сульфида:
2Cu2O + Cu2S = 6Cu + SO2.
Получается медь чистоты 99,3 99,6% Cu. Для получения меди более высокой чистоты проводят электролитическое рафинирование электролизом CuSO4 с медным анодом.
Гидрометаллургические методы получения меди основаны на растворении медных минералов в разбавленных растворах h3SO4 или Nh4, а затем из полученных растворов медь вытесняют железом или выделяют электролизом.
Золото извлекают из измельченных золотоносных пород промывкой водой. Этот метод отделения от пустой породы основан на большой разности плотностей Au и песка (SiO2). Часто промывку совмещают с растворением золота в жидкой ртути с последующей разгонкой амальгамы.
Лучшим методом отделения золота от пустой породы является цианидный метод. Он основан на растворении золота в растворе NaCN за счет окисления О2 воздуха и перехода в анионный комплекс Na[Au(CN)2] с последующим вытеснением золота из полученного раствора цинком:
4Au + 8NaCN + 2h3O + O2 = 4Na[Au(CN)2] + 4NaOH.
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au.
Cu, Ag, Au известны с доисторических времен.
Cu, Ag, Au мягкие блестящие металлы: медь имеет красную окраску, Ag белую, Au желтую. Все они, особенно Au, характеризуются исключительной пластичностью (могут получаться в виде тончайшей проволоки или фольги). Все они обладают высокой электро- и теплопроводностью, причем Ag самый электропроводный из всех металлов. Имеют высокие температуры плавления и кипения. Образуют сплавы, особенно со ртутью.
Химическая активность меди, серебра и золота невелика и уменьшается в этом ряду. С кислородом реагирует лишь Cu, при этом при 400оС образуется CuO, при более высокой температуре Cu2O:
400oC
2Cu + O2 → 2CuO
более 400оС
4Cu + O2 → 2Cu2O
Au и Ag не реагируют с О2 даже при нагревании:
to
Au (Ag) + O2 → не реагируют.
При нагревании Cu и Ag реагируют с серой:
to to
2Cu + S → Cu2+1S 2Ag + S → Ag2S.
Вследствие окисления медь на воздухе покрывается плотной зелено-серой пленкой основного карбоната меди:
2Cu + O2 + h3O + CO2 → (CuOH)2CO3.
При наличии в воздухе Н2S серебро покрывается черным налетом Ag2S:
4Ag + 2h3S + O2 → 2Ag2S + 2h3O
С водородом и водой Cu, Ag, Au не реагируют:
to
Cu (Ag, Au) + h3 → не реагируют.
to
Cu (Ag, Au) + h3O → не реагируют.
Легче всего эти металлы реагируют с галогенами. Ag, Au реагируют с галогенами при нагревании. При нагревании компактная медь сгорает в атмосфере Cl2, реакция с Ag и Au идет очень медленно.
to
Cu + Cl2 → CuCl2 (AgCl, AuCl3, то есть в самой характерной С.О.).
В ряду стандартных электродных потенциалов металлов Cu, Ag, Au находятся после водорода, поэтому водород не вытесняют из растворов кислот и кислоты могут окислять их только за счет аниона. Поэтому HCl и разбавленная h3SO4 на них не действуют. Исключение представляет взаимодействие Cu с очень концентрированной HCl, так как в результате комплексообразования потенциал Cu сильно сдвигается в сторону отрицательных значений (то есть Cu как бы уже до Н стоит в ряду стандартных электродных потенциалов):
2Cuo + 4H+1Cl конц. → 2H[Cu+1Cl2] + h3o.
Аналогичный окислительно-восстановительный процесс, обусловленный комплексообразованием, протекает в растворах цианидов:
2Cuo + 4KCN + 2h3+1O → 2K[Cu+1(CN)2] + 2KOH + h3o.
Cu и Ag растворяются в азотной кислоте и при нагревании реагируют с концентрированной h3SO4:
to
Cu + 2h3SO4(конц.) → CuSO4 + SO2 + 2h3O
Ag + 2HNO3 → AgNO3 + NO2 + h3O.
Золото с этими кислотами не реагирует. Золото растворяется в горячей концентрированной h3SeO4, являющейся сильным окислителем:
2Au + 7h3SeO4 = 2H[Au(SeO4)2] + 3SeO2 + 6h3O.
Золото растворяется в царской водке и в насыщенном хлором растворе HCl. В обоих случаях окисление идет за счет атомов хлора и образования анионного комплекса:
Au + 3Cl + HCl = H[AuCl4].
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2h3O.
В отсутствие окислителей Cu, Ag, Au устойчивы к щелочам.
I. Соединения меди (I), серебра (I), золота (I).
Атомам меди, серебра, золота в С.О. = +1 соответствует электронная конфигурация (n 1)d10nSo. Эта степень окисления (С.О.) характерна для серебра. У меди и особенно у золота эта С.О. проявляется реже. В водных растворах Au+ и Cu+ в виде простых растворимых солей нестойки и как правило диспропорционируют, то есть в растворе устанавливаются равновесия:
2Cu+1 (р) ↔ Cuo (т) + Cu+2 (p)
3Au+1 (p) ↔ 2Auo (т) + Au+3 (p).
Оксиды: Cu2O, Ag2O, Au2O образуются косвенно. Так как гидроксиды ЭОН нестойкие соединения, поэтому при попытке их получения по обменным реакциям выделяются оксиды Cu2O, Au2O и Ag2O:
2AgNO3 + 2KOH = Ag2O (т) + 2KNO3 + h3O.
При 300оС Ag2O разлагается:
300о
2Ag2O → 4Ag + O2.
Cu2O непрочен и при увеличении температуры от 200 до 375оС диспропорционирует to
Cu2O → CuO + Cu.
Все оксиды Э2О амфотерны. Кислотная природа оксидов Э2О проявляется при растворении в горячих концентрированных растворах щелочей, при этом получаются купраты (1) или куприты, аргентаты (1) или аргентиты и аураты (1) или ауриты.
to
Сu2O (т) + 2NaOH + h3O = 2Na[Cu(OH)2] (p)
Основной характер Э2О проявляется с кислотами с образованием солей:
Cu2O + 2HCl → 2CuCl↓ + h3O.
Оксиды Э2О легко растворяются в растворе Nh4:
Cu2O + 4Nh4 + h3O → 2[Cu(Nh4)2](OH).
Бинарные соединения Cu(I), Ag(I) и Au(I) твердые кристаллические солеподобные вещества, в большинстве не растворяются в воде. Плохо растворяются галогениды (кроме AgF), оксиды, цианиды, сульфиды и др.
Э(1) образуют много комплексных соединений, причем наиболее устойчивы цианидные комплексы. Для Э(1) аквакомплексы малостойки и кристаллогидраты не характерны, но для Cu(1) и Ag(1) устойчивы аммиакаты типа [Э(Nh4)2]+. Поэтому большинство соединений Cu(1), Ag(1) легко растворяются в присутствии аммиака:
AgCl + 2Nh4 → [Ag(Nh4)2]Cl,
Ag2O (т) + 4Nh4 + h3O → 2[Ag(Nh4)2]OH.
Нерастворимые в воде и кислотах галогениды ЭНаl довольно значительно растворяются в концентрированных растворах галогеноводородных кислот или основных галогенидов (то есть в избытке Hal-), что связано с образованием комплексов.
CuCl (т) + HCl (p) = H[CuCl2] (p).
AgJ (т) + KJ (p) = K[AgJ2] (p).
CuCN (т) + KCN → K[Cu(CN)2].
Cu2S + 3K2S → 2K3[CuS2], то есть нерастворимые в воде цианиды ЭСN, сульфиды Э2S и др. ведут себя аналогично.
Соединения Ag+ легко восстанавливаются до Ago, то есть Ag+ – сильный окислитель:
НСОН + 2[Ag(Nh4)2]OH → HCOOH + 2Ag + 4Nh4↑ + h3O (реакция «серебряного зеркала»).
Наоборот, большинство соединений Cu(I) и Au(I) легко окисляются (даже О2 воздуха), переходя в устойчивые Cu(II) и Au(III):
4CuCl (т) + О2 + 4HCl (p) = 4CuCl2 (p) + 2h3O (ж).
Для соединений Cu(I), Au(I) характерны реакции диспропорционирования:
2CuCl (т) ↔ Сuo(т) + СuCl2 (p),
3AuCl (т) + КCl (p) ↔ 2Au (т) + K[AuCl4].
П. Соединения меди (П)
Соединения Au(II) и Ag(II) практически неизвестны.
Поэтому рассмотрим лишь соединения Cu(II).
Оксид CuO черное кристаллическое вещество, получается по реакциям:
до 400о
2Cu + O2 → 2CuO
to
Cu(OH)2 → CuO + h3O
to
2Cu(NO3)2 = 2CuO + 4NO2 + O2.
Удобно CuO получать термическим разложением основного карбоната меди (есть в природе): to
(CuOH)2CO3 → 2CuO + h3O + CO2.
Гидроксид меди (П) Cu(OH)2 твердое вещество голубого цвета, получается по обменной реакции: Cu2+ + 2OH- → Cu(OH)2.
И оксид CuO, и гидроксид Cu(OH)2 не растворяются в воде. Оба амфотерны с преобладанием основных свойств, но и основные свойства выражены слабо. Оба легко растворяются в кислотах, образуя в воде голубые аквакомплексы [Cu(Oh3)6]2+. При растворении солей меди (П) в воде тоже образуются голубые аквакомплексы [Cu(h3O)6]2+.
Комплекс [Cu(h3O)6]2+ имеет голубую окраску, поэтому растворы солей меди (П) и большинство кристаллогидратов тоже имеют голубую окраску:
Cu(NO3)2 ∙ 6h3O, CuSO4 ∙ 5h3O (безводный CuSO4 бесцветен).
Cu(OH)2 растворяется при нагревании в концентрированных растворах щелочей с образованием ярко-синих растворов гидроксокупратов:
Cu(OH)2 + 2KOH конц. ↔ K2[Cu(OH)4]
Гидролиз солей: [Cu(h3O)6]2+ + HOH ↔ [Cu(OH)(h3O)5]+ + h4+O и по аниону: [Cu(OH)4]2- + HOH ↔ [Cu(OH)3(h3O)]- + OH-.
Кроме аква- и гидроксокомплексов медь (П) образует и другие комплексные соединения. Так, CuO и Cu(OH)2 растворяются в растворе аммиака с образованием темно-синего раствора, обусловленного комплексом [Cu(Nh4)4]2+:
Cu(OH)2 + 4Nh4 → [Cu(Nh4)4]2+ + 2OH-.
Из других катионных комплексов меди (П) очень характерны комплексы с азотсодержащими лигандами. Кроме Nh4, лигандами могут быть органические молекулы с группой Nh3 (этилендиамин Nh3Ch3Ch3Nh3 и аминокислоты
R CH COOH), с которыми образуются хелатные комплексы.
│
Nh3
Хелатный комплекс образуется легко:[Cu(en)(h3O)4]2+, [Cu(en)2(h3O)2]2+, где en этилендиамин.
Соединения Cu(II) устойчивее, чем однотипные соединения Cu(I). Так, Cu(OH)2 разлагается на CuO и h3O лишь при нагревании. Разложение CuF2 и CuCl2 протекает соответственно при 950 и 500оС:
to
2CuCl2 → 2CuCl + Cl2
Однако CuJ2 неустойчив, поэтому при получении CuJ2 по обменной реакции идет окислительно-восстановительная реакция:
2CuSO4 + 4KJ → 2CuJ↓ + J2 + 2K2SO4
белый осадок
Ш. Соединения золота (Ш)
Соединения Э(Ш) характерны для золота. Из бинарных соединений золота известны Au2O3 (черно-бурый), AuF3, AuCl3, AuBr3, Au2S3.
Основным исходным веществом для получения других соединений золота является AuCl3, который получается по реакции
200о
2Au + 3Cl2 (избыток) → 2AuCl3
Гидроксид Au(OH)3 красно-коричневое твердое вещество, в воде не растворяется. Галогениды, оксид и гидроксид Au(III) амфотерные соединения с преобладанием кислотных свойств:
легко
NaOH + Au(OH)3 → Na[Au(OH)4].
Даже растворение в кислотах гидроксида золота (Ш) происходит за счет образования анионных комплексов:
Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3h3O.
Кислотный характер галогенидов Au (III) проявляется в их исключительной способности давать галогеноаураты (Ш) М+1[AuHal4], большинство из которых хорошо растворяются в воде:
AuCl3 + HCl → H[AuCl4].
H[AuCl4] золотохлористоводородная кислота, обычно получается по реакциям: Au + царская водка → см. выше, или
Au(OH)3 + 4HCl = H[AuCl4] + 3h3O.
(H[Au(OH)4] или Au(OH)3 золотая кислота, а Na[AuCl4]∙2h3O золотая соль).
Особая склонность золота (Ш) к образованию анионных комплексов проявляется и при гидролизе его тригалидов:
AuCl3 + h3O ↔ H[Au(OH)Cl3] гидроксотрихлорозолотая кислота.
AuCl3 + h3O ↔ h3[AuOCl3] (после 2 ступени).
Все соединения золота легко разлагаются при нагревании с образованием металлического золота. Соединения Au(III) являются сильными окислителями, восстанавливаются легче, чем соединения серебра (I). Так, в водном растворе быстро идут реакции:
H[AuCl4] + 3FeSO4 → Au↓ + Fe2(SO4)3 + FeCl3 + HCl.
3Na2[Sn(OH)4] + 2AuCl3 + 6HOH = 3Na2[Sn(OH)6] + 2Au + 6HCl.
Золото обнаружено в тканях организма и крови, но биологическая роль не до конца выяснена. Соединения золота предложены в качестве средств против туберкулеза и проказы. Большое количество золота идет на изготовление зубных протезов.
refleader.ru

