Цинк химическая формула: Формула цинка в химии
alexxlab | 01.12.1991 | 0 | Разное
Формиат цинка, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Металлические нанопорошки
19 Мая 2020 КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМ
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМПандемия коронавируса COVID-19 показала, что существует неотложная потребность в эффективных мерах по предотвращению распространения вирусных инфекций различных нозологий. Последние случаи вспышек вируса атипичной пневмонии, птичьего гриппа, гриппа h2N1, и наконец, коронавируса COVID-19 показали, что высокоэффективные бытовые технические средства, позволяющие прервать пути распространения инфекций, отсутствуют. На данный момент известно, что есть два главных пути передачи вирусов. Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.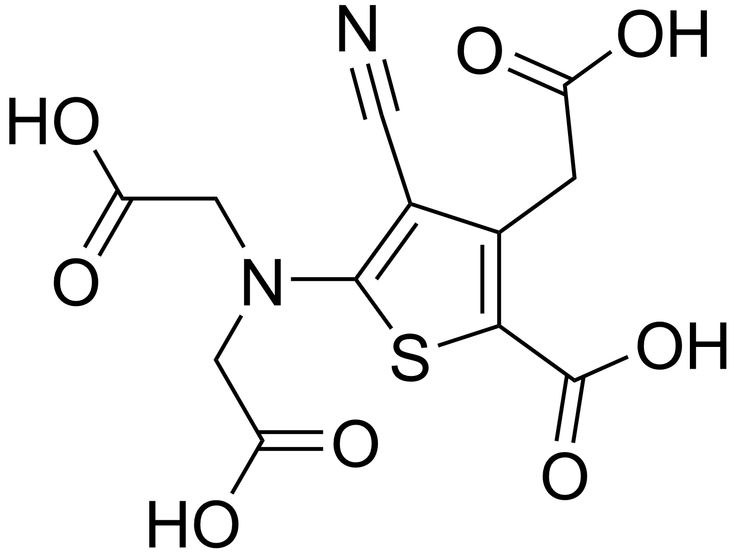
В настоящее время для прерывания путей передачи вирусов в быту в качестве индивидуальных защитных средств используются маски, защищающие органы дыхания, перчатки и различные антисептики, которыми обрабатываются руки и окружающие предметы и поверхности.
Защитные маски позволяют уменьшить распространение респираторных вирусов, особенно при использовании в замкнутом пространстве или при тесном контакте с человеком с симптомами заражения [1, 2]. Однако сами маски также могут быть источником инфекции [3]. Маска примерно через два часа становится влажной и уже в ней начинают размножаться микроорганизмы. По мнению ВОЗ, маски не гарантируют защиты от COVID-19. Установлено, что эффективность хирургических масок даже самого высокого класса защиты FFP3 недостаточна (гриппом заражается не менее 23 % медицинских сестер, носивших хирургические маски класса FFP3).
Вирус COVID-19 передается не только воздушно-капельным, но и контактным путем, и может сохраняться на поверхностях до 72 часов. Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Одним из путей решений вышеуказанных проблем является придание натуральным и искусственным, в т.ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5]. Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Например, импрегнация биоактивных наночастиц оксида меди в фильтрующий материал позволяет придать одноразовым респираторным маскам мощные биоцидные свойства без изменения их барьерных свойств [6]. При контакте с вирусом ионы меди вызывают массовое повреждение компонентов клеточной стенки, вирусных генов и ключевых белков [7].
Таким образом, с использованием нанопорошков оксидов меди и цинка, возможно разработать ряд продуктов, позволяющих прервать пути передачи вирусов в быту и в медицинских учреждениях – лицевых масок, одежды медицинского персонала, перчаток, больничных простыней, корпусов медицинского оборудования, контейнеры для хранения продуктов, клавиатуру компьютеров, корпуса мобильных телефонов и др.
Компания «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» может изготовить нанопорошки оксидов меди и цинка для разработки новых антимикробных материалов.
1. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2008) Physicalinterventions to interrupt or reduce the spread of respiratory viruses: systematicreview. BMJ 336: 77–80.
2. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2007) Interventions for the interruption or reduction of the spread of respiratoryviruses. Cochrane Database Syst Rev 6207.
3. Zhiqing L. et al. Surgical masks as source of bacterial contamination during operative procedures //Journal of orthopaedic translation.2018; 14: 57-62.
4. Borkow, G. and Gabbay, J. (2004). Putting Copper into Action:Copper-impregnated Products with Potent Biocidal Activities, FASEB Jounal,18(14): 1728–1730.
5. Akter M. et al. A systematic review on silver nanoparticles-induced cytotoxicity: Physicochemical properties and perspectives //Journal of advanced research. – 2018. – Т. 9. – С. 1-16.
– 2018. – Т. 9. – С. 1-16.
6. Gadi Borkow et al. A Novel Anti-Influenza Copper Oxide Containing Respiratory Face Mask // PLoS ONE, June 2010, Volume 5, Issue 6.
7. Borkow & Gabbay (2005) Copper as a biocidal tool. Current Medicinal Chemistry12:2163-75
ООО “ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ”
Адрес: 634055, Российская Федерация, Томск, проспект Академический, 8/8
Телефон/Факс: +7 (3822) 28-68-72 , 8-961-888-16-24
http://www.nanosized-powders.com
Цинк окись
Химическая формула:ZnO
Международное название:Zinc oxide
CAS No:1314-13-2
Квалификация:Имп.”ч” ГОСТ 10262-73
Внешний вид:порошок белого цвета
Фасовка:мешки, 25 кг
Условия хранения:в хорошо закрытой ёмкости, в проветриваемом сухом помещении
Синонимы: Цинк оксид, оксид цинка, окись цинка
Спецификация | |
Молекулярный вес | 81. |
Относительная плотность (вода = 1) | 5.6 |
Спецификация 1 (GRILLO PHARMA) | % |
Содержание основного вещества ZnO | 100 |
Содержание Pb | 0,0001 |
Содержание Cd | 0,0001 |
Содержание Fe | 0,0001 |
Содержание Cu | 0,00005 |
Содержание Cl | 0,0003 |
Содержание S | 0,0001 |
Содержание Mn | 0,00005 |
Содержание As | 0,00005 |
Влажность | 0,13 |
Спецификация 2 | % |
Содержание основного вещ-ва, не менее | 99,9 |
Содержание примесей, не более | 0,100 |
в т. | 0,002 |
в т. числе Cd, не более | 0,001 |
в т. числе Fe, не более | 0,0005 |
в т. числе Cu, не более | 0,0002 |
в т. числе Cl, не более | 0,0005 |
в т. числе S, не более | 0,002 |
в т. числе Mn, не более | 0,0001 |
в т. числе As, не более | 0,0001 |
в т. | 0,0001 |
Цинк окись (ZnO) или иначе реактив называется оксид цинка —
порошок белого цвета. Плотность 5,7 г/см3. Окись цинка желтеет при прокаливании, не плавится, возгоняется при температурах выше 1800 °С. В воде нерастворима. Цинк окись растворяется в кислотах с образованием соответствующих солей, а также в щелочах и водном аммиаке.
Получение
В
природе Оксид цинка встречается в виде
минерала Цинкита. В промышленности Цинк
окись получают сжиганием паров цинка
в воздушной среде. Цинк оксид улавливают
из дыма тканевыми и др. фильтрами.
Применение
•
Оксид цинка, цинк оксид используется
как активатор вулканизации некоторых
каучуков, вулканизирующий агент
хлоропреновых каучуков, катализатор
синтеза метанола, белый пигмент при
производстве красок и эмалей , наполнитель
и пигмент в производстве: резины,
пластмасс, бумаги, парфюмерии и
косметики.
• Оксид цинка применяется
в медицине в виде присыпок и в составе
мазей как антисептик. Свойства оксида
цинка обуславливают его широко применение
в фармацевтической промышленности.
Оксид цинка нашел широкое применение
в создании абразивных зубных паст и
цементов в терапевтической стоматологии,
в кремах для загара и косметических
процедурах.
Свойства оксида
цинка обуславливают его широко применение
в фармацевтической промышленности.
Оксид цинка нашел широкое применение
в создании абразивных зубных паст и
цементов в терапевтической стоматологии,
в кремах для загара и косметических
процедурах.
• Окись цинка используется
в производстве стекла и красок на основе
жидкого стекла, как один из компонентов
преобразователя ржавчины.
• Известно
также, что окись цинка обладает
фотокаталитической активностью, что
на практике используется для создания
самоочищающихся поверхностей,
бактерицидных покрытий для стен и
потолков в больницах и пр.
• Порошок
оксида цинка — перспективный материал
в качестве рабочей среды для порошковых
лазеров. На основе оксида цинка создали
светодиод голубого цвета. Тонкие пленки
и иные наноструктуры на основе оксида
цинка могут применяться как чувствительные
газовые и биологические сенсоры.
•
Оксид цинка используется в производстве
электрокабеля, искусственной кожи и
резинотехнических изделий. Кроме того,
применение распространено в шинной,
лакокрасочной, нефтеперерабатывающей
промышленностях. Оксид цинка участвует
процессе производства стекла и керамики.
Оксид цинка участвует
процессе производства стекла и керамики.
•
Добавка к кормам для животных и др.
Вернуться в каталог
Как к Вам обращаться:
Телефон:
Email для связи:
Интересующая продукция:
Ваше сообщение:
Zinc hydroxide – Formula, Uses, Structure and Solubility
- Zinc hydroxide Identification
- Zinc hydroxide Formula
- Zinc hydroxide Properties
- Zinc hydroxide Thermo chemistry
- Zinc hydroxide Structure
- Zinc hydroxide Occurrence
- Zinc hydroxide Preparation
- Гидроксид цинка Применение
- Гидроксид цинка MSDS
Это неорганическое химическое соединение, существующее в природе в виде редкого минерала. Он может одинаково растворяться в растворе сильной кислоты или основания и называется амфотерным соединением. В водных условиях соединение диссоциирует на ионы цинка и гидроксида.
Идентификация гидроксида цинка
Номер CAS: 20427-58-1
Pubchem: 9812759
HEMSPIDER: 798511119
HEMSPIDER: 798510 GHEMSPIDER: 79851040027 HYDRULA:
7985111044.10027.
Гидроксид цинка Свойства
Ниже приведены некоторые уникальные свойства соединения:
Внешний вид
Обычно он выглядит как белое твердое вещество.
Молярная масса
Весит около 99,424 г/моль.
Стабильность
Стабилен и не реагирует при нормальных условиях.
Плотность
Его объемная масса составляет около 3,053 г/см 3 .
Температура плавления
Разлагается при 125 градусах Цельсия.
Растворимость
Умеренно растворим в воде и абсолютно нерастворим в спирте. Произведение его растворимости (K sp ) равно 3,0 x 10 -17 .
Растворение
Гидроксид цинка растворяется в водном растворе аммиака с образованием бесцветного водорастворимого комплекса амина. При добавлении аммиака в избытке ионы гидроксида, которые диссоциируют от Zn(OH) 2 , реагируют с ним с образованием положительно заряженного тетракомплекса с координационным числом 4. Образовавшийся продукт окружен аммиачным лигандом, в результате чего в растворении.
Гидроксид цинка Термохимия
Его стандартная энтальпия образования или стандартная теплота образования -642 кДж.моль -1 .
Гидроксид цинка Структура
Здесь представлена структура амфотерного соединения.
Гидроксид цинка Происхождение
Встречается в виде трех редкоземельных минералов: вульфингита, ашоверита и свитита. Эти редкие минералы на самом деле являются природными полиморфами Zn (OH) 2 . В материаловедении любой твердый материал является полиморфным, если он существует более чем в одной форме, такой как орторомбическая или тетрагональная.
Гидроксид цинка Препарат
Обычно его получают путем добавления умеренного количества раствора гидроксида натрия к раствору соли цинка, например хлориду цинка или сульфату цинка. Эти два соединения реагируют при нормальных условиях с образованием белого осадка Zn(OH) 2 . В этой реакции следует использовать разбавленный раствор гидроксида натрия, чтобы предотвратить растворение неорганического соединения. В нормальных условиях соль цинка диссоциирует с образованием иона цинка, который связывается с двумя ионами гидроксида из раствора гидроксида натрия с образованием гидроксида цинка.
Zn 2+ + 2OH- → Zn(OH) 2
образуют бесцветный раствор иона цинката, как показано ниже:
Zn (OH) 2 + 2OH – → Zn(OH) 4 2-
используется для обнаружения присутствия ионов цинка в растворе. Однако это не единственный метод тестирования, поскольку многие соединения алюминия и свинца ведут себя очень похоже.
Растворяющая способность гидроксида цинка может быть обусловлена присутствием водных лигандов, которые обычно окружают ион. Когда к раствору добавляют избыток гидроксида натрия, два иона гидроксида восстанавливают его до отрицательно заряженного комплекса, что делает его растворимым.
Гидроксид цинка Применение
Некоторые из распространенных применений Zn (OH) 2 :
Хирургические повязки
Он используется для хирургических повязок, где действует как абсорбент. Большие бинты, которые используются после операции, покрыты соединением цинка для впитывания крови из раны.
Защитное покрытие
На сталь и железо чаще всего наносится цинковое покрытие посредством процесса, называемого гальванизацией. Во влажных условиях на этих оцинкованных металлах образуется слой гидроксида цинка, чтобы предотвратить их ржавление.
Протрава
Гидроксид цинка очень желеобразный (желеобразный) и обычно действует как протрава, закрепляющая красители на различных тканях или тканях.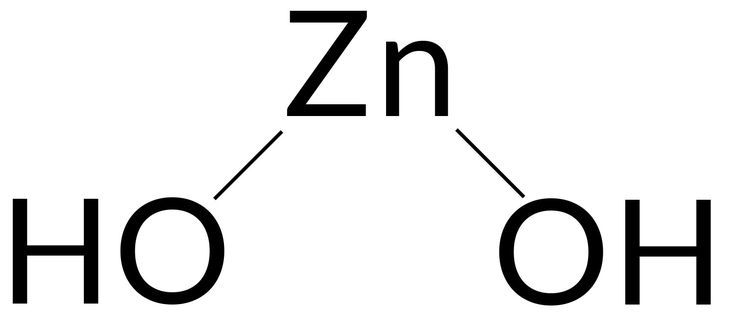 Краситель обычно представляет собой химический реагент, образующий комплекс металла с Zn(OH) 9.0041 2 и прочно крепится к тканевой подкладке.
Краситель обычно представляет собой химический реагент, образующий комплекс металла с Zn(OH) 9.0041 2 и прочно крепится к тканевой подкладке.
Пестициды
Часто используется в качестве промежуточного продукта для коммерческого производства пестицидов и пигментов.
Растворы для местного применения
Комбинация Zn (OH) 2 с оксидом цинка широко используется в каламиновых кремах, мазях, детской присыпке, лосьонах для кожи и косметике. Он реагирует с сильными основаниями из-за своей амфотерной природы с образованием цинкатов, которые используются в качестве пероральных препаратов для лечения ряда заболеваний.
Электрические батареи
Он также используется в высокоэнергетических электрических батареях, перезаряжаемых посредством обратимой реакции.
Резиновая смесь
Zn (OH) 2 используется для компаундирования или смешивания различных ингредиентов каучука для оптимизации свойств конечного использования в соответствии с потребностями потребителя.
Соединения цинка
Широкое разнообразие соединений цинка, таких как оксид цинка, сульфат цинка и нитрат цинка, производится в промышленных масштабах с помощью неорганического химического вещества.
Гидроксид цинка MSDS
Как правило, он негорюч и не представляет опасности для рабочих. Однако соединение нельзя пробовать на вкус или глотать, так как оно может содержать мало токсикологических ингредиентов.
Ссылки
http://en.wikipedia.org/wiki/Zinc_hydrooxide
http://simple.wikipedia.org/wiki/Zinc_hydrooxide
http://www.chemicalbook.com/ChemicalProductProperty_EN_CB.htm1092
Оксид цинка представляет собой молекулярную химическую формулу Vector Image
Оксид цинка представляет собой молекулярную химическую формулу Vector Image- лицензионные векторы org/ListItem”> Химические векторы
ЛицензияПодробнее
Стандарт Вы можете использовать вектор в личных и коммерческих целях. Расширенный Вы можете использовать вектор на предметах для перепродажи и печати по требованию.Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатный / редакционный | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и модифицировать | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по требованию |
Способы купитьСравнить
Плата за изображение $ 14,99 Кредиты $ 1,00 Подписка $ 0,69 Оплатить стандартные лицензии можно тремя способами. Цены составляют $ долларов США .
Цены составляют $ долларов США .
| Оплата с | Цена изображения |
|---|---|
| Плата за изображение $ 14,99 Одноразовый платеж | |
| Предоплаченные кредиты $ 1 Загружайте изображения по запросу (1 кредит = 1 доллар США). Минимальная покупка 30р. | |
| План подписки От 69 центов Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение $ 39,99 Кредиты $ 30,00Существует два способа оплаты расширенных лицензий. Цены составляют $ долларов США .
| Оплата с | Стоимость изображения |
|---|---|
Плата за изображение $ 39,99 Оплата разовая, регистрация не требуется. | |
| Предоплаченные кредиты $ 30 Загружайте изображения по запросу (1 кредит = 1 доллар США). | |
Дополнительные услугиПодробнее
Настроить изображение Доступно только с оплатой за изображение $ 85,00Нравится изображение, но нужны лишь некоторые изменения? Пусть наши талантливые художники сделают всю работу за вас!
Мы свяжем вас с дизайнером, который сможет внести изменения и отправить вам изображение в выбранном вами формате.
Примеры
- Изменить текст
- Изменить цвета
- Изменить размер до новых размеров
- Включить логотип или символ
- Добавьте свою компанию или название компании
файлов включены
Информация о загрузке…
- Идентификатор изображения
- 31301628
- Цветовой режим
- RGB
- Художник
- микростокер
ZnCO₃ Свойства, реакция и использование
- Автор Рия_И
- Последнее изменение 20-07-2022
Карбонат цинка представляет собой неорганическое соединение с химической формулой ZnCO3ZnCO3. Он также известен как монокарбонат цинка. Смитсонит (известный также как индюшиный жир или цинковый шпат) представляет собой встречающийся в природе минерал карбоната цинка. Карбонат цинка представляет собой белое кристаллическое твердое вещество, содержащее ионы цинка (Zn2+)(Zn2+) и карбоната (CO2–3)(CO32–). Эта статья посвящена обсуждению основ, связанных с карбонатом цинка. Будет обсуждаться подготовка, свойства и использование карбоната цинка. 9{2 – }} \справа)\) ионов. Поскольку между ионами цинка и карбоната существует ионная связь, он считается ионным соединением.
Он также известен как монокарбонат цинка. Смитсонит (известный также как индюшиный жир или цинковый шпат) представляет собой встречающийся в природе минерал карбоната цинка. Карбонат цинка представляет собой белое кристаллическое твердое вещество, содержащее ионы цинка (Zn2+)(Zn2+) и карбоната (CO2–3)(CO32–). Эта статья посвящена обсуждению основ, связанных с карбонатом цинка. Будет обсуждаться подготовка, свойства и использование карбоната цинка. 9{2 – }} \справа)\) ионов. Поскольку между ионами цинка и карбоната существует ионная связь, он считается ионным соединением.
Карбонат цинка может быть представлен как:
Learn 10th Exam Concepts
или
В карбонате цинка цинк имеет октаэдрическую форму, и каждый карбонат связан с шестью центрами цинка, так что атомы кислорода являются трехкоординатными. Карбонат цинка имеет структуру, аналогичную структуре карбоната кальция.
Молярная масса карбоната цинка примерно равна \(125,4\;{\rm{г}}/{\rm{моль}}\). 9{2 – }} \справа)\) радикалы. Валентность радикала цинка равна двум и валентности радикала карбоната также равна двум. Путем пересечения этих чисел валентности химическая формула карбоната цинка выглядит следующим образом: \({\rm{ZnC}}{{\rm{O}}_{\rm{3}}}\). То есть
9{2 – }} \справа)\) радикалы. Валентность радикала цинка равна двум и валентности радикала карбоната также равна двум. Путем пересечения этих чисел валентности химическая формула карбоната цинка выглядит следующим образом: \({\rm{ZnC}}{{\rm{O}}_{\rm{3}}}\). То есть
Карбонат цинка можно получить следующими способами:
- Естественно, карбонат цинка \(({\rm{ZnC}}{{\rm{O}}_{ \rm{3}}})\) можно получить в виде смитсонита.
- Карбонат цинка можно получить в лаборатории путем обработки холодного раствора сульфата цинка бикарбонатом калия.
- Карбонат цинка также образуется при взаимодействии карбоната калия с нитратом цинка. Химическое уравнение реакции можно представить в виде
\({{\rm{K}}_2}{\rm{C}}{{\rm{O}}_3} + {\rm{Zn}}{ \left( {{\rm{N}}{{\rm{O}}_3}} \right)_2} \to {\rm{ZnC}}{{\rm{O}}_3} + 2{\ rm{KN}}{{\rm{O}}_3}\) - Карбонат цинка осаждают также из раствора сульфата цинка добавлением к нему бикарбоната натрия или карбоната натрия.
 Химические уравнения для таких реакций могут быть даны как,
Химические уравнения для таких реакций могут быть даны как,
При добавлении карбоната натрия к раствору сульфата цинка:
\({\rm{ZnS}}{{\rm{O}}_4}({\rm{aq}}) + {\rm{N}}{ {\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}({\rm{aq}}) \to {\rm{N}}{{\rm{a }}_2}{\rm{S}}{{\rm{O}}_4}({\rm{aq}}) + {\rm{ZnC}}{{\rm{O}}_3}\left ( {\rm{s}} \right)\)
При добавлении бикарбоната натрия к раствору сульфата цинка:
\({\rm{ZnS}}{{\rm{O}}_4}({\rm{ водный раствор}}) + 2 {\ rm {NaHC}} {\ rm {O}}_3} ({\ rm {aq}}) \ to {\ rm {N}} {{\ rm {a}} _2 }{\rm{S}}{{\rm{O}}_4}({\rm{aq}}) + {\rm{ZnC}}{{\rm{O}}_3}({\rm{ s}}) + {{\rm{H}}_2}{\rm{O}} + {\rm{C}}{{\rm{O}}_2}\)
Попытка 10-го экзамена CBSE Пробные испытания
Карбонат цинка : СвойстваДавайте обсудим физические и химические свойства карбоната цинка.
Карбонат цинка : Физические свойства- Карбонат цинка выглядит как белое кристаллическое твердое вещество.
 Это соединение без запаха.
Это соединение без запаха. - Нерастворим в воде, пиридине, ацетоне, спирте и аммиаке.
- Карбонат цинка растворим в разбавленных кислотах и щелочах. 93}\).
1.
Разложение карбоната цинка:Карбонат цинка при нагревании при более высоких температурах разлагается с образованием оксида цинка и диоксида углерода. Химическое уравнение реакции можно представить следующим образом:
2.
Реакции карбоната цинка:Реакция карбоната цинка с соляной кислотой
Карбонат цинка реагирует с соляной кислотой с образованием хлорида цинка и воды вместе с выделение углекислого газа. Химическое уравнение реакции можно представить в виде
\({\rm{ZnC}}{{\rm{O}}_3} + 2{\rm{HCl}} \to {\rm{ZnC}}{{\rm{l}}_2} + {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}}\)
Реакция карбоната цинка с азотной кислотой
Карбонат цинка реагирует с азотной кислотой с образованием нитрата цинка и воды с выделением углекислого газа. Химическое уравнение реакции можно представить в виде
Химическое уравнение реакции можно представить в виде
\({\rm{ZnC}}{{\rm{O}}_3} + 2{\rm{HN}}{{\rm{O}}_3 } \to {\rm{Zn}}{\left( {\rm{N}}{{\rm{O}}_3}} \right)_2} + {\rm{C}}{{\rm {O}}_2} + {{\rm{H}}_2}{\rm{O}}\)
Реакция карбоната цинка с серной кислотой
Карбонат цинка реагирует с серной кислотой с образованием сульфата цинка и воды с выделением углекислого газа. Химическое уравнение реакции можно представить в виде
\({\rm{ZnC}}{{\rm{O}}_3} + {{\rm{H}}_2}{\rm{S}} {{\rm{O}}_4} \to {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}} + {\ rm{ZnS}}{{\rm{O}}_4}\)
Карбонат цинка : ПрименениеКарбонат цинка имеет несколько применений. Среди них:
- Используется в производстве фарфора, керамики и каучука.
- Карбонат цинка используется в качестве пигмента.
- Он используется в качестве антисептика (антимикробное вещество, используемое для предотвращения роста болезнетворных микроорганизмов) и вяжущего средства (это средства по уходу за кожей на водной основе, используемые для удаления излишков кожного сала, сужения пор и удаления остатков макияжа).
 ).
). - Карбонат цинка используется для извлечения металлического цинка из руды.
- Он также используется для предотвращения болезней, вызванных дефицитом цинка.
- Карбонат цинка используется в качестве кормовой добавки.
- Смитсонит, встречающийся в природе минерал карбоната цинка, имеет несколько применений в области металлургии, электроники и строительства.
- Карбонат цинка используется в зубной пасте для восстановления дентина в зубах.
- Карбонат цинка иногда используется в качестве микроэлемента для профилактики заболеваний у животных.
- Карбонат цинка можно использовать для получения других соединений цинка.
Часто задаваемые вопросы о карбонате цинка перечислены ниже:
В. Какова формула карбоната цинка?
Ответ: Карбонат цинка представляет собой неорганическое соединение с химической формулой \({\rm{ZnC}}{{\rm{O}}_3}\).


 38
38 числе Pb, не более
числе Pb, не более числе Ni, не более
числе Ni, не более ).
).