Цвет углекислого газа: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 07.03.1990 | 0 | Разное
Углекислый газ и его воздействие на организм человека
13/07/2020
Время прочтения ≈ 10 минут
Углекислый газ выполняет важную функцию в организме человека и поэтому оказывает на него непосредственное воздействие. Рассмотрим, что такое углекислый газ, какова его роль в метаболизме человека и почему он не менее важен, чем кислород. Расскажем, как СО2 влияет на организм, почему и чем опасна его высокая концентрация в помещении.
Содержание
Что такое углекислый газ
Углекислый газ и метаболизм
Углекислый газ в атмосфере
Углекислый газ в помещении
Влияние CO2 на организм
Синдром больного здания
Респираторный ацидоз
Состояние организма в зависимости от уровня CO2
Выводы
Что такое углекислый газ
Углекислый газ или диоксид углерода — малотоксичный газ, в нормальных условиях без запаха и цвета. CO2 — небольшая, но важная составляющая воздуха, он является одним из элементов окружающей среды, участвует в процессе фотосинтеза, метаболизма, выделяется людьми и животными, а также в ходе брожения и гниения.
Для организма человека углекислый газ не менее важен, чем кислород, а их баланс поддерживают естественные процессы — фотосинтез и дыхание.
Углекислый газ и метаболизм человека
Углекислый газ участвует во многих метаболических процессах. Он регулирует работу дыхательного и сосудисто-двигательного центра, возбудимость нервной системы, активность многих ферментов и гормонов, отвечает за электролитный состав крови, тонус центральной нервной системы, сосудов и бронхов, поддерживает обмен веществ. Следовательно СО2 непосредственно влияет на все биохимические реакции организма.
Углекислый газ — возбудитель дыхательной системы. Вопреки распространённому мнению, человек совершает очередной вдох при избытке углекислого газа, а не дефиците кислорода.
СО2 — продукт метаболизма, он переносится кровью от клеток тканей к лёгким. При вдохе лёгкие человека наполняются кислородом и в них происходит двусторонний обмен: кислород переходит в кровь, а углекислый газ выделяется из неё.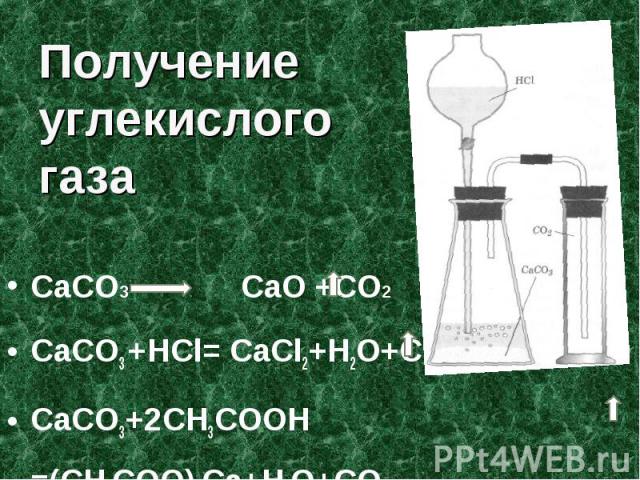
В обмене участвует гемоглобин, так как он основной переносчик кислорода к клеткам. В нём возникает процесс замены кислорода углекислым газом: гемоглобин доставляет кислород из лёгких к клеткам, а после — углекислый газ к лёгким. И этот обмен должен быть сбалансированным.
Дисбаланс вызывает эффект «Вериго-Бора», согласно которому переизбыток кислорода и недостаток углекислого газа приводят к кислородному голоданию. Такой парадокс вызван тем, что без присутствия CO2 кислород не может высвободиться из связанного состояния с гемоглобином и переходить в ткани и органы.
Таким образом, углекислый газ необходим для отрыва кислорода от гемоглобина, иначе кровь будет циркулировать по организму, но не отдавать кислород, что приведёт к кислородному голоданию.
СО2 помогает кислороду переходить в ткани и органы.
Для нормального функционирования организма важен баланс углекислого газа и кислорода. Недостаток и избыток углекислого газа в организме приводит к гипокапнии и гиперкапнии.
Подписаться в Telegram
Подписаться по email
Хотите узнавать о новых статьях, акциях и закрытых распродажах первыми? Подписывайтесь на нашу рассылку или канал в Telegram⚡
Гипокапния — недостаток углекислого газа в крови. Чаще всего проявляется в виде головокружения, в худшем случае приводит к потере сознания. Возникает в состоянии паники или стресса при частом и глубоком дыхании. Гипокапния также развивается с возрастом, когда содержание СО2 в крови падает ниже 3,5 % от нормальных 6—6,5 %.
Норма содержания углекислого газа в крови — 6—6,5%.
Гиперкапния — избыток углекислого газа в крови. Интоксикация углекислым газом проявляется в виде головной боли, тошноты, повышенного потоотделения, в крайних случаях — потери сознания. Возникает при длительном нахождении в замкнутом помещении с высоким содержанием CO2, но чаще всего в экстренных ситуациях, например, задержка дыхания под водой.
Углекислый газ в атмосфере
Углекислый газ выполняет важную функцию в атмосфере земли, он участвует в процессе фотосинтеза, воздействует на теплообмен. А также формирует «парниковый эффект» и влияет на климат.
А также формирует «парниковый эффект» и влияет на климат.
Основные источники углекислого газа — природного происхождения. Он вырабатывается людьми, растениями и животными, содержится в вулканических газах, выделяется при разложении органики.
К техногенным источникам относятся выбросы промышленных предприятий, транспорт, производство электроэнергии, сжигание ископаемого топлива.
Концентрация углекислого газа в воздухе незначительна и составляет 0,02—0,045 % или 250—450 ppm, но с каждым годом уровень CO2 растёт и в крупных городах может достигать 0,06% или 600 ppm.
PPM — величина, означающая одну миллионную долю. В случае измерения CO2, количество PPM показывает количество кубических сантиметров CO2 на 1 кубометр воздуха.
Первым доказательством постоянного роста концентрации углекислого газа в атмосфере стала работа Чарльза Дэвида Килинга — американского учёного климатолога. С 1958 года он проводил регулярные частые измерения концентрации CO2 в атмосфере на Южном полюсе и на Гавайях.
График Килинга: концентрации атмосферного CO2, на основе наблюдений в обсерватории Мауна-Лоа (Mauna Loa Observatory), Гавайи
Содержание углекислого газа в атмосфере сохраняет устойчивые тенденции роста. Так, в 2009 г. средняя концентрация CO2 составляла 387 ppm., а в 2016 г. превысила отметку в 400 ppm. В 2017 г. был зафиксирован уровень CO2 в 403,3 ppm, в 2018 г. — 410,26 ppm., в 2019 г. — уже 415,28. А в мае 2020 г. концентрация углекислого газа в атмосфере установила новый рекорд — 417,1 ppm.
Углекислый газ в помещении
Из внешней среды углекислый газ поступает в помещение вместе с воздухом, где его уровень начинает повышаться. Внутри помещений CO2 вырабатывается находящимися в нём людьми, животными и растениями и чем больше людей в помещении и активнее их деятельность, тем быстрее будет расти уровень CO2.
Основные нормативы по содержанию углекислого газа в помещении установлены в ГОСТ 30494-2011, согласно которому, оптимальным содержанием CO2 в помещении является 800 ppm. Это считается высоким качеством воздуха. Допустимая концентрация углекислого газа находится в пределах 1000-1400 ppm. Концентрация свыше этих показателей означает, что воздух в помещении низкого качества и может негативно влиять на организм человека.
Это считается высоким качеством воздуха. Допустимая концентрация углекислого газа находится в пределах 1000-1400 ppm. Концентрация свыше этих показателей означает, что воздух в помещении низкого качества и может негативно влиять на организм человека.
Оптимальный уровень CO2 в помещении — до 800 ppm
Подробнее о нормативах содержания CO2 в помещениях мы рассказываем в статье «Содержание углекислого газа в помещении: основные нормативы».
При закрытых окнах и отсутствии системы принудительной вентиляции, содержание CO2 будет постоянно расти. В помещениях люди находятся более 80% своего времени и в процессе пребывания многие начинают чувствовать духоту — это самый первый индикатор того, что уровень CO2 повышен.
В таких ситуациях ошибочно говорят о нехватке кислорода, но на самом деле уровень кислорода не меняется, а растёт уровень CO2. Помимо ощущения духоты, люди отмечают и другие симптомы: головная боль, ухудшение концентрации внимания, сонливость, вялость и т.д.
Единственный способ понижения уровня CO2 — это интенсивный приток свежего воздуха с улицы, который вытеснит переработанный и насыщенный углекислым газом воздух в систему вентиляции. Для этого необходимо регулярно проветривать помещение или установить систему приточной вентиляции.
Для этого необходимо регулярно проветривать помещение или установить систему приточной вентиляции.
Влияние углекислого газа на организм человека
Как мы уже говорили выше, углекислый газ влияет на состояние организма человека, так как играет важную роль в процессе метаболизма, помогая кислороду высвобождаться от гемоглобина и поступать в ткани и органы. Но необходимо поддерживать баланс кислорода и углекислого газа, так как избыток СО2 может привести к негативным последствиям.
Синдром больного здания
Если человек проводит много времени в определённом помещении и начинает испытывать неприятные ощущения и жаловаться на плохое самочувствие без видимых причин — это означает, что у него синдром «больного здания». Человек чувствует вялость, испытывает головную боль, у него заложен нос, но при этом он не болен. Симптомы могут пропадать, как только человек покидает помещение.
Синдром «больного здания» возникает при повышении уровня СО2 газа в помещении, чем он выше, тем активнее проявляются симптомы.
Повышенный уровень CO2 — это следствие и основной индикатор, который указывает на наличие проблемы. Помимо углекислого газа в воздухе содержатся другие соединения и загрязняющие вещества и по росту СО2 можно понять, что и их количество также увеличивается.
Воздействовать на организм могут и такие факторы, как тонкодисперсные частицы РМ2,5. Но они не способны оказывать такого быстрого влияния на человека, поэтому основная причина симптомов — это углекислый газ.
Подробнее про тонкодисперсные частицы мы рассказываем в статье «Что такое PM10 и PM2.5?Чем могут быть опасны тонкодисперсные частицы?».
Наиболее распространённая причина «больного» здания — это плохо работающая вентиляция или её отсутствие. Свежий воздух не поступает в помещение и растёт уровень углекислого газа, при достижении показателей CO2 свыше 1000 ppm., углекислый газ начинает оказывать на организм человека негативное воздействие. Подробнее про синдром «больного» здания мы рассказываем в статье «Синдром больного здания: почему в помещении становится плохо?».
Основная причина появления «Синдрома больного здания» — это повышенный уровень СО2 и других загрязняющих веществ. Основная причина того, что здание «болеет» — наличие проблем с системой вентиляции или её отсутствие.
Респираторный ацидоз
Если на протяжении длительного времени находиться в помещении с повышенным уровнем CO2, то в крови появляется избыток углекислого газа, нарушается кислотность крови (pH), что приводит к респираторному ацидозу или первичной гиперкапнии.
Респираторный или дыхательный ацидоз развивается в связи со снижением рН крови.
Среди симптомов респираторного ацидоза выделяют: снижение концентрации внимания, учащённое сердцебиение, перевозбуждение, общую вялость, сонливость, беспокойство, повышенное давление, головную боль, спутанность сознания. Симптомы развиваются постепенно по мере нахождения в помещении с высоким уровнем CO2, в критической ситуации могут привести к потере сознания.
Степень негативного влияния углекислого газа на организм увеличивается соразмерно периодичности и длительности пребывания в помещении с повышенной концентрацией CO2.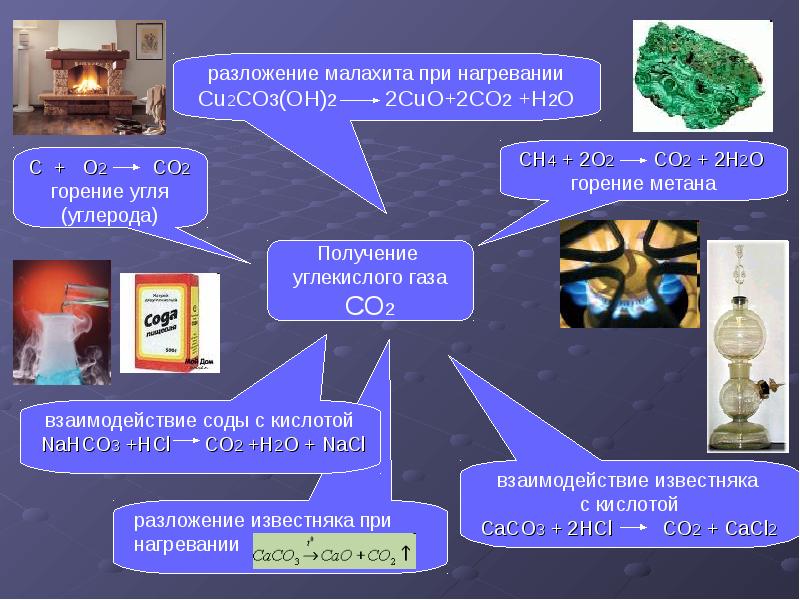 При кратковременном воздействии в несколько часов симптомы постепенно пройдут, когда человек покинет помещение или проветрит его.
При кратковременном воздействии в несколько часов симптомы постепенно пройдут, когда человек покинет помещение или проветрит его.
Но если воздействие высокого содержания углекислого газа носит регулярный характер, то может развиться хронический респираторный ацидоз, последствиями которого может стать снижение иммунитета, болезни дыхательных путей, заболевания сердечно-сосудистой системы, снижение метаболизма, нарушение сна, возникновение головных и суставных болей, общая слабость.
Состояние организма человека в зависимости от уровня CO2
Вопросом влияния углекислого газа на организм человека занималась компания KPMG совместно с Университетом Мидлсекс, изучив воздействие повышенного уровня CO2 на 300 человек. Их исследования показали, что при уровне CO2 выше 1000 ppm, концентрация внимания снижалась на 30%. При уровне 1500 ppm — 79% респондентов чувствовали усталость, при 2000 ppm — 67% опрошенных отметили, что не могут сосредоточиться. Среди опрошенных, кто периодически страдает мигренью, 97% сказали, что головная боль у них появилась ещё на отметке в 1000 ppm.
В зависимости от уровня углекислого газа в помещении и длительности его воздействия на человека, развиваются разные симптомы.
Воздух считается качественным, если содержание углекислого газа в нём не превышает 600—800 ppm.
Несмотря на исследования, которые показывают, что повышение концентрации углекислого газа выше 1000 ppm вызывает дискомфорт, снижение концентрации внимания, сонливость, общую слабость, по ГОСТу допускается концентрация СО2 в пределах 1000–1400 ppm.
Выводы
CO2 — природный газ, который необходим организму для поддержания всех физиологических процессов. Именно благодаря углекислому газу кислород поступает в клетки тканей и органов.
Необходимо, чтобы в крови соблюдался баланс содержания кислорода и углекислого газа, так как избыток или недостаток CO2 может вызвать гипокапнию или гиперкапнию.
Существует понятие «Синдром больного здания», которое указывает на повышенное содержание СО2 и других загрязняющих вещества в помещении и свидетельствует о нарушениях в работе системы вентиляции.
Воздействие углекислого газа в высоких концентрациях может вызвать респираторный ацидоз. Поэтому в помещении необходимо поддерживать содержание СО2 в значениях не выше 800 ppm.
Оптимальные и допустимые значения содержания СО2 в помещении прописаны в ГОСТ 30494-2011 — об этих нормативах и о том, как поддерживать оптимальный уровень СО2, мы рассказываем в статье «Содержание углекислого газа в помещении: основные нормативы».
Александра Конова
Павел Гончаров
Авторы статьи:
Понравилась статья? Напишите комментарий
или поделитесь в социальных сетях:
Ознакомьтесь с характеристиками популярных моделей и подберите бризер под свои задачи!
| Открыть каталог |
Молярная масса углекислого газа (co2), все формулы
Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Углекислый газ и его физические свойства — объем, плотность, масса, формула Ссылка на основную публикацию
Источник: https://UglekislyGaz. ru/dioksid-ugleroda/fizicheskie-svojstva-co2/
ru/dioksid-ugleroda/fizicheskie-svojstva-co2/
Карбонизация напитков
Для газирования напитков необходим газообразный диоксид углерода. При добавлении CO2 в воду происходит его химическая реакция с молекулами воды, в результате чего образуется некоторое количество угольной кислоты (h3CO3). Освежающий эффект безалкогольных напитков обусловлен наличием в их составе растворённого углекислого газа и органических кислот, например, лимонной. В зависимости от степени насыщения углекислым газом напитки могут быть негазированными, сильно, средне и слабогазированными.
Газирование напитков производят насыщением их углекислым газом в специальных установках — сатураторах. Насыщение воды CO2 делает напиток шипучим, придаёт ему искристость и приятный пикантный вкус.
Для карбонизации напитков большинство предприятий покупают жидкий диоксид углерода, хотя при производстве пива (брожении) выделяется достаточно много CO2, который можно собирать и после очистки использовать для газирования напитков.
Углекислый газ — это… Что такое Углекислый газ?
Диоксид углерода
Свойства Строение Техника безопасности Страница дополнительных сведений Родственные соединения
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25. 13 кДж/моль 13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pK a) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | (жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Структура и свойства | n , εr , и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
Диокси́д углеро́да
(
двуо́кись углеро́да
,
углеки́слый газ
,
окси́д углеро́да (IV)
,
диокси́д углеро́да
,
у́гольный ангидрид
,
углекислота́
) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин
.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её.
В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления.
Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием.
Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его.
Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см.
Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290
, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада.
Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Источник: https://dic.academic.ru/dic.nsf/ruwiki/1152999
Охлаждение и заморозка продуктов
Наряду с жидким азотом жидкий диоксид углерода наиболее подходит для прямого контактного замораживания различных видов продуктов. Как контактный хладагент он привлекателен дешевизной, химической инертностью и термической стабильностью, не вызывает коррозию, не горюч, не опасен для персонала.
Использование СО2 в контактных скороморозильных аппаратах даёт ряд принципиальных преимуществ по сравнению с традиционными технологиями заморозки: время заморозки сокращается до 5 — 30 мин.; быстро прекращается ферментативная активность в замораживаемом продукте; хорошо сохраняется структура тканей и клетки продукта, поскольку кристаллы льда формируются значительно меньших размеров и практически одновременно в клетках и в межклеточном пространстве тканей; при медленной заморозке в продукте появляются следы жизнедеятельности бактерий, в то время как при шоковой заморозке диоксидом углерода они просто не успевают развиться; потери массы продукта в результате усушки составляют всего 0,3 — 1 % против 3 — 6 %; легко улетучивающиеся ценные ароматические вещества сохраняются в больших количествах.
По сравнению с замораживанием жидким азотом при использовании диоксида углерода не наблюдается растрескивание продукта из-за слишком большого перепада температуры между поверхностью и сердцевиной замораживаемого продукта; в процессе замораживания СО2 проникает в продукт и поэтому во время размораживания защищает его от окисления и развития микроорганизмов.
Плоды и овощи, подвергнутые быстрой заморозке и фасовке на месте, наиболее полно сохраняют вкусовые качества и питательную ценность, все витамины и биологически активные вещества, что даёт возможность широко применять их в производствах продуктов для детского и диетического питания.
Часто диоксид углерода используется для быстрого охлаждения свежих пищевых продуктов в упакованном и неупакованном виде до 2 — 6 °С, что улучшает естественный цвет продукта вследствие небольшой диффузии СО2 внутрь продукта. Кроме этого, значительно увеличивается срок хранения продуктов, так как СО2 подавляет развитие как аэробных, так и анаэробных бактерий и плесневых грибков.
В холодильной промышленности СО2 применяется в качестве альтернативного хладагента. Диоксид углерода является эффективным хладагентом, поскольку имеет низкую критическую температуру (+31,1 °С), сравнительно высокую температуру тройной точки (-56 °С), большое давление в тройной точке (0,5 МПа) и высокое критическое давление (7,39 МПа). Как хладагент СО2 обладает следующими преимуществами: очень низкая стоимость по сравнению с другими хладагентами; нетоксичен, не горюч и невзрывоопасен; совместим со всеми электроизоляционными и конструкционными материалами; не разрушает озоновый слой; вносит (удельно) умеренный вклад в увеличение парникового эффекта по сравнению с современными галоидопроизводными хладагентами.
Как хладагент СО2 обладает следующими преимуществами: очень низкая стоимость по сравнению с другими хладагентами; нетоксичен, не горюч и невзрывоопасен; совместим со всеми электроизоляционными и конструкционными материалами; не разрушает озоновый слой; вносит (удельно) умеренный вклад в увеличение парникового эффекта по сравнению с современными галоидопроизводными хладагентами.
Формула углекислого газа
ОПРЕДЕЛЕНИЕ
Двуокись углерода (двуокись углерода, двуокись углерода, моноксид углерода (IV), карбоновый ангидрид, сухой лед) представляет собой бесцветный газ без запаха со слегка кислотным вкусом. Сформировано путем объединения двух элементов: углерода и кислорода.
- Химические, структурные и электронные формулы двуокиси углерода
- Химическая формула: ( mathrm{CO} 2 )
- Структурная формула: ( O=C=O )
- Электронная формула:
- Химические, структурные и электронные формулы двуокиси углерода
- Молярная масса: 44,01 г / моль.

- Физические свойства двуокиси углерода
В стандартных условиях — газ без цвета и запаха, с кислым вкусом. При атмосферном давлении в жидком состоянии не существует, а сильное охлаждение кристаллизуется в виде «сухого льда» — белой снежной массы. Температура сублимации составляет -78 ° С. В обычных условиях 0,9 объема двуокиси углерода растворяют в одном объеме воды.
- Химические свойства двуокиси углерода
- Это оксид кислоты.
- При растворении в воде образуется угольная кислота:
- ( C O_{2}+H_{2} O leftrightarrow H_{2} C O_{3} )
- Он взаимодействует с основными оксидами и основаниями с образованием карбонатов и бикарбонатов (соли углекислоты):
- ( N a_{2} O+C O_{2} ightarrow N a_{2} C O_{3} )
- ( 2 K O H+C O_{2} ightarrow K_{2} C O_{3}+H_{2} O )
- ( mathrm{KOH}+mathrm{CO}_{2}(избыток) ightarrow K H C O_{3} )
- Не поддерживает горение, но при нагревании может окислять активные металлы:
- ( C O_{2}+2 M g ightarrow 2 M g O+C )
- Качественная реакция — мутность извести ( (mathrm{Ca}(mathrm{OH}) 2) ) из-за образования белого осадка карбоната кальция:
- ( mathrm{Ca}(mathrm{OH})_{2}+mathrm{CO}_{2} ightarrow mathrm{CaCO}_{3} downarrow+mathrm{H}_{2} mathrm{O} )
Углекислый газ образуется гниением и сжиганием органического вещества. {circ} mathrm{C}}{longrightarrow} mathrm{CaO}+mathrm{CO}_{2} uparrow )
{circ} mathrm{C}}{longrightarrow} mathrm{CaO}+mathrm{CO}_{2} uparrow )
- Задача
Рассчитать количество двуокиси углерода ( (mathrm{NU}) ), которое может быть получено путем сжигания 12 тонн угля, если выход продукта составляет 90% от теоретически возможного. - Решение. Напишите уравнение для реакции горения:
- ( C+O_{2}=C O_{2} )
- Рассчитайте количество углеродного вещества по формуле:
- ( n(C)=frac{m(C)}{M(C)}=frac{12000000}{12}=1000000 моль )
- Согласно уравнению реакции
- ( n(C)=nleft(C O_{2} ight)=1000000 моль )
- 1 моль газа в нормальных условиях составляет 22,4 литра.
- Рассчитайте теоретический объем углекислого газа:
- ( Vteorleft(C O_{2} ight)=1000000 cdot 22,4=2240000=22400м3 )
- Мы вычисляем практический объем углекислого газа:
- ( Vpractleft(C O_{2} ight)=22400 cdot 0,9=20160м3 )

- Объем производимого диоксида углерода равен 20160 м3.
Рассчитать объем 20% раствора соляной кислоты (плотность = 1,1 г / мл), что необходимо для получения 5,6 литров диоксида углерода из образца известняка, который содержит 5% примесей.
- Напишите уравнение реакции:
( mathrm{CaCO}_{3}+2 mathrm{HCl} ightarrow mathrm{CaCl}_{2}+mathrm{H}_{2} mathrm{O}+mathrm{CO}_{2} uparrow )
где ( mathrm{Vm} ) — молярный объем, т. е. объем, который занимает один моль газа в нормальных условиях. ( mathrm{Vm}=22,4 л/моль )
- Затем:
- ( nleft(C O_{2} ight)=frac{Vleft(C O_{2} ight)}{V_{m}left(C O_{2} ight)}=frac{5,6}{22,4}=0,25 моль )
- Для расчета количества вещества соляной кислоты мы составляем пропорцию в соответствии с уравнением реакции:
- 2 моля ( mathrm{HCl} ) приводят к образованию 1 моль ( mathrm{CO} 2 )
- x моль ( mathrm{HCl} )приводит к образованию 0,25 моль ( mathrm{CO} 2 )
- Отсюда:
- ( x=frac{2.
 0,25}{1}моль )
0,25}{1}моль ) - Молярная масса соляной кислоты составляет 36,5 г / моль. Рассчитайте массу соляной кислоты:
- ( m(H C l)=n(H C l) cdot M(H C l)=0,5мольcdot 36,5г/моль=18,25г )
- Выражение для массовой доли вещества в растворе:
- ( omega=frac{pi r_{b}-b a}{m_{p-p a}} )
- Рассчитайте массу раствора соляной кислоты по формуле:
- ( m_{p-p a}=frac{m_{B C l}}{omega}=frac{18,25}{0,2}=91,25 mathrm{г} )
- Если раствор ( mathrm{HCl} ) составляет 20%, то массовая доля соляной кислоты в нем будет равна 0,20.
- Рассчитайте объем раствора соляной кислоты по формуле:
- ( V=m / ho=91,25 / 1,1=82,95_{mathrm{мл}} )
Объем 20% -ного раствора соляной кислоты составляет 82,95 мл.
Нужны оригинальность, уникальность и персональный подход? Закажи свою оригинальную работу УЗНАТЬ СТОИМОСТЬ
Источник: https://sciterm.ru/spravochnik/formula-uglekislogo-gaza/
Получение
Технология производства углекислоты отличается разнообразностью. Газ выделяется вместе с дымовыми отходами ТЭЦ и электростанций, при брожении спиртового состава. Абсорбирование газа предусматривает очистку, которая выполняется поэтапно в соответствии с установленными требованиями Государственного стандарта.
Газ выделяется вместе с дымовыми отходами ТЭЦ и электростанций, при брожении спиртового состава. Абсорбирование газа предусматривает очистку, которая выполняется поэтапно в соответствии с установленными требованиями Государственного стандарта.
Газ на нефтеперерабатывающих предприятиях — путем адсорбции моноэтаноламином и карбонатом калия. Технология сбора углерода предусматривает подачу по трубопроводу веществ, которые насыщаются углекислотой.
При повышенной температуре или низком давлении происходит высвобождение чистого соединения и других продуктов распада. В лабораторных условиях извлечение CO2 возможно в результате реакции кислот и гидрокарбонатов.
Отдельно выделить газ можно на промышленных установках для получения аргона, азота и кислорода. В этом случае углекислота является второстепенным продуктом. Хранится газ под давлением в специальных баллонах, окрашенных в черный цвет с надписью желтыми буквами. Добыча жидкой двуокиси углерода производится из газа путем его дополнительной обработки различными соединениями, предусмотренными технологическим процессом.
Реакция происходит при низком давлении. После очистки газ попадает в компрессор, сжимается и восстанавливается в 2 адсорбера, очищается от второстепенных запахов и переводится в конденсат. Этот метод применяют при спиртовом брожении на пивоварнях.
Угольный ангидрит в твердом агрегатном состоянии (сухой лед) образуется путем обработки жидкости низкой температурой -56ºC. В промышленном производстве только 20% объема исходного вещества переходит в лед, а остальное количество превращается в газ.
Технология изготовления твердой углекислоты предусматривает промывку, сжатие, охлаждение газообразного углерода. После очистки активированным углем жидкость поступает в холодильник, затем направляется на испарение и под пресс.
Углекислый газ, он же углекислота, он же двуокись углерода…
Углекислый газ бесцветный газ с едва ощутимым запахом не ядовит, тяжелее воздуха. Углекислый газ широко распространен в природе. Растворяется в воде, образуя угольную кислоту Н2CO3, придает ей кислый вкус. В воздухе содержится около 0,03% углекислого газа.
В воздухе содержится около 0,03% углекислого газа.
Плотность в 1,524 раза больше плотности воздуха и равна 0,001976 г/см3 (при нулевой температуре и давлении 101,3 кПа). Потенциал ионизации 14,3В. Химическая формула – CO2.
В сварочном производстве используется термин «углекислый газ» см. ГОСТ 2601.
В «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением» принят термин «углекислота», а в ГОСТ 8050 — термин «двуокись углерода».
Существует множество способов получения углекислого газа, основные из которых рассмотрены в статье Способы получения углекислого газа.
Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. При атмосферном давлении и температуре -78,5°С углекислый газ, минуя жидкое состояние, превращается в белую снегообразную массу «сухой лед».
Под давлением 528 кПа и при температуре -56,6°С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Двуокись углерода термически устойчива, диссоциирует на окись углерода и кислород только при температуре выше 2000°С.
Углекислый газ – это первый газ, который был описан как дискретное вещество.
В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 + 2HCl = СО2 + CaCl2 + h3O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3. Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
CaO + h3O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + h3O
Жидкая двуокись углерода бесцветная жидкость без запаха, плотность которой сильно изменяется с изменением температуры. Она существует при комнатной температуре лишь при давлении более 5,85 МПа. Плотность жидкой углекислоты 0,771 г/см3 (20°С). При температуре ниже +11°С она тяжелее воды, а выше +11°С — легче.
Удельная масса жидкой двуокиси углерода значительно изменяется с температурой, поэтому количество углекислоты определяют и продают по массе. Растворимость воды в жидкой двуокиси углерода в интервале температур 5,8-22,9°С не более 0,05%.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При нормальных условиях (20°С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа.
При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается. При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние.
При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние.
Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода — поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
Впервые жидкую двуокись углерода получили в 1823 г. Гемфри Дэви (Humphry Davy) и Майкл Фарадей (Michael Faraday).
Твердая двуокись углерода «сухой лед», по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое — 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры. Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке металлов;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- для чистки поверхностей сухим льдом.

Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Ранее препятствием для применения углекислоты в качестве защитной среды являлись поры в швах. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения оксиси углерода (СО) вследствие недостаточной его раскисленности.
- При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
- СO2=CO+O
- Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).

- Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
- Мэ + О = МэО
где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке.
Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом — только в ванне.
Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м3) углекислый газ оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола.
При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией.
Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м3 (0,5%).
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы.
В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м3 углекислого газа. В верхней части баллона вместе с газообразной углекислотой скапливается воздух.
Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу.
Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух.
Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом.
Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа.
Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги
Баллон с двуокисью углерода окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Коэффициенты перевода объема и массы двуокиси углерода при Т=15°С и Р=0,1 МПа
Масса, кг Объем газа, м3
| 1,848 | 1 |
| 1 | 0,541 |
Сварка в среде защитных газов
Сварка в среде защитных газов сегодня применяется практически для всех металлов, включая углеродистую и нержавеющую стали, алюминий, медь и титан. Теплотой дуги расплавляется основной металл и проволока или присадочный пруток, если сварку выполняют неплавящимся электродом. Расплавленный металл сварочной ванны, кристаллизуясь, образует шов. При сварке в зону дуги непрерывно подаётся защитный газ. В качестве защитных газов применяют углекислый газ (CO2) и инертные газы, такие как аргон (Ar), гелий (He) и их смеси: Ar+He, Ar+CO2, Ar+O2, CO2+O2, Ar+h3 и др.
При сварке в зону дуги непрерывно подаётся защитный газ. В качестве защитных газов применяют углекислый газ (CO2) и инертные газы, такие как аргон (Ar), гелий (He) и их смеси: Ar+He, Ar+CO2, Ar+O2, CO2+O2, Ar+h3 и др.
Изначально наибольшее распространение получила сварка в среде CO2. Такой способ является самым дешёвым при сварке углеродистых и низколегированных сталей.
Дальнейшим этапом повышения эффективности сварки при изготовлении сварных металлоконструкций стало применение газовых смесей на основе углекислого газа (CO2) и аргона (Ar). Предлагаемые технологии сварки в смесях с использованием CO2 и аргона позволяют значительно улучшить, в сравнении со сваркой в CO2, технологические параметры процесса сварки.
Сварочные смеси на основе углекислого газа являются наиболее распространёнными среди смесей, применяемых для сварки углеродистых конструкционных сталей.
Газовые баллоны | Ramans un Partneri
Промышленные газы
Ацетилен
Доступные ёмкости: 5 л, 10 л, 15 л, 20 л, 30 л, 40 л.
Баллоны всех ёмкостей можно только арендовать.
Цвет баллона: баллон имеет тёмно-коричневый цвет.
Ацетилен (C2h3) бесцветный газ со специфическим запахом, который почти не растворяется в воде и легче воздуха. Он используется для сварки, резки, пайки и при других процессах, в которых используются горючие газы. Ацетилен – особо легковоспламеняющийся газ. Для горящего ацетилена характерна очень высокая температура пламени (примерно 3300 °C). Пламя горения ацетилена самое горячее и самое сконцентрированное из всех горючих технических газов. Обычно для получения пламени ацетилен смешивают с кислородом, в отношении 1:1. Благодаря этому качеству ацетилен используется во многих отраслях – в технологиях сварки и резки металла, для чистки пламенем.
Аргон (Ar)
Доступные ёмкости: 10 л, 20 л, 40 л, 50 л.
Для баллонов ёмкостью 10 л и 40 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью. Баллоны ёмкостью 20 л и 50 л можно арендовать.
Баллоны ёмкостью 20 л и 50 л можно арендовать.
Цвет баллона: Серый с тёмно-зелёным верхом.
Аргон (Ar) – нетоксичный инертный газ большой плотности без запаха и вкуса, используемый в качестве защитного газа при сварке различных металлов. При использовании аргона во время сварки увеличивается текучесть металлического расплава, поэтому металлы можно сваривать быстрее. Для аргона характерна особо низкая теплопроводность.
Аргон используется при TIG, MIG, в процессах плазменной сварки и для защиты корня сварки; аргон облегчает зажигание электрической дуги. Аргон защищает вещества от окисления при сварке, расплавлении, резке металлов и их сплавов. Аргон очень широко используется в металлообработке, в производстве стекла, в металлургии и в производстве электроламп.
Газовая смесь. В составе аргон и углекислый газ (Газ MIX).
Доступные ёмкости: 10 л, 20 л, 40 л, 50 л.
Для баллонов ёмкостью 10 л и 40 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью. Баллоны ёмкостью 20 л и 50 л можно арендовать.
Баллоны ёмкостью 20 л и 50 л можно арендовать.
Цвет баллона: Серый со светло-зелёным верхом.
Газовая смесь аргона – это бесцветная и негорючая газовая смесь без запаха. Аргон – одна из главных составных частей защитной газовой смеси для сварки. Эта газовая смесь защищает электрод и раскалённый металл рядом со сварочным швом от влияния окружающей среды, а также облегчает процесс сварки и улучшает качества шва. Смерь аргона и углекислого газа является универсальной, поэтому пригодна для сварки низко легированной и нержавеющей стали.
Использование при сварке смеси аргона и углекислого газа способствует получению более надёжного сварного шва, так как металл сплавляется более равномерно и внутренних напряжений в сварном шве получается меньше.
Гелий (He)
Доступные ёмкости: 10 л, 20 л, 40 л.
Для баллонов ёмкостью 10 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью. Баллоны ёмкостью 20 л и 40 л можно арендовать.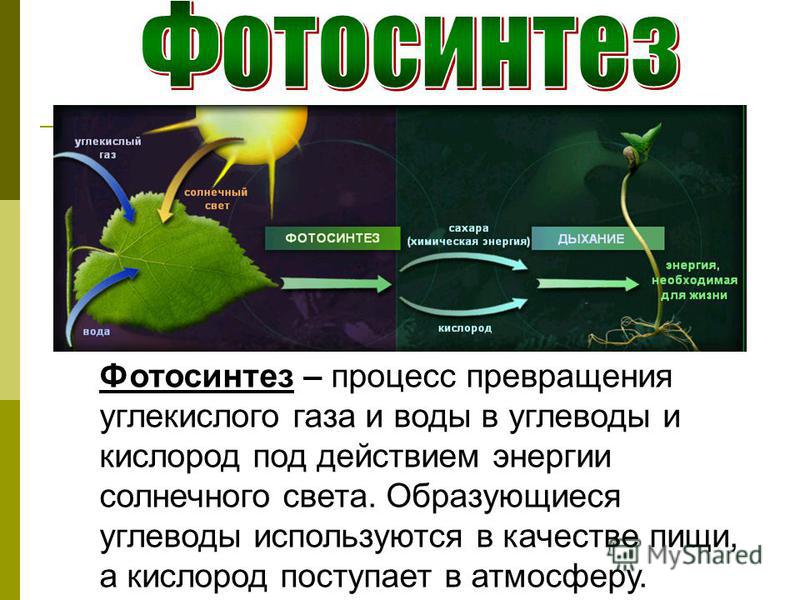
Цвет баллона: Серый со коричневым верхом.
Гелий (He) – бесцветный, неактивный и особо лёгкий инертный газ без запаха и вкуса. Чаще всего гелий знают как газ, которым надувают воздушные шары, поднимающиеся в воздух, потому что гелий воздуха. Однако гелий имеет настолько же большое значение в металлообрабатывающей отрасли, в химической и фармацевтической индустрии. Гелий используется как среда для инертных газов, чтобы устранить окисление в процессе сварки различных металлов (стали, алюминия, меди, магния). Смесь гелия и кислорода используется в оборудовании для подводного плавания и в подводных лодках. Гелий вытесняет кислород, тем самым облегчая дыхание. Этот газ используется для обнаружения трещин в системах высокого давления и в вакуумных системах. Гелий используется также в производстве телекоммуникационных оптико-волоконных кабелей.
Углекислый газ (CO
2)Доступные ёмкости: 10 л, 20 л, 40 л.
Для баллонов ёмкостью 10 л и 40 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью.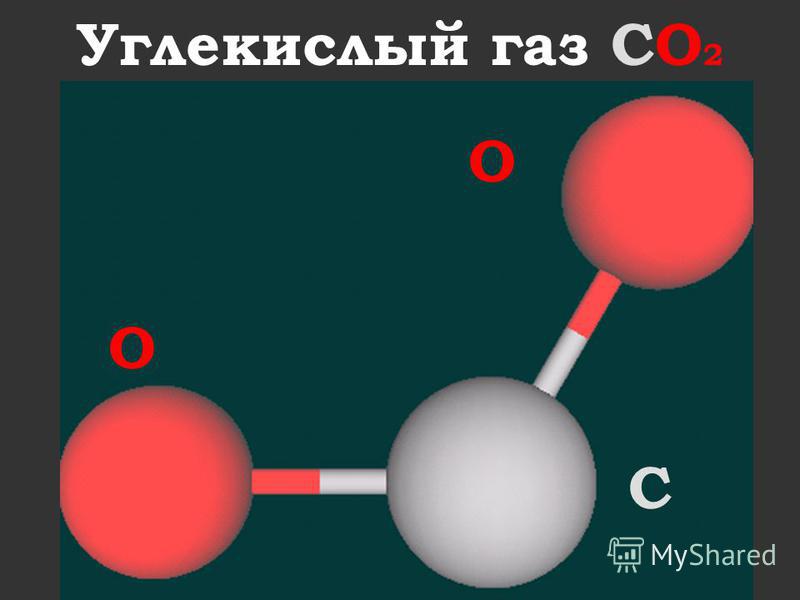 Баллоны ёмкостью 20 л и 40 л можно арендовать.
Баллоны ёмкостью 20 л и 40 л можно арендовать.
Цвет баллона: Баллон серого цвета.
Углекислый газ (CO2) бесцветный газ с несколько кисловатым вкусом и запахом.
Этот газ используется для MAG сварки (самый подходящий газ для так называемой сварки короткой дугой).
Этот газ имеет очень широкое применение при плавлении различных металлов – алюминия, сплавов алюминия и магния, сталей различных видов, хрома, никеля и других.
Он используется для резки металла и в различных отраслях промышленности – им наполняют аппараты огнетушения, предприятия водоснабжения его используют для освобождения воды от различных щелочей.
Пропан (смесь газов CH)
Доступные ёмкости: 27 л, 46 л, 50 л, 79 л.
Баллоны всех ёмкостей можно как арендовать, так и выкупить право на их аренду, и таким образом баллон станет вашей собственностью.
Цвет баллона: Красный – это так называемые баллоны старого типа (50 л). Все остальные – новые, соответствующие требованиям Европейского Союза, и они имеют жёлтый или синий цвет.
Все остальные – новые, соответствующие требованиям Европейского Союза, и они имеют жёлтый или синий цвет.
Пропан (С3H8) – горючий, бесцветный и нетоксичный газ. Когда пропан необходимо транспортировать или использовать в качестве топлива, его сжижают. Пропан используется в качестве топлива в автомобилях и промышленных погрузчиках, также его используют, сжигая в кислородосодержащей среде (например, при сварке, резке, пайке, разогревании и плавлении, резке пламенем). Пропан широко используется в строительных работах, в резке металла, разогревании и плавлении, в сантехнических работах, при соединении и пайке кабелей. Пропан также используется для разогревания дорожного покрытия, для его сушки и бетонирования. В наши дни пропан очень широко используется в качестве источника энергии для обогревателей. Более подробную информацию о домашней системе отопления, использующей баллоны с пропаном, смотрите в разделе «Для домашних хозяйств».
Кислород (O
2)Доступные ёмкости: 10 л, 20 л, 40 л, 50 л.
Для баллонов ёмкостью 10 л и 40 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью. Баллоны ёмкостью 20 л и 50 л можно арендовать.
Цвет баллона: серый с белым верхом.
Кислород (О2) не имеет запаха, вкуса или цвета. Этот газ создаёт пламя с особо высокой температурой, которое применяется для резки и сварки различных металлов.Посредством сварочной горелки он повышает температуру чёрных и цветных металлов. Кислород используется во множестве отраслей. Его используют и в медицине, и в промышленном производстве, в частности, в химической промышленности, производстве стекла, рыбоводстве, деревообработке и производстве бумаги, а также в авиации.
Азот (N
2)Доступные ёмкости: 10 л, 20 л, 50 л.
Для баллонов ёмкостью 10 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью. Баллоны ёмкостью 20 л и 50 л можно арендовать.
Азот (N2) – нетоксичный и химически инертный газ без цвета, запаха и вкуса.
Газы для пищевой промышленности
Пищевой углекислый газ
Доступные ёмкости: 13,4 л, 40 л.
Баллоны всех ёмкостей можно только арендовать.
Двуокись углерода, или так называемый пищевой углекислый газ. Он в основном используется в барах и кафе при продаже пива и других газированных напитков. Состоит из смеси двуокиси углерода и кислорода.
Пищевой азот
Доступные ёмкости: 20 л.
Баллоны ёмкостью 20 л можно только арендовать.
Цвет баллона: светло-серый цвет.
Азот используется при упаковке продуктов, чтобы в среде ограничить присутствие кислорода, уменьшая таким образом рост микроорганизмов и окисление жиров.
Пищевой азот (жидкий) используется для охлаждения ,а также для замораживания.
При охлаждении и замораживании процессиспарения жидкого азота используют для обеспечения быстрого замораживания или охлаждения.
При хранении вина и растительного масла азот используется в качестве инертного газа, который ограничивает процессы окисления и продлевает срок хранения продуктов.
Для домашних хозяйств
Пропан для отопления
Доступные ёмкости: для баллонов ёмкостью 79 л можно выкупить право на аренду, и таким образом баллон станет вашей собственностью, также баллоны можно арендовать.
Цвет баллона: жёлтый или синий.
Предлагаем Вам выбрать быстро набирающий популярность, один из наиболее удобных, экологичных и дешёвых видов отопления, которое используется в многоэтажных и индивидуальных домах и в промышленности.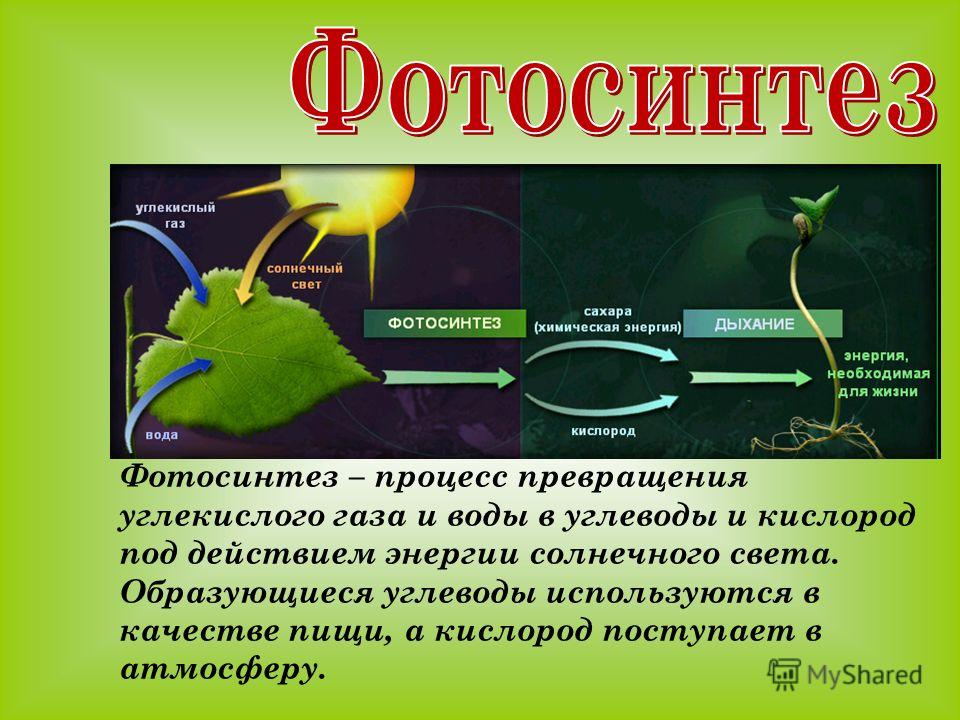
СИНОНИМЫ | ИНС № 290 |
ОПРЕДЕЛЕНИЕ | |
К.А.С. номер | 124-38-9 |
Химическая формула | СО 2 |
Вес формулы | 44. |
Анализ | Не менее 99% СО 2 по объему |
ОПИСАНИЕ | Бесцветный газ без запаха, 1 литр которого весит около 1,98 г при 0° и 760 мм рт. Под давлением около 59 атмосфер он может конденсироваться в жидкость, часть которой при быстром испарении образует белое твердое вещество (сухой лед). Твердый углекислый газ испаряется, не плавясь, на воздухе. Коммерческая двуокись углерода транспортируется и обрабатывается в баллонах под давлением или в системах наливной жидкости низкого давления или в твердых блоках. |
ФУНКЦИОНАЛЬНОЕ ПРИМЕНЕНИЕ | Пропеллент, замораживающий агент, карбонизирующий агент, консервант, растворитель для экстракции |
ХАРАКТЕРИСТИКИ | Следующие спецификации применяются к газообразному диоксиду углерода, полученному из его конденсированной жидкой или твердой фазы путем выделения в газовую фазу при нормальных условиях окружающей среды. |
ИДЕНТИФИКАЦИЯ | |
Образование осадков | При пропускании потока образца через раствор гидроксида бария образуется белый осадок, который с шипением растворяется в разбавленной уксусной кислоте. |
Тестовая трубка детектора | Проходит тест |
ЧИСТОТА | |
Кислотность | Проходит тест |
Фосфин, сероводород и другие органические восстанавливающие вещества | |
Проходит тест | |
Оксид углерода | Не более 10 мл л/л |
Нелетучие углеводороды | |
Не более 10 мг/кг | |
Летучие углеводороды | Не более 50 мл л/л |
Вода | Проходит тест |
ИСПЫТАНИЯ | |
ИДЕНТИФИКАЦИОННЫЕ ИСПЫТАНИЯ | |
Тестовая трубка детектора | Пропустите 100 ± 5 мл, выделившихся из паровой фазы содержимого контейнера, через трубку детектора диоксида углерода (см. ниже) со скоростью, указанной для трубки: Изменение индикатора распространяется на весь диапазон показаний трубки. Детекторная трубка представляет собой стеклянную трубку с плавким предохранителем (Draeger или аналог), предназначенную для прохождения через нее газа и содержащую подходящие адсорбирующие фильтры и вспомогательную среду для индикаторов гидразина и кристаллического фиолетового. |
ИСПЫТАНИЯ НА ЧИСТОТУ | |
Кислотность | Перенесите 50 мл воды, предварительно вскипяченной и охлажденной до комнатной температуры, в пробирку Несслера. Вводят 1000 мл образца в воду через трубку (внутренний диаметр 1 мм), оставляя отверстие трубки на расстоянии не более 2 мм от дна сосуда. Добавить 0,1 мл метилового оранжевого ИР. Полученный красный цвет не темнее, чем цвет идентичного контрольного раствора, к которому вместо диоксида углерода добавлено 1,0 мл 0,01 н. соляной кислоты. |
Фосфин, сероводород и другие органические восстанавливающие вещества | |
Перенесите 25 мл серебряно-аммиачной селитры ИР и 3 мл аммиака ИР в пробирку Несслера. | |
Оксид углерода | Принцип: Проведите тест на первой порции газа, выходящего из баллона. Используйте 5,0 л образца, смешанного с равным объемом азота, не содержащего монооксид углерода, и 10 л азота, не содержащего монооксид углерода, в качестве контроля. Разница между объемами 0,002 н. тиосульфата натрия, использованного в двух титрованиях, не превышает 0,5 мл. Аппаратура: Аппарат состоит из следующих частей, соединенных последовательно: – U-образная трубка, содержащая безводный силикагель, пропитанный триоксидом хрома. – Бутыль для скруббера (типа Дрешеля), содержащая 100 мл 40%-ного раствора гидроксида калия. – U-образная трубка, содержащая пятиокись фосфора, диспергированную на предварительно гранулированной плавленой пемзе. – Туба, содержащая рекристаллизованный йодистый ангидрид (I 2 O 5 ) в гранулах, предварительно высушенный при 200°С и выдержанный при температуре 120°С. Йодный ангидрид упакован в пробирку в виде 1-сантиметровых колонок, разделенных 1-сантиметровыми колонками из стекловаты, чтобы получить эффективную длину 5 см. – Колба, содержащая 2,0 мл калия йодида ИР и 3 капли раствора крахмала ИР. Процедура: Продуть аппарат 5,0 л воздуха, не содержащего диоксид углерода, и, при необходимости, слить синюю окраску в раствор йодида, добавив наименьшее необходимое количество свежеприготовленного 0,002 н. тиосульфата натрия. Продувку продолжают до тех пор, пока не потребуется не более 0,045 мл 0,002 н. тиосульфата натрия после пропускания 5,0 л воздуха, не содержащего диоксид углерода. Пропустите газ из баллона через аппарат. Смыть последние следы выделившегося йода в реакционную колбу, пропуская через аппарат 1,0 л воздуха, не содержащего монооксид углерода. |
Нелетучие углеводороды | Пропустите образец жидкого диоксида углерода из контейнера для хранения или цилиндра для образца через имеющийся в продаже снежный рожок для диоксида углерода непосредственно в открытый чистый контейнер. Взвесьте 500 г этого образца в чистый химический стакан. Дайте твердой двуокиси углерода полностью сублимировать, поместив над стаканом часовое стекло для предотвращения загрязнения окружающей среды. Промойте химический стакан растворителем, не оставляющим следов, и перенесите растворитель из стакана в чистое тарированное часовое стекло или чашку Петри с двумя дополнительными ополаскиваниями стакана растворителем. |
Летучие углеводороды | Стандартная подготовка: Промойте 500-мл стеклянную колбу для проб с перегородкой гелием и введите в колбу образец метана объемом 5,00 мл. Дайте колбе постоять 15 минут, чтобы газы смешались, а затем введите 2,50 мл смеси во вторую 500-миллилитровую колбу для проб, также промытую гелием, и оставьте эту трубку на 15 минут, чтобы газы смешать. Эта смесь является стандартом с номинальным содержанием 50 частей на миллион по объему. Определите точную концентрацию по точным объемам газовых баллонов. Чтобы определить эти объемы, взвесьте пустые пробирки, наполните их водой и снова взвесьте. По весу воды и ее температуре рассчитайте объемы трубок. Хроматографическая система: Газовый хроматограф оснащен пламенно-ионизационным детектором и металлической колонкой размером 1,8 м x 3 мм, заполненной Hayesep Q с размером ячеек от 80 до 100 меш (или эквивалентом). Методика: Ввести в газовый хроматограф 1,00 мл стандартного препарата в трех экземплярах и усреднить отклики площади пика. Относительное стандартное отклонение не должно превышать 5,0%. Аналогичным образом введите 1,00 мл образца в трех повторах, просуммируйте средние площади отдельных пиков, за исключением пиков углекислого газа, и рассчитайте концентрацию v/v в образце по формуле: м л/л = S(A U /A S ), , где S — расчетная часть метана в стандартном препарате (приблизительно 50 мл/л), A U — сумма средних значений откликов площадей отдельных пиков в образце, а As — средняя площадь стандартные ответы зоны подготовки. |
Вода | Трубка детектора водяного пара. Запаянная плавким предохранителем стеклянная трубка (Draeger или аналогичная), предназначенная для пропускания газа и содержащая подходящие поглощающие фильтры и поддерживающую среду для индикатора, состоящего из золя селена в суспензии серной кислоты. (Референсный номер Draeger: CH 67 28531, National Draeger Inc., P.O. Box 120, Pittsburgh, PA 15205-0120, США; диапазон измерений от 5 до 200 мг/м 9 .0343 3 ). Пропустите 24 000 мл пробы газа через подходящую водопоглощающую трубку длиной не менее 100 мм, предварительно промытую примерно 500 мл пробы и взвесив ее. Регулируйте поток так, чтобы для прохождения газа требовалось около 60 мин. Прибавка в массе поглотительной трубки не превышает 1,0 мг. |
МЕТОД АНАЛИЗА | Перенесите раствор гидроксида калия 1 к 3 в газовую пипетку соответствующего объема.
|
Цвета углерода | Nature Reviews Earth & Environment
Появился полный спектр цветовых описаний для описания свойств и распределения органического углерода: черный, коричневый, красный, синий, зеленый и бирюзовый. Эта терминология, основанная на цвете, способствует нашему развивающемуся пониманию углеродного цикла, переходя от традиционных, широких классификаций типов углерода (часто таких простых, как неорганический и органический углерод) к более тонким определениям, основанным на функции, атрибуте или местоположении углерода. Например, некоторые цвета (синий, зеленый и бирюзовый) подчеркивают роль углерода в смягчении последствий изменения климата посредством связывания. Другие типы (черный, коричневый и красный) влияют на тепловой баланс Земли или способствуют таянию криосферы.
Другие типы (черный, коричневый и красный) влияют на тепловой баланс Земли или способствуют таянию криосферы.
Авторы и права: Слева направо: Getty images/R.Tsubin; Getty images/shaunl; Getty images/Эшли Купер; Getty images/apomares; Getty images/shaunl; Getty images/Yulia-Images
Красный углерод — новейший цвет в углеродном спектре. «В самом широком контексте он включает в себя все живые биологические частицы на снегу и льду, которые уменьшают альбедо, чтобы выжить», — описывает Роман Дайал, профессор Тихоокеанского университета Аляски, США (Dial, R. J. et al. FEMS Microbiol. Ecol. 94 ). , fiy007; 2018). Красный выражает обычный пигмент, вырабатываемый снежными микроорганизмами, но этот термин также охватывает пигменты от желтого до фиолетового. Эти цвета поглощают обильные зеленые и синие волны света, растапливая снег и лед и «производя жидкую воду, необходимую для жизни, и высвобождая питательные вещества (такие как азот и фосфор), которые связаны внутри кристаллов льда», — добавляет Дайал.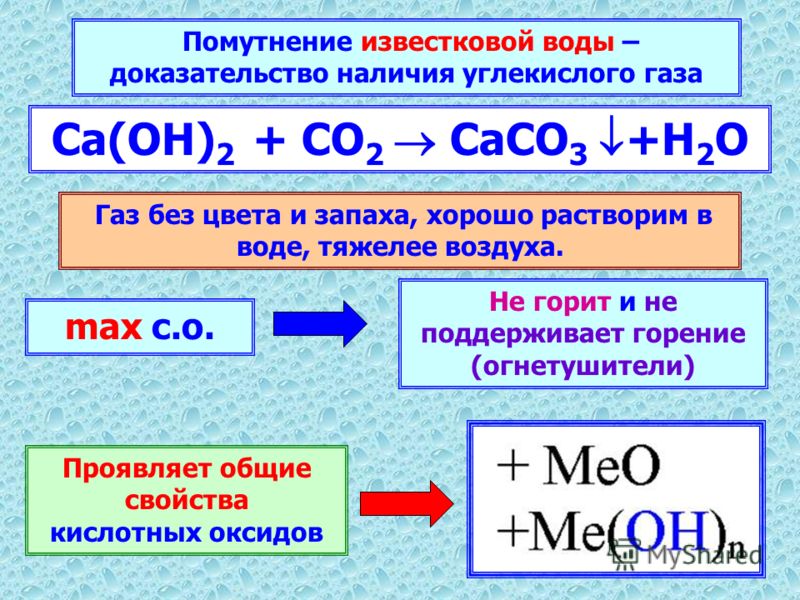 Хотя название «красный углерод» еще не прижилось, известно, что снижение альбедо пигментов увеличивает таяние снега, как это наблюдается в Арктике (Lutz, S. et al. 9).0004 Нац. общ. 7 , 11968; 2016), стимулируя расширение исследований роли микроорганизмов и криосферы.
Хотя название «красный углерод» еще не прижилось, известно, что снижение альбедо пигментов увеличивает таяние снега, как это наблюдается в Арктике (Lutz, S. et al. 9).0004 Нац. общ. 7 , 11968; 2016), стимулируя расширение исследований роли микроорганизмов и криосферы.
Черный углерод, один из наиболее известных цветов углерода, также снижает альбедо снега и льда, тем самым увеличивая таяние, и наряду с коричневым углеродом образуется в результате неполного сгорания органического вещества. Часть производства является естественной (например, во время лесных пожаров), но сжигание ископаемого топлива и промышленная деятельность также являются основными источниками (Bond, T.C. et al. 9).0004 Ж. Геофиз. Рез. Атмос. 118 , 5380–5552; 2013). По сравнению с черным углеродом, который часто называют графитовым и поглощающим широкий спектр света, коричневый углерод является компонентом органических аэрозолей, поглощающим видимый и УФ-свет. Однако оба этих термина меняются с развитием технологий. Например, черный углерод изначально определяли визуально, но теперь Эллен Драффель, профессор Калифорнийского университета в Ирвине, США, отмечает, что существует спектр от «угля, образующегося при частичном сжигании биомассы, до сажи при сжигании ископаемого топлива». Точно так же множество органических соединений, в том числе те, которые образуются в результате вторичных процессов в атмосфере, были идентифицированы под общим термином «коричневый углерод» (Laskin, A. et al. 9).0004 Хим. 115 , 4335–4382; 2015). Что ясно для обоих типов углерода, так это то, что они не только ухудшают качество воздуха, но и поглощают солнечную радиацию в верхних слоях атмосферы, сохраняя тепло и влияя на климат. Тем не менее, недавний «интерес к использованию биоугля в качестве способа хранения углерода», как заявил Друффель, привел к более широкому исследованию черного углерода для смягчения последствий изменения климата, представляя этот темный углерод в более позитивном свете.
Например, черный углерод изначально определяли визуально, но теперь Эллен Драффель, профессор Калифорнийского университета в Ирвине, США, отмечает, что существует спектр от «угля, образующегося при частичном сжигании биомассы, до сажи при сжигании ископаемого топлива». Точно так же множество органических соединений, в том числе те, которые образуются в результате вторичных процессов в атмосфере, были идентифицированы под общим термином «коричневый углерод» (Laskin, A. et al. 9).0004 Хим. 115 , 4335–4382; 2015). Что ясно для обоих типов углерода, так это то, что они не только ухудшают качество воздуха, но и поглощают солнечную радиацию в верхних слоях атмосферы, сохраняя тепло и влияя на климат. Тем не менее, недавний «интерес к использованию биоугля в качестве способа хранения углерода», как заявил Друффель, привел к более широкому исследованию черного углерода для смягчения последствий изменения климата, представляя этот темный углерод в более позитивном свете.
Улавливание углерода также вызвало интерес к зеленому, синему и бирюзовому углероду. Эти цвета объединены описанием местоположения углерода, а не неотъемлемым физическим свойством. Зеленый углерод отражает «углерод, секвестрированный наземными экосистемами», как утверждает Карлос Дуарте, профессор Университета науки и технологий имени короля Абдуллы, Саудовская Аравия, и включает углерод в почвах и в биомассе, такой как леса. Синий углерод, напротив, описывает «углерод, секвестрированный в океане», добавляет Дуарте, «определение которого изначально было сосредоточено на мангровых зарослях, солончаках и водорослях, но теперь также включает морские водоросли и отложения в более широком смысле». Наконец, бирюзовый углерод, который лишь недавно вошел в номенклатуру углеродных красок, относится к «углероду, хранящемуся во внутренних пресноводных водно-болотных угодьях», — говорит Шивон Феннесси, профессор колледжа Кеньон, США (Nahlik, A. M. & Fennessy, M. S. 9).0004 Нац. коммун. 7 , 13835; 2016).
Эти цвета объединены описанием местоположения углерода, а не неотъемлемым физическим свойством. Зеленый углерод отражает «углерод, секвестрированный наземными экосистемами», как утверждает Карлос Дуарте, профессор Университета науки и технологий имени короля Абдуллы, Саудовская Аравия, и включает углерод в почвах и в биомассе, такой как леса. Синий углерод, напротив, описывает «углерод, секвестрированный в океане», добавляет Дуарте, «определение которого изначально было сосредоточено на мангровых зарослях, солончаках и водорослях, но теперь также включает морские водоросли и отложения в более широком смысле». Наконец, бирюзовый углерод, который лишь недавно вошел в номенклатуру углеродных красок, относится к «углероду, хранящемуся во внутренних пресноводных водно-болотных угодьях», — говорит Шивон Феннесси, профессор колледжа Кеньон, США (Nahlik, A. M. & Fennessy, M. S. 9).0004 Нац. коммун. 7 , 13835; 2016).
Связывание синего углерода особенно заинтересовало политиков и ученых-экологов как решение для смягчения последствий изменения климата, потому что, как утверждает Дуарте, оно «не оказывает негативного воздействия, способствует адаптации путем поднятия морского дна и буферизации волн, дает дополнительные преимущества, таких как увеличение рыбных ресурсов, и является рентабельным». Тем не менее Феннесси утверждает, что «внутренние участки также должны быть признаны за их способность накапливать углерод. Это еще более важно в свете недавних изменений в правиле «WOTUS» (Воды Соединенных Штатов), которые могут разрешить уничтожение внутренних водно-болотных угодий, которые ранее были защищены». В случае разрушения бирюзовый углерод, хранящийся в водно-болотных угодьях, может действовать как источник CO2.
Тем не менее Феннесси утверждает, что «внутренние участки также должны быть признаны за их способность накапливать углерод. Это еще более важно в свете недавних изменений в правиле «WOTUS» (Воды Соединенных Штатов), которые могут разрешить уничтожение внутренних водно-болотных угодий, которые ранее были защищены». В случае разрушения бирюзовый углерод, хранящийся в водно-болотных угодьях, может действовать как источник CO2.
Определение и эффективное использование терминов, подобных приведенным здесь, может мотивировать продвижение и защиту углеродных исследований, особенно когда, как утверждает Дуарте, «спрос на надежные, эффективные и ценные природные решения для смягчения последствий изменения климата растет». Однако эти углеродные цвета являются живыми определениями, которые пересекают дисциплинарные границы и расширяются или уточняются, чтобы адаптироваться к новым знаниям, инструментам и политическим потребностям. Более того, продолжают появляться новые цвета, как в случае с красным и бирюзовым. По мере того, как исследования углерода продвигаются вперед, возникает вопрос, каким будет следующий цвет углеродной радуги.
По мере того, как исследования углерода продвигаются вперед, возникает вопрос, каким будет следующий цвет углеродной радуги.
Сезонные изменения содержания углекислого газа
Земля ID: 4565
Визуализации Грег Шира Выпущено 4 мая 2017 г.
Углекислый газ является наиболее важным парниковым газом, выбрасываемым в атмосферу в результате деятельности человека. На него также влияет естественный обмен с сушей и океаном. Эта визуализация обеспечивает трехмерное представление с высоким разрешением глобальных концентраций углекислого газа в атмосфере с 1 сентября 2014 г. по 31 августа 2015 г. Визуализация была создана с использованием выходных данных системы моделирования GEOS, разработанной и поддерживаемой учеными НАСА. Высота земной атмосферы и топография были преувеличены по вертикали и кажутся примерно в 400 раз выше, чем обычно, чтобы показать сложность атмосферного потока. Измерения углекислого газа со второго космического корабля НАСА «Орбитальная углеродная обсерватория» (OCO-2) включаются в модель каждые 6 часов для обновления или «корректировки» результатов модели, называемой ассимиляцией данных.
Как показывает визуализация, углекислый газ в атмосфере может смешиваться и переноситься ветрами в мгновение ока. В течение нескольких десятилетий ученые измеряли содержание углекислого газа в отдаленных местах на поверхности, а иногда и с самолетов. Миссия OCO-2 представляет собой важный шаг вперед в возможностях наблюдения за углекислым газом в атмосфере. OCO-2 собирает высокоточные измерения общего содержания углекислого газа (от датчика до поверхности Земли) в дневное время. Хотя наземные, воздушные и спутниковые наблюдения дают ценную информацию об углекислом газе, эти измерения не говорят нам о количестве углекислого газа на определенных высотах в атмосфере или о том, как он перемещается по странам и континентам. Возможности численного моделирования и усвоения данных позволяют ученым комбинировать различные типы измерений (например, измерения концентрации углекислого газа и ветра) из различных источников (например, со спутников, самолетов и наземных наблюдательных пунктов) для изучения поведения углекислого газа в атмосфере и как горы и погодные условия влияют на поток атмосферного углекислого газа. Ученые также могут использовать результаты моделирования, чтобы понять и предсказать, где углекислый газ выбрасывается и удаляется из атмосферы, а сколько в результате естественных процессов и деятельности человека.
Ученые также могут использовать результаты моделирования, чтобы понять и предсказать, где углекислый газ выбрасывается и удаляется из атмосферы, а сколько в результате естественных процессов и деятельности человека.
Колебания углекислого газа в значительной степени контролируются выбросами ископаемого топлива и сезонными потоками углерода между атмосферой и биосферой суши. Например, темно-красные и оранжевые оттенки обозначают регионы, где концентрация углекислого газа повышается за счет источников углерода. Осенью и зимой в Северном полушарии, когда деревья и растения начинают сбрасывать листья и разлагаться, в атмосферу выбрасывается углекислый газ, который смешивается с выбросами из антропогенных источников. Это, в сочетании с меньшим количеством деревьев и растений, удаляющих углекислый газ из атмосферы, позволяет концентрации расти всю зиму, достигая пика ранней весной. В весенние и летние месяцы в северном полушарии растения поглощают значительное количество углекислого газа посредством фотосинтеза, тем самым удаляя его из атмосферы и меняя цвет на синий (низкие концентрации углекислого газа). Этот трехмерный вид также показывает влияние пожаров в Южной Америке и Африке, которые происходят с регулярным сезонным циклом. Углекислый газ от пожаров может переноситься на большие расстояния, но на путь сильно влияют большие горные хребты, такие как Анды. В верхней части атмосферы синий цвет указывает на воздух, который последний раз касался Земли более года назад. В этой части атмосферы, называемой стратосферой, концентрация углекислого газа ниже, потому что на нее не повлияло недавнее увеличение выбросов.
Этот трехмерный вид также показывает влияние пожаров в Южной Америке и Африке, которые происходят с регулярным сезонным циклом. Углекислый газ от пожаров может переноситься на большие расстояния, но на путь сильно влияют большие горные хребты, такие как Анды. В верхней части атмосферы синий цвет указывает на воздух, который последний раз касался Земли более года назад. В этой части атмосферы, называемой стратосферой, концентрация углекислого газа ниже, потому что на нее не повлияло недавнее увеличение выбросов.
Эта версия визуализации была создана специально для поддержки серии статей в журнале Science и для подачи на фестиваль компьютерной анимации SIGGRAPH 2017.
Эта визуализация выиграла конкурс Data Stories 2017 года журнала Science в категории «профессионал» (см.: http://www.sciencemag.org/projects/data-stories/winners/2017)
Эта визуализация была показана на SIGGRAPH 2017 Электронный театр в Лос-Анджелесе, Калифорния, июль 2017 г. (см.: http://s2017.siggraph. org/content/computer-animation-festival#etvrlistings)
org/content/computer-animation-festival#etvrlistings)
Used Elsewhere In
Related
Visualization Credits
Greg Shirah (NASA/GSFC): Lead Visualizer
Horace Mitchell (NASA /GSFC): Визуализатор
Лоуренс Шулер (ADNET): Техническая поддержка
Ян Джонс (ADNET): Техническая поддержка
Лесли Отт (NASA/GSFC): Ученый
Стивен Поусон (NASA/GSFC): научный сотрудник
Брэд Вейр (USRA): ведущий научный сотрудник
Эннмари Элдеринг (NASA/JPL CalTech): научный сотрудник (USRA): Рассказчик
Стюарт А. Снодграсс (KBRwyle): Редактор
Укажите адрес этого элемента:
Студия научной визуализации НАСА
Короткий URL-адрес, чтобы поделиться этой страницей0471
https://svs.


 Гипокапния)
Гипокапния)
 0,25}{1}моль )
0,25}{1}моль )

 01
01 Дополнительные спецификации могут применяться к жидким или твердым формам диоксида углерода поставщиками или конкретными пользователями коммерческих продуктов с диоксидом углерода.
Дополнительные спецификации могут применяться к жидким или твердым формам диоксида углерода поставщиками или конкретными пользователями коммерческих продуктов с диоксидом углерода. описание в разделе ИСПЫТАНИЯ
описание в разделе ИСПЫТАНИЯ описание в разделе ИСПЫТАНИЯ
описание в разделе ИСПЫТАНИЯ (Референсный номер Draeger: CH 30801, National Draeger Inc., P.O. Box 120, Pittsburgh, PA 15205-0120, USA; диапазон измерений от 0,01% до 0,30%).
(Референсный номер Draeger: CH 30801, National Draeger Inc., P.O. Box 120, Pittsburgh, PA 15205-0120, USA; диапазон измерений от 0,01% до 0,30%).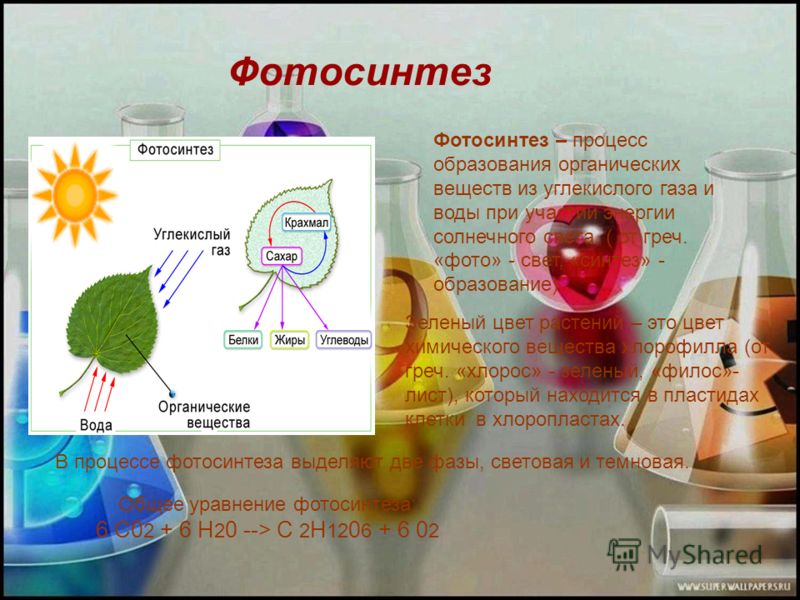 В отсутствие света вводят 1000 мл пробы так же, как и при испытании на кислотность. Коричневый цвет не образуется.
В отсутствие света вводят 1000 мл пробы так же, как и при испытании на кислотность. Коричневый цвет не образуется.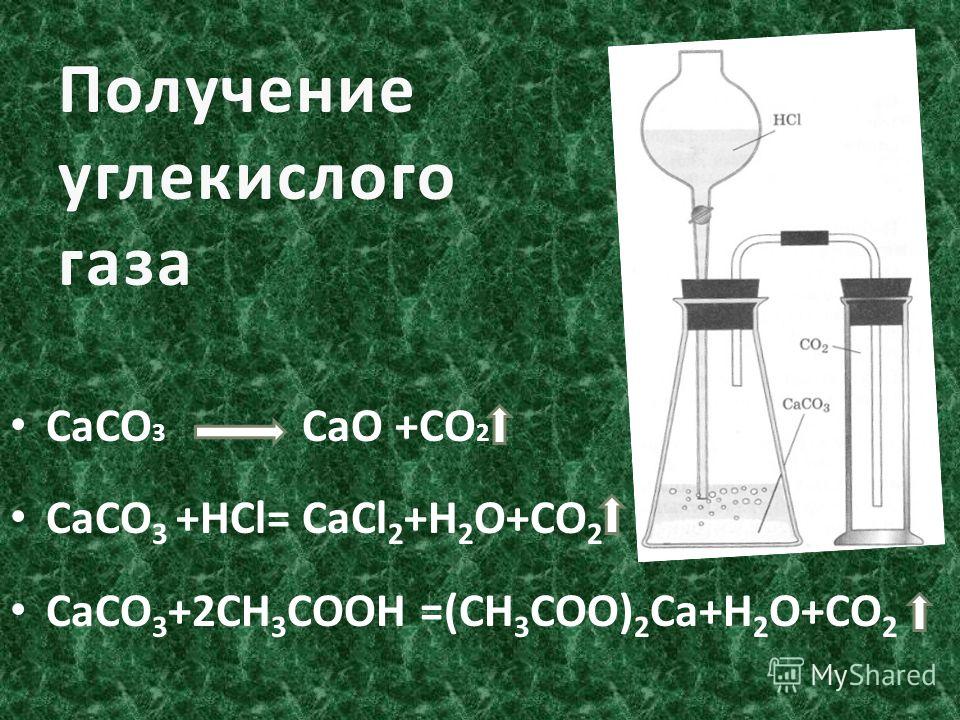
 Титруют выделившийся йод 0,002 N раствором тиосульфата натрия. Проведите холостой анализ, используя 10 л азота, не содержащего монооксид углерода. Разница между объемами 0,002 н. раствора тиосульфата натрия, используемого в двух титрованиях, не должна быть более 0,5 мл.
Титруют выделившийся йод 0,002 N раствором тиосульфата натрия. Проведите холостой анализ, используя 10 л азота, не содержащего монооксид углерода. Разница между объемами 0,002 н. раствора тиосульфата натрия, используемого в двух титрованиях, не должна быть более 0,5 мл. Дают растворителю испариться, нагревая до 104°, пока вес часового стекла или чашки Петри не станет постоянным. Определить массу остатка по разнице. Масса остатка не превышает 5 мг.
Дают растворителю испариться, нагревая до 104°, пока вес часового стекла или чашки Петри не станет постоянным. Определить массу остатка по разнице. Масса остатка не превышает 5 мг. Газ-носитель – гелий при скорости потока 30 мл/мин. Температура инжектора и температура детектора поддерживаются на уровне 230°. Температуру колонки программируют следующим образом: выдерживают при 70° в течение 1 мин, затем повышают до 200° со скоростью 20°/мин и затем выдерживают при 200° в течение 10 мин. Параметры детектора: диапазон чувствительности: 10 -12 А/мВ; затухание: 32. Концентрация летучих углеводородов указывается в эквивалентах метана. Различные отклики газовой хроматографии, за исключением отклика диоксида углерода, суммируются для получения общей концентрации летучих углеводородов. Состав присутствующих углеводородов будет варьироваться от образца к образцу. Типичное время удерживания: метан: 0,4 мин; диоксид углерода: 0,8 мин; гексан: 14,4 мин.
Газ-носитель – гелий при скорости потока 30 мл/мин. Температура инжектора и температура детектора поддерживаются на уровне 230°. Температуру колонки программируют следующим образом: выдерживают при 70° в течение 1 мин, затем повышают до 200° со скоростью 20°/мин и затем выдерживают при 200° в течение 10 мин. Параметры детектора: диапазон чувствительности: 10 -12 А/мВ; затухание: 32. Концентрация летучих углеводородов указывается в эквивалентах метана. Различные отклики газовой хроматографии, за исключением отклика диоксида углерода, суммируются для получения общей концентрации летучих углеводородов. Состав присутствующих углеводородов будет варьироваться от образца к образцу. Типичное время удерживания: метан: 0,4 мин; диоксид углерода: 0,8 мин; гексан: 14,4 мин.
 Точно отмерьте около 1000 мл образца в газовую бюретку, содержащую раствор хлорида натрия 1:10. Перенесите образец в газовую пипетку и хорошо встряхните. Когда объем оставшегося неабсорбированного газа постоянен (V мл), содержание углекислого газа рассчитывается по формуле:
Точно отмерьте около 1000 мл образца в газовую бюретку, содержащую раствор хлорида натрия 1:10. Перенесите образец в газовую пипетку и хорошо встряхните. Когда объем оставшегося неабсорбированного газа постоянен (V мл), содержание углекислого газа рассчитывается по формуле: