Давление в газовом баллоне 50 л в атмосферах: Какое давление выдерживает газовый баллон 50 л?
alexxlab | 07.05.2023 | 0 | Разное
Азотный баллон 50 л, новый от 18250 руб/шт
Пн-Пт 9:00-17:00
Регистрация Вход
- Главная
- Каталог
- Газовые баллоны
- Азотные баллоны
- Азотный баллон 50 л, новый
Оптовые цены
| Кол-во | Стоимость |
|---|---|
| 1 шт | 23 000 |
| 3 шт | 19 700 |
| 5 шт | 19 000 |
| 10 шт | 18 500 |
| 20 шт | 18 250 |
Оптовые цены
| Кол-во | Стоимость |
|---|---|
| 1 шт | 23 000 |
| 3 шт | 19 700 |
| 5 шт | 19 000 |
| 10 шт | 18 500 |
| 20 шт | 18 250 |
Объем баллона, л
5
10
20
40
50
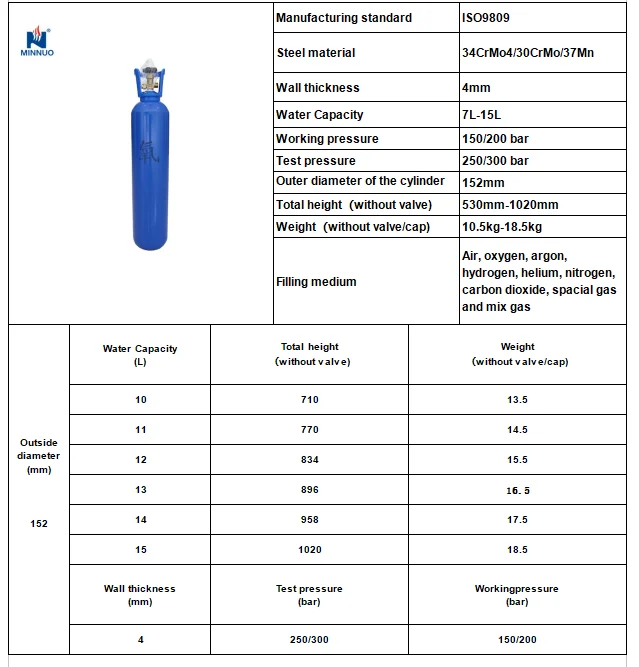
Характеристики
| Наименование | Значение |
|---|---|
| Объем: | 50 л |
| ГОСТ: | ГОСТ 949-73 |
| Материал: | Сталь 45, Д |
| Рабочее давление: | 150 Атм |
| Высота: | 1700 мм |
| Диаметр: | 219 мм |
| Новый: | Да |
| Рабочая температура: | от -50 до 60 °С |
| Вес: | 77 кг. |
Описание
Предлагаем приобрести новые и б/у азотные баллоны 50л, в наличии имеются как стандартные с рабочим давлением 150 АТМ так и высоко-атмосферные с 200 АТМ.
Баллон азотный предназначен для транспортировки и хранения азота. Баллон для азота комплектуется кольцом горловины, вентилем, предохранительным колпаком и опорным башмаком. Корпус азотных баллонов окрашивается эмалевой краской черного цвета. На баллон наносится надпись «АЗОТ» желтого цвета.
Азотные баллоны емкостью 50 литров изготавливаются из стали марки –30ХГСА, 45, Д. Масса баллонов указана без вентилей, колпаков, колец и башмаков и является справочной величиной и номинальной при изготовлении баллонов с ограничением по массе. Длины баллонов указаны как справочные и принимаются номинальными при изготовлении баллонов с ограничением по длине.
Ориентировочная масса колпака металлического-1,8 кг; из волокнита-0,5 кг; башмака-5,2 кг. Резьба горловины баллонов должна изготавляться в соответствии с ГОСТ 9909-81. На вентиле, ввинченом в горловину баллона, должно оставаться 2-5 запасных ниток, установка вентилей должна производиться с применением уплотнителя.
На вентиле, ввинченом в горловину баллона, должно оставаться 2-5 запасных ниток, установка вентилей должна производиться с применением уплотнителя.
Отзывы
Похожие товары
Азотный баллон 5 л, новый
7 700
Азотный баллон 10 л, новый
8 100
Азотный баллон 20 л, новый
14 900
Азотный баллон 40 л, новый
16 500
Часто ищут
Объем
5 литров
10 литров
20 литров
40 литров
50 литров
Вид
Безопасные
Большие
Бытовые
Воздушные
Высокие
Красные
Композитные
Металлические
Медицинские
Норвежские
Пластиковые
Полимерные
Переносные
Чёрные
Промышленные
Применение
Для сварки
Для шаров
Для натяжных потолков
Для пива
Для котлов
Для плиты
Вы смотрели
Азотный баллон 50 л, новый
23 000
Код: 1010405
Азотный баллон 50 л, новый
Остаточное давление в баллоне.
 Что это и зачем его нужно оставлять?
Что это и зачем его нужно оставлять?Практически ни одна сфера промышленности не обходится без использования технических газов: с помощью аргона, углекислоты и газовых смесей выполняют работы по сварке и резке металла. Азот используют в нефтегазовой и пищевой сфере, а кислород необходим металлургам и энергетикам. Так как объем необходимых для производственных целей газов должен быть значительным, то в баллоны их закачивают под высоким давлением. Как правило, это 150-200 атмосфер.
Газовые баллоны под таким давлением – опасный груз (второй класс опасности и выше), поэтому все правила работы с ними регламентированы несколькими документами, в числе которых «Федеральные нормы и правила в области промышленной безопасности», а именно раздел «Дополнительные требования промышленной безопасности к освидетельствованию и эксплуатации баллонов». Поскольку в этой статье мы говорим об остаточном давлении, то в первую очередь нас интересует пункт 516 данного раздела. Но для начала определим, что такое остаточное давление.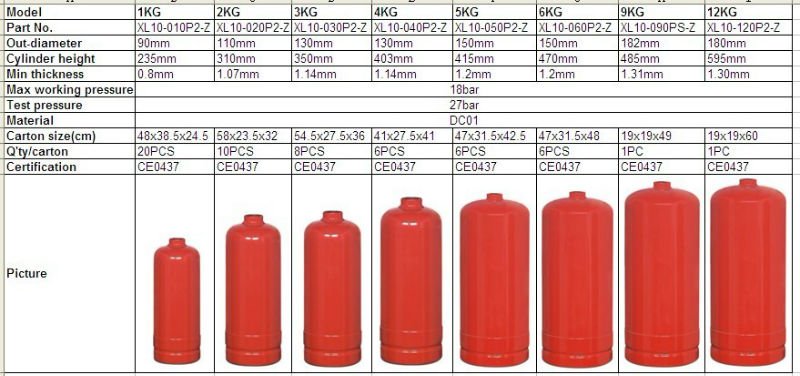
Остаточное давление в баллоне – это неиспользуемый остаток газа, который необходим для того, чтобы в баллон не попало никаких примесей из атмосферы. Тем самым обеспечивается чистота газа на выходе.
Согласно п.516 «При эксплуатации баллонов не допускается расходовать находящийся в них газ полностью. Для конкретного типа газа, с учетом его свойств, остаточное давление в баллоне устанавливается в руководстве (инструкции) по эксплуатации и должно быть не менее 0,05 МПа, если иное не предусмотрено техническими условиями на газ
».- С помощью лабораторных исследований определить, какого вида и какой чистоты был до этого газ в баллоне. По результатам полученных проб баллон и дальше заправляется таким же видом газа. Либо тара отправляется на техническое обслуживание (просушка, вакуумирование, обработка), после чего возможна заправка газом.
- Не допускать попадания внутрь баллона неблагоприятных примесей: масла, воды, воздуха, пыли и т.
 д. То есть обеспечить наличие гарантированно чистого газа в баллоне (что, например, является ключевым моментом при сварке аргоном).
д. То есть обеспечить наличие гарантированно чистого газа в баллоне (что, например, является ключевым моментом при сварке аргоном). - Проверить герметичность баллона. Если в газовой таре не остаётся давление, это может говорить о проблемах с запорной арматурой. Соответственно, в этом случае потребуется анализ и ремонт газового баллона.
- Не допустить возникновения пожаро- и взрывоопасных ситуаций. Если не контролировать остаточное давление и дать ему опуститься ниже требуемого, произойдет «подсос» окружающего воздуха с влагой или газа из соседнего баллона одной магистрали. Например, при сварке ацетиленом и кислородом в правильной пропорции обеспечивается равномерное горение (при смешивании). Но при попадании одного газа в другой происходит неконтролируемое смешивание, из-за которого может произойти взрыв.
Как проверить остаточное давление в баллоне?
Наличие остаточного давления в газовом баллоне проверяется.
- Для работы с неагрессивным газом необходимы манометры с внутренними деталями из цветного металла или нержавеющей стали.

- В баллонах с кислородом, ацетиленом и другими взрывоопасными газами и смесями используют специально разработанные манометры. Они отличаются тем, что в процессе производства проходят специальную технологическую процедуру очистки сухим воздухом. С их внутренних частей, которые вступают в непосредственный контакт с кислородом, удаляют все масло и смазку, оставшиеся после механической обработки. Что позволяет избежать возникновение пожароопасных ситуаций.
Всегда сохранять нужный остаток давления позволяют и вентили с обратным клапаном. Такие, как правило, используются по умолчанию на баллонах зарубежного производства, либо можно приобрести такие вентили отдельно на баллоны российских производителей.
Как мы видим, остаточное давление – важный показатель в работе с газовыми баллонами. Помните, что поставщики не заправят вам баллон, если в нем не будет остаточного давления. В этом случае тару отдадут на ремонт, после чего заново наполнят газом или смесью. Делается это для того, чтобы быть уверенными в чистоте продукта на выходе из баллона.
Делается это для того, чтобы быть уверенными в чистоте продукта на выходе из баллона.
ChemTeam: Закон идеального газа: Задачи №11
Обратите внимание на деление 750 на 760. Это делается для перевода давления из мм рт. ст. в атм, поскольку значение R содержит атм в качестве единицы измерения давления. Если бы мы использовали мм рт. ст., единицы давления не сокращались бы, и нам нужно, чтобы они сокращались, потому что мы требуем моль (и только моль) в ответе.
Проблема № 12: 1,09 г H 2 содержится в 2,00-литровом контейнере при 20,0 °C. Какое давление в этом сосуде в мм рт.
Обратите внимание на деление 1.09 на 2.02. Это делается для того, чтобы преобразовать граммы в моли, потому что значение R содержит моль как единицу количества вещества. Если бы мы использовали g, единица моль в R не сокращалась бы, и нам нужно, чтобы она сокращалась, потому что мы требуем, чтобы atm (и только atm) был в ответе.
Задача № 13: Вычислите объем 3,00 моль газа при 24,0 °C и 762,4 мм рт.ст.
Задача № 14: Сколько молей газа будет содержаться в газе, находящемся в сосуде объемом 100,0 мл при температуре 25,0 °C и давлении 2,50 атмосферы?
Задача № 15: Сколько молей газа содержится в газе, находящемся в сосуде объемом 37,0 л при температуре 80,00 °C и давлении 2,50 атм?
В = [(1,27 моль) (0,08206 л атм моль¯ 1 К¯ 1 ) (273,0 К)] / 1,00 атмили
(22,4 л/1,00 моль) = (х/1,27 моль)
3) Изменится ли ответ, если газом будет кислород? Криптон? Углекислый газ? Метан?
Нет, нет, нет, нет. Точная идентичность газа не имеет значения для количества присутствующих молей. Кстати, обратите внимание, что, поскольку температура и давление были бы одинаковыми, в одном и том же объеме будет содержаться одинаковое количество молекул газа, т.е. молей газа. Это гипотеза Авогадро.
Задача № 17: При каком давлении 0,150 моля газообразного азота при 23,0 °C занимают 8,90 л?
Решение:
Р = нРТ/ВP = [(0,150 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (296,0 K)] / 8,90 л
Задача №18: Какой объем заняли бы 32,0 г газа NO 2 при 3,12 атм и 18,0 °C?
Решение:
В = нРТ / ПВ = [(32,0 г / 46,0 г моль¯ 1 ) (0,08206 л атм моль¯ 1 К¯ 1 ) (291,0 К)] / 3,12 атм
Обратите внимание на перевод граммов в моли (32,0/46,0).
Задача №19: Сколько молей газа содержится в баллоне объемом 50,0 л при давлении 100,0 атм и температуре 35,0 °С? Если газ весит 79,14 г, какова его молекулярная масса?
Решение:
n = PV/RTn = [(100,0 атм) (5,00 л)] / [(0,08206 л атм моль¯ 1 К¯ 1 ) (308,0 К)]
n = 19,7828 моль (я сохранил некоторые сторожевые цифры).
мол. вес. = 79,14 г / 19,7828 моль = 4,00 г/моль (до 3 значащих цифр)
Задача №20: Количество идеального газа при температуре 290,9 К имеет объем 17,05 л при давлении 1,40 атм. Каково давление этой газовой пробы, если объем уменьшить вдвое, а абсолютную температуру умножить на четыре?
Решение:
1) Рассчитайте количество молей газа (я не упомянул единицы измерения):
n = [(1,40) (17,05)] / [(0,08206) (290,9)] = 1,00 моль2) Снова используйте PV = nRT, но разделите объем на два и умножьте температуру на 4.
 Используйте значение моля из приведенного выше и найдите P:
Используйте значение моля из приведенного выше и найдите P:P = [(1,00) (0,08206) (290,9 х 4)] / (17,05/2) = 11,2 атм
Есть и другой, более концептуальный способ объяснить ответ. Сначала подумаем о связи между давлением и объемом (они обратно пропорциональны). Затем мы подумаем о взаимосвязи между абсолютной температурой и давлением (они связаны напрямую).
Если объем уменьшится в два раза, что произойдет с давлением? Давление ПОВЫШАЕТСЯ в два раза. Таким образом, ваше давление удвоится. Р = 1,40 умножить на 2 = 2,80 атм.
Если абсолютная температура увеличивается, давление увеличивается на ту же величину. Следовательно, поскольку температура умножается на 4, то и давление следует умножать на 4. P = 2,80 умножить на 4 = 11,2 атм.
Задача №21: Полностью сдутый шарик имеет массу 0,5 г. Когда он заполнен неизвестным газом, масса увеличивается до 1,7 г. Вы замечаете на баллоне с неизвестным газом, что он занимает объем 0,4478 л при температуре 50 °С. Вы замечаете, что температура в комнате 25 °C. Определите газ.
Вы замечаете, что температура в комнате 25 °C. Определите газ.
Решение:
1) Используйте закон Чарльза, чтобы получить объем при 25 °C:
0,4478/323 = х/298
2) Предположим, что баллон находится под давлением 1,00 атм. Используйте PV = nRT, чтобы получить количество молей газа:
(1,00) (0,41314) = (х) (0,08206) (298)
3) Разделите граммы газа (1,7 г – 0,5 г = 1,2 г) на моли, чтобы получить молекулярную массу:
1,2 г / 0,01689466 моль = 71,0 г/мольГаз хлор Cl 2
Между прочим, использование закона Шарля на первом этапе предполагает, что все содержимое газового баллона было выпущено. Если мы предположим, что канистра разряжена лишь частично, то мы не сможем решить эту проблему.
Задача № 22: Образец газа массой 10,20 г имеет объем 5,25 л при 23,0 °C и 751 мм рт.ст. Если к этому постоянному объему 5,25 л добавить 2,30 г того же газа и поднять температуру до 67,0 градусов Цельсия, каково будет новое давление газа?
Решение:
1) Используйте PV = nRT для определения молей образца 10,20 г:
(751 мм рт.ст./760 мм рт.ст. атм -1 ) (5,25 л) = (n) (0,08206 л атм моль -1 К -1 ) (296 К)
n = 0,21358 моль
2) Определите молекулярную массу газа:
10,20 г/0,21358 моль = 47,757 г/моль
3) Определить количество молей 2,30 г газа:
2,30 г / 47,757 г/моль = 0,04816 моль
4) Определить новое давление с новым количеством молей и при новой температуре:
(P) (5,25 л) = (0,26174 моль) (0,08206 л атм моль -1 К -1 ) (340 К)Р = 1,39 атм.
Примечание: 0,26174 получилось из 0,21358 плюс 0,04816.
Задача № 23: Газ, состоящий только из углерода и водорода, имеет эмпирическую формулу CH 2 . Газ имеет плотность 1,65 г/л при 27,0 °C и 734,0 торр. Определите молярную массу и молекулярную формулу газа.
Решение:
1) Используйте PV = nRT для определения количества молей газа в 1,00 л:
(734,0 торр/760,0 торр атм -1 ) (1,00 л) = (n) (0,08206 л атм моль -1 К -1 ) (300, К)n = 0,039231 моль
2) Определите молекулярную массу газа:
1,65 г/0,039231 моль = 42,06 г/моль
3) Определите молекулярную формулу:
“Эмпирическая формула веса” CH 2 = 14,027“Эмпирическая формула массы” единиц CH 2 присутствует:
42,06 / 14,027 = 2,998 = 3Молекулярная формула C 3 H 6
Имейте в виду, что «вес по эмпирической формуле» не является стандартным термином в химии.
Задача № 24: 13,9 грамма неизвестного газа помещены в сосуд объемом 5,00 л. Его начальное давление составляет 58,6 кПа, а начальная температура — 60,0 °C. Как называется этот газ?
Решение:
1) Используйте PV = nRT:
(58,6 кПа) (5,00 л) = (n) (8,31447 л кПа моль -1 К -1 ) (333 К)n = 0,10582 моль
Здесь я нашел значение R.
2) Определите молекулярную массу:
13,9 г/0,10582 моль = 131,4 г/мольИзучение периодической таблицы приводит нас к идентификации газа как ксенона.
Задача №25: Колба на 19,5 л при 15 °C содержит смесь трех газов: N 2 (2,50 моль), He (0,38 моль) и Ne (1,34 моль). Рассчитайте парциальное давление неона в смеси.
Решение:
1) Определить общее количество молей газа:
2,50 + 0,38 + 1,34 = 4,22 моля
2) Используйте PV = nRT:
(х) (19,5 атм) = (4,22 моль) (0,08206) (288 К)х = 5,115 атм
Определите парциальное давление неона:
5,115 х (1,34/4,22) = 1,62 атм.Примечание: (1,34/4,22) определяет молярную долю неона.
Задача №26: Колба объемом 1,00 л заполнена 1,25 г аргона при температуре 25,0 °C. Затем в ту же колбу добавляют пары этана, пока общее давление не станет равным 1,050 атм. Какова масса этана, добавленного в колбу?
Решение:
1) Определить парциальное давление Ar:
PV = нРТ(P) (1,00 л) = (1,25 г/39,948 г/моль) (0,08206 л атм/моль К) (298 К)
P = 0,76518 атм
2) Определить парциальное давление этана:
1,050 атм − 0,76518 атм = 0,28482 атм
3) Определить моль добавленного этана:
PV = нРТ(0,28482 атм) (1,00 л) = (n) (0,08206 л атм/моль К) (298 К)
n = 0,011647 моль
4) Определить массу этана:
(0,011647 моль) (30,0694 г/моль) = 0,350 г (до трех цифр)
Бонусная задача №1: Давление паров воды при 25 °C составляет 23,76 торр. Если в сосуд объемом 2,0 л налить 1,50 г воды, будет ли в нем жидкость? Если да, то какая масса жидкости?
Если в сосуд объемом 2,0 л налить 1,50 г воды, будет ли в нем жидкость? Если да, то какая масса жидкости?
Решение:
1) Используя закон идеального газа, определите, сколько молей газа необходимо испарить, чтобы получить давление 23,76 торр.
PV = нВУP = давление газа в атм = 23,76 торр x (1 атм / 760 торр) = 0,0313 атм
В = объем газа в л = 2,0
n = моль газа = ?
R = газовая постоянная = 0,08206 л атм/К моль
T = температура по Кельвину = 25 °C + 273 = 298 Kn = PV / RT = (0,0313)(2,0) / (0,08206)(298) = 0,00255992 моль H 2 Газ O
2) Определите массу водяного пара:
0,00255992 моль H 2 газ O x (18,015 г H 2 O / 1 моль H 2 O) = 0,046117 г H 2 Газ O
3) Количество жидкости H 2 O в контейнере:
всего г H 2 O − g H 2 O газ —> 1,50 − 0,046117 = 1,45 г H 2 O жидкий (до трех знаков)
Бонусное задание №2: Контейнер A содержит газ N 2 массой 56,2 г, что в 4,4 раза больше объема контейнера B, содержащего аргон (Ar) при той же температуре и давлении. Какова масса Ar (в г) в контейнере B?
Какова масса Ar (в г) в контейнере B?
Решение:
1) Для этой задачи есть два представляющих интерес уравнения:
PV = нРТ
n = m/M, где M — молярная масса газа, а m — масса газа
2) Подставляя одно в другое, имеем вот что:
PV = (м/м)RTпереставить его на это:
ВМ/м = RT/P
3) Некоторые факторы постоянны, некоторые переменны:
R всегда является константой.
Проблема указывает, что P и T также являются постоянными.Это означает, что RT/P является постоянным.
4) Что означает:
ВМ/м = константа
5) Так как есть ВМ/м для азота и ВМ/м для аргона, мы имеем это:
V 1 M 1 /м 1 = V 2 M 2 /м 2перекрестное умножение:
M 2 V 1 M 1 = M 1 V 2 M 2
Divide на V 1 M 1 :
м 2 = м 1 (В 2 /В 1 ) (М 2 /М 1 )
6) Присвоить значения и решить:
Контейнер А (азот): V 1 = 4,4 В 2 , M 1 = 28,0 г/моль
Контейнер B (аргон): V 2 = V 2 , M 2 = 40,0 г/мольМасса Ar в контейнере B = (56,2 г) (V 2 /4,4V 2 ) (40,0/28,0) = 18,2 г (до 3-значной фиг.
)
7) Комментарий: я мог бы присвоить V 2 произвольный объем 1, сделав значение V 1 равным 4,4. Я мог бы сделать это, поскольку я знаю, что объем A (то есть V 1 ) в 4,4 раза больше объема B (то есть V 2 ).
Пятнадцать примеров
Проблемы №1-10
Только примеры и проблемы
Вернуться в меню KMT & Gas Laws
Давление в баллоне с гелием изначально составляет 30 атмосфер. После того, как было надуто много воздушных шаров, давление упало до 6 атм. Какая часть исходного газа осталась в баллоне?
- Course
- NCERT
- Class 12
- Class 11
- Class 10
- Class 9
- Class 8
- Class 7
- Class 6
- IIT JEE
- NCERT
- Exam
- JEE MAINS
- JEE ADVANCED
- X BOARDS
- XII BOARDS
- NEET
- Neet Предыдущий год (по годам)
- Физика Предыдущий год
- Химия0508
- Биология предыдущего года
- NEET ALL Образцы документов
- Образцы.
 Класс 9
Класс 9 - Класс 8
- Класс 7
- Класс 6
- Экзаменационный уголок
- Онлайн-класс
- Quiz
- Ask Doubt on Whatsapp
- Search Doubtnut
- English Dictionary
- Toppers Talk
- Blog
- About Us
- Career
- Download
- Получить приложение
Вопрос
Обновлено: 20.07.2020
ФИЗИКА ГАЛАКТИКА – АШИШ АРОРА-Кинетическая теория газов и газовые законы &hNP Численные задачи для подготовки ИПЧ9 НСЭП, ИО(3) и его необходимо надуть до давления 0,10 атм. Если используются газовые баллоны с гелием объемом 50 л при давлении 100 атм, сколько потребуется баллонов? Предположим, что температура постоянна.
25
- 2
02:57
В баллоне находится кислород при давлении 28 атм и температуре 300 К.
 Найдена масса кислорода газа, давление 7 атм и температура 200 К. что масса газа была использована?
Найдена масса кислорода газа, давление 7 атм и температура 200 К. что масса газа была использована?121607788
03:30
Сферический воздушный шар диаметром 21 см должен быть наполнен газообразным водородом при НТД из баллона с газом h3 при давлении 20 атм и температуре 27°C. Если баллон вмещает 2,82 л воды, сколько шаров можно наполнить водородом из баллона?
160818982
06:26
Требуется удвоить давление газообразного гелия, содержащегося в стальном баллоне, путем нагревания. Если начальная температура гелия 27°С, то температура, до которой его следует нагреть, равна – 9°С.0005
209197226
03:17
Давление 6 молей газообразного азота в баллоне составляет 30 атм при 30°C. Внезапно газ выходит из баллона из-за утечки. Если атмосферное давление и температура 1 атм и 30°С, то рассчитайте работу, совершенную газом. Предположим, что газ ведет себя идеально.
234814435
06:33
Баллон с газом H_(2) объемом 10,0 л соединен с вакуумированным баллоном объемом 290,0 л.
 Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне? 9@C при том же давлении. Доля исходного газа, оставшаяся в колбе, равна
Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне? 9@C при том же давлении. Доля исходного газа, оставшаяся в колбе, равна6378
02:41
Метеозонд надут гелием. Баллон имеет объем 100 м3 и его необходимо надуть до давления 0,10 атм. Если используются газовые баллоны с гелием объемом 50 л при давлении 100 атм, сколько потребуется баллонов? Предположим, что температура постоянна.
642605170
02:27
В 10-литровом баллоне находится гелий при 8 атм и 32∘C. Сколько баллонов по 2 л каждый при 2 атм и 32°С можно наполнить газом из баллона? 9@C, какое давление газа в баллоне?
643652810
02:27
Внутренний объем стального цилиндра составлял 25 литров и был заполнен газообразным водородом при давлении 30 атмосфер. Какой объем займет газообразный водород, если его наполнить в баллоне при атмосферном давлении 1,25 атм. давление. При той же температуре?
643959190
02:21
Баллон с газом h3 объемом 10,0 л соединен с вакуумированным баллоном объемом 290,0 л.
 Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне?
Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне?644659894
01:28
Газовый баллон выдерживает давление 15 атм. Давление в баллоне измерено 12 атм при 27°С. До какого предела температуры баллон не лопнет?
644811490
Текстовое решение
Реклама
Физика Галактика-Ашишская арора-конетическая теория газов и газовых законов-нерешенные численные проблемы
. Поднимитесь от Т(1) до Т(2). Сколько…
03:24
Когда колбу воздушного термометра постоянного объема погружают в лед,…
Текст Решение
Первоначальное давление в гелиевом баллоне составляет 30 атмосфер. Назад…
02:30
Пучок частиц массой m(0) и скоростью v направлен вдоль …
05:52
Цилиндр длиной 42см разделен на камеры одинакового объема и…
03:40
Два одинаковых сосуда соединены трубкой с клапаном, который.



 д. То есть обеспечить наличие гарантированно чистого газа в баллоне (что, например, является ключевым моментом при сварке аргоном).
д. То есть обеспечить наличие гарантированно чистого газа в баллоне (что, например, является ключевым моментом при сварке аргоном).
 ст./760 мм рт.ст. атм -1 ) (5,25 л) = (n) (0,08206 л атм моль -1 К -1 ) (296 К)
ст./760 мм рт.ст. атм -1 ) (5,25 л) = (n) (0,08206 л атм моль -1 К -1 ) (296 К)
 )
) Класс 9
Класс 9 Найдена масса кислорода газа, давление 7 атм и температура 200 К. что масса газа была использована?
Найдена масса кислорода газа, давление 7 атм и температура 200 К. что масса газа была использована? Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне? 9@C при том же давлении. Доля исходного газа, оставшаяся в колбе, равна
Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне? 9@C при том же давлении. Доля исходного газа, оставшаяся в колбе, равна Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне?
Если конечное давление равно 700 мм рт. ст., каким должно быть первоначальное давление газа в баллоне?