Диаграмма состояния системы железо углерод: Диаграмма железо-углерод | ООО КВАДРО
alexxlab | 01.12.1995 | 0 | Разное
Диаграмма состояния системы железо – углерод (Fe-C) :: Диаграммы сплавов
Начало изучения диаграммы состояния системы железо – углерод связано с открытием критических точек в стали Д. К. Черновым в 1868 г.
На рис. приведена полная диаграмма состояния системы
(стабильная система железо-углерод Fe—Сгр и метастабильная система железо – цементит Fe—FeC).
Метастабильная система Fe—Fe3C. Перитектическое превращение δ+ж↔γ протекает при 1494±2°С.
Предельная концентрация углерода в δ-фазе (точка Н) отвечает 0,1 % (по массе), или 0,46% (ат.).
Для точки A приняты значения 0,16% (по массе), или 0,74% (ат.), для точки В — значения 0,51% (по массе), или 2,33% (ат.). По данным термического анализа , линия ликвидус δ-фазы АВ — почти прямая, точке В соответствует 2,47% (ат.), предельная растворимость углерода в δ-Feсоставляет 0,5 % (эт.). Температура перитектической горизонтали равна 1496±2°С, точке 1 отвечает 0,18 % (но массе), или 0,83 % (эт. ).
).
Кривая ликвидус аустенита ВС, установленная по данным Руэра, Хондо, Эдкока, Умино и др.
Предельная растворимость углерода в γ-Fe при 1147°С составляет 2,14% (по массе), или 9,2% (ат.) ; при 1150°С 2,02% (по массе), или 8,7 % (ат.).
Кривая ликвидус цементита CD экспериментально не фиксируется. Первичный цементит выделяется только при закалке расплавов, содержащих до 5,5 % (по массе) С, а при нагреве белых заэвтектических чугунов цементит разлагается до плавления (Fe3C->Fe+Crp) . По расчетным данным, виртуальная Температура плавления цементита оценивается равной 1200—1450 °С .
Возможно, цементит испытывает инконгруэнтное разложение при 1250—1300° С.
В высокоуглеродистых сплавах, содержащих более 6,7 % (по массе) С после закалки из жидкого состояния в медную изложницу и ледяную воду наблюдали только Fe3C; других карбидов не обнаружено . Таким образом, метастабильная система при нормальном давлении ограничена цементитом. При повышении давления стабилизируются высшие карбиды Fe7C3, Fe2C и Салм, однако при давлении 0,1 МПа выделение карбидов FeхC (Fe2C) наблюдали лишь при низкотемпературном отпуске закаленной стали.
При повышении давления стабилизируются высшие карбиды Fe7C3, Fe2C и Салм, однако при давлении 0,1 МПа выделение карбидов FeхC (Fe2C) наблюдали лишь при низкотемпературном отпуске закаленной стали.
Температура эвтектической горизонтали ECF принята равной 1147°С, эвтектике (точке С) соответствует 4,30%
(по массе), или 17,28 % (ат.) С .
Превращение у↔а (A3, кривая GS), исследованное многими авторами, также подтверждено последующими работами.
Эвтектоидная точка, находится при 723 °С и 0,76 % (по массе), или 3,44% (ат.). растворимость цементита в α-Fe(кривая PQ) очень мала и составляет 0,02% (по массе), или 0,095 % (ат.) растворимость цементита в a-Feпри 723 °С равна 0,025 % (по массе).
Кристаллическая структура. Феррит имеет о. ц. к. структуру a-Fe. Период решетки a-Feравен 0,2862 им при 20 °С и линейно возрастает до 0,2899 нм при 910 °С . При 769 °С (точка Кюри) ферромагнитное a-Feпереходит в «немагнитное α-Fe» (точнее, в упорядоченное антиферромагнитное β-Fe) . Вследствие малой растворимости углерода в a-Fe[0,02 % (по массе)] период решетки Тk-феррита практически такие же, как и чистого a-Fe. Атомы углерода в феррите занимают преимущественно октапоры. Выше 1392 °С γ-Fe превращается в парамагнитную δ-фазу, существующую при 1392—1536 °С. Период решетки о. ц. к. δ-Fe равен 0,2925 нм при 1392 °С и линейно растет до 0,2935 нм при 1536 °С . Температурная зависимость периода решетки для α-(β-) и γ-Fe различны. Период решетки δ-феррита с повышением температуры увеличивается сильнее, чем α (β)-фазы и, по-видимому, растет с увеличением содержания углерода.
Вследствие малой растворимости углерода в a-Fe[0,02 % (по массе)] период решетки Тk-феррита практически такие же, как и чистого a-Fe. Атомы углерода в феррите занимают преимущественно октапоры. Выше 1392 °С γ-Fe превращается в парамагнитную δ-фазу, существующую при 1392—1536 °С. Период решетки о. ц. к. δ-Fe равен 0,2925 нм при 1392 °С и линейно растет до 0,2935 нм при 1536 °С . Температурная зависимость периода решетки для α-(β-) и γ-Fe различны. Период решетки δ-феррита с повышением температуры увеличивается сильнее, чем α (β)-фазы и, по-видимому, растет с увеличением содержания углерода.
Аустенит имеет г. ц. к. структуру γ-Fe. Период решетки γ-Fe линейно возрастает от 0,3637 нм при 911 °С до 0,368 нм при 1390 °С . углерод растворяется в γ-Fe в виде С4+ и занимает октапоры, образуя твердые растворы внедрения. С увеличением содержания углерода в аустените период решетки γ-фазы увеличивается.
Цементит Fe3C имеет ромбическую структуру .Периоды решетки: а=0,45244±0,0005 нм, b = 0,50885±0,0005 нм, с=0,67431± ±0,0005 нм; Температура перехода цементита из ферромагнитного в парамагнитное состояние (Тс) равна 215°С .
Карбид Fe7C3 получен только при высоких давлениях. Он имеет гексагональную структуру типа Сr7С3.
Периоды решетки а=0,6882 нм, с= 0,4540 нм. Установлено существование метастабильного карбида Fe2C
(ε-карбид), выделяющегося при отпуске стали. При 150—200°С из закаленной стали выделяется ε-карбид с гексагональной решеткой, имеющей периоды а=0,627 нм, с=0,214 нм. Высшие карбиды весьма неустойчивы и при построении диаграммы состояния при нормальных условиях не учитываются.
Диаграмма состояния системы железо – углерод
Металлические сплавы — это сложные по составу вещества на основе металлов, сохраняющие их основные свойства: высокую электро — и теплопроводность, литейные свойства, ковкость и др. Сплав может быть в жидком и твердом состоянии. В жидком состоянии существует только одна жидкая фаза, а в твердом у сплавов может быть несколько фаз в виде твердых растворов, химических соединений и механических смесей.
Твердые растворы состоят из двух и более компонентов, в которых атомы растворимого компонента располагаются в кристаллической решетке основного компонента, замещая его атомы, либо внедрясь в кристаллическую решетку.
Химические соединения могут быть в виде металлов с неметаллами (Fe3C) или металлов с металлами (CuAl2, CuNi). Они обладают конкретными физико — механическими свойствами. Например, цементит (Fe3C) имеет высокую твердость, повышенную хрупкость и низкую электропроводность.
Механические смеси состоят из нескольких компонентов, которые при затвердевании (кристаллизации) не взаимодействуют друг с другом. Каждая из фаз сохраняет свою кристаллическую решетку. Например, у сталей могут одновременно быть смеси феррита и аустенита, или перлита и цементита. Диаграммы состояния строятся на основе кривых нагрева и охлаждения. Рассмотрим сплав (рис. 1.25) медь- никель (Cu — Ni). Атомы Cu и Ni могут соединяться в любых пропорциях (0…100%), образуя твердый раствор, при этом атомы Ni могут замещать в кристаллической решетке Cu все атомы. По горизонтальной оси откладывается содержание компонентов в твердом растворе, а по вертикальной- температура. Точка 1083 °C показывает температуру плавления меди, а точка 1452 °C –никеля. Нижняя линия (солидус) –это граница твердого раствора. Ниже ее оба металла и смесь находятся в твердом состоянии (в кристаллическом виде). Выше верхней линии (ликвидуса) располагается область жидкого раствора обоих этих металлов и сплавов. В «чечевице», очерченной нижней и верхней линиями, лежит область смеси кристаллов и более тугоплавкового металла с капельками более легкоплавкого.
По горизонтальной оси откладывается содержание компонентов в твердом растворе, а по вертикальной- температура. Точка 1083 °C показывает температуру плавления меди, а точка 1452 °C –никеля. Нижняя линия (солидус) –это граница твердого раствора. Ниже ее оба металла и смесь находятся в твердом состоянии (в кристаллическом виде). Выше верхней линии (ликвидуса) располагается область жидкого раствора обоих этих металлов и сплавов. В «чечевице», очерченной нижней и верхней линиями, лежит область смеси кристаллов и более тугоплавкового металла с капельками более легкоплавкого.
В правой части рисунка 1.25 находятся кривые нагрева и охлаждения смеси (в данном случае представлена 50% смесь) этих металлов. На основании таких кривых, полученных для различных смесей в интервале 0…100% и построена диаграмма состояний. На кривых нагрева и охлаждения видны горизонтальные линии: при разрушении кристаллов тепло подводится, но повышения температуры нет, т.к. это тепло расходуется на разрушение кристаллов; при кристаллизации, наоборот, выделяется тепло, поэтому температура сплава по времени не снижается.
Для компонентов (пример для смеси свинец –сурьма), неограниченно растворимых в жидком состоянии и совершенно нерастворимых в твердом состоянии, с образованием механической смеси (эвтектики), диаграмма представлена на рис. 1.26.
На первом участке диаграммы ниже линии температур 327…243 °C кристаллизуется свинец, а далее на участке температур 243…631 °C — сурьма. В точке С кристаллизуется свинец и сурьма, и жидкость без промежуточных фаз переходит в твердое состояние. Эта смесь называется эвтектикой. До нее будет доэвтектический сплав (Рb + Э), а после заэвтектический сплав (Sb + Э). В точке С самая низкая температура плавления (243 °C) сплава.
Имеется связь характера диаграмм состояний со свойствами (электропроводность, твердость, прочность и т. д.). Так для первой группы сплавов –твердых растворов, с ростом концентрации компонента (например, Ni на рис. 1.25) механические свойства (твердость., прочность) увеличиваются, а для второй группы (рис. 1.26) имеется точка экстремума, т. е. сначала механические характеристики повышаются, а далее снижаются.
1.26) имеется точка экстремума, т. е. сначала механические характеристики повышаются, а далее снижаются.
Структурные составляющие железо — углеродистых сплавов представлены в виде твердых растворов (рис. 1. 27) (феррит и аустенит), химического соединения (цементит) и механических смесей (перлит, ледобурит.,…).
Феррит это твердый раствор внедрение углерода в a—железо. Он очень мягкий и пластичный, хорошо проводит тепло и электричество, сильно магнитен. Углерода в нем очень мало (около 0,002%). В микроструктурах металла цементит имеет белый цвет. Углерод замещает центральный атом объемно — центрированной кубической решетки (a — железо) или вакансии кристаллической решетки.
Фазовые превращения (рис. 1.28) происходят по мере изменения температуры. При нагреве до 768 °С a — железо теряет свои магнитные свойства, но кристаллическая решетка не меняется.
При 898 °С – эта решетка превращается в гранецентрированную кубическую решетку, называемую g — железом. Аустенит это твердый раствор внедрения углерода в y –железо. Он не магнитен, сравнительно мягкий, углерода содержится в нем максимально до 2%.
Аустенит это твердый раствор внедрения углерода в y –железо. Он не магнитен, сравнительно мягкий, углерода содержится в нем максимально до 2%.
При 1401 °С g — железо превращается в s — железо с объемно — центрированной решеткой, существующей до температуры плавления железа (1539 °С).
Цементит — это химическое соединение (карбид железа Fe3C), содержащее 6,67% углерода и имеющее высокую твердость и хрупкость, плохо проводящее электрический ток и тепло. Цементная сетка является светлой на микроструктурах сплава. Цементит является неустойчивым химическим соединением и при высоких температурах происходит его распад на железо и углерод:
Fe3 C ® Fe + C.
Ледебурит—это механическая смесь (эвтектика) , состоящая из аустенита и цементита и содержащая 4,3% углерода, образуется при температурах ниже 1147 °С, имеет высокую твердость и хрупкость.
Перлит – механическая смесь (эвтектоид), состоящая из тонких пластинок или зерен цементита и феррита, образуется в результате распада аустенита при температурах ниже 727 °С. Углерода в перлите 0,8%.
Углерода в перлите 0,8%.
На основе кривых (рис. 1.28) охлаждения и нагрева сплавов Fe-C строится диаграмма состояний (рис.1.29) системы железо-углерод. На ней имеются линии: ликвидуса –АСД ; солидуса — AECF. Выше линии ликвидуса металл находится в жидком состоянии, а ниже линии солидуса- в твердом (кристаллическом) состоянии. Остальные линии отражают превращения в сплавах, происходящие после затвердевания. Ниже линии солидуса, при дальнейшем снижении температуры происходят структурные изменения, т.е. перекристаллизация уже в твердом состоянии (вторичная кристаллизация).
В точке S аустенит распадается на твердую однородную смесь кристаллов феррита и цемента — перлит. Сплав в точке S — эвтектоидный, при содержании углерода меньше 0,8% доэвтектоидный, а более 0,8% — заэвтектоидный. После 0,8% происходит распад аустенита с выпаданием из него вторичного цементита.
Точка А –это температура плавления чистого железа Fe, а точка Д — температура плавления цементита Fe3C.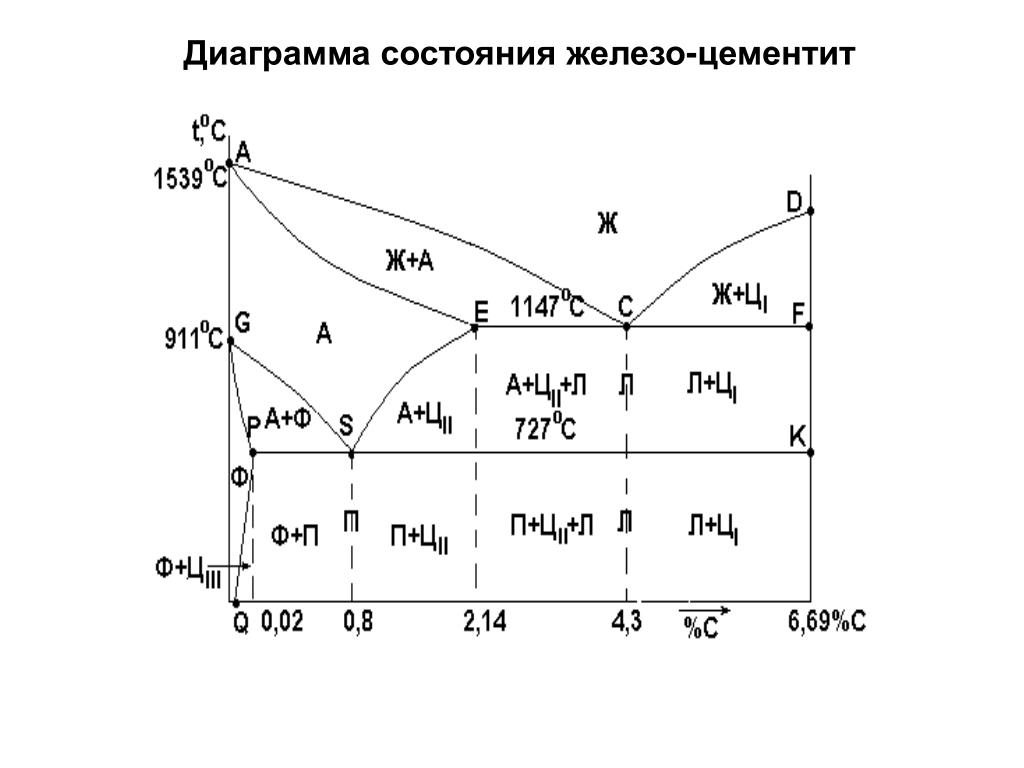 Точка Е (2,14% С) делит сплав на две группы: стали и чугуны. Левее точки Е будут стали, а правее- чугуны.
Точка Е (2,14% С) делит сплав на две группы: стали и чугуны. Левее точки Е будут стали, а правее- чугуны.
Температура плавления стали с увеличением количества углерода С в ней снижается, а чугунов после 4,3% — увеличивается.
Сразу после затвердевания структура сталей состоит из аустенита, а чугунов из смесей: аустенит + ледебурит ; цементит + ледебурит.
При охлаждении доэвтектоидных сталей (С < 0,8%, т.е. левее точки S) аустенит распадается, из него выделяется феррит.
В эвтектоидной точке С будет механическая смесь кристаллов аустенита и цементита — ледебурит. Правее точки С выделяется цементит. Сплавы чугунов левее точки С — доэвтектоидные, правее — заэвтектоидные.
Белые чугуны (белый оттенок на изломе). состоят из ледебурита и цементита Они твердые, хрупкие, трудно механически обрабатываются. Используются для передела в сталь.
Если углерод в сплаве находится в свободном состоянии, т.е. в виде графита, то это серые чугуны.
Диаграмма железо — углерод имеет большое практическое значение для инженеров. По ней можно определить температуру плавления и затвердевания сталей и чугунов, интервалы температур при обработке сталей давлением (ковка, штамповка,…) и термической обработке (закалка, отпуск,…), т.е.. она нужна металлургу, кузнецу и термисту.
Гиссерай Лексикон
ist Weltweit das umfangreichste Werk, das auf neuestem Technologiesstandard basiert und in English und Deutscher Sprache verfügbar ist! В бессрочном онлайн-лексиконе вы найдете полный набор технических и промышленных технологий! Может быть студентом или инженером, специалистом или практиком, профессором университета или инвестором. Hier finden Sie был Siesuchen!
FARO® Vantage Lasertracker – Schnelle, genaue Messungen für großformatige Anwendungen
Unterstützung für die E-Mobilität: KUKA Liefert 36 Roboter and ZF – Automatisierung for eine Eine Mobilität: Bei der ZF Gusstechnologie GmbH…
Neues Hammerüberwachungssystem MH5 für bis zu 8 Entkern-Hämmer zur Zustandsüberwachung von Entkern-Hämmern.
Simpson Technologies schließt sich der Norican-Gruppe an – Erwerb des Experten für Sandaufbereitung ergänzt globales Angebot.
Dynamik, Prozesssicherheit und Effizienz sind die wichtigsten Erfolgskriterien für das neuentwickelte Fill Bearbeitungszentrum SYNCROMILL C21-63/1500….
Д-р Зено Штауб, генеральный директор Vontobel Holding AG, eines in der Schweiz börsenkotierten, weltweit tätigen Investmenthauses, das…Das TAG-System versieht jedes Gussteil mit einer eindeutigen ID, die die Bediener einscannen können, um das Gussteil einer bestimmten Fehlerursache…
“Industrieller Herbst” in voller Blüte – Die Messe Kielce METAL, die Fachmesse für die Gießereiindustrie, und ihre Schwesterveranstaltungen, die in…
SAG am Weg auf den Weltmarkt mit LKW-Kryotanksystem für flussigen Wasserstoff – Derzeit интенсивный тест Testeinsatz bei OEM – wichtiger Schritt in Richtung..

Hammerstation HM-1 – Mit der Hammerstation HM-1 lassen sich Sandkerne von Gussteilen einfach und kostengünstig brechen.
ASK Chemicals führt ECOCURE™ BLUE PRO ein – ASK Chemicals, einer der führenden Anbieter von Gießereichemikalien, Bringt den Cold-Box-Binder ECOCURETM…
Neues Projekt geht an den Start – Foundry Goes Green – Die Gießereibranche dominiert den Veranstaltungskalender von Targi Kielce in der Zeit vom 20….
Вайтерлезен
Формирование микроструктуры сталей при затвердевании
Стали затвердевают в виде твердых растворов. Структура гранецентрированной кубической решетки с внедренным атомом углерода называется аустенитом.
- 1 Введение. Метастабильная система
Введение
В принципе, стали представляют собой бинарные системы, состоящие из основного элемента железа и легирующего элемента углерода с максимальным содержанием 2 % (выше 2 % углерода сплав железа с углеродом называется 9).0127 чугун !). Углерод обеспечивает необходимую прочность и твердость, потому что само по себе железо было бы слишком мягким в качестве строительного материала. Чтобы иметь возможность производить стали в соответствии с этими различными требованиями (высокая твердость или высокая прочность, или сочетание того и другого), требуется более глубокое понимание системы сплавов железо/углерод.
Сталь – это сплав железа и углерода! При содержании углерода более 2 % говорят о чугуне!
В отличие от ранее рассмотренных бинарных систем фазовое превращение происходит не только при затвердевании. Железо также проявляет аллотропию (полиморфизм), т. е. в зависимости от температуры железо существует в различных структурах решетки. В твердом состоянии они вызывают дальнейшие фазовые превращения. Поэтому фазовая диаграмма системы железо/углеродный сплав несколько сложнее.
В твердом состоянии они вызывают дальнейшие фазовые превращения. Поэтому фазовая диаграмма системы железо/углеродный сплав несколько сложнее.
Чтобы понять микроструктурные процессы внутри стали, имеет смысл сначала более подробно рассмотреть формирование микроструктуры чистого железа. По этой причине кривая охлаждения железа обсуждается более подробно в следующем разделе.
Формирование микроструктуры мягкого железа
Далее кривая охлаждения чистого железа будет рассмотрена более подробно. Поскольку чистое железо относительно мягкое в затвердевшем состоянии, его также называют мягким железом 9.0128 .
Кривая охлаждения чистого железа (Fe) имеет ряд термических остановок, при которых в микроструктуре происходят различные процессы. Первая термическая остановка происходит при температуре затвердевания 1536 °С. В этот момент расплав кристаллизуется в объемно-центрированной кубической решетке (ОЦК). В этом состоянии железо также называют \(\дельта\)-железом (\(\дельта\)-Fe). Обратите внимание, что вся микроструктура \(\дельта\)-железа уже полностью затвердела. Таким образом, все дальнейшие фазовые превращения в конечном итоге происходят в уже застывшем состоянии!
Обратите внимание, что вся микроструктура \(\дельта\)-железа уже полностью затвердела. Таким образом, все дальнейшие фазовые превращения в конечном итоге происходят в уже застывшем состоянии!
При температуре 1392 °C объемно-центрированное кубическое \(\дельта\)-железо переходит в гранецентрированную кубическую структуру (ГЦК) при постоянной температуре. В этой модификации решетки железо также называют \(\gamma\)-железом. Поскольку атомная структура и, следовательно, энергия связи изменяются во время преобразования решетки, это также связано с преобразованием энергии. Следовательно, структура решетки изменяется при постоянной температуре (термическая остановка)!
При температуре 911 °C окончательно происходит дальнейшее превращение решетки. При этой температуре гранецентрированное кубическое железо снова превращается в объемноцентрированную кубическую структуру. В этой форме железо также называют (\бета\)-железом.
Последняя термическая остановка происходит при температуре 769 °C. Однако это не связано с преобразованием решетки! Причина термической остановки — квантово-механический эффект, который отвечает за то, что железо магнитится ниже этой температуры, а не выше! Эту температуру также называют Температура Кюри (кроме железа, только элементы кобальт и никель являются ферромагнитными при комнатной температуре). Магнитное состояние железа с его объемно-центрированной кубической структурой решетки также называют (\альфа\)-железом.
Однако это не связано с преобразованием решетки! Причина термической остановки — квантово-механический эффект, который отвечает за то, что железо магнитится ниже этой температуры, а не выше! Эту температуру также называют Температура Кюри (кроме железа, только элементы кобальт и никель являются ферромагнитными при комнатной температуре). Магнитное состояние железа с его объемно-центрированной кубической структурой решетки также называют (\альфа\)-железом.
Температура Кюри — это температура, при которой ферромагнитный материал теряет свои магнитные свойства!
На приведенной ниже микрофотографии показано мягкое железо (\(\альфа\)-железо) в почти свободном от углерода состоянии. Видны зерна железа (белые области) и включения силиката (темные пятна).
Рисунок: Микрофотография мягкого железаТеперь, когда объяснены микроструктурные превращения чистого железа, в следующей статье более подробно описаны фазовые превращения в присутствии углерода (стали).
Формирование микроструктуры стали
В предыдущем разделе фазовые превращения чистого железа были рассмотрены более подробно.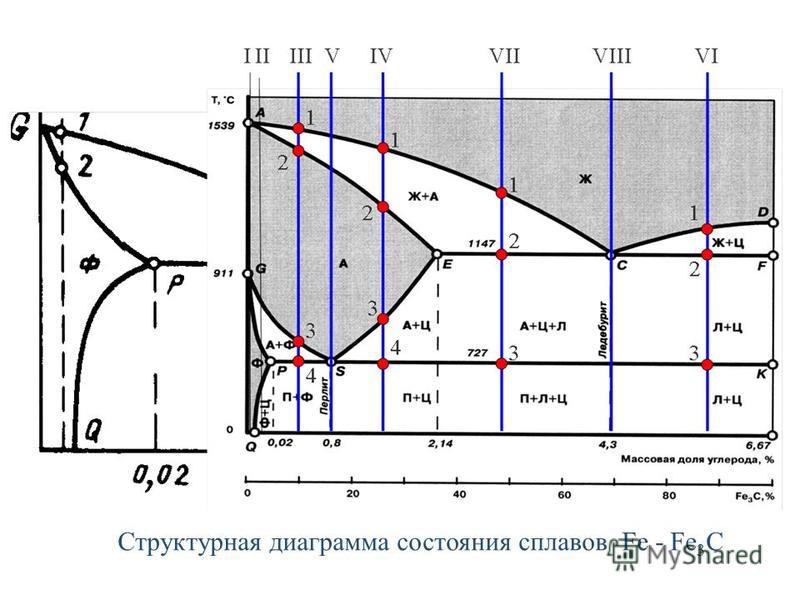 Однако в дополнение к железу стали также содержат углерод. Это приводит к сдвигу описанных фазовых превращений железа! Влияние углерода на фазовые переходы лучше всего поясняет соответствующая фазовая диаграмма (диаграмма состояний).
Однако в дополнение к железу стали также содержат углерод. Это приводит к сдвигу описанных фазовых превращений железа! Влияние углерода на фазовые переходы лучше всего поясняет соответствующая фазовая диаграмма (диаграмма состояний).
Диаграмма состояния системы железо-углерод также называется фазовой диаграммой железо-углерод . Создание фазовой диаграммы на основе выбранных кривых охлаждения из-за ее сложности обсуждаться не будет. Кроме того, диаграмма железо-углерод в следующих разделах изначально рассматривается только до содержания углерода около 2%, поскольку только этот диапазон относится к сталям. Поэтому эта область на диаграмме железо-углерод также называется частью 9 из стали .0128 . Более высокие концентрации углерода обсуждаются более подробно в отдельных разделах.
Стальная часть – участок диаграммы состояния железо-углерод до содержания углерода 2%, относящийся к сталям!
Рисунок: Затвердевание стали Углерод первоначально влияет на затвердевание стали как твердый раствор. Следовательно, стальная часть фазовой диаграммы имеет типичную линзообразную двухфазную область во время затвердевания. Начало затвердевания описывается цифрой 9.0127 линия ликвидуса и окончание затвердевания по линии солидуса . Между этими линиями формируется микроструктура с соответственно более медленной скоростью охлаждения. Фазовая диаграмма показывает, что область затвердевания смещается в сторону более низких температур с увеличением содержания углерода.
Следовательно, стальная часть фазовой диаграммы имеет типичную линзообразную двухфазную область во время затвердевания. Начало затвердевания описывается цифрой 9.0127 линия ликвидуса и окончание затвердевания по линии солидуса . Между этими линиями формируется микроструктура с соответственно более медленной скоростью охлаждения. Фазовая диаграмма показывает, что область затвердевания смещается в сторону более низких температур с увеличением содержания углерода.
Углерод смещает диапазон затвердевания стали в сторону более низких температур!
Кроме того, даже небольшие количества углерода (> 0,1%) полностью подавляют объемно-центрированную кубическую фазу \(\дельта\)-железа. Затем сталь немедленно кристаллизуется в гранецентрированной кубической решеточной структуре \(\gamma\)-железа. Так как фаза \(\delta\) все равно не имеет технического значения, фазовая диаграмма очень часто представляется в упрощенном виде без этой фазовой области.
Стали ведут себя во время затвердевания как твердые растворы, в которых легирующий элемент углерод полностью растворим в железе основного материала.
Хорошая растворимость углерода обусловлена гранецентрированной кубической структурой решетки \(\gamma\)-железа. Относительно небольшие атомы углерода находят свое место в свободных центрах элементарных ячеек. В данном случае это твердый раствор внедрения, в котором атом углерода внедрен в междоузлиях решетки железа. Эта гранецентрированная кубическая структура решетки железа с внедренными в нее атомами углерода также называется аустенит .
Аустенит представляет собой гранецентрированную кубическую решетчатую структуру \(\гамма\)-железа с внедренными в нее атомами углерода (твердый раствор)!
Рисунок: Элементарная ячейка аустенита Соответственно двухфазная область между линией ликвидуса и линией солидуса содержит фазы расплава (L) и аустенита (A). В двухфазной области соответствующие концентрации углерода двух фаз можно определить, как обычно, проводя перпендикулярную линию на оси концентрации. Доли фаз снова определяют с помощью рычажное правило .
В целом при затвердевании сталей имеют место те же основные механизмы, что и при затвердевании твердых растворов. Однако это применимо только до тех пор, пока температуры достаточно высоки и, таким образом, железо находится в гранецентрированном кубическом состоянии. Только тогда углерод полностью растворяется в решетке железа и сплав можно рассматривать как твердый раствор.
Аустенитная фаза существует только при достаточно высоких температурах, пока железо присутствует в гранецентрированной кубической структуре!
Однако из-за своей аллотропии при понижении температуры железо в конце концов меняет свою гранецентрированную кубическую структуру и превращается в объемно-центрированное кубическое \(\альфа\)-железо. С понижением температуры связано дальнейшее фазовое превращение, которое происходит уже в уже затвердевшей микроструктуре! Более подробно это преобразование будет рассмотрено в следующем разделе.
Осаждение углерода (\(\гамма\)-\(\альфа\)-превращение)
Чистое железо изменяет свою гранецентрированную кубическую решеточную структуру на \(\гамма\)-железо при температуре ниже 911 ° C и переходит в объемно-центрированную кубическую решетку \(\alpha\)-железа. В принципе, такое превращение решетки происходит и в присутствии углерода, но при других температурах!
В принципе, такое превращение решетки происходит и в присутствии углерода, но при других температурах!
По мере увеличения содержания углерода это так называемое \(\гамма\)-\(\альфа\)-превращение смещается в сторону более низких температур. Кроме того, углерод заставляет это преобразование решетки происходить в диапазоне температур, а не при термической блокировке при постоянной температуре. Только при содержании углерода 0,8 % \(\альфа\)-железо снова образуется при постоянной температуре, так что ломаные начала и конца \(\гамма\)-\(\альфа\)-превращения совпадают на фазовой диаграмме.
Присутствие углерода сдвигает \(\гамма\)-\(\альфа\)-превращение в сторону более низких температур!
Рис.: Линии превращения на диаграмме состояния железо-углерод (стальная часть) В отличие от твердого раствора \(\gamma\)-железа элементарная ячейка объемно-центрированной кубической решетки \(\alpha\) -железо уже занято атомом железа в центре куба. Поэтому \(\альфа\)-железо почти не растворяет углерод. Максимальная растворимость при 723 °C составляет всего 0,02 % и даже падает ниже 0,001 % при комнатной температуре (точный предел растворимости показан на диаграмме зеленой цифрой 9).0127 линия сольвуса ). Поэтому для упрощения далее предполагается, что углерод не растворяется в решетке \(\альфа\)-железа.
Максимальная растворимость при 723 °C составляет всего 0,02 % и даже падает ниже 0,001 % при комнатной температуре (точный предел растворимости показан на диаграмме зеленой цифрой 9).0127 линия сольвуса ). Поэтому для упрощения далее предполагается, что углерод не растворяется в решетке \(\альфа\)-железа.
Таким образом, атом углерода, ранее внедренный в аустенит, «выдавливается» из структуры решетки при \(\гамма\)-\(\альфа\)-превращении. Таким образом, это почти безуглеродная решетка \(\альфа\)-железа. В отличие от углеродсодержащей объемно-центрированной кубической решетки \(\gamma\)-железа, которую назвали аустенитом, почти свободную от углерода объемно-центрированную кубическую решетку \(\alpha\)-железа также называют феррит .
Феррит представляет собой почти не содержащую углерода кубическую объемно-центрированную решетчатую структуру \(\альфа\)-железа!
Рисунок: Элементарная ячейка ферритаСтабильная система
Во время \(\гамма\)-\(\альфа\)-превращения углерод, который больше не растворяется в \(\альфа\)-железе, в принципе может осаждаться от решетки двумя способами. При медленном охлаждении и относительно высоком содержании углерода достаточное количество атомов углерода может собраться вместе, чтобы сформировать собственную гексагональную структуру решетки. В этой модификации решетки углерод также называют графит .
При медленном охлаждении и относительно высоком содержании углерода достаточное количество атомов углерода может собраться вместе, чтобы сформировать собственную гексагональную структуру решетки. В этой модификации решетки углерод также называют графит .
Такое осаждение графита не только благоприятствует относительно низкой скорости охлаждения, но также может быть усилено добавлением кремния. Осаждение углерода в виде графита также называют стабильной системой , поскольку углерод в этой форме больше не может распадаться и поэтому стабилен в термодинамическом смысле.
Микроструктура, затвердевшая по стабильной системе, в основном состоит из железа (Fe) и графита (C). Это относится, в частности, к чугуну!
Чугун обычно имеет относительно высокое содержание углерода (> 2 %) и поэтому является типичным представителем стабильной системы. Однако некоторые типы чугуна также затвердевают в соответствии с метастабильной системой, описанной ниже. Это относится, в частности, к сталям.
Это относится, в частности, к сталям.
Метастабильная система
Если затвердевшая микроструктура охлаждается не относительно медленно, а быстрее, и присутствует только небольшое количество углерода, атомы углерода больше не могут присоединяться к общей структуре решетки графита. В этом случае осаждающийся углерод соединяется с тремя атомами железа, образуя соединение карбида железа Fe 9.0237 3
C и образует ромбоэдрическую решетчатую структуру. Это промежуточное (интерметаллическое) соединение карбида железа также называют цементитом .Цементит представляет собой относительно твердое, но хрупкое интерметаллическое соединение, состоящее из трех атомов железа и одного атома углерода (Fe 3 C)!
Как следует из названия, цементит очень твердый и в значительной степени отвечает за повышение твердости стали! Осаждение цементита может быть достигнуто не только за счет более быстрого охлаждения, но и за счет специальных добавок, таких как марганец.

