Для чего используют карбид: что такое, зачем нужно, где купить, цена
alexxlab | 07.03.1985 | 0 | Разное
5 областей применения карбида вольфрама
В наши дни мы сильно зависим от переработанных товаров, чтобы уменьшить потенциальный ущерб окружающей среде. Некоторые металлы и сплавы, такие как карбид вольфрама, обладают качествами, которые делают их полезными для различных целей/применений. Вольфрам — это плотное металлическое вещество, которое можно использовать во всем, от обычных бытовых изделий до промышленного оборудования. Использование вольфрама безграничны. Уникальные свойства вольфрама делают его незаменимым редким металлом, естественным образом встречающимся на Земле.
Что такое карбид вольфрама?
Карбид вольфрама это вещество, которое образуется при соединении металлического вольфрама с атомами углерода. Это химическое соединение, известное как WC, представляет собой серый порошок. Затем этот серый порошок можно спекать для получения желаемого продукта. Это прочный материал, часто используемый в промышленности, но возможности его применения безграничны. На самом деле карбид вольфрама настолько тверд, что его можно разрезать только алмазным инструментом. Карбид вольфрама особенно прочный, в большей степени, чем его другие металлические аналоги, такие как золото, серебро или платина.
На самом деле карбид вольфрама настолько тверд, что его можно разрезать только алмазным инструментом. Карбид вольфрама особенно прочный, в большей степени, чем его другие металлические аналоги, такие как золото, серебро или платина.
Каковы свойства карбида вольфрама?
Свойства карбида вольфрама весьма уникальны. Высокая прочность, плотность и твердость — это свойства, которые отличают карбид вольфрама от других и делают его универсальным материалом для многих применений. Карбид вольфрама может выдерживать чрезвычайно высокие температуры, что делает его отличным материалом для использования в станочных и режущих инструментах и даже для печей, и может быть сформирован для проведения электричества или наоборот. Износостойкость и коррозионная стойкость относятся к другим свойства карбида вольфрама которые демонстрируют его универсальность и уникальность.
5 промышленных применений карбида вольфрама
Уникальные свойства карбида вольфрама и исключительные качества делают его востребованным материалом для самых разных применений. Ассортимент применение вольфрама и его значение не ограничивается только производственной и промышленной сферой, но также играет важную роль в медицинской сфере, мире моды и многих других.
Ассортимент применение вольфрама и его значение не ограничивается только производственной и промышленной сферой, но также играет важную роль в медицинской сфере, мире моды и многих других.
#1: Строительство
Строительство требует использования инструментов с высокой прочностью и ударной вязкостью, чтобы они могли выдерживать использование на материалах, из которых состоит большинство конструкций. В таких материалах, как цемент и асфальт, трудно проникнуть, для чего требуется особо прочное и прочное лезвие или сверло, например, из карбида вольфрама. Карбид вольфрама широко используется в строительстве. материалы, такие как пилы и сверла, потому что он практически не ломается.
# 2: Промышленные сплавы
Для создания электроники, строительных проектов, промышленных передач и даже авиационного оборудования сплавы образуются путем смешивания металлов с другими металлами или элементами. Эти сплавы имеют определенные свойства, такие как прочность или термостойкость, необходимые для каждого отдельного продукта и его использования. Сплавы, созданные из карбида вольфрама являются особенно популярным выбором для строительных материалов и инструментов. Около 17% всего карбида вольфрама используется для создания этих сплавов.
Сплавы, созданные из карбида вольфрама являются особенно популярным выбором для строительных материалов и инструментов. Около 17% всего карбида вольфрама используется для создания этих сплавов.
# 3: Мукомольная промышленность
Применение карбида вольфрама имеют далеко идущие последствия. Из-за его долговечности и прочности около 10% всего использования карбида вольфрама приходится на мукомольную промышленность. Карбид вольфрама, часто используемый для фрез и концевых фрез, легко формуется, оставаясь при этом прочным. Фрезерная промышленность требует таких материалов, как карбид вольфрама, потому что это отрасль, которая полагается на точность; созданный продукт, возможно, потребуется измельчить в порошок, измельчить или натереть на терке, а универсальность карбида вольфрама позволяет создавать невероятно точные фрезерные инструменты.
# 4: Ювелирные изделия
Еще одним новым и перспективным применением карбида вольфрама является ювелирная промышленность. Карбид вольфрама, если его хорошо обрезать, обработать и отполировать, может выглядеть так же потрясающе, как и любые другие украшения, которые вы обычно носите. Помимо того, что карбид вольфрама известен своей невероятной устойчивостью к царапинам выше среднего, он также является доступной альтернативой золотым или серебряным украшениям, за которые мы привыкли платить. Благодаря своей долговечности этот металл берет штурмом промышленность, уже широко используется для изготовления серег, ожерелий и колец.
Карбид вольфрама, если его хорошо обрезать, обработать и отполировать, может выглядеть так же потрясающе, как и любые другие украшения, которые вы обычно носите. Помимо того, что карбид вольфрама известен своей невероятной устойчивостью к царапинам выше среднего, он также является доступной альтернативой золотым или серебряным украшениям, за которые мы привыкли платить. Благодаря своей долговечности этот металл берет штурмом промышленность, уже широко используется для изготовления серег, ожерелий и колец.
# 5: Производство хирургических инструментов
Многие из применение карбида вольфрама которые возможны, все еще обнаруживаются, и среди этих новых применений – его использование в области медицины. Карбид вольфрама часто используется для создания хирургических инструментов, потому что он повышает их производительность, а также устойчив к коррозии. Это увеличивает долговечность и прочность хирургических инструментов. Свойства карбида вольфрама, как и его способность затачиваться при сохранении твердости, хорошо подходят для хирургической промышленности.![]()
Другие виды использования
Применение карбида вольфрама бесконечны. Он используется в спортивном оборудовании, таком как клюшки для гольфа, из-за его долговечности и прочности. Его можно использовать в музыкальных инструментах, таких как гитарные слайды. Еще один важный использование карбида вольфрама, с которым мы все наверняка сталкивались, — это кончик шариковой ручки. Карбид вольфрама также используется в электрических компонентах, особенно в лампочках, из-за его термостойкости. Другой применение карбида вольфрама для бронебойных боеприпасов, потому что это такой прочный и жесткий материал. Кроме того, еще один интересный и авангардный применение карбида вольфрама находится в космических спутниках из-за его устойчивости к экстремальным колебаниям температуры.
Заключение
Как мы можем ясно понять, большой или маленький, вольфрам и карбид вольфрама играют важную роль в нашей жизни и встречаются в каждой отрасли. Применение карбида вольфрама значительно меняют наше представление о продуктах и вторичной переработке в целом. Есть путь, ведущий прямо в будущее, и он вымощен карбид вольфрама. Если вы ищете универсальный и долговечный материал, не ищите дальше, потому что карбид вольфрама меняет мир с помощью одного сверла и одной клюшки для гольфа за раз.
Применение карбида вольфрама значительно меняют наше представление о продуктах и вторичной переработке в целом. Есть путь, ведущий прямо в будущее, и он вымощен карбид вольфрама. Если вы ищете универсальный и долговечный материал, не ищите дальше, потому что карбид вольфрама меняет мир с помощью одного сверла и одной клюшки для гольфа за раз.
Способы сварки металлов без использования электрической энергии
Если ваше детство прошло в восьмидесятых или девяностых, то вам наверняка известно слово карбид. Точнее словосочетание карбид кальция. Куски этого продукта, напоминающего камни, практически всегда появлялись у детей и подростков после того, как во двор или на аварийный объект, расположенный по соседству, приезжала ремонтная бригада, в составе которой был сварщик. Карбид кальция и сегодня применяется в сварочных процессах, которые почти без изменений используются уже более 100 лет.
XIX век – период экспериментов и многих технических изобретений. Именно это столетие стало прорывным и в развитии сварки – процесса соединения металлов на молекулярном уровне. Тогда началось практическое применение дуговой электросварки, которую впоследствии использовали даже в космосе. Параллельно велась работа и над развитием методов сварки металлов без использования электроэнергии. И нужно признать, что все эти исследования были не напрасны. Сегодня есть несколько десятков видов сварки, которые делятся на три больших класса:
Именно это столетие стало прорывным и в развитии сварки – процесса соединения металлов на молекулярном уровне. Тогда началось практическое применение дуговой электросварки, которую впоследствии использовали даже в космосе. Параллельно велась работа и над развитием методов сварки металлов без использования электроэнергии. И нужно признать, что все эти исследования были не напрасны. Сегодня есть несколько десятков видов сварки, которые делятся на три больших класса:
- сварка плавлением
- сварка давлением
- термомеханическая сварка
В каждом из этих классов существуют виды сварочного процесса без применения электрической дуги. Вероятно, наиболее известные из них – это газовая сварка, холодная сварка и сварка взрывом. У каждого из них есть своя история и особенности применения.
Газосварка
История развития газосварки с применением того самого карбида кальция имеет причудливые повороты и даже развороты. Первые эксперименты по изучению свойств смеси газов, которые при горении дают высокую температуру, начались еще в конце XVIII столетия. Термин «газовая сварка» появился в 1840-х. Его употребил французский изобретатель Эжен Панон Десбассейн де Ришемон (Eugène Panon Desbassayns de Richemont) в научной статье о сварке свинца.
Первые эксперименты по изучению свойств смеси газов, которые при горении дают высокую температуру, начались еще в конце XVIII столетия. Термин «газовая сварка» появился в 1840-х. Его употребил французский изобретатель Эжен Панон Десбассейн де Ришемон (Eugène Panon Desbassayns de Richemont) в научной статье о сварке свинца.
Этот способ соединения металлов активно изучал другой француз – Анри Луи Ле Шателье, который в 1895 году при сжигании смеси ацетилена и кислорода получил высокотемпературное пламя – более 3000°С. Результаты были, но процесс длительное время не получал массового распространения.
Газ ацетилен был открыт еще в первой половине позапрошлого века, а в 1863 году даже был искусственно синтезирован, но это были лабораторные опыты. Они не давали больших объемов для массового применения и низкой себестоимости. Лишь в 90-х гг. XIX века практически одновременно во Франции и США был разработан промышленный способ производства карбида кальция из известняка и угля. Этот продукт стал источником ацетилена, который получается путем смешивания воды и карбида кальция в специальных емкостях.
Этот продукт стал источником ацетилена, который получается путем смешивания воды и карбида кальция в специальных емкостях.
Но этого тоже было недостаточно. Еще были нужны специальные горелки, в которых ацетилен, смешиваясь с кислородом, давал бы высокую температуру горения газовой смеси и обеспечивали бы приемлемую технологию сварки металла. Такую конструкцию в 1903 году разработали и запатентовали инженеры Эдмон Фуше и Шарль Пикар.
Лишь после этого удалось ускорить распространение и расширить сферы применения газосварки. Это было непросто, ведь к тому моменту уже более 10 лет активно использовалась дуговая электросварка. Но приблизительно до середины 1930-х именно газовая сварка стала основным способом соединения металлов. Она была относительно дешева, проста и надежна. К тому же оборудование для кислорода и ацетилена было более компактным и мобильным в сравнении с генераторами тока для поддержания электрической дуги.
Но в 30-е годы ХХ века произошел технологический прорыв в электросварке: уменьшились размеры источников питания, они стали более мобильными, началась автоматизация этого процесса.
Однако этого не произошло. Научные исследования в этой сфере привели к тому, что процесс кардинально изменился. Кислородные горелки начали использовать не столько для сварки, сколько для резки металлов. Начался новый виток развития технологии. Появились научные институты и заводы-гиганты по производству специального оборудования – автогенов, которые используются для резки, сварки и наплавки металлов при помощи горения газов.
Сварка взрывом
Сварка взрывом – это один из относительно молодых способов соединения металлов. Применяется он для сварки металлов, которые обладают разными свойствами. Их комбинация позволяет получить уникальный материал – биметалл или плакированный металл. Одна сторона такой пластины может успешно противостоять коррозии, а вторая быть твердой или износостойкой.
Технология получила быстрое развитие и широкое распространение. Сегодня ее используют для получения биметаллов, которые применяются в различных сферах экономики. Иногда в таком процессе используется не два, а три и даже четыре вида металлов, из которых получается своеобразный «сэндвич». Если один из слоев гораздо тоньше другого, то такой процесс называется плакированием.
В общих чертах процесс сварки взрывом можно описать следующим образом. Два или более слоев металла располагают на небольшом расстоянии друг от друга под углом или параллельно. Не верхний плакирующий слой равномерно наносится взрывчатое вещество. После чего происходит контролируемый взрыв, который приводит к соединению слоев и появлению материала, обладающего свойствами двух металлов.
После чего происходит контролируемый взрыв, который приводит к соединению слоев и появлению материала, обладающего свойствами двух металлов.
Но на практике все не так просто, как в теории. Нужно соблюдать огромное количество сложных технологических требований: от угла и скорости детонации до обеспечения взрывобезопасности в помещениях, где применяется такой способ сварки.
На сегодняшний день существует до 300 комбинаций различных металлов, которые можно соединять таким способом. Биметаллы, полученные сваркой взрывом, повышают надежность оборудования, снижают себестоимость изделий. Ведь в таком случае удается сократить использование дорогих металлов, которые можно нанести на более дешевую основу.
Холодная сварка
Холодная сварка – это, вероятно, наиболее древний способ соединения металлов. Считается, что ее использовали еще в 8-9 вв. до нашей эры для производства изделий из самородков драгоценных металлов. В эпоху Поздней Бронзы люди обрабатывали каменными молотками пластичные металлы – золото, серебро, медь. И в процессе наши предки выяснили, что куски этих металлов прочно соединяются между собой даже без нагрева внешними источниками тепла. Фактически это и были первые попытки зарождения холодной сварки. Сначала ее использовали для увеличения размеров металлических изделий, затем – для производства украшений. Современная наука признала холодную сварку неотъемлемой частью материаловедения в 1940-х.
В эпоху Поздней Бронзы люди обрабатывали каменными молотками пластичные металлы – золото, серебро, медь. И в процессе наши предки выяснили, что куски этих металлов прочно соединяются между собой даже без нагрева внешними источниками тепла. Фактически это и были первые попытки зарождения холодной сварки. Сначала ее использовали для увеличения размеров металлических изделий, затем – для производства украшений. Современная наука признала холодную сварку неотъемлемой частью материаловедения в 1940-х.
Но использование этого способа ограничено пластичными металлами, которые можно крепко соединить трением, сжатием или ударом. Холодной сваркой соединяют серебро, алюминий, свинец, медь, цинк, никель и некоторые другие. Для этого нужны две чистые гладкие поверхности одного и того же металла.
Основное преимущество холодной сварки – это отсутствие сторонних примесей в сварном шве, которые практически неизбежны при электро- и газосварке. Поэтому ее активно используют в электронике и электротехнике, где важно применение чистых токопроводящих металлов – меди и алюминия. Одним из наиболее перспективных современных методов сварки металлов без нагрева являются нанотехнологии. Уже доказано, что соединение микро- и наночастиц металлов происходит даже без давления, а лишь за счет соприкосновения на несколько секунд.
Одним из наиболее перспективных современных методов сварки металлов без нагрева являются нанотехнологии. Уже доказано, что соединение микро- и наночастиц металлов происходит даже без давления, а лишь за счет соприкосновения на несколько секунд.
Но у термина «холодная сварка» есть еще одно значение, которое может ввести в заблуждение. Сегодня практически в любом магазине можно купить клеящий состав с таким же названием. Как правило, это двухкомпонентное вещество на основе эпоксидной смолы. С его помощью можно выполнить экстренные ремонтные работы: заклеить дыру, трещину или соединить разломавшуюся металлическую деталь. То есть решить проблемную ситуацию до приезда сварщика. А если это будет газосварщик, то у него можно будет попросить кусочек карбида кальция, чтобы вспомнить детство.
«Зеленое» использование карбида кальция
1649
Добавить в закладки
Химики-теоретики Санкт-Петербургского государственного
университета и Института органической химии РАН имени
Н. Д. Зелинского разработали новую стратегию использования
карбида кальция в синтезе органических соединений.
Исследователи предложили новый подход, основываясь
на результатах моделирования взаимодействия карбида кальция
с водой и диметилсульфоксидом. Научная
работа опубликована в журнале Королевского
химического общества Chemical Science.
Д. Зелинского разработали новую стратегию использования
карбида кальция в синтезе органических соединений.
Исследователи предложили новый подход, основываясь
на результатах моделирования взаимодействия карбида кальция
с водой и диметилсульфоксидом. Научная
работа опубликована в журнале Королевского
химического общества Chemical Science.
Карбид кальция известен человечеству уже более 150 лет — это твердое вещество желтовато-белого, бежевого или серого цвета, полученное в результате соединения кальция с углеродом. Сегодня карбид кальция используют для получения газообразного ацетилена, который широко применяется в промышленности — от производства уксусной кислоты и этилового спирта, до пластмассы, каучука и ракетных двигателей.
Углерод, необходимый для синтеза карбида кальция, добывается
не оптимальным с точки зрения концепции устойчивого
развития способом — в шахтах. В результате запасы
ископаемого ресурса истощаются (не устойчивый подход),
а над поверхностью земли растет количество углерода.
Исследование было поддержано грантом СПбГУ и проводилось в рамках проекта по актуальной химии карбида кальция, которым занимается лаборатория кластерного катализа Университета при участии исследователей из Института органической химии имени Н.Д. Зелинского РАН. Значительная часть моделирования была проведена с помощью мощностей РЦ «Вычислительный центр» Научного парка СПбГУ.
«Главным вызовом для человечества сегодня является создание
промышленных процессов нового поколения, позволяющих получать
важнейшие органические соединения и материалы в рамках
углерод-нейтрального подхода. Особое значение имеет замена
ископаемых ресурсов на возобновляемые
и решение, таким образом, экологических задач. Как было
показано в наших работах, органический синтез на базе
карбида кальция открывает новые возможности для реализации
углерод-нейтральных технологий. Причем ключевое значение имеет
понимание химических процессов трансформации карбидных частиц
в химических процессах в растворе», — отметил
руководитель лаборатории кластерного катализа СПбГУ, заведующий
лабораторией металлокомплексных и наноразмерных
катализаторов Института органической химии имени
Н.Д. Зелинского РАН, академик РАН Валентин Анаников.
Особое значение имеет замена
ископаемых ресурсов на возобновляемые
и решение, таким образом, экологических задач. Как было
показано в наших работах, органический синтез на базе
карбида кальция открывает новые возможности для реализации
углерод-нейтральных технологий. Причем ключевое значение имеет
понимание химических процессов трансформации карбидных частиц
в химических процессах в растворе», — отметил
руководитель лаборатории кластерного катализа СПбГУ, заведующий
лабораторией металлокомплексных и наноразмерных
катализаторов Института органической химии имени
Н.Д. Зелинского РАН, академик РАН Валентин Анаников.
Предложить новую стратегию использования вещества химики смогли
с помощью моделирования процессов, возникающих
на уровне атомов и молекул при взаимодействии карбида
кальция с водой и растворителем диметилсульфоксидом.
Карбид кальция — это, по сути, соль, включающая
отрицательно заряженные кислотные остатки ацетилена (так
называемые ацетиленид-анионы с зарядом -2)
и положительно заряженные ионы кальция. В работе
исследовались кислотно-основные свойства ацетиленид-анионов, воды
и некоторых других веществ в растворителе
диметилсульфоксиде. В таком растворителе можно наблюдать
необычную ситуацию: взаимодействие ацетиленид-анионов
и воды, называемое гидролизом, идет не полностью.
Образуются анионы с зарядом -1, которые потом могут вступать
в широкий спектр ключевых для органического синтеза
химических реакций.
В работе
исследовались кислотно-основные свойства ацетиленид-анионов, воды
и некоторых других веществ в растворителе
диметилсульфоксиде. В таком растворителе можно наблюдать
необычную ситуацию: взаимодействие ацетиленид-анионов
и воды, называемое гидролизом, идет не полностью.
Образуются анионы с зарядом -1, которые потом могут вступать
в широкий спектр ключевых для органического синтеза
химических реакций.
«После проведения анализа выяснилось, что вместо воды можно
использовать и другие протонирующие вещества для перевода
ацетиленида в раствор, а в качестве растворителя
для реакций с карбидом кальция можно искать альтернативные
диметилсульфоксиды, еще менее токсичные и “зеленые”
растворители. Таким образом, производство с участием карбида
кальция в перспективе может стать более “зеленым”
не только из-за потенциально более безопасных способов
добычи углерода, но и благодаря возможности карбида
кальция вступать в реакции с менее токсичными
растворителями», — рассказал соавтор статьи, ассистент
Института химии СПбГУ Михаил Полынский.
Отметим, что одним из авторов статьи стала выпускница СПбГУ Мария Сапова, начавшая работу над проектом во время обучения в магистратуре. «Задача меня сразу привлекла: идея комбинации различных расчетных методов открывает большие возможности для моделирования сложных процессов, как, например, процесс растворения в нашем случае. Эта работа помогла не просто расширить кругозор, а выйти за рамки задач по моделированию кристаллов, которыми я занималась, и почувствовать границы применимости различных методов расчетной химии. Думаю, что такие сложные многоступенчатые подходы в моделировании должны развиваться дальше: это позволит нам приблизиться к описанию реальных экспериментов», — отметила Мария Сапова.
Как уточнил Михаил Полынский, работа на данном этапе —
полностью теоретическая и заключалась в компьютерном
моделировании процесса получения ацетиленидов из карбида
кальция. «Для моделирования мы использовали так
называемые квантово-химические методы, борн-оппенгеймеровскую
молекулярную динамику. В результате такого моделирования
можно сделать короткое молекулярное кино, показывающее, как
выглядит движение атомов и молекул на очень коротких,
пикосекундных временных интервалах», — заключил Михаил
Полынский.
В результате такого моделирования
можно сделать короткое молекулярное кино, показывающее, как
выглядит движение атомов и молекул на очень коротких,
пикосекундных временных интервалах», — заключил Михаил
Полынский.
Фото – СПбГУ.
Автор Пресс-Служба СПБГУ
Разместила Наталия Малахова
СПбГУ карбид кальция карбидные частицы органические соединения
Источник: СПбГУ
Информация предоставлена Информационным агентством “Научная Россия”. Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
СМИ о выборах президента РАН 2022
18:50 / Экспертный разговор, Общее собрание РАН 2022
Академик Ю.С. Соломонов: развитие науки должно быть эволюционным
18:48 / Наука и общество, Общее собрание РАН 2022
Кандидат в президенты РАН академик Г.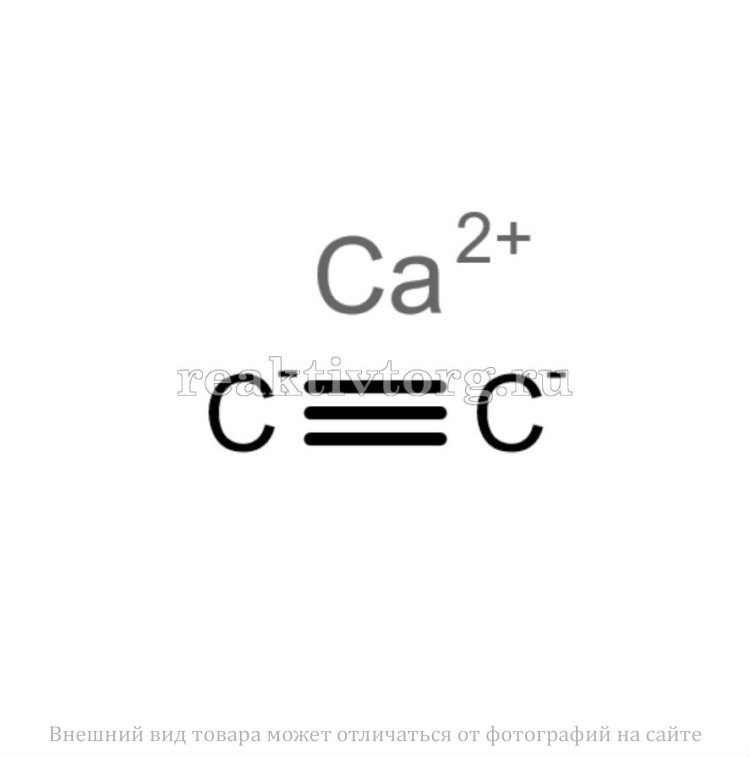 Я. Красников: РАН нужно возродить авторитет
Я. Красников: РАН нужно возродить авторитет
18:46 / Наука и общество, Общее собрание РАН 2022
Кандидат в президенты РАН академик Д.М. Маркович: наука должна быть востребована экономикой
18:45 / Наука и общество, Общее собрание РАН 2022
Академик РАН О.Л. Барбараш: развитие науки в консолидации усилий
18:35 / Наука и общество, Общее собрание РАН 2022
Академик РАН А.Г. Румянцев: Академия наук должна получить новый, государственный статус
18:30 / Наука и общество, Общее собрание РАН 2022
Академик Е. Федосов: российская наука способна совершить большой скачок
17:10 / Наука и общество, Экспертный разговор, Общее собрание РАН 2022
В Австралии найдено древнейшее окаменелое сердце
17:00 / Палеонтология
Общее собрание членов РАН: оглашение результатов голосования на выборах президента Российской академии наук. Прямая трансляция
17:00 / Наука и общество, Общее собрание РАН 2022
Академия должна повысить свою результативность, ― академик РАН Евгений Каблов
16:55 / Наука и общество, Общее собрание РАН 2022
Памяти великого ученого. Наука в глобальном мире. “Очевиднное – невероятное” эфир 10.05.2008
Наука в глобальном мире. “Очевиднное – невероятное” эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. “Очевидное – невероятное” эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
Карбид кальция
Подробности
- Подробности
- Опубликовано 27.05.2012 13:27
- Просмотров: 18213
Карбид кальция является химическим соединением кальция с углеродом и используется для получения ацетилена. По внешнему виду представляет собой твердое вещество темно-серого или коричневого цвета. Карбид кальция жадно поглощает воду. Он быстро разлагается на воздухе под влиянием содержащихся в нем паров воды. Карбид кальция получается сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определенных размеров. По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2X 8; 8X15; 15X25; 25X80.
Застывший карбид кальция дробится и сортируется на куски определенных размеров. По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2X 8; 8X15; 15X25; 25X80.
Технический карбид кальция содержит до 80% химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и др. Карбид кальция выпускается двух сортов: первого и второго.
Ацетилен получается при разложении карбида кальция водой, при этом в качестве отхода получается гашеная известь. Реакция разложения протекает быстро и сопровождается большим выделением тепла.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он дает при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе.
Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Ввиду того, что карбид кальция легко поглощает атмосферную влагу и при этом разлагается с выделением ацетилена, образующего с воздухом взрывоопасную смесь, его хранят и транспортируют в герметически закрытых барабанах. Стандартные карбидные барабаны изготовляются из кровельного железа толщиной не менее 0,5 мм, емкостью 100 и 130 кг. Вместо барабанов для перевозки и хранения карбида кальция применяют также бидоны, изготовленные из листовой малоуглеродистой стали, снабженные герметичной крышкой и резиновой прокладкой. Барабаны с карбидом кальция должны храниться в сухих хорошо проветриваемых помещениях. Нужно вскрывать карбидные барабаны не искрящим инструментом (например, зубилом и молотком из латуни или специальным ножом, типа консервного). Вскрытые барабаны после частичного отбора из них карбида кальция должны вновь герметически закрываться крышкой с резиновой прокладкой. Если их плотно закрыть нельзя, то карбид кальция из барабанов необходимо пересыпать в герметически закрывающиеся бидоны. Такие меры необходимы для того, чтобы влага воздуха не разлагала карбид кальция. При транспортировке барабаны нужно укрывать брезентом.
Если их плотно закрыть нельзя, то карбид кальция из барабанов необходимо пересыпать в герметически закрывающиеся бидоны. Такие меры необходимы для того, чтобы влага воздуха не разлагала карбид кальция. При транспортировке барабаны нужно укрывать брезентом.
Контрольные вопросы
1. Какими признаками характеризуются металлы?
2. В каком виде встречаются металлы в природе?
3. Какие черные и цветные металлы’ вы знаете?
4. Какими свойствами определяется качество металлов?
5. Какими величинами характеризуются механические свойства металлов?
6. Какой сплав называется сталью и как классифицируются стали?
7. Какие марки конструкционной стали вы знаете?
8. Какие стали называются специальными?
9. Как влияют различные примеси в стали на ее свариваемость?
10. Какой сплав называют чугуном?
11. Какая разница между белым, серым и ковким чугуном?
12. Какими свойствами обладают медь и ее сплавы?
Какими свойствами обладают медь и ее сплавы?
13. Каковы свойства алюминия и его сплавов?
14. Какие твердые сплавы вы знаете и где они применяются?
15. Что такое сварочные флюсы и каково их назначение?
16. Какие требования предъявляются к флюсам?
17. Какие металлы требуют применения флюсов при сварке?
18. Каково назначение присадочной проволоки и стержней?
19. Какие марки электродной проволоки применяются для сварки углеродистой стали?
20. Каким требованиям должны удовлетворять присадочная проволока и прутки для газовой сварки?
21. Каковы свойства кислорода и его назначение при газовой сварке и резке?
22. В каком виде получают кислород для сварки?
23. Какая должна быть чистота технического кислорода для сварки и резки?
24. Каковы свойства ацетилена и его назначение при газовой сварке и резке?
25. Каким образом получают ацетилен для сварочных работ?
Каким образом получают ацетилен для сварочных работ?
26. При каких условиях ацетилен взрывоопасен?
27. Какие горючие применяются в качестве заменителей ацетилена и каковы
их свойства?
28. Какова температура пламени различных горючих, способы их получения,
транспортировки и области применения?
29. Каковы свойства карбида кальция и как он получается?
30. Как нужно хранить карбид кальция и как с ним обращаться?
31. Какое количество ацетилена получается при разложении 1кг карбида
кальция?
32. Сколько требуется теоретически и практически воды для разложения 1кг
карбида кальция?
33. Что влияет на скорость разложения карбида кальция?
Читайте также
Добавить комментарий
КАРБИДЫ | Энциклопедия Кругосвет
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300°С, карбид тория ThC2 – при 2655°С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др.
Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300°С, карбид тория ThC2 – при 2655°С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2.
Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890°С соответственно).
Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890°С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257°С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257°С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.
Илья Леенсон
структура, свойства, производство, применение. Что такое карбид? Описание, особенности, применение и цена карбида
Содержание
- Как выглядит карбид?
- Что такое карбид?
- Свойства и состав
- Виды
- Применение
- Как получают карбид?
- Реакции, в которых участвует Карбид кальция
- Свойства
- Физические свойства
- Химические свойства
- Температура плавления
- Точка кипения
- Плотность
- Молекулярный вес
- Физиологическое действие
- При производстве ацетилена
- В сокращении выбросов CO2
- В металлургической промышленности
- Прекращенное использование
- Риски
- Транспортировка и хранение
- Получение карбида кальция
- Карбид кальция плюс азот
- Карбид кальция плюс водород
- Хранение карбида кальция
- Применение вещества
- Меры безопасности и хранение
- Можно ли тушить водой карбид кальция?
Как выглядит карбид?
Чтобы определить, где найти карбид на улице, нужно знать его физические свойства. Физически вещество является твердым, его цвет может быть темным, имея сероватый или коричневый оттенок. Цвет зависит от количества углерода. Также имеется специфический запах, который характеризует данное вещество.
Физически вещество является твердым, его цвет может быть темным, имея сероватый или коричневый оттенок. Цвет зависит от количества углерода. Также имеется специфический запах, который характеризует данное вещество.
По консистенции он твердый, но легко крошится, превращаясь в порошок. Если поднести спичку, то начнется горение с выделением углерода и разложением кальция. Правда, этого можно достичь при высоких температурах, например охотничьей спичкой.
Что такое карбид?
Самодельные бомбы. Вот, что приходит на ум первым делом, когда слышим слово карбид. И нет, занимались производством этих опасных игрушек не предприятия оборонной промышленности, а, как правило, мальчишки, лет так десяти.
Лет двадцать назад это было излюбленное развлечение у подростков. Это сейчас все сидят за своими планшетами, а тогда миром правил пытливый ум ребенка, который норовил все испробовать на практике.
Для того, чтобы почувствовать себя Рембо, требовалось раздобыть один чудо-камешек. Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.
Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.
Карбид кальция
Были и более безопасные пути использовать находку, к примеру, просто бросить в лужицу, тогда можно было наблюдать нечто похожее на действие современных бомбочек для ванны. Так что это за популярная «игрушка». Большинство из нас считали, что таким, как мы его знаем, карбид произвела природа. Но на самом деле это не так. И сегодня Вы в этом убедитесь.
Итак, вещество это всегда очень твердое, плюс ко всему, чтобы его расплавить, нужно приложить недюжинные усилия. На вид это темные, светлые, зеленоватые камни, либо порошок, все зависит от состава. Срок его годности недолог, как правило это полгода. Уложить емкости в общий склад не получится, у таких потенциально опасных веществ должен быть свой отсек.
Как Вы уже знаете, карбид постоянно норовит взорваться. Причем, некоторым соединениям даже особых условий не надо. Достаточно просто пересыпать порошок из тары в тару, как он может неожиданно рвануть.
Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.
Формула карбида кальция
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
- Материал необычайно твердый. По этому показателю он почти догнал алмаз.
 Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения.
Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения. - Чтобы расплавить камень, нужно будет приложить немало усилий. Ведь для этого необходимо нагреть его до 2-х, или даже 3-х тысяч градусов Цельсия. Эта цифра будет выше значений, необходимых для того, чтобы изменить состояние металлических веществ, до того, как они оказались в составе карбида.
- Это очень «не контактное» соединение. Так, реакция карбида на очень многие вещества будет нулевой. Для этого нужны особые условия. Потому кислоты, и прочие вещества, способствующие коррозии, им не страшны.
- Но предыдущий пункт не касается воды. Как Вы уже поняли из рассказа выше, карбид и вода – часто идут рука об руку. В случае, к примеру, когда задействован карбид кальция, для этого подойдет абсолютно любая влага, не нужно никаких условностей. Если же в работе карбид кремния, то без нагрева никак – нужен раскаленный пар (1800 градусов).
Виды
Науке известны три разновидности таких соединений:
- Ковалентные
Что их отличает, так это очень прочные связи между атомами. Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
- Солеобразные, либо ионные
Здесь в контакт с углеродом вступает либо алюминий, или металл, но не абы какой, а только из 1-2 групп хим. таблицы. Придать такому соединению жидкую форму все еще не очень просто, нужен предельный нагрев. А вот кислота незамеченной не останется, в результате такой «встречи» карбид распадется.
- Металлоподобные
Получаются они из металлов, относящихся к 4-8 группе, сюда же идут кобальт, а также никель, ну и, конечно, железо. Если рассматривать их химическое строение, увидим, что атомы углерода буквально разбросаны, между ними нет связей, они словно вкрапления в образовавшихся в металле пробелах. Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Применение
Как уже упоминалось, чаще всего это вещество можно встретить на стройке. И там ему находят десятки способов применения. В шлифовке без этого материала трудно обойтись, из него производят спец. диски. Но хорош он не только в качестве абразива, но и в виде острых режущих кругов, ножей и тому подобного.
Генератор ацитиленовый для газосварки, внутрь которого засыпается карбид кальция
Машиностроение – еще одна возможность использовать это соединение. Из карбида получаются не только различные детали автомобилей, но и зап. части для радио приборов. А благодаря своей теплопроводности он отлично справится и с задачей нагревательного типа. Даже в ядерной промышленности без такого составляющего никак. Все это требует особой прочности, поэтому здесь речь чаще всего о ковалентных видах.
Те составы, что содержат карбид железа, позволяют получить сталь, и всем известный чугун. Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Но этим дело не ограничивается. Этот искусственный минерал еще и для огородников важен. Ведь с его помощью получают особый вид удобрений. Они способны регулировать скорость роста различных культур.
Но, пожалуй, самый популярный из всех – карбид кальция. Ведь именно его в своей работе активно используют сварщики. Казалось бы, как этот темный камушек с чесночным ароматом может быть задействован в таком процессе?
Очень просто, ведь для газовой сварки, что логично, нужен горючий газ. В нашем случае дает карбид ацетилен. Как только он «встречается» с кислородом, мы получаем весьма интенсивное пламя, его температурные показатели переступают отметку в три тысячи градусов.
Если брать уже готовый летучий газ, то упаковкой ему служат спец. емкости, в них вещество доставляют к месту действия. Никакой тряски, или ударов во время такой поездки быть не должно – смертельно опасно.
Это сырье может вспыхнуть, даже без лишней «помощи», потому внимание всегда должно быть на пределе. Если же пожара избежать не удалось, никакой влаги при тушении. В ход должны идти только порошковые способы тушения.
Есть второй путь – произвести это «топливо» прямо на месте работ. Для этого нужно знать, что такое гидролиз карбидов. Говоря проще, это реакция соединения на контакт с водой. Причем, этот самую реакцию может вызвать даже одна капля.
Потому, если собрались осуществить сварочные работы, предельно аккуратно вскрываем герметичную тару с карбидом. Особо важно, чтобы никаких признаков огня по соседству, иначе ЧП гарантированно. О сигаретах и вовсе стоит забыть.
Еще следите за тем, чтобы даже самые мелкие крошки не оказались на Вашей коже, тем более на слизистых, иначе, в лучшем случае – раздражение, с худшем- ожоги и распухшие части тела. Так что вооружайтесь спец. обмундирование: защитить нужно все, с ног до головы, в том числе и дыхательные пути. Первая помощь, если контакта избежать не удалось: обильно поливаем водой пораженный участок, покрываем его плотным кремом. При необходимости вызвать врача.
При необходимости вызвать врача.
Если говорить о расходе, если масса карбида один килограмм, то это дает возможность выработать до трехсот кубических дециметров газа. Это достаточно хорошие показатели. Так же на такое количество сырья потребуется примерно литров 20 воды, хотя производители и заявляют, что достаточно будет полулитра. То, сколько времени все это займет, зависит от величины фракций соединения, и их чистоты.
После того, как с работой закончили, оставшиеся отходы, а это шлак из извести, не оставляем где попало, а утилизируем. Для таких работ потребуется спец. генератор. Бывают они внушительных размеров, их устанавливают на одном месте, к примеру, когда планируются масштабные работы. Но существует и мини-версия, переносная.
Сначала отсек, в котором и должен образоваться газ, заливаем водой, потом уже добавляем туда карбид. Идет реакция, появившийся в результате ацетилен по мягкой трубке поступает непосредственно к газовой горелке. Этот путь должен быть достаточно длинным, шланг обязательно нужно выбрать не короче десяти метров.
Карбид бора
Идет в дело и карбид бора. Предметы на его основе дают надежную защиту от огня. И не только от огня, кстати, ведь такой товар активно используют изготовители бронежилетов. Во-первых, он «ловит» пули, а во-вторых, не даст прохода и радиации. Что касается такого союза, как карбид алюминия, то сверкающие искры во время фейерверков – его заслуга. А ведь на вид это ничем не примечательный желтый порошок.
Как получают карбид?
Сначала о карбиде кальция. Его производство – дело востребованное. И хотя такие заводы требуют больших трат, особенно когда речь заходит об электроэнергии, предприятия от привычного способа изготовления не отказываются. Потому как спрос на такую продукцию не спешит падать. Ведь без ацетилена вряд ли можно представить хоть одну стройку. Чтобы экономить на электричестве, подобные предприятия открывают в странах с большим количеством ГЭС, в Канаде, например.
Почему же не перейти на работу с метаном, ведь из него тоже можно получить такой летучий газ? Да потому, что карбид кальция дает практически чистый продукт, довести до ума 98-ми процентный газ несложно. И перевозить его гораздо проще, чем тот, что получен при участии метана.
И перевозить его гораздо проще, чем тот, что получен при участии метана.
Главным объектом на таких производствах выступают электрические печи. В них загружают твердый уголь, который еще зовут коксом, и оксид кальция (известь, причем абы какая не подойдет, нужна очищенная и однородная). Все это раскаляется до 2-х тысяч градусов. И вуаля, реакция пошла.
Как результат жидкая субстанция, которая и станет потом привычным нам соединением. Но сначала ей нужно охладится в формах. После того, как градус снижен, эти пласты дробят на более удобные в использовании куски.
Теперь о кремниевом варианте. Получили его абсолютно случайно, как это по обыкновению бывает. Американский ученый пытался создать искусственный алмаз. В результате экспериментов произошло получение карбидов кремния (они, кстати, на втором месте по твёрдости после не ограненного бриллианта).
Он его запатентовал и открыл первый завод по производству материала. Сказать, что технология с тех пор сильно изменилась – нельзя. »
»
Свойства
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
CaC2 + 2h3O → Ca(OH)2 + C2h3↑
Представленная выше реакция является экзотермической.
Температура плавления
2160 ºC
Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Плотность
2,22 г / см3
Молекулярный вес
64,0992 г / моль
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
При производстве ацетилена
В промышленности реакция карбида кальция с водой используется для получения ацетилена C2ЧАС2.
CaC2 + 2 часа2O → HC≡CH + Ca (ОН)2
Это наиболее важное применение карбида кальция. В некоторых странах высоко ценится ацетилен, так как он позволяет производить поливинилхлорид, который является разновидностью пластика. Кроме того, ацетилен используется для сварки при высоких температурах.
Кроме того, ацетилен используется для сварки при высоких температурах.
В сокращении выбросов CO2
Остатки, полученные от получения ацетилена из CaC2 (также называемый «осадок карбида кальция» или «остатки карбида кальция») используются для получения клинкера или бетона.
Грязь из карбида кальция имеет высокое содержание гидроксида кальция (Ca (OH)2) (около 90%), немного карбоната кальция (CaCO3) и имеет pH более 12.
По этим причинам он может реагировать с SiO.2 или Al2ИЛИ3 образуя продукт, аналогичный продукту, полученному в процессе гидратации цемента.
Один из видов деятельности человека, который производит больше выбросов CO2 это строительная отрасль. Сотрудничество2 он образуется на востоке, чтобы отделиться от карбоната кальция во время реакции с образованием бетона.
Использование осадка карбида кальция для замены карбоната кальция (CaCO3) было обнаружено, что снижает выбросы CO2 на 39%.
В металлургической промышленности
Карбид кальция используется для удаления серы из таких сплавов, как ферроникель. CaC смешанный2 со сплавом, расплавленным при 1550 ° С. Сера (S) реагирует с карбидом кальция с образованием сульфида кальция CaS и углерода C:
CaC смешанный2 со сплавом, расплавленным при 1550 ° С. Сера (S) реагирует с карбидом кальция с образованием сульфида кальция CaS и углерода C:
CaC2 + S → 2 C + CaS
Удаление серы благоприятно, если смешивание является эффективным и содержание углерода в сплаве низкое. Сульфид кальция CaS плавает на поверхности расплавленного сплава, откуда его сливают и выбрасывают.
Прекращенное использование
ЦК2 он использовался в так называемых карбидных лампах. Их действие заключается в капании воды на карбид кальция с образованием ацетилена, который воспламеняется и, таким образом, дает свет.
Эти лампы использовались на угольных шахтах, но их использование было прекращено из-за наличия метана Ch5 в тех шахтах. Этот газ легко воспламеняется, и пламя карбидной лампы может воспламениться или взорваться.
Они широко использовались в сланцевых, медных и оловянных рудниках, а также в ранних автомобилях, мотоциклах и велосипедах в качестве фар или фар.
В настоящее время их заменяют электрические лампы или даже светодиодные лампы. Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.
Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.
Риски
Карбид кальция CaC2 в сухом виде он не горюч, но в присутствии влаги быстро образует ацетилен, которым и является.
Для тушения пожара в присутствии CaC2 нельзя использовать воду, пену, углекислый газ или галогенные огнетушители. Следует использовать песок или гидроксид натрия или кальция.
Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.
Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2. 45 45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Применение вещества
Кальция карбид активно применяется в промышленности. Он является катализатором в сфере синтеза органических соединений. С его помощью стало возможным синтезировать каучук за более низкую цену. Однако для этого вначале необходимо провести необходимые химические реакции для синтеза собственного карбида, а уже потом — каучука. Все больше химиков задаются вопросом о том, где найти карбид в природе, чтобы облегчить себе работу.
С его помощью стало возможным синтезировать каучук за более низкую цену. Однако для этого вначале необходимо провести необходимые химические реакции для синтеза собственного карбида, а уже потом — каучука. Все больше химиков задаются вопросом о том, где найти карбид в природе, чтобы облегчить себе работу.
Карбид нашел свое применение в садоводстве. На его основе фермеры получают удобрение под названием цианид кальция. Применяется для улучшения роста корневой системы саженцев и взрослых растений.
Меры безопасности и хранение
Calcium carbide относится к 1 классу опасности по степени воздействия на организм. Его пыль раздражающе действует на кожные покровы, слизистые оболочки и дыхательные пути. Реагент очень опасен при вдыхании (симптомы: прерывистое дыхание, кашель, насморк, чувство удушья, отек легких), попадании на кожные покровы (получение ожогов, язв) и в глаза (резь, слезотечение, отек век).
При применении материала необходимо использовать специальную защитную одежду, противогаз, перчатки и специальную обувь. Работать только в хорошо проветриваемых помещениях. В случае попадания на кожу промыть пораженное место большим количеством воды, смазать жирным кремом и вызвать врача.
Работать только в хорошо проветриваемых помещениях. В случае попадания на кожу промыть пораженное место большим количеством воды, смазать жирным кремом и вызвать врача.
Хранить в герметичных тарах в вертикальном положении (не более, чем в 3 ряда) в несгораемых, хорошо вентилируемых складах или на открытых площадках под навесом, защищающих от воздействия влаги. Не допускается совместное хранение с другими веществами. Срок годности – 6 месяцев с даты производства.
Можно ли тушить водой карбид кальция?
Calcium carbide является негорючим продуктом, но выделяющийся при его разложении ацетилен взрыво- и пожароопасен. Он легко воспламеняется даже при кратковременном контакте с воздухом и обладает способностью самовоспламеняться даже в чистом виде. Он также легко вступает в реакцию с солями меди, серебра и ртути с образованием нестойких взрывчатых ацетеленидов. Обладает наркотическим действием, обусловленным фосфористым водородом в его составе.
Реагент ни в коем случае не разрешается тушить водой! При попадании жидкости в емкости с веществом возможны взрывы. Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Ацетилен легче воздуха, поэтому возможно его накопление в высших точках слабовентилируемых помещений.
Источники
- https://pressadv.ru/metally-svarka/gde-vzyat-karbid.html
- https://stpoyka.ru/chto-takoe-karbid-opisanie-osobennosti-primenenie-i-cena-karbida/
- http://charchem.org/ru/subst-ref/?id=2004
- https://chem.ru/karbid-kalcija.html
- https://ru.warbletoncouncil.org/carburo-de-calcio-9133
- https://www.syl.ru/article/150446/mod_karbid-kaltsiya-svoystva-i-primenenie-poluchenie-atsetilena
- https://weldering.com/karbid-kalciya-acetilen-druzya-razley-voda
- https://him-kazan.ru/stati/karbid-kalcziya
Каково промышленное использование карбида кальция?
`;
Пол Скотт
Карбид кальция представляет собой соединение, полученное из термически преобразованной комбинации кокса и извести. Он имеет несколько промышленных применений, наиболее часто встречающимся из которых является производство газообразного ацетилена. Ацетилен широко используется в качестве менее дорогостоящей альтернативы традиционному топливу на нефтяной основе в ряде промышленных процессов. Необработанный карбид кальция находит дополнительное применение в сталелитейной промышленности в качестве реагента для десульфурации и раскисления. Менее распространенные применения карбида кальция в промышленности включают топливо для карбидных ламп, производство поливинилхлорида (ПВХ) и созревание фруктов.
Карбид кальция, производящий ацетилен, уже много лет используется в качестве источника топлива для освещения, печей, резки или сварки. Продукт высокотемпературной конверсии смесей кокса и извести, карбид кальция производит большое количество газообразного ацетилена при воздействии воды. До разработки жизнеспособного электрического освещения необработанные куски соединения широко использовались в сочетании с водой для производства ацетилена, сжигаемого в карбидных лампах для освещения подземных горных работ, автомобилей и уличного освещения. Эти примитивные, но удивительно эффективные лампы все еще можно найти в шахтах в нескольких развивающихся странах. Хотя за прошедшие годы появилось несколько других применений этого соединения в промышленности, наиболее распространенным современным применением карбида кальция по-прежнему является производство газообразного ацетилена.
Продукт высокотемпературной конверсии смесей кокса и извести, карбид кальция производит большое количество газообразного ацетилена при воздействии воды. До разработки жизнеспособного электрического освещения необработанные куски соединения широко использовались в сочетании с водой для производства ацетилена, сжигаемого в карбидных лампах для освещения подземных горных работ, автомобилей и уличного освещения. Эти примитивные, но удивительно эффективные лампы все еще можно найти в шахтах в нескольких развивающихся странах. Хотя за прошедшие годы появилось несколько других применений этого соединения в промышленности, наиболее распространенным современным применением карбида кальция по-прежнему является производство газообразного ацетилена.
Ацетилен является эффективным и относительно дешевым источником топлива для ряда промышленных процессов, особенно в развивающихся странах, где он используется в качестве непосредственного источника топлива и для производства газа для хранения в больших объемах. Простота изготовления, низкая стоимость и простой переход на газ делают его привлекательной альтернативой основным источникам тепла на ископаемом топливе. Ацетилен также широко используется во всем мире для кислородно-ацетиленовой резки и сварки. Этот газ также используется в химической промышленности для переработки нескольких соединений, наиболее известным из которых является необработанный ПВХ.
Простота изготовления, низкая стоимость и простой переход на газ делают его привлекательной альтернативой основным источникам тепла на ископаемом топливе. Ацетилен также широко используется во всем мире для кислородно-ацетиленовой резки и сварки. Этот газ также используется в химической промышленности для переработки нескольких соединений, наиболее известным из которых является необработанный ПВХ.
Черная металлургия использует как сырой карбид кальция, так и ацетилен в нескольких производственных процессах. Одним из таких применений является обессеривание чугуна, чугуна и стали. Он также используется в нескольких связанных приложениях в качестве мощного раскислителя. Газообразный ацетилен часто используется в этом секторе промышленности в качестве топлива для обогрева в определенных технологических процессах.
Он также используется в нескольких связанных приложениях в качестве мощного раскислителя. Газообразный ацетилен часто используется в этом секторе промышленности в качестве топлива для обогрева в определенных технологических процессах.
Одно из менее известных применений газообразного ацетилена находится в несколько необычном секторе промышленности. Коммерческие фермеры, выращивающие фрукты, обычно собирают урожай до того, как он полностью созреет, потому что зеленые фрукты легче транспортировать. Перед продажей зеленые плоды подвергают воздействию этилена или ацетилена, которые действуют как гормональный стимулятор, ускоряющий процесс созревания. В некоторых азиатских странах фрукты просто кладут под миски вместе с парой кусков сырого карбида кальция, где влага в воздухе вызывает выделение газообразного ацетилена.
В некоторых азиатских странах фрукты просто кладут под миски вместе с парой кусков сырого карбида кальция, где влага в воздухе вызывает выделение газообразного ацетилена.
5 Применение карбида вольфрама – Tungco
В наши дни мы сильно зависим от переработанных товаров, чтобы уменьшить потенциальный ущерб окружающей среде. Некоторые металлы и сплавы, такие как карбид вольфрама, обладают качествами, которые делают их полезными для различных целей/применений. Вольфрам — это плотное металлическое вещество, которое можно использовать во всем, от обычных бытовых изделий до промышленного оборудования. Использование вольфрама безгранично. Уникальные свойства вольфрама делают его незаменимым редким металлом, естественным образом встречающимся на Земле.
Вольфрам — это плотное металлическое вещество, которое можно использовать во всем, от обычных бытовых изделий до промышленного оборудования. Использование вольфрама безгранично. Уникальные свойства вольфрама делают его незаменимым редким металлом, естественным образом встречающимся на Земле.
Что такое карбид вольфрама?
Карбид вольфрама представляет собой вещество, образованное соединением металлического вольфрама с атомами углерода. Это химическое соединение, известное как WC, представляет собой серый порошок. Затем этот серый порошок можно спекать для получения желаемого продукта. Это прочный материал, часто используемый в промышленности, но возможности его применения безграничны. На самом деле карбид вольфрама настолько тверд, что его можно разрезать только алмазным инструментом. Карбид вольфрама особо прочный , в большей степени, чем его аналоги из других металлов, таких как золото, серебро или платина.
Каковы свойства карбида вольфрама?
Свойства карбида вольфрама в высшей степени уникальны. Высокая прочность, плотность и твердость — это свойства, которые отличают карбид вольфрама от других и делают его универсальным материалом для многих применений. Карбид вольфрама может выдерживать чрезвычайно высокие температуры, что делает его отличным материалом для использования в станочных и режущих инструментах и даже для печей, и может быть сформирован для проведения электричества или наоборот. Износостойкость и коррозионная стойкость входят в число других свойства карбида вольфрама , которые демонстрируют его универсальность и уникальность.
Высокая прочность, плотность и твердость — это свойства, которые отличают карбид вольфрама от других и делают его универсальным материалом для многих применений. Карбид вольфрама может выдерживать чрезвычайно высокие температуры, что делает его отличным материалом для использования в станочных и режущих инструментах и даже для печей, и может быть сформирован для проведения электричества или наоборот. Износостойкость и коррозионная стойкость входят в число других свойства карбида вольфрама , которые демонстрируют его универсальность и уникальность.
5 Промышленное применение карбида вольфрама
Уникальные свойства карбида вольфрама и исключительные качества делают его востребованным материалом для самых разных областей применения. Диапазон применения вольфрама и его ценность не только ограничены производством и промышленностью, но также играют важную роль в области медицины, мира моды и многих других.
#1: Строительство
Строительство требует использования инструментов с высокой прочностью и жесткостью, чтобы они могли выдерживать воздействие на материалы, из которых состоит большинство конструкций. В таких материалах, как цемент и асфальт, трудно проникнуть, для чего требуется особо прочное и прочное лезвие или сверло, например, из карбида вольфрама. Карбид вольфрама обычно используется в строительных материалах , таких как пилы и сверла, потому что он практически не ломается.
В таких материалах, как цемент и асфальт, трудно проникнуть, для чего требуется особо прочное и прочное лезвие или сверло, например, из карбида вольфрама. Карбид вольфрама обычно используется в строительных материалах , таких как пилы и сверла, потому что он практически не ломается.
#2: Промышленные сплавы
Для создания электроники, строительных проектов, промышленных передач и даже авиационного оборудования сплавы образуются путем смешивания металлов с другими металлами или элементами. Эти сплавы имеют определенные свойства, такие как прочность или термостойкость, необходимые для каждого отдельного продукта и его использования. Сплавы, созданные из карбида вольфрама , особенно популярны для изготовления строительных материалов и инструментов. Около 17% всего карбида вольфрама используется для создания этих сплавов.
#3: Мукомольная промышленность
Применение карбида вольфрама имеет далеко идущие последствия. Из-за его долговечности и прочности около 10% всего использования карбида вольфрама приходится на мукомольную промышленность. Карбид вольфрама, часто используемый для фрез и концевых фрез, легко формуется, оставаясь при этом прочным. Фрезерная промышленность требует таких материалов, как карбид вольфрама, потому что это отрасль, которая полагается на точность; созданный продукт, возможно, потребуется измельчить в порошок, измельчить или натереть на терке, а универсальность карбида вольфрама позволяет создавать невероятно точные фрезерные инструменты.
Из-за его долговечности и прочности около 10% всего использования карбида вольфрама приходится на мукомольную промышленность. Карбид вольфрама, часто используемый для фрез и концевых фрез, легко формуется, оставаясь при этом прочным. Фрезерная промышленность требует таких материалов, как карбид вольфрама, потому что это отрасль, которая полагается на точность; созданный продукт, возможно, потребуется измельчить в порошок, измельчить или натереть на терке, а универсальность карбида вольфрама позволяет создавать невероятно точные фрезерные инструменты.
#4: Ювелирные изделия
Еще одно новое и перспективное применение карбида вольфрама – ювелирная промышленность. Карбид вольфрама, если его хорошо обрезать, обработать и отполировать, может выглядеть так же потрясающе, как и любые другие украшения, которые вы обычно носите. Помимо того, что карбид вольфрама известен своей невероятной устойчивостью к царапинам выше среднего, он также является доступной альтернативой золотым или серебряным украшениям, за которые мы привыкли платить. Благодаря своей долговечности этот металл берет штурмом промышленность, уже широко используется для изготовления серег, ожерелий и колец.
Благодаря своей долговечности этот металл берет штурмом промышленность, уже широко используется для изготовления серег, ожерелий и колец.
#5: Производство хирургических инструментов
Многие из возможных применений карбида вольфрама все еще изучаются, и среди этих новых применений – его использование в области медицины. Карбид вольфрама часто используется для создания хирургических инструментов, потому что он повышает их производительность, а также устойчив к коррозии. Это увеличивает долговечность и прочность хирургических инструментов. Свойства карбида вольфрама , такие как его способность затачиваться при сохранении твердости, хорошо подходят для хирургической промышленности.
Другое применение
Применение карбида вольфрама безгранично. Он используется в спортивном оборудовании, таком как клюшки для гольфа, из-за его долговечности и прочности. Его можно использовать в музыкальных инструментах, таких как гитарные слайды. Другим важным применением карбида вольфрама , с которым мы все наверняка сталкивались, является наконечник шариковой ручки. Карбид вольфрама также используется в электрических компонентах, особенно в лампочках из-за его термостойкости. Еще применение карбида вольфрама предназначено для бронебойных боеприпасов, потому что это такой прочный и прочный материал. Кроме того, еще одно интересное и авангардное применение карбида вольфрама — это космические спутники из-за его устойчивости к экстремальным колебаниям температуры.
Другим важным применением карбида вольфрама , с которым мы все наверняка сталкивались, является наконечник шариковой ручки. Карбид вольфрама также используется в электрических компонентах, особенно в лампочках из-за его термостойкости. Еще применение карбида вольфрама предназначено для бронебойных боеприпасов, потому что это такой прочный и прочный материал. Кроме того, еще одно интересное и авангардное применение карбида вольфрама — это космические спутники из-за его устойчивости к экстремальным колебаниям температуры.
Заключение
Как мы можем ясно понять, большой или маленький вольфрам и карбид вольфрама играют важную роль в нашей жизни и встречаются в каждой отрасли. Применение карбида вольфрама значительно меняет наше представление о продуктах и вторичной переработке в целом. Есть путь, ведущий прямо в будущее, и он вымощен карбидом вольфрама. Если вы ищете универсальный и прочный материал, не ищите дальше, потому что карбид вольфрама меняет мир с помощью одного сверла и одной клюшки для гольфа за раз.
Карбид кремния (SiC): свойства, производство, применение
Что такое карбид кремния (SiC)?
Карбид кремния с химическим символом SiC представляет собой твердый кристаллический минерал промышленного назначения. Он используется в качестве полупроводника и керамики, обычно называемой карборундом. SiC существует в природе в чрезвычайно редком минерале под названием муассанит. Чистые карбиды кремния выглядят как бесцветные и прозрачные кристаллы. Когда добавляются примеси, такие как азот или алюминий, кристаллы карбида кремния становятся зелеными или синими в зависимости от уровня примеси. Карбид кремния в основном используется из-за его твердости и прочности, хотя его керамические и полупроводниковые свойства делают SiC превосходным материалом для производства быстрых, высоковольтных и высокотемпературных устройств [1].
Свойства карбида кремния
Прочная кристаллическая структура
Карбид кремния состоит из легких элементов, кремния (Si) и углерода (C).![]() Его основным строительным блоком является кристалл из четырех атомов углерода, образующих тетраэдр, ковалентно связанных с одним атомом кремния в центре. SiC также проявляет полиморфизм, так как существует в различных фазах и кристаллических структурах [2][3].
Его основным строительным блоком является кристалл из четырех атомов углерода, образующих тетраэдр, ковалентно связанных с одним атомом кремния в центре. SiC также проявляет полиморфизм, так как существует в различных фазах и кристаллических структурах [2][3].
Высокая твердость
Карбид кремния имеет твердость по шкале Мооса 9, что делает его самым твердым доступным материалом после карбида бора (9,5) и алмаза (10). Именно это очевидное свойство делает SiC отличным материалом для механических уплотнений, подшипников и режущих инструментов.
Стойкость к высоким температурам
Стойкость карбида кремния к высоким температурам и тепловым ударам позволяет использовать карбид кремния в производстве огнеупорных кирпичей и других огнеупорных материалов. Разложение карбида кремния начинается при 2000°С [2].
Проводимость
Если SiC очищается, его поведение проявляется в качестве электрического изолятора. Однако, управляя примесями, карбиды кремния могут проявлять электрические свойства полупроводника. Например, введение различных количеств алюминия путем легирования приведет к получению полупроводника p-типа. Как правило, SiC промышленного класса имеет чистоту от 98 до 99,5%. Обычными примесями являются алюминий, железо, кислород и свободный углерод [2].
Однако, управляя примесями, карбиды кремния могут проявлять электрические свойства полупроводника. Например, введение различных количеств алюминия путем легирования приведет к получению полупроводника p-типа. Как правило, SiC промышленного класса имеет чистоту от 98 до 99,5%. Обычными примесями являются алюминий, железо, кислород и свободный углерод [2].
Химическая стабильность
Карбид кремния является стабильным и химически инертным веществом с высокой коррозионной стойкостью даже при воздействии или кипячении в кислотах (соляная, серная или плавиковая кислота) или основаниях (концентрированные гидроксиды натрия). Установлено, что он реагирует в хлоре, но только при температуре 900°С и выше. Карбид кремния начнет реакцию окисления на воздухе при температуре около 850°C с образованием SiO 2 [2].
Производство карбида кремния
Карбид кремния можно найти в минерале муассаните, но в природе он встречается редко. Таким образом, он производится синтетическим путем с помощью метода синтеза, называемого методом Ачесона, названного в честь его изобретателя Эдварда Г. Ачесона. Чистый кремнезем (SiO 2 ) или кварцевый песок и мелкоизмельченный нефтяной кокс (углерод) смешивают и нагревают в электропечи сопротивления до повышенной температуры примерно от 1700 до 2500°C. Ниже представлена основная химическая реакция, приводящая к образованию ɑ-SiC:
Ачесона. Чистый кремнезем (SiO 2 ) или кварцевый песок и мелкоизмельченный нефтяной кокс (углерод) смешивают и нагревают в электропечи сопротивления до повышенной температуры примерно от 1700 до 2500°C. Ниже представлена основная химическая реакция, приводящая к образованию ɑ-SiC:
Карбид кремния образует цилиндрический слиток вокруг ядра, образуя слои ɑ-SiC, β-SiC и непрореагировавший материал снаружи. ɑ-SiC — высшая марка с крупнокристаллической структурой, а β-SiC — металлургическая марка. В зависимости от качества сырья карбид кремния может быть зеленого или черного цвета. Затем слитки карбида кремния сортируются и обрабатываются для конкретного применения, для которого они предназначены. Их можно измельчать, измельчать или подвергать химической обработке для достижения свойств, необходимых для утилизации [4].
Применение карбида кремния
Благодаря прекрасному сочетанию свойств, которыми обладает карбид кремния, он оказался многообещающим материалом для применения в условиях высоких температур и износостойкости [3].
Абразивный материал
Порошки карбида кремния используются для процессов абразивной обработки, таких как шлифование, пескоструйная обработка и гидроабразивная резка. SiC можно ламинировать бумагой, тканью или деревом для создания фрикционного сцепления. Его также можно использовать для придания формы, хонингования и полировки других материалов.
Высокотемпературный датчик газа
Карбид кремния используется в качестве чувствительного элемента в химическом производстве, а также при испытаниях турбин или двигателей для обнаружения легковоспламеняющихся и горючих газов в суровых, высокотемпературных и агрессивных средах [3].
Электроника
Карбиды кремния используются в качестве полупроводников во многих элементах схем из-за их сопротивления высокому напряжению. Сопротивление напряжению SiC в десять раз выше, чем у обычного кремния, и даже лучше, чем у нитрида галлия, в системах с напряжением более 1000 В. Таким образом, SiC оказывается ценным при разработке электромобилей, инверторов солнечной энергии и сенсорных систем [5].
Таким образом, SiC оказывается ценным при разработке электромобилей, инверторов солнечной энергии и сенсорных систем [5].
[1] G.L. Harris, Properties of Silicon Carbide , London: INSPEC, 1995.
[2] S. Somiya, Y. Inomata, Silicon Carbide Ceramics—1: Fundamental and Solid Reaction , Essex: Elsevier Science Publishers LTD, 2012.
[3] S. E. Saddow, A. Agarwal, Advances in Silicon Carbide Processing and Applications , MA: Artech House Inc, 2004.
[4] «SiC Production Process», Fiven , nd, [В сети] Доступно: https://www.fiven.com/world-of-silicon-carbide/sic-production-process/ [Проверено 11 декабря 2020 г.]
[5] М. Р. Николс, «Каковы преимущества карбида кремния в полупроводниках?» Euroscientist , март 2019 г., [онлайн] Доступно: https://www.euroscientist.com/what-are-the-benefits-of-silicon-carbide-in-semiconductors/ [Проверено 30 августа 2019 г.]
Карбид кремния
| Ежемесячная техническая подсказка от Тони ХансенSignUp | Нет отслеживания ! Нет объявлений ! Вот почему эта страница загружается быстро! |
- Материалы для керамики
1-9 | А | Б | С | Д | Е | Ф | Фриты | г | Н | я | Дж | К | л | М | Н | О | П | Вопрос | Р | С | Т | У | В | Вт | Х | Y | Z
Альтернативные названия : SiC
| Оксид | Анализ | Формула |
|---|
| Материалы | Глинозем |
|---|---|
| Материалы | Фенолформальдегид |
| Материалы | нитрид бора |
| Материалы | карбид бора Б4К |
| Материалы | титанат бария |
| URL-адреса | http://en.wikipedia.org/wiki/кремниевый_карбид Карбид кремния в Википедии |
| URL-адреса | http://skylinecomponents. com/SiC.html com/SiC.html Информация о SiC в Skyline Components |
| Типовые коды | Стойкий к истиранию сверхтвердый материал Эти материалы, как правило, доступны в гранулированной форме, частицы склеиваются друг с другом с помощью фритты для получения абразивных изделий. Однако порошкообразные и суспензионные формы этих материалов также можно формовать и обжигать различными способами для получения твердых материалов. |
| Типовые коды | Неоксидный материал Многие из этих материалов не используются в традиционной керамике, но они обладают такими невероятными свойствами, что некоторые из них были включены в эту базу данных. |
| Типовые коды | Общий материал Непатентованные материалы не имеют торговой марки. Обычно они носят теоретический характер, химический состав показывает, каким был бы образец, если бы в нем не было загрязнения.  Общие материалы полезны в образовательных ситуациях, когда учащимся необходимо изучать теорию материалов (позже они переходят к работе с реальными материалами). Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов достаточна при использовании универсальных материалов. Общие материалы полезны в образовательных ситуациях, когда учащимся необходимо изучать теорию материалов (позже они переходят к работе с реальными материалами). Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов достаточна при использовании универсальных материалов. |
| Глоссарий | Горячее прессование |
Data
| Hardness (Moh) | 9+ |
|---|
Mechanisms
| Glaze Color | Small silicon carbide additions to copper glazes fired in an oxidation kiln will produce reduction последствия. |
|---|
| Автор: Тони Хансен Следуйте за мной на |
Расскажите нам, как улучшить эту страницу
Или задайте вопрос, и мы изменим эту страницу, чтобы лучше ответить на него.
Адрес электронной почты
Имя
Субъект
Сообщение
Сообщение Введите это, чтобы доказать, что вы не робот, или Обновить
Оставьте следующее пустым
https://digitalfire.com, все права защищены
Политика конфиденциальности
Что такое карбид кальция? (с картинками)
`;
Адам Хилл
Карбид кальция представляет собой химическое соединение, содержащее кальций и карбид, с химической формулой CaC 2 . Чистый карбид кальция бесцветен, но большая часть материала производится промышленным способом и имеет несколько загрязнений, что придает ему черный или серовато-белый цвет, в зависимости от качества. В основном это вещество используется для производства легковоспламеняющегося газа ацетилена.
Чистый карбид кальция бесцветен, но большая часть материала производится промышленным способом и имеет несколько загрязнений, что придает ему черный или серовато-белый цвет, в зависимости от качества. В основном это вещество используется для производства легковоспламеняющегося газа ацетилена.
Карбид кальция необходимо производить в промышленных масштабах, поскольку в природе он не встречается в больших количествах. Для производства материала необходимы очень высокие температуры, порядка 3630 градусов по Фаренгейту (2000 градусов по Цельсию). Его изготавливают в печи, называемой электродуговой печью, в которой температура может быть намного выше, чем при простом сжигании. Основной химический процесс, используемый для изготовления материала, не изменился с тех пор, как он был открыт в 1888 году.
Основной химический процесс, используемый для изготовления материала, не изменился с тех пор, как он был открыт в 1888 году.
При контакте любого сорта карбида кальция с водой немедленно начинается химическая реакция, в результате которой образуются два новых соединения, одним из которых является ацетилен, очень полезный горючий газ. Такие страны, как Китай, используют большое количество ацетилена в качестве промышленного топлива, главным образом потому, что его дешевле производить и использовать внутри страны, чем импортировать нефть для той же цели. Как ни странно, ацетилен также можно использовать для ускорения созревания фруктов, так же как и этилен.
Карбид кальция также используется для изготовления некоторых видов удобрений. Цианамид кальция является одним из них и образуется при реакции карбида кальция с азотом при высоких температурах. Некоторые процессы производства стали также требуют использования этого материала.
Одним из первых применений этого материала было устройство, называемое карбидной лампой. Это был тип лампы, в которой использовался тот факт, что вода и карбид кальция реагируют вместе, образуя ацетилен. Эти лампы использовались в шахтах с конца 19 века.век. Открытое пламя, возникающее при горении ацетилена в лампе, исключало его использование в угольных шахтах, но добытчики олова, меди и сланца могли извлечь выгоду из его использования.
Это был тип лампы, в которой использовался тот факт, что вода и карбид кальция реагируют вместе, образуя ацетилен. Эти лампы использовались в шахтах с конца 19 века.век. Открытое пламя, возникающее при горении ацетилена в лампе, исключало его использование в угольных шахтах, но добытчики олова, меди и сланца могли извлечь выгоду из его использования.
Карбидные лампы также использовались в качестве маяков и даже в качестве фар в автомобилях и велосипедах. Их использование сегодня редко и в основном ограничивается охотой и исследованием пещер, и даже здесь обычно доступны лучшие варианты освещения. Важно помнить, что ацетилен, образующийся при контакте карбида кальция с водой, является легковоспламеняющимся и потенциально взрывоопасным газом, и следует принимать соответствующие меры предосторожности.
Важно помнить, что ацетилен, образующийся при контакте карбида кальция с водой, является легковоспламеняющимся и потенциально взрывоопасным газом, и следует принимать соответствующие меры предосторожности.
Часто задаваемые вопросы о карбидных лампах
Эта страница содержит часто задаваемые вопросы о карбидных лампах. Если вы считаете, что нужно что-то добавить на эту страницу, сообщите мне об этом по адресу Этот адрес электронной почты защищен от спам-ботов.
 У вас должен быть включен JavaScript для просмотра. и я добавлю!!
У вас должен быть включен JavaScript для просмотра. и я добавлю!!Q1. Я только что нашел карбидную лампу. Где купить карбид кальция?
Ответ:- Карбид кальция используется в производстве газообразного ацетилена, как и в карбидных лампах. Как правило, вы можете приобрести большие количества у таких компаний, как Air Liquide или любого, кто производит ацетилен. Спелеоклубы по всему миру использовали карбидные лампы для спелеологии и, как правило, имели запасы карбида. Однако они, как правило, больше не используют карбид для освещения благодаря светодиодному освещению.
Последним продавцом (21.08.2007) карбида кальция в США стала компания Ray-Vin Bullseye Black Carbide Calcium, которая предлагает 10 унций. пакеты карбида кальция сорта мелкого зерна гороха по цене 15,95 долларов США за штуку. Цена покупки включает в себя наземную доставку (2-4 недели) почтовой службой USPS. Они могут отправлять карбид кальция только по адресам в Соединенных Штатах (можно использовать абонентские ящики).
Karst Sports (по состоянию на 24.04.2016) отправляет 10-фунтовые контейнеры с карбидом в США по цене 104,95 долларов США.
Вы также можете приобрести карбидный камень в Интернете на сайте Lehman’s www.lehmans.com по цене 80 долларов США за ящик из пяти двухфунтовых банок. Вы можете приобрести 2-фунтовые банки прямо в магазине за 12,85 долларов США. (Большое спасибо Биллу Смиту, предоставившему информацию о количестве банок в ящике и информацию об отдельных банках — октябрь 2008 г.).
В качестве альтернативы, если вы находитесь в США, предлагаем вам перейти на домашнюю страницу Национального спелеологического общества, и там вы найдете поисковую систему, чтобы найти информацию о вашем местном гроте спелеологического клуба. Свяжитесь с ними и узнайте, могут ли они помочь.
Если вы находитесь в Европе, попробуйте файл ссылок на клубы спелеологов в Великобритании и Европе.
Если вы находитесь в Австралии, посетите веб-сайт Австралийской спелеологической федерации и поговорите с членами спелеологического клуба рядом с вами, которые МОГУТ посоветовать, где еще можно купить карбидный камень.
Q2. Как заставить карбидную лампу работать?
Ответ: Это сильно зависит от модели лампы, но, как правило, вы наливаете воду в верхний резервуар (обычно), а карбид кальция кладете небольшими (диаметром <1 см) или средними (диаметром <3 см) кусочками в нижний. камера. Заполните карбидную камеру только примерно на 3/4 камнем – он расширяется при добавлении воды. Перед добавлением воды в верхнюю камеру убедитесь, что резиновое уплотнение (обычно), закрывающее карбидную камеру, присутствует и не повреждено. Убедитесь также, что жиклер, в котором горит газ, чист, используя тонкую проволочную «проколку», чтобы очистить его. Возможно, потребуется снять жиклер и прочистить его.
Затем добавьте воду в верхнюю камеру и отрегулируйте поток воды до минимума. Встряхните лампу, чтобы запустить генерацию газа, а затем зажгите струю газа, которая должна исходить из струи (попробуйте почувствовать струю газа рукой/пальцем перед тем, как зажечь) спичкой. Предлагаю сделать это снаружи с помощью шланга под рукой – на всякий случай – см. ниже!!
ниже!!
ВНИМАНИЕ:- Если в лампе есть отверстия или уплотнения не работают, то при зажигании лампа может “загореться” – будьте готовы продуть их или используйте шланг, предложенный выше!! ЕЩЕ ХУЖЕ, если газ вообще не может выйти из лампы, ВОЗМОЖНО, что лампа может взорваться. Автор этого FAQ не несет ответственности за лиц, пострадавших от взрыва ламп или травм, полученных при попытке зажечь карбидные лампы!!
Q3. Где купить новые карбидные лампы?
В США их больше не производят, но вы можете забрать их в рабочем состоянии в Antique Malls. В Англии их все еще можно купить новыми!! Лампы Premier по-прежнему производятся компанией Caving Supplies.
Если вы хотите приобрести одну или несколько ламп, обращайтесь по адресу:
Карбидные цокольные лампы Premier (плюс карбидная головка собственного производства и выносной генератор)…
Принадлежности для спелеологии,
19London Road,
Buxton,
Derbyshire, UK
Tel (44)-(0)1298 71707
ИЛИ покупка непосредственно в Caving Supplies
Другие хорошие сайты для поиска и покупки ламп: The Guys Dropper Shop или The Lamp Tramp веб-сайт коллекционных предметов добычи полезных ископаемых (похоже, это одно и то же место, просто разные названия)
Запчасти и аксессуары можно также приобрести в интернет-магазине Inner Mountain Outfitters.
Детали ламп также можно приобрести у Bob and Bob в США. Ознакомьтесь с запчастями по ссылке (Carbide Lamp Parts) на главной странице
Другой источник ламп – J.K. Дей и сыновья в Индии. Они изготовят вам лампу по вашим спецификациям!!
В США J.K. Лампы Dey and Sons также можно приобрести в Интернете на сайте Lehman www.lehmans.com. Просто найдите карбидную лампу, чтобы найти их. Они также продают карбидный камень по цене 80 долларов США за ящик из пяти двухфунтовых банок. Вы можете приобрести 2-фунтовые банки прямо в магазине за 12,85 долларов США. (Большое спасибо Биллу Смиту, предоставившему информацию о количестве банок в ящике и информацию об отдельных банках — октябрь 2008 г.).
Q4. Где я могу получить ДОПОЛНИТЕЛЬНУЮ информацию о карбидных лампах?
Книга Грегга С. Клеммера «Карбидные лампы американских горняков» является отличным источником информации для тех, кто хочет узнать больше о найденных ими лампах. Обратите внимание, что эта книга посвящена только американским карбидным лампам, но если это то, что вы ищете, то это здорово. Его можно легко приобрести, перейдя на страницу книжного магазина NSS: – Книжный магазин Национального спелеологического общества – Общая страница – Раздел освещения. Краткий синопсис книги: «Эта книга не только охватывает историю карбидных ламп, но также включает советы коллекционерам, приложения, в которых перечислены патенты, основанные на хронологии, технологии, дизайне и редкости».
Его можно легко приобрести, перейдя на страницу книжного магазина NSS: – Книжный магазин Национального спелеологического общества – Общая страница – Раздел освещения. Краткий синопсис книги: «Эта книга не только охватывает историю карбидных ламп, но также включает советы коллекционерам, приложения, в которых перечислены патенты, основанные на хронологии, технологии, дизайне и редкости».
Q5. Где я могу купить карбидные лампы и/или сколько стоят лампы??
Если вы ищете бывшую в употреблении (старую) карбидную лампу, я предлагаю вам посетить сайт:
http://www.ebay.com
или
http://www.ebay.com. au (для Австралии/Новой Зеландии)
На обоих этих сайтах регулярно продается несколько карбидных ламп. Здесь вы можете увидеть, что другие предлагают за разные модели карбидных ламп, и это дает вам представление о том, сколько стоит каждая модель. Вы обязательно найдете любую лампу, которую ищете, на ebay, но она может быть дорогой, если это редкая лампа!
После того, как вы установили цены на лампы, вы можете отправиться на поиски в вашем районе.

