Для пайки какая нужна кислота: Как паять кислотой? – самые полезные статьи в интернет-магазине радиодеталей и радиоэлектроники Electronoff
alexxlab | 31.01.2023 | 0 | Разное
Для чего нужна паяльная кислота © Геостарт
Каждый человек, которому приходилось работать с радиоэлектроникой, неоднократно использовал паяльник для решения своих задач, поэтому он знает, в чём заключается принцип работы подобного оборудования. Но из-за неприятного запаха, издаваемого при обработке конструкции с помощью классического припоя, а также существенных сложностей на разных этапах действия, такая технология не пользуется особым спросом и имеет ряд более простых аналогов.
Назначение паяльной кислоты
Чтобы сделать предстоящую пайку более продуктивной многие сварщики используют специальные вещества — флюсы, с помощью которых припой растекается равномерно по месту спайки. Среди основных флюсов выделяют канифоль и паяльную кислоту. Первый вариант незаменим при пайке меди и серебра, а кислоту применяют в особо сложных случаях. Как действует паяльная кислота, состав и другие особенности такого вещества — основные вопросы, волнующие многих неопытных новичков.
Если выделить основные рекомендации для успешной пайки с помощью кислоты, то они будут выглядеть следующим образом:
- При выборе подходящего решения необходимо разобраться с типом металла или сплава. При спайке железа, в том числе и оцинкованного, используется уникальная разновидность паяльной кислоты, представленная раствором хлората цинка. Спайка нержавеющей стали проводится с помощью ортофосфорной кислоты для пайки, а также многокомпонентных флюсов. Такой материал, как алюминий не поддаётся спайке , что связано с отсутствием подходящих флюсов, способных растворить оксидную пленку материала. Кислоту нельзя использовать для пайки печатных плат, ведь это повышает риск образования коррозийных элементов и замыкания между проводниками.
- Если вы намерены применить паяльную кислоту для своих целей, можно приобрести её в соответствующем магазине в виде пасты. Тем не менее многие сварщики изготавливают паяльную кислоту своими руками, утверждая, что такое действие не требует особых сложностей.
 Вам нужно взять около 100 мл соляной кислоты, положить в неё кусочки цинка, например, изъятого из батареек, и дождаться завершения химической реакции, в процессе которой произойдёт выделение водорода. Учитывая эту особенность, мероприятие лучше проводить в проветриваемой среде вдали от источников огня. Если пузырьки водорода перестанут подниматься вверх, дайте раствору отстояться до прозрачности, а потом осторожно перелейте его в пузырек. Вот и всё, высокоэффективная паяльная кислота готова.
Вам нужно взять около 100 мл соляной кислоты, положить в неё кусочки цинка, например, изъятого из батареек, и дождаться завершения химической реакции, в процессе которой произойдёт выделение водорода. Учитывая эту особенность, мероприятие лучше проводить в проветриваемой среде вдали от источников огня. Если пузырьки водорода перестанут подниматься вверх, дайте раствору отстояться до прозрачности, а потом осторожно перелейте его в пузырек. Вот и всё, высокоэффективная паяльная кислота готова.
Инструкции по использованию
- Непосредственно перед спайкой требуется зачистить поверхность напильником или наждачной бумагой, что позволит избежать всевозможных загрязнений.
- На место спайки следует нанести кислоту, для чего можно использовать кисточку. Дальше требуется покрыть спаиваемую конструкцию припоем, выполненным на основе олова или его сплава. Если вещество не ложится равномерно, придётся повторить обработку кислотой ещё раз.

- На следующем этапе осторожно спаяйте поверхности. Работая с нагретым паяльником, не забывайте о правилах безопасности и старайтесь не захламлять рабочую зону материалами, которые очень быстро возгораются.
- После завершения процедуры кислоту следует нейтрализовать , применяя щелочь, например, раствор соды, а затем промыть место спайки, чтобы избавиться от остатков кислоты. В редких случаях роль флюса выполняет ацетилсалициловая кислота, правда её использование требует более сложного подхода.
Особенности пайки металлов
Серебро
Если вам приходилось работать с паяльником, то вы знаете, что пайка — это своеобразный вид неразъёмного соединения металлических изделий посредством легкоплавкого металла. Сама технология подбирается с учётом типа металлов, которые подлежат пайке, а также окружающих условий, где будет выполнено действие. Для примера, обработка печатных плат из какой-нибудь электроники и ремонт ювелирных изделий из серебра существенно отличаются друг от друга.
Для примера, обработка печатных плат из какой-нибудь электроники и ремонт ювелирных изделий из серебра существенно отличаются друг от друга.
При такой пайке вам следует воспользоваться паяльником, припоем, а также флюсом, в качестве которого используется колофоний.
Пошаговая инструкция выглядит так:
- Не секрет, что для пайки элементов с высоким содержанием серебра применяется припой, в котором присутствует около 60% олова и 40% свинца, который способен расплавляться при температурном режиме 180 градусов Цельсия. Постарайтесь приготовить припой, который будет незаменимым для спайки электронных схем. Такое изделие представляет собой тонкие трубки, которые заполнены смолой и выполняют роль флюса.
- Поверхность, которая будет поддаваться пайке, должна быть предварительно очищена от любых дефектов и неровностей, которые могут появиться при воздействии оксидной пленки. В таком случае нагретый припой сможет создать эффективное соединение с серебром.

- Деталь в зоне пайки прогревают до таких температур, чтобы началось естественное плавление припоя. Однако на данном этапе не избежать некоторых трудностей, которые могут быть связаны с недостаточным запасом мощности паяльника для достаточно качественного прогрева. При пайке серебряных изделий важно защитить место от возможных воздействий кислорода воздуха. В данном случае используется колофоний, способный создать над местом пайки защитную пленку.
- Что касается пайки ювелирных изделий, то её проводят посредством высокотемпературных припоев, которые соответствуют пробе металла, или с помощью припоев более низкой пробы, но содержащих серебро. Пайка ювелирных изделий оловом необходима лишь в самых крайних случаях, и только после предварительного соглашения всех деталей с владельцем кольца, цепочки, браслета или прочего изделия. Если не знать, как правильно выполнять такое действие, это может стать причиной повреждения дорогостоящей конструкции.
Платы
Не секрет, что запаивание радиодеталей в платы — процесс несложный . Его гораздо проще выполнить, чем соединить свободные провода, т. к. отверстия в платах предназначаются для фиксации припаиваемых деталей. Однако нужно понимать, что конечный результат напрямую связан с опытом и ответственностью рабочего. Первую схему, которую собирают на макетной плате, нельзя назвать очень удачной. Но не стоит переживать — через какое-то время качество соединений существенно вырастет.
Его гораздо проще выполнить, чем соединить свободные провода, т. к. отверстия в платах предназначаются для фиксации припаиваемых деталей. Однако нужно понимать, что конечный результат напрямую связан с опытом и ответственностью рабочего. Первую схему, которую собирают на макетной плате, нельзя назвать очень удачной. Но не стоит переживать — через какое-то время качество соединений существенно вырастет.
Пошаговая инструкция и особенности такой пайки состоят в следующих моментах:
- Основная цель предстоящей работы заключается в эффективном соединении микросхемы с платой, чтобы получилась равномерно хорошая спайка. Мероприятие можно разделить на несколько отдельных этапов.
- Для начала необходимо одновременно подвести припой и жало уже прогретого инструмента к зоне, где требуется соединение. Важно соблюдать ключевое правило, делая так, чтобы жало паяльника полностью соприкасалось с обрабатываемым выводом и самой платой.

- При обработке нельзя менять положение жала паяльника, до момента, пока всё место контакта не покроется равномерным слоем припоя. В большинстве случаев на это уходит от 0,5 до 1 секунды. Такой временной промежуток обеспечивает достаточный нагрев места пайки.
- На следующем этапе вам нужно обвести жало инструмента возле обрабатываемого контакта по полукругу, передвигая во встречном направлении припой. Таким же образом следует нанести на место пайки ещё один миллиметр припоя. За этот период выбранный участок прогреется достаточно хорошо, поэтому расплавившийся под воздействием поверхностного натяжения припой распределится по контактной площадке равномерным образом.
- После успешного нанесения необходимого количества припоя на выбранное место, можно отвести проволоку от спаиваемой зоны.
- И на последнем этапе следует осуществить быстрый отвод жала в сторону. За небольшой временной промежуток жидкое вещество, с небольшим слоем флюса, обретет окончательную форму и застынет, создав прочное соединение.

Важно понимать, что при достаточном прогревании жала, действие не займёт больше 1 секунды. Старайтесь оттачивать своё мастерство и следуйте за рекомендациями профессионалов. Таким образом вы сможете достичь невероятных успехов.
Медь
Научится паять может каждый мужчина, ведь такая процедура не требует особых навыков или секретов. В любом случае умение проводить пайку может стать очень полезным и пригодиться в быту, где требуется соединять провода и детали электросхем, ремонтировать радиатор автомобиля, а также монтировать медные элементы трубопровода.
Не секрет, что медь относится к тем материалам, которые очень хорошо поддаются пайке. К тому же поверхность изделий из этого металла с лёгкостью очищается от оксидной пленки, загрязнений, неровностей и прочих дефектов без использования дорогостоящих химикатов, и агрессивных средств. Большинство металлов легкоплавкого типа отличаются превосходной адгезией (сцеплением поверхностей) с медью, и не требуют использования дорогих или сложных флюсов. Медь практически не вступает во взаимодействие с воздухом при нагревании.
Медь практически не вступает во взаимодействие с воздухом при нагревании.
За счёт таких уникальных свойств , металл можно паять в самых различных окружающих условиях, применяя различные типы флюсов и припоев.
Чтобы провести пайку деталей, следует использовать электрические паяльники или паяльные станции с разной мощностью. Известно, что чем больше масса и объём детали, тем выше должны быть показатели мощности рабочего инструмента. Если вы никогда раньше не практиковали пайку, возможно, лучшим решением станет устройство мощностью 25−50 Вт.
Другие особенности пайки
На этапе обучения у многих новичков возникает вопрос: «а что такое припой и флюс». Припой представляет собой распространенную разновидность легкоплавкого металла, который требуется для успешной пайки радиосхем, элементов электроники и ювелирных изделий. Чаще всего припой создаётся из олова, но в чистом виде такой металл стоит недешево, поэтому его используют лишь для лужения и пайки посуды, которая применяется для хранения и приготовления еды. При необходимости выполнить пайку проводов и электросхем, задействуется вариант оловянно-свинцового припоя.
При необходимости выполнить пайку проводов и электросхем, задействуется вариант оловянно-свинцового припоя.
При выполнении паяльных работ вам могут понадобиться такие инструменты и принадлежности:
- подставка под паяльное устройство;
- бокорезы;
- плоскогубцы;
- пинцет;
- канцелярский нож;
- тиски;
- оловоотсос или оплетка из меди.
Сам процесс пайки включает в себя несколько действий:
- Зачистку выбранной зоны до блеска.
- Окунание жала паяльника в канифоль для более эффективной очистки.
- Плотное прижимание соединяемых элементов друг с другом.
- Затем требует приложить к месту соединения таких частей паяльник с небольшим количеством припоя на конце.
- Дальше жалом паяльника нужно провести по детали или проводу, делая это максимально быстро, чтобы избежать выгорания канифоли на жале.

- Место пайки следует тщательно прогреть, чтобы канифоль при плавлении покрыл всю поверхность детали, а припой заполнил зазор между деталями.
- Не забудьте удалить излишек припоя с помощью паяльника или оловоотсоса. Также не помешает применение оплетки.
Если все операции выполнены в точности установленными правилами, твёрдость припоя станет максимальной, а его распределение будет равномерным.
Если на этапе затвердевания припоя спаянные детали перемещались с места, скорее всего, пайка недостаточно хорошая. Чтобы избежать такого хода событий, достаточно научится не допускать многих ошибок.
Заключение
Учитывая вышеизложенную информацию, можно с уверенностью заявить, что при желании и наличии соответствующего руководства, постичь все секреты мастерства пайки можно за несколько часов и экспериментов. Главное — не сдаваться при столкновении с ошибками и неприятностями. В бытовых условиях можно научится паять самыми различными способами, что позволит добиться максимально качественного крепления деталей и герметичности ёмкостей. Сегодня с помощью паяльной кислоты можно успешно соединить практически все разновидности металлов и сплавов, электрические провода, корпуса радиаторов автомобиля, посуду из металла и множество других предметов повседневного обихода.
Сегодня с помощью паяльной кислоты можно успешно соединить практически все разновидности металлов и сплавов, электрические провода, корпуса радиаторов автомобиля, посуду из металла и множество других предметов повседневного обихода.
Зачем нужна кислота при пайке
Практически у каждого, кто учился паять самостоятельно, на первых порах случались неудачи. То припой не желал прилипать к заготовкам и деталям, то спаянный шов вдруг распадался. Не зная технологии паяльных работ, трудно догадаться, почему так происходит. Справиться с проблемой помогает кислота для пайки, снимающая окислы, и способствующая отличному соединению. Чтобы подготовить детали к накладыванию припоя, необходимо очистить их от частиц посторонних материалов — пыли, песка, воды.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Зачем нужна кислота при пайке
- Паяльная кислота и ее применение при пайке проводов в распределительных коробках
- Зачем нужна паяльная кислота
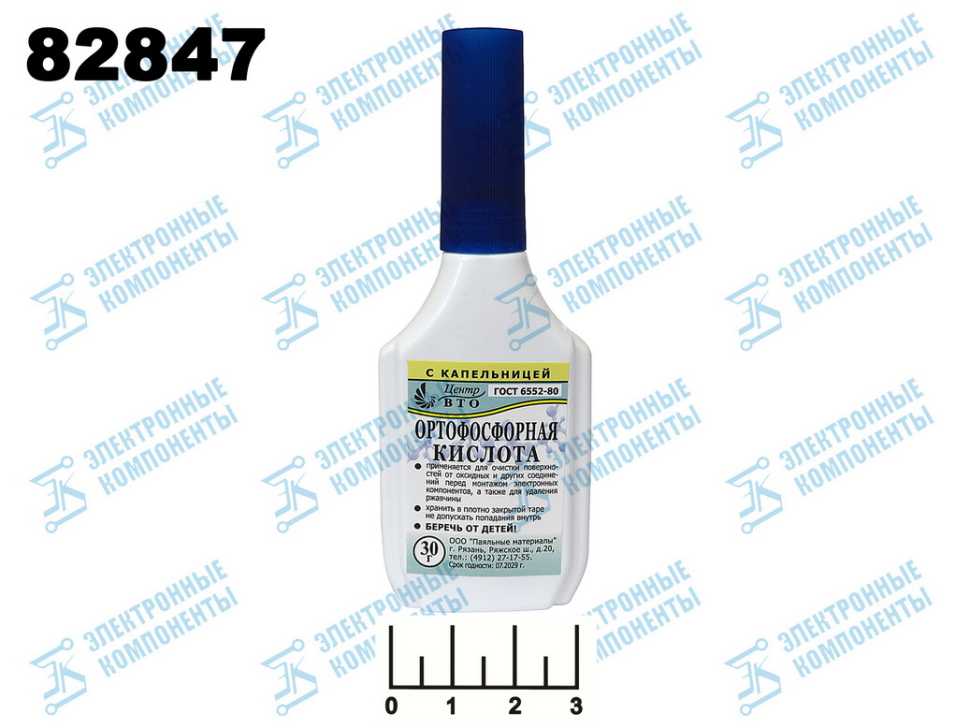
- Паяльная кислота ортофосфорная
- Состав паяльной кислоты и назначение
- Зачем нужна кислота при пайке
- Для чего нужна паяльная кислота
- Как использовать паяльную кислоту
- Флюс (пайка)
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Чем лучше паять канифолью или флюсом: полезное видео от Интернет-магазина Electronoff
Зачем нужна кислота при пайке
Любой домашний мастер, работающий с радиоэлектроникой, умеет пользоваться паяльником. Дело в том, что в отличие от сварки, соединение с помощью припоя требует более тщательной подготовки соединяемых поверхностей. Расплавленный припой ведет себя как обыкновенная жидкость. Почему так происходит? На поверхности любого металла образуются окислы. Эта тонкая пленка не дает металлам вступить в нормальный физический контакт.
Разумеется, поверхность можно механически зачистить перед пайкой. Но при нагреве оксидная пленка моментально покроет подготовленную поверхность. Против этого эффекта и работает флюс. Кроме очищающей функции, флюсы создают защитную пленку на металлах, препятствующую появлению окислов. Напротив, она с применением флюсов только усиливается.
В результате мы получаем прочное соединение с отличной электропроводностью.
Покупая подобные составы, неопытные мастера сталкиваются с несовместимостью флюса и обрабатываемого металла. Например, кислота для пайки нержавейки плохо обрабатывает медные контакты. А состав, который используется для меди и серебра, не подходит к алюминиевым деталям.
Поэтому многие радиолюбители предпочитают использовать самодельные составы. Паяльная кислота своими руками изготавливается из доступных материалов. Чтобы не испортить изделие, и в то же время получить качественный очиститель окислов, необходимо знать, для чего нужна каждая паяльная кислота.
В самый неподходящий момент соединение распадется. Второй вариант проблемы — применение неправильно подобранной кислоты приводит к образованию тончайшего диэлектрического слоя в месте пайки.
Прочность соединения может быть высокой, а вот параметры электропроводности будут нарушены. Этот контакт станет слабым звеном всей схемы. Найти неисправность довольно сложно. Заменять паяльную кислоту для определенного металла, составом на основе иного активного элемента, нежелательно.
Применяется для пайки железа. С точки зрения школьного курса химии, это чистый цинк, растворенный в соляной кислоте: то есть, раствор хлористого цинка. Собственно так он и производится: в емкость с гранулированным цинком добавляется раствор соляной кислоты либо концентрат, в зависимости от технического задания , проходит химическая реакция, и состав можно использовать.
Во время реакции выделяется водород, который в смеси с кислородом из воздуха, образует взрывоопасную смесь не говоря о том, что газ сам по себе горюч. После применения, поверхность следует обработать щелочным раствором, для прекращения реакции.
Например — мыльной водой. Незаменимый состав для пайки алюминия. В чистом виде не применяется. Собственно, в чистом виде ее и не бывает. Используется так называемый технический олеин. Для сохранения стабильности вещества, олеиновую кислоту смешивают с иными жирными кислотами. Полученную массу смешивают с йодидом лития, и получается идеальный флюс для алюминиевых сплавов. Для чего нужна паяльная кислота при пайке алюминия? При зачистке механическим способом, моментально нарастает новая пленка.
Технологи много лет ищут, чем можно заменить кислоту. Никакой другой флюс вместо паяльной кислоты не подходит, но можно смешать железные опилки с машинным маслом и растирать точку соединения с одновременным нагревом и добавлением припоя.
Олеиновый флюс выполняет сразу две задачи: растворяет оксидную пленку что весьма непросто , и сохраняет защитный слой до окончания пайки. При нагреве кислота испаряется, но место пайки уже надежно залужено. Изготовить паяльную кислоту на основе олеина, в домашних условиях невозможно.
При нагреве кислота испаряется, но место пайки уже надежно залужено. Изготовить паяльную кислоту на основе олеина, в домашних условиях невозможно.
Но флюс недорогой, и всегда доступен. Пожалуй, самый распространенный кислотный флюс. Основное применение — пайка железных, стальных контактов, и никельсодержащих сплавов. Также этим флюсом хорошо паять чистую медь особенно, если площадь контакта слишком велика. После удаления окислов, флюс покрывает металл прочной эластичной пленкой, препятствующей дальнейшему окислению. При касании жала паяльника, защитная пленка испаряется, давая возможность адгезии припоя.
После завершения пайки, металл, обработанный флюсом, не корродирует. В зависимости от выбранного металла, применяются различные пропорции компонентов. Ортофосфорная кислота смешивается с обычной канифолью, этиловым спиртом, и даже хлористым цинком. В основном, присадки добавляются при создании флюсов, для пайки хромовых и никелевых соединений.
Если вам удастся найти кислоту в чистом виде, вы самостоятельно можете изготовить любой флюс, добавляя доступные компоненты.
Главное преимущество — отличная защита точки пайки от окисления. Флюс можно и даже нужно не удалять, если только нет эстетических требований к работам. Дешевизна и универсальность применения могли бы сделать этот флюс самым популярным. Исключение составляет тот же алюминий. Однако выделения при термической обработке настолько едкие, что для работы обязательно требуется вытяжка. Это ограничивает домашнее применение препарата.
Однако при нормальном проветривании, можно пользоваться даже самостоятельно изготовленным флюсом. Самый простой способ: растереть таблетку аспирина, и посыпать место спайки. При лужении концов провода, достаточно положить жгут на таблетку, и прижать паяльником.
Каждый состав лучше работает с тем или иным металлом. Информацию о том, как пользоваться кислотами, вы найдете на этикетке. При изготовлении флюса самостоятельно, вопросы безопасности также стоят на первом месте. Общее правило: добавляйте кислоту в остальные компоненты, а не наоборот. Промывка деталей после обработки нужна не всегда, в ряде случаев, кислотный состав напротив, защищает место пайки.
Каждый, кто умеет паять знает, что кроме хорошего, проверенного паяльника для работы требуется еще качественный припой и флюс. В качестве припоя обычно выступает сплав олова и свинца, выполненный в виде проволоки. Толщина проволоки, а также количественные пропорции состава могут изменяться в зависимости от назначения припоя. В качестве флюса для пайки в домашних условиях чаще всего выступает канифоль.
Помимо канифоли, распространено лужение паяльной кислотой. С ее помощью можно паять различные изделия из алюминия, бронзы, нержавейки, латуни, никеля и стали. О видах и способах применения паяльной кислоты пойдет речь далее. Их основное назначение — убрать с области пайки различные загрязнения и продукты окисления, создать условия для качественного, равномерного растекания припоя по рабочей поверхности.
Этим достигается надежное соединение двух деталей с аккуратным швом. Кроме этого, применение кислотного флюса препятствует образованию окислов в процессе эксплуатации изделия, что положительно сказывается на долговечности соединения. Обратите внимание! Пользоваться кислотным флюсом для работы с электронными платами категорически запрещено.
Кроме разрушающего действия на хрупкие элементы, кислота способна создать дополнительные токопроводящие каналы, что неизбежно приведет к выходу платы из строя.
Обычно ортофосфорная кислота бесцветна. В некоторых случаях обладает светло-желтым оттенком. Изредка встречается состав, имеющий несколько мутный цвет, что не является нарушением или показателем плохого качества продукта. Отметим, что ортофосфорный флюс — материал неорганического происхождения.
Паяльная кислота и ее применение при пайке проводов в распределительных коробках
Флюс лат. Паяльный флюс не должен взаимодействовать с припоем , кроме флюсов для реактивно-флюсовой пайки. В зависимости от технологии , флюс может использоваться в виде жидкости, пасты или порошка. Существуют также паяльные пасты , содержащие частицы припоя вместе с флюсом; иногда трубка из припоя содержит внутри флюс-заполнитель. Остатки разных флюсов могут быть как диэлектриками, так и проводить электричество. Даже такой флюс, как глицерин , необходимо отмывать от печатной платы, так как он обладает хорошей гигроскопичностью, вследствие чего место пайки быстро окисляется.
Паяльная кислота нужна для удаления пленки оксида и подготовки поверхности детали к пайке. Для чего при сварке нужен кислородный баллон. Как правило, это пайка и лужение меди, серебра и различных сплавов железа.
Для чего при сварке нужен кислородный баллон. Как правило, это пайка и лужение меди, серебра и различных сплавов железа.
Зачем нужна паяльная кислота
Опытные мастера — электронщики и домашние радиолюбители знают, что для качественного соединения понадобится не только паяльник, но и дополнительные аксессуары. Для пайки используется флюс и припой, последний выполнен на основе свинца и олова, зачастую предлагается в виде проволоки. Характеристики соотношения проволоки, флюса могут отличаться по параметрам, зависимым от типа изделия. В качестве второго компонента выступает флюс, распространенная форма применяется в виде канифоли. Она помогает качественно, быстро спаять детали медного состава, провода и другие материалы. Паяльной кислотой возможно работать с материалами латуни, никеля, нержавейки и т. Категория, к которой попадает паяльная кислота отличается на фоне других реагентов, обладает рядом положительных свойств. В качестве флюса изделие распространяется только в жидком виде, некоторые составы возможно разбавлять для снижения концентрации при взаимодействии с металлом.
Паяльная кислота ортофосфорная
Каждый человек, которому приходилось работать с радиоэлектроникой, неоднократно использовал паяльник для решения своих задач, поэтому он знает, в чём заключается принцип работы подобного оборудования. Но из-за неприятного запаха, издаваемого при обработке конструкции с помощью классического припоя, а также существенных сложностей на разных этапах действия, такая технология не пользуется особым спросом и имеет ряд более простых аналогов. Чтобы сделать предстоящую пайку более продуктивной многие сварщики используют специальные вещества — флюсы, с помощью которых припой растекается равномерно по месту спайки. Среди основных флюсов выделяют канифоль и паяльную кислоту.
Паяльную кислоту ее также называют травленой используют в условиях приготовления или ремонта различных металлических предметов или устройств, когда какие-то части или мелкие детали нужно соединить друг с другом очень прочно.
Состав паяльной кислоты и назначение
Пайка – это соединение деталей между собой, для соединения этих деталей используется два основных компонента, это припой и флюс. Ни один процесс пайки не обходится без таких материалов как припой, флюс, канифоль, некоторые радиолюбители используют паяльные кислоты, различные смеси и прочее. В этой статье о них и поговорим. Припой – это металл или сплав, применяется для соединения и пайки радиодеталей, имеет температуру плавления ниже, чем соединяемые металлы. Припой прочно соединяет радиодетали между собой, растекается по нему и заполняет зазоры или отверстия между соединяемыми деталями.
Ни один процесс пайки не обходится без таких материалов как припой, флюс, канифоль, некоторые радиолюбители используют паяльные кислоты, различные смеси и прочее. В этой статье о них и поговорим. Припой – это металл или сплав, применяется для соединения и пайки радиодеталей, имеет температуру плавления ниже, чем соединяемые металлы. Припой прочно соединяет радиодетали между собой, растекается по нему и заполняет зазоры или отверстия между соединяемыми деталями.
Зачем нужна кислота при пайке
Практически у каждого, кто учился паять самостоятельно, на первых порах случались неудачи. То припой не желал прилипать к заготовкам и деталям, то спаянный шов вдруг распадался. Не зная технологии паяльных работ, трудно догадаться, почему так происходит. Справиться с проблемой помогает кислота для пайки, снимающая окислы, и способствующая отличному соединению. Чтобы подготовить детали к накладыванию припоя, необходимо очистить их от частиц посторонних материалов — пыли, песка, воды.
Что такое паяльная кислота, и зачем она нужна . Чаще всего пайка производится при помощи препаратов на основе соляной или фосфорной кислоты.
Чаще всего пайка производится при помощи препаратов на основе соляной или фосфорной кислоты.
Для чего нужна паяльная кислота
При проведении пайки для предварительной обработки поверхности деталей во многих случаях используют флюсы кислотного характера. Степень активности материала подбирают в зависимости от типа металла и меры его загрязнения. В продаже есть различные средства, состав которых подобран с учетом специфики предстоящей работы. Можно сделать паяльную кислоту в домашних условиях самостоятельно.
Как использовать паяльную кислоту
Паяльные работы предусматривают обязательное использование качественного флюса, который обеспечивает надежное спаивание материала и припоя, а также высокую электропроводность и длительный срок службы. В качестве флюса часто применяют кислоту для пайки. Существует несколько видов таких химических соединений. Состав паяльной кислоты напрямую влияет на область ее применения.
Доброго дня!
Флюс (пайка)
Сколько уже времени прошло Наткнулся на этот пост в чьей-то подборке сохраненного на Пикабу и теперь чувствую себя как путешественник во времени Но все-таки надеюсь что мне ответят на вопрос по теме: я иногда паяю с аллюминевым флюсом, что ты про него скажешь или посоветуешь. Немного информации, которая может быть полезна вам, как в быту, так и в иных сферах жизни. Небольшой урок по пайке. Дубликаты не найдены. Все комментарии Автора. Через какое то время их просто разъест!
Немного информации, которая может быть полезна вам, как в быту, так и в иных сферах жизни. Небольшой урок по пайке. Дубликаты не найдены. Все комментарии Автора. Через какое то время их просто разъест!
Любой домашний мастер, работающий с радиоэлектроникой, умеет пользоваться паяльником. Дело в том, что в отличие от сварки, соединение с помощью припоя требует более тщательной подготовки соединяемых поверхностей. Расплавленный припой ведет себя как обыкновенная жидкость.
Припои и паяльные кислоты. Часть 4
Этот раздел взят из книги «Рецепты и формулы машиностроительного цеха», изданной The Industrial Press. Также доступно на Amazon: квитанции и формулы Machinery’s Shop.
Улучшенная паяльная кислота
Весьма удовлетворительную паяльную кислоту можно приготовить, используя обычную паяльную кислоту в качестве основы и добавляя определенную пропорцию хлорида олова и нашатырного спирта. Это дает кислоту, которая намного превосходит старую форму. Чтобы приготовить один галлон этой паяльной жидкости, возьмите три литра обычной соляной кислоты и растворите в ней как можно больше цинка. Это, как известно, обычная форма кислоты, используемая при пайке. Затем растворите 6 унций нашатырного спирта в пинте теплой воды. В другой пинте растворяют 4 унции хлорида олова. Затем следует смешать три раствора. После смешивания раствор может казаться мутным, и его можно очистить несколькими каплями соляной кислоты, стараясь не добавлять слишком много. Кислота используется так же, как и любая обычная жидкость для пайки. Выяснится, что он не будет разбрызгиваться при воздействии горячего утюга, а также, что при необходимости с ним можно использовать более дешевый припой.
Это дает кислоту, которая намного превосходит старую форму. Чтобы приготовить один галлон этой паяльной жидкости, возьмите три литра обычной соляной кислоты и растворите в ней как можно больше цинка. Это, как известно, обычная форма кислоты, используемая при пайке. Затем растворите 6 унций нашатырного спирта в пинте теплой воды. В другой пинте растворяют 4 унции хлорида олова. Затем следует смешать три раствора. После смешивания раствор может казаться мутным, и его можно очистить несколькими каплями соляной кислоты, стараясь не добавлять слишком много. Кислота используется так же, как и любая обычная жидкость для пайки. Выяснится, что он не будет разбрызгиваться при воздействии горячего утюга, а также, что при необходимости с ним можно использовать более дешевый припой.
Урбана, Иллинойс Т. Е. О’Доннелл.
Как паять алюминий
Большим недостатком алюминия для листового металла является трудность пайки. Это вызвано образованием оксида на поверхности нагретого металла, который препятствует сплавлению припоя с алюминием. Эту трудность можно преодолеть, применив следующий метод:
Эту трудность можно преодолеть, применив следующий метод:
Приготовьте припой из 80% олова и 20% цинка и используйте стеариновую кислоту в качестве флюса. Лудите поверхность указанным выше способом, перемещая медную насадку вперед и назад по металлу и заливая припоем. Пленка оксида затем может быть счищена, а покрытая поверхность легко пропаяна вышеназванным припоем или обычным жестяным припоем. А. Эйлс.
Манчестер, англ.
Золотые припои
Золотые припои, подходящие для 18-каратных работ: Золото, линия, 1 унция; серебро чистое, 144 грана; медная проволока, 06 грамм. (Вес Троя.)
Подходит для работы с 16-каратным золотом. 1 унция; чистое серебро, 144 грана; медная проволока, 168 гран.
Подходит для работы с 15-каратным золотом. 1 унция; чистое серебро, 240 гран; медная проволока, 240 гран.
Подходит для работы с 14-каратным золотом, 1 унция. чистое серебро, 300 гран; медная проволока, 300 гран.
Самый твердый серебряный припой: чистое серебро, 1 унция; дробь медная, 120 гран.
Лучший твердый серебряный припой: чистое серебро, 1 унция; дробь медная, 105 гран; полбы, 15 гран.
Средний серебряный припой: Мелкое серебро, 360 гран; дробь медная, 96 гран; полбы, 24 гран.
Легкий серебряный припой: чистое серебро, 336 гран; дробь медная, 108 гран; полбы, 36 гран. HD Schattle.
Сиракьюс, Нью-Йорк
Паяльная паста
В соответствии с требованиями электротехнической промышленности в некоторых случаях нельзя использовать кислотный паяльный флюс. Флюс, который можно использовать для любых работ, известен как паяльная паста. Для пайки медных проводов и других электрических проводов паста не имеет себе равных и особенно подходит для работ, при которых нежелательны разбрызгивание и коррозия. Смесь для паяльной пасты состоит из определенных пропорций смазки и хлорида цинка. В качестве смазки обычно используется петролатум или вазелин, которые придают пасте нужную консистенцию. Используемые пропорции: петролатум или вазелин, 1 фунт и 1 жидкая унция насыщенного раствора хлорида цинка.
Урбана, Иллинойс Т. Е. О’Доннелл.
Флюс для пайки: кислоты, твердые вещества и растворители
Флюс состоит из двух основных ингредиентов: кислоты для удаления оксидов и вещества или веществ («твердых веществ») для покрытия поверхности и предотвращения доступа кислорода к поверхности после удаления оксидов. Жидкий флюс — это те же ингредиенты в растворителе.
Выбор флюса может быть самым важным решением, которое когда-либо будет приниматься на предприятии, занимающемся сборкой электроники. Правильный флюс может сэкономить огромные расходы, включая, помимо прочего, дефекты припоя, очистку и отказы продукта. Тем не менее, флюсы сложны, и правильный выбор включает в себя навигацию по химическому минному полю, осложненному иногда причудливой терминологией и, слишком часто, сомнительной маркетинговой практикой некоторых известных производителей флюсов.
Это вторая из трех частей объяснения флюсов: что они делают, как они это делают и какой из них лучше всего подходит для различных приложений. Если вы читали часть 1, значит, вы знакомы с основами флюса и готовы к особенностям выбора флюса, который значительно облегчит вашу жизнь при пайке. Если вы не читали часть 1 о флюсе для пайки, это действительно лучшее место для начала.
Если вы читали часть 1, значит, вы знакомы с основами флюса и готовы к особенностям выбора флюса, который значительно облегчит вашу жизнь при пайке. Если вы не читали часть 1 о флюсе для пайки, это действительно лучшее место для начала.
Течение припоя известно как смачивание и происходит только в том случае, если припой наносится на поверхность из чистого элементарного металла. Элементарный металл нестабилен и обладает энергией для притяжения припоя (межатомное притяжение). Однако окисленному металлу не хватает этой энергии, и он не допускает смачивания. За исключением золота, все поверхности компонентов окисляются, и этот оксид должен быть полностью удален, а раскисленная поверхность защищена от повторного окисления перед нанесением припоя. Удаление оксидов и предотвращение повторного окисления является ролью флюса.
Флюс состоит из двух основных ингредиентов: кислоты для удаления оксидов и вещества или веществ («твердых веществ») для покрытия поверхности и предотвращения доступа кислорода к поверхности после удаления оксидов. Жидкий флюс — это те же ингредиенты в растворителе.
Жидкий флюс — это те же ингредиенты в растворителе.
B журнал написан:
Джеймс А. (Джим) Смит, доктор философии ABD, президент Electronics Manufacturing Sciences, Inc.0002
Кислоты
Часть флюса, удаляющая оксиды, которую промышленность по причинам, утерянным в древности, настаивает на том, чтобы называть их «активаторами», почти всегда представляет собой кислоту либо непосредственно, либо в составе соединения, выделяющего кислоту при нагревании. . Для описания кислотности потока используется термин «активность». Чаще всего кислоты являются органическими (то есть содержат углерод). Неорганические кислоты (соединения водорода с неметаллами), такие как соляная или бромистоводородная, обладают исключительными свойствами удаления оксидов, но несовместимы с надежностью электроники; они оставляют высокопроводящие и вызывающие коррозию остатки, которые могут вызвать сбои в работе электрооборудования. Неорганические кислоты в форме галогенидов (обсуждаемые ниже) встречаются в некоторых флюсах для электроники, но в очень низких концентрациях и только в дополнение к большим количествам органических кислот.
Сила кислоты определяется содержанием в ней ионов водорода; больше ионов водорода соответствует большей кислотности. При раскислении (взаимодействии кислоты с оксидом металла, основанием) водород из кислоты соединяется с отщепленным от оксида кислородом с образованием воды, а другие элементы кислоты соединяются с металлом с образованием солей металлов. Более сильные кислоты обычно притягивают кислород с большей силой, чем более слабые кислоты. Большее притяжение означает, что более сильные кислоты обладают большей раскисляющей способностью (способны удалять большее количество оксидов быстрее, чем более слабые кислоты, и способны удалять оксиды из большего числа металлов, чем более слабые кислоты).
Сильные и слабые кислоты Давайте сделаем паузу, чтобы извиниться перед химиками за использование слов «сильный» и «слабый» применительно к кислотности. Для наших целей мы можем думать, что «сильные» кислоты просто более мощные, чем «слабые». Но химики не думают о силе действия, когда классифицируют кислоты как сильные или слабые. Для них сильными кислотами являются те, которые распадаются на составные части («ионизируются») при добавлении в воду. Слабые кислоты не ионизируются полностью, в отличие от сильных кислот. Эта специальная терминология вызывает значительную путаницу у нехимиков, когда лаборатории, проверяющие чистоту схемных узлов, сообщают, что отказы происходят из-за чрезмерного количества слабых кислотных остатков.
Для них сильными кислотами являются те, которые распадаются на составные части («ионизируются») при добавлении в воду. Слабые кислоты не ионизируются полностью, в отличие от сильных кислот. Эта специальная терминология вызывает значительную путаницу у нехимиков, когда лаборатории, проверяющие чистоту схемных узлов, сообщают, что отказы происходят из-за чрезмерного количества слабых кислотных остатков.
Водные растворы содержат водород в двух формах: ионы водорода [H + ][1] и ионы гидроксония [H 3 O + ]. Атом водорода (Н) состоит из одного протона и одного электрона. Ион водорода (H + ) — это просто протон (и его часто называют протоном, а не ионом водорода). Ионы водорода обладают высокой реакционной способностью и могут быть донорами протонов или реципиентами электронов в химических реакциях.
Растворы, содержащие больше H + , чем H 3 O + , являются кислотами, а растворы с меньшим количеством относительных ионов водорода являются основными. Концентрация H + выражается как pH, отрицательный логарифм ионов водорода на литр – pH = −log 10 [H + ], где [H + ] представляет собой концентрацию ионов водорода в молях (M ).[2] Шкала pH варьируется от 0 до 14, где 7,0 означает нейтральное значение.[3][4] Числа меньше 7,0 (более высокие концентрации H + ) являются кислыми, а более 7,0 — основными.
Концентрация H + выражается как pH, отрицательный логарифм ионов водорода на литр – pH = −log 10 [H + ], где [H + ] представляет собой концентрацию ионов водорода в молях (M ).[2] Шкала pH варьируется от 0 до 14, где 7,0 означает нейтральное значение.[3][4] Числа меньше 7,0 (более высокие концентрации H + ) являются кислыми, а более 7,0 — основными.
Это очень упрощенный взгляд на кислоты. На самом деле существует три разных определения кислоты, два из которых относятся исключительно к водороду, а третье определяет кислоту таким образом, что водород не требуется. Для наших целей туда идти не обязательно.
рН по сравнению с кислотным числом Люди, не являющиеся химиками, часто думают о силе кислоты с точки зрения рН, но по большей части рН не имеет значения, когда речь идет о потоке. По причинам, о которых мы поговорим позже, растворителем большинства жидких флюсов является спирт, а не вода, в то время как pH относится только к растворам на водной основе. Для растворов, не основанных на воде, соответствующей мерой прочности является «кислотное число», количество миллиграммов гидроксида калия (основания), необходимое для нейтрализации грамма кислого вещества. Для целей, которые здесь имеют значение, кислоты работают одинаково в водных и неводных растворах; отличается только система измерения кислоты.
Для растворов, не основанных на воде, соответствующей мерой прочности является «кислотное число», количество миллиграммов гидроксида калия (основания), необходимое для нейтрализации грамма кислого вещества. Для целей, которые здесь имеют значение, кислоты работают одинаково в водных и неводных растворах; отличается только система измерения кислоты.
«Сила» кислоты зависит от концентрации ионов водорода. Более низкая концентрация (содержание по общему объему) кислоты будет иметь более низкий pH или кислотное число, чем более высокая концентрация той же кислоты. Это важно в отношении использования очень реакционноспособных галогенидов в потоках электроники, обсуждаемых ниже.
Флюс с нейтральным pH Доступны флюсы с маркировкой «нейтральный pH», в том числе флюсы некоторых известных марок. И они чрезвычайно эффективны для удаления оксидов, способных раскислять некоторые из наименее поддающихся пайке металлов.[5] Как что-то «нейтральное» (что, в конце концов, означает нереактивное) может удалять оксиды? Ответ, конечно же, заключается в том, что они не являются «нейтральными» при всех температурах.
Нейтральные потоки бывают двух видов. Первый остается нейтральным соединением, но при нагревании образует кислоты. Кислоты очень сильные и поэтому отлично подходят для раскисления. Но образуются высокопроводящие и вызывающие коррозию ионные остатки, которые необходимо удалять после пайки.
Второй тип начинается с высокой кислотности, но нейтрализуется реакцией с кислородом при высоких температурах. Проблема в том, что бывают ситуации, когда не весь флюс достигает температуры нейтрализации и любой флюс в полостях или под компонентами вытесняет воздух (и кислород), необходимый для нейтрализации.
Оба типа нейтрального флюса требуют смывания после пайки. Остатки водорастворимы и могут быть удалены водой , если вода может достичь остатков . Это не точно. Флюс имеет низкое поверхностное натяжение, что позволяет ему проникать в труднодоступные места. На самом деле очень важна способность флюса попадать в те пространства, которые требуют раскисления. Но вода имеет очень высокое поверхностное натяжение и не может достичь потока в полостях. Кроме того, водопроводная вода, как и флюс, содержит проводящие и потенциально вызывающие коррозию ионы, которые снижают надежность. Для очистки должна использоваться вода, из которой удалены ионы («деионизированная» вода). Но поверхностное натяжение деионизированной воды больше, чем поверхностное натяжение водопроводной воды, что увеличивает вероятность того, что промывочная вода не достигнет всех остатков флюса.
Кроме того, водопроводная вода, как и флюс, содержит проводящие и потенциально вызывающие коррозию ионы, которые снижают надежность. Для очистки должна использоваться вода, из которой удалены ионы («деионизированная» вода). Но поверхностное натяжение деионизированной воды больше, чем поверхностное натяжение водопроводной воды, что увеличивает вероятность того, что промывочная вода не достигнет всех остатков флюса.
Раскисление является эндотермической химической реакцией и происходит быстрее при более высоких температурах. Хотя некоторые сильные кислоты могут удалять некоторые оксиды при комнатной температуре, все кислоты работают быстрее при нагревании, а кислоты во флюсе электроники обычно не начинают работать, пока не нагреются. Минимальная температура, при которой кислота начинает работать, называется «температурой активации». Температура активации часто находится в диапазоне 150°F/65°C, но это только начальная точка.
Во многих случаях флюсовые кислоты изначально представляют собой инертные соединения при комнатной температуре. Они должны быть нагреты, чтобы разрушиться и сформировать кислоты.
Они должны быть нагреты, чтобы разрушиться и сформировать кислоты.
Хотя флюсы в основном основаны на кислотах для удаления оксидов, некоторые также содержат небольшие количества галогенидов металлов для усиления действия кислоты. Хлорид натрия (поваренная соль) является обычным галогенидом, хотя и не обнаруженным во флюсе. Во флюсе используются только соединения хлора и брома, но есть несколько возможностей, и нет никакого способа узнать, какой галогенид находится во флюсе. Когда галогенид сталкивается с водой (один из побочных продуктов раскисления, когда водород кислоты соединяется с кислородом из оксида), он разделяется на ион металла и анион галогена, обычно либо хлорид, либо бромид. Интересно, что галоген является основанием, подобным оксиду металла, а не кислотой, но он энергично атакует оксид. Почему и как? Ответ не ясен. Ученые до сих пор спорят о причине, по которой галогены атакуют оксид металла (возможно, потому, что галоген является более сильным основанием, чем оксид, но это не доказано).
Известно, что небольшое количество галогена (от разложения галоида) усиливает работу флюсовых кислот. Также известно, что галогены несут сильный электрический заряд, который в больших количествах разрушает электронные схемы. Чтобы флюс считался не содержащим галогенидов в соответствии с J-STD-004B, действующей системой классификации, флюс должен содержать менее 0,05% галогенида по объему (то есть для жидкого флюса объем без учета растворителя). Это очень сложный уровень, и большинство флюсов, пригодных для использования в производстве надежных продуктов, не соответствуют статусу безгалогенных. Однако флюсы высокой надежности содержат менее 0,5% галогенидов по объему.
Проблема ионного загрязнения В идеальном мире использование сильных кислот и галогенидов не привело бы к негативным последствиям. Однако наш мир не идеален, и как кислота, так и галогениды создают серьезные проблемы с надежностью. Кислотные и галогенидные остатки являются ионными, и их остатки после пайки называются «ионными загрязнениями». Ионные означает, что они являются электрическими проводниками и потенциально коррозионными. В целом, хотя и не абсолютно, проводимость и коррозионная активность увеличиваются с увеличением силы кислоты или основания.
Ионные означает, что они являются электрическими проводниками и потенциально коррозионными. В целом, хотя и не абсолютно, проводимость и коррозионная активность увеличиваются с увеличением силы кислоты или основания.
Проводящие остатки могут позволить электрическому току течь между не общими проводниками («утечка тока»), а не через схему. Большинство сборок электроники могут допустить некоторую утечку тока, но все сборки имеют пределы, легко превышающие ионные или анионные остатки относительно мягких флюсов. Более высокие уровни ионов (больший ионный заряд и/или большее количество ионного материала) могут способствовать образованию дендритов. И даже более высокие уровни ионов могут вызвать коррозию.
Классификация прочности флюса Флюсы для электроники классифицируются как низко-, средне- или высокоактивные (обозначаются L, M и H) на основе проводимости и коррозионной активности их остатков после пайки. Правила изложены в отраслевом документе J-STD-004B, выпущенном торговой ассоциацией IPC. Коррозионную активность определяют, нанося флюс на тонкий слой меди на стеклянной пластине и наблюдая, проникает ли флюс через медь и в какой степени, оставляя только стекло. (Там, где медь удалена, можно увидеть сквозь стеклянную подложку.) С проводимостью сложнее.
Коррозионную активность определяют, нанося флюс на тонкий слой меди на стеклянной пластине и наблюдая, проникает ли флюс через медь и в какой степени, оставляя только стекло. (Там, где медь удалена, можно увидеть сквозь стеклянную подложку.) С проводимостью сложнее.
Процедура определения проводимости довольно сложна, но, по сути, и очень в целом, шаги таковы: гребенчатый узор из тонких следов, расположенных на расстоянии 0,020 дюйма или 0,508 мм друг от друга).
Образец для проверки проводимости с гребенчатым рисунком (IPA-B-24)
- Пропустите образцы через печь оплавления, настроенную на нормальную рабочую температуру, или через волну припоя
- Очистка некоторых обработанных купонов
- очищенных и неочищенных купонов
- Поместите чистые и неочищенные купоны в климатическую камеру при температуре 40°C и относительной влажности 90%
- Подайте ток и измерьте изменение SIR через 96 часов и через 7 дней
- Flux проходит тест, если:
- SIR не падает ниже 100 МОм в любой точке и
- SIR не падает ниже 1000 МОм через 96 часов до завершения испытания и
- Дендриты (электрические мостики между необычными проводниками, образованные миграцией положительно заряженных ионов металла, мигрирующих к отрицательно заряженному проводнику) не образуются
Флюсы, пробы которых проходят испытание на проводимость без очистки и не прорывают какую-либо зону покрытия при испытании медным зеркалом, классифицируются как низкоактивные (L). Некоторые флюсы средней активности (M) пробивают до 50% площади покрытия медного зеркала, но могут пройти испытание на проводимость без очистки, но большинство из них требуют очистки для прохождения испытания на проводимость. Потоки H пробивают более 50% площади покрытия медного зеркала и требуют очистки для прохождения теста на проводимость. Флюсы, которые не могут пройти тест на электропроводность, сильнее H и не подходят для использования в электронных узлах.
Некоторые флюсы средней активности (M) пробивают до 50% площади покрытия медного зеркала, но могут пройти испытание на проводимость без очистки, но большинство из них требуют очистки для прохождения испытания на проводимость. Потоки H пробивают более 50% площади покрытия медного зеркала и требуют очистки для прохождения теста на проводимость. Флюсы, которые не могут пройти тест на электропроводность, сильнее H и не подходят для использования в электронных узлах.
Тест на электропроводность имеет несколько критических недостатков. Самое главное, нагревание флюса в печи для оплавления или в системе для пайки волной припоя может нейтрализовать органические кислоты. При достаточной температуре (150°C и выше) в присутствии кислорода (воздух, который нас окружает) органические кислоты окисляются и становятся нейтральными. Другими словами, флюсовые кислоты могут быть нейтрализованы перед проведением испытаний проводимости и дендритов. Сторонники процедуры классификации утверждают, что флюс превысит температуру нейтрализации во время нанесения припоя. Критики (включая меня) отмечают, что это никоим образом не гарантируется. Например, флюс, который не находится в контакте с паяльником, может никогда не нагреться выше комнатной температуры. Флюс, попавший в полости или под компоненты для поверхностного монтажа, вытесняет кислородсодержащий воздух и не окисляется независимо от температуры, в которой они находятся. Существуют и другие сценарии, при которых флюс не достигает температуры нейтрализации. Еще больше замутняя воду, группа флюсов использует соединения, изначально нейтральные, но образующие очень сильные кислоты при достижении достаточно высокой температуры, которая может быть больше пиковой температуры при обработке исследуемых образцов.
Сторонники процедуры классификации утверждают, что флюс превысит температуру нейтрализации во время нанесения припоя. Критики (включая меня) отмечают, что это никоим образом не гарантируется. Например, флюс, который не находится в контакте с паяльником, может никогда не нагреться выше комнатной температуры. Флюс, попавший в полости или под компоненты для поверхностного монтажа, вытесняет кислородсодержащий воздух и не окисляется независимо от температуры, в которой они находятся. Существуют и другие сценарии, при которых флюс не достигает температуры нейтрализации. Еще больше замутняя воду, группа флюсов использует соединения, изначально нейтральные, но образующие очень сильные кислоты при достижении достаточно высокой температуры, которая может быть больше пиковой температуры при обработке исследуемых образцов.
При выборе флюса рекомендуется начать с рейтинга J-STD-004B; это экономит много времени, которое в противном случае могло бы быть потрачено на оценку совершенно неподходящих флюсов. Однако сохранность флюса в чистом виде (не нагретом) также должна учитываться . Многие флюсы, квалифицируемые J-STD-004B как низкоактивные, имеют подозрительно высокие кислотные числа, и не весь этот флюс в каждой области печатной платы будет подвергаться значительному нагреву во время пайки. К сожалению, информация о проводимости потока перед нагревом обычно отсутствует.
Однако сохранность флюса в чистом виде (не нагретом) также должна учитываться . Многие флюсы, квалифицируемые J-STD-004B как низкоактивные, имеют подозрительно высокие кислотные числа, и не весь этот флюс в каждой области печатной платы будет подвергаться значительному нагреву во время пайки. К сожалению, информация о проводимости потока перед нагревом обычно отсутствует.
Проводимость остатков флюса имеет огромное значение. Отказы происходят, когда слишком много электричества предпочитает протекать через остатки кислоты между не общими проводниками, а не по схеме. Степень утечки тока «слишком велика» зависит от требуемой точности используемого продукта и среды, в которой продукт должен работать. (Проблемы с ионным загрязнением возрастают по мере увеличения влажности. Сборка, находящаяся в пустыне, будет гораздо меньше подвержена ионному загрязнению, чем такая же сборка в болоте.)
Еще немного о галогенидах Галогениды имеют особое значение в классификации флюсов. Поскольку остатки галогенидов обладают высокой электропроводностью и вызывают коррозию, флюсы, содержащие галогениды, классифицируются отдельно от флюсов, не содержащих галогенидов («не содержащие галогенидов»). Флюсы, содержащие галогениды, также классифицируются по процентному содержанию галогенидов. Только флюсы, содержащие менее 0,05 % галогенидов по объему (исходя из содержания флюса без растворителя), могут быть классифицированы как не содержащие галогенидов. Галогенные флюсы с низкой активностью содержат менее 0,5% галогенидов по объему. Предельное содержание галогенидов для галогенидных флюсов средней активности составляет менее 2,0%. Высокоактивные галогенидные флюсы содержат 2% или более галогенидов. Это приводит к шести уровням активности: L0, L1, M0, M1, H0 и h2, где 0 означает отсутствие галогенов и 1 — содержание галогенидов в указанных пределах.
Поскольку остатки галогенидов обладают высокой электропроводностью и вызывают коррозию, флюсы, содержащие галогениды, классифицируются отдельно от флюсов, не содержащих галогенидов («не содержащие галогенидов»). Флюсы, содержащие галогениды, также классифицируются по процентному содержанию галогенидов. Только флюсы, содержащие менее 0,05 % галогенидов по объему (исходя из содержания флюса без растворителя), могут быть классифицированы как не содержащие галогенидов. Галогенные флюсы с низкой активностью содержат менее 0,5% галогенидов по объему. Предельное содержание галогенидов для галогенидных флюсов средней активности составляет менее 2,0%. Высокоактивные галогенидные флюсы содержат 2% или более галогенидов. Это приводит к шести уровням активности: L0, L1, M0, M1, H0 и h2, где 0 означает отсутствие галогенов и 1 — содержание галогенидов в указанных пределах.
Оксиды должны быть удалены, иначе припой не будет смачиваться. Однако удаление оксидов само по себе недостаточно. Если кислород может достичь раскисленной поверхности, новые оксиды будут мгновенно образовываться, а поверхностная энергия будет потеряна. В дополнение к удалению оксидов флюс должен создавать барьер, предотвращающий доступ кислорода к вновь раскисленному металлу до тех пор, пока не будет нанесен припой. Вот где на помощь приходят твердые вещества.
Если кислород может достичь раскисленной поверхности, новые оксиды будут мгновенно образовываться, а поверхностная энергия будет потеряна. В дополнение к удалению оксидов флюс должен создавать барьер, предотвращающий доступ кислорода к вновь раскисленному металлу до тех пор, пока не будет нанесен припой. Вот где на помощь приходят твердые вещества.
У производителей флюсов есть свой жаргон, например, «активаторы» вместо кислот. Традиционный, но все более редкий жаргон для твердых тел — «носитель», предположительно потому, что кислоты переносятся твердыми телами. «Твердые вещества» более точно отражают роль материала в обеспечении барьера против кислорода.
Роль твердых веществ Твердые вещества существуют только для предотвращения доступа кислорода к раскисленному металлу во время нанесения припоя. Это все. Они не удаляют оксиды. Они не токопроводящие. Они не вызывают коррозии. Они составляют гораздо больший процент объема флюса, чем кислоты. Любые видимые остатки флюса после пайки являются остатками твердых частиц; кислоты не видно. Однако, как известно контрактным производителям, их клиенты не разбираются в науке о пайке и хотят отказаться от сборок с видимыми остатками. (В зависимости от природы твердых частиц они могут вызвать такие проблемы, как загрязнение штифтов испытательного приспособления или нарушение надлежащей адгезии конформного покрытия, но сами по себе они не влияют на целостность продукта. В случае конформного покрытия замена материалов покрытия часто может устранить проблема адгезии.) Из-за давления со стороны неосведомленных клиентов многие контрактные производители приняли рецептуры флюсов, которые не оставляют видимых остатков, и, конечно же, производители флюсов создали новые рецептуры для удовлетворения спроса на невидимые твердые частицы.
Любые видимые остатки флюса после пайки являются остатками твердых частиц; кислоты не видно. Однако, как известно контрактным производителям, их клиенты не разбираются в науке о пайке и хотят отказаться от сборок с видимыми остатками. (В зависимости от природы твердых частиц они могут вызвать такие проблемы, как загрязнение штифтов испытательного приспособления или нарушение надлежащей адгезии конформного покрытия, но сами по себе они не влияют на целостность продукта. В случае конформного покрытия замена материалов покрытия часто может устранить проблема адгезии.) Из-за давления со стороны неосведомленных клиентов многие контрактные производители приняли рецептуры флюсов, которые не оставляют видимых остатков, и, конечно же, производители флюсов создали новые рецептуры для удовлетворения спроса на невидимые твердые частицы.
Исторически во всех флюсах для электроники использовалась канифоль[4] для твердых частиц. Канифоль получают из сока некоторых сосен после испарения большинства летучих компонентов (среди прочих производных образуется скипидар). Любой, кто имел дело с рождественской елкой, хорошо знаком с одним свойством канифоли — она очень липкая (до тех пор, пока все оставшиеся летучие вещества не испарятся, после чего канифоль на ощупь и действует очень похоже на полиуретан, хотя эти два материала очень разные химически).
Любой, кто имел дело с рождественской елкой, хорошо знаком с одним свойством канифоли — она очень липкая (до тех пор, пока все оставшиеся летучие вещества не испарятся, после чего канифоль на ощупь и действует очень похоже на полиуретан, хотя эти два материала очень разные химически).
Диск изготовлен из той же канифоли, что и флюс.
Музыканты используют его со струнными инструментами.
Канифоль обладает двумя свойствами, которые делают ее идеальной для использования в электронных флюсах. Во-первых, он выдерживает температуры пайки без разрушения, гарантируя, что раскисленная поверхность остается защищенной от кислорода. Во-вторых, что еще более важно, он гидрофобный (отталкивает влагу). Канифоль инкапсулирует кислоты в среде без влаги, что сводит к минимуму проводимость и коррозию. (Все неприятные последствия ионного загрязнения требуют некоторой влажности. Сопротивление утечке тока снижается по мере увеличения влажности.)
Канифоль в естественном состоянии содержит очень мягкую органическую кислоту, абиетиновую. Кислота недостаточно сильна, чтобы удалить многие оксиды, кроме оксида олова. Во флюсы, пригодные для производства, добавляют более сильные кислоты, но канифоль в спирте без дополнительных кислот по-прежнему продается для использования с лужеными деталями. (Согласно устаревшему стандарту MIL для флюса канифоль в спирте обозначается как «Тип R».)
Кислота недостаточно сильна, чтобы удалить многие оксиды, кроме оксида олова. Во флюсы, пригодные для производства, добавляют более сильные кислоты, но канифоль в спирте без дополнительных кислот по-прежнему продается для использования с лужеными деталями. (Согласно устаревшему стандарту MIL для флюса канифоль в спирте обозначается как «Тип R».)
Канифоль неполярна и не растворяется в воде, которая является полярной.[5] Попытка смешать канифоль с водой приводит к липкой массе (не технический термин, а точное описание). Мощные растворители, такие как трихлорэтан, которые в прошлом были очень эффективны для удаления остатков канифоли, теперь запрещены из-за проблем с окружающей средой и здоровьем. Ни один доступный в настоящее время растворитель не может сравниться с трихлорэтаном по способности удалять канифоль, а доступные растворители дороги. Он предназначен для того, чтобы оставить его на схеме после пайки.
Основная проблема канифоли — ее видимость. После пайки выделяется коричневый осадок. Остаток безвреден (хотя кислота, содержащаяся в канифоли, может быть проблемой, но только в том случае, если используется неправильная сила флюса), но слишком часто неосведомленные люди интерпретируют его как признак плохой надежности. Операторы пайки часто тратят много времени и усилий на удаление видимой канифоли после пайки, что является пустой тратой ресурсов. «Очистка» щеткой или тряпкой и растворителем после ручной пайки мало что дала, за исключением того, что остатки флюса распределились по большей площади, что сделало их менее заметными.
Остаток безвреден (хотя кислота, содержащаяся в канифоли, может быть проблемой, но только в том случае, если используется неправильная сила флюса), но слишком часто неосведомленные люди интерпретируют его как признак плохой надежности. Операторы пайки часто тратят много времени и усилий на удаление видимой канифоли после пайки, что является пустой тратой ресурсов. «Очистка» щеткой или тряпкой и растворителем после ручной пайки мало что дала, за исключением того, что остатки флюса распределились по большей площади, что сделало их менее заметными.
Количество остатка, остающегося после пайки, определяется концентрацией твердых частиц во флюсе. Чтобы избежать неприятного количества остатков канифоли, нужно избегать флюсов с высокой концентрацией канифоли. Поскольку они были разработаны для ранних версий пайки волной припоя, где избыток припоя, например мостов, можно было предотвратить за счет высокой концентрации канифоли (в некоторых случаях 40% и более), многие канифольные флюсы, которые до сих пор широко используются, содержат во много раз больше твердых веществ, чем необходимо. для сегодняшней пайки. Темно-коричневый жидкий флюс не дает преимуществ, компенсирующих время и деньги, необходимые для удаления остатков после пайки. Сегодня большинство производителей флюсов предлагают жидкие канифольные флюсы с низким содержанием твердых частиц (менее 5% по объему), которые не оставляют значимого остатка.
для сегодняшней пайки. Темно-коричневый жидкий флюс не дает преимуществ, компенсирующих время и деньги, необходимые для удаления остатков после пайки. Сегодня большинство производителей флюсов предлагают жидкие канифольные флюсы с низким содержанием твердых частиц (менее 5% по объему), которые не оставляют значимого остатка.
Эти флюсы идентичны, за исключением концентрации канифоли, но флюс слева не требует очистки после пайки.
Припой с порошковой проволокой оставляет остатки. Содержание флюса по умолчанию в проволочном припое составляет около 3% по весу, что соответствует очень большому количеству по объему. Использование припоя с содержанием флюса около 1% устраняет основной источник видимого остатка канифоли. Флюс внутри припоя в любом случае не дает большой пользы.[6]
Смола Недостатком канифоли для производителей флюсов является получение прибыли. Канифоль есть канифоль, независимо от этикетки производителя флюса. На фундаментальном уровне нет существенной разницы между одним брендом и другим. Но замена твердых веществ материалом, отличным от канифоли, позволяет дифференцировать продукт и дает возможность несколько повысить цену и прибыль.
На фундаментальном уровне нет существенной разницы между одним брендом и другим. Но замена твердых веществ материалом, отличным от канифоли, позволяет дифференцировать продукт и дает возможность несколько повысить цену и прибыль.
Одним из материалов, используемых вместо канифоли, являются смолы. И это становится сложно.
Кембриджский словарь определяет смолу как «густое, липкое вещество, производимое некоторыми деревьями и становящееся желтым и твердым после сбора, или любое из различных подобных веществ, получаемых в результате химического процесса для использования в промышленности». Мы уже обсуждали материал в первой части этого определения: канифоль. А некоторые смолы, очищенные от канифоли, имеют свойства, очень похожие на канифоль. Но другие смолы не имеют отношения к канифоли; они являются результатом химического синтеза. Канифоль есть канифоль, но смолы имеют много форм, и, поскольку ни один производитель не раскрывает свои запатентованные ингредиенты, невозможно узнать, какая смола используется в каком-либо конкретном флюсе на основе смолы.
Заказчики контрактных производителей (или внутренние заказчики интегрированных компаний с собственным производством) часто отказываются от сборок с видимыми остатками флюса. Видимые остатки представляют собой безвредные остатки твердых веществ и не являются проблемой надежности, в отличие от невидимого ионного загрязнения, оставленного кислотами, но большинство аудиторов поставщиков ничего не знают о процессе. Самый простой способ успокоить неосведомленных клиентов — заменить видимые твердые вещества (канифоль или некоторые смолы) бесцветными твердыми веществами. Гликоли являются одними из самых популярных заменителей.
Гликоли бесцветны и растворимы в воде. Они оставляют очень мало видимых следов после пайки и, в отличие от канифоли, при необходимости могут быть удалены промывкой водой. Отсутствие видимости и возможность удаления водой (в отличие от дорогостоящих химикатов, необходимых для удаления канифоли) делает эти флюсы очень популярными среди контрактных производителей, а также компаний, производящих для собственного использования, но не обладающих достаточными знаниями, чтобы понять, почему остатки канифоли сами по себе не означают плохой надежности (или что отсутствие видимых остатков в случае твердых веществ, таких как гликоли, не обязательно свидетельствует о высокой надежности).
Флюсы доступны внутри проволочного припоя, смешанные с частицами припоя в паяльной пасте, в виде гелей или паст и в виде жидкостей. Особенностью, которая отличает жидкий флюс от других форм, является растворитель.
Наиболее распространенным растворителем является спирт. На самом деле не имеет значения, какой алкоголь используется; все они ведут себя одинаково. Две характеристики делают спирт идеальным растворителем флюса:
- Низкое поверхностное натяжение, позволяющее флюсу проникать в труднодоступные места, где может потребоваться удаление оксидов, и
- Высокое давление паров (сила, превращающая жидкость в пар без тепла), что приводит к быстрому высыханию спирта без использования тепла, необходимого для активации флюса и расплавления припоя
Спирты представляют собой летучие органические соединения (ЛОС), которые могут быть канцерогенными, способствуют образованию смога и действуют как парниковые газы. Ограничения по летучим органическим соединениям в некоторых регионах, особенно в некоторых частях Калифорнии, не позволяют использовать флюсы на спиртовой основе. Альтернативой спирту является вода, которая уступает спирту по четырем основным параметрам:
Ограничения по летучим органическим соединениям в некоторых регионах, особенно в некоторых частях Калифорнии, не позволяют использовать флюсы на спиртовой основе. Альтернативой спирту является вода, которая уступает спирту по четырем основным параметрам:
- Высокое поверхностное натяжение, поэтому плохое проникновение в труднодоступные места, включая сквозные отверстия с покрытием
- Очень низкое давление пара, поэтому небольшая склонность к высыханию после нанесения
- Очень высокая скрытая теплота парообразования. Для удаления испаряющейся воды требуется нагрев до 212°F/100°C, энергия, которая в противном случае использовалась бы для активации флюса и плавления припоя, и
- Разбрызгивание при соприкосновении горячего утюга с флюсованной заготовкой или попадание флюсовой сборки в волну припоя
На водной основе не то же самое, что водорастворимый. Водорастворимый означает, что остатки флюса после испарения растворителя растворяются в воде.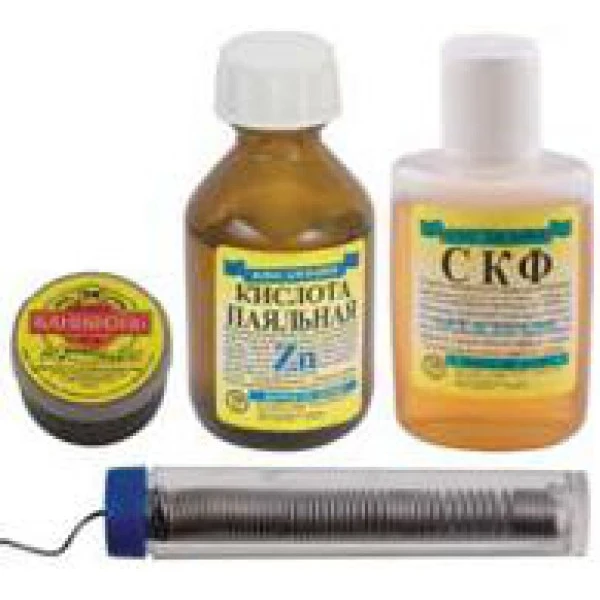 Остатки многих флюсов на спиртовой основе (за исключением флюсов, содержащих канифоль и некоторые смолы) растворимы в воде.
Остатки многих флюсов на спиртовой основе (за исключением флюсов, содержащих канифоль и некоторые смолы) растворимы в воде.
Скоро
В электронной книге «Флюсы для пайки» объясняются категории флюсов в соответствии с J-STD-004B. В заключение будут даны рекомендации по выбору флюса, наиболее подходящего для нужд продукта.
[1] Ионы водорода H+ фактически связаны с кислородом в форме OH – , известной как гидроксид, но водород ведет себя как отдельный ион, и химики называют гидроксид ионами водорода.
[2] M представляет количество молей на литр воды, где 1 моль = 602 214 076 000 000 000 000 000
[3] Литр чистой воды при 25°C содержит 1 × 10 -7 M ионов водорода и такое же количество ионов гидроксония. (1 × 10 -7 М) x (−log 10 ) = 7.
[4] «Нейтральный» на самом деле является движущейся целью, которая зависит от температуры. Нейтральная вода при 25°C имеет pH 7,0.

