Электрохимическая и химическая коррозия: Химическая коррозия
alexxlab | 08.06.1986 | 0 | Разное
|
Навигация: Химическая и электрохимическая коррозия Химическая и электрохимическая коррозия
Коррозия считается химической, если после разрыва металлической связи атомы металла непосредственно соединяются химической связью с теми атомами или группами атомов, которые входят в состав окислителей, отнимающих валентные электроны у металла. Химическая коррозия возможна в любой коррозионной среде, но чаще всего она наблюдается в случаях, когда среда не является электролитом. Скорость ее определяется, как правило, диффузией частиц металла, и окислителя через поверхностную пленку продуктов коррозии, иногда — растворением или испарением этой пленки, ее растрескиванием, изредка — конвективной доставкой окислителя из внешней среды. Коррозия считается электрохимической, если при выходе из металлической решетки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды. Окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединить валентные электроны металла, не удерживая около себя катионы. При электрохимической коррозии удаление атома из металлической решетки (что составляет сущность любого коррозионного процесса) осуществляется в результате двух независимых, но сопряженных, связанных между собой электрическим балансом, электрохимических процессов: анодного (переход сольватируемых катионов металла в раствор) и катодного (связывание окислителем освобождающихся электронов). Следовательно, процесс электрохимической коррозии можно замедлить не только путем торможения анодного процесса, но и воздействия на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов и восстановление растворенного кислорода. Их ча-cjo называют соответственно водородной и кислородной деполяризацией. Анодный и катодный процессы с определенной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей ее площади. В таком идеальном случае коррозия называется гомогенно-електрохимичеекой, отмечая, таким образом, отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что не исключает термодинамической гетерогенности взаимодействующих фаз. В действительности на, металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. Проводимость металла очень высока, и при возникновении избыточного заряда электроны практически мгновенно перераспределяются, так что плотность заряда и электрический потенциал металла меняются одновременно по всей его поверхности независимо от того, в каких ее точках электроны освободились после ухода катионов, а в каких захватываются окислителем. В частности это означает, что от мест, где преимущественно протекает анодная реакция, электроны перемещаются в металле к местам протекания катодной. Соответственно раствор вблизи анодных участков получает избыточный положительный заряд растворившихся катионов, а вблизи катодных заряжается отрицательно в результате захвата электронов растворенным окислителем. В растворе эти заряды не перераспределяются так легко, как в металле. Поэтому с повышением скорости процесса потенциал раствора, находящегося в непосредственной близости от анодных участков, становится все более положительным, что затрудняет катодный процесс. Когда такое падение напряжения велико, коррозионную систему удобнее представить в виде системы короткозамкнутых микро-или макрогальванических элементов. В остальных случаях при определении средней по площади- скорости растворения металла современная теория, наряду с вышеизложенной моделью, позволяет также представлять электрохимически гетерогенную поверхность как квазигомогенную. Тогда ей приписывают удельные анодные и катодные характеристики, равные интегрально усредненным ‘по площади значениям одноименных характеристик моделируемой на основе теории подобия гетерогенной поверхности. Графически их изображают на коррозионной диаграмме в виде анодных и катодных поляризационных кривых, которые отображают влияние электродного потенциала на усредненные по площади и выраженные в единицах плотности тока скорости выхода катионов и электронов с данной поверхности в данный электролит. Похожие статьи: Навигация:
Главная → Справочник → Статьи → Блог → Форум |
Коррозия металлов
Коррозия металлов
Коррозией называется разрушение металлов и сплавов под действием окружающей среды. Подавляющее большинство металлов, применяемых в технике, в различной степени подвержено коррозии.
Коррозия обычно начинается с поверхности и затем распространяется в глубину металла, вследствие чего ухудшаются его механические свойства. Среда, в которой протекают коррозионные процессы, оказывает большое влияние на их характер, в связи с чем различают два основных вида коррозии: химическую и электрохимическую.
Среда, в которой протекают коррозионные процессы, оказывает большое влияние на их характер, в связи с чем различают два основных вида коррозии: химическую и электрохимическую.
Химическая коррозия возникает в результате воздействия на металлы жидкостей, сухих газов, которые не являются проводниками электрического тока (бензин, масла, смолы, газы и т. п.). При химической коррозии на поверхности металлов образуются пленки окислов. Такие пленки некоторых металлов (алюминий, хром, молибден) обладают высокой прочностью и предохраняют металл от разрушения. Пленки окислов железа и других черных металлов непрочны. Местные разрушения этих пленок окислов и являются причиной дальнейшего протекания коррозии, проникающей в металл на большую глубину.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Окисление металлов при повышенных температурах с образованием на их поверхности окалины является типичным видом химической коррозии.
Электрохимическая коррозия является результатом воздействия на металлы различных электролитов — кислот, щелочей, растворов солей и воды с растворенными в ней газами и примесями. Все эти жидкости, являются хорошими проводниками тока.
Одним из наиболее распространенных видов электрохимической коррозии является атмосферная коррозия металлов, сущность которой заключается в следующем. Из физики известно, что пластинки, изготовленные из разнородных металлов и соединенные между собой, при погружении в электролит образуют гальванические пары. При этом металл, обладающий более высоким электрическим потенциалом, будет являться катодом, а металл с более низким потенциалом — анодом.
В промышленности наибольшее применение имеют сплавы, а не чистые металлы. Состав сплавов не является однородным. Например, перлитная сталь состоит из зерен феррита и цементита и других примесей, в результате чего получается множество гальванических пар, в которых зерна феррита являются катодом, а зерна цементита — анодом.
При соприкосновении с влажным воздухом на поверхности стали появляется влага в виде водяной пленки, которая является в данном случае электролитом. При. этом появляются токи, являющиеся основной причиной коррозии металла. Следовательно, электрохимическая коррозия отличается от химической тем, что при ней происходят электрохимические процессы вследствие возникновения токов.
Защита металлов от коррозии. Коррозия металлов причиняет огромные убытки народному хозяйству. Основными металлами в машиностроении и в других отраслях народного хозяйства являются черные, т. е. сталь и чугун. Они обладают слабой стойкостью против коррозии, вследствие чего выходит из строя большое количество деталей из черных металлов.
Металлические изделия защищают от коррозии различными способами: металлическим и неметаллическим покрытием, созданием на их поверхности окисных пленок и легированием металлов и сплавов.
Для защиты металлов и сплавов от коррозии неметаллическими покрытиями поверхность изделия окрашивают различными красками, покрывают лаками и пр.
Легирование металлов и сплавов осуществляют введением хрома, никеля, алюминия, кремния и других элементов, повышающих сопротивление коррозии.
—
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с коррозионной средой.
Виды коррозии. Коррозия металлов и сплавов начинается с их поверхности и постепенно распространяется в глубь материала. При этом внешний вид металлов изменяется: они теряют блеск, их поверхность становится неровной, изъеденной. Часто коррозия металлов сопровождается снижением их механической прочности, твердости и другими явлениями. Примером коррозии металлов может служить ржавление железа под воздействием влажного воздуха, в результате чего на поверхности металлов образуется бурый слой ржавчины.
В зависимости от состояния коррозионной среды, вида металла и условий их взаимодействия на поверхности металла образуются различные химические соединения, так называемые продукты коррозии. Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Они могут быть в виде пленок и наростов с плотной и рыхлой структурой, прочно приставших к поверхности металла или легко удаляемых с него.
Пленки, особенно если они плотные (беспористые), могут тормозить дальнейший процесс коррозии, а в некоторых случаях надежно защищать металл от разрушения. Например, пленка, образовавшаяся на алюминии при воздействии кислорода воздуха, защищает его от дальнейшей коррозии. При образовании защитной пленки металл теряет способность к химическим взаимодействиям с окружающей средой, т. е. переходит в пассивное состояние. Но достаточно удалить защитную пленку и коррозия металла начинается снова.
Рис. 1. Виды коррозии:
а — сплошная (равномерная) коррозия, б — местная, в — межкристал-лнтная; 1 — металл, 2, 3 — продукты коррозии, 4 — трещины
В зависимости от характера протекания коррозионного процесса, состояния коррозионной среды, природы металла и действующих на него напряжений (изгибающих, сжимающих, ударных, растягивающих) наиболее часто встречаются три вида коррозии: сплошная, местная и межкристаллитная.
Сплошная коррозия, охватывающая всю поверхность металла, подразделяется на равномерную и неравномерную.
Равномерная коррозия протекает с одинаковой скоростью по всей поверхности металла, а неравномерная протекает с неодинаковой скоростью на различных участках поверхности металла.
Равномерная коррозия происходит в большинстве случаев на открытом воздухе.
При коррозии этого вида металл разрушается равномерно по всей поверхности конструкции или аппарата. Если с поверхности металла удалить слой ржавчины, то можно увидеть, что его поверхность стала шероховатой. При более длительном воздействии воздуха углубления в металле увеличиваются.
Местная коррозия — это коррозия, охватывающая отдельные участки поверхности металла. Такая коррозия подразделяется на подповерхностную, точечную, сквозную и коррозию пятнами.
Местная коррозия возникает при наличии в металле загрязнений (шлаков и др.), внутренних напряжений, вследствие вмятин, наклепа; при грубой структуре и неоднородности поверхности металла; неравномерном действии коррозионной среды; при неравномерной аэрации поверхности металла.
Коррозия вследствие неравномерной аэрации часто возникает на тех участках металла, которые менее доступны воздействию кислорода, чем остальная поверхность. Такими участками являются царапины, раковины, заклепочные швы конструкций и т. п.
Местная коррозия на отдельных участках металла резко снижает его механическую прочность, что приводит к преждевременному разрушению оборудования и металлических конструкций, нарушению герметичности емкостей и трубопроводов.
Межкристаллитная коррозия распространяется по границам кристаллов-зерен, составляющих металл, и нарушает между ними связь. Это вызывает снижение механической прочности материала. Особенностью коррозионного разрушения этого вида является то, что коррозия распространяется глубоко внутрь металла, не изменяя внешнего вида металлической конструкции. Межкристаллитная коррозия чаще всего поражает конструкции, изготовленные из нержавеющей стали и алюминиевых сплавов. Разрушение конструкции происходит внезапно в результате резкого падения прочности металла или сплава.
Межкристаллитная коррозия обычно возникает в зоне сварных швов. Это объясняется тем, что при термической обработке нержавеющих сталей (высокохромистых) при высокой температуре — (1000—1110 °С) и последующем относительно быстром охлаждении происходят изменения состава металла по границам кристаллов за счет образования карбидов, т. е. соединений железа с углеродом, обладающих меньшей устойчивостью к коррозионным средам по сравнению с хромом.
Склонность алюминиевых сплавов к межкристаллитной коррозии объясняется образованием по границам зерен соединений менее коррозионностойких, чем основная часть зерен металла.
Часто можно наблюдать, что металл одновременно подвергнут нескольким видам коррозии. Равномерная коррозия, например, сопровождается местной и т. д.
Типы коррозии. В зависимости от вида коррозионной среды коррозия металла может происходить химическим или электрохимическим путем.
Химическая коррозия возникает при действии на металлы сухих газов при высоких температурах или жидких неэлектролитов (жидкостей, не проводящих электрический ток). К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
К химической коррозии относится также разрушение металла кислородом сухого воздуха и другими газами (углекислым, сернистым) при отсутствии паров воды.
При химической коррозии происходит взаимодействие коррозионной среды с поверхностью металла, в результате которого продукты коррозии (пленки, окислы, окалина) образуются непосредственно на том участке поверхности металла, где происходит его разрушение.
Электрохимическая коррозия возникает при взаимодействии металла с жидкой коррозионной средой (растворами электролитов, т. е. жидкостями, проводящими электрический ток), влажными газами, расплавленными солями и щелочами. Электролитами служат растворы кислот, солей или щелочей. При электрохимической коррозии разрушение металла связано с возникновением и перетеканием электрического тока с одних участков металла на другие.
Чтобы понять сущность электрохимической коррозии, рассмотрим некоторые явления, лежащие в основе этого процесса. Если в сосуд с разбавленной серной кислотой опустить два разнородных металла, например медь и цинк, и соединить их проводником, то по нему потечет электрический ток. Полученный источник тока называется гальваническим элементом.
Полученный источник тока называется гальваническим элементом.
Возникновение электрического тока в гальваническом элементе объясняется следующим. В растворе серной кислоты (электролите) молекулы вещества распадаются на части, которые называются ионами. Ионы каждого химического вещества несут определенный химический заряд: положительный (катион) или отрицательный (анион).
При погружении цинковой пластинки в электролит между кислотой и металлом возникает взаимодействие, в результате которого цинк постепенно-переходит в раствор. При этом каждый атом цинка оставляет-на металлической пластинке два электрона, а сам становится в растворе положительным ионом.
Цинковая пластинка, обогащаясь электронами, приобретает отрицательный электрический заряд. Слой электролита, непосредственно прилегающий к пластинке, заряжается при этом положительно. Между пластинкой и раствором кислоты возникает разность потенциалов (электрических зарядов).
Освободившиеся на цинковой пластинке (аноде) электроны текут по внешнему проводнику к медной пластинке (катоду).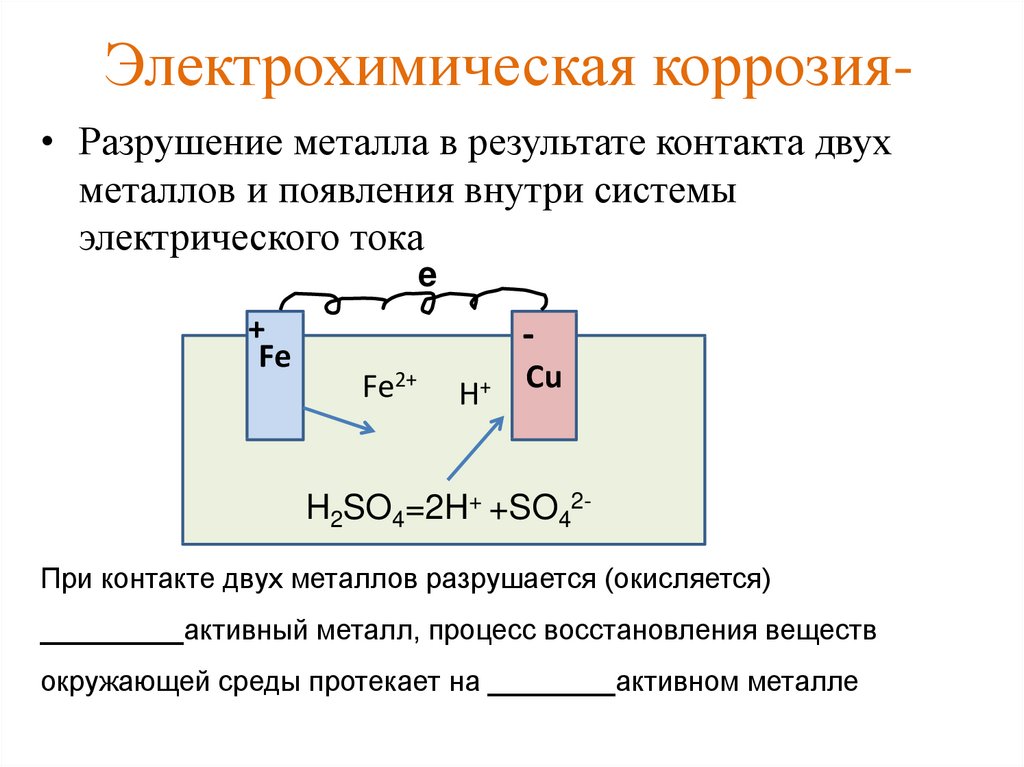 Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрическая цепь’ замыкается через электролит, в котором ионы переносят ток. В результате работы гальванического элемента цинковая пластинка (анод) постепенно разрушается.
Электрохимическая коррозия металла напоминает постепенное растворение анода гальванического элемента.
При эксплуатации химического оборудования под действием электролита происходит разрушение металла в результате образования гальванических элементов. Например, в химическом аппарате, изготовленном из нескольких различных металлов, при действии электролита у мест сопряжения этих металлов создаются условия для возникновения гальванического элемента, в результате работы которого металл разрушается и переходит в раствор.
В отличие от обычного гальванического элемента, где электроды соединены проводником, в гальваническом элементе, возникающем при коррозии химической аппаратуры, электроды соединены между собой непосредственно.
При изготовлении металлических аппаратов и строи, тельных конструкций всегда учитывают возможность возникновения электрохимической коррозии от соединения различных металлов.
Недопустимо, например, соединять без изолирующих прокладок алюминий с медными сплавами или с нержавеющими сталями.
Причиной возникновения электрохимической коррозии в металлическом аппарате или конструкции может служить также физическая неоднородность металла. Например, коррозия часто возникает в местах расположения сварных и заклепочных швов. Это объясняется тем, что при сварке металла в результате его нагревания на сравнительно небольшом участке происходит изменение структуры металла. При действии коррозионной среды этот участок по отношению к основному металлу конструкции становится анодом и начинает разрушаться. Такой же процесс возникает, если в конструкции есть заклепочные швы: заклепки становятся анодами по отношению к основному металлу и образуют с ним гальванический элемент.
Очень часто металл разрушается в результате возникновения на его поверхности микрогальваноэлементов, что происходит из-за его химической или физической неоднородности. Например, цинк, применяемый для различных технических целей, в своем составе содержит ряд примесей различных металлов и в том числе медь.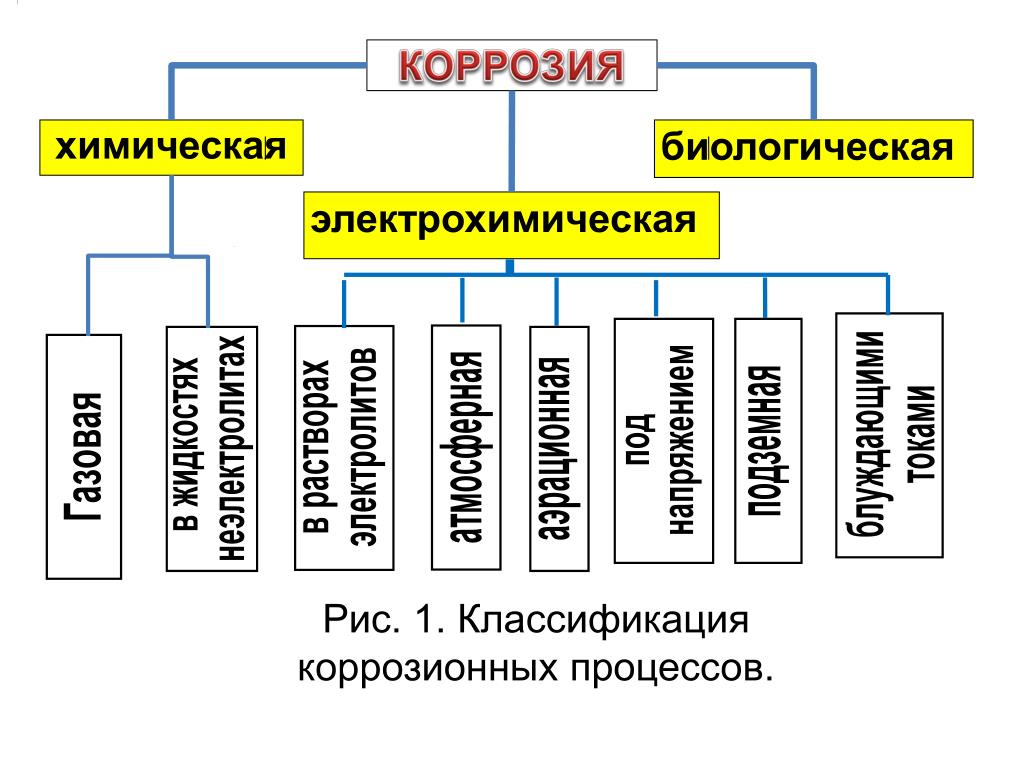 Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Так как-растворимость меди в цинке ограничена, то при содержании ее в цинке выше определенной нормы медь выделяется в виде отдельных мелких включений. В результате этого на поверхности цинка возникают мельчайшие, невидимые глазу гальваноэлементы, в которых катодами являются частицы меди, а анодами — цинк. При работе микроэлемента цинк переходит в электролит, что в конечном счете приводит к полному разрушению цинковой пластинки.
Обычно конструкционная сталь, из которой изготовляют химическую аппаратуру, технологические и строительные конструкции, также отличается химической неоднородностью. Эта неоднородность обусловливает низкую коррозионную стойкость стали в коррозионных средах и вызывает необходимость в осуществлении мероприятий по защите оборудования и конструкций от коррозии.
Коррозионная стойкость. Не все металлы и сплавы в одинаковой степени разрушаются коррозионными средами. Одни разрушаются быстрей, другие в тех же условиях оказываются устойчивыми к действию коррозии в течение длительного времени. Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Однако нет металлов совершенно не подвергающихся коррозии. Например, одним из наиболее устойчивых металлов является платина, но и она при погружении в смесь азотной и соляной кислот разрушается. Алюминий устойчив к воздействию крепкой азотной кислоты (поэтому его используют для изготовления цистерн и хранилищ под азотную кислоту), но если в алюминиевые аппараты залить соляную кислоту или щелочные растворы, то они очень быстро разрушат этот металл.
Способность металла сопротивляться коррозионному воздействию среды, называется коррозионной стойкостью. Она определяется качественно и количественно (скоростью коррозии в данных условиях, группой или баллом >по принятой шкале).
Одним из основных методов испытания металла на коррозионную стойкость является массовый метод. При испытании этим методом определяют разность массы образца металла до и после коррозии. Результаты испытаний относят к единице поверхности металла (м2, см2) и единице времени (час, сутки, год и т. д.). Таким образом, коррозионные потери могут быть выражены в г/см2-ч\ г/м2-день и т. д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
д. Однако массовый метод не учитывает плотности металла. В результате этого при одной и той же потере массы для разных металлов уменьшение сечения металла будет (различным.
При коррозии, сосредоточенной на небольших участках металла, массовый метод неприменим. В этом случае глубину проникновения коррозии определяют с помощью специальных методов.
Для более точного определения коррозионной стойкости металла полученные данные массового метода приводят к показателю, который характеризует уменьшение толщины металла (проникновение коррозии в глубину металла), например в мм/год.
Общие представления о коррозии металлов
Общие представления о коррозии металлов.
Под коррозией понимают разрушение металла вследствие его химического и электрохимического взаимодействия с окружающей средой.
В терминах окислительно-восстановительных реакций сущность этого взаимодействия сводится к окислению металла и восстановлению окислителя среды.
Me – ne = Men+ окисление (ионизация) металла
Ox + ne = Red восстановление окислителя среды
Коротко можем записать:
коррозия = окисление металла + восстановление окислителя.
Окислитель- “Ox” всегда принимает электроны. Поэтому в качестве окислителя среды может выступать любое вещество, способное принимать на себя электроны от атомов металла.
Ox- окислитель среды= захватчик электронов
Red-восстановитель среды= поставщик электронов
Примеры коррозии металлов в различных средах:
Атмосферная коррозия- окисление железа кислородом воздуха
4Fe + 3O2 = 2Fe2O3 окислитель-кислород
В этой реакции железо поставляет электроны, а кислород их захватывает
4Fe – 12e = 4Fe3+ окисление железа
3O2 + 12e = 6O2- восстановление кислорода
Коррозия железа в водных средах, содержащих ионы водорода
2Fe + 6H+ = 2Fe3+ + 3H2 окислитель-ионы водорода
В этой реакции железо также отдает электроны, а принимают их ионы водорода
2Fe – 6e = 2Fe3+ окисление железа
6H+ + 6e = 3H2 восстановление ионов водорода
Коррозия наносит огромный ущерб почти всем отраслям народного хозяйства, при этом основные убытки определяются даже не потерей металла, а порчей дорогостоящих металлических изделий, конструкций, машин и аппаратов, что в первую очередь связано с утратой функциональных возможностей их отдельных узлов. Достаточно упомянуть разрывы нефте- и газопроводов, а также разрывы труб городского водоснабжения. Коррозия металлической арматуры железобетонных конструкций приводит к потере их прочности и разрушению промышленных и жилых зданий.
Достаточно упомянуть разрывы нефте- и газопроводов, а также разрывы труб городского водоснабжения. Коррозия металлической арматуры железобетонных конструкций приводит к потере их прочности и разрушению промышленных и жилых зданий.
О масштабах коррозии черных металлов можно судить хотя бы по тому, что примерно каждая шестая домна в мире работает на восполнение коррозионных потерь.
Классификация различных видов коррозии.
По механизму действия коррозия делится на химическую и электрохимическую
Химическая коррозия – взаимодействие металла с окружающей средой, при котором окисление металла и восстановление окислителя коррозионной среды происходит в одном акте без перехода заряженных частиц через границу металл-окислительная среда.
Химическая коррозия = окисление металла + восстановление окислителя без перехода заряженных частиц через границу металл-коррозионная среда.
Скорость химической коррозии не зависит от потенциала металла.
Примером химической коррозии может служить окисление железа кислородом воздуха
4Fe + 3O2 = 2Fe2O3
Образующаяся при этом оксидная пленка на металле может предохранять его от дальнейшего окисления, если температура окисления невысока. При высоких температурах химического окисления любое железное изделие превращается в окалину. Химический вид коррозии может также иметь место и в растворах неэлектролитов.
Электрохимическая коррозия – взаимодействие металла с окружающей средой, при котором окисление металла и восстановление окислителя коррозионной среды происходит в результате протекания нескольких элементарных актов, сопровождающихся переходом заряженных частиц через границу металл-окислительная среда.
Электрохимическая коррозия = окисление металла + восстановление окислителя с переходом заряженных частиц через границу металл-коррозионная среда.
Скорость электрохимической коррозии зависит от потенциала металла.
Примером может служить растворение цинка в кислоте
Zn + 2H+ = Zn2++ Н2
Еще со школы мы привыкли рассматривать эту реакцию, как химическую. На самом деле эта реакция протекает через две сопряженные электрохимические реакции:
реакцию окисления атома цинка
Zn = Zn2+ + 2e
и реакцию восстановления ионов водорода
2H+ + 2е= Zn2++ Н2
Если сложить эти две реакции, то получим суммарную реакцию
Zn + 2H+ = Zn2+ + Н2
При этом заряженная частица- ион цинка переходит через границу металл-раствор в объем раствора, а пара электронов остается в металле, заряжая его отрицательно по схеме
Ионы водорода подходят к отрицательно заряженной поверхности металла, а электроны из металла переходит через границу раздела металл-раствор на ионы водорода, в результате образуется молекула водорода
По характеру коррозионной среды различают следующие типы коррозии
Другими словами – коррозия в небе, на суше и на море.
Газовая коррозия – химическая коррозия металлов в газах при высоких температурах (например, в камере сгорания реактивных двигателей).
Атмосферная коррозия– коррозия в атмосфере воздуха (при наличии конденсированной пленки влаги и атмосферных осадков).
Электролитная коррозия– коррозия в речной и морской воде, а также в растворах солей, кислот, щелочей.
Грунтовая коррозия-коррозия металлических изделий при контакте с грунтом-почвенным электролитом.
По условиям эксплуатации различают следующие типы электрохимической коррозии
Щелевая коррозия-электрохимическая коррозия в щелях и зазорах
между двумя металлами, куда попадает электролит.
Контактная коррозия-электрохимическая коррозия любых двух контак-
тирующих металлов, погруженных в электролит. Она проявляется в усиле-
нии коррозии одних металлов при их контакте с другими металлами.
Коррозионное растрескивание-коррозия металла при одновременном
воздействии коррозионной среды и внешних или внутренних механических
напряжений растяжения с образованием транскристаллитных или межкрис-
таллитных трещин.
Коррозионная усталость– понижение предела усталости металла при
одновременном воздействии циклических растягивающих напряжений и кор-
розионной среды.
Коррозия при трении – разрушение металла, вызываемое одновременным
воздействием коррозионной среды и трения.
Формы коррозионных разрушений.
По форме коррозионных разрушений коррозия делится на виды
Для всех металлических изделий, испытывающих механическую нагрузку,наиболее опасными являются локальные виды коррозии. Это демонстрирует график зависимости потерь прочности детали из дуралимина от коррозионных потерь веса при различных видах коррозионного разрушения.
При коррозии металла на его поверхности одновременно протекают две независимые электрохимические реакции
Me – ne = Men+ окисление (ионизация) металла
Ox + ne = Red восстановление окислителя среды
В стационарном состоянии все электроны, которые выделяются в результа-
те ионизации металла должны потребляться в сопряженном процессе восс-
тановления окислителя.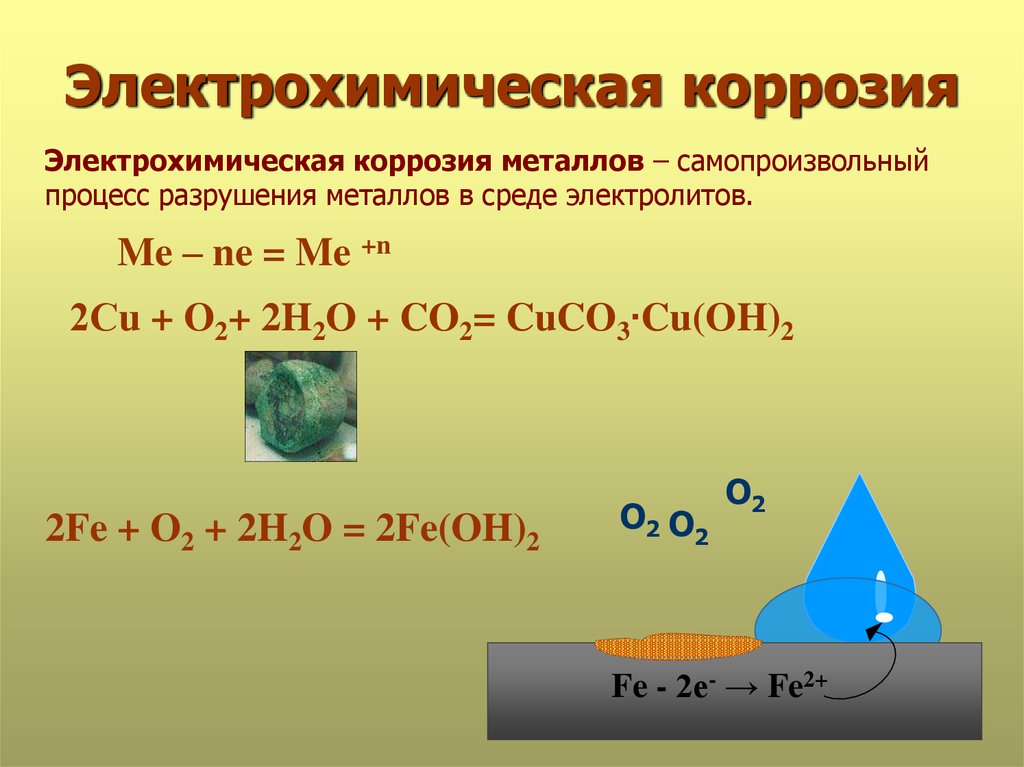
Если в качестве окислителя при коррозии металла выступают ионы
водорода, то такая коррозия называется коррозией с водородной деполя-
ризацией.
В этом случае при одном и том же стационарном потенциале одновременно протекают процессы растворения металла и восстановления ионов водорода
Me = Men+ + ne
2H+ + 2e = H2
Если в качестве окислителя при коррозии металла выступают молекулы растворенного кислорода, то такая коррозия называется коррозией с кислородной деполяризацией. В этом случае при одном и том же стационарном потенциале одновременно протекают процессы растворения металла
и восстановления молекул кислорода. Эти процессы для щелочных растворов имеют вид
Me = Men+ + ne
16 Тематика семинарских занятий – лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
O2 + 2H2O + 4e = 4OH–
В кислых растворах восстановление кислорода протекает по схеме
О2 + 4H+ + 4e = 2H2O восстановление кислорода
В нейтральных средах для активных металлов, вытесняющих водород
из воды, в качестве восстановителя могут выступать сами молекулы воды
2H2O + 2e =H2 + 2OH–
Коррозия металлов и защита от коррозии
Коррозия металлов
Коррозия — это разрушение металла под действием окружающей среды.
По механизму протекания различают два типа коррозии — химическую и электрохимическую.
Химическая коррозия начинает влиять на металл сначала его происхождения. Окалина ее продукт. Взаимодействие металла и окружающей среды протекает постоянно, химические процессы, проходящие при этом взаимодействии можно назвать борьбой за выживание, наша задача свести потери металла в этой борьбе к минимуму.
По характеру агрессивной среды различают атмосферную коррозию, подземную и подводную.
Виды коррозионных разрушений разнообразны — равномерная коррозия, неравномерная, коррозия пятнами, коррозия язвами, подповерхностная коррозия, точечная или питтинговая, структурно-избирательная коррозия, межкристаллитная коррозия (этот самый опасный вид коррозии, обусловленный сложностью выявления). Последствия скрытно протекающих коррозионных процессов зачастую приводят к авариям, которых могло бы и не быть.
Химическая коррозия — это процесс разрушения металла под действием внешней среды, не сопровождаемая образованием электрического тока. Ее разновидность — газовая коррозия, представляет собой процесс взаимодействия газов при высокой температуре с металлом. При таком взаимодействии образуется оксидная пленка, на железе она рыхлая, легко отскакивает и не защищает от разрушения. В отличии от химической — электрохимическая коррозия протекает при контакте металла с раствором электролита. При этом электролитом может являться любая жидкость или газ. Примером электрохимической коррозии может быть атмосферная коррозия.
Ее разновидность — газовая коррозия, представляет собой процесс взаимодействия газов при высокой температуре с металлом. При таком взаимодействии образуется оксидная пленка, на железе она рыхлая, легко отскакивает и не защищает от разрушения. В отличии от химической — электрохимическая коррозия протекает при контакте металла с раствором электролита. При этом электролитом может являться любая жидкость или газ. Примером электрохимической коррозии может быть атмосферная коррозия.
Электрохимическая коррозия, более трудно прогнозируемая, чем химическая, ввиду необходимости учёта множества факторов, зачастую изменяющихся в процессе эксплуатации ТУ. При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии. В одних случаях на поверхности металла может образоваться плотная оксидная пленка, выполняющая роль защитного слоя. Образовавшаяся оксидная пленка предохраняет металл от разрушения. Это явление широко используется в современной технике, как способ защиты от коррозионных процессов.
Защита от коррозии
Существует немало способов защиты от коррозии. Самый лучший из них создание такого металла, который бы вообще не коррозировал. Один из путей создания коррозионностойкого металла — получение особых сплавов, в которые добавляют хром, никель, молибден, титан и другие компоненты. Так называемое легирование. Технология создания таких сплавов трудоемка, и связана с повышенными экономическими затратами. Цена таких материалов выше и не всегда целесообразно применение их в конкретных условиях.
Ингибирование — способ, при котором скорость коррозии снижается, если в агрессивную среду ввести соединения, значительно замедляющие коррозионный процесс. Одним из механизмов ингибирования является адсорбция ингибитора на поверхности защищаемого изделия. Ингибируемые бумаги и пленки применяются при долговременном хранении.
Различают металлические и неметаллические защитные покрытия, изолирующие металл от агрессивной среды. Большие детали или трубы защищают методом металлизации.
Большие детали или трубы защищают методом металлизации.
Плакирование — метод защиты металла от коррозии другим металлом, который устойчив к агрессивной среде. Трубы газо- и нефтепроводов защищаются комбинированным способом, мазутно-битумное покрытие, ингибированная бумага и одновременно с этим катодная защита.
Сущность электрозащиты состоит в том что, на катод, которым является сам трубопровод, накачиваются электроны от внешнего источника тока, и это тормозит коррозию. Анодом в этом случае может служить любой ненужный металл.
Так же широко сейчас применяются различные плёнки на основе полиэтилена, внутренняя поверхность так же защищается различными покрытиями на основе керамики.
Сварные стыки также защищаются от взаимодействия с перекачиваемой средой различными способами. При защите ТУ применяется метод протекторной защиты. Протектор — активный металл, с более отрицательным потенциалом, например цинк, который разрушаясь сам, защищает объект.
Надежным способом зашиты от коррозии, являются гальванические покрытия, которые получают электролизом в водных растворах.
Неметаллические покрытия — это покрытия лаками, красками, различными силикатными эмалями и полимерными материалами. Покрытие силикатными эмалями широко применяется в химической промышленности. Кислотостойкие эмали применяют для покрытия вакуумных аппаратов, резервуаров, реакторов. Затраты на защиту металла от коррозии оправданы и дают хороший экономический эффект, с учётом снижения затрат на замену непригодного ТУ. Где то, например подземные трубопроводы с агрессивной средой, она просто необходима для безопасной эксплуатации.
При проведении экспертизы промышленной безопасности технических устройств, применяемых на опасных производственных объектах, одной из важнейших задач является определение скорости коррозии и прогнозирование этой скорости на планируемый период эксплуатации. Мероприятия по антикоррозионной защите могут значительно увеличить срок эксплуатации и, как следствие, снизить затраты на замену ТУ.
Коррозия металлов – доклад сообщение 9 класс по химии
- Энциклопедия
- Химия
- Коррозия металлов
В природе рано или поздно все ломается, разрушается, приходит в негодность. Деревья и растения засыхают, цветы вянут, а люди умирают от различных причин. Даже неживым предметам грозит такой конец. Металлы, из которых создается разного рода техника, являются хорошим примером. Причин разрушения металлов достаточно: прогиб, трещины, износ или пластическая деформация. Но самая распространенная причина – это коррозия. Как она возникает? Чем грозит для людей? И приносит ли коррозия хоть какую-нибудь пользу?
Коррозия – это приход материала в негодность из-за разных воздействий окружающей среды на него. Синонимом слову коррозия является другое слово – ржавчина. Наиболее хорошо данный процесс можно увидеть на примере коррозии железа в водной среде с участием кислорода:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Тут стоит обратить внимание на химическое соединение Fe(OH)3 – гидроксид железа. Это основание и есть та ржавчина, которую люди видят повседневно. К неметаллам понятие коррозии не относится, в большинстве случаев. Температура влияет на то, насколько быстро или медленно протекает процесс коррозии.
Это основание и есть та ржавчина, которую люди видят повседневно. К неметаллам понятие коррозии не относится, в большинстве случаев. Температура влияет на то, насколько быстро или медленно протекает процесс коррозии.
Главные виды коррозий и их отличия.
Всего отмечают 4 типа коррозий. Они все относятся к металлам, как правило.
1) Электрохимическая.
Короче говоря, это коррозия, происходящая под действием на определенный металл или изделие из соответствующего элемента электролита. Например, капля воды. Если поместить металл в водную среду и там будет присутствовать какая – либо соль, то процесс будет проходить быстрее.
2) Водородная.
Такая коррозия случается тогда, когда при реакции с металлом восстанавливается вода или гидроксоний (h4O). Наглядно рассмотреть процесс данного вида коррозии можно на следующей реакции:
2h4O+ + 2e– = 2H2O + H2
3) Кислородная.
Эта коррозия похожа на прошлую, только в данном случае выделяться будет кислород:
O2 + 2H2O + 4e– = 4OH–
Стоит уточнить один момент. Все виды, рассмотренные ранее, относятся к тем ситуациям, когда друг с другом действуют 2 металла. Еще есть случай с одним металлом, когда поверхность вещества неоднородна. Это химическая коррозия.
Все виды, рассмотренные ранее, относятся к тем ситуациям, когда друг с другом действуют 2 металла. Еще есть случай с одним металлом, когда поверхность вещества неоднородна. Это химическая коррозия.
Доклад 2
Под воздействием атмосферных или иных условий эксплуатации металлические поверхности покрываются рыжей, рыхлой пленкой, которая называется ржавчиной или коррозией. Учеными установлено, что на производстве 10% всех металлических изделий становится непригодными.
Происходит процесс разрушения конструкции, качество ухудшается, и они приходят в негодность.
Коррозийный процесс зависит от таких факторов как:
- вида среды;
- условий и механизма протекания;
- температуры;
- других.
Коррозийный процесс различают:
- по характеру разрушения;
- по условиям протекания.
Химическая и электрохимическая коррозии
Химическая коррозия возникает в результате взаимодействия кислорода с металлом и встречается часто. В этом процессе могут участвовать вода, соль, кислота, щелочь, растворы солей. Они образуют окись железа, что приводит к появлению ржавчины. Различают два вида химической коррозии:
В этом процессе могут участвовать вода, соль, кислота, щелочь, растворы солей. Они образуют окись железа, что приводит к появлению ржавчины. Различают два вида химической коррозии:
- газовая;
- жидкостная.
Электрохимическая коррозия
В среде электролитов атом выпадает из кристаллической решетки и происходит анодная и катодная реакция. Ионы металла (электроны) проникают в раствор и далее соединяются с окислителем. Этот процесс называется деполяризацией.
Электрохимическая коррозия существуют в двух разновидностях:
- в электролитах;
- атмосферная коррозия.
Металлические поверхности, контактируя с воздухом, в некоторых местах поверхности могут быть анодом, другие катодом. Такую коррозию называют:
- аэрационная;
- морская;
- биологическая;
- другие.
Методы защиты от коррозии
Ущерб от коррозии ежегодно исчисляется миллиардными убытками. И способы защиты покрытий являются основой для защиты металлических конструкций от коррозии.
И способы защиты покрытий являются основой для защиты металлических конструкций от коррозии.
Защитные покрытия подразделяются:
- анодное или катодное;
- лаком, битумом, красками;
- химическими составами;
- протекторная защита.
Самой популярной в настоящее время является лакокрасочная защита металлических конструкций. Стоит недорого, защищает поверхность в течение 7- 8 лет, а другие средства защиты металлических конструкций от коррозии являются более затратными.
Загрязнение атмосферы влияет на процессы коррозии металлов и исключить
это разрушение невозможно. Можно только замедлить коррозийный процесс, применяя различные методы защиты.
Коррозия металлов
Интересные темы
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H2O=4Fe(OH)3
Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Электрохимия коррозии: 6 электрохимических реакций
Коррозия — это электрохимический метод разрушения материалов. Во многих случаях — и особенно когда присутствуют жидкости — это связано с химией. Во время коррозии электроны из отдельных участков поверхности металла перетекают в альтернативные участки через атмосферу, способную проводить ионы. Это простая химия коррозии, но деталей совсем нет. То же самое касается воздействия.
Реклама
На самом деле экономические последствия коррозии намного больше, чем многие думают. Согласно отчету CC Technologies Laboratories Inc. за 2001 год, стоимость коррозии только в США составляла 276 миллиардов долларов в год. Из них 121 миллиард долларов был потрачен на борьбу с коррозией, а остальные 155 миллиардов долларов были понесены в качестве чистого убытка для экономики. Коммунальные услуги, особенно водопроводные и канализационные системы, испытывают наибольшее экономическое воздействие, за ними следуют автомобили и транспорт.
Коммунальные услуги, особенно водопроводные и канализационные системы, испытывают наибольшее экономическое воздействие, за ними следуют автомобили и транспорт.
Поскольку коррозия металлов представляет собой непрерывный электрохимический процесс, очень важно знать основную природу электрохимических реакций, чтобы должным образом подавлять коррозию и уменьшать ее воздействие на конструкции. В этой статье мы обсудим механизмы коррозии, подробно рассмотрев:
Реклама
- Электрохимические реакции
- Ячейка Даниэля
- Анодный метод
- Закон Фарадея
- Катодный метод 0013 Воздействие на площадь поверхности
Что такое электрохимия коррозии?
Коррозия в водной среде и в атмосферных условиях представляет собой электрохимический процесс, при котором электроны переносятся между металлической поверхностью и жидким раствором электролита, что приводит к ухудшению состояния подложки. Коррозия возникает из-за сильной склонности металлов к электрохимическим реакциям с кислородом, водой и другими веществами в атмосфере. В этом контексте термин «анод» используется для объяснения той части поверхности металла, которая действительно подвергается коррозии, тогда как термин «катод» используется для объяснения поверхности металла, которая поглощает электроны, образующиеся в результате реакции коррозии. Улик Р. Эванс, пионер объяснения коррозии как электрохимического процесса, сказал, что ее можно описать как разрушение электрохимическими или химическими агентами. Таким образом, электрохимия коррозии — это просто электрохимический метод, с помощью которого мы можем понять механизмы коррозии.
Коррозия возникает из-за сильной склонности металлов к электрохимическим реакциям с кислородом, водой и другими веществами в атмосфере. В этом контексте термин «анод» используется для объяснения той части поверхности металла, которая действительно подвергается коррозии, тогда как термин «катод» используется для объяснения поверхности металла, которая поглощает электроны, образующиеся в результате реакции коррозии. Улик Р. Эванс, пионер объяснения коррозии как электрохимического процесса, сказал, что ее можно описать как разрушение электрохимическими или химическими агентами. Таким образом, электрохимия коррозии — это просто электрохимический метод, с помощью которого мы можем понять механизмы коррозии.
Электрохимические реакции
Электрохимическая реакция определяется как реакция с переносом электронов. Это также реакция, которая включает окисление и восстановление. Тот факт, что коррозия состоит как минимум из одной химической реакции и одной реакции восстановления, не совсем очевиден, потому что обе реакции обычно сочетаются в одном куске металла (например, в цинке), как схематично показано ниже.
Рис. 1. Электрохимические реакции при коррозии Zn в безвоздушной HCl.
Реклама
На рисунке 1 кусочек цинка, погруженный в раствор кислоты, подвергается коррозии. В какой-то момент на поверхности Zn превращается в ионы Zn, теряя электроны. Эти электроны проходят через твердый проводящий металл к альтернативным местам на поверхности металла, где ионы водорода (H) восстанавливаются до газообразного водорода в соответствии со следующим уравнением:
Эти уравнения иллюстрируют характер электрохимической реакции в цинке. На протяжении всей такой реакции передаются электроны, или, если рассматривать ее по-другому, реакция окисления происходит в сочетании с реакцией восстановления.
Следовательно, в электрохимии анодные и катодные реакции протекают одновременно и с одинаковыми скоростями. Однако коррозия происходит исключительно в областях, которые функционируют как аноды.
Ячейка Даниэля и электрохимическая коррозия
Доктрина электрохимических реакций используется в ячейке Даниэля, во время которых металлы меди и цинка погружаются в растворы их индивидуальных сульфатов. Ячейка Даниэля была первой разумной и надежной батареей, поддерживавшей несколько разрядов.Электрические инновации го века, такие как телеграф.
Ячейка Даниэля была первой разумной и надежной батареей, поддерживавшей несколько разрядов.Электрические инновации го века, такие как телеграф.
В ячейке Даниэля электроны переносятся от корродирующего цинка к меди по токопроводящему пути в виде электрического тока. (Узнайте о похожей коррозионной ячейке в статье «Введение в ячейку Александра».) Цинк теряет электроны быстрее, чем медь, а это означает, что раствор цинка и меди в растворах их солей вызовет поток электронов через внешний провод, который ведет к из цинка в медь по следующим реакциям:
Разница в коррозионном потенциале между двумя металлами обычно вызывает сценарий, называемый гальванической коррозией, названной в честь ее первооткрывателя Луиджи Гальвани.
Такая ситуация характерна для ячеек с естественной коррозией, где электролит дополняет ячейку коррозии. Проводимость жидкой атмосферы, такой как почва, бетон или вода, обычно связана с ее коррозионной активностью.
Сокращенное описание в следующем уравнении действительно для каждой конфигурации ячейки Daniell.
Это уравнение идентифицирует цинковый электрод как анод, потому что он отрицательный в случае спонтанной реакции, в то время как медный электрод является катодом из-за его положительного заряда.
Анодный метод и коррозия
Теперь мы более подробно рассмотрим, что происходит на аноде после возникновения коррозии (анодный метод). Например, реакция коррозии железа (Fe), которая включает восстановление ионов водорода до газообразного водорода, согласуется с электрохимической реакцией цинка в хлористом водороде (HCl). Эта реакция выделения водорода происходит в различных металлах и кислотах и может включать соляную, серную, хлорную, плавиковую, муравьиную и альтернативные кислоты. Отдельные анодные реакции для железа, никеля и алюминия перечислены ниже:
Мы можем записать общую анодную реакцию, происходящую во время коррозии, рассмотрев приведенные выше уравнения как: с валентным зарядом n+ и, следовательно, с высвобождением «n» электронов.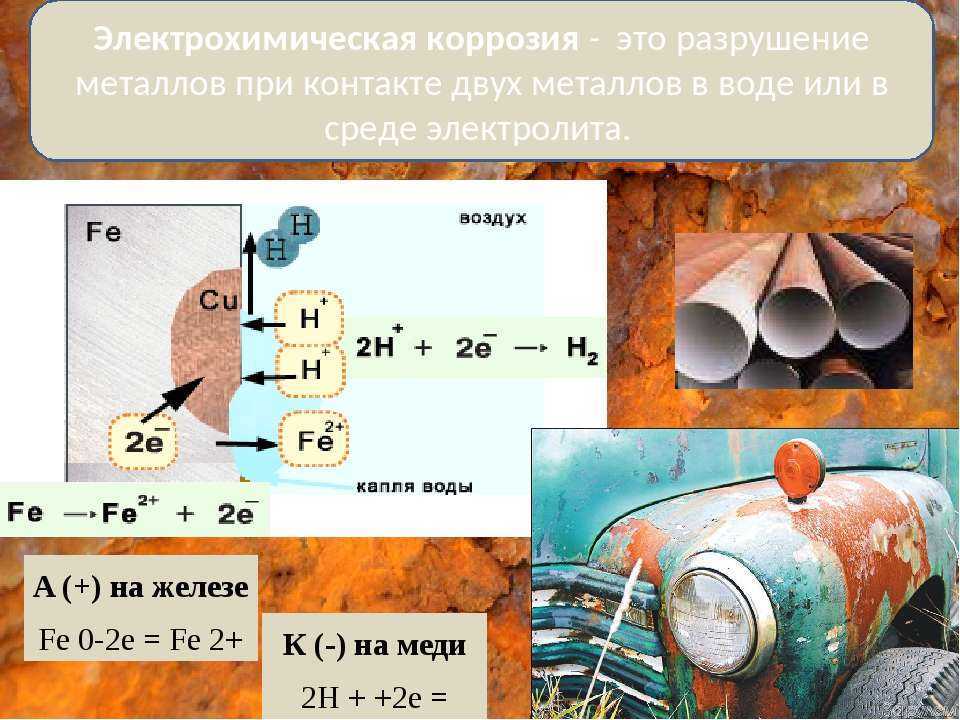 Ценность n, конечно, полностью зависит от характера металла. Некоторые металлы, такие как серебро, являются одновалентными, в то время как многовалентное железо, титан и уран обладают положительным зарядом до +6. Это уравнение является общим и применимо ко всем без исключения реакциям коррозии.
Ценность n, конечно, полностью зависит от характера металла. Некоторые металлы, такие как серебро, являются одновалентными, в то время как многовалентное железо, титан и уран обладают положительным зарядом до +6. Это уравнение является общим и применимо ко всем без исключения реакциям коррозии.
Закон Фарадея и электрохимия коррозии
Если бы ток, генерируемый одной из анодных реакций, описанных ранее, был известен, можно было бы преобразовать этот ток в аналогичную скорость потери массы или скорости проникновения коррозии, используя полезное соотношение, открытое Майклом Фарадеем. . (См. Преобразование скорости коррозии: простые способы преобразования данных между распространенными единицами измерения коррозии, чтобы узнать о скорости коррозии.) Эмпирические законы электролиза Фарадея связывают ток электрохимической реакции с количеством молей реагирующего элемента. Предположим, что заряд, необходимый для такой реакции, составляет один электрон на молекулу, как в случае гальваники или коррозионного воздействия серебра, это может быть показано как:
Согласно закону Фарадея, для реакции с одним молем серебра потребуется один моль электронов или одно число электронов Авогадро (6,022 x 10 23 ). Заряд, переносимый одним молем электронов, известен как один Фарадей (F). Один Фарадей равен 96 485 Кл/(моль электронов). Объединение основных представлений Фарадея с конкретными электрохимическими реакциями общепризнанной стехиометрии дает нам следующее уравнение:
Заряд, переносимый одним молем электронов, известен как один Фарадей (F). Один Фарадей равен 96 485 Кл/(моль электронов). Объединение основных представлений Фарадея с конкретными электрохимическими реакциями общепризнанной стехиометрии дает нам следующее уравнение:
Где:
N — число молей и Δ N — изменение этого количества
n — число электронов на молекулу реагирующего вещества
I — общий ток в амперах (А)
t — период электрохимического метода в секундах (с)
Катодный метод
Когда ионы водорода (H) восстанавливаются до их атомарного типа, они обычно смешиваются, как показано ранее, с образованием газообразного водорода в результате реакции с электронами на катодной поверхности. Это восстановление ионов водорода на катодной поверхности может нарушить баланс между кислыми ионами водорода (H+) и образующими основания ионами гидроксила (OH-), делая раствор менее кислым, более щелочным или щелочным в этой области.
В нейтральной воде анодная коррозия некоторых металлов, таких как алюминий (Al), цинк (Zn) или магний (Mg), создает достаточно энергии для непосредственного отделения воды, как показано в следующем уравнении и на рисунке:
Рис. 2. Электрохимические реакции Mg при коррозии в нейтральной воде.
Изменение концентрации ионов H или увеличение содержания ионов гидроксила (OH) может быть выявлено путем измерения уровня pH для обнаружения поверхностей, на которых происходят катодные реакции. В процессе коррозии может происходить множество катодных реакций. Среди них:
Кислородное восстановление
Кислородное восстановление является обычной катодной реакцией, поскольку кислород присутствует в атмосфере и в растворах, подвергающихся воздействию окружающей среды. Хотя и нечасто, восстановление ионов металла и осаждение металла вызывают серьезные проблемы с коррозией, например: осаждение ионов меди, которые образуются перед водяным контуром, на внутренней алюминиевой поверхности радиатора. Поэтому, как правило, следует избегать использования медного трубопровода в контуре на водной основе, где также присутствует алюминий.
Поэтому, как правило, следует избегать использования медного трубопровода в контуре на водной основе, где также присутствует алюминий.
Все реакции коррозии представляют собой просто комбинации одной или многих из вышеперечисленных катодных реакций в сочетании с анодной реакцией. Таким образом, каждый случай жидкостной коррозии в большинстве случаев может быть сведен к этим уравнениям либо по отдельности, либо в комбинации. Учитывайте коррозию Zn (цинка) водой или влажным воздухом. Умножая реакцию окисления цинка на 2 и суммируя ее с реакцией восстановления кислорода, можно получить следующее уравнение:
Продуктами этой реакции являются Zn 2+ и OH – , которые сразу превращаются в нерастворимый Zn(OH) 2 . Точно так же коррозия Zn сульфатом меди, представленная в следующем уравнении, представляет собой просто суммирование реакции окисления Zn и реакции осаждения металла с участием ионов меди (II):
может иметь место реакция восстановления. Например, при коррозии Zn в концентрированном растворе соляной кислоты, содержащем растворенный кислород, возможны две катодные реакции. Один представляет собой выделение H, а другой – восстановление кислорода. Поскольку есть две катодные реакции или методы, которые потребляют электроны, общая скорость коррозии цинка завышена. Таким образом, он обычно более агрессивен, чем кислоты, не содержащие воздуха, и удаление кислорода из растворов кислот обычно может сделать эти растворы менее коррозионно-активными. Это типичный метод снижения коррозионной активности во многих условиях. Кислород можно удалить химическим или механическим способом.
Например, при коррозии Zn в концентрированном растворе соляной кислоты, содержащем растворенный кислород, возможны две катодные реакции. Один представляет собой выделение H, а другой – восстановление кислорода. Поскольку есть две катодные реакции или методы, которые потребляют электроны, общая скорость коррозии цинка завышена. Таким образом, он обычно более агрессивен, чем кислоты, не содержащие воздуха, и удаление кислорода из растворов кислот обычно может сделать эти растворы менее коррозионно-активными. Это типичный метод снижения коррозионной активности во многих условиях. Кислород можно удалить химическим или механическим способом.
Воздействие на площадь поверхности
При коррозии куска металла электроны, образующиеся в анодных областях, проходят через металл, реагируя на катодные области, которые в равной степени подвержены воздействию окружающей среды, где они восстанавливают электрический баланс системы. Сам факт отсутствия суммарного накопления зарядов на коррозионной поверхности имеет жизненно важное значение для понимания большинства процессов коррозии и способов их смягчения. Однако равенство между анодным и катодным токами, выраженное в следующем уравнении, не означает, что плотности тока для этих токов равны:
Однако равенство между анодным и катодным токами, выраженное в следующем уравнении, не означает, что плотности тока для этих токов равны:
Взяв относительные анодные (S a ) и катодные (S c ) площади поверхности (и связанные с ними плотности тока ia 90ic и единиц ), это уравнение может быть выражено через плотности тока.
Значение отношения площади поверхности (S c /S a) в приведенном выше уравнении особенно важно, когда речь идет о нескольких разновидностях локальной коррозии, таких как точечная коррозия и коррозионное растрескивание под напряжением. (Дополнительную информацию о коррозионном растрескивании под напряжением см. в разделе Что вызывает коррозионное растрескивание под напряжением в трубопроводах?) Это также имеет большое значение для возникновения коррозии в разнородных металлах.
Легко понять, что результат определенного количества анодного тока, сфокусированного на небольшом участке поверхности металла, будет намного больше, чем когда такое же количество тока рассеивается на гораздо большей площади. Это важная проблема усиления анодного тока, когда S c /S a больше единицы, и фактор подавления, когда он меньше единицы.
Это важная проблема усиления анодного тока, когда S c /S a больше единицы, и фактор подавления, когда он меньше единицы.
Причину плотности тока можно увидеть при соединении двух разнородных металлов (здесь это Cu и Fe), что схематично показано на рисунке 3 ниже.
Рис. 3. Области, пораженные разнородными металлами, где «а» — стальные заклепки на медных пластинах, а «б» — медные заклепки на стальных пластинах.
Когда стальные заклепки являются частью медных пластин, коррозия катодных медных пластин будет низкой, а коррозия малых заклепок из анодной стали будет высокой. С другой стороны, если медные заклепки соединяют стальные пластины, коррозия меди будет высокой, а коррозия стальных пластин едва заметна.
Ключ к пониманию предотвращения коррозии
В этой статье мы рассмотрели коррозию как электрохимическое явление, при котором материалы/конструкции разрушаются. Подробно рассмотрены электрохимические реакции коррозии с помощью ячейки Даниэля, анодного метода, катодного метода, законов Фарадея и эффектов площади поверхности. Поскольку мы можем предотвратить коррозию, если хорошо понимаем электрохимию коррозии, производители и пользователи продуктов коррозии должны быть внимательны к электрохимическим механизмам коррозии.
Подробно рассмотрены электрохимические реакции коррозии с помощью ячейки Даниэля, анодного метода, катодного метода, законов Фарадея и эффектов площади поверхности. Поскольку мы можем предотвратить коррозию, если хорошо понимаем электрохимию коррозии, производители и пользователи продуктов коррозии должны быть внимательны к электрохимическим механизмам коррозии.
Реклама
Родственные термины
- Электрохимическая реакция
- Закон Фарадея
- Анод
- Катод
- Окисление
- Сокращение
- Гальваническая коррозия
- Площадь воздействия
- Дэниел Сотовый
- Валентность
Поделиться этой статьей
| Вернуться к:
Домашняя страница энциклопедии
Содержание
Указатель авторов
Предметный указатель
Search
Словарь
Домашняя страница ESTIR
Домашняя страница ЭКС Джером Крюгер Университет Джона Хопкинса Балтимор, Мэриленд 21218, США (апрель 2001 г.  ) ) Улик Р. Эванс, британский ученый, которого считают «отцом науки о коррозии», сказал, что «коррозия в значительной степени представляет собой электрохимическое явление, [которое] можно определить как разрушение электрохимическими или химическими агентами …». Коррозия в водной среде и в атмосферной среде (которая также включает тонкие водные слои) является электрохимическим процессом, поскольку коррозия включает перенос электронов между металлической поверхностью и водным раствором электролита. Это происходит из-за подавляющей склонности металлов к электрохимическим реакциям с кислородом, водой и другими веществами в водной среде. К счастью, большинство полезных металлов вступают в реакцию с окружающей средой, образуя более или менее защитные пленки продуктов реакции коррозии, которые не позволяют металлам переходить в раствор в виде ионов. Хотя в последние годы термин «коррозия» применялся ко всем видам материалов во всех средах, в этой статье будет рассматриваться только электрохимия коррозии металлов и сплавов в водных растворах при температуре окружающей среды. Протекающая в таких условиях электрохимическая коррозия является крупным разрушительным процессом, приводящим к таким дорогостоящим, неприглядным и разрушительным последствиям, как образование ржавчины и других продуктов коррозии, образование зияющих дыр или трещин в самолетах, автомобилях, лодках, водосточных желобах, экранах. , сантехника и многие другие предметы, сделанные из любого металла, кроме золота. Такие системы, как ядерные реакторы с кипящей водой, использующие водные растворы, также являются примерами электрохимической коррозии, но не будут рассматриваться. В этой статье также не будет рассматриваться неэлектрохимический процесс, называемый высокотемпературным окислением, деструктивный процесс, представляющий собой воздействие на металл или сплав высоких температур в газовой среде (обычно включая кислород или газы с серосодержащими соединениями), где более толстые слои образуются продукты коррозии. Последствия коррозииКоррозия имеет много серьезных последствий для экономики, здоровья, безопасности, технологий и культуры для нашего общества. Экономические эффекты Исследования в ряде стран пытались определить национальную стоимость коррозии. Самым обширным из этих исследований было исследование, проведенное в Соединенных Штатах в 1976 году, которое показало, что общие ежегодные затраты на металлическую коррозию для экономики США составляют 70 миллиардов долларов, или 4,2% валового национального продукта. Чтобы почувствовать серьезность этой потери, мы можем сравнить ее с другим экономическим воздействием, которое всех беспокоит — импортом иностранной сырой нефти, который стоил 45 миллиардов долларов в 1919 году.77. Влияние на здоровье В последние годы все чаще используются металлические протезы в организме, такие как штифты, пластины, тазобедренные суставы, кардиостимуляторы и другие имплантаты. Были разработаны новые сплавы и улучшенные методы имплантации, но коррозия продолжает создавать проблемы. Примеры включают отказы из-за разорванных соединений в кардиостимуляторах, воспаление, вызванное продуктами коррозии в тканях вокруг имплантатов, и разрушение протезов, несущих нагрузку. Примером последнего является использование металлических тазобедренных суставов, которые могут облегчить некоторые проблемы артрита тазобедренного сустава. В последние годы ситуация улучшилась, так что тазобедренные суставы, которые сначала использовались только у людей старше 60 лет, теперь используются у более молодых людей, потому что они служат дольше. Чтобы почувствовать серьезность этой потери, мы можем сравнить ее с другим экономическим воздействием, которое всех беспокоит — импортом иностранной сырой нефти, который стоил 45 миллиардов долларов в 1919 году.77. Влияние на здоровье В последние годы все чаще используются металлические протезы в организме, такие как штифты, пластины, тазобедренные суставы, кардиостимуляторы и другие имплантаты. Были разработаны новые сплавы и улучшенные методы имплантации, но коррозия продолжает создавать проблемы. Примеры включают отказы из-за разорванных соединений в кардиостимуляторах, воспаление, вызванное продуктами коррозии в тканях вокруг имплантатов, и разрушение протезов, несущих нагрузку. Примером последнего является использование металлических тазобедренных суставов, которые могут облегчить некоторые проблемы артрита тазобедренного сустава. В последние годы ситуация улучшилась, так что тазобедренные суставы, которые сначала использовались только у людей старше 60 лет, теперь используются у более молодых людей, потому что они служат дольше. Защитные эффекты Еще более серьезной проблемой является коррозия конструкций, которая может привести к тяжелым травмам или даже гибели людей. На безопасность влияет коррозия, способствующая выходу из строя мостов, самолетов, автомобилей, газопроводов и т. д. всего комплекса металлических конструкций и устройств, составляющих современный мир. Технологические эффекты Экономические последствия коррозии сказываются на технологии. В значительной степени разработка новых технологий сдерживается проблемами коррозии, поскольку материалы должны выдерживать, во многих случаях одновременно, более высокие температуры, более высокое давление и более агрессивные среды. Проблемы с коррозией, которые легче решить, затрагивают солнечные энергетические системы, в которых сплавы должны выдерживать воздействие горячих циркулирующих теплоносителей в течение длительных периодов времени, и геотермальные системы, в которых требуется, чтобы материалы выдерживали высококонцентрированные растворы коррозионно-активных солей при высоких температурах и давлениях. Защитные эффекты Еще более серьезной проблемой является коррозия конструкций, которая может привести к тяжелым травмам или даже гибели людей. На безопасность влияет коррозия, способствующая выходу из строя мостов, самолетов, автомобилей, газопроводов и т. д. всего комплекса металлических конструкций и устройств, составляющих современный мир. Технологические эффекты Экономические последствия коррозии сказываются на технологии. В значительной степени разработка новых технологий сдерживается проблемами коррозии, поскольку материалы должны выдерживать, во многих случаях одновременно, более высокие температуры, более высокое давление и более агрессивные среды. Проблемы с коррозией, которые легче решить, затрагивают солнечные энергетические системы, в которых сплавы должны выдерживать воздействие горячих циркулирующих теплоносителей в течение длительных периодов времени, и геотермальные системы, в которых требуется, чтобы материалы выдерживали высококонцентрированные растворы коррозионно-активных солей при высоких температурах и давлениях. Другой пример, бурение на нефть в море и на суше, включает в себя преодоление таких проблем коррозии, как сульфидная коррозия под напряжением, микробиологическая коррозия и широкий спектр трудностей, связанных с работой в высококоррозионной морской среде. Во многих из этих случаев коррозия является ограничивающим фактором, препятствующим разработке экономически или даже технологически работоспособных систем. Культурные предметы Международную обеспокоенность вызвало сообщение о серьезном износе художественных и культурно значимых позолоченных бронзовых статуй в Венеции, Италия. Коррозионные процессы ускорят износ драгоценных артефактов, таких как те, что находятся в Венеции, из-за сильно загрязненной окружающей среды, которая сейчас распространена в большинстве стран мира. Точно так же в музеях мира консерваторы и реставраторы трудятся, чтобы защитить культурные ценности от разрушительного действия коррозии или удалить ее следы с художественных или культурно важных артефактов. Другой пример, бурение на нефть в море и на суше, включает в себя преодоление таких проблем коррозии, как сульфидная коррозия под напряжением, микробиологическая коррозия и широкий спектр трудностей, связанных с работой в высококоррозионной морской среде. Во многих из этих случаев коррозия является ограничивающим фактором, препятствующим разработке экономически или даже технологически работоспособных систем. Культурные предметы Международную обеспокоенность вызвало сообщение о серьезном износе художественных и культурно значимых позолоченных бронзовых статуй в Венеции, Италия. Коррозионные процессы ускорят износ драгоценных артефактов, таких как те, что находятся в Венеции, из-за сильно загрязненной окружающей среды, которая сейчас распространена в большинстве стран мира. Точно так же в музеях мира консерваторы и реставраторы трудятся, чтобы защитить культурные ценности от разрушительного действия коррозии или удалить ее следы с художественных или культурно важных артефактов. Электрохимия коррозииОдна и та же металлическая поверхность, подверженная воздействию водного электролита, обычно имеет места для окисления (или анодной химической реакции), в результате которого в металле образуются электроны, и для восстановления (или катодной реакции), в результате которого электроны, образующиеся в результате анодной реакции, потребляются. Эти «участки» вместе составляют «коррозионную ячейку». Анодная реакция представляет собой растворение металла с образованием либо растворимых ионных продуктов, либо нерастворимого соединения металла, обычно оксида. Возможны несколько катодных реакций в зависимости от того, какие восстанавливаемые частицы присутствуют в растворе. Типичными реакциями являются восстановление растворенного газообразного кислорода или восстановление растворителя (воды) с получением газообразного водорода. Примеры таких реакций приведены в Приложении. Поскольку эти анодная и катодная реакции происходят одновременно на поверхности металла, они создают электрохимическую ячейку типа, показанного на рисунке 1.
Места, где протекают анодные и катодные реакции, аноды и катоды коррозионной ячейки, определяются многими факторами: (i) они не обязательно закреплены на месте; (ii) они могут быть смежными или далеко друг от друга, так что, например, если два металла находятся в контакте, один металл может быть анодом, а другой катодом, что приводит к гальванической коррозии более анодного металла; (iii) могут существовать поверхностные колебания концентрации кислорода в окружающей среде, что приводит к установлению анода на тех участках, которые подвергаются воздействию среды с более низким содержанием кислорода дифференциальная аэрационная коррозия; (iv) или аналогичным образом, изменения концентрации ионов металлов или других веществ в окружающей среде, возникающие из-за пространственной ориентации корродирующего металла и гравитации; или, наконец, (v) вариации однородности поверхности металла из-за наличия включений, различных фаз, границ зерен, нарушения металла и других причин могут привести к образованию анодных и катодных участков. Процесс, происходящий на анодных участках, представляет собой растворение металла в виде ионов металлов в электролите или превращение этих ионов в нерастворимые продукты коррозии, такие как ржавчина. Это разрушительный процесс, называемый коррозией. Поток электронов между корродирующими анодами и некорродирующими катодами образует коррозионный ток, величина которого определяется скоростью образования электронов анодной реакцией и их потребления катодной реакцией. Скорости производства и потребления электронов, конечно, должны быть равными, иначе произойдет накопление заряда. Движущая сила, склонность к коррозииДвижущая сила необходима для движения электронов между анодами и катодами. Этой движущей силой является разница потенциалов между анодным и катодным участками. Это различие существует потому, что каждая реакция окисления или восстановления связана с потенциалом, определяемым тенденцией к самопроизвольному протеканию реакции. Потенциал является мерой этой тенденции. Электрохимические равновесия: окисление и восстановление Поскольку большинство коррозионных реакций, протекающих в присутствии жидкости, такой как вода, являются не химическими, а электрохимическими, использование химических равновесий для изучения водной коррозии имеет минимальное значение. Полезным способом изучения связи потенциала с коррозией является использование диаграммы электрохимического равновесия, называемой «диаграммой Пурбэ», разработанной М. Пурбэ (доступно на WWW). большое значение для коррозионных процессов. Электрохимические равновесия: окисление и восстановление Поскольку большинство коррозионных реакций, протекающих в присутствии жидкости, такой как вода, являются не химическими, а электрохимическими, использование химических равновесий для изучения водной коррозии имеет минимальное значение. Полезным способом изучения связи потенциала с коррозией является использование диаграммы электрохимического равновесия, называемой «диаграммой Пурбэ», разработанной М. Пурбэ (доступно на WWW). большое значение для коррозионных процессов.
 Такая пленка может резко повлиять на скорость коррозии, а в некоторых случаях практически остановить ее (см. Пассивность и пробой). Линии (a) и (b) на рисунке 2 представляют восстановление кислорода (приложение, уравнения [2] или [3]) и выделение водорода (приложение, уравнение [4]) соответственно. Они являются мерой концентрации кислорода или водорода в растворе и показывают изменение потенциала в зависимости от pH для растворов, находящихся в равновесии с одной атмосферой кислорода или водорода. Линии, проведенные параллельно (а), но ниже, показывают изменение потенциала в зависимости от рН для раствора, содержащего меньшее количество кислорода, чем представлено (а). Таким образом, потенциал образца может дать некоторое представление о концентрации кислорода в окружающей среде. Различия в концентрации кислорода между разными участками металла приводят к дифференциальная аэрация, коррозия , упомянутая выше. С помощью диаграммы Пурбе путем измерения потенциала и рН можно получить некоторое представление о склонности металла находиться в невосприимчивом, пассивном или коррозионном режиме, а также оценить влияние ограниченного или легкого доступа кислорода на его состояние. Такая пленка может резко повлиять на скорость коррозии, а в некоторых случаях практически остановить ее (см. Пассивность и пробой). Линии (a) и (b) на рисунке 2 представляют восстановление кислорода (приложение, уравнения [2] или [3]) и выделение водорода (приложение, уравнение [4]) соответственно. Они являются мерой концентрации кислорода или водорода в растворе и показывают изменение потенциала в зависимости от pH для растворов, находящихся в равновесии с одной атмосферой кислорода или водорода. Линии, проведенные параллельно (а), но ниже, показывают изменение потенциала в зависимости от рН для раствора, содержащего меньшее количество кислорода, чем представлено (а). Таким образом, потенциал образца может дать некоторое представление о концентрации кислорода в окружающей среде. Различия в концентрации кислорода между разными участками металла приводят к дифференциальная аэрация, коррозия , упомянутая выше. С помощью диаграммы Пурбе путем измерения потенциала и рН можно получить некоторое представление о склонности металла находиться в невосприимчивом, пассивном или коррозионном режиме, а также оценить влияние ограниченного или легкого доступа кислорода на его состояние. коррозионный процесс. коррозионный процесс. Кинетика, скорость коррозииХотя необходимо определить склонность к коррозии путем измерения потенциалов, недостаточно установить, будет ли данный металл или сплав подвергаться коррозии при заданном наборе условий окружающей среды. Потому что, хотя склонность к коррозии может быть высокой, скорость коррозии может быть очень низкой, и, таким образом, коррозия может не представлять проблемы. Скорость коррозии определяется путем подачи тока для получения поляризационной кривой (степень изменения потенциала в зависимости от величины приложенного тока) для металлической поверхности, скорость коррозии которой определяется. Когда потенциал металлической поверхности поляризуется приложением тока в положительном направлении, говорят, что он анодно поляризован; отрицательное направление означает, что он катодно поляризован. Степень поляризации является мерой того, насколько скорости анодных и катодных реакций замедляются под воздействием различных факторов окружающей среды (концентрация ионов металлов, растворенного кислорода и т.
 также Приложение). На этом рисунке «Е о,а » и «Е о,с » — равновесные потенциалы рассматриваемых реакций (анодных или катодных). «Линии Тафеля» характеризуются «наклоном» линейной части поляризационной кривой и их «пересечением» при экстраполяции к равновесному потенциалу. «Пересечение» пропорционально логарифму плотности тока обмена «i o » (то есть выражает собственную скорость электродной реакции). Значения этих характеристических констант в уравнении Тафеля зависят от рассматриваемого металла и окружающей среды. Анодный и катодный линейные участки поляризационных кривых можно экстраполировать на коррозионный потенциал “Е корр “, где в идеальных условиях они должны пересекаться. Величиной тока в месте их пересечения будет скорость коррозии “i корр “, выраженная в плотности тока. Значения плотностей тока обмена для катодной анодные реакции оказывают сильное влияние на скорость коррозии. Это показано на примере использования двух значений “i o,c ” (но для простоты предполагается, что “E o,c ” постоянная): чем больше “i o,c ” чем больше скорость коррозии, “i корр. также Приложение). На этом рисунке «Е о,а » и «Е о,с » — равновесные потенциалы рассматриваемых реакций (анодных или катодных). «Линии Тафеля» характеризуются «наклоном» линейной части поляризационной кривой и их «пересечением» при экстраполяции к равновесному потенциалу. «Пересечение» пропорционально логарифму плотности тока обмена «i o » (то есть выражает собственную скорость электродной реакции). Значения этих характеристических констант в уравнении Тафеля зависят от рассматриваемого металла и окружающей среды. Анодный и катодный линейные участки поляризационных кривых можно экстраполировать на коррозионный потенциал “Е корр “, где в идеальных условиях они должны пересекаться. Величиной тока в месте их пересечения будет скорость коррозии “i корр “, выраженная в плотности тока. Значения плотностей тока обмена для катодной анодные реакции оказывают сильное влияние на скорость коррозии. Это показано на примере использования двух значений “i o,c ” (но для простоты предполагается, что “E o,c ” постоянная): чем больше “i o,c ” чем больше скорость коррозии, “i корр. ” (см. рисунок 3). ” (см. рисунок 3). Части экстраполяции, показанные на рис. 3, дают диаграммы (диаграммы Эванса), показанные на рис. 4. Относительные значения «наклонов» анодных или катодных поляризационных кривых определяют, анодная, катодная или обе реакции контролируют скорость реакции. процесс коррозии. Диаграммы Эванса широко используются учеными и инженерами-коррозионистами для оценки влияния различных факторов на скорость коррозии.  Для целей данного обсуждения достаточно охарактеризовать пассивность как условия, существующие на поверхности металла из-за наличия защитной пленки, природа которой является источником разногласий, которая заметно снижает скорость коррозии, даже если активна. коррозии можно было бы ожидать из соображений движущей силы (склонности к коррозии). Для целей данного обсуждения достаточно охарактеризовать пассивность как условия, существующие на поверхности металла из-за наличия защитной пленки, природа которой является источником разногласий, которая заметно снижает скорость коррозии, даже если активна. коррозии можно было бы ожидать из соображений движущей силы (склонности к коррозии). Чтобы быть эффективной, пассивная пленка должна обеспечивать защитный барьер, который удерживает ток коррозии на металлической поверхности на достаточно низком уровне, чтобы свести к минимуму степень коррозионного повреждения. Эффективная пленка — это та, которая противостоит разрушению (называемому разрушением) пассивной пленки. Процессы разрушения приводят к формам локальной коррозии, которые являются одними из основных источников коррозионных разрушений, точечной, щелевой, межкристаллитной коррозии и коррозии под напряжением (см. ниже). Они вызывают разрушение пассивной пленки и, таким образом, подвергают дискретные оголенные участки поверхности металла воздействию окружающей среды, где вероятность атаки очень высока. С процессом разрушения пассивной пленки конкурирует процесс репассивации пассивной пленки. Таким образом, эффективным сплавом для сопротивления локальной коррозии будет сплав, поверхность которого не только образует пассивирующую пленку, которая противостоит процессу, ведущему к разрушению, но также способна репассивировать с достаточно высокой скоростью, так что, как только произойдет разрушение, воздействие коррозионного экология минимальна. Виды коррозииТолько что описанный процесс разрушения и восстановления пассивности связан со многими, но не со всеми различными типами коррозии. Точечная коррозия Возникновение ямки происходит, когда электрохимическое или химическое разрушение подвергает небольшой локальный участок на поверхности металла воздействию повреждающих частиц, таких как ионы хлорида. Места, где зарождаются ямки, до конца не изучены, но некоторые из них могут быть связаны с царапинами, неоднородностями состава поверхности (включениями) или местами, где существуют вариации окружающей среды. Ямка растет, если высокая плотность тока область инициирования пробоя чрезвычайно мала , участвующая в процессе репассивации, не препятствует образованию большой локальной концентрации ионов металла, образующихся при растворении в точке инициирования. Если скорость репассивации недостаточна для подавления роста ямок, возникают два новых условия. Во-первых, ионы металлов, образующиеся в процессе распада, осаждаются в виде твердых продуктов коррозии (таких как Fe(OH) 2 , Приложение, Уравнение [7]), которые обычно закрывают устье карьера. Это покрытие улавливает раствор в ямке и позволяет накапливать положительные ионы водорода в результате реакции гидролиза (Приложение, уравнение [5]). Затем хлорид или другие повреждающие отрицательные ионы диффундируют в яму, чтобы поддерживать нейтральность заряда. Следовательно, репассивация значительно затрудняется, поскольку раствор в яме очень кислый, содержит большую концентрацию повреждающих ионов и ионов металлов и низкую концентрацию кислорода. Тем самым скорость роста ямок ускоряется. Это покрытие улавливает раствор в ямке и позволяет накапливать положительные ионы водорода в результате реакции гидролиза (Приложение, уравнение [5]). Затем хлорид или другие повреждающие отрицательные ионы диффундируют в яму, чтобы поддерживать нейтральность заряда. Следовательно, репассивация значительно затрудняется, поскольку раствор в яме очень кислый, содержит большую концентрацию повреждающих ионов и ионов металлов и низкую концентрацию кислорода. Тем самым скорость роста ямок ускоряется.Ямка представляет собой анод электрохимической коррозионной ячейки, а катод ячейки представляет собой поверхность без изъязвлений. Поскольку площадь поверхности язвы составляет очень малую часть площади катодной поверхности, весь ток анодной коррозии течет на чрезвычайно малую площадь поверхности очага возникновения пробоя. Таким образом, плотность анодного тока становится очень высокой, и проникновение в металлическую конструкцию, имеющую лишь несколько ямок, может быть быстрым. Щелевая коррозия
 Коррозионная усталость в чем-то похожа на SCC. Он в основном отличается от SCC тем, что включает ситуации, когда напряжение применяется циклически, а не как статическое устойчивое растягивающее напряжение.  Равномерное коррозионное повреждение, иногда называемое потерями, обычно проявляется в постепенном утончении металлической детали до тех пор, пока она практически не растворится или не станет тонкой кружевной структурой. Гальваническая (и термогальваническая) коррозия Два металла, имеющие разные потенциалы в проводящем электролите, приводят к тому, что более анодный металл обычно подвергается гальванической коррозии. Из-за электрического контакта между двумя разными металлами гальваническая коррозия отличается от других форм коррозии, описанных ранее, тем, что анодный и катодный участки коррозионной ячейки находятся отдельно на двух связанных разных металлах, составляющих коррозионную ячейку, в то время как для других форм коррозии коррозии, катоды и аноды существуют на поверхности одного и того же металла. Равномерное коррозионное повреждение, иногда называемое потерями, обычно проявляется в постепенном утончении металлической детали до тех пор, пока она практически не растворится или не станет тонкой кружевной структурой. Гальваническая (и термогальваническая) коррозия Два металла, имеющие разные потенциалы в проводящем электролите, приводят к тому, что более анодный металл обычно подвергается гальванической коррозии. Из-за электрического контакта между двумя разными металлами гальваническая коррозия отличается от других форм коррозии, описанных ранее, тем, что анодный и катодный участки коррозионной ячейки находятся отдельно на двух связанных разных металлах, составляющих коррозионную ячейку, в то время как для других форм коррозии коррозии, катоды и аноды существуют на поверхности одного и того же металла. Значение разности потенциалов между двумя разнородными металлами обычно получают из списка стандартных равновесных потенциалов для различных металлов (для реакций типа, приведенного в Приложении, уравнение [1]).  В результате увеличивается концентрация остальных компонентов и происходит селективное выщелачивание. Этот вид коррозии также называют отрывом и, по наиболее распространенному примеру, селективным выщелачиванием цинка из латуни, обесцинкованием. Эрозионная коррозия Эрозионная коррозия возникает в результате разрушения защитно-пассивных пленок эрозионными или абразивными процессами. После удаления защитной или пассивной пленки в водном электролите происходят электрохимические процессы описанных выше типов коррозии. В результате увеличивается концентрация остальных компонентов и происходит селективное выщелачивание. Этот вид коррозии также называют отрывом и, по наиболее распространенному примеру, селективным выщелачиванием цинка из латуни, обесцинкованием. Эрозионная коррозия Эрозионная коррозия возникает в результате разрушения защитно-пассивных пленок эрозионными или абразивными процессами. После удаления защитной или пассивной пленки в водном электролите происходят электрохимические процессы описанных выше типов коррозии.Защита от коррозииТолько что описанные типы электрохимической коррозии можно предотвратить или контролировать, используя современное понимание принципов, лежащих в основе процессов коррозии. Это понимание стало основой для разработки ряда мер по предотвращению коррозии.
Другие меры, используемые для контроля процессов электрохимической коррозии, включают следующее: (i) Коррозионно-стойкие сплавы разработаны для обеспечения коррозионной стойкости и содержат такие компоненты, как хром, которые образуют более эффективные защитные пленки, устойчивые к разрушению и быстро восстанавливающие пассивацию. ПриложениеРеакции коррозии Ниже приведены некоторые примеры анодных и катодных реакций, протекающих одновременно на поверхности металла в «коррозионной ячейке».Типичное анодное окисление, при котором образуется растворенный ионный продукт, например, для металлического железа, представляет собой: [1] Fe ==> Fe 2+ + 2e – Примерами катодного восстановления, участвующего в процессе коррозии, являются: [2] O 2 + 2H 2 O + 4e – ==> 4OH – [3] O 2 + 4H + + 4e – ==> 2H 2 O [4] 2Н + + 2е – ==> Н 2 Катодная реакция, представленная уравнением [2], иллюстрирует коррозию в естественных условиях, где коррозия происходит при почти нейтральных значениях рН. [5] Fe 2+ + 2H 2 O ==> Fe(OH) 2 + 2H + В результате этой реакции образуются ионы Н + , концентрация которых при определенных условиях может стать большой, если ионы Н + не могут легко выйти из ограниченного объема. Общая коррозионная реакция представляет собой, конечно, сумму катодной и анодной парциальных реакций. Например, для реакции с образованием растворенных ионов (сумма реакций [1] и [4]): [6] Fe + 2H + ==> Fe 2+ + Н 2 или для реакции с образованием нерастворимого гидроксида (сумма реакций [1] и [2]): [7] 2Fe + O 2 + 2H 2 O ==> 2Fe(OH) 2 Уравнение Тафеля Уравнение Тафеля представляет собой раннее (1905 г. ) эмпирическое соотношение между перенапряжением электрода и плотностью тока, проходящего через электрод: ) эмпирическое соотношение между перенапряжением электрода и плотностью тока, проходящего через электрод:«а» и «b» — характеристические константы электродной системы. График электродного потенциала в зависимости от логарифма плотности тока называется «графиком Тафеля», а полученная прямая линия – «линии Тафеля». «b» представляет собой «наклон Тафеля», который дает информацию о механизме реакции, а «a» точка пересечения дает информацию о константе скорости (и плотности тока обмена) реакции. Связанные статьиАнодированиеАрхеологическое использование электрохимии Катодная/анодная защита от коррозии Ингибирование коррозии Библиография
Списки книг по электрохимии, обзорные главы, тома трудов и полные тексты некоторых исторических публикаций также доступны в Информационном ресурсе по науке и технологиям электрохимии (ESTIR). (http://knowledge.electrochem.org/estir/) Вернуться к: Топ Домашняя страница энциклопедии Содержание Указатель авторов Предметный указатель Искать Словарь Домашняя страница ESTIR Домашняя страница ЭКС | |||||||||||||
Организатор: The Electrochemical Society, Inc. (ECS) | Уведомление об авторских правах * Под редакцией: Золтана Наги ([email protected]) | кафедра химии | UNC в Чапел-Хилл |
Электрохимические испытания на коррозию | Анализ электрохимической коррозии
Описание метода
Вся коррозия представляет собой электрохимический процесс реакций окисления и восстановления. Когда происходит коррозия, электроны высвобождаются металлом (окисление) и приобретаются элементами (восстановление) в корродирующем растворе. Поскольку в реакции коррозии присутствует поток электронов (ток), его можно измерять и контролировать с помощью электроники. Таким образом, контролируемые электрохимические экспериментальные методы могут быть использованы для характеристики коррозионных свойств металлов и металлических компонентов в сочетании с различными растворами электролитов. Характеристики коррозии уникальны для каждой системы металл/раствор.
Когда происходит коррозия, электроны высвобождаются металлом (окисление) и приобретаются элементами (восстановление) в корродирующем растворе. Поскольку в реакции коррозии присутствует поток электронов (ток), его можно измерять и контролировать с помощью электроники. Таким образом, контролируемые электрохимические экспериментальные методы могут быть использованы для характеристики коррозионных свойств металлов и металлических компонентов в сочетании с различными растворами электролитов. Характеристики коррозии уникальны для каждой системы металл/раствор.
В практике тестирования используется поляризационная ячейка, состоящая из раствора электролита, электрода сравнения, противоэлектрода(ов) и исследуемого металлического образца, соединенного с держателем образца. (Образец называется рабочим электродом.) Электроды подключены к электронному прибору, называемому потенциостатом. Рабочий электрод, электрод сравнения и счетный электрод помещаются в раствор электролита, обычно раствор, наиболее близкий к реальной среде применения испытуемого материала. В растворе между различными электродами создается электрохимический потенциал (напряжение). Потенциал коррозии (E CORR ) измеряется потенциостатом как разность энергий между рабочим электродом и электродом сравнения.
В растворе между различными электродами создается электрохимический потенциал (напряжение). Потенциал коррозии (E CORR ) измеряется потенциостатом как разность энергий между рабочим электродом и электродом сравнения.
Эксперименты по электрохимической коррозии измеряют и/или контролируют потенциал и ток реакций окисления/восстановления. Можно провести несколько типов экспериментов, манипулируя этими двумя переменными и измеряя их.
В большинстве экспериментов к рабочему электроду прикладывается потенциал и измеряется результирующий ток. Потенциостатический эксперимент прикладывает постоянный потенциал к рабочему электроду в течение определенного периода времени. Измеренный ток отображается в зависимости от времени.
Для потенциодинамических экспериментов приложенный потенциал увеличивается со временем, в то время как ток постоянно контролируется. Ток (или плотность тока) отображается в зависимости от потенциала. После сканирования потенциала до заданной плотности тока или потенциала, сканирование потенциала может быть реверсировано, в то время как ток продолжает измеряться. Подобное потенциодинамическое сканирование называется обратной поляризацией или циклической поляризацией.
Подобное потенциодинамическое сканирование называется обратной поляризацией или циклической поляризацией.
Также возможно контролировать ток и измерять результирующий потенциал. Эксперименты, в которых накладывается ток, а не потенциал, называются гальванодинамическими или гальваностатическими. Гальванодинамические методы отображают изменение потенциала в зависимости от контролируемого тока. Гальваностатические тесты поддерживают постоянный ток и отображают изменение потенциала в зависимости от времени.
Аналитическая информация
Потенциодинамические эксперименты могут предоставить различные данные, связанные с точечной, щелевой коррозией и пассивацией для конкретных комбинаций образец/раствор. По мере увеличения потенциала точечная коррозия начинается при определенном значении, известном как потенциал пробоя (E B , самый низкий потенциал, при котором возникает точечная коррозия). Поскольку питтинговая коррозия связана с увеличением скорости окисления, E B определяется соответствующим увеличением измеренного тока. Увеличение Е B ассоциируется с более высокой стойкостью к точечной коррозии. По мере уменьшения потенциала при обратном сканировании происходит уменьшение тока. Однако для обратного сканирования наблюдается гистерезис и прослеживается петля гистерезиса. Образец репассивируется при потенциале, при котором обратное сканирование пересекает прямое сканирование. Потенциал репассивации, или защитный потенциал (E P ), возникает при более низком потенциале, чем E B . Отличие E B и E P относится к подверженности щелевой коррозии; чем больше гистерезис на поляризационной кривой, тем больше подверженность щелевой коррозии.
Поскольку питтинговая коррозия связана с увеличением скорости окисления, E B определяется соответствующим увеличением измеренного тока. Увеличение Е B ассоциируется с более высокой стойкостью к точечной коррозии. По мере уменьшения потенциала при обратном сканировании происходит уменьшение тока. Однако для обратного сканирования наблюдается гистерезис и прослеживается петля гистерезиса. Образец репассивируется при потенциале, при котором обратное сканирование пересекает прямое сканирование. Потенциал репассивации, или защитный потенциал (E P ), возникает при более низком потенциале, чем E B . Отличие E B и E P относится к подверженности щелевой коррозии; чем больше гистерезис на поляризационной кривой, тем больше подверженность щелевой коррозии.
Эксперименты по электрохимической коррозии также можно использовать для определения скорости коррозии (график Тафеля), активных/пассивных характеристик для конкретной системы образец/раствор, степени пассивации, а также анодной и катодной защиты.
Типичные области применения
- Анализ готовых медицинских изделий на восприимчивость к точечной и щелевой коррозии
- Сравнение сырья (сортировка) по коррозионным характеристикам
- Оценка влияния пассивации или модификации поверхности на коррозионное поведение
- Оценка/Сравнение влияния обработки на коррозионные свойства
- Оценка комбинаций биметаллов на гальваническую коррозию
Требования к образцам
Образцы для испытаний на электрохимическую коррозию должны быть электрическими проводниками и должны быть достаточно малы, чтобы поместиться в поляризационной ячейке. Компоненты можно тестировать как целиком, так и в виде небольшой секции. Металлические купоны изготавливаются специально для некоторых испытаний.
Металлические купоны изготавливаются специально для некоторых испытаний.
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). (Журнальная статья)
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). (Журнальная статья) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Вурхис, Дж. Д.
- Дата публикации:
- Исследовательская организация:
- Стэнфордский университет, Калифорния
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 4688749
- Номер АНБ:
- НСА-26-018154
- Тип ресурса:
- Журнальная статья
- Название журнала:
- Дж.
 Электрохим. соц. 119: № 2, 219–22 (февраль 1972 г.).
Электрохим. соц. 119: № 2, 219–22 (февраль 1972 г.).
- Дополнительная информация журнала:
- Прочая информация: ориг. Дата поступления: 31 декабря 1972 г.
- Страна публикации:
- Страна неизвестна/код недоступен
- Язык:
- Английский
- Тема:
- N50110* – Металлы, керамика и другие материалы – Керамика и металлокерамика – Коррозия, эрозия и поверхностные явления; АНОДЫ; ЦЕРИЯ СУЛЬФАТЫ; КОРРОЗИЯ; ФЕРРИЦИАНИДЫ; СЕРНАЯ КИСЛОТА; КАРБИДЫ ВОЛЬФРАМА; ВОЛЬТАМЕТРИЯ; КАРБИДЫ ВОЛЬФРАМА/коррозия сульфатом церия или феррицианидом в серной кислоте; КАРБИДЫ ВОЛЬФРАМА/коррозия серной кислотой, потенциостатико-кулонометрические исследования на аноде; СЕРНАЯ КИСЛОТА/коррозионное воздействие на карбид вольфрама, потенциостатико-кулонометрические исследования; ФЕРРИЦИАНИДЫ/Коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатически-кулонометрические исследования; СУЛЬФАТЫ ЦЕРИЯ/коррозионное воздействие на карбид вольфрама в серной кислоте, потенциостатико-кулонометрические исследования на
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
Веб. дои: 10.1149/1.2404164.
ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/Код недоступен: N. p., 1972.
Веб. дои: 10.1149/1.2404164.
Копировать в буфер обмена
Voorhies, J D. ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC). . Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164
Копировать в буфер обмена
Вурхис, Дж. Д., 1972.
«ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC)». Страна неизвестна/код недоступен. https://doi.org/10.1149/1.2404164.
Копировать в буфер обмена
@статья{osti_4688749,
title = {ЭЛЕКТРОХИМИЧЕСКАЯ И ХИМИЧЕСКАЯ КОРРОЗИЯ КАРБИДА ВОЛЬФРАМА (WC).},
автор = {Вурхис, Дж. Д.},
Д.},
abstractNote = {},
дои = {10.1149/1.2404164},
URL-адрес = {https://www.osti.gov/biblio/4688749},
журнал = {Дж. Электрохим. соц. 119: № 2, 219-22 (февраль 1972 г.).},
номер = ,
объем = ,
place = {Страна неизвестна/Код недоступен},
год = {1972},
месяц = {1}
}
Копировать в буфер обмена
https://doi.org/10.1149/1.2404164
Найти в Google Scholar
Поиск в WorldCat, чтобы найти библиотеки, в которых может храниться этот журнал
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Коррозия и другие электрохимические аспекты биоматериалов
Обзор
. 1994;22(3-4):139-251.
1994;22(3-4):139-251.
Кей Джей Банди 1
принадлежность
- 1 Факультет биомедицинской инженерии, Тулейнский университет, Новый Орлеан, LA 70118, США.
- PMID: 8598129
Обзор
Кей Джей Банди. Crit Rev Biomed Eng. 1994.
. 1994;22(3-4):139-251.
Автор
Кей Джей Банди 1
принадлежность
- 1 Факультет биомедицинской инженерии, Тулейнский университет, Новый Орлеан, LA 70118, США.

- PMID: 8598129
Абстрактный
Металлические материалы широко используются в качестве ортопедических имплантатов, стоматологических материалов, чувствительных элементов биоэлектродов и других приложений. Электрохимическое поведение этих биоматериалов представляет интерес по целому ряду причин. Коррозионная стойкость материала имплантата влияет на его функциональные характеристики и долговечность и является основным фактором, определяющим биосовместимость. К числу аспектов, влияющих на биосовместимость, относятся количество и формы высвобождаемых продуктов коррозии и их расположение в организме после высвобождения. Принципы электрохимии очень полезны для понимания факторов, влияющих на коррозионную стойкость, а также служат основой для многих биосенсоров, измеряющих концентрацию различных химических соединений (включая выделяемые продукты коррозии и встречающиеся в природе вещества). Многие методы электрохимических измерений использовались для изучения биоматериалов в течение многих лет (например, измерение кривой поляризации), в то время как другие (например, методы полярографии и импеданса переменного тока) стали применяться совсем недавно. Данная работа посвящена четырем основным темам. Во-первых, это природа окружающей среды тела, поскольку она влияет на электрохимические явления in vivo, то есть на химические, механические, биологические и биоэлектрические явления, которые влияют на поведение и характеристики биоматериалов. Второй касается методологии — методов, используемых для измерения коррозии и определения концентрации, соответствующей среды (лаборатория, клеточная культура, in vivo и т. д.) и возникающих экспериментальных проблем. Третьей рассматриваемой темой являются накопленные знания о характеристиках сплавов имплантатов в различных областях применения, например, о формах коррозии, которым они подвержены, и т. д. Наконец, усовершенствования, которые могут произойти в будущем в отношении как материалов, так и методологии испытаний считается.
Многие методы электрохимических измерений использовались для изучения биоматериалов в течение многих лет (например, измерение кривой поляризации), в то время как другие (например, методы полярографии и импеданса переменного тока) стали применяться совсем недавно. Данная работа посвящена четырем основным темам. Во-первых, это природа окружающей среды тела, поскольку она влияет на электрохимические явления in vivo, то есть на химические, механические, биологические и биоэлектрические явления, которые влияют на поведение и характеристики биоматериалов. Второй касается методологии — методов, используемых для измерения коррозии и определения концентрации, соответствующей среды (лаборатория, клеточная культура, in vivo и т. д.) и возникающих экспериментальных проблем. Третьей рассматриваемой темой являются накопленные знания о характеристиках сплавов имплантатов в различных областях применения, например, о формах коррозии, которым они подвержены, и т. д. Наконец, усовершенствования, которые могут произойти в будущем в отношении как материалов, так и методологии испытаний считается.
Похожие статьи
Оптимизация биоматериала при тотальном эндопротезировании диска.
Hallab N, Link HD, McAfee PC. Халлаб Н. и др. Позвоночник (Фила Па, 1976). 2003 г., 15 октября; 28 (20): S139-52. doi: 10.1097/01.BRS.0000092214.87225.80. Позвоночник (Фила Па, 1976). 2003. PMID: 14560185
Коррозионное поведение сплава Ti-15Mo для зубных имплантатов.
Кумар С., Нараянан Т.С. Кумар С. и др. Джей Дент. 2008 июль; 36 (7): 500-7. doi: 10.1016/j.jdent.2008.03.007. Epub 2008 12 мая. Джей Дент. 2008. PMID: 18468762
Электрохимическая стабильность и коррозионная стойкость сплавов Ti-Mo для биомедицинских применений.

Оливейра NT, Гуастальди AC. Оливейра Н.Т. и соавт. Акта Биоматер. 2009 Январь; 5 (1): 399-405. doi: 10.1016/j.actbio.2008.07.010. Epub 2008 25 июля. Акта Биоматер. 2009 г.. PMID: 18707926
Биоповреждение и коррозия металлических имплантатов и протезов.
Лопес Г.Д. Лопес ГД. Медицина (B Aires). 1993;53(3):260-74. Медицина (B Aires). 1993. PMID: 8114635 Обзор. Испанский.
Проблема коррозии зубных имплантатов: обзор.
Олмедо Д.Г., Тасат Д.Р., Дуффо Г., Гульельмотти М.Б., Кабрини Р.Л. Олмедо Д.Г. и соавт. Акта Одонтол Латиноам. 2009;22(1):3-9. Акта Одонтол Латиноам. 2009. PMID: 19601489 Обзор.
Посмотреть все похожие статьи
Цитируется
Коррозия металлических биоматериалов: обзор.

Элиаз Н. Элиаз Н. Материалы (Базель). 201928 января; 12 (3): 407. дои: 10.3390/ma12030407. Материалы (Базель). 2019. PMID: 30696087 Бесплатная статья ЧВК. Обзор.
Механические и микроструктурные свойства систем фиксации, применяемых в челюстно-лицевой хирургии.
Мендес М.Б., Медейрос Р.С., Лаурия А., Марчиори Э., Савазаки Р., Лопес Э.С., Морейра Р.В. Мендес М.Б. и соавт. Оральный челюстно-лицевой хирург. 2016 март; 20(1):85-90. doi: 10.1007/s10006-015-0532-3. Epub 2015 13 ноября. Оральный челюстно-лицевой хирург. 2016. PMID: 26563099
Влияние декстрозы и липополисахарида на коррозионное поведение сплава Ti-6Al-4V с гладкой поверхностью или обработанного двойным кислотным травлением.
Faverani LP, Assunção WG, de Carvalho PS, Yuan JC, Sukotjo C, Mathew MT, Barao VA.
 Фаверани Л.П. и др.
ПЛОС Один. 2014 26 марта; 9 (3): e93377. doi: 10.1371/journal.pone.0093377. Электронная коллекция 2014.
ПЛОС Один. 2014.
PMID: 24671257
Бесплатная статья ЧВК.
Фаверани Л.П. и др.
ПЛОС Один. 2014 26 марта; 9 (3): e93377. doi: 10.1371/journal.pone.0093377. Электронная коллекция 2014.
ПЛОС Один. 2014.
PMID: 24671257
Бесплатная статья ЧВК.Разработка имплантируемых медицинских устройств: с инженерной точки зрения.
Юнг Ю.Х. Юнг Ю.Х. Int Neurourol J. 2013 Sep;17(3):98-106. doi: 10.5213/inj.2013.17.3.98. Epub 2013 30 сентября. Международный нейроурол Дж. 2013. PMID: 24143287 Бесплатная статья ЧВК. Обзор.
Лазерная обработка поверхности Ti6Al4V в газообразном азоте: коррозионная стойкость в физиологическом растворе.
Сингх Р., Чоудхури С.Г., Тивари С.К., Дахотре Н.Б. Сингх Р. и др. J Mater Sci Mater Med. 2008 март; 19(3):1363-9. doi: 10.
 1007/s10856-007-3263-7. Epub 2007 4 октября.
J Mater Sci Mater Med. 2008.
PMID: 17914613
1007/s10856-007-3263-7. Epub 2007 4 октября.
J Mater Sci Mater Med. 2008.
PMID: 17914613
Просмотреть все статьи “Цитируется по”
Типы публикаций
термины MeSH
вещества
Приборы для испытаний на электрохимическую коррозию Gamry Instruments
Компания Gamry находится в авангарде электрохимических испытаний на коррозию с момента своего основания в 1981 году. Наши клиенты говорят нам, что простота использования и сокращение времени сбора данных являются наиболее важными особенностями их исследований.
Gamry Преимущества Гамри Экспертиза рекомендуемые Электрохимическая коррозия Вопросы и ответы
Преимущества Gamry
Исследователи, стремящиеся к высокой производительности или выбору материалов, ищут простые в использовании и надежные системы, которые дадут им правильный ответ. Gamry уже давно известна как лидер рынка, когда речь идет о приборах для испытаний на коррозию. Выполнение тестирования ASTM очень просто благодаря нашему стандартному списку экспериментов: сопротивление поляризации, потенциодинамический анализ, циклическая поляризация и т. д. Наш мастер последовательности позволяет объединить эксперименты, нажать кнопку «Пуск» и вернуться к ним, когда закончите.
Gamry уже давно известна как лидер рынка, когда речь идет о приборах для испытаний на коррозию. Выполнение тестирования ASTM очень просто благодаря нашему стандартному списку экспериментов: сопротивление поляризации, потенциодинамический анализ, циклическая поляризация и т. д. Наш мастер последовательности позволяет объединить эксперименты, нажать кнопку «Пуск» и вернуться к ним, когда закончите.
Все потенциостаты Gamry электрически изолированы, что позволяет проводить эксперименты на заземленных ячейках, таких как автоклавы. Высокие напряжения соответствия обеспечивают достаточную мощность при работе с резистивными электролитами.
Наше аналитическое программное обеспечение позволяет легко обрабатывать данные, составлять отчеты и строить графики. Легко сравнивайте результаты или экспортируйте данные для обработки в другой программе.
Gamry Expertise
Gamry Instruments производит недорогие электрически изолированные потенциостаты для испытаний на коррозию с 19 лет. 89. У нас есть самая полная библиотека методов электрохимической коррозии, включая разработанные/эксклюзивные эксперименты Gamry.
89. У нас есть самая полная библиотека методов электрохимической коррозии, включая разработанные/эксклюзивные эксперименты Gamry.
Мы также готовы поделиться своим опытом с нашими клиентами. Существуют примечания по применению, которые имеют отношение к специалистам по коррозии и инженерам. У нас также есть специалисты по электрохимии, с которыми можно связаться по электронной почте или по телефону, которые разбираются в испытаниях на коррозию и могут указать вам правильное направление.
Если вы новичок в исследованиях коррозии и, в частности, в электрохимических испытаниях на коррозию, вы можете начать с краткого ознакомления с нашими рекомендациями по применению методов коррозии постоянным током и подумать о том, чтобы записаться на краткий курс, подобный тому, который преподается в Университете штата Пенсильвания каждый год. лето. Для тех, кто уже знаком с процессом электрохимической коррозии, ознакомьтесь с нашими рекомендациями по применению, посвященными спектроскопии электрохимического импеданса, и рассмотрите возможность замены Rp/Ec Trend на EFM Trend.
Рекомендуется
Рекомендуемые системы:
Стандартные ASTM G 59, G 61, F 746 или F 2129 Тестирование — интерфейс 1010B, 1010E или 5000E (одно- или многоканальные настройки в зависимости от потребности в пропускной способности), многопортовый, два Satur Электроды сравнения (один резервный). Gamry рекомендует электрохимический мультиплексор ECM8, если требуется повышенная пропускная способность по более низкой цене. Обратите внимание, что мультиплексор запускает эксперименты последовательно, а не одновременно. Для очень устойчивых к коррозии систем (очень низкая скорость коррозии) Gamry рекомендует Reference 600+ из-за его слаботочных характеристик (минимальный диапазон полной шкалы 60 пА).
Если вы планируете проводить эксперименты с электрохимическим импедансом, вам идеально подойдут Interface 1010E, Reference 600+, Reference 3000 и Reference 3000AE.
Критическая температура точечной коррозии — любой из вышеупомянутых приборов может проводить эксперименты с критической температурой точечной коррозии, но вам также потребуется контроллер температуры TDC4 (или аналогичный), FlexCell, нагревательный кожух, двигатель мешалки и комплект мешалки.
Электрохимическая коррозия Вопросы и ответы
Что такое электрохимическая коррозия?
В большинстве случаев коррозия металлов происходит в результате электрохимических реакций на границе раздела между металлом и раствором электролита.
Коррозия – это химический процесс, при котором материалы портятся как часть процесса окисления. Коррозия обычно возникает, когда металл находится под нагрузкой или в анаэробной или безвоздушной среде. Ионы металлов растворяются и поглощаются деполяризатором, обычно кислородом.
Почему коррозия является электрохимическим процессом?
Коррозия является электрохимическим процессом, поскольку это процесс, при котором электроны перемещаются из одной области поверхности металла в другую через среду, благоприятную для ионов. Жидкость в той или иной форме обычно действует как электролит, химически реагирующий с металлическими поверхностями.
Коррозия обычно происходит со скоростью, определяемой равновесием между противоположными электрохимическими реакциями. Самая медленная химическая реакция между ионами определяет скорость возникновения коррозии. Это происходит из-за тенденции металлов возвращаться в свое естественное состояние, в виде оксида или руды.
Самая медленная химическая реакция между ионами определяет скорость возникновения коррозии. Это происходит из-за тенденции металлов возвращаться в свое естественное состояние, в виде оксида или руды.
Одной из реакций является анодная реакция, при которой металл окисляется, высвобождая электроны в металл.
В чем разница между химической и электрохимической коррозией?
Химическая коррозия возникает во влажных условиях, таких как присутствие электролита или влаги. Электрохимическая коррозия происходит при электрохимическом воздействии агрессивной среды на поверхность металла. Электрохимическая коррозия обычно протекает быстрее, чем химическая. Как правило, это более распространенное и более серьезное заболевание.
Какие четыре условия необходимы для возникновения электрохимической коррозии?
Для электрохимической коррозии необходимы четыре элемента: анод, катод, электролит и путь обратного тока.



 На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической.
На таких участках возможно более энергичное протекание анодного или катодного процессов, и коррозия становится гетерогенно-электрохимической. Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.
Иначе это можно представить, как вызванное протеканием тока падение напряжения между прианодным и прика-тодным слоями раствора, с учетом которого потенциал металла по отношению к прианодному слою оказывается более отрицательным, а по отношению к прикатодному — более положительным, чем по отношению к объему раствора.