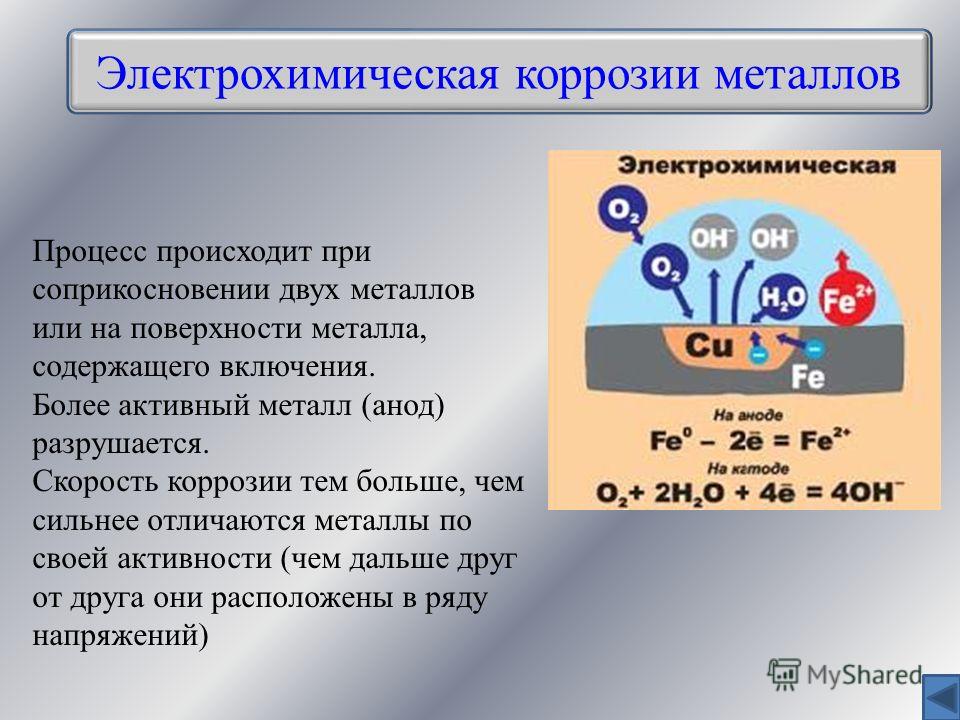
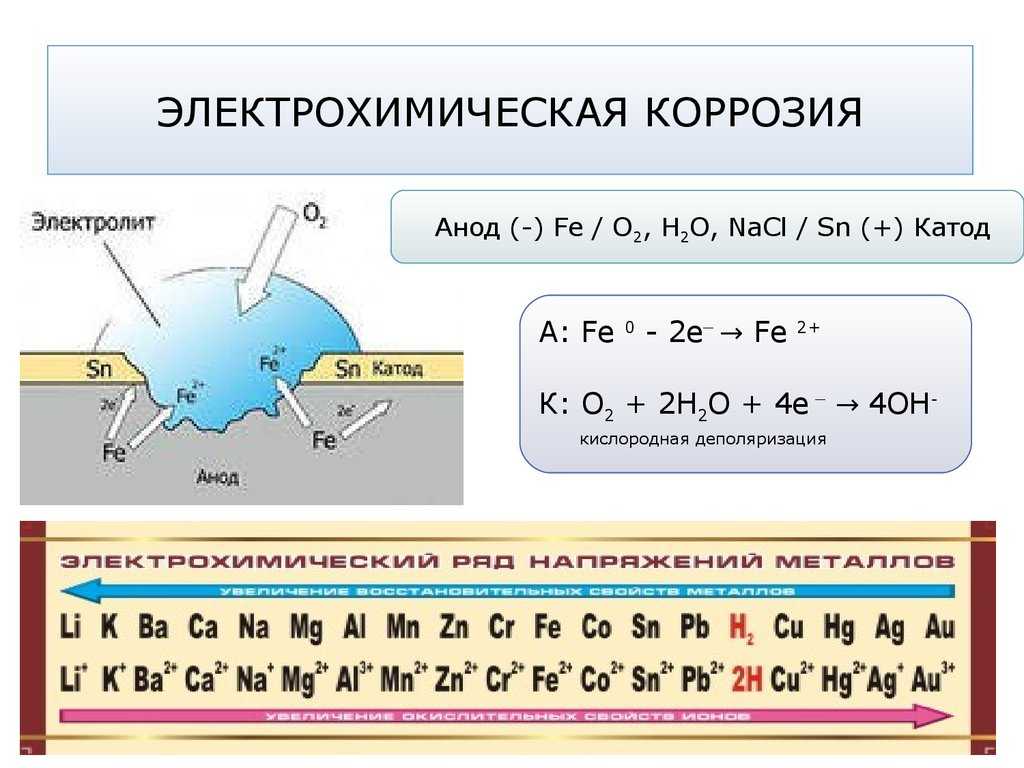
Электрохимическая коррозия это: Электрохимическая коррозия
alexxlab | 16.02.2023 | 0 | Разное
Электрохимическая коррозия | Материаловедение
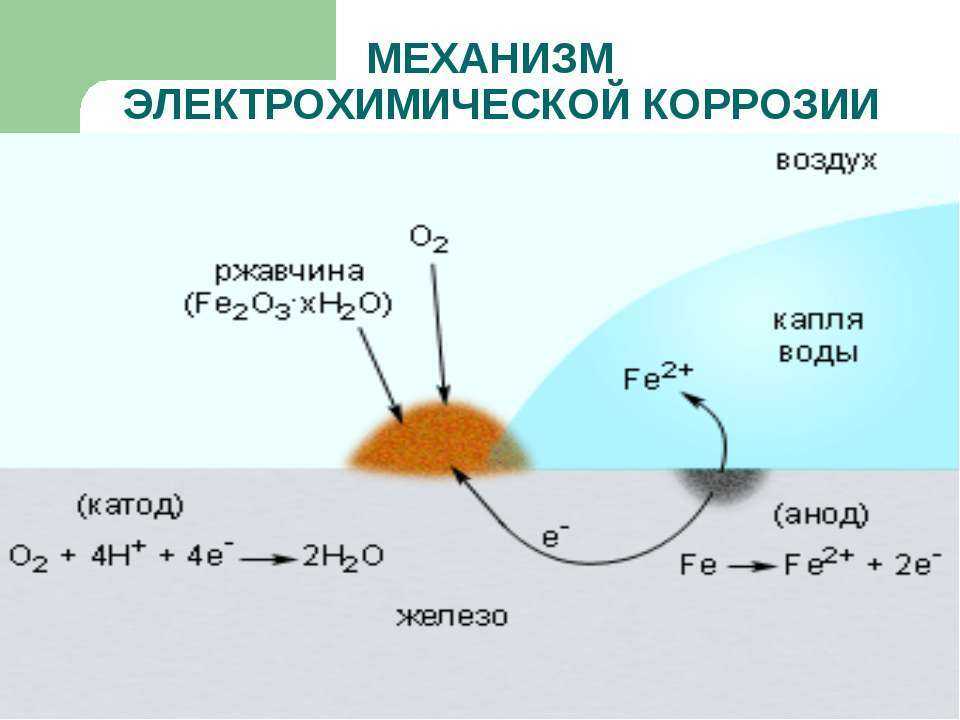
Электрохимическая коррозия – это разрушение металла в результате взаимодействия с раствором электролита, при котором окислительный и восстановительный процессы протекают не в одном акте и на разных участках металла – анодном и катодном. Электрохимическая коррозия сопровождается протеканием электрического тока. К этому виду коррозии относятся атмосферная, подземная, морская и др.
Электролиты – это химические соединения, которые в растворе полностью или частично диссоциируют на катионы и анионы( NaCl = Na+ + Сl–). Наличие положительно и отрицательно заряженных ионов придает растворам электролитов электропроводность. Диссоциация может происходить только в растворителях, молекулы которых полярны, например в воде. Молекулы воды являются диполями и электростатически взаимодействуют с ионами растворенною вещества, образуя гидратированные катионы и анионы. При гидратации иона выделяется энергия гидратации.
Рисунок 1 – схема строения двойного электрического слоя
Электродный потенциал – разность потенциалов в ДЭС между металлом и раствором.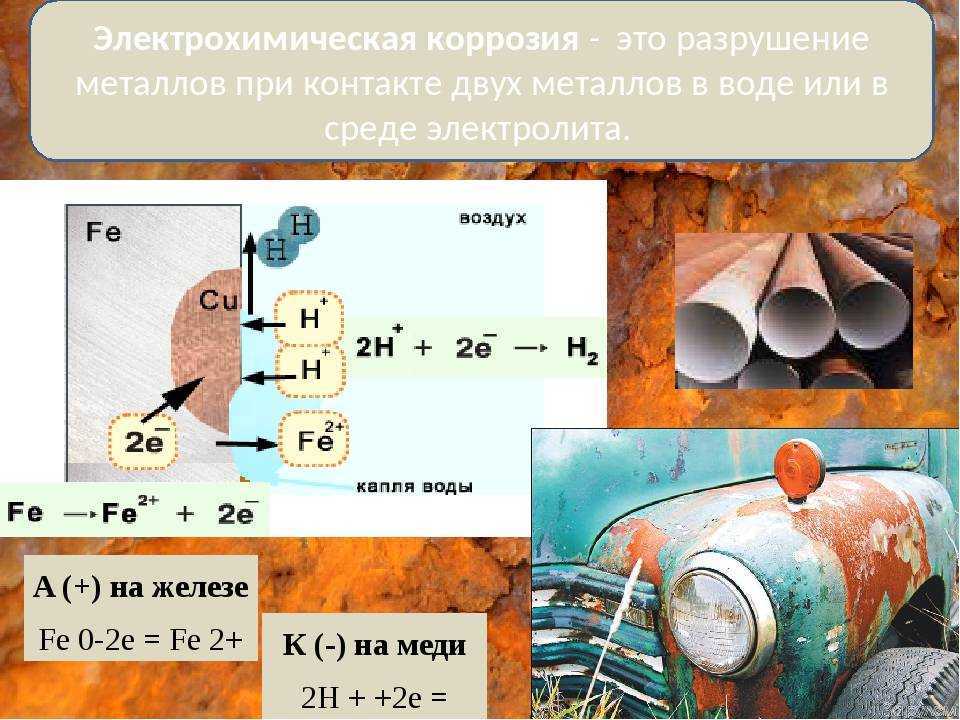
Механизм электрохимической коррозии.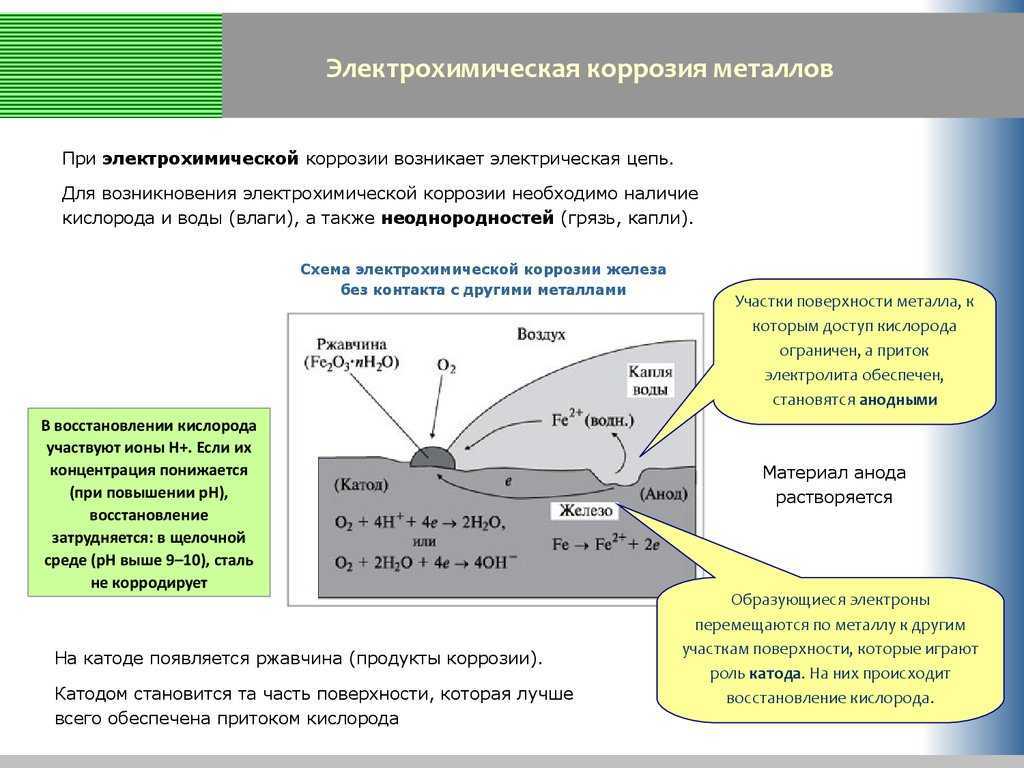 Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде – участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде – участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Fe – 2е– = Fe2+
Анод при этом заряжается отрицательно. На катоде – участке поверхности с более положительным потенциалом (цементит) происходит восстановление ионов и молекул раствора, например:
O2+4H++4e– = 2H2O
O2+2H2O+4e– = 4OH–
Катод при этом заряжается положительно. Катодами могут быть не только зерна цементита, но и включения металлов с более положительным потенциалом или различных неметаллов.
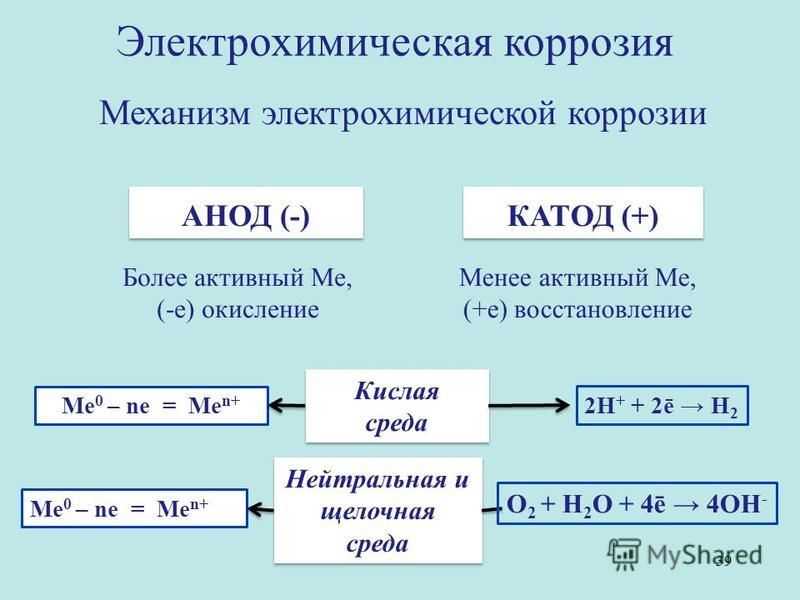 Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток – образуется замкнутый гальванический элемент.
Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток – образуется замкнутый гальванический элемент.Рисунок 2 – схема электрохимической коррозии стали в кислоте
| На нашем сайте Вы можете заказать решениe |
Электрохимическая коррозия металлов – презентация онлайн
1. Электрохимическая коррозия металлов
2. Электрохимической коррозией называется самопроизвольный процесс разрушения металлов под действием электролитов , при котором
ОпределениеЭлектрохимической коррозией
называется самопроизвольный процесс
разрушения металлов под действием
электролитов , при котором окисление
металла и восстановление окислителя
протекают в виде двух сопряженных
электрохимических реакций
3.
 ЭРаспространеннрррррРаспространенность
ЭРаспространеннрррррРаспространенностьэлектрохимической коррозии
Электролит – любая электропроводящая
жидкость.
В строительной практике это вода и любые
водные растворы и взвеси (кислоты, щелочи,
растворы солей, грунт и т.д.)
Чтобы узнать есть ли электрохимическая коррозия
– нужно ответить на вопрос: есть ли электролит на
поверхности металла в рассматриваемых
условиях.
Распространенность
электрохимической коррозии
Электрохимическая коррозия встречается
повсеместно (атмосферная, подводная,
грунтовая коррозии).
Возникает вопрос: как возникают на
поверхности металле две
электрохимические реакции?
Возникновение электрохимической
коррозии
Fe
Екор
Fe2+
Н+
Н2
1.1 Fe – 2e→Fe2+
1.2 Fe2+ + 2e→ Fe
ЕFeравн = -0,51
2.1 H+ + e→Haт →Н2
ЕН
+
2.2. Haт- e→ H
2
равн
= -0,18
Екор = -0,28 В
NaCl рН=3
анодная
реакция
2. H+ + e→Haт →Н2 катодная
реакция
1.
 Fe – 2e→Fe2+
Fe – 2e→Fe2+Взаимодействие поверхностных
ионов железа с водой
+
Fe
Н 2О
–
Fe+2
–
+
Вода- это диполь
НОН (Н+ОН-)
В NaCl присутствуют следующие частицы: Na+,
Cl-, Н+ , ОН-, Н2О (НОН), О2
7. Екор – потенциал коррозии, образующийся за счёт одновременного протекания на нём двух электрохимических реакций очень важное
Потенциал коррозииЕкор – потенциал коррозии,
образующийся за счёт одновременного
протекания на нём двух
электрохимических реакций очень
важное понятие электрохимической
коррозии.
Он может быть легко измерен.
И его можно изменить, тем самым
изменяя скорость коррозии.
Условия возникновения и протекания
электрохимической коррозии
Коррозионный потенциал возникает всегда когда выполняется
термодинамическое условие электрохимической коррозии
Термодинамическое условие: потенциал корродирующего
металла должен быть меньше потенциала хотя бы одного
окислителя, прсутствующего в коррозионной среде
Me
Е равн <
Oх
Е
равн
Коррозионный потенциал довольно постоянен , что происходит за счет того
что выполняется условие стационарности электрохимической коррозии.
Условие стационарности коррозии: скорости анодной и катодной
реакции коррозионного процесса равны:
Ja = Jк
Термодинамика электрохимической
коррозии
• Насколько часто выполняется термодинамическое
условие электрохимической коррозии?
ЕMeравн < ЕOх равн
В обычной воде есть следующие виды молекул и ионов:
Н2О, H+, ОН-, О2
окислителями могут быть: Н2О (НОН), H+,
ЕН2 равн = -0,06 рН;
и растворенный в электролите О2,
ЕО2 равн = 1.23-0,06 рН
Ряд напряжений
-1,5 -0,79 -0,44
Al
Zn
Fe
-0,23
0
+0,34
Ni
h3
Cu
1,23
Ag
O2
Если посмотреть ряд напряжений, то можно сделать вывод,
что все металлы за исключением золота должны окислятся
растворенным в электролите кислородом. А железо и его
сплавы могут корродировать, как под действием ионов
водорода или воды, так и под действием растворенного
кислорода.
11. Растворенный в электролите кислород самый распространенный окислитель О2 + 4Н+ + 4е 2Н2О (кислая среда) или О2 + 2Н2О + 4е 4ОН
Окислители, вызывающиеэлектрохимическую коррозию
Растворенный в электролите кислород самый
распространенный окислитель
О2 + 4Н+ + 4е 2Н2О
(кислая среда)
или
О2 + 2Н2О + 4е 4ОН (нейтральная или щелочная среда)
Коррозия под действием растворенного кислорода
называется коррозия с кислородной
деполяризацией
12.
 Ион водорода или вода также могут вызывать электрохимическую коррозию 2Н+ + 2е 2Нат Н2 (кислая среда) или 2Н2О + 2е 2Нат + 2ОНОкислители, вызывающие
Ион водорода или вода также могут вызывать электрохимическую коррозию 2Н+ + 2е 2Нат Н2 (кислая среда) или 2Н2О + 2е 2Нат + 2ОНОкислители, вызывающиеэлектрохимическую коррозию
Ион водорода или вода также могут вызывать
электрохимическую коррозию
2Н+ + 2е
2Нат Н2
(кислая среда)
или
2Н2О + 2е
2Нат + 2ОН – Н2 + 2ОН (нейтральная или щелочная среда)
Коррозия под действием ионов водорода или воды,
сопровождающаяся выделением молекулярного водорода
называется коррозия с водородной деполяризацией.
Для сплавов железа наблюдается в кислых коррозионных
средах с рН < 3-4
13. Me – ne
Анодные реакции электрохимическойкоррозии
Катионы Меne+
Комплексные соединения [Ме(Кn)]m+,
[Ме(Кn)]m-
Me – ne
Оксиды и гидроксиды МеО, Ме(ОН)2
Сложные анионы металла МеО-2, МеО22Труднорастворимые соли МеА
Опасность электрохимической
коррозии
Наиболее опасен для практики случай, когда
получаются растворимые продукты коррозии
• Гидратированные катионы
• Сложные анионы металла
• Комплексные соединения
Растворяясь в электролите, они не влияют на
скорость коррозии и она всегда остается
опасной.

Опасность электрохимической
коррозии
Если в результате анодной реакции коррозионного
процесса получаются нерастворимые продукты
коррозии:
оксиды,
гидроксиды,
трудностворимые соли,
то такие продукты обычно снижают скорость
коррозии во времени, и тем в большей степени,
чем выше степень упорядоченности(плотности)
получаемых продуктов коррозии.
Зависимость скорости коррозии от вида
и упорядоченности продуктов коррозии
• Если продукты коррозии получаются рыхлые не
упорядоченные (например, ржавчина на железе), то
такие продукты мало тормозят скорость коррозии и
она остается опасной.
• Если продукты коррозии получаются упорядоченные,
плотные (например, на сплавах алюминия при
атмосферной коррозии), то металл перестает
корродировать, металл запассивировался, коррозия
не опасна.
• В практике часто получаются растворимые или
неупорядоченные продукты коррозии, поэтому
электрохимическая коррозия опасна при любой τ оС
Пассивность металлов
• Состояние повышенной коррозионной
стойкости металла, вызванное
торможением анодного процесса за счет
образования упорядоченных оксидных,
гидроксидных и солевых пленок
называется пассивностью.
Примеры пассивных металлов: титан в
кислотах;
медь, алюминий, цинк –
атмосферная коррозия.
Локальный характер протекания
электрохимической коррозии
Электрохимическая коррозия чаще всего протекает
локально, т.е. анодная и катодная реакции коррозионного
процесса протекают на разных участках корродирующего Ме.
Причин локальности много: неоднородность металла;
неоднородность коррозионной среды; неоднородность
физических условий на металле и т.д.
Отсюда много видов локальной коррозии: язвенная,
питтинговая (точечная), коррозия пятнами, межкристаллитная,
коррозионное растрескивание и т.д.).
Локальные формы коррозии более опасны, т.к. металл
быстрее выходит из строя.
При локальном характере коррозии ее скорость зависит от
электропроводности коррозионной среды.
Локальное протекание
электрохимической коррозии
При локальной коррозии в металле и электролите возникают
локальные токи. Их протекание зависит от
электропроводности коррозионной среды.

Электролит
Ме+2
ОН-
Ме – 2е = Ме+2
ne
Н+ + е = Нат
Ме
Н2
Основные особенности
электрохимической коррозии
• Возникает всегда, когда на поверхности металла
появляется электролит;
• Протекает в виде двух сопряженных
электрохимических реакций;
• На поверхности корродирующего металла
появляется потенциал коррозии;
• Электрохимическая коррозия часто идет локально,
локальные формы коррозии опаснее общей;
• Электрохимическая коррозия зависит от
электропроводности коррозионной среды;
• Опасна при любой температуре.
Окислители, вызывающие коррозию
в строительной практике
В строительной практике электрохимическая
коррозия чаще всего протекает по действием двух
окислителей иона водорода или воды:
2Н+ + 2е = 2Нат Н2
(кислая среда)
2Н2О + 2е = 2Нат + 2ОН – Н2 + 2ОН –
И растворенного в электролите кислорода
О2 + 4Н+ + 4е 2Н2О
(кислая среда)
О2 + 2Н2О + 4е 4ОН (нейтральная или щелочная среда)
Особенности коррозии с водородной
деполяризацией
1.
 Сопровождается выделением атомарного водорода Нат , который
Сопровождается выделением атомарного водорода Нат , которыйпроникая вглубь металла, вызывает его наводороживание. Что
в свою очередь ухудшает механические и технологические
свойства металла: металл становится более хрупким и плохо
сваривается.
2. Коррозия с водородной деполяризацией сопровождается
выделением молекулярного водорода (Н2), который отрывает
защитные покрытия (лакокрасочные, битумные, полимерные),
что усугубляет коррозию.
3. Если есть коррозия с водородной деполяризацией, то
одновременно есть и коррозия с кислородной деполяризацией.
Вывод: коррозия с водородной деполяризацией очень опасна для
строительной практики и ее нужно исключать, т.е строительные
конструкции не должны контактировать с растворами с рН<3-4.
Особенности коррозии с
кислородной деполяризацией
• Растворимость кислорода в электролитах не велика,
поэтому диффузия его к корродирующему металлу
идет медленно и коррозия также идет медленно.
• При коррозии с кислородной деполяризацией
диффузия к различным точкам корродирующего
металла идет не одинаково. Возникают аэрационные
пары
• В результате и возникновения аэрационных пар
коррозия протекает локально.
• В большей степени корродируют участки с плохой
диффузией кислорода.
Возникновение аэрационной пары
Ме
Рис. Щелевая коррозия
Анализ коррозионной ситуации
Чтобы проанализировать коррозионную ситуацию и оценить
опасность коррозии необходимо выяснить:
1.Какие катодные реакции идут на поверхности
металла при коррозии, т.е. какие окислители её
вызывают.
2. По какому пути идёт анодная реакция коррозионного
процесса, т.е. какие продукты коррозии получаются:
растворимые, нерастворимые, упорядоченные,
неупорядоченные;
Анализ коррионной ситуации
• Исходя из состава коррозионной среды прежде
всего определяется, какие окислители в ней
присутствуют. Их как минимум два: ионы
водорода(Н+) и растворённый в коррозионной
среде кислород(О2).

• Далее с помощью электрода сравнения и
вольтметра замеряют потенциал коррозии (Екор)
металла в исследуемой коррозионной среде.
Определение вида окислителя, вызывающего
электрохимическую коррозию
Далее необходимо сравнить
стационарный потенциал коррозии
(Екор) с равновесными потенциалами
этих окислителей (Еохравн). Если
выполняется соотношение
Екор<Еохравн,
То данный окислитель участвует в
процессе коррозии.
Равновесные потенциалы двух главных
окислителей, вызывающих
электрохимическую коррозию
Равновесные потенциалы окислителей (Н+ и О2) при
известном рН коррозионной среды рассчитываются по
уравнениям:
Н2
Е равн= – 0,06рН;
О
Е 2равн=1,23 – 0,06рН
Определение вида окислителя, вызывающего
электрохимическую коррозию
Пример: Если потенциал коррозии Екор равен – 0,2 В,
а рН среды разная (2, 7,12) то равновесные
потенциалы окислителей будут следующие:
pH=2 , Eh3равн = -0,12В, EO2равн= 1,11В
pH=7 Eh3равн = -0,42 В,
EO2равн= 0,81В
pH=12 Eh3равн = -0,72 В,
EO2равн= 0,51В
Проверяем неравенство Eкор < Eoxравн, и видим, что
при pH=2 коррозия протекает под действием обоих
окислителей, а при pH=7, и pH=12 в коррозионном процессе
участвует только один окислитель O2
Определение пути анодной реакции
коррозионного процесса
• Для определения пути реакции коррозионного процесса нужно
знать состав коррозионной среды.

• Если в составе коррозионной среды есть
комплексообразователи, то анодная реакция идет с получением
комплексов. Они, обычно, растворимые вещества и коррозия
опасна.
• Если в коррозионной среде нет комплексообразователей, но есть
анионы, способные давать с корродирующим металлом
труднорастворимую соль, то именно она и получается при
протекании анодного процесса. А для того, что бы сделать вывод
об опасности коррозии необходимо знать насколько
упорядоченна эта соль. (литературные данные).
Определение характера анодной
реакции и вида продуктов коррозии
• Если в коррозионной среде нет комплексообразователей, и
анионов, способных образовывать с корродирующим
металлом труднорастворимую соль, то тогда нужно обратиться
к диаграмме Пурбе для корродирующего металла (обширная
сводка диаграмм Пурбе есть в «Справочнике химика, том 3).
• На следующих слайдах представлены упрощенные диаграммы
Пурбе для алюминия и железа.
• Для того, чтобы определить какое вещество получается в
результате анодного реакции коррозии по диаграмме Пурбе
нужно знать потенциал коррозии и рН коррозионной среды.

Диаграмма Пурбе для алюминия
Е,В
Al2O3
Al3+
-1,2
AlO2
-1,6
-2,0
Al
1
2
3
4
5
6
7
8
9
10
11
12
13
14
рН
1
3
5
7
9
11
13
E,B
Fe3+
+0.8
Fe(OH)3
+0.2
-0.4
Fe(OH)2
-1.0
HFeO-2
Fe
2
4
6
8
10
12
Рис. 1.2 Диаграмма Пурбе для железа
pH
Анализ коррозионной ситуации
Пример: В растворах Na2SO4 железо согласно диаграммы Пурбе в зависимости
от pH корродирует с образованием:
Fe2+ ,Fe3+
Fe-2e
Гидратированые катионы, рН <3
Fe(OH)2, Fe(OH)3
Гидроксиды, рН 3-13
FeO2- ,Fe(OH)3 Сложный анион металла, рН>13
И, сл-но, железо с учетом растворимости и упорядоченности продуктов
коррозии будет устойчиво только в растворах Na2SO4 с рН = 11,5-13
Поведение железа в условиях
электрохимической коррозии
Анализ коррозионного процесса для углеродистых и
низколегированных сталей в средах с различным рН
показывает:
• При рН < 3 железо корродирует под действием двух
окислителей Н+ и О2, продуктами коррозии являются
растворимые катионы Fe2+, Fe3+, и коррозия очень опасна
и тем опасней, чем выше кислотность коррозионной среды.
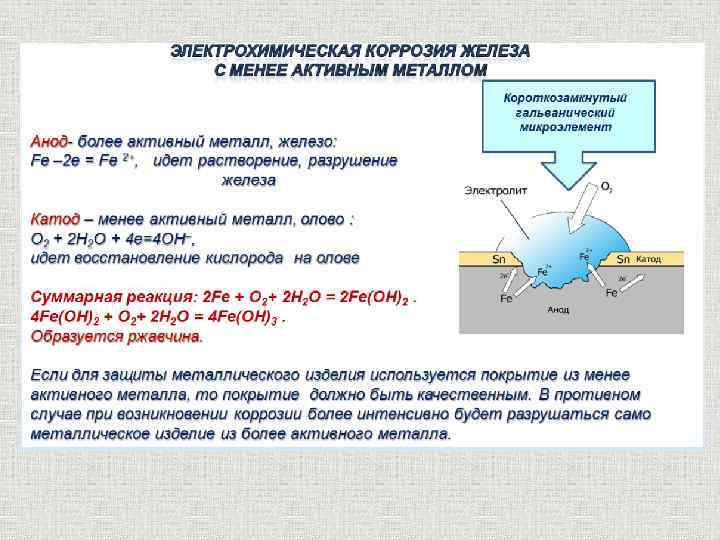
• В диапазоне рН 3-11,5 железо корродирует под действием
только О2, продуктами коррозии являются смесь
гидроксидов Fe(OH)2, Fe(OH)3 , причем они получаются в
виде ржавчины, т.е. неупорядоченные, неплотные.
Защитное действие ржавчины плохое и коррозия остается
высокой по скорости и опасной.
Поведение железа в условиях
электрохимической коррозии
• В диапазоне рН 11,5-13 железо корродирует под действием
только О2, продуктами коррозии также являются смесь
гидроксидов Fe(OH)2, Fe(OH)3 , но эти гидроксиды
получаются упорядоченные, плотные. В результате чего
железо пассивируется и не корродирует. Его можно не
защищать.
• При рН > 13 железо корродирует с образованием
упорядоченных гидроксидов Fe(OH)2, Fe(OH)3 и
одновременно растворимых анионов HFeO-2, в результате
чего скорость коррозии в концентрированных щелочах
повышается.
• Графически изменение скорости коррозии железа от рН
коррозионной среды представлено на следующем слайде
Поведение железа в условиях
электрохимической коррозии
Vkop
3
6
9
12
Рис.
 1.3 Зависимость скорости коррозии железа от рН среды
1.3 Зависимость скорости коррозии железа от рН средырH
Поведение железа и его сплавов в
условиях электрохимической коррозии
Вывод:
• Железо, углеродистые и
низколегированные стали в условиях
электрохимической коррозии необходимо
защищать во всех средах, кроме
слабощелочных с рН от 11,5 до 13.
39. Коррозия металлов в контакте (Контактная коррозия)
Коррозия металлов в контактеКоррозия металлов в контакте
(Контактная коррозия)
В реальной практике конструкции часто
выполняются из двух или нескольких металлов.
В этом случае возникает так называемая
контактная коррозия.
• В этом случае на поверхности корродирующей
конструкции устанавливается единый потенциал
коррозии, лежащий между коррозионными
потенциалами отдельных металлов.
Контактная коррозия
• Т.е. при контактной коррозии потенциал
более отрицательного металла сдвигается в
положительном направлении и скорость
коррозии его увеличивается.
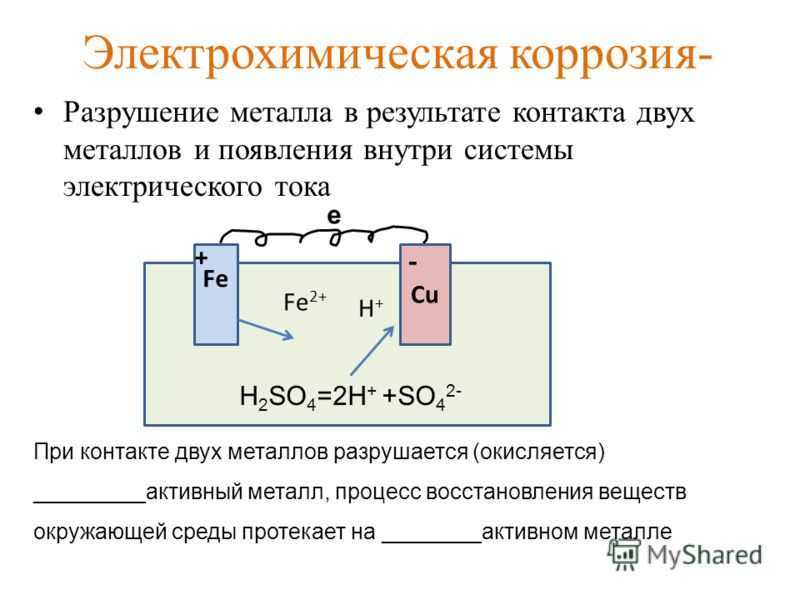
• А потенциал коррозии более
положительного металла сдвигается в
отрицательном направлении, скорость
коррозии его уменьшается или он совсем
перестает корродировать.
Коррозия металлов в контакте
• Ответы на эти вопросы дает ГОСТ 9.005–72 ЕСЗКС
«Допустимые и недопустимые контакты металлов».
Согласно этому ГОСТ, все конструкционные металлы
делятся на 16 групп при атмосферной коррозии и на 11
групп при подводной коррозии. В ГОСТ 9.005–72 указано,
контакт между какими группами металлов является
недопустимым, ограниченно допустимым и допустимым в
этих коррозионных средах.
• При необходимости использовать в конструкциях
недопустимый контакт нужно предусмотреть методы
защиты от контактной коррозии, также регламентируемые
ГОСТ 9.005–72.
Коррозия: Электрохимическая | Машиностроение
Коррозия окружает нас повсюду, в нашей повседневной жизни, тихо работает и идет своим чередом. Коррозия — это ухудшение свойств материала из-за реакции с окружающей средой. NACE определяет коррозию как «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». и другие материалы также подвержены коррозии.
NACE определяет коррозию как «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». и другие материалы также подвержены коррозии.
Последствия коррозии можно увидеть повсюду: на наших домах, на детских площадках, на наших автомобилях, зданиях и мостах. Если его не остановить, это может привести к серьезным авариям, таким как обрушение моста I-35W в Миннеаполисе 1 августа 2007 г., в результате которого 13 человек погибли и 145 получили ранения 2 , или рейс Aloha 243, у которого в середине полета произошла взрывная декомпрессия, оторвавшая часть. фюзеляжа, в результате чего один член экипажа погиб и 65 пассажиров и членов экипажа получили ранения 3 .
Коррозия также имеет финансовые последствия. В США коррозия вызывает ежегодные убытки в размере 47,9 млрд долларов в коммунальном хозяйстве, 29,7 млрд долларов в транспортной отрасли, 22,6 млрд долларов в инфраструктуре, 20,1 млрд долларов в государственных структурах и 17,6 млрд долларов в производстве и обрабатывающей промышленности 4 . Это составляет 275,7 миллиардов долларов в год из-за коррозии, при этом самые большие затраты приходятся на системы питьевой воды и канализации на 36 миллиардов долларов и увеличиваются 5 .
Это составляет 275,7 миллиардов долларов в год из-за коррозии, при этом самые большие затраты приходятся на системы питьевой воды и канализации на 36 миллиардов долларов и увеличиваются 5 .
Исследования коррозии показали нам, что существует два основных механизма коррозии: электрохимическое и химическое окисление. Оба этих типа имеют множество форм и разветвлений, некоторые из них более выражены, чем другие, но механизм, с помощью которого они разлагают вещество или материал, всегда можно проследить до одного из этих двух типов. В этой части статьи мы рассмотрим механизм электрохимической коррозии и ее наиболее распространенные формы.
Электрохимическая коррозия
Электрохимическая коррозия — это процесс, в результате которого металл возвращается в состояние окисления с наименьшей энергией. Чтобы правильно понять электрохимическую коррозию, нужно понять, как находят руды и превращают их в металл.
Необработанные руды берутся из природы, где некоторые из них находятся в химическом соединении с другими элементами в термодинамически стабильном состоянии. Например, железо встречается вместе с оксидами, гидратами и сульфидами. Чтобы извлечь или очистить железо, энергия (тепло) нагнетается в руду, чтобы превратить ее в металл. Это приводит к тому, что железная руда восстанавливается и становится термодинамически нестабильной. Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Например, железо встречается вместе с оксидами, гидратами и сульфидами. Чтобы извлечь или очистить железо, энергия (тепло) нагнетается в руду, чтобы превратить ее в металл. Это приводит к тому, что железная руда восстанавливается и становится термодинамически нестабильной. Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Однако некоторые металлы уже встречаются в природе в металлической форме, например, золото, и поэтому уже стабильны в металлической форме, поэтому золото не подвергается коррозии. Это не означает, что только те металлы, которые встречаются в природе в чистом металлическом виде, являются единственными, которые не подвергаются коррозии, есть руды, которые при окислении дают металл, который не подвергается коррозии, разница в том, что количество энергия (тепло), необходимая для окисления руды, в этом случае минимальна.
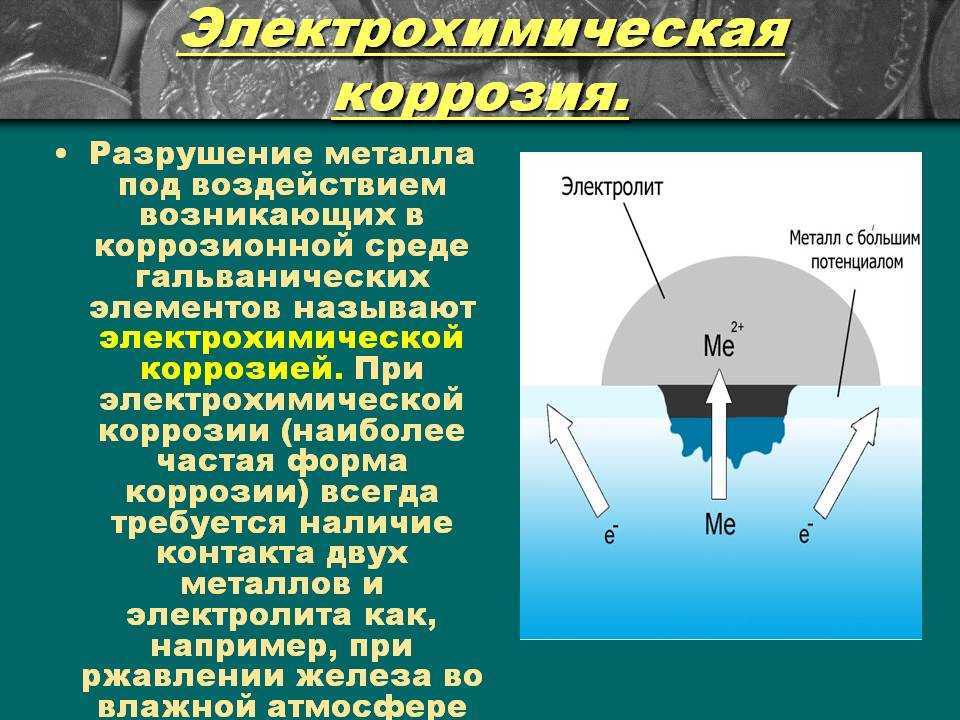
Нестабильные металлы становятся стабильными в течение многих лет в результате электрохимической коррозии, если их не защитить.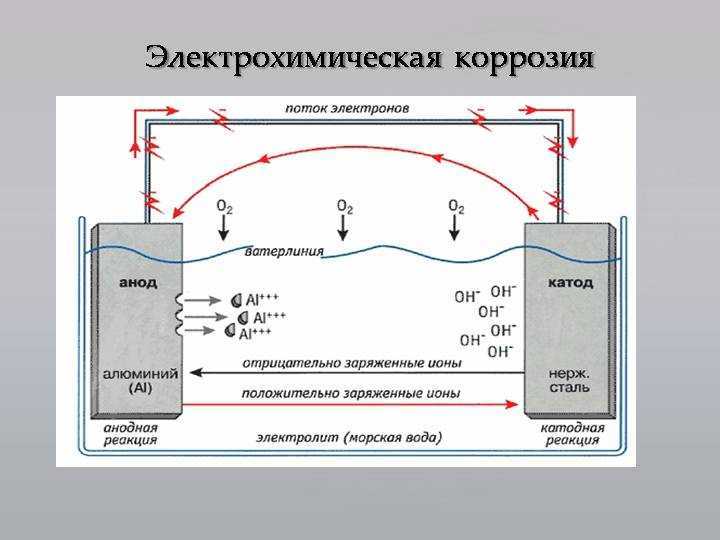 Для возникновения электрохимической коррозии необходимо наличие коррозионной ячейки. Коррозионная ячейка представляет собой комбинацию четырех элементов: анода, катода, электролита и металлического пути, соединяющего анод и катод. Без любого из этих четырех элементов коррозии не будет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, утверждая, что в некоторых формах коррозии кислород является последним завершающим этапом для достижения истинного состояния с самой низкой энергией.
Для возникновения электрохимической коррозии необходимо наличие коррозионной ячейки. Коррозионная ячейка представляет собой комбинацию четырех элементов: анода, катода, электролита и металлического пути, соединяющего анод и катод. Без любого из этих четырех элементов коррозии не будет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, утверждая, что в некоторых формах коррозии кислород является последним завершающим этапом для достижения истинного состояния с самой низкой энергией.
- На аноде происходит фактическая потеря металла. Ионизируясь в электролите, ионы высвобождают электроны в ходе сложной серии химических реакций с образованием оксида железа (Fe2O3) и кислорода. Оксид железа — это то, что мы обычно называем ржавчиной.
- Катод является чрезвычайно важным элементом коррозионной ячейки, поскольку он определяет скорость коррозии. Электроны с анода перемещаются к катоду и задерживаются там.
 Чем больше электронов может разместить катод, тем быстрее будет корродировать анод. Это основная взаимосвязь между анодом и катодом в коррозионной ячейке.
Чем больше электронов может разместить катод, тем быстрее будет корродировать анод. Это основная взаимосвязь между анодом и катодом в коррозионной ячейке. - Электролит также является важным элементом коррозионной ячейки, поскольку это раствор, который окружает анод и катод. Электролит также влияет на скорость коррозии, поскольку проводимость электролита либо позволяет электронам свободно перемещаться от анода к катоду, либо ограничивает их поток, тем самым снижая скорость коррозии.
- Металлический путь — это то, что некоторые могут назвать внутренней цепью, поскольку она обеспечивается металлом, в котором находятся анод и катод. Металлический путь замыкает цепь коррозии.
Кислород считается важным фактором коррозии, так как без кислорода коррозия замедляется и в конце концов прекращается. Кислород отвечает за реакцию с ионами водорода, которые высвобождаются на катоде из-за аккомодации электронов. При недостатке кислорода ионы водорода накапливаются на катоде и препятствуют аккомодации электронов, останавливая процесс коррозии. Это явление называется поляризацией 6 .
Это явление называется поляризацией 6 .
Хотя электрохимическая коррозия относится к механизму коррозии, она может проявляться во многих формах. Наиболее распространены гальваническая, точечная и щелевая коррозия.
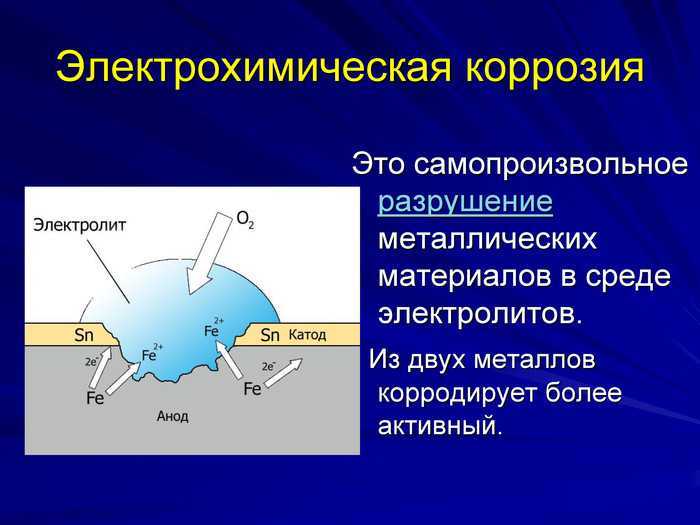
Гальваническая коррозия
Гальваническая коррозия возникает, когда два разных металла погружаются в раствор и соединяются металлическим путем. Примером может служить железный корабль с алюминиевыми винтами. Электролит — это море, а металлическая дорожка — это настоящая конструкция корабля. Анод и катод определяются из гальванического ряда. В таблице 1 показана упрощенная гальваническая серия.
Из таблицы 1 видно, что на железном корабле алюминиевые гребные винты будут наиболее активным металлом или анодом и, следовательно, будут подвергаться коррозии. Следует отметить, что чем дальше друг от друга находятся два металла в гальваническом ряду, тем выше будет скорость коррозии.
В этом конкретном случае также стоит обратить внимание на размер анода и размер катода. Чем больше катод, тем больше электронов он может принять от анода, заставляя его ионизироваться с большей скоростью, что приводит к гораздо более быстрой коррозии. Эта зависимость между ними является линейной: чем больше разница в размерах между катодом и анодом, тем быстрее будет корродировать анод. Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии замедляется. Следовательно, отношение теперь обратное.
Чем больше катод, тем больше электронов он может принять от анода, заставляя его ионизироваться с большей скоростью, что приводит к гораздо более быстрой коррозии. Эта зависимость между ними является линейной: чем больше разница в размерах между катодом и анодом, тем быстрее будет корродировать анод. Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии замедляется. Следовательно, отношение теперь обратное.
Точечная коррозия
Точечная коррозия – это форма коррозии, которая часто связана с соотношением размеров между анодом и катодом, описанным выше. Наиболее распространенной причиной питтинга является неоднородность металлов. Иногда металлы непостоянны по своему содержанию, в них могут входить горшечные металлы или другие крупинки легкокорродирующих металлов. Если в металле есть включения такого рода, которые являются более анодными, чем остальной металл, эти примеси корродируют быстрее и вызывают язвы. Обратное также возможно, примеси могут быть катодными по отношению к остальной части металла, это вызовет ямки в окружающей примеси области.
Неоднородность — не единственная причина точечной коррозии. Защитные покрытия могут сломаться и обнажить часть подложки, которую они должны были защищать. Это приводит к тому, что остальная часть металла с покрытием действует как катод, а небольшая несплошность становится анодом. В соответствии с соотношением размеров между анодом и катодом скорость коррозии на этом маленьком аноде будет высокой, что приведет к образованию язв.
Щелевая коррозия
Это особая форма коррозии, которая возникает в очень маленьких трещинах на металлах. Щелевая коррозия — очень интересная форма, потому что в какой-то момент она включает один из двух основных механизмов: электрохимический и химический. Щелевая коррозия часто локализуется в местах застоя электролита. К таким местам часто относятся соединения внахлест, под прокладками и под изоляцией. В этих местах щелевая коррозия обычно начинается как электрохимическая коррозия с попаданием в щель электролита. Из-за небольшого размера щели кислород, необходимый для поддержания электрохимической коррозии, вскоре истощается, и электролит становится кислым. Это происходит за счет гидролиза ионов металлов, вызванного электрохимической коррозией 9.0003 7 . В этот момент тип или механизм коррозии представляет собой химическую атаку.
Это происходит за счет гидролиза ионов металлов, вызванного электрохимической коррозией 9.0003 7 . В этот момент тип или механизм коррозии представляет собой химическую атаку.
Хотя создание коррозионной ячейки может показаться трудным процессом, это происходит с большей легкостью, чем предполагалось. Электрохимическая коррозия может произойти везде, она может взаимодействовать не с одним металлом, а также проникать внутрь бетона и разъедать арматурные стержни. Вся наша инфраструктура подвержена коррозии. Многие другие формы коррозии можно наблюдать в промышленных условиях, однако, как уже объяснялось, все эти формы восходят к электрохимическим. Эти другие формы могут включать нитевидную, атмосферную и прокатную коррозию.
Электрохимическая коррозия является наиболее распространенным механизмом в современной промышленности, и ее последствия можно измерить с точки зрения экономики, здоровья, безопасности и даже культуры. Этот механизм коррозии может существовать внутри наших тел, в кардиостимуляторах, он может привести к падению мостов, разрыву газопроводов и даже к ржавчине культурных сооружений, таких как статуя Свободы, если о них не заботиться должным образом. Электрохимическая коррозия — это сила, с которой необходимо считаться в современном мире, и ее необходимо решать как таковую. В следующем выпуске мы рассмотрим механизм химического окисления и его наиболее распространенные формы.
Электрохимическая коррозия — это сила, с которой необходимо считаться в современном мире, и ее необходимо решать как таковую. В следующем выпуске мы рассмотрим механизм химического окисления и его наиболее распространенные формы.
См. также Коррозия: Химическое окисление
1 VanDelinder, L.S. изд. Основы коррозии – введение, глава 1, объем и язык коррозии. Национальная ассоциация инженеров по коррозии, стр. 14, 1984
2 Фроммер, Фредерик и Лоуи, Джоан. «Дефекты конструкции моста могут быть не такими редкими, как предполагалось» USA Today. 25 декабря 2010 г.
3 Кристофф, Сьюзен. «Усталостный отказ самолета Aloha Flight 243: как циклическая нагрузка и коррозия вызвали отказ во время полета», Suite 101. 27 декабря 2010 г.
4 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Стоимость коррозии. 28 декабря 2010 г.
5 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Стоимость коррозии. 28 декабря 2010 г.
Стоимость коррозии. 28 декабря 2010 г.
6 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка. Национальная ассоциация инженеров по коррозии, стр. 21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозия-Доктора. 28 декабря 2010 г.
Есть ли у вас опыт и знания по темам, упомянутым в этом содержании? Вам следует подумать о том, чтобы внести свой вклад в нашу редакционную команду CFE Media и получить признание, которого вы и ваша компания заслуживаете. Нажмите здесь, чтобы начать этот процесс.
Электрохимическая коррозия металлических биоматериалов
Обзор
. 1984 г., май; 5 (3): 122–34.
doi: 10.1016/0142-9612(84)
-2.
М Пурбе
- PMID: 6375748
- DOI:
10.
 1016/0142-9612(84)
1016/0142-9612(84)-2
Обзор
M Пурбэ. Биоматериалы. 1984 май.
. 1984 г., май; 5 (3): 122–34.
дои: 10.1016/0142-9612(84)-2.
Автор
М Пурбе
- PMID: 6375748
- DOI:
10.1016/0142-9612(84)
-2
Абстрактный
Методы электрохимической термодинамики (диаграммы равновесия электродный потенциал-рН) и электрохимической кинетики (кривые поляризации) могут помочь понять и предсказать коррозионное поведение металлов и сплавов в присутствии биологических жидкостей. Дан краткий обзор литературы по некоторым применениям таких методов, как in vitro, так и in vivo, применительно к хирургическим имплантатам (нержавеющие стали, хром-кобальт-молибденовые сплавы, титан и титановые сплавы) и стоматологическим сплавам (серебро-олово). – амальгамы меди, литейные сплавы на основе серебра и золота, литейные сплавы на основе никеля). Обращается внимание на необходимость более фундаментальных исследований щелевой и фреттинг-коррозии материалов хирургических имплантатов и стоматологических сплавов, а также на токсичность продуктов коррозии. Совершенное понимание точного значения электродных потенциалов необходимо для успеха такой задачи.
Дан краткий обзор литературы по некоторым применениям таких методов, как in vitro, так и in vivo, применительно к хирургическим имплантатам (нержавеющие стали, хром-кобальт-молибденовые сплавы, титан и титановые сплавы) и стоматологическим сплавам (серебро-олово). – амальгамы меди, литейные сплавы на основе серебра и золота, литейные сплавы на основе никеля). Обращается внимание на необходимость более фундаментальных исследований щелевой и фреттинг-коррозии материалов хирургических имплантатов и стоматологических сплавов, а также на токсичность продуктов коррозии. Совершенное понимание точного значения электродных потенциалов необходимо для успеха такой задачи.
Похожие статьи
[Электрохимическое поведение титана и стоматологической отливки при моделировании условий полости рта].
Пелсоци-Ковач И., Куцан Г., Раушер А., Фазекас А. Пелсоци-Ковач I и др.
Фогорв Сз. 2005 г., декабрь 98(6):251-5. Фогорв Сз. 2005. PMID: 16468487 Венгерский.
Поведение материалов имплантатов в условиях щелевой коррозии in vitro.
Сутов Э.Дж., Джонс Д.В., Милн Э.Л. Sutow EJ и соавт. Джей Дент Рез. 1985 г., май; 64 (5): 842-7. дои: 10.1177/00220345850640051201. Джей Дент Рез. 1985. PMID: 3858307
Коррозионное поведение стоматологических металлов и сплавов в различных средах.
Кедичи С.П., Аксют А.А., Киличарслан М.А., Байрамоглу Г., Гёкдемир К. Кедичи С.П. и др. J Оральная реабилитация. 25 октября 1998 г. (10): 800-8. дои: 10.1046/j.1365-2842.1998.00305.х. J Оральная реабилитация. 1998. PMID: 9802590
Коррозия и модификация поверхности биосовместимых металлов: обзор.

Асри РИМ, Харун ВСВ, Самикано М., Лах НАК, Гани САК, Тарлочан Ф., Раза М.Р. Асри РИМ и др. Mater Sci Eng C Mater Biol Appl. 2017 1 августа; 77: 1261-1274. doi: 10.1016/j.msec.2017.04.102. Epub 2017 20 апр. Mater Sci Eng C Mater Biol Appl. 2017. PMID: 28532004 Рассмотрение.
Биоповреждение и коррозия металлических имплантатов и протезов.
Лопес Г.Д. Лопес ГД. Медицина (B Aires). 1993;53(3):260-74. Медицина (B Aires). 1993. PMID: 8114635 Рассмотрение. Испанский.
Посмотреть все похожие статьи
Цитируется
Биоразлагаемое железо и пористое железо: механические свойства, поведение при разложении, способы производства и биомедицинские применения.

Салама М., Ваз М.Ф., Коласо Р., Сантос С., Кармезим М. Салама М. и др. J Функция Биоматер. 2022 1 июня; 13 (2): 72. дои: 10.3390/jfb13020072. J Функция Биоматер. 2022. PMID: 35735927 Бесплатная статья ЧВК. Рассмотрение.
Исследование биосовместимости мембран на основе полисахаридов Anacardium occidentale L. и поливинилового спирта после подкожной имплантации крысам.
Шагас А.Л.Д., Оливейра Л.П., Круз М.В., Мело Р.М., Мигель М.П., Фернандес К.Ф., Менезеш Л.Б. Шагас ALD и др. Материалы (Базель). 2022 10 февраля; 15 (4): 1296. doi: 10.3390/ma15041296. Материалы (Базель). 2022. PMID: 35207837 Бесплатная статья ЧВК.
Испытания in vitro на трибокоррозию конуса шейки бедра: обзор экспериментальных методов.

Уайт К.М., Шемич Э.Х. Уайт С.М. и соавт. Proc Inst Mech Eng H. 2022 Feb 10;236(4):9544119221074582. дои: 10.1177/09544119221074582. Онлайн перед печатью. Proc Inst Mech Eng H. 2022. PMID: 35139678 Бесплатная статья ЧВК.
Связаны ли режимы повреждения с микроструктурой и потерей материала в сильно поврежденных головках бедренных костей CoCrMo?
Маккарти С.М., Холл ДиДжей, Мэтью М.Т., Джейкобс Дж.Дж., Лундберг Х.Дж., Поурзал Р. Маккарти С.М. и др. Clin Orthop Relat Relat Res. 2021 1 сентября; 479(9):2083-2096. doi: 10.1097/CORR.0000000000001819. Clin Orthop Relat Relat Res. 2021. PMID: 34019490 Бесплатная статья ЧВК.
Фотоэлектрический эффект ускорил электрохимическую коррозию и процессы наноотпечатка на пластинах арсенида галлия.



 Чем больше электронов может разместить катод, тем быстрее будет корродировать анод. Это основная взаимосвязь между анодом и катодом в коррозионной ячейке.
Чем больше электронов может разместить катод, тем быстрее будет корродировать анод. Это основная взаимосвязь между анодом и катодом в коррозионной ячейке. 1016/0142-9612(84)
1016/0142-9612(84)