Электрохимическая защита: Электрохимическая защита
alexxlab | 03.12.1989 | 0 | Разное
Электрохимическая защита технологических трубопроводов
При укладке в траншею изолированного трубопровода и его последующей засыпке изоляционное покрытие может быть повреждено, а в процессе эксплуатации трубопровода оно постепенно стареет (теряет свои диэлектрические свойства, водоустойчивость, адгезию). Поэтому при всех способах прокладки, кроме надземной, трубопроводы подлежат комплексной защите от коррозии защитными покрытиями и средствами электрохимической защиты (ЭХЗ) независимо от коррозионной активности грунта.
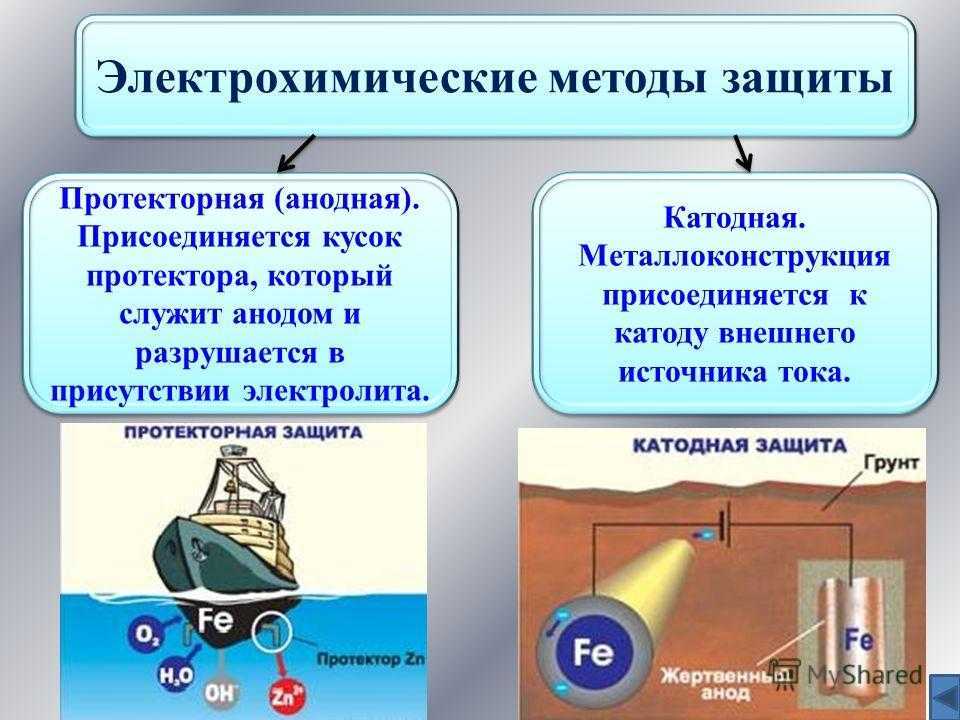
К средствам ЭХЗ относятся катодная, протекторная и электродренажная защиты.
Защита от почвенной коррозии осуществляется катодной поляризацией трубопроводов. Если катодная поляризация производится с помощью внешнего источника постоянного тока, то такая защита называется катодной, если же поляризация осуществляется присоединением защищаемого трубопровода к металлу, имеющему более отрицательный потенциал, то такая защита называется протекторной.
Катодная защита
Принципиальная схема катодной защиты показана на рисунке.
Источником постоянного тока является станция катодной защиты 3, где с помощью выпрямителей переменный ток от вдольтрассовой ЛЭП 1, поступающий через трансформаторный пункт 2, преобразуется в постоянный.
Отрицательным полюсом источник с помощью соединительного провода 4 подключен к защищаемому трубопроводу 6, а положительным — к анодному заземлению 5. При включении источника тока электрическая цепь замыкается через почвенный электролит.
Принципиальная схема катодной защиты
1 — ЛЭП; 2 — трансформаторный пункт; 3 — станция катодной защиты; 4 — соединительный провод; 5 — анодное заземление; 6 — трубопровод
Принцип действия катодной защиты следующий. Под воздействием приложенного электрического поля источника начинается движение полусвободных валентных электронов в направлении «анодное заземление — источник тока— защищаемое сооружение». Теряя электроны, атомы металла анодного заземления переходят в виде ион-атомов в раствор электролита, т.е. анодное заземление разрушается. Ион-атомы подвергаются гидратации и отводятся в глубь раствора. У защищаемого же сооружения вследствие работы источника постоянного тока наблюдается избыток свободных электронов, т.е. создаются условия для протекания реакций кислородной и водородной деполяризации, характерных для катода.
Ион-атомы подвергаются гидратации и отводятся в глубь раствора. У защищаемого же сооружения вследствие работы источника постоянного тока наблюдается избыток свободных электронов, т.е. создаются условия для протекания реакций кислородной и водородной деполяризации, характерных для катода.
Подземные коммуникации нефтебаз защищают катодными установками с различными типами анодных заземлений. Необходимая сила защитного тока катодной установки определяется по формуле
Jдр=j3·F3·K0
где j3 — необходимая величина защитной плотности тока; F3 — суммарная поверхность контакта подземных сооружений с грунтом; К0 — коэффициент оголенности коммуникаций, величина которого определяется в зависимости от переходного сопротивления изоляционного покрытия Rnep и удельного электросопротивления грунта рг по графику, приведенному на рисунке ниже.
Необходимая величина защитной плотности тока выбирается в зависимости от характеристики грунтов площадки нефтебазы в соответствии с таблицей ниже.
Протекторная защита
Принцип действия протекторной защиты аналогичен работе гальванического элемента.
Два электрода: трубопровод 1 и протектор 2, изготовленный из более электроотрицательного металла, чем сталь, опущены в почвенный электролит и соединены проводом 3. Так как материал протектора является более электроотрицательным, то под действием разности потенциалов происходит направленное движение электронов от протектора к трубопроводу по проводнику 3. Одновременно ион-атомы материала протектора переходят в раствор, что приводит к его разрушению. Сила тока при этом контролируется с помощью контрольно-измерительной колонки 4.
Зависимость коэффициентов оголенности подземных трубопроводов от переходного сопротивления изоляционного покрытия для грунтов удельным сопротивлением, Ом-м
1 — 100; 2 — 50; 3 — 30; 4 — 10; 5 — 5
Зависимость защитной плотности тока от характеристики грунтов
Тип грунта | рп Омм | А, А/м2 |
Влажный глинистый грунт: | ||
— pH >8 | 15 | 0,033 |
pH = 6-8 | 15 | 0,160 |
— с примесью песка | 15 | 0,187 |
Влажный торф (pH <8) | 15 | 0,160 |
Увлажненный песок | 50 | 0,170 |
Сухой глинистый грунт | 100 | 0,008 |
Принципиальная схема протекторной защиты
1 — трубопровод; 2 — протектор; 3 — соединительный провод; 4 — контрольно-измерительная колонка
Таким образом, разрушение металла все равно имеет место. Но не трубопровода, а протектора.
Но не трубопровода, а протектора.
Теоретически для защиты стальных сооружений от коррозии могут быть использованы все металлы, расположенные в электрохимическом ряду напряжений левее железа, так как они более электроотрицательны. Практически же протекторы изготавливаются только из материалов, удовлетворяющих следующим требованиям:
- разность потенциалов материала протектора и железа (стали) должна быть как можно больше;
- ток, получаемый при электрохимическом растворении единицы массы протектора (токоотдача), должен быть максимальным;
- отношение массы протектора, израсходованной на создание защитного тока, к общей потере массы протектора (коэффициент использования) должно быть наибольшим.
Данным требованиям в наибольшей степени удовлетворяют сплавы на основе магния, цинка и алюминия.
Протекторную защиту осуществляют сосредоточенными и протяженными протекторами. В первом случае удельное электросопротивление грунта должно быть не более 50 Ом-м, во втором — не более 500 Ом·м.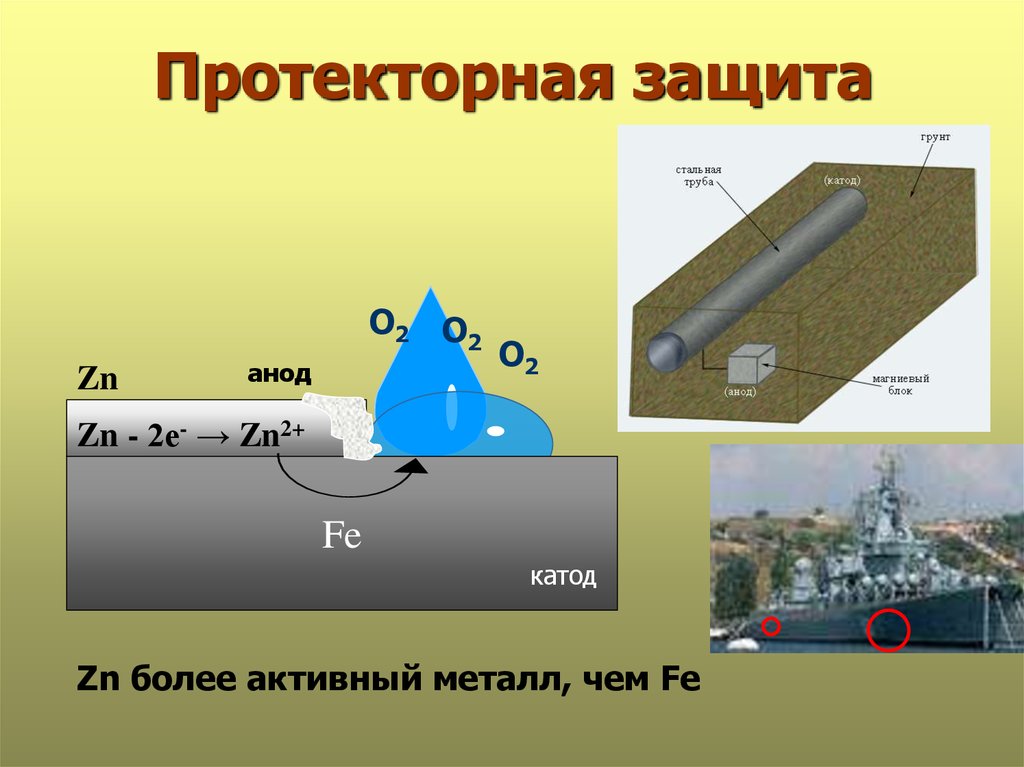
Электродренажная защита трубопроводов
Метод защиты трубопроводов от разрушения блуждающими токами, предусматривающий их отвод (дренаж) с защищаемого сооружения на сооружение — источник блуждающих токов либо специальное заземление, называется электродренажной защитой.
Применяют прямой, поляризованный и усиленный дренажи.
Принципиальные схемы электродренажной защиты
а — прямой дренаж; б —поляризованный дренаж; в — усиленный дренажПрямой электрический дренаж — это дренажное устройство двусторонней проводимости. Схема прямого электрического дренажа включает: реостат К, рубильник К, плавкий предохранитель Пр и сигнальное реле С. Сила тока в цепи «трубопровод — рельс* регулируется реостатом. Если величина тока превысит допустимую величину, то плавкий предохранитель сгорит, ток потечет по обмотке реле, при включении которого включается звуковой или световой сигнал.
Прямой электрический дренаж применяется в тех случаях, когда потенциал трубопровода постоянно выше потенциала рельсовой сети, куда отводятся блуждающие токи. В противном случае дренаж превратится в канал для натекания блуждающих токов на трубопровод.
В противном случае дренаж превратится в канал для натекания блуждающих токов на трубопровод.
Поляризованный электрический дренаж — это дренажное устройство, обладающее односторонней проводимостью. От прямого дренажа поляризованный отличается наличием элемента односторонней проводимости (вентильный элемент) ВЭ. При поляризованном дренаже ток протекает только от трубопровода к рельсу, что исключает натекание блуждающих токов на трубопровод по дренажному проводу.
Усиленный дренаж применяется в тех случаях, когда нужно не только отводить блуждающие токи с трубопровода, но и обеспечить на нем необходимую величину защитного потенциала. Усиленный дренаж представляет собой обычную катодную станцию, подключенную отрицательным полюсом к защищаемому сооружению, а положительным — не к анодному заземлению, а к рельсам электрифицированного транспорта.
За счет такой схемы подключения обеспечивается: вопервых, поляризованный дренаж (за счет работы вентильных элементов в схеме СКЗ), а во-вторых, катодная станция удерживает необходимый защитный потенциал трубопровода.
После ввода трубопровода в эксплуатацию производится регулировка параметров работы системы их защиты от коррозии. При необходимости с учетом фактического положения дел могут вводиться в эксплуатацию дополнительные станции катодной и дренажной защиты, а также протекторные установки.
технологических трубопроводов, резервуаров, сосудов, свай, причалов, мостов и многого другого — электронный каталог продукции,разработка мобильных приложений,АОС,автоматизированные обучающие системы,семинары по нефтегазовой тематике,разработка СТУ,СТУ
Метод электрохимической защиты (ЭХЗ) от коррозии уже многие годы применяется инженерами для продления срока службы различных металлических устройств и сооружений. Однако так повелось, что наиболее широко известны технические решения по использованию ЭХЗ для противокоррозионной защиты больших металлоемких конструкций и сооружений, таких как подземные трубопроводы в нефтегазовой промышленности и в сфере ЖКХ или большие стальные резервуары, хотя принцип работы ЭХЗ универсален, и может быть успешно использован практически везде, где есть контакт металла и агрессивного электролита. В этой статье мы бы хотели дать, безусловно, очень краткий обзор других возможностей применения электрохимзащиты вокруг нас – в индустриальной, общественной и даже приватной сфере жизни современного человека.
В этой статье мы бы хотели дать, безусловно, очень краткий обзор других возможностей применения электрохимзащиты вокруг нас – в индустриальной, общественной и даже приватной сфере жизни современного человека.
Электрохимическая защита основана на управлении токами электрохимической коррозии, всегда возникающими при контакте любого металлического сооружения и электролита. С помощью ЭХЗ анодная разрушающаяся зона переносится с защищаемого объекта либо на специальное анодное заземление (при катодной защите), либо на отдельное изделие из более активного металла (при протекторной защите). Более подробно о физико-химических принципах катодной и протекторной защиты от коррозии можно прочитать здесь. Главное, что следует понимать при принятии решения о применении ЭХЗ – это то, что необходим обязательный контакт защищаемого объекта/системы объектов и внешнего анода (анодного заземления или протектора), как посредством проводника первого рода (металлического кабеля или прямого металлического контакта), так и посредством проводника второго рода (электролита).
Простой и очевидный пример объекта, подвергающегося электрохимической коррозии, которую можно замедлить с помощью ЭХЗ – это закопанное в землю или стоящее на земле любое металлическое сооружение: свая, резервуар, трубопровод любого назначения. Конечно, применять ЭХЗ везде и всюду нет никакой необходимости, однако если объект находится в грунте высокой коррозионной агрессивности (высокая влажность или засоленность – явные признаки такого грунта!), либо это промышленно значимый и плохо ремонтопригодный объект – ЭХЗ явно не будет лишней. Проект такой системы ЭХЗ не очень сложен. Например, если нужно защитить свайный фундамент, то достаточно станции катодной защиты малой мощности (может хватить и аккумулятора) и несколько правильно расположенных точечных анодов, или несколько небольших отрезков протяженного анода. Только нужно не забыть, что если сваи сделаны из труб, то они могут корродировать и изнутри, там, где ЭХЗ работать не будет. Одиночный, полностью закопанный резервуар также прекрасно защищается точечными анодами по периметру сооружения, а днище резервуара, стоящего на грунте – одним точечным анодом или изогнутым отрезком протяженного анода. Если есть возможность менять анодные заземления и сопротивление грунта мало, то вместо точечных анодов можно установить протекторные установки, срок эффективной работы которых обычно составляет 5-7 лет.
Конечно, применять ЭХЗ везде и всюду нет никакой необходимости, однако если объект находится в грунте высокой коррозионной агрессивности (высокая влажность или засоленность – явные признаки такого грунта!), либо это промышленно значимый и плохо ремонтопригодный объект – ЭХЗ явно не будет лишней. Проект такой системы ЭХЗ не очень сложен. Например, если нужно защитить свайный фундамент, то достаточно станции катодной защиты малой мощности (может хватить и аккумулятора) и несколько правильно расположенных точечных анодов, или несколько небольших отрезков протяженного анода. Только нужно не забыть, что если сваи сделаны из труб, то они могут корродировать и изнутри, там, где ЭХЗ работать не будет. Одиночный, полностью закопанный резервуар также прекрасно защищается точечными анодами по периметру сооружения, а днище резервуара, стоящего на грунте – одним точечным анодом или изогнутым отрезком протяженного анода. Если есть возможность менять анодные заземления и сопротивление грунта мало, то вместо точечных анодов можно установить протекторные установки, срок эффективной работы которых обычно составляет 5-7 лет.
Теперь перейдем к не очень распространенному, но очень продуктивному способу электрохимической защиты от коррозии внутренней поверхности трубопроводов и резервуаров (сосудов) любой емкости и назначения, имеющих контакт с агрессивным водным электролитом (промышленными сточными водами или просто водой с высоким содержанием минеральных солей и кислорода). В этом случае применение ЭХЗ позволяет продлить срок безремонтной эксплуатации объекта в несколько раз. Более простой случай – внутренняя ЭХЗ резервуара, когда во внутреннем пространстве резервуара размещаются протекторы или анодные заземления. Эффективность ЭХЗ существенно повысится, если внутренняя поверхность резервуара будет дополнительно защищена изоляционным покрытием с хорошими диэлектрическими свойствами. Более сложное техническое решение применяется для внутренней электрохимической защиты трубопровода. В этом случае наиболее эффективно ввести во внутреннюю полость трубопровода протяженный гибкий анод (ПГА) из токопроводящей резины.
Внутренняя ЭХЗ трубопровода с применением протекторов
Такие системы внутренней электрохимзащиты чрезвычайно эффективны, даже когда ничего больше не помогает в принципе. Например, срок службы трубопроводов и различных очистительных установок – очень коррозионно-агрессивных сточных вод промышленных предприятий – продлевается за счет внутренней ЭХЗ в 5-20 раз!
Следующий интересный случай применения систем ЭХЗ – это причальные сооружения, основания нефтегазовых платформ, опоры мостов или любые другие металлические конструкции в морской воде. Кстати, воды некоторых пресных водоемов в нашей “экологически чистой” стране, особенно вблизи крупных городов и промышленных предприятий, по коррозионной агрессивности приближаются к морской воде, поэтому все излагаемое ниже распространяется и на них с небольшими оговорками.
Коррозия сваи в зоне переменного смачивания и забрызгивания
Итак, металлические конструкции в морской воде подвергаются активной электрохимической коррозии, которая не может быть остановлена обычной покраской. По механизму коррозионного процесса на таких объектах обычно выделяют три основных зоны:
- зона переменного смачивания и забрызгивания;
- зона полного погружения в воду;
- зона погружения сваи в грунт.
Наибольшую сложность при реализации систем электрохимической защиты представляет зона переменного смачивания, где нет постоянной электрической цепи “сооружение – электролит – анод”. Для этих зон необходимы анодные заземления (протекторы) сетчатой или браслетной формы, обеспечивающие раздельную защиту локально увлажненных участков металлической конструкции. В самых сложных случаях имеет смысл обеспечить принудительное постоянное увлажнение зоны переменного смачивания конструкции, для постоянной работы средств ЭХЗ.
Электрохимзащита зоны полного смачивания металлических свай в водной среде может быть реализована в зависимости от конструкции разными способами, среди которых имеет смысл выделить следующие:
- размещение нескольких подвесных точечных анодов, каждый из которых защищает ближайшие, окружающие его, сваи;
- на более глубоких участках возможно использование протяженных гибких анодов, которые крепятся к тросам, закрепляемым концами на металлическом сооружении и дне водоема;
- если нет возможности подвести электричество к защищаемому сооружению, тогда приемлемым методом электрохимической защиты будет использование больших глубинных протекторов с длительными расчетными сроками эксплуатации.
Магниевый протектор для электрохимзащиты морских сооружений
Теперь вернемся к анонсированной ЭХЗ от атмосферной коррозии металлического сооружения во влажном морском или промышленном воздухе. По своему механизму этот случай чем-то напоминает коррозию в зоне переменного смачивания – также большое количество локально-увлажненных участков, только еще более маленьких. В этом случае единственный способ обеспечить электрохимическую защиту всей поверхности защищаемого изделия – это обеспечить свою локальную систему ЭХЗ на каждом увлажненном участке. Эта цель достигается путем нанесения на поверхность изделия специального покрытия, содержащего частицы металла, обладающего защитными протекторными свойствами по отношению к стали. Обычно этим металлом является цинк. Таким образом, на каждом участке поверхности обеспечивается своя маленькая установка протекторной защиты, которая активируется при увлажнении.
В этой статье мы рассказали только о нескольких основных случаях применения электрохимической защиты разнообразных металлических конструкций. На самом деле можно привести гораздо больше таких примеров – ЭХЗ может использоваться повсеместно: кузова автомобилей, корпуса морских судов, бытовые нагреватели воды, морские трубопроводы и т.д. Иногда даже приходится обеспечивать электрохимзащиту железобетонных конструкций, но это настолько объемная тема, что требует отдельного обзора. Поэтому можно смело говорить, что пока наш век металла не сменился веком композиционных материалов, именно электрохимическая защита будет одной из наиболее важных и востребованных человечеством технологий.
На самом деле можно привести гораздо больше таких примеров – ЭХЗ может использоваться повсеместно: кузова автомобилей, корпуса морских судов, бытовые нагреватели воды, морские трубопроводы и т.д. Иногда даже приходится обеспечивать электрохимзащиту железобетонных конструкций, но это настолько объемная тема, что требует отдельного обзора. Поэтому можно смело говорить, что пока наш век металла не сменился веком композиционных материалов, именно электрохимическая защита будет одной из наиболее важных и востребованных человечеством технологий.
comments powered by HyperComments
ХиМиК.ru – ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА – Химическая энциклопедия
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
металлов
от коррозии, основана на зависимости скорости коррозии от электродного
потенциала металла. В общем случае эта зависимость имеет сложный характер
и подробно описана в ст. Коррозия металлов. В принципе, металл или
сплав должен эксплуатироваться в той области потенциалов, где скорость
его анодного растворения меньше нек-рого конструктивно допустимого
предела, к-рый определяют, исходя из срока службы оборудования или допустимого
уровня загрязнения технол. среды продуктами коррозии. Кроме того, должна
быть мала вероятность локальных коррозионных повреждений. Это т. наз. потенциостатич.
защита.
В общем случае эта зависимость имеет сложный характер
и подробно описана в ст. Коррозия металлов. В принципе, металл или
сплав должен эксплуатироваться в той области потенциалов, где скорость
его анодного растворения меньше нек-рого конструктивно допустимого
предела, к-рый определяют, исходя из срока службы оборудования или допустимого
уровня загрязнения технол. среды продуктами коррозии. Кроме того, должна
быть мала вероятность локальных коррозионных повреждений. Это т. наз. потенциостатич.
защита.
К собственно электрохимической защите относят катодную защиту,
при к-рой потенциал металла специально сдвигают из области активного растворения
в более отрицат. область относительно потенциала коррозии, и анодную защиту,
при к-рой электродный потенциал сдвигают в положит. область до таких значений,
когда на пов-сти металла образуются пассивирующие слои (см. Пассивность
металлов).
Катодная защита. Сдвиг потенциала
металла м. б. осуществлен с помощью внеш. источника постоянного тока (станции
катодной защиты) или соединением с др. металлом, более электроотрицательным
по своему электродному потенциалу (т. наз. протекторный анод). При этом
пов-сть защищаемого образца (детали конструкции) становится эквипотенциальной
и на всех ее участках протекают только катодные процессы, а анодные, обусловливающие
коррозию, перенесены на вспомогат. электроды. Если, однако, сдвиг потенциала
в отрицат. сторону превысит определенное значение, возможна т. наз. перезащита,
связанная с выделением водорода, изменением состава приэлектродного слоя
и др. явлениями, что может привести к ускорению коррозии. Катодную защиту,
как правило, совмещают с нанесением защитных покрытий; необходимо учитывать
возможность отслаивания покрытия.
б. осуществлен с помощью внеш. источника постоянного тока (станции
катодной защиты) или соединением с др. металлом, более электроотрицательным
по своему электродному потенциалу (т. наз. протекторный анод). При этом
пов-сть защищаемого образца (детали конструкции) становится эквипотенциальной
и на всех ее участках протекают только катодные процессы, а анодные, обусловливающие
коррозию, перенесены на вспомогат. электроды. Если, однако, сдвиг потенциала
в отрицат. сторону превысит определенное значение, возможна т. наз. перезащита,
связанная с выделением водорода, изменением состава приэлектродного слоя
и др. явлениями, что может привести к ускорению коррозии. Катодную защиту,
как правило, совмещают с нанесением защитных покрытий; необходимо учитывать
возможность отслаивания покрытия.
Катодную защиту широко применяют для защиты
от морской коррозии. Гражданские суда защищают с помощью А1-, Mg-
или Zn-протекторных анодов, к-рые размещают вдоль корпуса и вблизи винтов
и рулей. Станции катодной защиты используют в тех случаях, когда требуется
отключение защиты для устранения электрич. поля корабля, при этом потенциал
обычно контролируют по хлорсеребряным электродам сравнения (х. с. э.).
Критерием достаточности защиты является значение потенциала -0,75 В по
х. с. э. или сдвиг от потенциала коррозии, составляющий 0,3 В (на практике
обычно 0,05-0,2 В). Существуют автоматич. станции катодной защиты, расположенные
на судне либо на берегу (при стоянке или ремонте). Аноды обычно изготовлены
из платинированного титана, линейной или круглой формы, с околоанодными
непроводящими экранами для улучшения распределения потенциала и плотности
тока вдоль корпуса судна. Конструкция анодов обеспечивает их защиту от
мех. повреждений (напр., в ледовых условиях).
Станции катодной защиты используют в тех случаях, когда требуется
отключение защиты для устранения электрич. поля корабля, при этом потенциал
обычно контролируют по хлорсеребряным электродам сравнения (х. с. э.).
Критерием достаточности защиты является значение потенциала -0,75 В по
х. с. э. или сдвиг от потенциала коррозии, составляющий 0,3 В (на практике
обычно 0,05-0,2 В). Существуют автоматич. станции катодной защиты, расположенные
на судне либо на берегу (при стоянке или ремонте). Аноды обычно изготовлены
из платинированного титана, линейной или круглой формы, с околоанодными
непроводящими экранами для улучшения распределения потенциала и плотности
тока вдоль корпуса судна. Конструкция анодов обеспечивает их защиту от
мех. повреждений (напр., в ледовых условиях).
Особенно важно использование катодной
защиты для стационарных нефтегазопромысловых сооружений, трубопроводов
и хранилищ к ним на континентальном шельфе. Подобные сооружения не могут
быть введены в сухой док для восстановления защитного покрытия, поэтому
электрохимическая защита является осн. методом предотвращения коррозии. Морская нефтепромысловая
вышка, как правило, снабжена в своей подводной части протекторными анодами
(на одну вышку приходится до 10 т и более протекторных сплавов).
Подобные сооружения не могут
быть введены в сухой док для восстановления защитного покрытия, поэтому
электрохимическая защита является осн. методом предотвращения коррозии. Морская нефтепромысловая
вышка, как правило, снабжена в своей подводной части протекторными анодами
(на одну вышку приходится до 10 т и более протекторных сплавов).
Широко распространена катодная защита
подземных сооружений. Практически все магистральные и городские трубопроводы,
кабели, подземные хранилища и скважины, особенно в засоленных грунтах,
снабжены устройствами для катодной защиты в сочетании с защитными покрытиями.
Как правило, электрохимическая защита осуществляется от станций катодной защиты, протекторные
аноды применяют лишь при отсутствии источников тока. Потенциал сооружения
контролируют по сульфатно-медным электродам сравнения; ток катодной защиты
периодически регулируют, исходя из потенциала защиты в разл. точках сооружения.
По мере разрушения защитного покрытия ток защиты увеличивают. Протекторные
аноды м. б. изготовлены из железокремниевых сплавов или графитопластов,
снабжаются околоанодной засыпкой (кокс, уголь) для снижения общего сопротивления
растеканию тока с анода в землю. По мере удаления анода от защищаемого
сооружения увеличивают необходимое напряжение защиты (обычно до 48 В, для
сильно удаленных анодов до 200 В), при этом улучшается распределение защитного
тока. Для защиты разветвленных городских сетей или для совместной защиты
неск. сооружений применяют глубинные аноды, расположенные под землей на
глубине 50-150 м.
точках сооружения.
По мере разрушения защитного покрытия ток защиты увеличивают. Протекторные
аноды м. б. изготовлены из железокремниевых сплавов или графитопластов,
снабжаются околоанодной засыпкой (кокс, уголь) для снижения общего сопротивления
растеканию тока с анода в землю. По мере удаления анода от защищаемого
сооружения увеличивают необходимое напряжение защиты (обычно до 48 В, для
сильно удаленных анодов до 200 В), при этом улучшается распределение защитного
тока. Для защиты разветвленных городских сетей или для совместной защиты
неск. сооружений применяют глубинные аноды, расположенные под землей на
глубине 50-150 м.
Важное значение имеет электрохимическая защита подземных
сооружений в поле блуждающих токов, осн. причина возникновения таких токов
– работа электротранспорта, реже – заземление электрооборудования. Борьба
с коррозией в этих условиях сводится к контролю потенциала и установке
дренажных устройств, обеспечивающих электрич. соединение источников токов
утечки с защищаемым сооружением. Используют автоматич. дренажные устройства
с включением и выключением в соответствии со значением защитного потенциала.
Такие дренажные устройства обеспечивают надежную защиту вне зависимости
от изменения знака потенциала на защищаемом сооружении.
соединение источников токов
утечки с защищаемым сооружением. Используют автоматич. дренажные устройства
с включением и выключением в соответствии со значением защитного потенциала.
Такие дренажные устройства обеспечивают надежную защиту вне зависимости
от изменения знака потенциала на защищаемом сооружении.
Катодную защиту стальной арматуры в железобетоне
применяют для свай, фундаментов, дорожных сооружений (в т. ч. горизонтальных
покрытий) и зданий. Арматура, сваренная, как правило, в единую электрич.
систему, корродирует при проникновении в бетон влаги и хлоридов. Последние
могут попадать в результате воздействия морской воды или использования
солей-антиобледенителей дорожных сооружений, применения хлоридов для ускорения
твердения бетона. Весьма эффективна санация бетона старых зданий с установкой
катодной защиты. При этом устанавливают первичные аноды из кремнистого
чугуна, платинированных титана или ниобия, графита, титана с металлооксидным
покрытием, к-рые обеспечивают подвод тока к вторичным (распределительным)
анодам (титановой сетке с металлооксидным покрытием или электропроводящим
неметаллич. покрытием, титановому стержню с покрытием), расположенным вдоль
всей пов-сти сооружения и закрытым сверху относительно тонким слоем бетона.
Потенциал арматуры регулируют, изменяя внеш. ток.
покрытием, титановому стержню с покрытием), расположенным вдоль
всей пов-сти сооружения и закрытым сверху относительно тонким слоем бетона.
Потенциал арматуры регулируют, изменяя внеш. ток.
Разрабатываются способы катодной защиты
кузовов транспортной техники (автомобилей). Протекторные аноды используют
для защиты отд. декоративных элементов кузова, при этом электронные устройства
обеспечивают постоянный или импульсный ток; аноды, наклеиваемые на кузов,
изготавливают из электропроводящего полимера (напр., графитопласта, углепластика)
или нержавеющей стали. Для увеличения зоны действия защиты необходимо размещать
аноды в наиб. коррозионноопасных точках или использовать электропроводящую
окраску.
Анодная защита применяется в хим.
и смежных с ней отраслях пром-сти в принципиально иных условиях, чем катодная
защита; оба типа электрохимической защиты в агрессивных средах дополняют друг друга. Металл
конструкции или сооружения должен иметь область пассивности с достаточно
низкой скоростью растворения, к-рая лимитируется не только разрушением
металла, но и возможным загрязнением среды. Широко применяют анодную защиту
для оборудования, работающего в серной к-те, средах на ее основе, водных
р-рах аммиака и минер, удобрений, фосфорной к-те, в целлюлозно-бумажной
пром-сти и ряде отд. произ-в (напр., роданида натрия). Особенно важна анодная
защита теплообменного оборудования из легир. сталей в произ-ве серной к-ты;
защита холодильников со стороны к-ты позволяет повысить рабочую т-ру, интенсифицировать
теплообмен, повысить эксплуатац. надежность. Регулирование потенциала металла
осуществляют автоматич. станциями анодной защиты (регуляторами потенциала),
работающими с контролем потенциала и управляющим сигналом от электрода
сравнения. Вспомогат. электроды изготавливают из высоколегир. сталей, кремнистого
чугуна, платинированной латуни (бронзы) или меди. Электроды сравнения -
выносные и погружные, близкие по составу к анионному составу агрессивной
среды (сульфатно-ртутные, сульфатно-медные и т. п.). М. б. использованы
любые электроды, имеющие в данной среде к.
Широко применяют анодную защиту
для оборудования, работающего в серной к-те, средах на ее основе, водных
р-рах аммиака и минер, удобрений, фосфорной к-те, в целлюлозно-бумажной
пром-сти и ряде отд. произ-в (напр., роданида натрия). Особенно важна анодная
защита теплообменного оборудования из легир. сталей в произ-ве серной к-ты;
защита холодильников со стороны к-ты позволяет повысить рабочую т-ру, интенсифицировать
теплообмен, повысить эксплуатац. надежность. Регулирование потенциала металла
осуществляют автоматич. станциями анодной защиты (регуляторами потенциала),
работающими с контролем потенциала и управляющим сигналом от электрода
сравнения. Вспомогат. электроды изготавливают из высоколегир. сталей, кремнистого
чугуна, платинированной латуни (бронзы) или меди. Электроды сравнения -
выносные и погружные, близкие по составу к анионному составу агрессивной
среды (сульфатно-ртутные, сульфатно-медные и т. п.). М. б. использованы
любые электроды, имеющие в данной среде к. -л. устойчивый потенциал, напр.
потенциал коррозии (электроды из чистого цинка) или потенциал электрохим.
р-ции (осаждения покрытия, выделения хлора или кислорода). Зона действия
защитных потенциалов зависит от области оптим. запассивированности металла
и изменяется от неск. В (титановые сплавы) до неск. десятков мВ (нержавеющие
стали при повышенных т-рах).
-л. устойчивый потенциал, напр.
потенциал коррозии (электроды из чистого цинка) или потенциал электрохим.
р-ции (осаждения покрытия, выделения хлора или кислорода). Зона действия
защитных потенциалов зависит от области оптим. запассивированности металла
и изменяется от неск. В (титановые сплавы) до неск. десятков мВ (нержавеющие
стали при повышенных т-рах).
Анодная защита ванн для хим. осаждения
покрытий обеспечивает защиту ванны от коррозии и случайных осаждений покрытия
на стенки ванны. Возможно возникновение вторичной пассивной области потенциалов,
расположенных положительнее области питтингообразования, что обеспечивает
анодную защиту от питтинговой коррозии. Для стабилизации систем
защиты применяют протекторные катоды с высоким положит. потенциалом (графитопластовые
электроды), поляризация создается с помощью оксидных электродов или кислородных
электродов, используемых в топливных элементах.
В злектрохим. произ-вах для защиты оборудования
от токов утечки по электролиту устанавливают дополнит. электроды, устраняющие
протекание тока через защищаемую пов-сть.
произ-вах для защиты оборудования
от токов утечки по электролиту устанавливают дополнит. электроды, устраняющие
протекание тока через защищаемую пов-сть.
Лит.: Красноярский В. В., Электрохимический метод защиты металлов от коррозии, М., 1961; Фрейман Л.И., Макаров В.А., Брыксин Е. И., Потенциостатические методы в коррозионных исследованиях и электрохимической защите, Л., 1972; Люблинский Е. Я., Протекторная зашита морских судов и сооружений от коррозии, Л., 1979; Кузуб B. C., Анодная защита технологического оборудования, М., 1989.
В. А. Макаров.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Основы катодной защиты
Коррозия является естественным разрушительным явлением, которое возникает, когда некоторые металлы подвергаются воздействию окружающей среды. Реакция между воздухом, влагой и металлической подложкой вызывает специфические химические реакции, в результате которых металл превращается в более химически стабильную форму оксида, гидроксида или сульфида. В металлах на основе железа, таких как сталь, коррозия проявляется в виде оксидов железа III, также известных как ржавчина.
Реакция между воздухом, влагой и металлической подложкой вызывает специфические химические реакции, в результате которых металл превращается в более химически стабильную форму оксида, гидроксида или сульфида. В металлах на основе железа, таких как сталь, коррозия проявляется в виде оксидов железа III, также известных как ржавчина.
Реклама
Для возникновения электрохимической коррозии должны присутствовать три компонента: анод, катод и электролит. Анод и катод обычно соединены непрерывным электрическим путем, при этом оба погружены в один и тот же электролит. Во время этого процесса анод подвергается коррозии, а катод остается незатронутым.
Реклама
Рисунок 1. Типичная электрохимическая ячейка, показывающая поток электронов от анода к катоду через электрическое соединение. (Источник: Alksub в английской Википедии / CC BY-SA)
Существуют различные методы предотвращения коррозии и борьбы с ней. Один из них известен как катодная защита (CP). Этот метод работает путем соединения металла, который нужно защитить, с более легко подверженным коррозии «жертвенным металлом». Этот жертвенный металл преимущественно подвергается коррозии (действуя как анод), в то время как рассматриваемый более ценный металлический объект (действуя как катод) остается защищенным. В этой статье мы объясним, как работает этот метод жертвенной защиты, и опишем его различные применения.
Один из них известен как катодная защита (CP). Этот метод работает путем соединения металла, который нужно защитить, с более легко подверженным коррозии «жертвенным металлом». Этот жертвенный металл преимущественно подвергается коррозии (действуя как анод), в то время как рассматриваемый более ценный металлический объект (действуя как катод) остается защищенным. В этой статье мы объясним, как работает этот метод жертвенной защиты, и опишем его различные применения.
Понимание гальванической или биметаллической коррозии
Чтобы понять, как работает катодная защита, мы должны сначала понять основы биметаллической коррозии, также известной как гальваническая коррозия. Биметаллическая коррозия, как следует из ее названия, представляет собой уникальный тип коррозии, возникающий при соединении двух металлов. Эта коррозия наблюдается в нескольких ситуациях, когда разнородные металлы находятся в прямом или косвенном контакте друг с другом. Биметаллическая коррозия обычно характеризуется ускоренной коррозией одного металла, в то время как другой остается незатронутым. Другими словами, один металл жертвует собой, защищая другой. (Более подробно этот процесс рассмотрен в статье «Почему два разнородных металла вызывают коррозию?»)
Другими словами, один металл жертвует собой, защищая другой. (Более подробно этот процесс рассмотрен в статье «Почему два разнородных металла вызывают коррозию?»)
Коррозия в гальваническом элементе обусловлена главным образом свойством, известным как разность потенциалов. Эта разность потенциалов заставляет электроны течь от одного металла в ячейке (анод) к другому металлу (катод), генерируя при этом небольшое количество электричества. По мере того, как электроны вытекают из анода, происходит окисление, вызывающее разрушение или коррозию анодного металла. Между тем, когда электроны текут к катоду, происходит восстановление, дополнительно защищающее катодный металл.
Реклама
При биметаллической коррозии эта разность потенциалов является прямым результатом разности электродных потенциалов между двумя разнородными металлами. Когда металл погружается в электролит, он принимает электродный потенциал, который отражает способность металла окисляться или восстанавливаться. Электродный потенциал различных металлов отображается в виде списка, известного как гальванический ряд. (Дополнительную информацию см. в разделе «Введение в серию гальваники: гальваническая совместимость и коррозия».) Металлы, расположенные выше в таблице, считаются анодными (более электроотрицательными), а металлы, расположенные ниже в таблице, более катодными (более электроположительными). . Чем дальше друг от друга находятся контактирующие металлы в гальваническом ряду, тем больше разность потенциалов между металлами и тем сильнее коррозия на аноде.
Электродный потенциал различных металлов отображается в виде списка, известного как гальванический ряд. (Дополнительную информацию см. в разделе «Введение в серию гальваники: гальваническая совместимость и коррозия».) Металлы, расположенные выше в таблице, считаются анодными (более электроотрицательными), а металлы, расположенные ниже в таблице, более катодными (более электроположительными). . Чем дальше друг от друга находятся контактирующие металлы в гальваническом ряду, тем больше разность потенциалов между металлами и тем сильнее коррозия на аноде.
Катодная защита (CP) и метод ее работы
Несмотря на то, что конструкция систем катодной защиты может быть сложной, их работа основана на концепции биметаллической или гальванической коррозии, описанной ранее. Понимая принципы этого типа коррозии, мы можем намеренно соединять металлы вместе, чтобы гарантировать катодную защиту одного из них от другого. Другими словами, если мы хотим защитить определенную металлическую конструкцию, мы можем создать условия, при которых этот металл станет катодом электрохимической ячейки.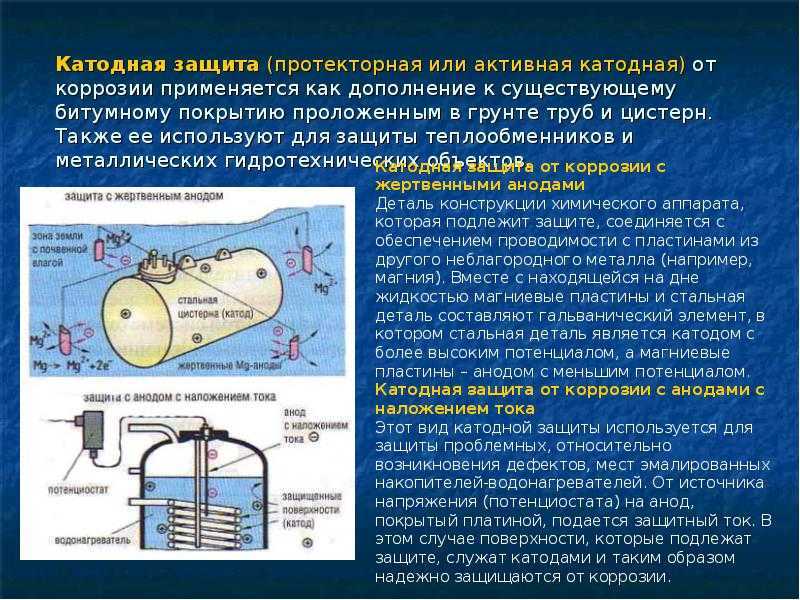 Электрически соединяя защищаемый металл с более анодным (электроотрицательным) металлом, мы можем гарантировать, что анод жертвует собой, корродируя преимущественно по сравнению с катодным аналогом.
Электрически соединяя защищаемый металл с более анодным (электроотрицательным) металлом, мы можем гарантировать, что анод жертвует собой, корродируя преимущественно по сравнению с катодным аналогом.
В некоторых случаях внешние источники питания могут использоваться для подачи дополнительных электронов в электрохимический процесс, что может повысить эффективность катодной защиты.
Системы катодной защиты используются во многих отраслях промышленности для защиты широкого спектра конструкций в сложных или агрессивных средах. В частности, в нефтяной и газовой промышленности системы катодной защиты используются для предотвращения коррозии топливопроводов, стальных резервуаров для хранения, морских платформ и обсадных труб нефтяных скважин. В морской промышленности этот метод защиты также используется для стальных свай, пирсов, причалов и корпусов судов. Другой распространенный тип катодной защиты, известный как цинкование, обычно используется для защиты стальных элементов и конструкций. (Чтобы узнать больше, прочтите «Гальванизация и ее эффективность в предотвращении коррозии».)
(Чтобы узнать больше, прочтите «Гальванизация и ее эффективность в предотвращении коррозии».)
Типы катодной защиты (CP)
Как упоминалось ранее, катодная защита работает путем преднамеренного формирования гальванического элемента с другим жертвенным металлом. Это может быть достигнуто за счет использования двух различных типов катодной защиты: пассивной катодной защиты и катодной защиты подаваемого тока.
Пассивная катодная защита
В системах пассивной катодной защиты расходуемый анод прямо или косвенно соединен с защищаемым металлом. Разность потенциалов между двумя разнородными металлами генерирует достаточное количество электричества для формирования электрохимической ячейки и запуска гальванической или биметаллической коррозии.
Этот тип защиты обычно используется в нефтегазовой промышленности для защиты стальных конструкций морских буровых установок и платформ. Здесь алюминиевые стержни (или другой подходящий металл) монтируются непосредственно на стальные секции, чтобы взять на себя роль жертвенного металла. Аналогичным методом катодно защищают стальные водонагреватели, резервуары и сваи.
Аналогичным методом катодно защищают стальные водонагреватели, резервуары и сваи.
Рисунок 2. Схема защиты трубопровода расходуемым анодом с использованием методов пассивной катодной защиты. Обратите внимание на отсутствие внешнего источника питания.
Другим распространенным примером пассивной катодной защиты является горячеоцинкованная сталь. Во время этого процесса стальные элементы или конструкции погружаются в ванну с расплавленным цинком, который покрывает объект. Когда сталь удаляется из расплавленного цинка, она вступает в реакцию с воздухом и влагой, образуя защитный слой, известный как карбонат цинка, который создает гальванический элемент со сталью.
Когда стальной элемент поцарапан или поврежден, так что подложка обнажается, окружающее цинковое покрытие действует как расходуемый анод и подвергается коррозии преимущественно для защиты незащищенной стали. Этот тип защиты продолжается до тех пор, пока близлежащий цинк не истощится.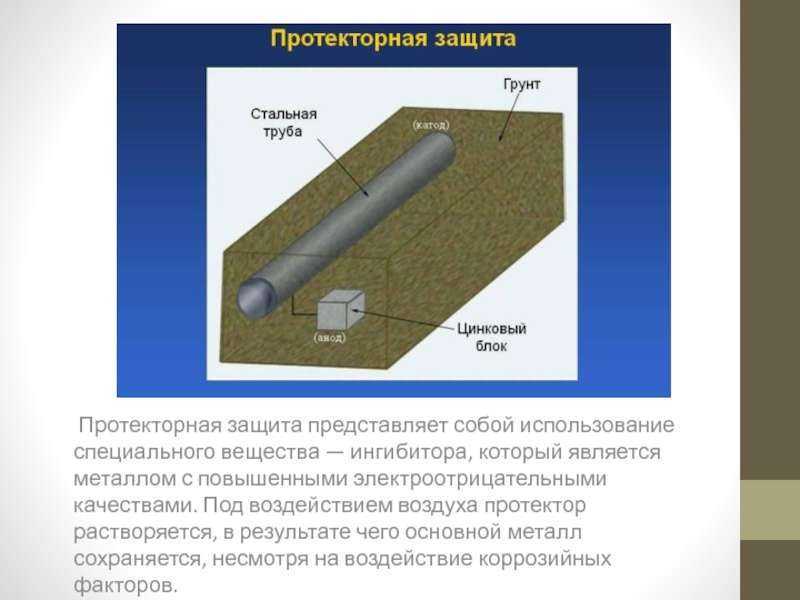
Катодная защита импульсным током (ICCP)
В крупных конструкциях использование методов пассивной катодной защиты может оказаться нецелесообразным. Количество расходуемых анодов, необходимых для подачи достаточного тока для обеспечения адекватной защиты, может быть либо нереалистичным, либо нецелесообразным. Чтобы решить эту проблему, используется внешний источник питания, который помогает управлять электрохимическими реакциями. Этот метод известен как катодная защита подаваемым током (ICCP). Системы ICCP идеально подходят для защиты протяженных сооружений, таких как подземные трубопроводы. Фланцы соединительных труб обычно изолируются с помощью изоляционных комплектов, чтобы разделить трубы на более мелкие и удобные секции в целях защиты ICCP.
Рисунок 3. Схема объекта, защищаемого анодом с использованием методов катодной защиты подаваемым током (ICCP). Обратите внимание, как задействован внешний источник питания постоянного тока.
Ограничения катодной защиты
В крупных трубопроводных сетях может быть много пересечений, параллелизма и подходов вблизи системы КП трубопровода. Между трубопроводами могут возникать помехи постоянного тока, что ускоряет коррозию. Чтобы решить эту проблему, трубопроводы могут быть электрически соединены либо напрямую, либо через сопротивление.
Для трубопроводов с покрытием катодное отслоение может произойти из-за высоких уровней CP, когда качество нанесенного покрытия низкое. Более высокие температуры также могут способствовать катодному отслоению. Окружающая среда с высоким pH также вызывает беспокойство с точки зрения коррозионного растрескивания под напряжением.
Заключение
Катодная защита является популярным методом защиты от коррозии трубопроводов, морских нефтяных платформ и других стальных конструкций. Однако для эффективной реализации крайне важно понимать основные принципы биметаллической/гальванической коррозии. Выбор правильного типа системы катодной защиты зависит от нескольких факторов, включая экономическую эффективность и размер защищаемой конструкции.
Выбор правильного типа системы катодной защиты зависит от нескольких факторов, включая экономическую эффективность и размер защищаемой конструкции.
Реклама
Связанные термины
- Катод
- Анод
- Катодная защита
- Жертвенный анод
- Гальваническая серия
- Импульсная токовая катодная защита
- Катодное отслоение
- Протекторная катодная защита анода
- Гальваническая коррозия
- Потенциал вождения
Поделиться этой статьей
Катодная защита и системы катодной защиты
Последнее обновление: май 2022 г. Продление срока службы объектов и оборудования является первостепенной задачей для операторов. В конце концов, коррозия является основной причиной преждевременного выхода из строя металлических конструкций. Для многих решением является установка систем катодной защиты (CP) и их регулярное тестирование.
Эти системы для многолетней защиты от коррозии используются во многих гражданских и промышленных целях. Установка обычно происходит во время первоначального строительства, крупных расширений или обновлений.
Подробнее о:
- Системы катодной защиты гальваническим и импульсным током
- Типы защищаемых конструкций
- Пример CP для предотвращения коррозии трубопровода наши часто задаваемые вопросы внизу этой страницы.
Перейти к часто задаваемым вопросам по катодной защите
Катодная гальваническая защита
Общие сведения о гальванических анодах
В гальванической системе используются аноды, подключенные к защищаемой конструкции в цепи.
 Естественный потенциал этих анодов более отрицателен, чем потенциал конструкции. При включении в цепь ток катодной защиты течет от анода (более отрицательного) к конструкции (менее отрицательного).
Естественный потенциал этих анодов более отрицателен, чем потенциал конструкции. При включении в цепь ток катодной защиты течет от анода (более отрицательного) к конструкции (менее отрицательного).При правильном применении и с ограничениями гальванические аноды (также называемые протекторными анодами) могут защитить от коррозии подземные стальные, морские, внутренние и промышленные конструкции. Для работы гальванических систем CP не требуется внешний источник питания. Кроме того, эти аноды могут быть как долговечными, так и простыми в эксплуатации.
Доступны гальванические аноды с различными характеристиками, включая:
- Аноды из чистого металла, такие как сплавы магния, цинка, алюминия и других сплавов
- Упаковка для обратной засыпки для подземного использования
- Внешние стальные хомуты для крепления к конструкциям
- Различные типы лент
- Стержни и специальные формы
Катодная защита от импульсного тока
Питание Разница потенциалов: Часто катодная защита от импульсного тока52, потенциал 901 разницы между гальваническим анодом и стальной конструкцией недостаточно для возникновения защиты.
 В этих случаях требуется, чтобы источник питания (выпрямитель) генерировал большую разность потенциалов, чтобы обеспечить протекание большего тока к защищаемой конструкции.
В этих случаях требуется, чтобы источник питания (выпрямитель) генерировал большую разность потенциалов, чтобы обеспечить протекание большего тока к защищаемой конструкции.Эти системы катодной защиты с питанием от подаваемого тока (ICCP) обеспечивают:
- Аноды с более длительным сроком службы
- Системы с большим током
- Улучшенный контроль системы
- Простой мониторинг
- 6 Системы катодной защиты 6 Системы катодной защиты6 MATCORCP которые защищают конструкции в течение 30 лет и более. Эти конструкции включают:
- Наземные резервуары для хранения
- Подземные трубопроводы
- Арматурная сталь в бетонных конструкциях
- Теплообменники
- Морские сваи
- Стены из шпунтовых свай
- Другие металлические конструкции
- Понимать условия окружающей среды
- Оценка конструкции, требующей защиты
- Рассмотрение вариантов конструкции или применения
- Выбор подходящей системы
- Завершение проектирования, включая подробные спецификации и чертежи, с использованием новейшего инженерного программного обеспечения
- Gas pipelines
- Above ground storage tanks
- Marine structures such as docks and piers
- Plant piping
- And more…
- Impressed current linear anodes
- Deep анодные системы
- Резервуарные анодные системы
- Морские и водные анодные системы
- Аноды с грунтовым дном
- Аноды для внутренних зондов
- BRACHODECTHENTERENTIERS
- Ссылка катодной защиты.
 и материалы
и материалы - Услуги по катодной защите
Правильно спроектированные системы CP могут служить десятилетиями.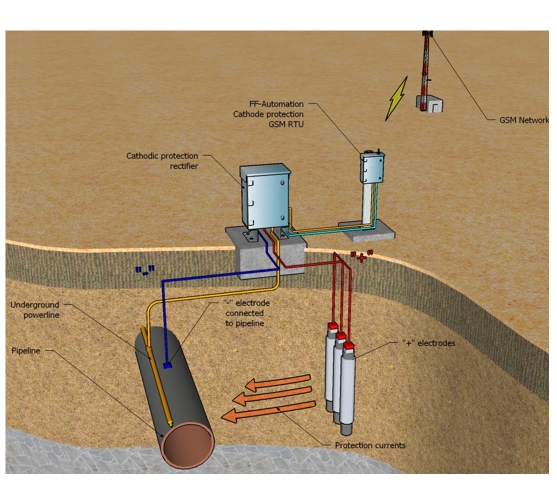 Лучшие инженеры-проектировщики имеют опыт работы со структурами, которые они пытаются защитить. Они также знают этапы проектирования системы. Они:
Лучшие инженеры-проектировщики имеют опыт работы со структурами, которые они пытаются защитить. Они также знают этапы проектирования системы. Они:
Инженеры-проектировщики, обладающие необходимым опытом и знаниями конструкция, требующая защиты от коррозии, должна выполнять все этапы проектирования системы.
Как это работает
Возможные изменения возникают естественным образом на незащищенном трубопроводе. Протекание тока и гальваническая коррозия трубопровода происходит при переходе от незначительного плюса к незначительному минусу. Применение CP, такого как линейный анод MATCOR, который проходит параллельно трубопроводу, заставляет ток сбрасываться с анода на трубопровод, предотвращая коррозию.
Трубопровод без CP
CP применяется к трубопроводу
Часто задаваемые вопросы о катодной защите
Что такое катодная защита?
Катодная защита (CP) представляет собой электрохимический процесс, который замедляет или останавливает коррозионные токи путем приложения постоянного тока к металлу. При правильном применении CP останавливает коррозионную реакцию, защищая целостность металлических конструкций.
Как работает катодная защита?
Катодная защита работает путем помещения анода или анодов (внешних устройств) в электролит для создания цепи. Ток течет от анода через электролит к поверхности конструкции. Коррозия движется к аноду, чтобы остановить дальнейшую коррозию конструкции.
Какие существуют два типа систем катодной защиты?
Два основных типа: гальванические и токовые.
Что такое анод?
Анод является основным компонентом систем катодной защиты. Он функционирует как источник электронов и разряжает постоянный ток. Аноды более негативны по отношению к защищаемой конструкции.
Что такое катод?
Катодно-защищенная конструкция представляет собой катод в системе CP. Это место, где протекает ток после разряда с анода. Катод более положителен по отношению к защищаемой структуре. Когда электроны текут к катоду, он поляризуется или становится более электрически отрицательным.
Что такое электролит?
Электролит для целей катодной защиты представляет собой среду вокруг катода (защищаемая структура), обладающую достаточной электропроводностью, чтобы позволить току течь от анода к катоду. Анод и катод должны находиться в этой среде, чтобы ток катодной защиты протекал от анода к катоду. В некоторых случаях может быть несколько слоев или типов электролита, через которые может протекать ток.
В некоторых случаях может быть несколько слоев или типов электролита, через которые может протекать ток.
Какие конструкции обычно требуют катодной защиты?
Заглубленные или затопленные конструкции требуют или могут получить пользу от надлежащего применения катодной защиты. Примеры активов, обычно защищаемых с использованием CP, включают: стальные нефтепроводы и газопроводы, стальные и ковкие чугунные водопроводные системы, днища резервуаров на надземных резервуарах большого диаметра, стояки пожарных гидрантов из ковкого чугуна и анкеры направляющего троса башни HVAC. Морские прибрежные сооружения, такие как стальные сваи и стенки из шпунта, корабли и другие крупные суда, являются дополнительными примерами активов с катодной защитой. Это некоторые распространенные приложения CP, но есть и множество других.
Что такое поляризация?
Когда ток катодной защиты течет от анода к защищаемой конструкции (катоду в цепи), электрический потенциал конструкции смещается в сторону отрицательного электрического потенциала. Обычно измеряется в мВ. Мы называем это изменением потенциальной поляризации. Поляризация является мерой эффективности тока катодной защиты. Как только поляризация становится достаточной, мы считаем структуру катодно защищенной. Время, необходимое для полной поляризации структуры, может варьироваться. Это зависит от структуры и окружающей среды. В некоторых случаях для полной поляризации структуры могут потребоваться недели.
Обычно измеряется в мВ. Мы называем это изменением потенциальной поляризации. Поляризация является мерой эффективности тока катодной защиты. Как только поляризация становится достаточной, мы считаем структуру катодно защищенной. Время, необходимое для полной поляризации структуры, может варьироваться. Это зависит от структуры и окружающей среды. В некоторых случаях для полной поляризации структуры могут потребоваться недели.
Что такое деполяризация?
Когда ток катодной защиты перестает течь от анода к защищаемой структуре, структура начинает деполяризоваться. Скорость деполяризации может варьироваться в зависимости от структуры и ее окружения.
Когда моя конструкция защищена катодом? Каковы критерии катодной защиты?
В соответствии с международными стандартами NACE существует два основных критерия, которые можно использовать для подтверждения катодной защиты конструкции.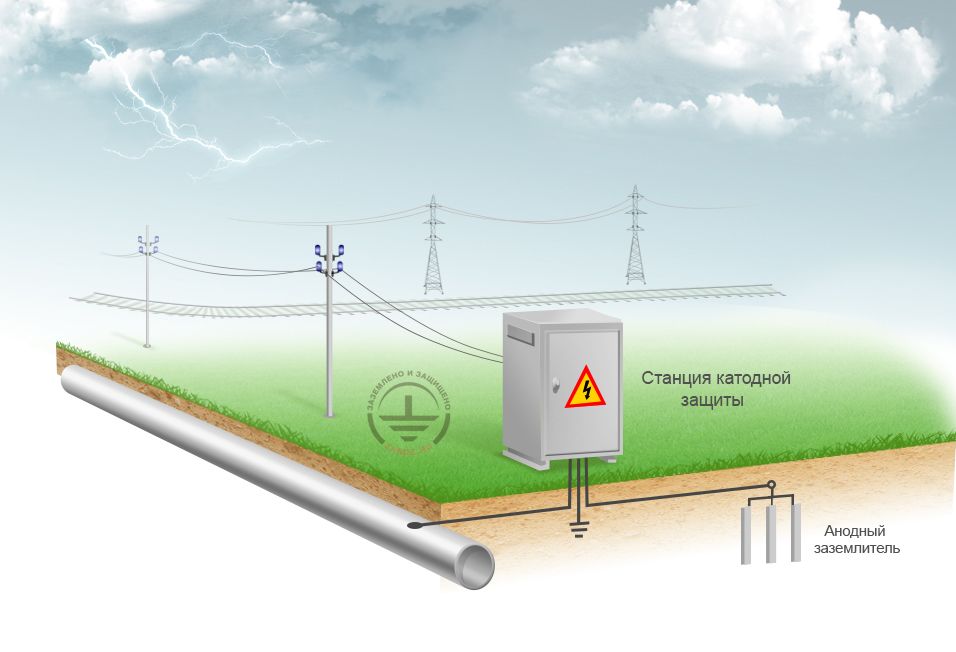 100 мВ поляризации – первый критерий. Этот простой критерий подразумевает, что вы сначала измеряете потенциал конструкции без применения CP (собственный потенциал). Затем, после того как вы применяете катодную защиту на время, достаточное для достижения поляризации, снова измерьте потенциал. Если разность потенциалов больше 100 мВ, конструкция защищена. Это широко известно как критерий сдвига 100 мВ. Другим критерием является критерий отключения потенциала 850 мВ. В этом случае собственный потенциальный базовый уровень не требуется. Этот критерий просто требует, чтобы потенциал конструкции был более отрицательным, чем -850 мВ после учета всех источников тока (выключив их на мгновение).
100 мВ поляризации – первый критерий. Этот простой критерий подразумевает, что вы сначала измеряете потенциал конструкции без применения CP (собственный потенциал). Затем, после того как вы применяете катодную защиту на время, достаточное для достижения поляризации, снова измерьте потенциал. Если разность потенциалов больше 100 мВ, конструкция защищена. Это широко известно как критерий сдвига 100 мВ. Другим критерием является критерий отключения потенциала 850 мВ. В этом случае собственный потенциальный базовый уровень не требуется. Этот критерий просто требует, чтобы потенциал конструкции был более отрицательным, чем -850 мВ после учета всех источников тока (выключив их на мгновение).
Что такое «Мгновенное выключение»?
Мгновенное отключение — это процесс проведения измерений в тот момент, когда вы отключаете питание системы CP с подаваемым током. Когда у вас есть несколько источников тока, вы должны отключить их одновременно с помощью синхронизированных прерывателей. Целью выключения всех источников тока является устранение ИК-падений в цепи. Поскольку ток (I) течет по кабелю, существует сопротивление (R), которое ток должен преодолеть — это известно как падение напряжения, поскольку V = I x R.
Целью выключения всех источников тока является устранение ИК-падений в цепи. Поскольку ток (I) течет по кабелю, существует сопротивление (R), которое ток должен преодолеть — это известно как падение напряжения, поскольку V = I x R.
При попытке измерить уровень поляризации важно устранить ИК-падения в цепи, которые являются результатом протекания тока, создающего эти ИК-падения. При мгновенном отключении тока показания ИК-падения немедленно уменьшаются до нуля, поскольку ток (I) теперь равен нулю. Это означает, что поляризация, которую вы измеряете сразу после отключения тока, является током истинной поляризации. Время имеет решающее значение, потому что при отключении тока структура немедленно деполяризуется. Поляризацион- ный потенциал начнет затухать. Целью мгновенных показаний поляризации при выключении является определение уровня поляризации при выключении питания и до начала процесса деполяризации.
Какие существуют типы анодов?
Аноды можно разделить на два основных типа анодов – гальванические аноды (часто называемые протекторными анодами) и аноды с подаваемым током.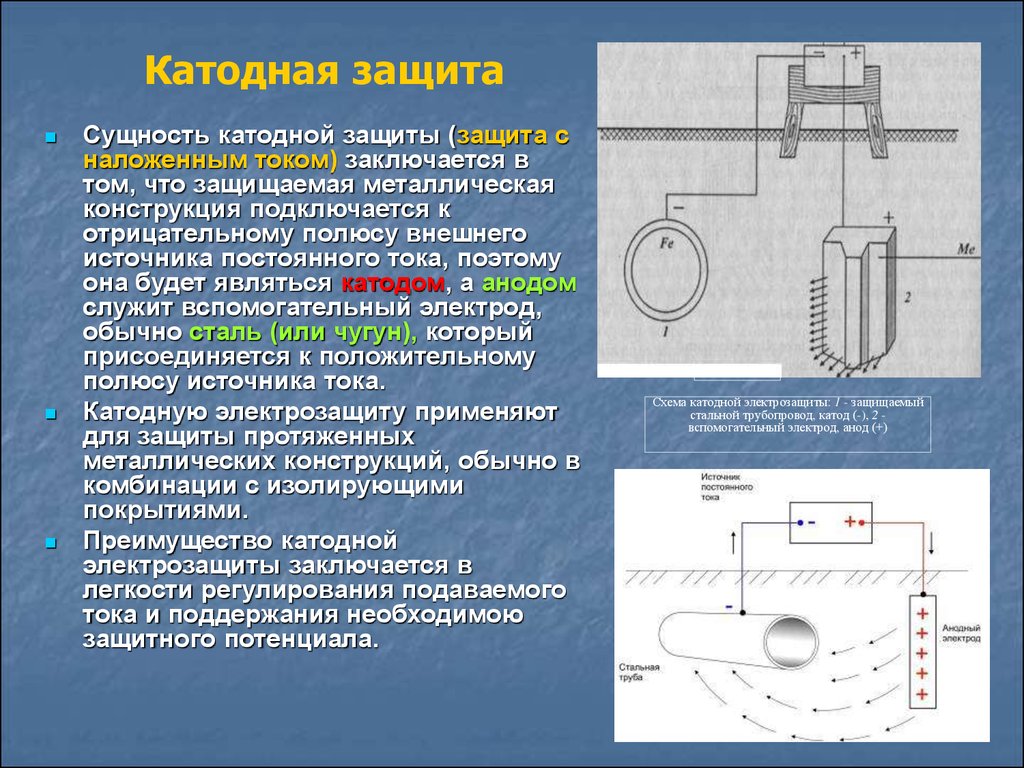 Гальванические аноды используют естественный перепад напряжения между анодом и конструкцией для отвода тока от анода к конструкции. Аноды с током под давлением используют внешний источник питания для отвода тока от анода к конструкции.
Гальванические аноды используют естественный перепад напряжения между анодом и конструкцией для отвода тока от анода к конструкции. Аноды с током под давлением используют внешний источник питания для отвода тока от анода к конструкции.
Что такое гальванический или расходуемый анод?
Гальванические аноды в основном представляют собой металлические отливки, которые не используют внешний источник питания для подачи тока. Они полагаются на естественную разность потенциалов между двумя металлами для управления током катодной защиты. Существует три основных типа гальванических анодов. Магний является наиболее активным типом гальванического анода и используется в основном в почве. Цинковые гальванические аноды менее активны и обычно используются в почвах с низким удельным сопротивлением и солоноватой воде. Цинк также является основным металлом в оцинкованных изделиях. Наконец, в приложениях с морской водой обычно используется третий тип гальванических анодов — алюминий.
ПРИМЕЧАНИЕ. Люди часто называют гальванические аноды жертвенными анодами, потому что они потребляются реакцией СР. Это также верно для многих анодов с подаваемым током. Термин «жертвенный» подразумевает, что источника питания не существует и что используемые аноды более активны, чем защищаемая структура.
Каковы преимущества системы с гальваническим анодом?
Системы с гальваническим анодом обладают двумя основными преимуществами. Во-первых, им не нужен источник питания. И во многих приложениях стоимость обеспечения питания и установки блока питания может быть весьма значительной. Во-вторых, поскольку нет источника питания, они практически не требуют регулярного обслуживания. При правильном применении эти два преимущества делают гальванические анодные системы рентабельными.
Каковы недостатки гальванических анодных систем?
Системы гальванической катодной защиты имеют три существенных ограничения. 1) Ограниченная мощность. Движущая сила между анодом и конструкцией ограничена максимальным значением около 1 В и часто намного меньше движущей силы 1 В. Более крупные конструкции часто требуют большего тока, чем то, что может быть экономически обеспечено гальваническими анодами. 2) Ограниченный срок службы. Гальванические аноды потребляют при относительно больших расходах в пересчете на несколько кг/ампер в год. Это значительно ограничивает срок службы анода в некоторых приложениях. 3) Ограниченный контроль. Гальванические аноды не имеют источника питания, поэтому мы не можем регулировать выходную мощность, изменяя мощность, подаваемую на анод. Системы с гальваническим анодом работают исключительно на основе сопротивления системы, полагаясь на перепад напряжения между анодом и конструкцией.
1) Ограниченная мощность. Движущая сила между анодом и конструкцией ограничена максимальным значением около 1 В и часто намного меньше движущей силы 1 В. Более крупные конструкции часто требуют большего тока, чем то, что может быть экономически обеспечено гальваническими анодами. 2) Ограниченный срок службы. Гальванические аноды потребляют при относительно больших расходах в пересчете на несколько кг/ампер в год. Это значительно ограничивает срок службы анода в некоторых приложениях. 3) Ограниченный контроль. Гальванические аноды не имеют источника питания, поэтому мы не можем регулировать выходную мощность, изменяя мощность, подаваемую на анод. Системы с гальваническим анодом работают исключительно на основе сопротивления системы, полагаясь на перепад напряжения между анодом и конструкцией.
Что такое анод под давлением?
Токовые аноды разряжают ток при питании от внешнего источника постоянного тока. Обычно этот внешний источник представляет собой трансформатор/выпрямитель, который преобразует мощность переменного тока в мощность постоянного тока.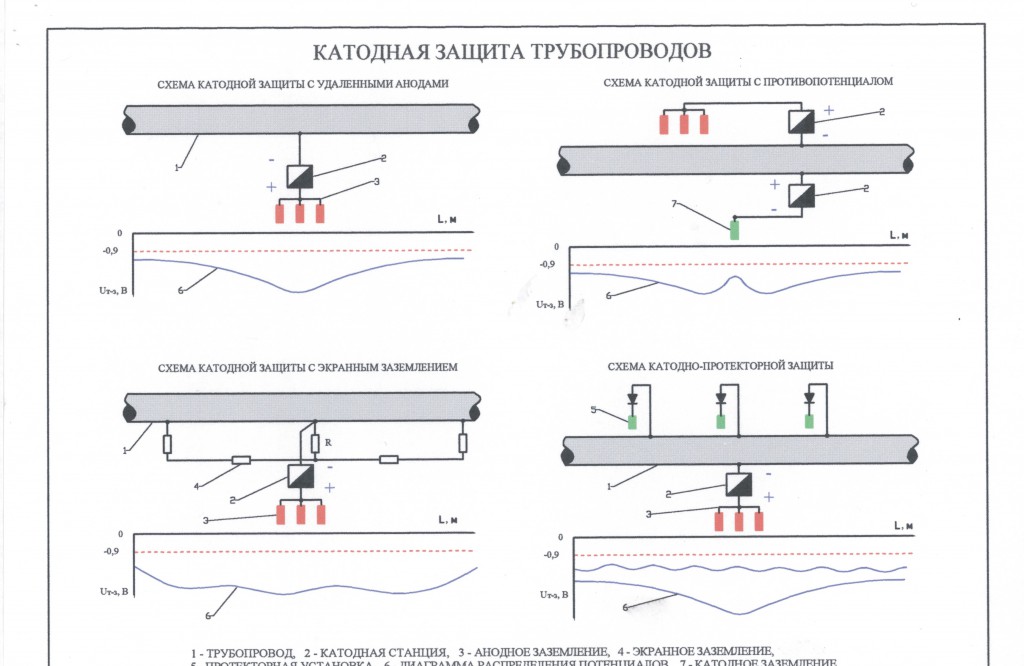 При наличии достаточного количества внешних блоков питания анодные системы с подаваемым током могут отводить ток, достаточный для защиты практически любой конструкции. Это не зависит от размера или состояния покрытия. Нам не нужно выбирать эти аноды на основе их уровня активности. Вместо этого мы можем выбрать их на основе их текущих характеристик разряда — какой ток они могут выдержать. Три наиболее распространенных анода с подаваемым током – это графит, чугун с высоким содержанием кремния и аноды электрокаталитического типа.
При наличии достаточного количества внешних блоков питания анодные системы с подаваемым током могут отводить ток, достаточный для защиты практически любой конструкции. Это не зависит от размера или состояния покрытия. Нам не нужно выбирать эти аноды на основе их уровня активности. Вместо этого мы можем выбрать их на основе их текущих характеристик разряда — какой ток они могут выдержать. Три наиболее распространенных анода с подаваемым током – это графит, чугун с высоким содержанием кремния и аноды электрокаталитического типа.
Каков ожидаемый срок службы анода?
Существует два основных класса анодов. Аноды, которые вступают в электрохимическую реакцию для генерации электрического тока, включают в себя аноды из магния, цинка и алюминия, а также графита и чугуна с высоким содержанием кремния. Эти аноды потребляют с определенной скоростью в зависимости от генерируемого тока. Мы можем определить их скорость потребления в единицах массы, потребляемой в килограммах на каждые столько-то ампер-лет работы.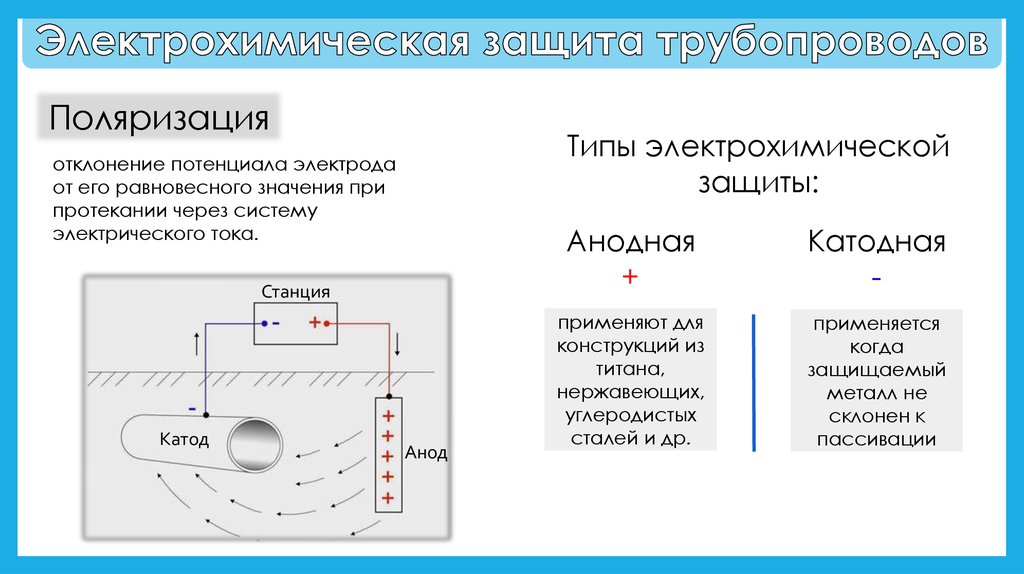 Всегда следует учитывать возможность использования анода. Вы никогда не сможете полностью израсходовать 100% массы анода. В какой-то момент деградация анода влияет на его работоспособность. Таким образом, для этих электрохимически реактивных анодов вполне возможно рассчитать ожидаемый срок службы анода.
Всегда следует учитывать возможность использования анода. Вы никогда не сможете полностью израсходовать 100% массы анода. В какой-то момент деградация анода влияет на его работоспособность. Таким образом, для этих электрохимически реактивных анодов вполне возможно рассчитать ожидаемый срок службы анода.
Второй класс анодов – электрокаталитические. Они не являются реагентами, но способствуют электрохимическим реакциям. Эти аноды каталитического типа изготавливаются либо на основе платины, либо на основе MMO. ММО — это сокращение от смешанного оксида металла. ММО представляет собой покрытие, состоящее из оксидов металлов иридия (или рутения) и других компонентов. Поскольку эти аноды являются каталитическими, они потребляют не так, как электрохимически реактивные аноды. С анодами MMO не происходит заметной потери массы. Это потому, что они не реагируют напрямую с электролитом. Тем не менее, эти каталитические аноды имеют свой собственный определяемый срок службы анода, также основанный на ампер-годах работы.
Что такое анод из смешанных оксидов металлов (MMO)?
ММО представляет собой покрытие, состоящее из смеси оксидов редкоземельных металлов с иридием или рутением в качестве активного катализатора. Иридий подходит для всех сред CP, в то время как аноды на основе рутения подходят только для применений с морской водой. Точная смесь покрытия может варьироваться от производителя к производителю. Главное, чтобы у производителя была проверенная рецептура и мы могли предсказуемо рассчитать его эксплуатационные характеристики. Сюда входит срок службы анода, основанный на программах ускоренных испытаний на срок службы. Производители наносят эти анодные покрытия MMO на подложку из технически чистого титана Grade I или Grade II. Некоторые из распространенных форм анодов MMO включают проволоку, стержни, трубки, полосы, ленточные сетчатые полосы и листы, пластины и диски.
Что такое выпрямитель?
Выпрямитель — это просто источник питания, который преобразует мощность переменного тока в мощность постоянного тока.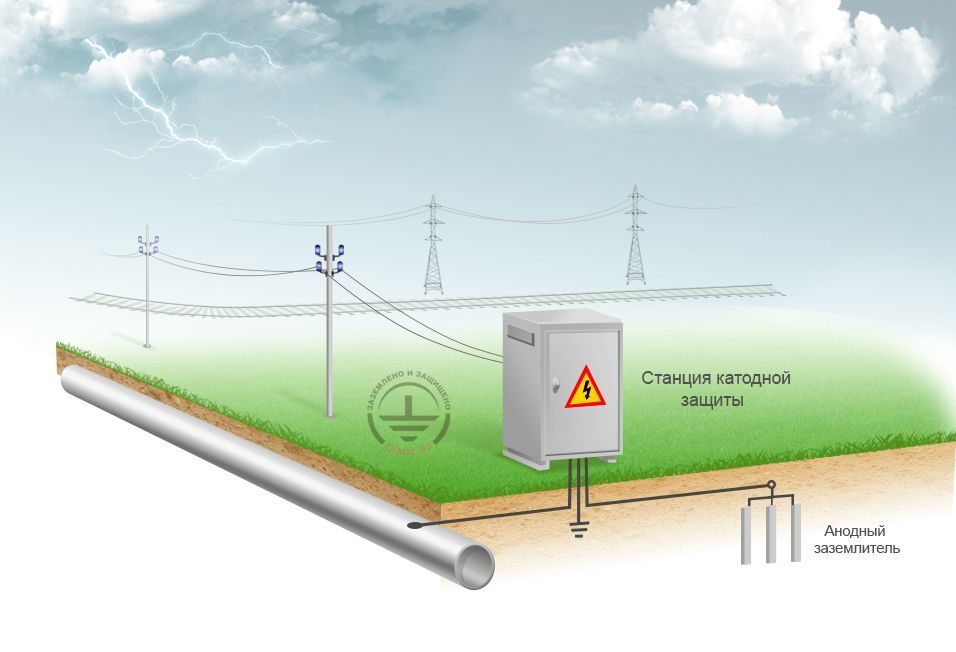 Для большинства систем катодной защиты с импульсным током выпрямитель является неотъемлемым компонентом конструкции системы. Выпрямители доступны в различных типах корпусов в зависимости от окружающей среды и классификации взрывоопасных зон места. Размер выпрямителя основан на максимальной номинальной мощности постоянного тока. Например, 50 В x 50 А означает, что выпрямитель способен выдавать мощность 2500 Вт.
Для большинства систем катодной защиты с импульсным током выпрямитель является неотъемлемым компонентом конструкции системы. Выпрямители доступны в различных типах корпусов в зависимости от окружающей среды и классификации взрывоопасных зон места. Размер выпрямителя основан на максимальной номинальной мощности постоянного тока. Например, 50 В x 50 А означает, что выпрямитель способен выдавать мощность 2500 Вт.
Какова правильная проводка постоянного тока для выпрямителя с катодной защитой?
Очень важно правильно установить полярность на выходе выпрямителя постоянного тока перед подачей питания на выпрямитель или источник питания. Положительный постоянный ток должен всегда подключаться к анодной системе. И отрицательный постоянный ток всегда должен подключаться к выводам конструкции, подключенным к конструкции. Повторюсь, анод всегда должен подключаться к плюсу. Структура к негативу. Если выводы анода и конструкции подключены к противоположной полярности, ток будет отводиться от конструкции к анодной системе.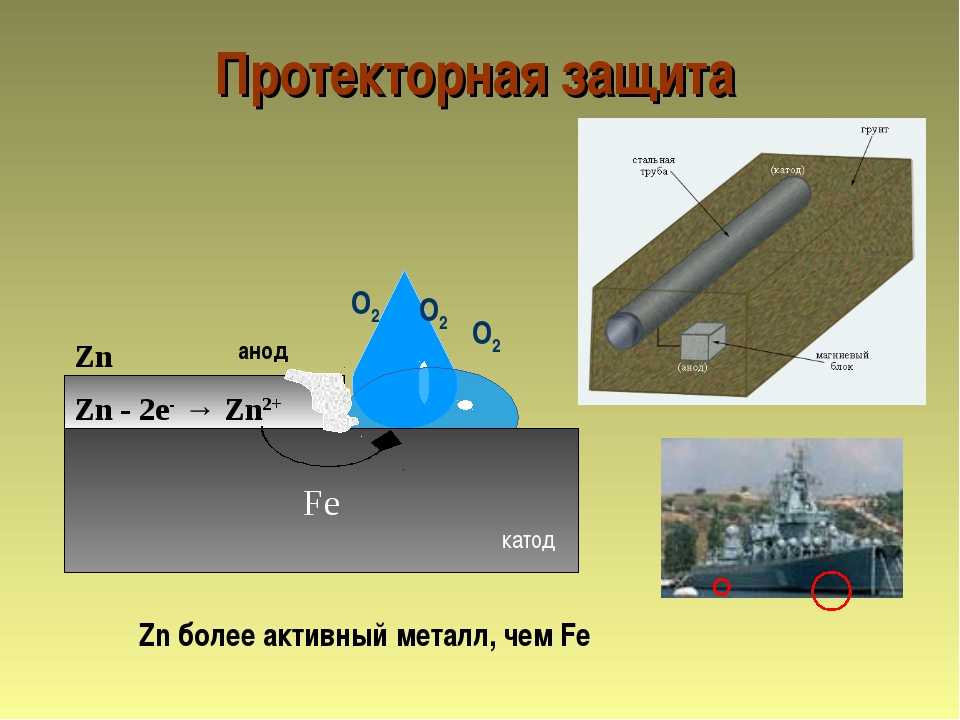 Это может иметь катастрофические последствия, вызывая ускоренную коррозию конструкции. Для стали это будет составлять 20 фунтов/ампер в год.
Это может иметь катастрофические последствия, вызывая ускоренную коррозию конструкции. Для стали это будет составлять 20 фунтов/ампер в год.
Что такое испытательная станция катодной защиты?
Испытательные станции являются еще одним ключевым компонентом конструкции системы катодной защиты. Обычно мы устанавливаем испытательные станции в стратегически важных местах, чтобы обеспечить доступ для тестирования. Испытательная станция — это общее название. Они могут варьироваться от простого провода от трубы или заглубленной конструкции до испытательной станции, которая обеспечивает простое электрическое соединение. Очень сложные испытательные станции могут включать в себя датчики скорости коррозии, купоны переменного и постоянного тока и оборудование для удаленного сбора данных и мониторинга.
Что такое кабель HMWPE? Что такое кабель HMWPE/Kynar или HMWPE/Halar?
В отрасли катодной защиты типичны заглубленные аноды и суровые условия эксплуатации. Для защиты целостности анодной кабельной системы в промышленности используется кабельная система «прямого заглубления». Наиболее распространенным в США является кабель из полиэтилена с высокой молекулярной массой или HMWPE. Эта изоляция кабеля обычно имеет толщину 110 мил и более, она чрезвычайно прочна и ее трудно повредить даже при самом жестком обращении. Для некоторых сред с высоким содержанием хлора обычно используется двойная изоляция с внутренней оболочкой из фторполимера. Наиболее распространенными типами являются PVDV (Kynar) и ECTFE (Halar). Они имеют очень похожие характеристики химической стойкости.
Для защиты целостности анодной кабельной системы в промышленности используется кабельная система «прямого заглубления». Наиболее распространенным в США является кабель из полиэтилена с высокой молекулярной массой или HMWPE. Эта изоляция кабеля обычно имеет толщину 110 мил и более, она чрезвычайно прочна и ее трудно повредить даже при самом жестком обращении. Для некоторых сред с высоким содержанием хлора обычно используется двойная изоляция с внутренней оболочкой из фторполимера. Наиболее распространенными типами являются PVDV (Kynar) и ECTFE (Halar). Они имеют очень похожие характеристики химической стойкости.
Где в системах CP используются кабели HMWPE/Kynar или HMWPE/Halar с двойной изоляцией?
Кабель для прокладки в грунт с двойной изоляцией имеет внутренний слой из химически стойкого фторполимера (кинар или халар). Это обеспечивает дополнительную химическую стойкость в средах с высоким содержанием хлора. Если присутствуют соли, эти соли могут привести к образованию газообразного хлора, который реагирует с водой с образованием соляной кислоты. Это может сильно повредить стандартный кабель. Мы настоятельно рекомендуем дополнительную химическую защиту кабелей с двойной изоляцией в местах с высокой плотностью тока в среде, богатой хлоридами, с минимальной подвижностью газа или электролита. Глубокие слои анодного заземления, засоленные почвы и заболоченные участки могут создать проблемы для стандартного кабеля. Эти приложения требуют более химически инертной изоляции кабеля.
Это может сильно повредить стандартный кабель. Мы настоятельно рекомендуем дополнительную химическую защиту кабелей с двойной изоляцией в местах с высокой плотностью тока в среде, богатой хлоридами, с минимальной подвижностью газа или электролита. Глубокие слои анодного заземления, засоленные почвы и заболоченные участки могут создать проблемы для стандартного кабеля. Эти приложения требуют более химически инертной изоляции кабеля.
Какие проблемы с соединением кабеля с анодом в катодной защите?
Для систем катодной защиты с подаваемым током крайне важно, чтобы не было надрезов, порезов или трещин в кабеле или любых кабельных соединениях/соединениях. Это особенно важно для кабелей анода, подключенных к положительной стороне источника питания. Если какая-либо часть анодной кабельной системы скомпрометирована, а медный проводник имеет обратный электрический путь в окружающую среду, то медь становится непреднамеренным анодом.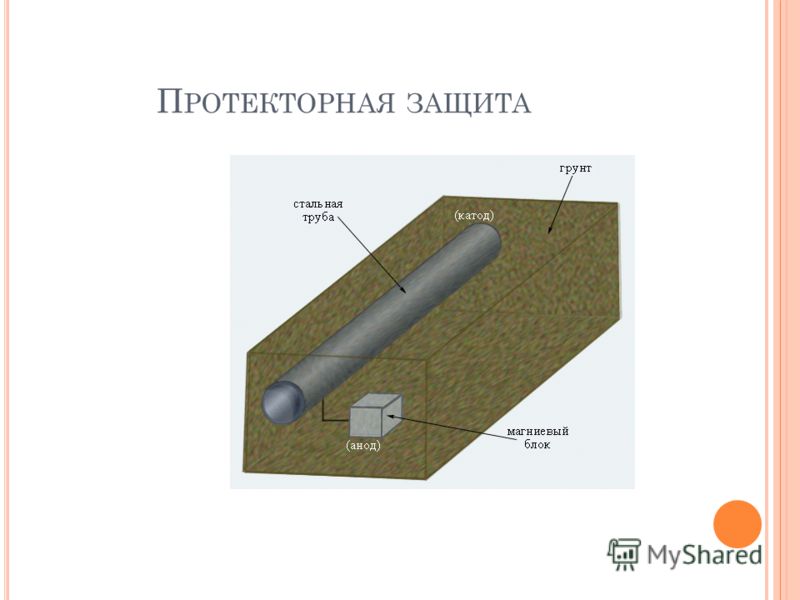 Он начнет очень быстро потреблять, что приведет к обрыву цепи и неработоспособной системе КП. Таким образом, со стороны анода очень важно, чтобы каждый сросток или соединение были полностью водонепроницаемыми и чтобы вся изоляция кабеля была в хорошем состоянии.
Он начнет очень быстро потреблять, что приведет к обрыву цепи и неработоспособной системе КП. Таким образом, со стороны анода очень важно, чтобы каждый сросток или соединение были полностью водонепроницаемыми и чтобы вся изоляция кабеля была в хорошем состоянии.
Что такое RMU? Как системы катодной защиты используют RMU?
RMU — это сокращение от Remote Monitoring Unit. При дистанционном мониторинге катодной защиты RMU обычно используются для контроля и, в большинстве случаев, управления работой выпрямителей в системах катодной защиты с подаваемым током. Мы также применяем RMU на испытательных станциях, критически важных соединениях и в других приложениях для мониторинга. Доступны различные технологии, включая широкополосную, сотовую и спутниковую связь, позволяющие осуществлять мониторинг и управление системой.
Что такое обследование CIS (или CIPS)?
CIS или исследование с малым интервалом, в международном масштабе чаще называемое CIPS (исследование потенциала с близким интервалом), является распространенным средством проверки надлежащих характеристик системы катодной защиты вдоль трубопроводов большой протяженности или внутри станций/сетей трубопроводов.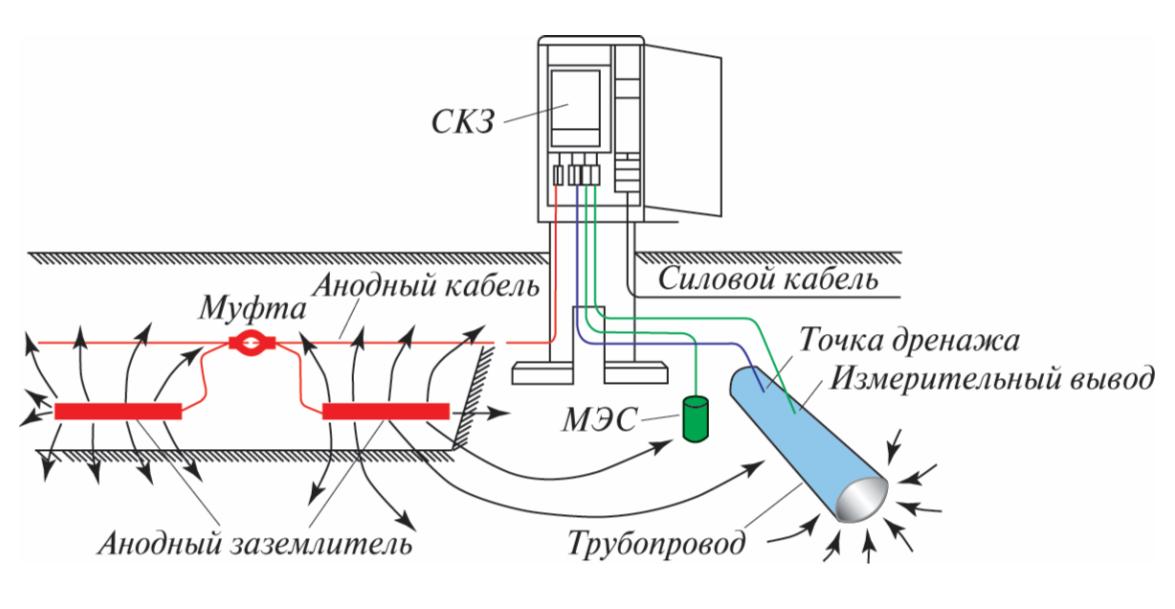 Обследование состоит из снятия возможных показаний, когда бригада проходит по центру подземного трубопровода. Обычно мы считываем эти показания при циклическом включении и выключении всех влияющих источников тока через равные промежутки времени. Таким образом, показания фиксируют потенциал между трубой и электродом сравнения. Мы фиксируем как текущие показания во включенном, так и в выключенном состоянии. Этот процесс повторяется по всей длине трубопровода. Затем мы анализируем данные включения/выключения, чтобы подтвердить, что система CP работает правильно и обеспечивает требуемую поляризацию системы.
Обследование состоит из снятия возможных показаний, когда бригада проходит по центру подземного трубопровода. Обычно мы считываем эти показания при циклическом включении и выключении всех влияющих источников тока через равные промежутки времени. Таким образом, показания фиксируют потенциал между трубой и электродом сравнения. Мы фиксируем как текущие показания во включенном, так и в выключенном состоянии. Этот процесс повторяется по всей длине трубопровода. Затем мы анализируем данные включения/выключения, чтобы подтвердить, что система CP работает правильно и обеспечивает требуемую поляризацию системы.
Что такое «прерыватель»?
Прерыватель — это сложный переключатель, который можно использовать для прерывания работы выпрямителя. Используемые сегодня прерыватели автоматически синхронизируются со спутниковым сигналом, что позволяет многочисленным прерывателям синхронизироваться с одним и тем же временем, чтобы собранные данные об отключении были точными. Многие новые трубопроводные выпрямители оснащены встроенными прерывателями, которые мы можем дистанционно активировать для обследований и тестирования системы CP.
Многие новые трубопроводные выпрямители оснащены встроенными прерывателями, которые мы можем дистанционно активировать для обследований и тестирования системы CP.
Что такое система с глубоким анодом?
Иногда называемая глубоким анодным колодцем или глубоким анодным заземлителем, система глубокого анода часто является эффективным средством подачи большого количества тока в землю из одного места с очень небольшой площадью поверхности. Мы используем обычное буровое оборудование для бурения скважин глубиной примерно 200-400 футов. Затем мы опускаем один или несколько анодов в отверстие перед засыпкой отверстия. Мы располагаем аноды достаточно далеко от поверхности, чтобы иметь возможность считать их электрически удаленными от конструкции. В результате мы можем проецировать ток в перегруженную подземную среду или распределять ток на мили в каждом направлении для изолированных трубопроводов.
Что такое газовая блокировка анода?
Электрохимическая реакция катодной защиты приводит к образованию газа как части реакционного процесса.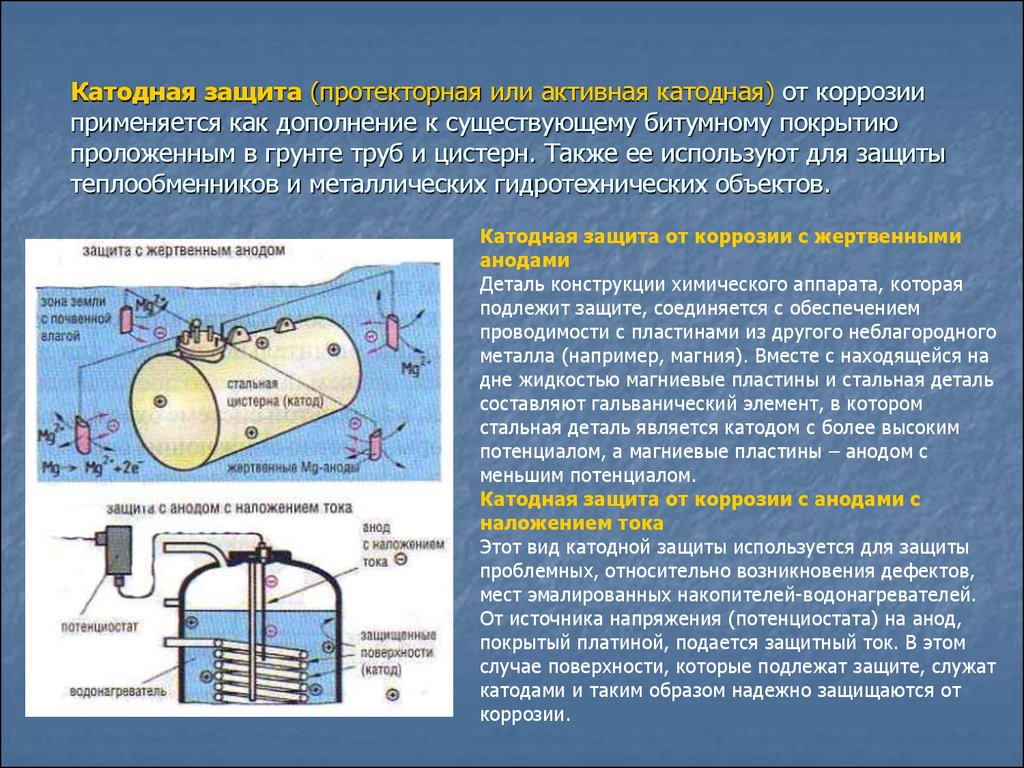 Это также высвобождает электроны, позволяя току распределяться по электролиту. В большинстве сред этот газ может куда-то диффундировать или выделяться. Однако в тех редких случаях, когда образовавшийся газ не может мигрировать от поверхности анода, газ может фактически блокировать поток электронов и подавлять реакцию катодной защиты. Это чаще встречается в системах с глубокими анодами, где отверстие пробуривается с поверхности вниз в землю, а окружающая среда вокруг отверстия может быть не очень проницаемой, что улавливает газы. В большинстве систем с глубоким анодом используется вентиляционная труба, позволяющая газам выходить, чтобы предотвратить блокировку газа.
Это также высвобождает электроны, позволяя току распределяться по электролиту. В большинстве сред этот газ может куда-то диффундировать или выделяться. Однако в тех редких случаях, когда образовавшийся газ не может мигрировать от поверхности анода, газ может фактически блокировать поток электронов и подавлять реакцию катодной защиты. Это чаще встречается в системах с глубокими анодами, где отверстие пробуривается с поверхности вниз в землю, а окружающая среда вокруг отверстия может быть не очень проницаемой, что улавливает газы. В большинстве систем с глубоким анодом используется вентиляционная труба, позволяющая газам выходить, чтобы предотвратить блокировку газа.
Что такое вентиляционная труба?
Вентиляционные трубы представляют собой трубы малого диаметра с просверленными отверстиями или прорезями, которые позволяют газам отводиться от анода во время процесса катодной защиты. Это уменьшает скопление газов вокруг анода или концентрацию соляной кислоты с низким pH, которая может образовываться, когда имеется избыток газообразного хлора, который не удаляется. Эта среда с низким pH может повредить изоляцию кабеля из высокомолекулярного полиэтилена и привести к преждевременному выходу кабеля из строя.
Эта среда с низким pH может повредить изоляцию кабеля из высокомолекулярного полиэтилена и привести к преждевременному выходу кабеля из строя.
Какова роль материала коксовой засыпки?
Почти все заглубленные аноды имеют ту или иную форму обратной засыпки. Он либо встроен в корпус анода, либо поставляется снаружи для установки. Впрессованные токовые аноды обычно используют коксовую засыпку. Основная роль коксовой засыпки заключается в обеспечении однородной среды с низким сопротивлением, в которую анод может легко отводить ток. Это помогает уменьшить любые проблемы с плохим контактом заземления заглубленного анода. Кроме того, это увеличивает эффективный размер анода, уменьшая засыпку анода до сопротивления земли.
Расходуется ли также закладка кокса, и если да, то сколько?
Углерод сам по себе может действовать как анод под давлением. Когда в коксовой засыпке установлен еще один анод с подаваемым током, часть коксовой засыпки будет действовать как продолжение анода с подведенным током. В той мере, в какой потребляется углерод, вероятно, снижается потребление подаваемого тока на аноде. Насколько быстро расходуется коксовая засыпка и какое положительное влияние это оказывает на фактический срок службы анода, во многом зависит от конкретной площадки. Переменные параметры включают качество коксовой колонны, уплотнение частиц кокса, уровень влажности и форму частиц.
В той мере, в какой потребляется углерод, вероятно, снижается потребление подаваемого тока на аноде. Насколько быстро расходуется коксовая засыпка и какое положительное влияние это оказывает на фактический срок службы анода, во многом зависит от конкретной площадки. Переменные параметры включают качество коксовой колонны, уплотнение частиц кокса, уровень влажности и форму частиц.
Для электронов существует два режима проводимости. При электронной проводимости электроны текут от анода через кокс. Как продолжение фактического анода, электрохимическая анодная реакция происходит от углерода к окружающей среде. В результате углерод является реагентом. Ионный перенос имеет место, когда ток генерируется на аноде, а затем течет по пути прохождения влаги по внешней стороне частиц кокса. При этом углерод не используется в качестве основного реагента, и поэтому потребление не происходит. Суть в следующем: трудно знать, как будет работать отдельная установка или с какой скоростью будет расходоваться засыпка.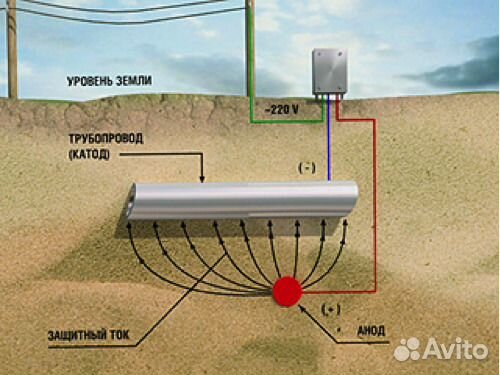
Где я могу узнать больше о катодной защите?
Конечно, вы всегда можете связаться с MATCOR, однако темы ScienceDirect включают множество книг и рецензируемых журналов по теме ДЦП.
Есть вопрос, на который здесь нет ответа?
Мы ответим на ваш вопрос по электронной почте и опубликуем его здесь.
Системы катодной защиты и услуги
MATCOR предлагает ряд решений для защиты объектов инфраструктуры, включая:
MATCOR cathodic protection systems include:
Чтобы связаться с нашей командой экспертов по катодной защите для получения дополнительной информации, задать вопрос или получить предложение, нажмите ниже. Мы ответим по телефону или электронной почте в течение 24 часов. Для немедленной помощи, пожалуйста, позвоните по телефону +1-215-348-2974.
Связаться со специалистом по коррозии
Морская катодная защита 101: Что это такое и как это работает
Ричард Бакстер и Джим Бриттон
Как сталь подвергается коррозии в воде?
Чтобы понять катодную защиту, вы должны сначала понять, как возникает коррозия. Для возникновения коррозии должны присутствовать три вещи:
1. Два разнородных металла
2. Электролит (вода с любым типом соли или растворенных в ней солей)
3. Металлическая (проводящая) дорожка между разнородными металлами
Два разнородных металла могут быть совершенно разными сплавами, такими как сталь и алюминий, но, скорее всего, это микроскопические или макроскопические металлургические различия на поверхности одного куска стали. В этом случае будем рассматривать свободнокорродирующую сталь, которая неоднородна.
В этом случае будем рассматривать свободнокорродирующую сталь, которая неоднородна.
При наличии вышеуказанных условий в более активных центрах происходит следующая реакция: (два иона железа плюс четыре свободных электрона).
2Fe => 2Fe ++ + 4e –
Свободные электроны проходят через металл к менее активным местам, где происходит следующая реакция: (газообразный кислород превращается в ион кислорода – путем соединения с четырьмя свободными электронами – который соединяется с водой с образованием гидроксильных ионов) .
O 2 + 4e – + 2H 2 0 => 4 OH –
Рекомбинация этих ионов на активной поверхности приводит к следующей реакции, которая дает продукт коррозии железа (гидроксид железа): железо соединяется с кислородом и водой с образованием гидроксида железа).
2Fe + O 2 + 2H 2 O => 2Fe (OH) 2
Эта реакция чаще описывается как «ток тока через воду от анода (более активного участка) к катоду ( менее активный сайт).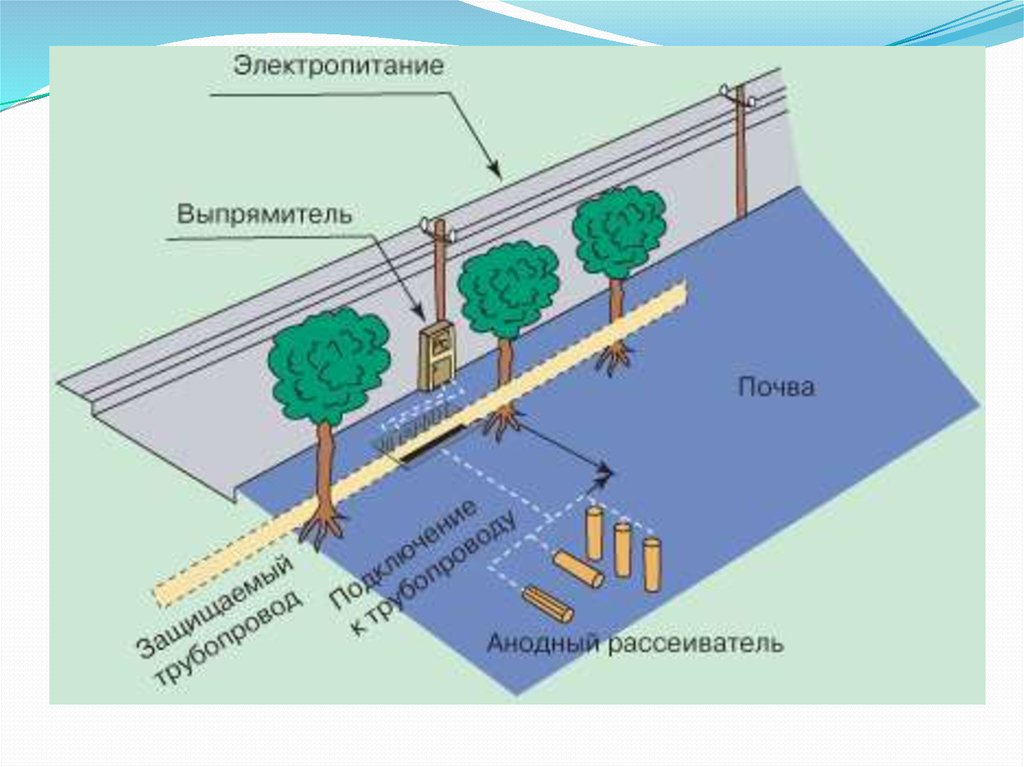
Как катодная защита останавливает коррозию?
Катодная защита предотвращает коррозию путем преобразования всех анодных (активных) участков на поверхности металла в катодные (пассивные) участки за счет подачи электрического тока (или свободных электронов) из альтернативного источника.
Обычно это гальванические аноды, которые более активны, чем сталь. Эту практику также называют жертвенной системой, поскольку гальванические аноды жертвуют собой, чтобы защитить конструкционную сталь или трубопровод от коррозии.
В случае алюминиевых анодов реакция на поверхности алюминия: (четыре иона алюминия плюс двенадцать свободных электронов)
4Al => 4AL +++ + 12 e –
и на поверхности стали : (газообразный кислород превращается в ионы кислорода, которые соединяются с водой с образованием ионов гидроксила).
3O 2 + 12e – + 6H 2 0 => 12OH –
Пока ток (свободные электроны) поступает к катоду (стали) быстрее, чем поступает кислород, коррозия невозможна. происходить.
происходить.
Рис. 1: Система расходуемых анодов в морской воде
Основные соображения при проектировании систем расходуемых анодов
Электрический ток, который проходит через анод, регулируется законом Ома, а именно:
I=E/R
I= Ток в амперах
E= Разность потенциалов между анодом и катодом в вольтах
R= Общее сопротивление цепи в Омах но по мере уменьшения разности потенциалов из-за влияния тока, протекающего на катод, ток постепенно уменьшается из-за поляризации катода. Сопротивление цепи включает в себя как водную дорожку, так и металлическую дорожку, которая включает в себя любой кабель в цепи. Доминирующей величиной здесь является сопротивление анода морской воде.
Для большинства применений сопротивление металла настолько мало по сравнению с сопротивлением воде, что им можно пренебречь (хотя это неверно для салазок или длинных трубопроводов, защищенных с обоих концов). Как правило, длинные тонкие аноды имеют меньшее сопротивление, чем короткие толстые аноды. Они будут разряжать больше тока, но не так долго.
Они будут разряжать больше тока, но не так долго.
Таким образом, разработчик катодной защиты должен выбрать размер анодов таким образом, чтобы они имели правильную форму и площадь поверхности для отвода тока, достаточного для защиты конструкции, и достаточный вес для обеспечения желаемого срока службы при отводе этого тока.
Общее практическое правило:
Длина анода определяет, какой ток может производить анод, и, следовательно, сколько квадратных футов стали можно защитить. Поперечное сечение (вес) определяет, как долго анод может поддерживать этот уровень защиты.
Системы катодной защиты с импульсным током (анодные системы ICCP)
Из-за больших токов, характерных для многих систем морской воды, нередко используются системы с импульсным током, в которых используются аноды типа (аноды ICCP), которые нелегко растворяются в ионы металлов. Это вызывает альтернативную реакцию: окисление растворенных ионов хлора.
2Cl – => Cl 2 + 2e –
Питание подается от внешнего блока питания постоянного тока.