Электрохимическую коррозию металла вызывает: Коррозия металлов. Виды коррозийных разрушений. Методы защиты металлов от коррозии
alexxlab | 01.02.2023 | 0 | Разное
Металл / Сведения о корозии металлов
Для правильного определения причин разрушения металла, из которого сделан предмет, приостановления и предотвращения этого процесса необходимо знать некоторые основы теории коррозии и защиты металлов. Умение различить виды коррозии необходимо как реставратору для правильной оценки состояния металла при составлении точного описания в реставрационном паспорте и выбора наиболее подходящего метода реставрации, так и хранителю для определения начавшихся изменений и опасности этих изменений для сохранности предметов.
По механизму разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия происходит при контакте металла с сухими газами или воздухом, в жидкостях-не-электролитах, т.е. не проводящих электрический ток. К этому виду коррозии относится, в частности, окисление металлов – образование на поверхности тонкой пленки оксидов, приводящей к пассивности. Электрохимическая коррозия возникает при налачии физико-химической неоднородности поверхности металла или среды в присутствии жидкости, проводящей ток, – электролита. Так как на поверхности металла практически всегда находится пленка влаги, часто тончайшая, практически невидимая, содержащая растворенные соли, которые попадают в нее из атмосферы, с пылью, из почвы, т.е. проводящая ток, а поверхность металла не бывает однородной, то металлические предметы разрушаются вследствие электрохимической коррозии.
Так как на поверхности металла практически всегда находится пленка влаги, часто тончайшая, практически невидимая, содержащая растворенные соли, которые попадают в нее из атмосферы, с пылью, из почвы, т.е. проводящая ток, а поверхность металла не бывает однородной, то металлические предметы разрушаются вследствие электрохимической коррозии.
При электрохимической коррозии металлов происходит два основных процесса:
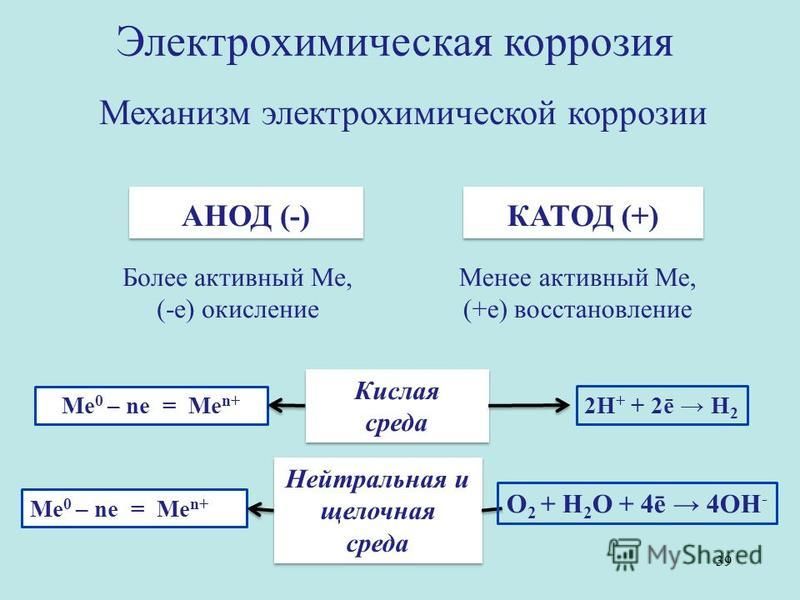
1) анодный процесс – переход металла в раствор в виде гидратированных ионов или его окисление; при этом в металле остается соответствующее число электронов;
2) катодный процесс – поглощение появившихся в металле избыточных электронов деполяризаторами, которыми могут быть атомы, молекулы или ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных его участках.
Рис. 1. Схема электрохимического коррозионного процесса
Переход ионов металла в раствор (разрушение)
Пример анодной реакции:
Fe —> Fе2+ + 2е окисление железа
В общем виде: Me — Меn+ + nе.
Примеры катодных реакций: 2Н+ + 2е –> 2H —> Н2 – восстановление ионов водорода в кислой среде;
2H+ + 2Н20 + 4е —> 4ОН- – восстановление растворенного кислорода в нейтральной или щелочной среде.
Таким образом разрушаются анодные участки поверхности. Теоретически для анодной реакции должно было бы наступить равновесие а следовательно, и прекращение разрушения. Практически это равновесие не достигается в силу того, что в ходе коррозии химический состав раствора вблизи металлической поверхности меняется в результате вторичных реакций, например, образования гидроокисей металлов, удаления ионов от поверхности, выделения газов.
Идеальное равновесие и прекращение растворения могли бы быть достигнуты только в случае полной химической и физической однородности как металла, так и электролита, и в случае невозможности побочных реакций ионов металла. Так как такая идеальная однородность недостижима, то практически процесс растворения или коррозия может продолжаться, хотя и очень медленно, до полного разрушения металла.
Таким образом, процесс электрохимической коррозии очень приближенно можно уподобить процессу, происходящему в простом гальваническом элементе. Электродвижущая сила гальванического элемента зависит от активности, проявляемой в реакциях вытеснения металлов друг другом из растворов их солей.
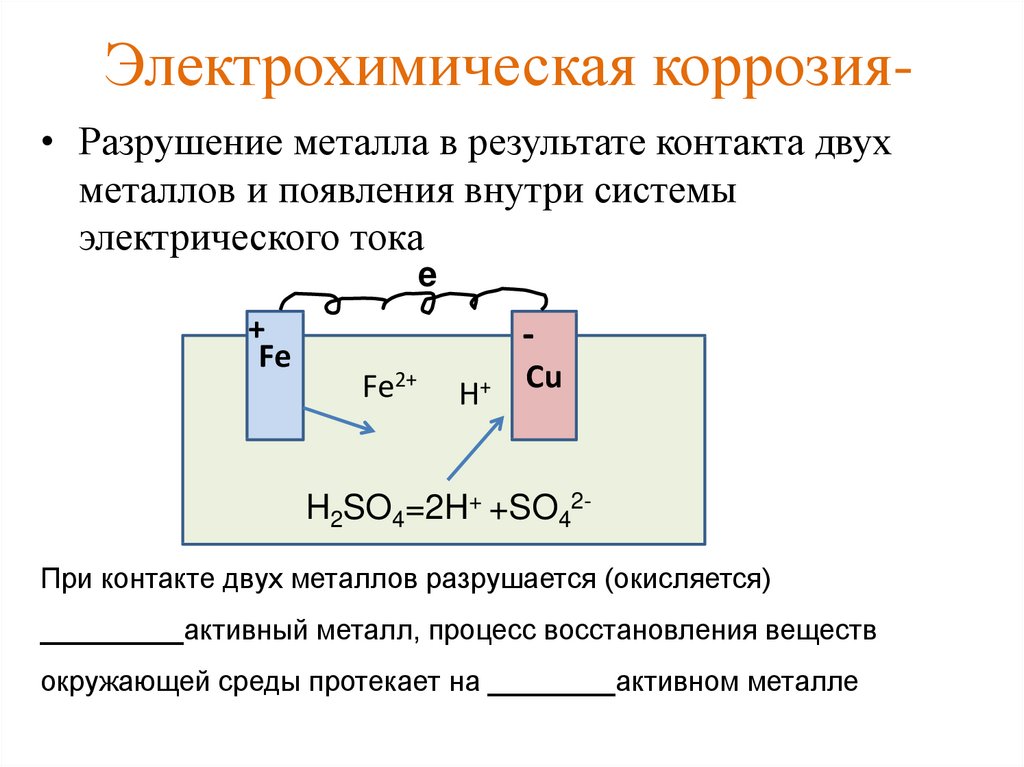
В зависимости от этой активности металлы располагаются в следующий электрохимический ряд напряжений: Li, К, Са, Nа, Mg, Be, Al, Ti, Zr, Mn, Nb, Zn, Cr, Fe, Cd, Co, Ni, Mo, Sn, Рb, Н, Cu, Hg, Pd, Ag, Pt, Аu. Каждый левее стоящий в ряду металл может вытеснять все следующие за ним металлы из растворов их солей, настоящее время не существует способов экспериментального измерения абсолютного значения потенциала металла, поэтому его значение в справочниках приводится относительно, например, водородного электрода сравнения. При контакте разнородных металлов, а такие случаи, в практике достаточно часты, например инкрустация железа медью, серебром или золотом, серебряное покрытие на медном сплаве и др. возникает особый вид электрохимической коррозии – контактная коррозия.
возникает особый вид электрохимической коррозии – контактная коррозия.
По величинам потенциалов двух металлов в данном электролите можно указать, какой из них будет замедлять коррозию другого, а какой ускорять: металл, имеющий более положительный. потенциал, т.е. стоящий правее в ряду напряжений, ускоряет катодный процесс и способствует коррозии металла, с которым находится в паре. В реальных условиях металлы могут покрываться оксидными пленками, что меняет их электрохимическое состояние, и опытные данные могут противоречить теоретическим предсказаниям. При контакте металлов коррозия наиболее интенсивно происходит вблизи места соединения двух разнородных металлов. Контактом разных металлов объясняется быстрое химическое разрушение спаянных изделий именно по месту спайки. Кроме того, на скорость коррозии анодного металла в контактной паре оказывает влияние соотношения анодных и катодных площадей. Например, в случае соединения медных листов стальными заклепками последние за короткое время подвергаются ному разрушению. При обратной картине, когда стальные листы соединены медными заклепками, наблюдается незначительный рост коррозии вблизи медных заклепок. Известно покрытие железа цинком и оловом. Исходя из электрохимического ряда напряжений цинк должен защищать железо, тогда как олово – усиливать коррозию. Оловянное покрытие чисто механически защищает железо и достаточно в одном месте нарушить цельность олова, как , железо начинает разрушаться. Иначе обстоит дело с цинковым покрытием: до тех пор, пока не растворится весь цинк, железе не корродирует. Предотвращают контактную коррозию подбором соответствующих материалов с малой разностью потенциалов, электрической изоляцией различных металлов друг от друга и др. Скорость электрохимической коррозии зависит от внутренних.и внешних факторов. К внутренним относятся факторы, связанные с природой металла, его химическим составом, структурой, наличием неметаллических включений. Очень чистые металлы медленно разрушаются. Инородные включения заметно понижают стойкость металлов, двухфазные сплавы корродируют гораздо быстрее, чем однофазные.
При обратной картине, когда стальные листы соединены медными заклепками, наблюдается незначительный рост коррозии вблизи медных заклепок. Известно покрытие железа цинком и оловом. Исходя из электрохимического ряда напряжений цинк должен защищать железо, тогда как олово – усиливать коррозию. Оловянное покрытие чисто механически защищает железо и достаточно в одном месте нарушить цельность олова, как , железо начинает разрушаться. Иначе обстоит дело с цинковым покрытием: до тех пор, пока не растворится весь цинк, железе не корродирует. Предотвращают контактную коррозию подбором соответствующих материалов с малой разностью потенциалов, электрической изоляцией различных металлов друг от друга и др. Скорость электрохимической коррозии зависит от внутренних.и внешних факторов. К внутренним относятся факторы, связанные с природой металла, его химическим составом, структурой, наличием неметаллических включений. Очень чистые металлы медленно разрушаются. Инородные включения заметно понижают стойкость металлов, двухфазные сплавы корродируют гораздо быстрее, чем однофазные. Коррозия быстрее развивается по напряжённым местам металлических изделий, чем по ненапряженным – более деформированные участки становятся анодами и подвергаются большему разрушению; литой металл разрушается меньше кованого. Тонкая обработка поверхности (шлифовка, полировка), как правило, повышает коррозионную стойкость металлов, облегчая образование на поверхности защитных пленок. К внешним факторам относятся природа и свойства коррозионной среды и ее параметры.. На скорость электрохимической коррозии влияет концентрация водородных ионов в растворе электролита (т.н. рH среды). Для каждого металла имеется определённое значение рН раствора, при котором скорость коррозии минимальна. Известно, например, что железо пассивно в молочной среде. Значительное влияние оказывает температура, так как она меняет скорость диффузии и растворимость продуктов коррозии. В зависимости от внешних условий различают атмосферную коррозию и почвенную.
Коррозия быстрее развивается по напряжённым местам металлических изделий, чем по ненапряженным – более деформированные участки становятся анодами и подвергаются большему разрушению; литой металл разрушается меньше кованого. Тонкая обработка поверхности (шлифовка, полировка), как правило, повышает коррозионную стойкость металлов, облегчая образование на поверхности защитных пленок. К внешним факторам относятся природа и свойства коррозионной среды и ее параметры.. На скорость электрохимической коррозии влияет концентрация водородных ионов в растворе электролита (т.н. рH среды). Для каждого металла имеется определённое значение рН раствора, при котором скорость коррозии минимальна. Известно, например, что железо пассивно в молочной среде. Значительное влияние оказывает температура, так как она меняет скорость диффузии и растворимость продуктов коррозии. В зависимости от внешних условий различают атмосферную коррозию и почвенную.
Атмосферной коррозии подвергаются памятники на открытом воздухе, в условиях музейного хранения и экспозиции. Атмосферная коррозия разделяется на три типа, хотя это деление условно, так как в реальных условиях возможен переход одного типа коррозии в другой:
Атмосферная коррозия разделяется на три типа, хотя это деление условно, так как в реальных условиях возможен переход одного типа коррозии в другой:
1) “Сухая” коррозия протекает при полном отсутствии следов влаги на поверхности металла. Большинство металлов при взаимодействии с кислородом воздуха или другими окислителями в сухой атмосфере покрываются пленкой оксида. По своему механизму этот процесс является чисто химическим и не приводит к сколько-нибудь существенным разрушениям металла. Толщина плёнок меняется в широких пределах:
а) тонкие (невидимые), толщина которых от нескольких до 400 А;
б) средние (дающие цвета побежалости), толщина которых от 400 до 5000 А;
в) толстые (видимые), толщина которых свыше 5000 А.
В образующихся на металлах пленках при их утолщении могут возникать внутренние напряжения, которые вызывают механическое разрушение пленок с потерей защитных свойств, так как защитными свойствами обладают только сплошные пленки. В двухкомпонентном сплаве окисление начинается с образования оксида – менее благородного компонента сплава, т. е. менее термодинамически устойчивого (например, в низкопробном серебре окисляется медная составляющая сплава).
е. менее термодинамически устойчивого (например, в низкопробном серебре окисляется медная составляющая сплава).
2) “Влажная” атмосферная коррозия – коррозия при наличии на поверхности металла тончайшей, невидимой пленки влаги, которая образуется в результате конденсации при относительной влажности воздуха ниже 100%. С понятием относительной влажности часто приходится сталкиваться на практике, поэтому напомним, что относительной влажностью называется отношение фактического содержания водяных паров в воздухе к максимально возможному в данных условиях. Средняя относительная влажность в городах составляет 70-80% в отдельные летние месяцы -60-65%. Влажность на этом же уровне держится в музейных залах и запасниках. При таком значении имеются все условия для увлажнения металлической поверхности. Конденсации способствуют перепады температуры. Например, при температуре +25°С и влажности 50% конденсат образуется при охлаждении металла до +14°С если влажность воздуха 90%, то конденсат образуется при перепаде температур в 1°С, т. е. уже при +24°С. Влажность, при которой резко возрастает скорость коррозии называется критической. Критическое значение относительной влажности равно примерно 70%, но при некоторых условиях значительно ниже.
е. уже при +24°С. Влажность, при которой резко возрастает скорость коррозии называется критической. Критическое значение относительной влажности равно примерно 70%, но при некоторых условиях значительно ниже.
Величина критической влажности меняется в зависимости от состояния поверхности металла и состава атмосферы. Так при наличии в атмосфере сернистого газа или других активных реагентов она может снизиться до 50%.
3) “Мокрая” атмосферная коррозия – коррозия при наличии на поверхности металла видимой пленки влаги. Атмосферная коррозия этого типа наблюдается при относительной влажности воздуха около 100%, когда имеется капельная конденсация влаги на поверхности металла, а также при непосредственном попадании влаги на металл, например, во время дождя. Конденсация влаги настолько вредный процесс, что металлы, находящиеся под навесом, могут корродировать интенсивнее, чем условиях открытой экспозиции, где дождь быстро смывает кислоты, образовавшиеся на поверхности при конденсации, т. к. влага, конденсирующаяся на поверхности металла вечером при понижении температуры, обладает часто большей кислотностью, чем дождевая вода.
к. влага, конденсирующаяся на поверхности металла вечером при понижении температуры, обладает часто большей кислотностью, чем дождевая вода.
Наиболее агрессивными примесями воздуха являются сернистый газ, хлористый натрий, сероводород, аммиак, пары соляной кислоты. Ускорение коррозии наблюдается при концентрации сернистого газа порядка IO-4 – 10-5 объемн.%. Сернистый газ попадает в атмосферу вместе с продуктами сжигания сернистого топлива, хлористый натрий – за счет соли, уносимой ветром с поверхности океанов и морей. Концентрация хлористого натрия в воздухе меняется в широких пределах и сильно зависит от удаленности от моря. В приморских районах повышенная скорость коррозии объясняется высокой влажностью и наличием в воздухе частичек хлористого натрия. Например, содержание хлор-иона в дожде, снеге, тумане Одессы достигает 440 мг/л. При попадании на поверхность железа хлористого натрия критическое значение относительной влажности задает до 58%.
Влияние углекислого газа неоднозначно. В некоторых случаях его присутствие даже тормозит коррозию. Сильно ускоряет коррозию газообразный хлор. Причем, характерно, что в присутствии этого газа коррозия возрастает и в относительно сухих атмосферах (влажность менее 42%). Сероводород при повышенной влажности также является весьма сильным реагентом. Кроме газов и паров кислот, на процесс коррозии большое влияние оказывают твердые частицы, осаждающиеся на поверхности металла из воздуха. Одни из них (коррозионно-активные) оказывают прямое воздействие на металл, другие, хотя и не отличаются коррозионно-активными свойствами, например, частички угля, приводят к ускорению коррозии благодаря тому, что они способствуют адсорбции на поверхности металла сернистого газа. Вот почему недопустимо отложение пыли и грязи на металлических предметах в музеях. Особенно опасными местами являются поднутрения на высоких рельефах. Известны случаи развития коррозионного процесса на бронзовой скульптуре, стоящей в залах и не защищенной витринами.
В некоторых случаях его присутствие даже тормозит коррозию. Сильно ускоряет коррозию газообразный хлор. Причем, характерно, что в присутствии этого газа коррозия возрастает и в относительно сухих атмосферах (влажность менее 42%). Сероводород при повышенной влажности также является весьма сильным реагентом. Кроме газов и паров кислот, на процесс коррозии большое влияние оказывают твердые частицы, осаждающиеся на поверхности металла из воздуха. Одни из них (коррозионно-активные) оказывают прямое воздействие на металл, другие, хотя и не отличаются коррозионно-активными свойствами, например, частички угля, приводят к ускорению коррозии благодаря тому, что они способствуют адсорбции на поверхности металла сернистого газа. Вот почему недопустимо отложение пыли и грязи на металлических предметах в музеях. Особенно опасными местами являются поднутрения на высоких рельефах. Известны случаи развития коррозионного процесса на бронзовой скульптуре, стоящей в залах и не защищенной витринами.
Почвенная коррозия. Почвенной коррозии подвергается археологический металл. Сохранность такого металла гораздо xyже, чем предметов, никогда не соприкасавшихся с почвой. Каковы же особенности почвы как коррозионной среды? Наличие влаги и растворенных в ней солей делает почву электролитом и вызывает электрохимическую коррозию металла. Увеличение влажности грунта, затрудняя доступ кислорода, замедляет пассивацию металла. В зависимости от содержания в почвенной влаге растворимых солей грунтовые воды подразделяются на пресные (до0,1%), солоноватые (от 0,1 до 1%), соленые (от I до 5%) и рассолы (от 5 до 40%). Большая часть соединений находится в грунтовых водах в виде ионов. Содержание аниона хлора в незасоленных почвах незначительно, благодаря хорошей растворимости и вымываемости его солей. В засоленных почвах количество хлоридов, сульфатов, карбонатов достигает значительной величины. Величина рН изменяется в зависимости от общей минерализации грунтовых вод и присутствия в них кислот, кислых и основных солей. По величине рН различают сильнокислые почвы (3-4,5), кислые (4,5-5,5), слабокислые (5,5-6,5), нейтральные (6,5-7), слабощелочные (7-7,5)-, щелочные (7,5-8,6) и сильно-щелочные (8,5-9).
Почвенной коррозии подвергается археологический металл. Сохранность такого металла гораздо xyже, чем предметов, никогда не соприкасавшихся с почвой. Каковы же особенности почвы как коррозионной среды? Наличие влаги и растворенных в ней солей делает почву электролитом и вызывает электрохимическую коррозию металла. Увеличение влажности грунта, затрудняя доступ кислорода, замедляет пассивацию металла. В зависимости от содержания в почвенной влаге растворимых солей грунтовые воды подразделяются на пресные (до0,1%), солоноватые (от 0,1 до 1%), соленые (от I до 5%) и рассолы (от 5 до 40%). Большая часть соединений находится в грунтовых водах в виде ионов. Содержание аниона хлора в незасоленных почвах незначительно, благодаря хорошей растворимости и вымываемости его солей. В засоленных почвах количество хлоридов, сульфатов, карбонатов достигает значительной величины. Величина рН изменяется в зависимости от общей минерализации грунтовых вод и присутствия в них кислот, кислых и основных солей. По величине рН различают сильнокислые почвы (3-4,5), кислые (4,5-5,5), слабокислые (5,5-6,5), нейтральные (6,5-7), слабощелочные (7-7,5)-, щелочные (7,5-8,6) и сильно-щелочные (8,5-9). Содержание кислорода, углекислого газа и азота в почвенном и атмосферном воздухе различно. В почвенном воздухе наблюдается более высокое содержание углекислоты (0.1-0.5%) по сравнению с атмосферным (0,03%). Это обусловлено протекающими в почве биохимическими процессами. Содержание кислорода в почве колеблется от 2 до 0,1% (в атмосфере 21%). Почвенный воздух всегда насыщен парами воды. Его относительная влажность обычно около 100%. Коррозионную активность почвы с достаточной точностью характеризует величина электропроводности, которая зависит от влажности, состава и количества солей и структуры. Неоднородность почвы по структуре, плотности, составу, влажности, кислотности и др. приводит к усилению неравномерности коррозии. Коррозионная активность почвы меняется во времени. Кроме того, существуют местные причины, которые влияют на агрессивность – применение удобрений, повышение концентрации вредных газов в атмосфере вблизи индустриальных центров, понижение уровня почвенных вод в результате строительства ирригационных сооружений и др.
Содержание кислорода, углекислого газа и азота в почвенном и атмосферном воздухе различно. В почвенном воздухе наблюдается более высокое содержание углекислоты (0.1-0.5%) по сравнению с атмосферным (0,03%). Это обусловлено протекающими в почве биохимическими процессами. Содержание кислорода в почве колеблется от 2 до 0,1% (в атмосфере 21%). Почвенный воздух всегда насыщен парами воды. Его относительная влажность обычно около 100%. Коррозионную активность почвы с достаточной точностью характеризует величина электропроводности, которая зависит от влажности, состава и количества солей и структуры. Неоднородность почвы по структуре, плотности, составу, влажности, кислотности и др. приводит к усилению неравномерности коррозии. Коррозионная активность почвы меняется во времени. Кроме того, существуют местные причины, которые влияют на агрессивность – применение удобрений, повышение концентрации вредных газов в атмосфере вблизи индустриальных центров, понижение уровня почвенных вод в результате строительства ирригационных сооружений и др.
Биокоррозия. Микроорганизмы, находящиеся в большом количестве в почвах, могут вызвать ускорение разрушения черных металлов. Особенно активны анаэробные сульфовосстанавливыающие бактерии, которые развиваются в илистых, глинистых и болотных почвах. Из аэробных бактерий опасны серобактерии, которые в процессе своей жизнедеятельности окисляют сероводород в серу, а затем в серную кислоту. Образующаяся серная кислота вызывает интенсивную коррозию. Морская коррозия. Морская вода является хорошо аэрированным (8 мг/л 02), нейтральным ( pH 7,2-8,6) электролитом с высокой электропроводностью, обусловленной растворенными солями, главным образом хлоридами и сульфатами натрия, магния, кальция и калия. Общая засоленность морской воды колеблется от I до 4%. В морской воде металлические предметы покрываются слоем растительных и животных организмов. Вместе с кремнекислыми соединениями и углекислым кальцием они дают осадки на металле, которые могут оказывать защитное действие.
На предметах, находящихся в зоне периодического смачивания, коррозия протекает с повышенной скоростью за счет облегченного доступа кислорода к поверхности металла.
По характеру коррозионного разрушения различают: 1) сплошную или общую коррозию, и 2) местную коррозию, Сплошная коррозия бывает равномерной, которая протекает с одинаковой скоростью по всей поверхности металла. Равномерной по толщине окисной пленкой покрываются металлические предметы, находящиеся в музейных, условиях, за которыми тщательно ухаживают: на них не скапливается пыль, не попадают агрессивные вещества, например с рук или при уборке помещения. Сплошная коррозия бывает и неравномерной и протекает с неодинаковой скоростью на различных участках поверхности металла. К этому виду коррозии относится разрушение археологического металла. В атмосферных условиях до образования патины коррозия также имеет неравномерный характер.
Местная коррозия приводит к разрушению отдельных участков поверхности металлического предмета. Коррозия может иметь вид тёмных пятен, точек (питтингов), язв в виде раковин. Это наиболее часто встречающиеся повреждения музейного металла. К этому виду разрушения относятся случаи “бронзовой болезни”, которые будут подробно рассмотрены в разделе “Разрушение медных сплавов”. К местной коррозии относится также межкристаллическая коррозия – разрушение по границам кристаллитов (этот вид коррозии опасен тем, что, не меняя внешнего вида, металл теряет прочность и пластичность), сквозная коррозия, коррозионное растрескивание – разрушение металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений. При соприкосновении с предметом не защищенных перчатками рук происходит взаимодействие металла с потом. Нередки случаи образования на поверхности музейного экспоната коррозионного пятна, воспроизводящего отпечаток пальца. Пот содержит .кроме воды (98-99% по массе) молочную кислоту, мочевину, хлорид натрия, что определяет его агрессивность. Источник:
К местной коррозии относится также межкристаллическая коррозия – разрушение по границам кристаллитов (этот вид коррозии опасен тем, что, не меняя внешнего вида, металл теряет прочность и пластичность), сквозная коррозия, коррозионное растрескивание – разрушение металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений. При соприкосновении с предметом не защищенных перчатками рук происходит взаимодействие металла с потом. Нередки случаи образования на поверхности музейного экспоната коррозионного пятна, воспроизводящего отпечаток пальца. Пот содержит .кроме воды (98-99% по массе) молочную кислоту, мочевину, хлорид натрия, что определяет его агрессивность. Источник:
РЕСТАВРАЦИЯ МЕТАЛЛА. Методические рекомендации. ВНИИР. сост. М.С.Шемаханская М., 1989
МЕТАЛЛЫ И МЕТАЛЛОКОНСТРУКЦИИ
|
Коррозия – электрохимическая
Коррозия – электрохимическая| Коррозия и ухудшение состояния окружающей среды | |||||||||||||||
| Электрохимический
Процессы · схема иллюстрирует электрохимическую реакцию, происходящую на поверхности металла, покрытого пленкой воды, содержащей растворенный кислород.  показаны две реакции, участвующие в коррозии. Атомы металла диссоциируют
на ионы металлов и свободные электроны в реакции окисления на аноде.
Эти электроны мигрируют в металл и инициируют реакцию восстановления.
на катоде, который генерирует гидроксильные ионы. показаны две реакции, участвующие в коррозии. Атомы металла диссоциируют
на ионы металлов и свободные электроны в реакции окисления на аноде.
Эти электроны мигрируют в металл и инициируют реакцию восстановления.
на катоде, который генерирует гидроксильные ионы. | |||||||||||||||
| · реакции окисления и восстановления находятся в равновесии, так что в случае
На рисунке два иона металла переходят в раствор на каждые четыре иона гидроксила.
произведено. Самая низкая скорость реакции определяет общую скорость коррозии. · Другой возможны восстановительные реакции, причем одновременно могут протекать несколько в реальном процессе коррозии. От кого: http://corrosion-doctors.org/AtmCorros/ mechani1.htm | |||||||||||||||
Большие проблемы в исследованиях электрохимической коррозии
Коррозия — это процесс деградации или разрушения материала в результате химической реакции между материалом и окружающей средой. Это незаменимая область исследований в области материаловедения и инженерии, поскольку коррозионная стойкость характеризует стабильность или долговечность материала, что является одним из наиболее важных характеристик материала при применении.
Это незаменимая область исследований в области материаловедения и инженерии, поскольку коррозионная стойкость характеризует стабильность или долговечность материала, что является одним из наиболее важных характеристик материала при применении.
По сравнению с другими материалами металлы относительно активны и, вероятно, подвержены коррозии. Таким образом, исследования коррозии в основном касаются механизма повреждения и поведения различных металлов, включая черные и цветные, монокристаллы или нанокристаллы, литые или кованые, а также конструкционные или функциональные сплавы. Он естественным образом развился в различные отрасли на основе сплава (Shreir et al., 1994), такие как коррозия стали, коррозия алюминиевого сплава, коррозия никелевого сплава и т. д. Состав и микроструктура всегда являются наиболее решающими факторами в определении коррозионной стойкости. сплав. В этом аспекте критическим вопросом, который необходимо решить, является то, как на процесс коррозии влияют фазовый состав матрицы, сегрегированный легирующий элемент, структура решетки, кристаллический дефект, ориентация кристаллов, размер зерна, состав вторичной фазы, распределение интерметаллических частиц, пористость, микроструктура. плотность трещин, уровень примесей и состояние поверхности.
плотность трещин, уровень примесей и состояние поверхности.
Еще одним важным аспектом исследования коррозии является сложное влияние факторов окружающей среды на коррозию. Чувствительность коррозионного поведения к факторам окружающей среды привела к различной степени и формам повреждения металлов в различных условиях эксплуатации (Cramer and Covino, 2006). В зависимости от среды, которой подвергаются металлы, коррозию можно легко разделить на различные типы, такие как водная или неводная коррозия, коррозия окружающей среды или высокотемпературная коррозия, кислотная или щелочная коррозия и т. д. В естественной среде атмосферная коррозия, морская вода коррозия и подземная коррозия обычно по-разному воздействуют на металлы. Различные проблемы с коррозией, связанные с условиями обслуживания, также часто возникают в химической, нефтегазовой, трубопроводной, гражданской, автомобильной, аэрокосмической, военной, ядерной и медицинской отраслях. Поскольку большинство факторов окружающей среды, таких как температура, давление, химический состав, концентрация компонентов, значение pH, электрическая или теплопроводность, вязкость и т. д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте.
д., могут прямо или косвенно взаимодействовать и постоянно или непостоянно влиять на процесс коррозии, прогнозирование долгосрочных коррозионное поведение довольно сложно. Выявление ключевого влияющего фактора и понимание его влияния на кинетику коррозии должно быть предметом исследования в этом аспекте.
В основе исследований коррозии лежит изучение механизма реакции материала с окружающей средой. Именно фундаментальное понимание подробных реакционных процессов, процедур и стадий, а также факторов, влияющих на них, лежит в основе науки о коррозии. Большинство проблем с коррозией в окружающей среде можно отнести к электрохимическим реакциям (Kaesche, 2003), поскольку влага и водная жидкость широко распространены в естественной среде, а электрохимическая реакция обычно протекает быстрее, чем реакции окисления-восстановления в условиях окружающей среды. Коррозионное разрушение, вызванное напряжением, во многих случаях является результатом сложных взаимодействий между напряжением и электрохимическими реакциями; напряжение резко облегчает электрохимический процесс, а последнее резко усиливает повреждающее действие первого. Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.
Даже при высоких температурах коррозию расплавленной соли также можно описать как электрохимический процесс. Таким образом, электрохимия является одним из наиболее актуальных предметов исследования коррозии (Mansfeld and Bertocci, 2005). Чтобы получить представление об основной области науки о коррозии, следует уделить первоочередное внимание изучению подробных электрохимических механизмов и созданию моделей интерфейса металл-электролит.
Изучив основные аспекты и суть науки о коррозии, никогда не следует забывать, что конечной целью исследований коррозии является минимизация коррозионного повреждения. В связи с этим большой интерес представляют все методы, способные препятствовать реакции металла с окружающей средой и эффективно замедлять коррозионный процесс. Фактически, катодная защита (Baeckmann et al., 1997), покрытие (Swaraj, 1996), обработка/модификация поверхности (Biestek and Weber, 1976) и ингибитор (Braford, 19).93) методы, которые замедляют коррозию с помощью различных механизмов, имеют долгую историю успешного уменьшения коррозионного повреждения на практике. Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии.
Они создали важное продолжение науки о коррозии, которая более или менее пересекается с наукой о поверхностях и покрытиях, технологиями и инженерией. Хотя технологические инновации являются центральной темой в этой области, очень желательны научные прорывы. Инновации в предотвращении коррозии часто появляются, когда новые идеи, методы и результаты других дисциплин внедряются в эту прикладную область исследований коррозии.
Из приведенного выше краткого введения можно выделить следующие основные характеристики, которые практически отличают исследования коррозии от других дисциплин материаловедения и техники:
(1) Коррозия возникает в сложной системе, на которую одновременно воздействуют факторы окружающей среды и металлургические параметры. . Эти взаимодействующие факторы чрезвычайно усложняют коррозионную систему. Таким образом, невозможно четко определить ключевой влияющий фактор и этап, определяющий скорость, которые управляют фундаментальной кинетикой процесса коррозии. Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.
Следовательно, многие коррозионные явления не поддаются теоретическому объяснению. Исследования коррозии в некоторых случаях должны опираться на значительный объем эмпирических знаний.
(2) Коррозия — процесс, чувствительный ко времени. Поскольку большинство факторов окружающей среды могут заметно меняться со временем, коррозионные характеристики металла могут быть невероятно разными на разных стадиях. Даже в коррозионной системе с постоянными факторами внешней среды и строго контролируемыми начальными и граничными условиями состояние корродирующей поверхности может меняться во времени за счет растворения металла или отложения продуктов коррозии. Следовательно, различные параметры окружающей среды в сочетании со сложным влиянием факторов окружающей среды делают теоретическое предсказание коррозии чрезвычайно трудным.
(3) Отсутствуют методы с высоким разрешением in situ для выявления механизма коррозии. Из-за зависимости коррозии от условий окружающей среды измерения ex situ могут не дать существенной информации о процессе коррозии или могут исказить эту информацию. В настоящее время большинство передовых инструментов, обычно используемых для характеристики микроструктуры и состава поверхности металла на наноуровне, должны работать в высоком вакууме, или требуют тщательной предварительной обработки/подготовки образца, или требуют добавления некоторых вспомогательных частиц для провоцируют дополнительные реакции в коррозионной системе. Они не могут производить настоящие in situ возникает из-за ненарушенной коррозионной поверхности в агрессивных средах. Ожидается, что некоторые новые появляющиеся методы in situ с высоким разрешением, например специально разработанная электролитная ячейка, которую можно установить в SEM или TEM, станут доступными для большинства исследователей коррозии при изучении микроструктуры и состава корродирующей поверхности в жидкие среды.
В настоящее время большинство передовых инструментов, обычно используемых для характеристики микроструктуры и состава поверхности металла на наноуровне, должны работать в высоком вакууме, или требуют тщательной предварительной обработки/подготовки образца, или требуют добавления некоторых вспомогательных частиц для провоцируют дополнительные реакции в коррозионной системе. Они не могут производить настоящие in situ возникает из-за ненарушенной коррозионной поверхности в агрессивных средах. Ожидается, что некоторые новые появляющиеся методы in situ с высоким разрешением, например специально разработанная электролитная ячейка, которую можно установить в SEM или TEM, станут доступными для большинства исследователей коррозии при изучении микроструктуры и состава корродирующей поверхности в жидкие среды.
Помимо этих основных характеристик исследования коррозии и вытекающих из этого трудностей, существует множество сложных вопросов, требующих решения, некоторые из которых стали серьезными препятствиями, критически препятствующими дальнейшему развитию науки о коррозии. Успешное решение этих критических проблем может значительно продвинуть эту область. Например, следующие темы особенно сложны и могут заинтересовать исследователей, занимающихся коррозионной наукой.
Успешное решение этих критических проблем может значительно продвинуть эту область. Например, следующие темы особенно сложны и могут заинтересовать исследователей, занимающихся коррозионной наукой.
(1) Коррозия метастабильных металлов: в то время как наука о материалах распространяется на нанотехнологии и метастабильные микроструктуры, такие как аморфные и нанокристаллические сплавы, современные принципы коррозии, основанные на традиционных кристаллических металлах, начинают сталкиваться с новыми проблемами. Понимание реакции коррозии на поверхности, состоящей из чрезвычайно высокой плотности дефектов, является новой областью в науке о коррозии. Чтобы расширить и углубить знания о коррозии и обеспечить практическое применение инновационных материалов, в первую очередь необходимо решить задачу разработки новых теорий коррозии для высокоактивированной металлической поверхности.
(2) Коррозия и защита передовых технических металлов: по мере роста спроса на материалы с некоторыми весьма желаемыми свойствами несколько сплавов, которые изначально считались непригодными для некоторых применений, теперь попадают в короткий список кандидатов. Например, сплавы Mg изначально были слишком активны, чтобы быть популярными конструкционными материалами, но теперь высокое соотношение прочности и веса делает их привлекательными в автомобильной промышленности в качестве материалов-кандидатов для автомобилей следующего поколения. Эти типы материалов обычно имеют коррозионное поведение, отличное от традиционных сплавов, и существующие знания и технологии защиты от коррозии и защиты не могут быть непосредственно применены к ним. Важно и сложно продолжать дальнейшее развитие существующих принципов и методов коррозии для покрытия этих передовых технических сплавов.
Например, сплавы Mg изначально были слишком активны, чтобы быть популярными конструкционными материалами, но теперь высокое соотношение прочности и веса делает их привлекательными в автомобильной промышленности в качестве материалов-кандидатов для автомобилей следующего поколения. Эти типы материалов обычно имеют коррозионное поведение, отличное от традиционных сплавов, и существующие знания и технологии защиты от коррозии и защиты не могут быть непосредственно применены к ним. Важно и сложно продолжать дальнейшее развитие существующих принципов и методов коррозии для покрытия этих передовых технических сплавов.
(3) Подробный механизм влияния наноструктуры на коррозию: коррозионная стойкость сплава в основном определяется его поверхностными «слабыми местами». Эти активные центры на поверхности фактически представляют собой кристаллические дефекты, такие как дислокации, двойники, границы зерен, границы раздела фаз, сегрегированные легирующие элементы, осажденные интерметаллиды или примесные включения. Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0211 in situ экспериментальные методы освоены учеными-коррозионистами.
Понимание деталей коррозионной реакции в этих местах, очевидно, является неизбежным шагом в решении центральной проблемы науки о коррозии. К сожалению, эти дефекты обычно находятся в наномасштабе. Выявить механизм микрокоррозии в этих дефектных участках до получения 9 высокого разрешения — большая проблема.0211 in situ экспериментальные методы освоены учеными-коррозионистами.
(4) Механизм коррозии и технология предотвращения коррозии в экстремальных условиях: к экстремальным условиям относятся чрезвычайно сильные помехи электрических и магнитных полей, облучения, давления, температуры и т. д. Коррозионные повреждения в этих суровых условиях были обнаружены в ядерной, аэрокосмической , газовая / нефтяная и химическая промышленность. Однако до того, как исследователи получат in situ методы, специально разработанные для этих экстремальных условий, их понимание этого вида коррозии не может быть таким всеобъемлющим, как понимание коррозии окружающей среды. Кроме того, из-за суровых условий эксплуатации и ограниченности промышленных методов эксплуатации в этих отраслях отчаянно не хватает экономически эффективных мер по предотвращению коррозии. Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения.
Поскольку этот вид коррозии может в конечном итоге угрожать общественной безопасности, ученый-коррозионист обязан принять вызов, чтобы улучшить понимание коррозии в экстремальных условиях и разработать более эффективные методы предотвращения.
(5) Понимание, мониторинг и моделирование коррозии in vivo : человеческое тело представляет собой сложную самоподдерживающуюся коррозионную систему. Коррозия in vivo представляет собой процесс биодеградации, происходящий в очень хорошо контролируемой окружающей среде. Измерения коррозии на месте или мониторинг в режиме реального времени без нарушения физиологических реакций внутри человеческого тела затруднены. Сложное влияние физиологических реакций и компонентов жидкости организма на коррозию является еще одним препятствием для понимания in vivo механизм коррозии. Также маловероятно точное моделирование реальной среды in vivo путем имитации жидкости организма и физиологических реакций в лаборатории. Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии.
Таким образом, исследование механизма биоразложения и процесса коррозии in vivo в лаборатории останется сложной задачей в исследованиях коррозии.
(6) Прогнозирование коррозии в реальных условиях: в естественной среде условия спонтанной коррозии не контролируются. Более того, существует множество изменений факторов окружающей среды, которые могут влиять на коррозию, что в значительной степени усложняет коррозионный процесс. Хуже того, неизбежная жизненная деятельность в реальном мире также может влиять на процесс коррозии, что делает поведение коррозии почти непредсказуемым. Например, микробио/бактерии, колонизирующие канализационные системы, образование биопленки на морской инфраструктуре, загрязнение воздуха автомобильными выхлопами и загрязнение почвы/подземных вод бытовыми отходами могут неожиданно ускорить коррозию открытых объектов. . Непредвиденная коррозия инфраструктуры под землей, в бетоне или в воде при определенных обстоятельствах может привести к катастрофе. Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.
Чтобы снизить риск, прогнозирование коррозионных характеристик в естественных условиях считается большой проблемой в исследованиях коррозии. В этом аспекте создание долгосрочной базы данных о коррозии является важной задачей, а компьютерное моделирование может стать подходом, который может привести к прорыву в прогнозировании коррозии.
(7) Механизм перехода состояния поверхности: начало пассивации, возникновение точечной коррозии и разрушение поверхностной пленки являются примерами перехода состояния поверхности. Таких поверхностных изменений на практике гораздо больше. Переход от исходной поверхности к новому стационарному состоянию является переходным процессом. Новое состояние обычно зависит от начальных условий поверхности, которые в конечном итоге могут повлиять на общее коррозионное повреждение. Например, разрыв первоначально сформированной пленки может в значительной степени повлиять на характер роста пленки на более поздней стадии; распределение точечной коррозии на поверхности металла на ранней стадии будет влиять на конечную морфологию коррозии; исходная чистота поверхности стали иногда может определять пассивность стали. Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии.
Очень интересно узнать, как, когда и где внезапно начинается переход. Предсказать появление перехода на металлической поверхности сложно, но это сложная цель, которую необходимо решить при исследовании коррозии.
(8) Разработка антикоррозионных функциональных покрытий: покрытия могут полностью изменить свойства поверхности металла, что открывает множество новых областей применения металлов. Улучшенная коррозионная стойкость или защитная способность традиционно являются важным требованием для разработки покрытий в технике предотвращения коррозии. Вообще говоря, коррозионная стойкость покрытия зависит от стабильности материала покрытия, целостности и толщины слоя покрытия и адгезии покрытия к металлам. Это также зависит от того, как покрытие реагирует на температуру, нагрузку и истирание в процессе эксплуатации. Антикоррозионное покрытие обычно представляет собой компромисс многих требований. Если новое покрытие может быть электро- или теплоизолирующим или проводящим, противоскользящим или самовыделяющим смазку, супергидрофобным или гидрофильным, избирательно адсорбирующим и поглощающим определенные виды и т. д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны.
д., оно найдет гораздо более широкое применение. себя, а также значительно расширить применение металлических компонентов/деталей в промышленности. Однако у такого покрытия будет слишком много противоречивых требований, чтобы идти на компромисс. Его изобретение и разработка не только сложны, но и интересны.
Таким образом, коррозия как процесс разрушения материала, вызванный реакцией материала с окружающей его средой, интенсивно и всесторонне исследовалась. Много достижений было сделано в отношении состава сплава и влияния микроструктуры, влияния факторов окружающей среды, механизма коррозии и методов защиты. Однако детальный механизм коррозии in situ под влиянием множества различных факторов не был всесторонне раскрыт из-за отсутствия 9 высокого разрешения.0211 in situ методы. В настоящее время самая большая трудность в исследованиях коррозии состоит в том, чтобы получить глубокое понимание процесса разложения in situ на коррозионной поверхности, скрытой коррозионной средой.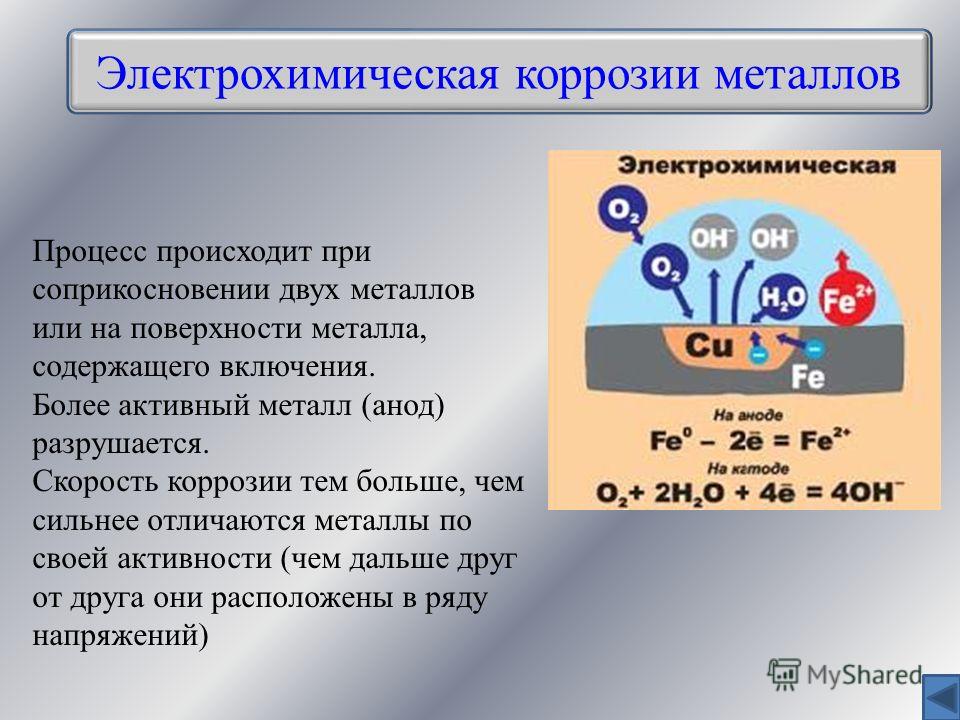 Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
Вокруг этого есть по крайней мере восемь больших проблем на передовых рубежах исследований коррозии. Оспаривание этих актуальных тем может привести к прорыву в области науки о коррозии.
Бекманн В., Швенк В. и Принц В. (1997). Справочник по катодной защите от коррозии , 3-е изд. Хьюстон, Техас: Издательство Gulf Professional.
Бистек, Т., и Вебер, Дж. (1976). Электролитические и химические конверсионные покрытия . Редхилл: Portcullis Press Limited.
Брафорд, SA (1993). Защита от коррозии . Лондон: Ван Рейнхольд.
Крамер, С. Д., и Ковино, Б. С. младший (редакторы) (2006). Справочник по ASM, том 13C: Коррозия: окружающая среда и промышленность . Парк материалов, Огайо: ASTM International.
Каеше, Х. (2003). Коррозия металлов, физико-химические основы и современные проблемы . Берлин: Спрингер.
Мансфельд Ф. и Берточчи У. (ред.) (2005 г.). Коррозионные испытания и стандарты , 2-е изд. Западный Коншохокен, Пенсильвания: ASTM International.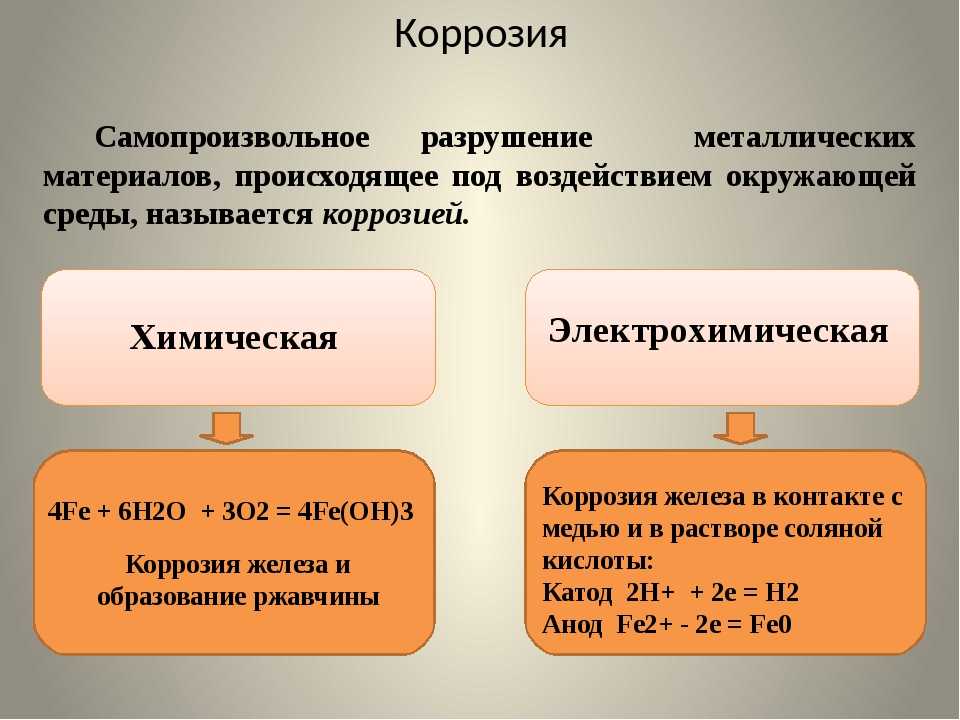


 Поскольку среди живых организмов — агентов биокоррозии — основными являются бактерии и микроскопические грибы, то в специальной литературе приняты термины «бактериальная» и «грибная» коррозия. В зарубежной литературе термин биокоррозия и микробиологическая коррозия иногда распространяется и на неметаллические материалы. В нашей стране официально принятый термин «биокоррозия» относится только к металлам и металлоизделиям. В технике и повседневной жизни со случаями биокоррозии металлов приходится сталкиваться реже, чем со случаями биоповреждений .неметаллических материалов. Это связано с различными причинами. Прежде всего металлы сами по себе являются более биостойким материалом, а некоторые из «их обладают даже биоцидным действием. В машинах, приборах и других технических изделиях они, как правило, используются с различными защитными и декоративными лакокрасочными и другими покрытиями, которые первыми принимают на себя воздействие агентов биоповреждений и предохраняют металл от биокоррозии.
Поскольку среди живых организмов — агентов биокоррозии — основными являются бактерии и микроскопические грибы, то в специальной литературе приняты термины «бактериальная» и «грибная» коррозия. В зарубежной литературе термин биокоррозия и микробиологическая коррозия иногда распространяется и на неметаллические материалы. В нашей стране официально принятый термин «биокоррозия» относится только к металлам и металлоизделиям. В технике и повседневной жизни со случаями биокоррозии металлов приходится сталкиваться реже, чем со случаями биоповреждений .неметаллических материалов. Это связано с различными причинами. Прежде всего металлы сами по себе являются более биостойким материалом, а некоторые из «их обладают даже биоцидным действием. В машинах, приборах и других технических изделиях они, как правило, используются с различными защитными и декоративными лакокрасочными и другими покрытиями, которые первыми принимают на себя воздействие агентов биоповреждений и предохраняют металл от биокоррозии.
 Предварительные анализы грунта на коррозионную агрессивность дали отрицательные результаты. Однако микробиологи выявили, во-первых, наличие в пробах грунта минералов, содержащих соединения серы, например пирита, состоящего из дисульфида железа, во-вторых, наличие в этих же пробах тионовых (сероокисляющих) бактерий и, в-третьих, изменение атмосферных условий в тоннеле при его прокладке. Предварительные испытания до начала строительства тоннеля показали, что грунт влажный, условия анаэробные и тионовые бактерии не опасны. Кессонный способ прокладки тоннелей связан с подачей в забой сжатого воздуха под давлением около 3 атм. Как только появился третий фактор — кислород воздуха, создались благоприятные условия, в результате чего начался бурный рост и размножение тионовых бактерий, количество которых, как показали опыты, в считанные дни может возрасти с единиц в 1 г почвы до нескольких миллионов. В аэробных условиях эти бактерии интенсивно окисляют сульфиды с образованием серной кислоты, которая может вызывать коррозию.
Предварительные анализы грунта на коррозионную агрессивность дали отрицательные результаты. Однако микробиологи выявили, во-первых, наличие в пробах грунта минералов, содержащих соединения серы, например пирита, состоящего из дисульфида железа, во-вторых, наличие в этих же пробах тионовых (сероокисляющих) бактерий и, в-третьих, изменение атмосферных условий в тоннеле при его прокладке. Предварительные испытания до начала строительства тоннеля показали, что грунт влажный, условия анаэробные и тионовые бактерии не опасны. Кессонный способ прокладки тоннелей связан с подачей в забой сжатого воздуха под давлением около 3 атм. Как только появился третий фактор — кислород воздуха, создались благоприятные условия, в результате чего начался бурный рост и размножение тионовых бактерий, количество которых, как показали опыты, в считанные дни может возрасти с единиц в 1 г почвы до нескольких миллионов. В аэробных условиях эти бактерии интенсивно окисляют сульфиды с образованием серной кислоты, которая может вызывать коррозию.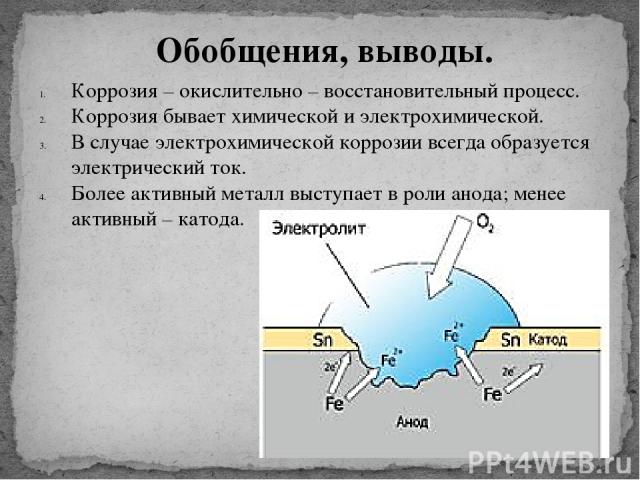

 Случаи анаэробной коррозии более характерны для -подземных сооружений и конструкций (нефтепромысловое оборудование, трубопроводы, нефтехранилища и т. п.), находящихся в плотных глинистых и водоносных слоях грунта. Коррозия металлов под действием СВБ связана главным образом с образованием сероводорода и сульфидов в результате восстановления сульфатов:
Случаи анаэробной коррозии более характерны для -подземных сооружений и конструкций (нефтепромысловое оборудование, трубопроводы, нефтехранилища и т. п.), находящихся в плотных глинистых и водоносных слоях грунта. Коррозия металлов под действием СВБ связана главным образом с образованием сероводорода и сульфидов в результате восстановления сульфатов: Особенно интенсивно протекает коррозия чугуна под действием СВБ, сохраняющиеся островки частиц углерода рассыпаются от легкого прикосновения. В анаэробных условиях глинистых почв водопроводные трубы с толщиной стенки 6 мм разрушались полностью в течение 3—4 лет. Наличие в почве свободных ионов железа ускоряет биокоррозию. Механизм биокоррозии под действием СВБ очень сложен, поскольку параллельно протекает несколько многостадийных процессов, Наряду с восстановлением сульфатов, как правило, происходит восстановление фосфатов. Особую актуальность исследование биокоррозии под действием СВБ приобрело в нефтяной промышленности в последние годы. Для повышения эффективности нефтяных месторождений (полноты отдачи нефти месторождениями) был разработан и широко внедрен метод законтурного заводнения нефтесодержащих пластов. Метод заключается в том, что по периметру (контуру) месторождения под землю нагнеталась под давлением вода, которая выдавливала нефть из грунта и выносила ее вместе с собой.
Особенно интенсивно протекает коррозия чугуна под действием СВБ, сохраняющиеся островки частиц углерода рассыпаются от легкого прикосновения. В анаэробных условиях глинистых почв водопроводные трубы с толщиной стенки 6 мм разрушались полностью в течение 3—4 лет. Наличие в почве свободных ионов железа ускоряет биокоррозию. Механизм биокоррозии под действием СВБ очень сложен, поскольку параллельно протекает несколько многостадийных процессов, Наряду с восстановлением сульфатов, как правило, происходит восстановление фосфатов. Особую актуальность исследование биокоррозии под действием СВБ приобрело в нефтяной промышленности в последние годы. Для повышения эффективности нефтяных месторождений (полноты отдачи нефти месторождениями) был разработан и широко внедрен метод законтурного заводнения нефтесодержащих пластов. Метод заключается в том, что по периметру (контуру) месторождения под землю нагнеталась под давлением вода, которая выдавливала нефть из грунта и выносила ее вместе с собой.


 Местное повышение влажности в присутствии мицелия создает дополнительные благоприятные условия для развития коррозии. Наиболее опасными в отношении биокоррозии металлов климатическими зонами являются зоны влажного тропического и субтропического климата. В зонах умеренного климата грибы вызывают коррозию в тех случаях, где нарушаются условия хранения или эксплуатации техники. Типичными представителями грибов, вызывающих биокоррозию в различных климатических зонах, являются грибы родов Аsреrgillus, Penicillium, Fusarium, Cladosporium и др. Штаммы музейных культур этих грибов используются в качестве тесткультур для исследования биокоррозии металлов в лабораторных условиях. Как правило, музейные штаммы бывают менее агрессивны, чем культуры, выделенные непосредственно с пораженных грибами материалов. В естественных микоценозах могут встречаться и доминировать наряду с указанными грибами и другие. Поскольку грибы гетеротрофы, то на поверхности чистого, незагрязненного металла, не имеющего контакта с органическими материалами, например смазками, полимерными пленками, красками и др.
Местное повышение влажности в присутствии мицелия создает дополнительные благоприятные условия для развития коррозии. Наиболее опасными в отношении биокоррозии металлов климатическими зонами являются зоны влажного тропического и субтропического климата. В зонах умеренного климата грибы вызывают коррозию в тех случаях, где нарушаются условия хранения или эксплуатации техники. Типичными представителями грибов, вызывающих биокоррозию в различных климатических зонах, являются грибы родов Аsреrgillus, Penicillium, Fusarium, Cladosporium и др. Штаммы музейных культур этих грибов используются в качестве тесткультур для исследования биокоррозии металлов в лабораторных условиях. Как правило, музейные штаммы бывают менее агрессивны, чем культуры, выделенные непосредственно с пораженных грибами материалов. В естественных микоценозах могут встречаться и доминировать наряду с указанными грибами и другие. Поскольку грибы гетеротрофы, то на поверхности чистого, незагрязненного металла, не имеющего контакта с органическими материалами, например смазками, полимерными пленками, красками и др.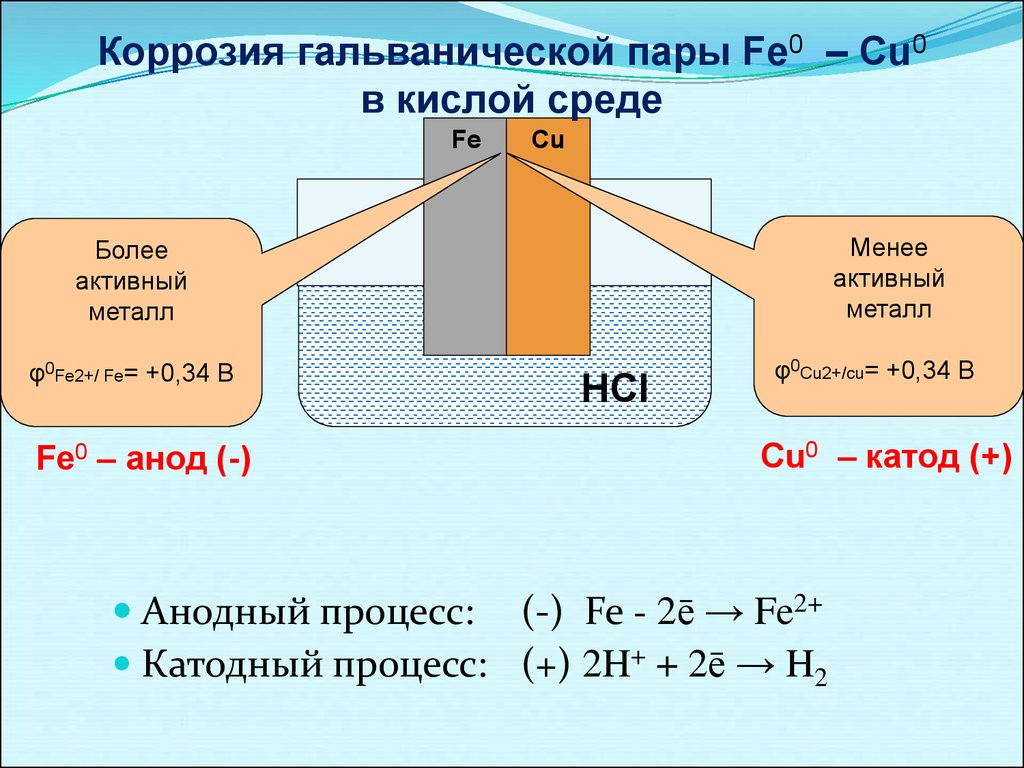 , они не могут развиваться. Биокоррозия металлов под действием грибов носит в связи с этим как бы вторичный характер. Вначале грибы поселяются и развиваются на органических материалах, контактирующих с металлом, а затем мицелий, распространяясь на металл, вызывает коррозию своими метаболитами — кислотами, ферментами. Биокоррозия отмечалась на незащищенных смазками или не-. окрашенных металлических деталях — резьбовых соединениях, элек-трическах контактах и т. п. Такие поражения характерны для радиоэлектронных и оптических приборов (телевизоры, стереотрубы, микроскопы). Образование мицелия на поверхности электрических контактов приборов в ряде случаев вызывало нарушение работы всего прибора вследствие замыкания электрической цепи или размыкания из-за нароста продуктов коррозии на поверхностях. Защита металлов от биокоррозии. Способы защиты металлов от биокоррозии основаны на применении химических бактериоцидов и фунгицидов, а также на рациональном подборе и использовании в конструкциях технических изделий биостойких материалов.
, они не могут развиваться. Биокоррозия металлов под действием грибов носит в связи с этим как бы вторичный характер. Вначале грибы поселяются и развиваются на органических материалах, контактирующих с металлом, а затем мицелий, распространяясь на металл, вызывает коррозию своими метаболитами — кислотами, ферментами. Биокоррозия отмечалась на незащищенных смазками или не-. окрашенных металлических деталях — резьбовых соединениях, элек-трическах контактах и т. п. Такие поражения характерны для радиоэлектронных и оптических приборов (телевизоры, стереотрубы, микроскопы). Образование мицелия на поверхности электрических контактов приборов в ряде случаев вызывало нарушение работы всего прибора вследствие замыкания электрической цепи или размыкания из-за нароста продуктов коррозии на поверхностях. Защита металлов от биокоррозии. Способы защиты металлов от биокоррозии основаны на применении химических бактериоцидов и фунгицидов, а также на рациональном подборе и использовании в конструкциях технических изделий биостойких материалов. Большое значение имеет строгое соблюдение санитарно-гигиенических правил на производствен при эксплуатации техники. Важным условием предупреждения биокоррозии подземных сооружений является прогнозирование биокоррозионной опасности почв и грунтов, в которых должны строиться и эксплуатироваться подземные сооружения. Там, где повышена опасность бактериальной коррозии, рекомендуется принимать следующие меры: 1) при прокладке трубопроводов следует избегать анаэробных условий для предупреждения биокоррозии от СВБ. В участках наиболее высокой опасности СВБ эффективную защиту оказывают аэрация, дренаж заболоченных почв, засыпка гравием и т. п. Если же опасность грозит со стороны тионовых бактерий, то надо предпринимать все меры, чтобы не допустить интенсивной аэрации; 2) использование щелочных реагентов позволяет подавить жизнедеятельность СВБ. Поэтому при прокладке труб в потенциально опасных кислых почвах целесообразно делать засыпки известью или мелом; 3) использование специальных биостойких защитных покрытий или материалов, например керамических труб, биостойких полимерных труб; 4) очистка воды от опасных микроорганизмов и солей.
Большое значение имеет строгое соблюдение санитарно-гигиенических правил на производствен при эксплуатации техники. Важным условием предупреждения биокоррозии подземных сооружений является прогнозирование биокоррозионной опасности почв и грунтов, в которых должны строиться и эксплуатироваться подземные сооружения. Там, где повышена опасность бактериальной коррозии, рекомендуется принимать следующие меры: 1) при прокладке трубопроводов следует избегать анаэробных условий для предупреждения биокоррозии от СВБ. В участках наиболее высокой опасности СВБ эффективную защиту оказывают аэрация, дренаж заболоченных почв, засыпка гравием и т. п. Если же опасность грозит со стороны тионовых бактерий, то надо предпринимать все меры, чтобы не допустить интенсивной аэрации; 2) использование щелочных реагентов позволяет подавить жизнедеятельность СВБ. Поэтому при прокладке труб в потенциально опасных кислых почвах целесообразно делать засыпки известью или мелом; 3) использование специальных биостойких защитных покрытий или материалов, например керамических труб, биостойких полимерных труб; 4) очистка воды от опасных микроорганизмов и солей. Эффективную дезинфекцию от СВБ и других бактерий обеспечивает длительное хлорирование воды при концентрации активного хлора 0,0001 % или ударными дозами хлора. Интересный способ защиты был разработан тюменскими нефтяниками. Они предложили сочетать электрохимическую и химическую защиту подземного оборудования нефтепромыслов от коррозии под действием СВБ путем электролизного хлорирования. Электрический ток пропускают между обсадными трубами скважины. В результате электролиза хлоридов, растворенных в воде, образуется хлор, который и производит бактерицидное действие. Применяемые для защиты от коррозии трубопроводов битумные покрытия часто оказываются благоприятным субстратом для развития микроорганизмов и вслед за ними — коррозии. Более эффективны покрытия из каменноугольного пека, а также эпоксидно-каменноугольные покрытия. Для защиты от биокоррозии внутренних поверхностей резервуаров нефтепродуктов и топливных систем используют биоцидные добавки к нефтепродуктам, а также защитные покрытия.
Эффективную дезинфекцию от СВБ и других бактерий обеспечивает длительное хлорирование воды при концентрации активного хлора 0,0001 % или ударными дозами хлора. Интересный способ защиты был разработан тюменскими нефтяниками. Они предложили сочетать электрохимическую и химическую защиту подземного оборудования нефтепромыслов от коррозии под действием СВБ путем электролизного хлорирования. Электрический ток пропускают между обсадными трубами скважины. В результате электролиза хлоридов, растворенных в воде, образуется хлор, который и производит бактерицидное действие. Применяемые для защиты от коррозии трубопроводов битумные покрытия часто оказываются благоприятным субстратом для развития микроорганизмов и вслед за ними — коррозии. Более эффективны покрытия из каменноугольного пека, а также эпоксидно-каменноугольные покрытия. Для защиты от биокоррозии внутренних поверхностей резервуаров нефтепродуктов и топливных систем используют биоцидные добавки к нефтепродуктам, а также защитные покрытия. Наиболее эффективные покрытия для защиты стальных резервуаров от бактериальной коррозии—-эпоксидные. Они выдерживают самые жесткие коррозионные условия, возникающие в резервуарах в донной части на границе раздела нефтепродукт — вода. Среди химических средств защиты нефтепромыслового оборудования от СВБ эффективным и доступным оказался формальдегид (формалин). Введение его в концентрации 10—20 мг/л в воду, нагнетаемую в скважины, обеспечивает резкое снижение биокоррозии. Рекомендовано много других биоцидов, однако их высокая стоимость и дефицитность ограничивают возможность широкого применения их. Для защиты металлов от коррозии под действием грибов применяются в основном те же химические средства (фунгициды), что и для защиты неметаллических материалов. Существенным требованием при этом к фунгицидам является то, чтобы они, обладая биологически активным действием против грибов, сами не были агрессивны к металлам и не вызывали коррозии, так как известно, что некоторые фунгициды коррозионно опасны.
Наиболее эффективные покрытия для защиты стальных резервуаров от бактериальной коррозии—-эпоксидные. Они выдерживают самые жесткие коррозионные условия, возникающие в резервуарах в донной части на границе раздела нефтепродукт — вода. Среди химических средств защиты нефтепромыслового оборудования от СВБ эффективным и доступным оказался формальдегид (формалин). Введение его в концентрации 10—20 мг/л в воду, нагнетаемую в скважины, обеспечивает резкое снижение биокоррозии. Рекомендовано много других биоцидов, однако их высокая стоимость и дефицитность ограничивают возможность широкого применения их. Для защиты металлов от коррозии под действием грибов применяются в основном те же химические средства (фунгициды), что и для защиты неметаллических материалов. Существенным требованием при этом к фунгицидам является то, чтобы они, обладая биологически активным действием против грибов, сами не были агрессивны к металлам и не вызывали коррозии, так как известно, что некоторые фунгициды коррозионно опасны. В то же время среди органических соединений, применяемых для защиты от коррозии в качестве ингибиторов коррозии, были найдены препараты, обладающие фунгицидным действием.
В то же время среди органических соединений, применяемых для защиты от коррозии в качестве ингибиторов коррозии, были найдены препараты, обладающие фунгицидным действием.