Элемент cu: LTC40FFED3AA000 DKC + , 1, Cu, 2P+2P/4P+4P/4P+2P, 40A
alexxlab | 20.08.2021 | 0 | Разное
химический элемент Медь Cuprum — “Химическая продукция”
Что такое
Медь, cuprum, характеристики, свойстваМедь — это химический элемент Cu (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь класс химических элементов
Элемент Cu — относится к группе, классу хим элементов (элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29)
Элемент Cu свойство химического элемента Медь Cuprum
Основные характеристики и свойства элемента Cu…, его параметры.
формула химического элемента Медь Cuprum
Химическая формула Медьа:
Атомы Медь Cuprum химических элементов
Атомы Cuprum хим. элемента
элемента
Cuprum Медь ядро строение
Строение ядра химического элемента Cuprum — Cu,
История открытия Медь Cuprum
Открытие элемента Cuprum — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк.
Медный век
значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Медь Cuprum происхождение названия
Откуда произошло название Cuprum Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл».
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П.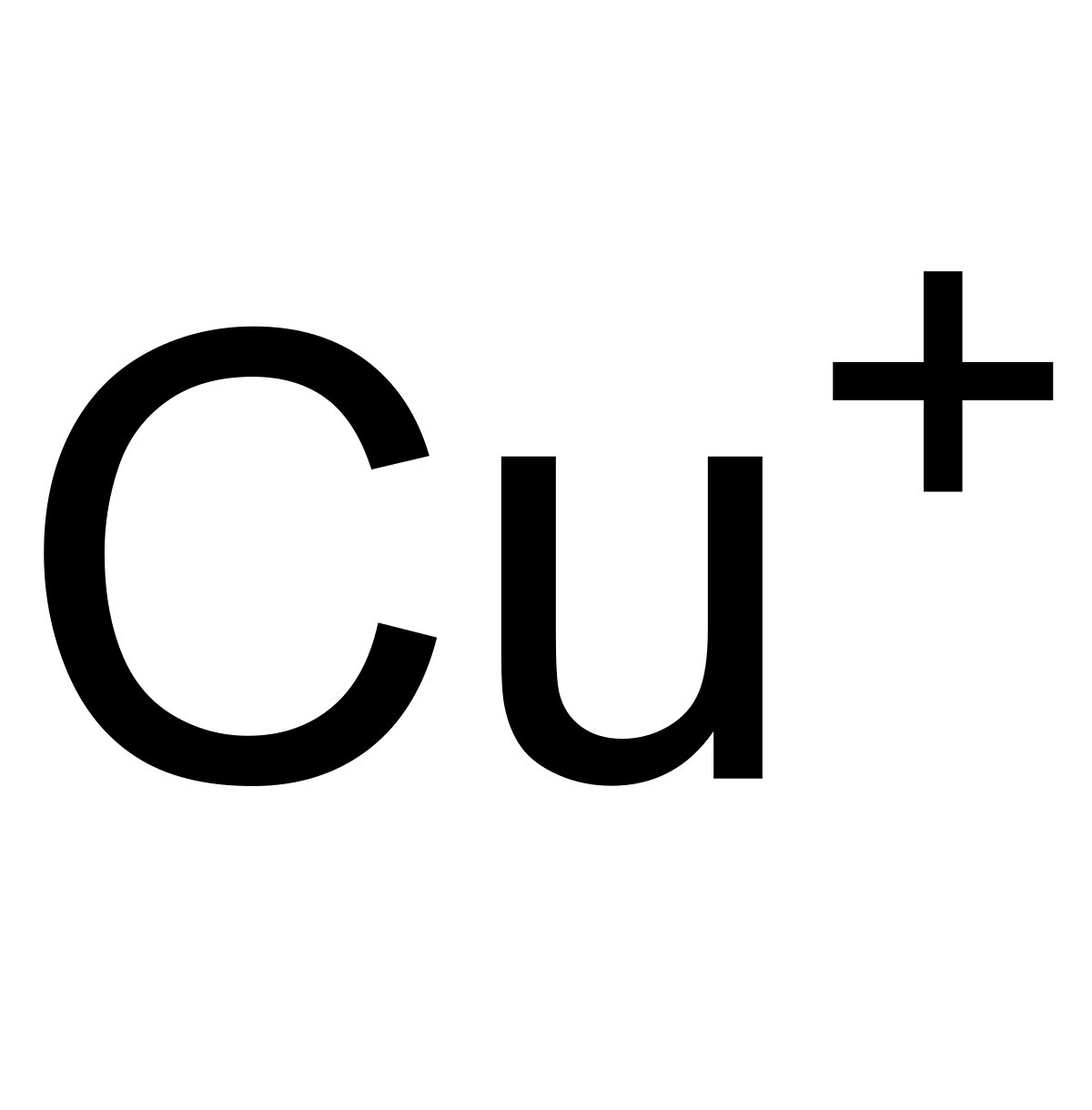
Распространённость Медь Cuprum
Как любой хим. элемент имеет свою распространенность в природе, Cu …
Получение Медь Cuprum
Cuprum — получение элемента
Физические свойства Медь Cuprum
Основные свойства Cuprum —
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света.
Изотопы Cuprum Медь
Наличие и определение изотопов Cuprum — природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Медь-64
64Cu имеет период полураспада 12,7 часа и распадается по одной из четырех схем:
- Позитронный распад: вероятность 17,8 %, дочерний изотоп стабильный 64Ni.
- Бета-распад: вероятность 39 %, дочерний изотоп стабильный
- Электронный захват: вероятность 43 %, дочерний изотоп стабильный 64Ni.
- Внутренняя конверсия: вероятность 0,47 %, дочерний изотоп стабильный 64Ni.
Cu свойства изотопов Медь Cuprum
| Символ нуклида | Z(p) | N(n) | Масса изотопа (а. е. м.  ) ) | Период полураспада (T1/2) | Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 52Cu | 29 | 23 | 51,99718 | 3+ | |
| 53Cu | 29 | 24 | 52,98555 | 300 нс | 3/2- |
| 54Cu | 29 | 25 | 53,97671 | 75 нс | 3+ |
| 55Cu | 29 | 26 | 54,96605 | 40 мс | 3/2- |
| 56Cu | 29 | 27 | 55,95856 | 93 мс | 4+ |
| 57Cu | 29 | 28 | 56,949211 | 196,3 мс | 3/2- |
| 58Cu | 29 | 29 | 57,9445385 | 3,204 с | 1+ |
| 59Cu | 29 | 30 | 58,9394980 | 81,5 с | 3/2- |
| 60Cu | 29 | 31 | 59,9373650 | 23,7 мин | 2+ |
| 61Cu | 29 | 32 | 60,9334578 | 3,333 ч | 3/2- |
| 62Cu | 29 | 33 | 61,932584 | 9,673 мин | 1+ |
| 63Cu | 29 | 34 | 62,9295975 | стабилен | 3/2- |
| 64Cu | 29 | 35 | 63,9297642 | 12,700 ч | 1+ |
| 65Cu | 29 | 36 | 64,9277895 | стабилен | 3/2- |
| 66Cu | 29 | 37 | 65,9288688 | 5,120 мин | 1+ |
| 67Cu | 29 | 38 | 66,9277303 | 61,83 ч | 3/2- |
| 68Cu | 29 | 39 | 67,9296109 | 31,1 с | 1+ |
| 68mCu | 721,6 кэВ | 3,75 мин | 6- | ||
| 69Cu | 29 | 40 | 68,9294293 | 2,85 мин | 3/2- |
| 69mCu | 2,7418 МэВ | 360 нс | 13/2+ | ||
| 70Cu | 29 | 41 | 69,9323923 | 44,5 с | 6- |
| 70m1Cu | 101,1 кэВ | 33 с | 3- | ||
| 70m2Cu | 242,6 кэВ | 6,6 с | 1+ | ||
| 71Cu | 29 | 42 | 70,9326768 | 19,4 с | 3/2- |
| 71mCu | 2,756 МэВ | 271 нс | 19/2- | ||
| 72Cu | 29 | 43 | 71,9358203 | 6,6 с | 1+ |
| 72mCu | 270 кэВ | 1,76 мкс | 4- | ||
| 73Cu | 29 | 44 | 72,936675 | 4,2 с | 3/2- |
| 74Cu | 29 | 45 | 73,939875 | 1,594 с | 1+ |
| 75Cu | 29 | 46 | 74,94190 | 1,224 с | 3/2- |
| 76Cu | 29 | 47 | 75,945275 | 641 мс | 3 |
| 76mCu | 0 кэВ | 1,27 с | 1 | ||
| 77Cu | 29 | 48 | 76,94785 | 469 мс | 3/2- |
| 78Cu | 29 | 49 | 77,95196 | 342 мс | |
| 79Cu | 29 | 50 | 78,95456 | 188 мс | 3/2- |
| 80Cu | 29 | 51 | 79,96087 | 100 мс | |
| 81Cu | 29 | 52 | > 632 нс | ||
| 82Cu | 29 | 53 | > 636 нс | ||
Химические свойства Медь Cuprum
Определение химических свойств Cuprum
Меры предосторожности Медь Cuprum
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Cuprum
Стоимость Медь Cuprum
Рыночная стоимость Cu, цена Медь Cuprum
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Cu
элемент Cu
Применение олигоэлементов в косметике – польза и значение, результаты использования
История открытия олигоэлементов
История открытия олигоэлементов стартует с 1922 года: базисную основу оценки микроэлементов, как важного фактора функционирования макроорганизма, дал академик В. И. Вернадский. Основатель и специалисты компании HORMETA начали разрабатывать свою продукцию спустя четверть века, став пионерами этой отрасли косметологии.
Что такое олигоэлементы?
Олигоэлементы представляют собой вещества, находящиеся в микроколичествах в живом организме.Они являются ингибиторами окислительных процессов, активизируют регенерацию и восстановление тканей.
Олигоэлементы участвуют в синтезе многих клеточных структур, способствуют синтезу фибробластами волокон коллагена, эластина. Нейтрализуют процессы окисления, уменьшают количество свободных радикалов.
Нейтрализуют процессы окисления, уменьшают количество свободных радикалов.
Олигоэлементы – микроэлементы, обладающие важным каталитическим действием, применяются в ферментативных реакциях, чем обеспечивает нормальный обмен веществ в клетках.
Микроэлементы используются в малых дозах. Отсюда и название: с греческого языка «олигос» переводится как «незначительный».
Комплекс Олигокос-5 от ОРМЕТА включает в себя следующие элементы: медь, кремний, магний, цинк и марганец.
Олигоэлементы в косметологии
В косметологии их действие хорошо изучено: микроэлементы стимулируют образование структурного белка соединительной ткани коллагена, отвечающего за упругость кожи, предотвращают образование отёков, выполняют роль дезинфектантов. Каждый компонент этого комплекса играет важную роль
Комплекс олигоэлементов входит в состав антивозрастных средств. Они способствуют повышению упругости кожи, стимулируют процессы клеточного обновления. Благодаря олигоэлементам лицо приобретает здоровый цвет, уменьшается выраженность мелких морщин.
Медь (Cu) – блокировка свободных радикалов и веществ, разрушающих коллаген.
Медь в первую очередь выполняет роль восстанавливающего, дезинфицирующего и ранозаживляющего средства.
Её участие в процессах метаболизма выражается синтезом ряда активных ферментов, которые оказывают влияние на образование эластина.
В составе ферментов медь осуществляет блокировку свободных радикалов и веществ, разрушающих коллаген.
Биодоступный кремний (Si) – активация синтеза коллагена
Кремний – очень древний и распространенный элемент неживой природы, которому мы, может быть, обязаны жизни на этой планете. На земле он занимает второе место по распространенности после кислорода:
Кремний – это один из компонентов, содержащихся в соединительной ткани человека. Его основными функциями являются восстановительные и регенерирующие действия, кроме этого кремний оказывает увлажняющий эффект. Рассматривая основные действия кремния более подробно, стоит отметить, что он способствует синтезу эластина и коллагена, а также известна его регенеративная функция, которая хорошо заметна в клетках эпидермиса и дермы.
Кремний в косметологии важен как элемент, поддерживающий функции соединительной ткани путём активации синтеза коллагена. Ввиду того, что его поступление обычным путём (с продуктами питания) затруднено, поскольку он находится в составе силикатов, активная транспортировка микроэлемента в биодоступном виде позволяет уменьшить морщины, разгладить кожу, сохранить целостность эпидермиса, плотность всех слоёв дермы.
Магний (Mg) – внутриклеточное образование АТФ
Магний – минерал, который находиться на главном месте в своем классе, когда дело доходит до обсуждения его разнообразных преимуществ в организме в целом и непосредственно для кожи лица. Magnifique – значит великолепный. От этого французского слова получил название элемент периодической таблицы – магний.
Магний является участником синтеза молекул энергетической «валюты» АТФ, обеспечивающих энергоснабжение клеток кожи: поступая внутридермально, он активизирует процессы метаболизма, обновляя клеточную структуру. При нехватке магния на лице появляются отёки, поскольку организм скапливает воду. Одновременно по причине дефицита энергии формируется неполноценный коллаген, который приводит к образованию стрий разной формы (атрофированных участков кожи в виде полос).
При нехватке магния на лице появляются отёки, поскольку организм скапливает воду. Одновременно по причине дефицита энергии формируется неполноценный коллаген, который приводит к образованию стрий разной формы (атрофированных участков кожи в виде полос).
Цинк (Zn) – регенерация и заживление
Цинк реализует несколько задач: активизирует регенерацию кожи за счёт очистки её от жира и продуктов липидного обмена, приостанавливает действие свободных радикалов и предотвращает акне. Микроэлемент задействуют в качестве способа защиты от ультрафиолета, для отбеливания и дезинфекции кожи. Его противовоспалительное действие дополняет функцию меди.
Данный микроэлемент способствует заживлению тканей. Микроэлемент также увеличивает выработку коллагена в организме, а кому как не женщинам знать, что коллаген – белковая структура, которая отвечает не только за заживление, но и за упругость и молодость кожи.
Марганец (Mn) – активатор антиоксидантов
Марганец – один из важнейших микроэлементов для человеческого организма, поддерживающий обменные процессы и положительно влияющий на усвоение организмом других минералов, витаминов и активных веществ, в частности, витамина В1, витамина С, меди и других элементов.
Марганец является активатором антиоксидантов, куда входит супероксиддисмутаза, ликвидирующая свободные радикалы. При его помощи синтезируется глюкозамин, представляющий собой базисный строительный материал для соединительной ткани и коллагена. Элемент влияет на образование гликопротеинов (транспортных белков матрикса), отвечающих за соединение и перенос внутриклеточных компонентов в зоны роста и регенерации.
HORMETA – создатели олигокосметики с 1949 года.
Основу всех средств марки представляет уникальный комплекс специфических олигоэлементов ОЛИГОКОС – 5 (Mg, Mn, Zn, Si, Cu) в оптимальной концентрации. Этот комплекс стал предметом серьёзных научных исследований, продемонстрировавших его активные свойства
Кроме уникального комплекса олигоэлементов ОЛИГОКОС – 5, формулы марки содержат инновационные активные компоненты и растительные экстракты, сочетание которых помогает добиваться поистине фантастических результатов в решении проблемы старения кожи.
Лаборатории Ормета, основываясь на богатом минеральном и растительном разнообразии природной среды Швейцарии, являются членом ассоциации “Swisscos”, которая занимается защитой происхождения швейцарской косметики. Члены этой ассоциации обладают сертификатом, подтверждающим, что производство и упаковка продукции были произведены в Швейцарии.
Олигокосметика – мы знаем о ней все
Питающий элемент + заглушка, тип 2, Cu, 6P, 25A
Технические характеристики Питающего элемента + заглушка, тип 2, Cu, 6P, 25A ДКС(DKC) LTC25LFED4AA000
-
Материал изоляции?
ПВХ – поливинилхлорид (самый распространенный материал изоляции, из плюсов: низкая пожарная опасность, сравнительно высокая долговечность в щадящих условиях, из минусов: токсичность продуктов горения.) ПНД – полиэтилен (самый стойкий к воздействию внешних факторов материал, но есть минус: высокая пожарная опасность.
Термопласт )
БПК – безгалогенная полимерная композиция (один из новейших нетоксичных материалов не содержащих хлор, но есть минус: высокая по сравнению с ПВХ выделение тепла при горении.)
)
БПК – безгалогенная полимерная композиция (один из новейших нетоксичных материалов не содержащих хлор, но есть минус: высокая по сравнению с ПВХ выделение тепла при горении.)
- Цвет Серый
- Ширина 0.12 м.
- Код товара DKC (ДКС)#ltc25lfed4aa000
- Высота 0.06 м.
- Глубина 0.34 м.
- Количество полюсов 2
- Номинальный ток 25 А
-
Вес
0.
 56 кг.
56 кг.
- Номинальное напряжение 380 В
- Материал изделия Медь
Сертификаты товара
- Сертификат EAC
- Протокол испытаний
- Сертификат пожарной безопасности
- Сертификат пожарной безопасности
FAQ: теплосчетчики SANEXT | Блог компании «Санекст»
| В статье мы разобрали часто задаваемые вопросы, которые возникают у потребителей теплосчетчиков SANEXT. |
Компания САНЕКСТ.ПРО выпускает 2 вида тепловых счетчиков под брендом SANEXT: механические SANEXT Mono RM и ультразвуковые SANEXT Mono CU.![]()
На сегодняшний день более 300 тысяч наших теплосчетчиков установлено в жилых домах. Многие жильцы не знают, как пользоваться приборами учета тепла и в связи с этим у них возникает много вопросов. Мы собрали часто задаваемые и ответили на них в стиле вопрос-ответ:
Вопрос: Какие показатели теплосчетчика нужно подавать в управляющую компанию / ресурсоснабжающую организацию?
Ответ:
Для теплосчетчика Mono CU:
☀ – 0.000 Gcal (если счетчик установлен на подающем трубопроводе)
❄ – 0.000 Gcal (если счетчик установлен на обратном трубопроводе)
Для теплосчетчика Mono RM:
Показания меню в «Гкал»
Вопрос: Как определить на каком трубопроводе установлен теплосчетчик?
Ответ: Если ваш счетчик установлен на подающем трубопроводе, то знак ☀ будет отображать накопленные значения, а знак ❄ будет со значением 0. Для обратного трубопровода знак ❄ будет отображать накопленные значения, а знак ☀ будет равен 0.
Вопрос: Где находится элемент питания и можно ли заменить батарейку самостоятельно и без демонтажа?
Ответ: Элемент питания находится внутри корпуса. При вскрытии корпуса срываются заводские/поверочные пломбы. Для эксплуатации теплосчетчика после проведения ремонта, в данном случае замены элемента питания необходимо осуществить периодическую (внеочередную) поверку. Кроме того, вмешательство в прибор снимает теплосчетчик с гарантии.
Вопрос: Почему не горит дисплей теплосчетчика?
Ответ: Показания на дисплее теплосчетчика Mono CU выводятся по запросу посредством нажатия кнопки на дисплее, тогда как на теплосчетчике Mono RM данные отображаются всегда.
Вопрос: Почему счетчик Mono RM не реагирует на кнопку?
Ответ: Если дисплей теплосчетчика Mono RM не выводит показания на дисплей то скорее всего элемент питания разрядился. Необходимо произвести замену/ремонт в рамках гарантийного обслуживания. Обратитесь с запросом на [email protected]
Необходимо произвести замену/ремонт в рамках гарантийного обслуживания. Обратитесь с запросом на [email protected]
Вопрос: На моем счетчике Mono RM отображается иконка «разряженной батарейки». Что делать?
Ответ: Элемент питания разрядился и емкость составляет около 25%. Необходимо произвести замену/ремонт в рамках гарантийного обслуживания. Обратитесь с запросом на [email protected]
Вопрос: Как заказать дубликат паспорта?
Ответ: Для заказа паспорта на Теплосчетчики моделей Mono RM и Mono CU, отправьте запрос на [email protected]
Вопрос: Как снять архивные показания теплосчетчика?
Ответ: Для просмотра архивов необходимо воспользоваться инструкцией по эксплуатации теплосчетчика конкретной модели.
Вопрос: Какой срок гарантии теплосчетчиков?
Ответ: Гарантийный срок на теплосчетчики SANEXT Mono RM и SANEXT Mono CU составляет 5 лет.![]()
Вопрос: Можно ли поменять дату и время на дисплее теплосчетчика?
Ответ: Нет, такой возможности нет.
Вопрос: Что означает знак * на дисплее теплосчетчика Mono RM?
Ответ: В нормальном состоянии работы знак * на дисплее теплосчетчика означает, что крыльчатка расходомера вращается, т.е. счетчик регистрирует расход теплоносителя.
Вопрос: На дисплее теплосчетчика горит знак ! и мигают 2 значка температуры, что это значит?
Ответ: Данная ошибка говорит о том, что разность температур (подающего трубопровода и обратного) отрицательная. Для разрешения проблемы необходимо проверить правильность установки термодатчиков и по необходимости поменять их местами.
Вопрос: Можно ли снимать показания через оптической порт на компьютер?
Ответ: Такой возможности не имеется. Оптический порт предназначен для служебного пользования.
Оптический порт предназначен для служебного пользования.
Как смонтировать теплосчетчик, вы найдете в техническом паспорте:
Если вы не смогли найти ответ на свой вопрос, задайте его нам в социальных сетях: Вконтакте или Facebook.
Читайте также
10 фактов о меди – атомный номер 29, символ Cu
Медь – красивый и полезный металлический элемент, который можно найти в вашем доме как в чистом виде, так и в виде химических соединений. Медь – это элемент № 29 в периодической таблице Менделеева с символом Cu, от латинского слова cuprum . Название означает «с острова Кипр», который был известен своими медными рудниками.
10 фактов о меди
- Медь имеет красновато-металлическую окраску, уникальную среди всех элементов.Единственный другой не серебристый металл в таблице Менделеева – это золото, которое имеет желтоватый цвет. Добавление меди к золоту – вот как получается красное или розовое золото.

- Медь была первым металлом, который обработал человек, наряду с золотом и метеоритным железом. Это связано с тем, что эти металлы были одними из немногих, которые существуют в своем естественном состоянии, а это означает, что относительно чистый металл можно найти в природе. Использование меди насчитывает более 10 000 лет. Ледяной Человек Эци (3300 г. до н.э.) был найден с топором, голова которого была сделана из почти чистой меди.Волосы ледяного человека содержали высокий уровень токсина мышьяка, что может указывать на то, что человек подвергся воздействию этого элемента во время плавки меди.
- Медь – важный элемент питания человека. Минерал имеет решающее значение для образования клеток крови и содержится во многих продуктах питания и большинстве источников воды. Продукты с высоким содержанием меди включают листовую зелень, зерно, картофель и бобы. Хотя для этого требуется много меди, ее можно получить и слишком много. Избыток меди может вызвать желтуху, анемию и диарею (которая может быть синей!).

- Медь легко образует сплавы с другими металлами. Двумя наиболее известными сплавами являются латунь (медь и цинк) и бронза (медь и олово), хотя существуют сотни сплавов.
- Медь – природное антибактериальное средство. В общественных зданиях обычно используют латунные дверные ручки (латунь – это медный сплав), потому что они помогают предотвратить передачу болезней. Металл также токсичен для беспозвоночных, поэтому его используют на корпусах кораблей, чтобы предотвратить прикрепление мидий и ракушек. Он также используется для борьбы с водорослями.
- Медь обладает многими желательными свойствами, характерными для переходных металлов. Он мягкий, податливый, пластичный и отлично проводит тепло и электричество, а также устойчив к коррозии. Медь в конечном итоге окисляется с образованием оксида меди или зеленого цвета. Это окисление является причиной того, что Статуя Свободы имеет зеленый цвет, а не красновато-оранжевый. Это также причина того, что недорогие украшения, в состав которых входит медь, часто обесцвечивают кожу.
- По промышленному использованию медь занимает третье место после железа и алюминия.Медь используется в проводке (60 процентов всей меди), сантехнике, электронике, строительстве, посуде, монетах и множестве других товаров. Медь в воде, а не хлор, является причиной зеленого цвета волос в плавательных бассейнах.
- Существует две распространенных степени окисления меди, каждая со своим набором свойств. Один из способов отличить их – по цвету спектра излучения, когда ион нагревается в пламени. Медь (I) превращает пламя в синий цвет, а медь (II) дает зеленое пламя.
- Почти 80 процентов добытой на сегодняшний день меди все еще используется. Медь – это металл, пригодный для вторичной переработки на 100%. Это металл в большом количестве в земной коре, концентрация которого составляет 50 частей на миллион. Его содержание в морской воде составляет 2,5 х 10-4 мг / л. Медь Земли образовалась в результате взрыва белых карликов и массивных звезд до образования Солнечной системы.
- Медь легко образует простые бинарные соединения, которые представляют собой химические соединения, состоящие всего из двух элементов.Примеры таких соединений включают оксид меди, сульфид меди и хлорид меди. Медь также образует комплексы, металлоорганические соединения и другие соединения, содержащие несколько атомов.
Источники
- Хаммонд, К. Р. (2004). «Элементы», в Справочнике по химии и физике (81-е изд.). CRC Press. ISBN 0-8493-0485-7.
- Ким, Б.Е. (2008). «Механизмы приобретения, распределения и регулирования меди». Нат Хем Биол .Национальный центр биотехнологической информации, Bethesda MD.
- Массаро, Эдвард Дж., Изд. (2002). Справочник по фармакологии и токсикологии меди . Humana Press. ISBN 0-89603-943-9.
- Смит, Уильям Ф. и Хашеми, Джавад (2003). Основы материаловедения и инженерии . McGraw-Hill Professional. п. 223. ISBN 0-07-292194-3.
- Вист, Роберт (1984). CRC, Справочник по химии и физике .Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
Copper Facts
Медь имеет атомный номер 29 с символом элемента Cu.Медь – это красноватый переходный металл с атомным номером 29 и символом элемента Cu. Символ элемента происходит от латинского названия элемента cuprum. Эти факты о меди включают химические и физические данные, общую информацию и мелочи.
Основные сведения о меди
Название : Медь
Атомный номер : 29
Символ элемента : Cu
Атомная масса : 63.546 (3)
Группа : 11
Период : 4
Блок : d-блок
Семейство элементов : переходный металл
Электронная конфигурация : [Ar] 3d 10 4s 1
Discovery : Первое известное использование меди на Ближнем Востоке датируется 9000 годом до нашей эры. Единственными металлами, использовавшимися человеком до меди, были золото и метеоритное железо.
Происхождение имени : Имя «медь» является искаженной формой латинского слова «cuprum», которое, в свою очередь, является искаженной формой имени «aes cyprium».Aes cyprium означает «металл Кипра» и относится к римской добыче меди на острове Кипр. Современное название элемента впервые появилось в употреблении около 1530 года.
Изотопы : существует 29 изотопов меди. Только медь-63 и медь-65 являются стабильными, причем на медь-63 приходится около 69% встречающегося в природе элемента. Остальные изотопы радиоактивны.
Физические данные
Плотность : 8,96 г / см 3
Точка плавления : 1357.77 K (1084,62 ° C, 1984,32 ° F)
Точка кипения : 2835 K (2562 ° C, 4643 ° F)
Состояние при 20 ° C : твердое вещество
Тепло плавления : 13,26 кДж / моль
Теплота испарения : 300,4 кДж / моль
Молярная теплоемкость : 24,440 Дж / (моль · К)
Магнитный заказ : Диамагнитный
Атомные данные
Конфигурация электронной оболочки для медь.Электроотрицательность: 1.90 (шкала Полинга)
Атомный радиус : 128 пм (эмпирические данные)
Ковалентный радиус : 132 ± 4 пм
Сродство к электрону : 140 пм
Энергия первой ионизации : 745,5 кДж / моль
2-я энергия ионизации : 1957,9 кДж / моль
3-я энергия ионизации : 3555 кДж / моль
Степени окисления : Наиболее распространенная степень окисления +2. Медь также имеет степени окисления -2, +1, +3 и +4.
10 Фактов о меди
- Медь встречается в чистом или самородном виде. (Джонатан Зандер)
Медь – один из немногих металлов, который существует в относительно чистой форме в природе или в самородном состоянии. Вот как это работал древний человек. Ледяной человек Эци, живший примерно в 3300 г. до н.э., был найден с топором с головой, состоящей из почти чистой меди. Его волосы содержали высокий уровень мышьяка, токсичного элемента, используемого при плавке меди.
- Цвет меди уникален среди элементов.Большинство металлов имеют серебристый или серый цвет. Золото и некоторые другие металлы желтого цвета. Только медь имеет красновато-металлический блеск. Когда медь добавляется к другим металлам, она может добавить красный цвет. Так делают розовое золото.
- Медь имеет множество применений. В электропроводке используется чистый металл. Латунь (медь и цинк) и бронза (медь и олово) – два важных медных сплава. Медь используется для изготовления сантехники, монет и кухонной посуды. При добавлении в воду бассейна соли меди (не хлор) могут обесцветить волосы и придать им зеленый оттенок.
- Медь необходима для питания человека, особенно для образования клеток крови. Этот элемент естественным образом встречается в большинстве источников воды и в пищевых продуктах, таких как картофель, бобы, листовая зелень и зерно. Избыток меди вызывает желтуху и анемию, а моча может стать синей.
- Хотя медь необходима для человека и других позвоночных, большинство беспозвоночных плохо переносят ее соли. Медь также обладает естественными антибактериальными свойствами. Вот почему металлические дверные ручки из латуни или бронзы уменьшают передачу болезней.Медь также токсична для водорослей.
- Медь легко перерабатывается. Около 80% добытой на сегодняшний день меди остается в обращении. Металл содержится в земной коре в изобилии, его концентрация составляет в среднем 50 частей на миллион. Медь занимает третье место после железа и алюминия по количеству металла, используемого в Соединенных Штатах.
- В то время как наиболее распространенная степень окисления меди – +2, состояние +1 встречается во многих соединениях. Один из простых способов определить состояние ионизации элемента – провести испытание пламенем.Медь (II) превращает пламя в зеленый цвет, а медь (I) – в синий.
- Как и многие переходные металлы рядом с ней в периодической таблице, медь пластична, податлива, отлично проводит тепло и электричество, а также устойчива к коррозии. Он относительно мягкий и в конечном итоге окисляется, образуя зеленую зелень. Окисление является причиной того, что многие латунные и бронзовые статуи с возрастом становятся зелеными, а при ношении недорогих украшений часто вызывает изменение цвета кожи.
- Большая часть добываемой меди извлекается из сульфидных медных руд.Крупные производители включают Чили, США, Индонезию и Перу.
- Как известно, цена на медь нестабильна. Его минимум за 60 лет составлял 0,60 доллара за фунт (1,32 доллара за кг) в 1999 году и 4,63 доллара за фунт в 2011 году.
Узнайте больше об элементах в таблице Менделеева.
Элемент месяца – медь
«В честь Международного года Периодической таблицы элементов этой серии статей подробно рассматривается проект Элемент месяца , разработанный Стивеном У.Райт (SWW), младший научный сотрудник Pfizer Inc., и Марша Р. Фолджер (MRF), учитель химии (сейчас на пенсии) в средней школе Лайма – Олд Лайм в Коннектикуте. Прочтите «Элемент месяца – введение », чтобы получить обзор проекта и ссылки на другие статьи из этой серии ». – Редактор
В феврале мы вернемся к более знакомым элементам и подробно обсудим металлический элемент с изучением меди. Это позволяет нам перейти к обсуждению ряда активности металлов и продемонстрировать реакционную способность различных металлов, обусловленную их окислительными потенциалами.Химия меди, конечно же, красочна, что добавляет удовольствия от этих экспериментов.
Использует
Студенты обычно хорошо знают, что медь используется в чеканке монет, кухонной посуде, кровле, сантехнике и электрических проводниках. Отметим, что медь часто легируется цинком для образования латуни, популярного декоративного сплава, и оловом, чтобы получить бронзу, которая тверже и менее подвержена коррозии, чем латунь или медь, и часто используется для изготовления деталей для кораблей, таких как гребные винты.Мы упоминаем, что соединения меди используются в качестве фунгицидов и альгицидов. На столе выставлены банка с пенни, обрезок медной трубы и несколько фитингов, обрезок медного электрического кабеля, обрезок меди, кусок медной посуды, латунная дверная ручка и кусок обработанного давлением. древесина.
Физические свойства
Студенты часто знакомы с медью как с красноватым, умеренно плотным мягким металлом. Мы отмечаем, что медь является одновременно ковкой и пластичной, и объясняем, что эти термины означают, что ей легко придать форму путем удара молотком или вытягивания через матрицу.Мы отмечаем, что не все металлы являются такими, поскольку железо, очевидно, труднее придать форму. Медь – отличный проводник как электричества, так и тепла.
Рисунок 1: Слева направо: раствор сульфата меди II, раствор сульфата меди II плюс небольшое количество NH 4 OH, осаждающий Cu (OH) 2 , раствор сульфата меди II плюс избыток NH 4 OH, что приводит к растворению Cu (OH) 2 и образованию дикатиона Cu (NH 3 ) 4 .
Химические свойства
Мы начинаем с утверждения, что медь является относительно инертным или трудно поддающимся окислению металлом. Вот почему это так полезно. Нам не нужны крыши, монеты, трубы и провода, которые легко подвержены коррозии. Мы демонстрируем качественный аналитический тест на ион меди, обрабатывая некоторый раствор сульфата меди 2 М раствором гидроксида аммония в большой пробирке. Мы показываем начальное образование синего осадка Cu (OH) 2 , за которым следует растворение осадка при дальнейшем добавлении раствора гидроксида аммония с образованием темно-синего комплексного иона Cu (NH 3 ) 4 2 + (см. Рисунок 1). 1 Мы также продемонстрировали цвет пламени меди, используя 0,2 M раствор хлорида меди (см. Видео 1). Этот раствор дает гораздо более яркий цвет пламени, чем сульфат меди. 2 Мы упоминаем, что медь образует множество комплексов, не только с аммиаком, поэтому химия меди так разнообразна. Например, мы показываем и сравниваем образцы безводного и гидратированного сульфата меди. Затем мы добавляем несколько капель воды к безводному сульфату меди, чтобы показать гидратацию безводного сульфата меди с образованием синего иона Cu (H 2 O) 4 2+ .Мы особенно отмечаем изменение цвета с белого на синий, который по совпадению является школьным цветом нашей старшей школы. Затем мы готовим 0,2 М раствор хлорида меди, растворяя 17 г дигидрата CuCl 2 в 500 мл воды, содержащей 10 мл концентрированной соляной кислоты (HCl предотвращает возможный частичный гидролиз CuCl 2 с образованием нерастворимого Cu (OH). 2 ). Мы сливаем 200 мл этого раствора в отдельную колбу и показываем, что ион меди также образует комплекс с хлорид-ионом, добавляя большой избыток безводного хлорида кальция (25 г).Дополнительный хлорид-ион способствует смещению равновесия от синего иона Cu (H 2 O) 4 2+ к зеленому иону CuCl 4 2+ . 3 Цвета химического состава меди делают его забавным, а низкая реакционная способность металла делает его полезным.
Видео 1: Цвета элементов в пламени – хлорид меди (II). Источники: Ф. М. Гастингс, Дж. Дж. Якобсен. Получено от Jacobsen, Jerrold J .; Мур, Джон В., Химия оживает !, Vol. 2; Журнал химического образования, 2000, 77 (5), 671.DOI: 10.1021 / ed077p671. *
Затем мы спрашиваем класс, растворяется ли металлическая медь в соляной кислоте. Продемонстрируем реакцию образцов медной, железной, цинковой и алюминиевой проволоки с 6 М соляной кислотой в больших пробирках. Сначала мы даем возможность образцам проволоки реагировать при комнатной температуре, а затем кратковременно нагреваем каждую трубку по очереди, помещая трубку в большой стакан с очень горячей водой (Примечание: важно убедиться, что образцы медной и железной проволоки не подвержены коррозии. или потускнение, и что на железной проволоке нет жира или масла).Мы объясняем, что металлическая медь растворяется только в окисляющих кислотах, таких как сильная серная кислота или азотная кислота, и напоминаем им об эксперименте Айры Ремсен, который мы провели в ноябре и который описан в разделе «Элемент месяца: азот» (см. Видео 2).
Видео 2: Несколько капель концентрированной азотной кислоты помещены на медный пенни до 1982 года. Источники: Jacobsen, Jerrold J .; Мур, Джон В., Химия оживает !, Vol. 3; Журнал химического образования, 1999 (76) 9 1311.DOI: 10.1021 / ed076p1311. *
Основываясь на реакциях образцов проволоки с соляной кислотой, мы спрашиваем класс: Какой металл наиболее реакционноспособен? Какой наименее реактивный? Что находится посередине? Мы пишем список на доске в порядке реакции, от наименьшей к наибольшей в зависимости от выбора учащихся. Мы спрашиваем: «Существуют ли какие-либо металлы, которые менее реактивны, чем медь? Обычно студенты вскоре предложат серебро, золото и, возможно, платину. Мы добавляем эти металлы в наш список на доске.Затем мы спрашиваем класс, : «Что произойдет, если мы поместим металл, который более активен, чем медь, в раствор соединения меди?» Мы демонстрируем это, растворяя 25 г дигидрата CuCl 2 в 500 мл воды в химическом стакане при быстром перемешивании на магнитной мешалке, а затем добавляем в химический стакан 5 г алюминиевых гранул размером 20 меш. 4 Продолжаем быстро помешивать и отмечаем явную теплоту реакции. Когда реакция стихает, мы фильтруем смесь через большую гофрированную фильтровальную бумагу и отмечаем бесцветный фильтрат, содержащий хлорид алюминия, и фильтровальную бумагу, содержащую осажденную металлическую медь.Затем мы спрашиваем класс, : «А как насчет обратной реакции – превращения меди в раствор алюминия?» Большинство студентов сразу предложат, что никакой реакции не ожидается. Мы помещаем образец медной фольги в разбавленный раствор сульфата алюминия в большой пробирке и спрашиваем класс, следует ли приостановить действие «Элемент месяца» до тех пор, пока не будет наблюдаться реакция. Хор «Нет!» результата и мы идем дальше.
Рисунок 3: Гвозди до (слева) и после (справа) воздействия 0.2 M раствор CuCl 2 примерно на 10 минут.
Мы спрашиваем, “что может случиться, если мы будем использовать менее химически активный металл, такой как железо, с нашим раствором хлорида меди?” Мы помещаем три или четыре чистых стальных гвоздя в какой-то 0,2 М раствор хлорида меди в химическом стакане. Обычные гвозди «четыре пенни» работают хорошо, но их необходимо очистить от жира, используя полотенце и немного растворителя для краски или скипидара. Через минуту или две сливаем раствор хлорида меди и кладем ногти на бумажное полотенце (см. Рисунок 3).Они покрыты красно-коричневым налетом металлической меди. Затем мы спрашиваем, что может случиться, если мы пойдем другим путем и добавим менее химически активный металл, такой как серебро, в раствор меди. Класс снова правильно угадает, что никакой реакции ожидать не стоит. Мы подтверждаем это, помещая кусок серебряной фольги в раствор сульфата меди (мы не используем раствор хлорида меди, потому что ион хлорида может потускнуть поверхность серебра). Хорошо, мы спрашиваем, “что может случиться, если мы поместим металлическую медь в раствор серебра?” К настоящему времени класс выполняет задачу и правильно предложит реакцию.Мы помещаем кусок медной фольги в 0,1 М (или 5%) раствор нитрата серебра в большой пробирке и показываем быстрый рост частиц серебра на поверхности медной фольги. 5 Наконец, мы спрашиваем класс, как мы можем заставить металлическую медь осаждаться на серебре, фактически заставляя реакцию идти «в обратном направлении»? Это, конечно, может быть достигнуто только путем подачи энергии в систему в виде электрической энергии. Мы показываем, что мы можем гальванизировать медь на серебро, используя стакан, содержащий 0.2 M раствор сульфата меди, подкисленный небольшим количеством разбавленной серной кислоты с использованием анода из медной фольги и катода из серебряной фольги с приложенным постоянным током около 3 вольт. 6 На серебряной фольге быстро появляется коричневый налет меди. Наконец, мы спрашиваем класс, что произойдет, если мы запустим ячейку в обратном направлении. Мы меняем полярность ячейки, и медный налет почти волшебным образом исчезает с серебряной фольги. 7
* * другие видео из ChemEd X Collection доступны по подписке.
Примечания и ссылки:
См., Например, Engelder, C.J .; Dunkelberger, T. H .; Шиллер, У. Дж. Полумикро качественный анализ; Wiley: Нью-Йорк, 1936; С. 122.
- Цветовое излучение сигнатуры вызывается возбуждением хлорида металла; см., например: (a) Lancaster, R .; Shimizu, T .; Батлер, Р. Э. А .; Холл, Р. Дж. Фейерверк: Принципы и практика Химического издательства: Нью-Йорк, 1972; pp 60; (b) Конклинг, Дж. Р. Химия пиротехники Марсель Деккер: Нью-Йорк, 1985; С. 155 – 166.
- Этот эксперимент модифицирован из (a) Summerlin, Lee R .; Или, Джеймс Л. Младший. Химические демонстрации: Справочник для учителей; Американское химическое общество: Вашингтон, округ Колумбия, 1985; стр 54 – 55; и (b) Summerlin, Lee R .; Borgford, Christie L .; Или, Джули Б. Химические демонстрации: Справочник для учителей Том 2, 2-е изд .; Американское химическое общество: Вашингтон, округ Колумбия, 1988 г .; pp 71 – 72. Мы используем безводный хлорид кальция вместо концентрированной соляной кислоты, чтобы избежать коррозии смеси, одновременно вызывая повышение температуры и высокую концентрацию хлорид-иона.
- Это модификация Summerlin, Lee R .; Borgford, Christie L .; Или, Джули Б. Химические демонстрации: Справочник для учителей Том 2, 2-е изд .; Американское химическое общество: Вашингтон, округ Колумбия, 1988 г .; pp 202. Можно использовать пятнадцать граммов металлического гранулированного цинка размером 30 меш, если гранулированный алюминий недоступен. В качестве альтернативы можно использовать три грамма алюминиевой фольги, нарезанной на маленькие кусочки площадью около 3 мм.
- Демонстрация серебряной «листвы» на «дереве» из медной фольги популярна уже много лет, см .: Ford, Leonard A.Химическая магия, 2-е изд .; Дувр: Минеола, Нью-Йорк, 1993; С. 82.
- См. Шакашири, Бассам А. Химические демонстрации: Справочник для учителей, Vol. 4; University of Wisconsin Press: Мэдисон, Висконсин, 1992; 212 – 223 стр.
- В этих экспериментах по нанесению гальванических покрытий важно использовать сульфат меди (II), а не хлорид меди (II) в качестве раствора электролита. Когда в конце демонстрации элемент вращается «назад» для удаления слоя меди с серебряной фольги, некоторое количество металлического серебра будет окисляться до иона серебра на аноде, и это приведет к образованию мутной суспензии AgCl, если медь (II ) хлорид.Раствор электролита бережем и используем из года в год.
← 29 → ↓ Переходный металл, масса: 63,546 ед., 2 стабильных изотопа (63, 65), степень распространенности (земля / космос): 25/25 Щелкните изображение, чтобы увеличить. Натуральный медный самородок, 44 грамма. Исходный размер в см: 1 x 2,5 x 3,5 Объявление Последнее изменение страницы: 24 апреля 2017 г. Водород, Дейтерий, Гелий, Литий, Бериллий, Бор, Углерод, Азот, Кислород, Фтор, Неон, Натрий, Магний, Алюминий, Кремний, Фосфор, Сера, Хлор, Аргон, Калий, Кальций , Скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром, криптон, рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций, рутений, родий , Палладий, серебро, кадмий, индий, олово, сурьма, теллур, йод, ксенон, цезий, барий, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттрий , Лютеций, гафний, тантал, вольфрам, рений, осмий, иридий, платина, золото, ртуть, таллий, свинец, висмут, полоний, астатин, радон, франций, радий, актиний, торий, протактиний, уран, нептуний, плутоний, америций , Кюрий, берклий, калифорний, эйнштейний, фермиу м, Менделевий, Нобелий, Лоуренсий, Резерфордий
|| Лантаноиды, Актиноиды
|| Дом, Все, Мозаика, Игра на концентрацию, Знание, Свойства, Записи, Архивы, Острова стабильности, Светящиеся газы ↑ |
Факты о меди, символ, открытие, свойства, использование
Что такое медь
Медь (произношение KOP-er [2] ), представленная химическим символом или формулой Cu [1] , является мягким, податливым и пластичным элементом, принадлежащим к семейству переходных металлов [3, 4, 7 ] . Естественно, что Cu представляет собой смесь двух стабильных изотопов с массовыми числами 63 и 65 [1, 3] . Кроме того, он содержит 24 синтетических радиоактивных изотопа с известным периодом полураспада [3] . В нормальных условиях он стабилен на воздухе, но в раскаленном состоянии реагирует с кислородом с образованием его оксида. Он также реагирует с галогенами и кислотами [21] .
Медный символ
Где это находится
Металл в природе встречается редко. Его основные руды – минералы, такие как борнит и халькопирит.Cu выделяется из этих руд плавкой, выщелачиванием и электролизом [1, 3] .
Медный пенни
История
Происхождение названия: Название происходит от старого английского названия «coper», которое, в свою очередь, происходит от латинских слов «Cyprium aes», что означает металл с Кипра [1] .
Кто открыл медь: Неизвестно [1] .
Когда был обнаружен: В доисторические времена [1] .
Как было обнаружено
Исторически медь была первым металлом, обработанным людьми. Открытие того, что он может быть упрочнен добавлением олова для образования сплава бронзы, привело к названию бронзового века, когда его использовали для изготовления монет, столовых приборов и инструментов. Было обнаружено, что медным бусам, найденным при раскопках в северном Ираке, более десяти тысяч лет [1] .
Медь
Медная идентификация | |||
| Атомный номер | 29 [1] | ||
| Номер CAS | 7440-50-8 [1] | ||
| Позиция в таблице Менделеева | Группа | Период | Блок |
| 11 [1] | 4 [1] | d [1] | |
Где медь в Периодической таблице
Свойства и характеристики меди
Общая недвижимость | ||
| Атомная масса | 63.546 атомных единиц массы [1] | |
| Атомный вес | 63,546 [1] | |
| Массовое число | 63 [3] | |
| Молярная масса / молекулярная масса | 63,546 г / моль [20] | |
Физические свойства | ||
| Цвет / внешний вид | Оранжево-красный [3] | |
| Глянец | Яркий металлик [3] | |
| Точка плавления / замерзания | 1084.62 ° C, 1984,32 ° F [1] | |
| Точка кипения | 2560 ° C, 4640 ° F [1] | |
| Плотность | 8,96 г см -3 [1] | |
| Состояние вещества при комнатной температуре (нормальная фаза) | Цельный [1] | |
| Теплопроводность | 385 Вт / (м · К) [8] | |
| Электропроводность | 5.96X10 7 См / м [9] | |
| Удельная теплоемкость | 0,385 Дж / г o C [10] | |
| Удельный вес | 8,89 [11] | |
| Удельное сопротивление | 1.72X10 -8 Ом-м [12] | |
| Твердость (шкала Мооса) | 3 [13] | |
| Предел текучести | 40-80 МПа [14] | |
| Предел прочности | 200 МПа [14] | |
| Температурный коэффициент | +0.393% / o C [15] | |
| Коэффициент линейного расширения | 17X10 -6 / o C [16] | |
Химические свойства | ||
| Степени окисления / ионный заряд | 2, 1 [1] | |
| Воспламеняемость | № [17] | |
Магнитные свойства | ||
| Магнитный заказ | Диамагнитный [18] | |
Атомные данные меди (элемент 29)
| Валентные электроны | 1 или 2 [5] | |||||||
| Валентность | +1, +2 [6] | |||||||
| Квантовые числа | ||||||||
| – № | 3 [7] | |||||||
| – | ℓ2 [7] | |||||||
| – м ℓ | 2 [7] | |||||||
| – м с | -½ [7] | |||||||
| Электронная конфигурация (конфигурация благородного газа) | [Ar] 3d 10 4s 1 [1] | |||||||
| Кристаллическая структура | Гранецентрированный кубик [4] | |||||||
| Постоянная решетки | 361.49, 361,49, 361,49 вечера [19] | |||||||
| Атомная структура | ||||||||
| – Количество электронов | 29 [3] | |||||||
| – Количество нейтронов | 34 [3] | |||||||
| – Число протонов | 29 [3] | |||||||
| Уровни энергии [3] | ||||||||
| – Первый уровень энергии | 2 | |||||||
| – Второй энергетический уровень | 8 | |||||||
| – Третий уровень энергии | 18 | |||||||
| – Четвертый уровень энергии | 1 | |||||||
| Радиус атома | ||||||||
| – Атомный радиус | 1.96 Å [1] | |||||||
| – Ковалентный радиус | 1,22 Å [1] | |||||||
| Электроотрицательность (шкала Полинга) | 1,90 [1] | |||||||
| Энергия ионизации (кДжмоль -1 ) [1] | 1-й | 2-я | 3-я | 4-я | 5-я | 6-й | 7-й | 8-й |
| 745.482 | 1957,919 | 3554.616 | 5536,33 | 7699,5 | 9938 | 13411 | 16017 | |
Медно-электронная конфигурация (модель Бора)
Применение меди
- Обычно используется для изготовления монет [1] .
- Для электрического оборудования, такого как двигатели и электропроводка, из-за его высокой электрической и теплопроводности [1] .
- Для строительных целей (например, сантехника и кровля) и промышленного оборудования (например, теплообменников) [1] .
- Сульфат меди находит широкое применение в качестве сельскохозяйственного яда и альгицида при очистке воды [1] .
- Соединения меди, например, раствор Фелинга, используются в химических тестах на обнаружение сахара [1] .
Медная посуда
Это опасно
Хотя этот элемент необходим для всех растений и животных, его избыток токсичен. Приготовление кислой пищи в медной посуде может вызвать отравление. Вот почему медная посуда должна быть покрыта футеровкой, чтобы предотвратить попадание опасной вердигри (соединений, образующихся в результате коррозии меди).Взрослому человеку ежедневно требуется около 1,2 миллиграмма меди [1, 3] . Вы можете предотвратить дефицит меди, употребляя продукты с высоким содержанием меди, такие как цельнозерновые, орехи, бобы, картофель, устрицы и другие моллюски [22] .
Медный провод
Интересные факты
- В отличие от людей, которые используют железо, содержащееся в гемоглобине крови, для переноса кислорода в свои тела, некоторые ракообразные используют комплексы меди [1] .
- Поверхность меди на воздухе постепенно тускнеет до тусклого коричневатого цвета [3] .
Медь металлическая
Стоимость меди (элемент Cu)
Чистый металл продается по цене 9,76 доллара за каждые 100 грамм, а оптом – 0,66 доллара [3] .
Список литературы
- http://www.rsc.org/periodic-table/element/29/copper
- https://education.jlab.org/itselemental/ele029.html
- https://www.chemicool.com/elements/copper.html
- https://www.lenntech.com/periodic/elements/cu.htm
- https://environmentalchemistry.com/yogi/periodic/Cu.html
- https://www.enotes.com/homework-help/valency-copper-585843
- http://chemistry-reference.com/q_elements.asp?Symbol=Cu
- http://hyperphysics.phy-astr.gsu.edu/hbase/Tables/thrcn.html
- https://www.oughttco.com/table-of-electrical-resistivity-conductivity-608499
- http://www.iun.edu/~cpanhd/C101webnotes/matter-and-energy/specificheat.html
- https: // www.engineeringtoolbox.com/specific-gravity-solids-metals-d_293.html
- https://www.electronics-tutorials.ws/resistor/resistivity.html
- http://periodictable.com/Properties/A/MohsHardness.v.html
- https://www.kupferinstitut.de/en/materials/material-properties/copper.html
- https://www.cirris.com/learning-center/general-testing/special-topics/177-temperature-coefficient-of-copper
- http://hyperphysics.phy-astr.gsu.edu/hbase/Tables/thexp.html
- https: // www.teck.com/media/2015-Products-Copper_Metal_SDS_-_2.1.1.pdf
- https://www.quora.com/Is-copper-mintage
- http://periodictable.com/Properties/A/LatticeConstants.html
- https://www.webqc.org/molecular-weight-of-Cu.html
- https://www.webelements.com/copper/chemistry.html
- https://medlineplus.gov/ency/article/002419.htm
Медь Элемент – Медь и посуда для дома
Я, должно быть, знал, что медь – это что-то удивительное, когда я использовала ее в качестве одного из цветов для украшения своей свадьбы в 2006 году.Это было до того, как использование металлика на свадьбах считалось модным, поэтому я чувствовал себя далеко впереди тренда, используя как бы медь.
Но что делает медь такой фантастической на чистом, элементарном уровне? Что делает его таким идеальным проводником тепла или прекрасным металлом?
Во-первых, давайте начнем с меди в таблице Менделеева, и это материаловедение.
Атомный номер меди на столе – 29, а его символ – Cu (чего я никогда не понимаю, так как в слове «медь» нет буквы «u»… это все равно, что иметь аббревиатуру штата США, которая не полностью совпадает).-6. Чистая медь считается очень мягкой по шкале твердости С по Роквеллу и относится к категории «цветные металлы», что означает, что она не содержит никаких молекул железа.
Уф. Так что, если эта информация вам помогла, милости просим. Я чувствую себя умнее, просто записывая все в одном месте!
Медь по сравнению с другими металлами не обладает высокой реакционной способностью. Это означает, что он не реагирует на другие природные элементы так, как, например, железо. Атаки кислорода и водорода (или воды, если на то пошло) обычно бесполезны – медь необходимо нагреть как минимум до 300 ° C, чтобы изменить ее молекулярный состав и превратить ее в оксид меди.С другой стороны, железо просто нужно подвергнуть воздействию воздуха, чтобы образовался оксид железа (он же ржавчина).
Медь может превращаться / связываться с другими металлами с обменом электронами. Элементы постоянно образуют ковалентные связи между другими элементарными атомами (когда элемент может делить электроны с другим атомом) или теряют электроны, чтобы стать положительно заряженными. Когда это происходит, потерянные электроны перемещаются к другому элементу, который затем заряжается отрицательно (этот класс естественных наук еще не вернулся к вам?), Создавая электрическое (как магнит) притяжение между двумя атомами, которое называется ионным. связь.
Большинство металлических элементов / атомов теряют электроны, когда они образуют ионные связи с другими элементами. Однако медь уникальна тем, что может образовывать две ионные связи. То есть, когда происходит обмен электронами и атом становится менее стабильным, он может соединяться с другими элементами (например, с кислородом) двумя способами вместо одного. Это означает, что глубокие молекулярные изменения могут происходить все быстрее и быстрее, когда медь вступает в контакт с другими элементами. Возьмем, к примеру, предмет, лежащий на улице под дождем.Это изделие из латуни (содержащее медь), и во время дождя кислород и углекислый газ создают карбонат меди, поскольку медь реагирует с дождем разными способами. Изделие из латуни покрыто зеленоватым карбонатом меди, что защищает изделие от дальнейшей коррозии.
Для всех вышеперечисленных чисел медь, конечно же, не получается из Матери-Земли такой чистой и красивой. Мы должны его добывать, и получается медная руда, которая обычно содержит только 1% металла, поэтому руду нужно плавать.Нефтеперерабатывающие заводы измельчают руду, смешивают ее с водой, а затем пропускают через резервуары, заполненные водой. Химические вещества, используемые в воде, образуют пену, которая улавливает медные минералы на поверхности, чтобы их можно было удалить, оставив оставшуюся руду. . Это та часть, где тип химикатов (или их отсутствие) может определять, как медь раскисляется, или может ли она превратиться в сплав меди вместо того, чтобы оставаться чистой. В готовом «продукте» этого процесса сейчас около 25-35% меди, которая отправляется на плавку.
В плавильном производстве для окончательной очистки меди используются высокие температуры. На первом этапе из руды удаляется больше меди, нагревая ее газообразным кислородом. После этого «черновая» медь проходит стадию огневого рафинирования и электролитического рафинирования, в результате чего получается медь чистотой 99,99%.
Когда у вас есть чистая медь, связывающие способности этих электронов находятся на очень высоком пике. Медь проводит тепло почти на идеальном уровне 386, и она способна легко связываться с серебром или оловом (в зависимости от химических веществ / элементов, используемых для извлечения меди из руды – некоторые из них фактически препятствуют связывающей способности меди), создавая молекулярная связь, которая сохраняется, по крайней мере, в посуде, в течение значительного периода времени.
И это, все, что наука объединила в одном месте, вероятно (теперь, когда я знаю о меди гораздо больше, чем на свадьбе) делает медную посуду для меня такой невероятно крутой (и, конечно же, красивой).
Влияние существующей формы элемента Cu на механические свойства, биокоррозионные и антибактериальные свойства сплавов Ti-Cu для биомедицинского применения
Основные моменты
- •
Существующая форма Cu влияет на механические, коррозионные и антибактериальные свойства .
- •
Cu проявляла сильную упрочняющую способность и антибактериальные свойства.
- •
Ti 2 Cu играет ключевую роль в сильных антибактериальных и механических свойствах.
- •
Высокое содержание Cu и тонкий Ti 2 Cu обладает антибактериальными и механическими свойствами.
Реферат
Сплавы Ti-Cu проявили сильную антибактериальную способность, но сплавы Ti-Cu, полученные с помощью различных процессов, показали разную антибактериальную способность.Чтобы выявить механизм управления, в этой статье были приготовлены сплавы Ti-Cu с различными существующими формами элемента Cu. Систематически исследовалось влияние существующей формы Cu на микроструктуру, механические, коррозионные и антибактериальные свойства сплавов Ti-Cu. Результаты показали, что литые сплавы Ti-Cu показали более высокую твердость и механическую прочность, а также более высокую степень антибактериальности (51–64%), но относительно более низкую коррозионную стойкость, чем чистый титан.Обработка при 900 ° C / 2 ч (T4) значительно повысила твердость и прочность, улучшила коррозионную стойкость, но мало повлияла на антибактериальные свойства. Обработка при 900 ° C / 2 часа + 400 ° C / 12 часов (T6) дополнительно повысила твердость и механическую прочность, улучшила коррозионную стойкость, а также значительно повысила уровень антибактериальности (> 90%). Было продемонстрировано, что элемент Cu в состоянии твердого раствора показал высокую упрочняющую способность, но низкую антибактериальную способность, тогда как элемент Cu в фазе Ti 2 Cu проявил сильную упрочняющую способность и сильные антибактериальные свойства.


 )
БПК – безгалогенная полимерная композиция (один из новейших нетоксичных материалов не содержащих хлор, но есть минус: высокая по сравнению с ПВХ выделение тепла при горении.)
)
БПК – безгалогенная полимерная композиция (один из новейших нетоксичных материалов не содержащих хлор, но есть минус: высокая по сравнению с ПВХ выделение тепла при горении.)
 56 кг.
56 кг.
