Элемент cu: Медь — Википедия
alexxlab | 27.08.2020 | 0 | Разное
Медь (Cu, Cuprum) – влияние на организм, польза и вред, описание
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).

Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.

Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Общая характеристика меди, цинка, хрома, железа
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
+26Fe [Ar]3d64s2 [Ar] 4s  3d
3d 
У атома цинка на происходит полное заполнение 3d-подуровня:
+30Zn [Ar]3d104s2 [Ar] 4s  3d
3d 
У атомов хрома и меди наблюдается «проскок» или «провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень. Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d

| Элемент | Электронная конфигурация валентной зоны | |
| Теоретическая | Реальная | |
| Медь +29Cu | [Ar]3d104s1 [Ar] 4s | |
| Хром +24Cr | [Ar]3d 54s1 [Ar] 4s | |
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.

| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d54s1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d64s2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d104s1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d104s2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:

| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Хром | 51,996 | +24 | 1,66 | 0,130 | 652,4 | 1856,9 | 7,19 |
| Железо | 55.845 | +26 | 1.83 | 0,126 | 759,1 | 1538,85 | 7,874 |
| Медь | 63,546 | +29 | 1,90 | 0,128 | 745,0 | 1083,4 | 8,92 |
| Цинк | 65,38 | +30 | 1,65 | 0,138 | 905,8 | 419,6 | 7,133 |
Свойства соединений железа, меди, цинка и хрома.
Для
Характерные степени окисления железа: +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
| Элемент | Степень окисления | Тип и формула оксида | Тип и формула гидроксида | Окислительно-восстановительные свойства |
| Хром | +2 | CrO, основный | Cr(OH)2, основание | восстановитель, слабый окислитель |
| Cr2O3, амфотерный | Cr(OH)3, амфотерный гидроксид | окислитель и восстановитель | ||
| +6 | CrO3, кислотный | H2CrO4 и H2Cr2O7, кислоты | окислитель | |
| Железо | +2 | FeO, основный | Fe(OH)2, основание | восстановитель и слабый окислитель |
| +3 | Fe2O3, амфотерный | Fe(OH)3, амфотерный гидроксид | окислитель, очень слабый восстановитель | |
| Медь | +1 | Cu2O, основный | CuOH, основание | восстановитель и слабый окислитель |
| +2 | CuO, основный | Cu(OH)2, основание | окислитель | |
| Цинк | +2 | ZnO, амфотерный | Zn(OH)2, амфотерный гидроксид | слабый окислитель |

Переходные элементы Cu,Zn,Cr,Fe. Характеристика.
Медь Cu, цинк Zn, железо Fe и хром Сr относятся к переходным металлам, являются представителями d-элементов. В таблице Менделеева находятся в побочных (Б) подгруппах.
Медь
Медь Cu расположена в IБ группе IV-го периода. Электронная конфигурация внешнего энергетического уровня записывается как 3d104s1, в ее случае наблюдается, так называемый, «проскок электрона». Наиболее устойчивая степень окисления меди равна +2, но встречаются также и соединения, содержащие медь в степени окисления +1. Медь образует оксиды Сu2О и СuО, которым соответствуют гидроксиды СuОН и Сu(ОН)2. Оксид и гидроксид меди (I) – Сu2О и СuОН обладают основными свойствами, в то время как оксид меди (II) СuО и гидроксид меди (II) Cu(ОН)2 являются амфотерными, с преобладанием основных свойств.
Цинк
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможно только одна единственная степень окисления равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Хром
Химический элемент хром Cr находится в VIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов хрома в основном состоянии 3d54s1 . Как и в случае с медью, здесь также наблюдается «проскок» электрона. Для хрома кроме нуля возможны три степени окисления: +2, +3 и +6. Повышение степени окисления хрома приводит к возрастанию его кислотных свойств, или, что то же самое, уменьшению основных. Оксид хрома (II) СгО проявляет основные свойства – ему соответствует основание Сг(ОН)2, оксид хрома (III) Сг2О3 обладает амфотерными свойствами – ему соответствует амфотерный гидроксид хрома (III) Сг(ОН)3, а вот оксид хрома (VI) СгО3 — типичный кислотный оксид, ему соответствуют сразу две сильных кислоты — хромовая Н2СгО4, и дихромовая Н2Cr2О7. Наиболее устойчивой является степень окисления +3. Соединения, содержащие хром в степени окисления +2 являются сильными восстановителями, а соединения хрома (VI) — сильными окислителями.
Железо
Железо Fe находится в VІIIБ группе IV-го периода. Электронная конфигурация внешнего электронного слоя в основном состоянии 3d64s2. В соединениях железо может проявлять степени окисления равные +2, +3 и +6. Наиболее устойчивой является степень окисления железа +3, соединения, содержащие железо в степени окисления +6 являются крайне сильными окислителями и относительно устойчивы только в сильнощелочных средах. Оксида и гидроксид железа (II) FeО и железа (II) Fe(ОН)2 обладают основными свойствами; в то время, как оксид железа (III) Fe2О3 и гидроксид железа (III) Fe(ОН)3 проявляют некоторые амфотерные свойства с преобладанием основных.
Алфавитный список химических элементов – это… Что такое Алфавитный список химических элементов?
- Алфавитный список химических элементов
Алфавитный список химических элементов.
Wikimedia Foundation. 2010.
- Дрейф
- Круизное судно
Смотреть что такое “Алфавитный список химических элементов” в других словарях:
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
Список химических элементов по атомным номерам — См. также: Список химических элементов по символам и Алфавитный список химических элементов Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в… … Википедия
ISO 4217 — (ИСО 4217) Коды для представления валют и фондов Codes for the representation of currencies and funds (англ.) Codes pour la représentation des monnaies et types de fonds (фр.) … Википедия
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Хронология изобретений — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Изобретения человека — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Изобретения — Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Русские — У этого термина существуют и другие значения, см. Русские (значения). Русские … Википедия
1: — Терминология 1: : dw Номер дня недели. «1» соответствует понедельнику Определения термина из разных документов: dw DUT Разность между московским и всемирным координированным временем, выраженная целым количеством часов Определения термина из… … Словарь-справочник терминов нормативно-технической документации
Список химических элементов – это… Что такое Список химических элементов?
Список химических элементов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Латинское название | Период, группа | Атомная масса (г/моль) | Плотность (г/см³) при 20 °C | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Ftorum, Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorum | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfurum | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum, Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lantanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Prasaeodymum | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymum | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Prometium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolfrahmium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum, Wismatum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Asthatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berklium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium, Mendeleevium, Mendeleievium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | Lawrencium, Laurentium | 7, 3 | [260,1053][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [261,1087][5] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | Dubnium | 7, 5 | [262,1138][5] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [263,1182][5] | 1974 | Флёров | |||
| 107 | Борий | Bh | Bohrium | 7, 7 | [262,1229][5] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | Hassium | 7, 8 | [265][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [266][5] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [269][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [272][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][5] | 2004 | ОИЯИ (*), LLNL (*) | ||||
| 114 | Флеровий | Fl | Flerovium, Fliorovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][5] | 2004 | ОИЯИ, LLNL | ||||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [292][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Унунсептий | Uus | 7, 17 | [295][5] | 2010 | ОИЯИ | ||||
| 118 | Унуноктий | Uuo | 7, 18 | [294][5] | 2004 | ОИЯИ |
Аббревиатуры
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research)
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
№ элемента | Химический знак | Название элемента | Электронная формула |
1 | H | водород | 1s1 |
2 | He | гелий | 1s2 |
II период | |||
3 | Li | литий | 1s22s1 |
4 | Be | бериллий | 1s22s2 |
5 | B | бор | 1s22s22p1 |
6 | C | углерод | 1s22s22p2 |
7 | N | азот | 1s22s22p3 |
8 | O | кислород | 1s22s22p4 |
9 | F | фтор | 1s22s22p5 |
10 | Ne | неон | 1s22s22p6 |
III период | |||
11 | Na | натрий | 1s22s22p63s1 |
12 | Mg | магний | 1s22s22p63s2 |
13 | Al | алюминий | 1s22s22p63s23p1 |
14 | Si | кремний | 1s22s22p63s23p2 |
15 | P | фосфор | 1s22s22p63s23p3 |
16 | S | сера | 1s22s22p63s23p4 |
17 | Cl | хлор | 1s22s22p63s23p5 |
18 | Ar | аргон | 1s22s22p63s23p6 |
IV период | |||
19 | K | калий | 1s22s22p63s23p64s1 |
20 | Ca | кальций | 1s22s22p63s23p64s2 |
21 | Sc | скандий | 1s22s22p63s23p64s23d1 |
22 | Ti | титан | 1s22s22p63s23p64s23d2 |
23 | V | ванадий | 1s22s22p63s23p64s23d3 |
24 | Cr | хром | 1s22s22p63s23p64s13d5 |
25 | Mn | марганец | 1s22s22p63s23p64s23d5 |
26 | Fe | железо | 1s22s22p63s23p64s23d6 |
27 | Co | кобальт | 1s22s22p63s23p64s23d7 |
28 | Ni | никель | 1s22s22p63s23p64s23d8 |
29 | Cu | медь | 1s22s22p63s23p64s13d10 |
30 | Zn | цинк | 1s22s22p63s23p64s23d10 |
31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 |
32 | Ge | германий | 1s22s22p63s23p64s23d104p2 |
33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 |
34 | Se | селен | 1s22s22p63s23p64s23d104p4 |
35 | Br | бром | 1s22s22p63s23p64s23d104p5 |
36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
V период | |||
37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 |
40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 |
48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
VI период | |||
55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
VII период | |||
87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
s-элементы | p-элементы | d-элементы | f-элементы |
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица Менделеева. Названия. Электронные формулы. Молярные массы. Структурные формулы. Таблицы степеней окисления и валентности. Изотопы. / / Таблица степеней окисления химических элементов. Максимальная и минимальная степень окисления. Возможные степени окисления химических элементов. Поделиться:
| ||||||||||||||||||||||||||
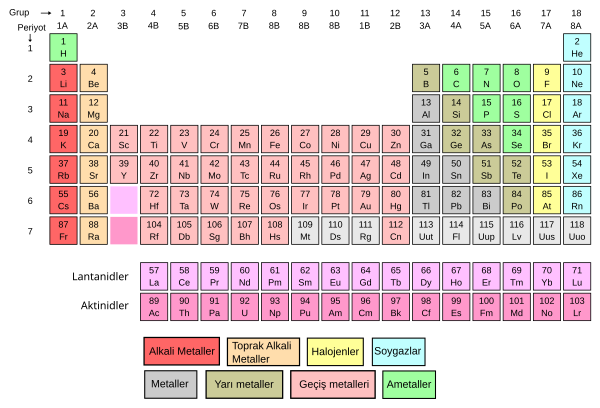
Bütün Elementlerin İsimleri, Sembolleri, Atom Numaraları ve Kütleleri Nedir? Elementlerin Grubu ve Periyodu
Bu Yazıda Okuyacaklarınız:
Sizden gelen soru:
İlk 30 elementin sembolü numarası ve ismi pliz?
Cevap:
Kimyasal Elementler
Element , aynı cins atomlardan oluşan, bileşim yoluyla elde edilemeyen ve kimyasal yollarla kendinden madilımürıan ve kimyasal yollarla kendinden málıırın ve kimyasal
Kimyasal elementlerin atom numaraları aynıdır. Бир atomdaki протон sayısını diğer bir tabirle çekirdek yükünü gösteren sayı atom numarasıdır. Buradan tanesi da anlaşılacağı üzere bir elementin atom sayısı kadar proton bulunur. Nötron satısı farklı ancak proton sayıları aynı olan atomlara ise izotop denir.

 Periyodik tablo
Periyodik tabloElementleri toplam sayısı 118’dir. Bu elementlerden 94 tanesi yeryüzünde doğal olarak bulunur. 80 tane element ise sabit izotopa sahiptir.Bu elementler ise atom numarası 1’den 82’ye kadar olan atomlardır. элементлер ise radyoaktif özelliklere sahiptirler. Bu elementlerin atom numarası 83’ten 94’e kadar olanlar kesinlikle sabit değillerdir.
Bütün Elementlerin Bilgileri
Kimyasal elementlerin tamamını aşağıdaki listede göreceksiniz. Bu listede yer alan bütün elementlerin; атом numaraları, ismi, sembolü, grup ве periyot numaraları gösterilmektedir. Grubu alanında numarası olmayan elementler ise IUPAC’ye göre grupsuz elementler olarak kabul edilir ve bunlara Lantanitler ve Aktinitler denir.
| Щелочной металл | Алкалин | Lantanit | Aktinit | Geçiş metalleri | Zayıf metaller | Metaloid | Ametal | Halojen | 57 Soygaz
Элемент Кимьясал – Википеди
Элемент , aynı cins atomlardan oluşan ве kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere verilen isimdir.
Ее farkli kimyasal element farklı atom numarasına sahiptir. Atom numarası atomdaki proton sayısını (çekirdek yükünü) gösteren sayıdır. Бир elementin böylece tüm atomlarında aynı sayıda протон Bulunur. Протон sayıları aynı, nötron sayısı (kütle numaraları [= протон sayısı + nötron sayısı]) farklı atomlara izotop denir.
Toplam 118 adet element bulunmuştur. Bunların 94 tanesi Dünya üzerinde doğal olarak bulunmaktadır. 80 adet element kararlı izotopa sahiptir. Bu elementler, номер атома 43 ве 61 (teknetyum ve prometyum) dışında atom numarası 1’den 82’ye kadar olan atomlardır. Atom numarası 83 ве daha fazlası olan atomlar (bizmut ve fazlası) kesinlikle kararli değildirler ве radyoaktif özellikler barındırırlar. Atom numarası 83’ten 94’e kadar olanlar kararlı değillerdir.
Bir element insan vücudunda yüzde miligram mertebesinde bulunursa bu elemente makroelement (majörelement, пластиковый элемент) denir.Diğerlerine nazaran daha az oranda (yüzde mikrogram mertebesinde) bulunanlara ise izelement (олигоэлемент, minörelement, каталитический элемент) adı verilir. Minörelementler genellikle enzim, гормон гиби vücutta önemli fonksiyonu olan maddelere bağlı olarak görev yaparlar.
İyon halinde bulunanlar [deiştir | kaynağı değiştir]
Na + , K + , Ca 2+ , Mg 2+ , Cl – , HCO 3 – , PO 4 3- , HPO 4 2- gibi iyonlar halinde bulunurlar.Электролит dengeyi sağlarlar. Ayrıca vücutta su dengesinin ve osmotik basıncın ayarlanması iyon halindeki elementlerle sağlanır.
Kompleks Halinde Bulunanlar [değiştir | kaynağı değiştir]
Hemoglobinde, miyoglobinde demir (Fe) bulunur, çeşitli enzimlerin yapısında da metal iyonları bulunmaktadır. Bunların haricinde silisyum (Si), alüminyum (Al), kalay (Sn) ve arsenik (As) de az miktarda bulunabilir. Kurşun (Pb) ве kadmiyum (Cd) да yiyecek kapları ве kirli hava ile vücuda girebilir.
.Элемент – Diyadinnet
 Элемент Недир?
Элемент Недир?
Kimyasal çözümlemeyle ayrıştırılamayan veya bireşim yoluyla elde edilemeyen maddeye element denir. Elementler Aynı cins atomlardan meydana gelen saf maddelerdir.
Elementlerin özellikleri
Elementler fiziksel ве kimyasal yollarla kendisinden daha basit maddelere ayrıştırılmazlar.
Elementlerin en küçük yapı taşları atomdur.
Elementler sembollerle gösterilir.
Elementler saf maddelerdir.
Elementleri öz kütleleri ve erime, kaynama noktaları sabittir.
Elementler tabiatta hem katı, hem sıvı hem de gaz halinde bulunurlar.
Saf ve homojen maddelerdir
Sabit öz kütleleri vardır.
Kullandıımız Elementler
Hidrojen, oksijen ve karbon vücudumuzu oluşturan başlıca elementlerdir. Diğerleri де аз miktarlarda olmasına rağmen yaşantımız için vazgeçilmez önemdedirler. Бу elementler yapımızda yer aldıkları gibi onları hayatımız boyunca doğadan sağlarız.Gerekli olmadıı halde birçok element vücudumuza girer. Ancak onları zararsız hale getirecek özelliklerimiz vardır. Genel olarak bakarsak yaşamamız için gereken element miktarının çok olmadığını görürüz. Selenyum çok önemlidir. Ама gereken dozun üstündeki miktar öldürücüdür. Canlı organismaların, kendilerine gereken maddeleri Hangi oranda alacağı evrim ile belirlenmiştir.
Aynı şekilde yararsız olan yabancı maddelere karşı direnç te gelişim sürecinde kazanılmıştır. Bu direncin seviyesi, çevrelerindeki элемент çokluğu ile ilgilidir.Başka bir ifade ile, canlılar gerekli ve gereksiz elementlerle iç içe yaşar. Ама evrimsel birikimleri иле метаболизма yaşamsal ayrımı gerçekleştirir. Elementlerin birbirleri ile birleştiklerinde bize garip gelen özellikleri vardır. Hem oksijen hem de hidrojen ateşe karşı duyarlıdır. Oksijenin bizzat kendisi yanıcı değildir, sadece başka maddelerin yanmasını kolaylaştırır.
Hidrojen gaz halinde iken son derece yanıcıdır. Ама бир арайа гельдиклеринде ортая çıkan özellik там терсидир.Ayrı ayrı yanma olayını tetikleyen bu iki element uygun oranda birleştiklerinde ateşi söndürür.
Sodyum kararsız bir elementtir. Klor ise oldukça toksiktir, yani bünyede zehirlenme etkisi yapar. Су içerisine аз миктарда желчи саф содюм атылырса кувветли бир патлама олур. Klor аз younlukta kullanılır ise mikroorganizmaları yok eder. Ама yoğunluğun artması bizim için çok tehlikelidir.
Nitekim yüzme havuzlarına mikrop öldürücü olarak atılan klor çok seyreltilmiş haldedir. Buna rağmen onun varlığını hissederiz.Ayrı ayrı bize zararlı olan bu iki element bir araya gelince ilginç bir oluşum gerçekleşir.Sodyum klorür. Яни yemeklerimize kattığımız софра тузу. Бир элемент doğal yollardan bünyemize girmiyorsa ona karşı direnç sistemimiz yoktur. Öyle de ifade edebiliriz: Yaşantımız için doğrudan veya dolaylı ilgisi olmayan maddeler bizim için zararlıdır. Örneğin kurşun insan açısından zehirlidir.Zira onu zararsız hale getirecek savunmamız yoktur. Cıva ve plütonyum da böyledir.
Elementlerin sınıflandırılması
Elementler kimyasal özellikleri bakımından üçe ayrılır.Металлер Аметаллер Сойгазлар.
Metaller
Tabiatta atomik halde bulunur.
Genellikle yüzeyi parlak görünüşlüdür.
Levha ve tel haline getirilebilir.
Isı ve elektrik akımını iletir.
Oda sıcaklığında hepsi katıdır. (cıva hariç)
Ametaller
Yüzeyleri parlak görünüşlü değil, mattır.
Genellikle erime noktası düşüktür.
Katı olan ametaller tel ve levha hâline getirilemez. Кырилгандыр.
Tabiatta oda sıcaklığında üç halde de bulunur.(Klor gaz, brom sıvı, iyot katıdır.)
Elektrik akımını iletmez. (Karbonun bir allotropu olan grafit hariç)
Soy gazlar
He, Ne, Ar, Kr, Xe, Rn elementleri soy gazdır.
Soy gazlar son yörüngesinde maksimum sayıda elektron bulundurur. Bu sayı helyum için 2, diğer beş soy gaz için 8 реж.
Soy gazlar nötr atomlar olarak kalmayı tercih ederler. Электрон алмаз, вермез ве ортаклашмазлар.
Elementlerin Simgeleri
Elementlerin Simgesi, ее элемент ait bir ya da iki harften oluşan simgelerin, uluslararası geçerliliği vardır.Чок аз сайда elementin bilindiği zamanlarda, elementler, Plato’nun Eski Yunanlıların kullandığı Toprak – hava – su ve ateş sembollerinden yaptığı uyarlamalarla simgeleniyordu. Daha sonra yeni elementler keşfedildikçe, tüm elementlerin eninde sonunda “altın” a dönüşeceği düşüncesinden yola çıkan simyacılar tarafından, güneş (altın) merkezli sistemdeki verildi elegenin ad. О dönemde bilinen elementlerin bazılarının «simya» sembolleri kullanılıyordu.
| Z | Sembol | ISIM | ||||
| 1 | H | Hidrojen | ||||
| 2 | He | Helyum | Lityum | |||
| 4 | Be | Berilyum | ||||
| 5 | B | Bor | ||||
| 6 | C | Karbon | ||||
| 7 | N | Nitrojen | ||||
| 8 | O | Oksijen | ||||
| 9 | F | Flor | ||||
| 10 | Ne | Neon | ||||
| 11 | Na | Sodyum | ||||
| 12 | Mg | Magnezyum | ||||
| 13 | Al | Alüminyum | ||||
| 14 90 074 | Si | Silisyum | ||||
| 15 | P | Fosfor | ||||
| 16 | S | Kükürt | ||||
| 17 | Cl | Klor | ||||
| 18 | Ar | Аргон | ||||
| 19 | K | Potasyum | ||||
| 20 | Ca | Kalsiyum | ||||
| 21 | Sc | Skandiyum | ||||
| 22 | Ti | Titanyum | ||||
| 23 | V | Vanadyum | ||||
| 24 | Cr | Krom | ||||
| 25 | Mn | Mangan | ||||
| 26 | Fe | Demir | ||||
| 27 | Co | Kobalt | ||||
| 28 | Ni | Никель | ||||
| 29 | 900 71 CuBakır | |||||
| 30 | Zn | inko | ||||
| 31 | Ga | Galyum | ||||
| 32 | Ge | Germanyum | ||||
| 33 | As | Arsenik | ||||
| 34 | Se | Selenyum | ||||
| 35 | Br | Brom | ||||
| 36 | Kr | Kripton | ||||
| 37 | Rb | Рубидий | ||||
| 3874 | 3874 | Sr | Стронсиюм | |||
| 39 | Y | İtriyum | ||||
| 40 | Zr | Циркон | ||||
| 41 | Nb | Niyobyum | ||||
| 42 | Молибюм | Молибден | ||||
| 43 | TC | Teknetyum | ||||
| 44 9007 4 | Ru | Rutenyum | ||||
| 45 | Rh | Rodyum | ||||
| 46 | Pd | Paladyum | ||||
| 47 | Ag | Gümüş | ||||
| Cd74 900mi | ||||||
| 49 | In | İndiyum | ||||
| 50 | Sn | Kalay | ||||
| 51 | Sb | Antimon | ||||
| 52 | Te | Tellür | ||||
| 53 | I | Iyot | ||||
| 54 | Xe | Ksenon | ||||
| 55 | Cs | Sezyum | ||||
| 56 | Ba | Baryum | ||||
| 57 | La | Lantan | ||||
| 58 | Ce | Seryum | ||||
| 59 | 9007 1 PrPraseodim | |||||
| 60 | Nd | Neodim | ||||
| 61 | Pm | Prometyum | ||||
| 62 | Sm | Samaryum | ||||
| 63 | Eu | Evro | ||||
| 64 | Gd | Gadolinyum | ||||
| 65 | Tb | Terbiyum | ||||
| 66 | Dy | Disprosyum | ||||
| 67 | Ho | Holmiyum | ||||
| Erbiyum | ||||||
| 69 | Tm | Tulyum | ||||
| 70 | Yb | İterbiyum | ||||
| 71 | Lu | Lutetyum | ||||
| 72 | Hafn | Hfn | ||||
| 73 | Ta | Тантал | ||||
| 74 | W | Вольфрам | ||||
| 75 | Re | Renyum | ||||
| 76 | Os | Osmiyum | ||||
| 77 | Ir | İridyum | ||||
| 78 | Pt | Platin | ||||
| 79 | Au | Altın | ||||
| 80 | Hg | Cıva | ||||
| 81 | Tl | Talyum | ||||
| 82 | Pb | Kurşun | 83 | Bi | Bizmut | |
| 84 | Po | Polonyum | ||||
| 85 | At | Astatin | ||||
| 86 | Rn | Радон | ||||
| 87 | Fr | Fransiyum | ||||
| 88 | Ra | Radyum | ||||
| 89 | Ac | Aktinyum | ||||
| 90 | Th | Toryum | ||||
| 91 | Pa | Protaktinyum | ||||
| 92 | U | Uranyum | ||||
| 93 | Np Neptünyum | |||||
| 94 | Pu | Plütonyum | ||||
| 95 | Am | Amerikyum | ||||
| 96 | Cm | Küriyum | ||||
| 97 | Bk | Berkely | Berkely | Cf | Калифорния | |
| 99 | Es | Einsteinyum | ||||
| 100 | Fm | Фермиюм | ||||
| 101 | Md | Mendelevyum | ||||
| 102 | Mendelevyum | |||||
| 102 | ||||||
| 103 | Lr | 9007 1 Lavrensiyum|||||
| 104 | Rf | Rutherfordyum | ||||
| 105 | Db | Dubniyum | ||||
| 106 | Sg | Seaborgiyum | ||||
| 107 | Bhriyum | Bhriyum | 108 | Hs | Hassiyum | |
| 109 | Mt | Meitneriyum | ||||
| 110 | Ds | Darmstadtiyum | ||||
| 111 | Uuu | Ununnilyum | 112Унунбиюм | |||
| 113 | Уут | Унунтриум | ||||
| 114 | Уук | Унункуадьюм | ||||
| 115 | Ууп | Унунпентиюм | ||||
| 116 | Унунхэ | 116 | Унхе | * | Uus 90 074 | Ununseptiyum |
| 118 | Uuo | Ununoktiyum | ||||
| 119 * | Uue | Ununenniyum | ||||
| 120 * | Ubn | Unbiniliyum |
ELEMENT NEDR TANIMI ELEMENTLERN ZELLKLER ELEMENT ETLER ELEMENT SEMBOLLER (FEN VE ТЕКНОЛОЙ ДЕРС КОНУ АНЛАТИМ)
Элементлер uluslar aras bilim dnyasnda anlalmas в латинском alfabesine gre adlandrlp kullanlrlar. Ее defasnda elementlerin адларн куланмак Йерин де бу адларн иже харфлери терцих эдилир ве бунлара сембол денир.
Кшачас elementler sembollerle gsterilir.
Таблода ил 20 elementin, numaralar, adlar ve sembolleri gsterilmitir. Bunlar рениниз.
Элементлер sembollerle gsterilir fakat sembollerden, o elementin atomik yapda m, Molekler Yapda M olduu Anlalmaz. Molekler yapda olan elementlerin ka atomdan (bilgi yelpazesi.net) olutuunun anlalmas iin formller kullanlr:
rnein hidrojen, oksijen ve iyot elementleri iki atomludur.Kkrt 8, fosfor ise 4 атомлудур.
Hidrojen..H Oksijen.O yotI
Ккрт..С ФосфорП
Билейклер де formllerle gsterilir. rnein su: H O
2- ELEMENTLERN ZELLKLER:
1- Эн кк яп birimleri atomlardr.
2- Айн цинс атомлардан олуурлар.
3- Кендинден Даха Басит ве фаркл мадделере айрламазлар.
4- Saf maddelerdir.
5- Семболлер gsterilirler.
3- ЭЛЕМЕНТ ETLER:
а) Атомик Япдаки Элементлер:
Baz elementleri oluturan ayn cins atomlar doada tek balarna bulunurlar.Байл атомлара sahip elementlere атомик япл elementler denir. Atomik yapl elementlerin en kk tanecii atomlardr.
рнек: Демир, бакр, альминьюм, инко, курун, альтн гиби elementler atomik yapldr.
б) Molekler Yapdaki Elementler:
Baz elementleri олутуран айн цинс атомлар доада икили (вейа даха фазла сайда атомдан олуан karmak yapl) gruplar halinde bulunurlar.Byle atomlara sahip elementlere Molekler Yapl elementler Denir.
Молеклер япл elementlerin en kk tanecii molkllerdir.
rnek: Hidrojen, оксижен, иёт, карбон, фосфор, ккрт, азот
4- ЭЛЕМЕНТЛЕРН СЕМБОЛЛЕР:
Gnmzde bilinen 118 элемент вардр.Bu elementlerin 92 tanesi doada bulunurken гери калан да labratuarlarda elde edilen yapay elementlerdir.
Elementler sembollerle gsterilir ве ее elementin kendine zg sembol vardr. Sembol элемента яслркен;
=> Sembol tek harfli ise byk harfle yazlr.
=> Sembol iki Вея Харфли Исэ Илк Харф Дайма Бык, Дайер Харфлер КК ЯЗЛР. (Sembollerin iki veya harften olumasnn nedeni, baz elementlerin ba харфлеринин айн олмасдр).
Elementlerin sembollerle гстерилмесинин недени, бтн Дняда ортак бир билим дили олутурмак, билимсел iletiimi ve yazmlarn kolaylatrmaktr. Элементлерин бтн Дняда kullanlan sembolleri ayn olmasna ramen isimleri dillere gre farkldr. (Trke, Rusa, ince, Japonca da element isimleri farkl olmasna ramen семболлери айндр).
Элементлер иже bulunduklarnda bir ksmna elementlerin zelliklerini belirten bir isim (hidrojene Latincede su reten anlamna gelen Hydrogenes, oksijene Latincede asit yapan anlamna gelenxygenium, fosfora Latincede k veren phosphorus), bir ksmna elementi bulan bilim adamnn ismi (Альберт ЭйнштейнAyntaynyumEs, Грегор Мендель Менделевюм, доктор медицины, Резерфорд, Резерфордиюм, RF, Андре Мари Кури KriyumCm), бир ксмна (билги елпазеси.net) gezegen ve yldzlarn isimleri (NeptnNeptnyumNp, PltonPltunyumPu, UransUranyumU), бир кшмна да эитли кта, эхир ве лке исимлери (AvrupaEuropyumEu, AmerikaAmerikyumAm, КалифорнияKaliforniyumCf, Fransa FransiyumFr) verilmitir.
Elementlerin sembolleri belirlenirken, elementlerin Latince, isimlerinin и тому подобное, veya ilk, iki () harfi kullanlmtr.
5- SEMBOL VE FORMLN KULLANILMASI:
Элементлер, атомик ве Molekler yapl elementler olarak iki grupta incelenir.Атомик япл elementlerin en kk yap birimi atom, molkler yapl elementlerin de en кк яп бирими молклдр.
Elementler sembollerle гстерилир. Elementin sembolne bakldnda o elementin atomik yapl m yoksa млеклер япл м олдуу анлаламаз. Bu nedenle Molekler yapl elementleri олутуран молеклерин ка тане атомдан олутуунун белиртилмеси в бу elementler formllerle gsterilirler.
Bileiklerin en kk yap birimi Molekllerdir.Bileii oluturan molkllerde hangi atomdan ve ka tane bulunduunun belirtilmesi iin bileikler formllerle gsterilir.
Sembolle gsterimde tek bir atom, formlle gsterimde en az iki atomun bulunmas gerekir.
РНЕКЛЕР:
1- Aadaki elementlerden sembol ve formlle gsterilenleri belirleyin.
2- Aadaki isimleri ve formlleri verilen bileiklerde hangi elementten ka tane bulunduunu belirleyin.
НЕ:
1- Билим адамлар эски аларда (M 500l yllardan sonra) btn maddelerin hava, toprak, su ve ate gibi drt elementten olutuuna, bu elementlerin farkl ekillerde bir araya gelmesi sonucu da farkl maddeleri oluturduklarna inanyorlard.
2- Билим адамлар эски аларда хава, топрак, су ве ели оларак кабул эттиклери элементлери фаркл biimlerde izilmi drt genle gstermilerdir.Бунун недели Дняда ки бтн билим адамларн ортак бир сембол кулланмаснн саланмая аллмасдр.
3- Byclk ve falclk Гиби Герек д олайлар недениайл MS 1600 илна кадар btn maddelerin, element olarak nitelendirdikleri hava, toprak, su ve ate gibi drt elementten olutuu fikri hkm srmtr.
4- М 400л илларда Демокрит, maddelerin taneciklerden olutuunu savunmu ve bu taneciklere атом адн вермитир.Демокрит, атом hakkndaki grlerini deneylere gre deil varsaymlara gre sylemitir. Демокрит, madde paralara ayrldnda en sonunda blnemeyen bir tanecik elde edileceini ve bu tanecie atom denildiini, btn maddeler ayn tr atomlardan olutuunu, атомларн grlemediini ve grlemedii iin blnemediini ve doada bulunan maddelerin farkl olmasnn nedenin maddeyi oluturan atomlarn say ve dizilii biiminin фаркл олмасндан кайнакландн sylemitir.
5- Орта аларда (М 500 л иллардана MS 1600 илна кадар) simya denilen bilim dal ile uraanlar, btn maddeleri altna dntrmeye almlardr.Симья денилен алмалар, 18. Ызылдан сонра кимья билимин днмтр.
6- 1650 Илнда Роберт Бойл, элементы даха басит мадделере айрламаян мадде оларак танмлам ве hava, toprak, suve atein element olmadn sylemitir. Хава, топрак, су ве atein element olmamasnn nedeni, kendinden daha basit maddelere ayrlamayan maddeler olmamasdr.
7- Элементлерин sembolleri ve Latince isimleri arasnda iliki vardr ve sembolleri genelde Latince simlerinin илк veya ilki iki (вея) harfinden oluur.
6- ЭЛЕМЕНТЛЕРН КУЛЛАНИМ АЛАНЛАРИ ВЕ ЦЕЛЛКЛЕР:
1- Hidrojen (H):
=> lk olarak 1776 г. Илнда Генри Кавендиш тарафндан кефедилмитир.
=> Hidrojen ismi ise Antoine Lavoisier tarafndan verilmitir.
=> Билинен Renksiz en hafif gazdr.
=> Суюн, canllarn ve petrol gibi birok maddenin yapsnda bulunur.
=> Рокет якт оларак куланлр.
2- Хелюм (He):
=> 1868 г. ylnda Fransz Pierre Janssen ve ngiliz Norman Lockyer birbirinden bamsz оларак хелюму кефетмилердир.
=> 1908 г. ylnda Heike Kamerlingh Onnes иже sv helyumu elde etmitir.
=> Хелюм Атмосферде ок аз миктарда булунур.
=> Gnete ve диер йлдзларда бол миктарда булунур.
=> Ренксиз бир газдр.
=> Zeplin ve balon gibi hava tatlarnn iirilmesinde, roket yaktlarnn sktrlmasnda kullanlr. (Хавадан даха хафиф газ олмас неденилэ).
3- Литюм (Ли):
=> lk olarak 1817 ylnda Johann Arvedson tarafndan kefedilmitir.
=> Gmms гри металик ренкте булунан кат бир элементтир.
=> лаларда, Pil retiminde, seramik ve cam yapmnda kullanlr.
4- Берилюм (Be):
=> 1828 г. ylnda birbirlerinden bamsz olarak Friedrich Whler ve Antony Bussy тарафндан эльде эдилмитир.
=> Гри renklidir katdr.
=> Уак ве uzay aralarnn yapmnda elektrik ve s iletkeni olarak kullanlr.
5- Бор (В):
=> 1808 Илнда Хамфри Дэви, GayLussac ве Thenard tarafndan ilk defa elde edilmitir.
=> Ода koullarnda kat halde bulunur.
=> Ися Dayankl renkli cam imalatnda, seramiklerde ve roket yaktlarnda kullanlr.
6- Карбон (К):
=> Saf халдейкен карбон, эльмас, графит, есть, кмр гиби (4 тане аллотропу вардр) бирок eitli maddelerde bulunur.
=> Графитин yaps siyah, elmasn yaps ise renksiz bir katdr.
=> Йеризнде кмр, бензин, doal gaz gibi maddelerin ve canllarn yapsnda bulunup canllar asndan ok nemlidir.
7- Азот (Н):
=> Азот иже olarak 1772 ylnda Daniel Rutherford tarafndan kefedildi.
=> Renksiz ve кокусуз бир газр.
=> Канлар iin gerekli temel elementlerden biridir.
=> Св азот soutma amacyla kullanlr.
=> Баз азот bileikleri tarmda gbre olarak kullanlr.
8- Оксиджен (О):
=> Oksijen ир. оларак 1774 г. Илнда Джозеф Пристли ве Карл Вильгельм Шееле тарафндан кефедилмитир.
=> 1781 Илнда Лавозье, оксидженин хавада булунан ве янмая этки, эден бир мадде олдууну кефетмитир.
=> Ренксиз (билги yelpazesi.net) бир газр.
=> Canllarn yaamas iin gerekli temel elementtir.
=> Дальгларн ve astronotlarn solunum yapmalar iin kullandklar oksijen tplerinde булунур.
9- Флор (Ф):
=> lk defa 1886 Ylnda Анри Муассан tarafndan elde edilmitir.
=> Ак сар renkli bir gazdr.
=> Ди macunlar ve deodorantlarn yapsnda bulunur.
=> Буздолаб ве klimalarn soutma sisteminin almasnda kullanlr.
10- Неон (Ne):
=> Неон 1898 г. ylnda Уильям Рамзи ве Моррис Траверс tarafndan kefedilmitir.
=> Ренксиз бир газдр.
=> Ренкли реклама паноларнн айднлатлмасенда ве телевидение тплэринде кулланлр.
11- Sodyum (Na):
=> Sodyum иже с ним оларак 1877 г. Илнда Хамфри Дэви тарафндан старший эдилмитир.
=> Юмуак, kaygan bir metal olup gmms beyaz renkli bir katdr.
=> Doada ru хорошо софра тузунун (содюм клоррн) япснда булунур.
=> Кэт, гда, текстиль, кимья, сабун, кам ве металл гиби бир ок эндстриел куланлр.
12- Магнезюм (Mg):
=> 1755 ylnda ngiltereli Джозеф Блэк тарафндан иже оларак кефедилмитир.
=> Gmms бейаз ренкли бир металдир.
=> Ода koullarnda kat halde bulunur.
=> Хафиф бир металл olduu iin hava tatlarnn yapmnda kullanlr.
=> Курутулму meyvelerde bulunur.
13- Альминьюм (Al):
=> 1827 г. ylnda Wohler tarafndan bulunmutur.
=> Альминьюм юмуак ве хафиф бир металдир.
=> Мат, gmms renkli bir katdr.
=> Мутфак ара gerelerinin, elektrik kablolarnn ve iecek kutularnn yapmnda kullanlr.
14- Силисий (Si):
=> Силисюмун илк кефи 1824 ylnda Berzelius tarafndan gerekletirilmitir.
=> Йеризнде en fazla bulunan elementlerden biridir.
=> Кою гри renkli bir katdr.
=> Кумда, kilde, cam yapmnda ve yap malzemelerinde bulunur.
15- Фосфор (П):
=> Фосфор иже с ним olarak 1669 ylnda Hennig Brand tarafndan kefedildi.
=> Фосфор renksiz, beyaz, krmz ve siyah renklerinde bulunabilir.
=> Ода koullarnda kat halde bulunur.
=> Canllarn синир ве кемик dokularnda grevlidir.
=> Suni gbre yapmnda kullanlr.
16- Ккрт (S):
=> Ккрт, Antik Ada Bilinen dokuz elementten biriydi. Kkrdn kimyasal bir элемент olduunu 1777de Lavoisier ortaya att. 1810 Ylnda Gay Lussac ile Thenard tarafndan deneysel olarak doruland.
=> Сар ренкли тац, кокусуз бир маддедир.
=> Ода koullarnda kat halde bulunur.
=> Является ве elektrii iyi iletemez.
=> Барут ве slfrik asit yapm ile kuru meyvelerde mikrop ldrc olarak kullanlr.
17- Клор (Cl):
=> Клор иже с ним olarak 1774 ylnda Карл Вильгельм Шееле tarafndan kefedildi.1810 Ylnda Ise Хамфри Дэви tarafndan bugnk ismi verildi.
=> Сарьейл renkli zehirli bir gazdr.
=> Doada ru хорошо софра тузунун япснда булунур.
=> я sularnda mikrop ldrc olarak bulunur.
18-Аргон (Ar):
=> 1785 ylnda havada argon olduu ilk defa Генри Кавендиш tarafndan iddia edilmi ve 1894 Ylnda Lord Rayleigh ve William Ramsay tarafndan kefedilmi.
=> Кокусуз ве рэнксиз бир газр.
=> Ампуллерда ве флоресан tplerinde kullanlr.
19- Потасюм (К):
=> Potasyum ilk olarak 1807 ylnda Humphrey Davy tarafndan elde edilmitir.
=> Gmms beyaz renkli bir katdr.
=> Зв Deterjan, gbre, barut, cam ve lens yapmnda kullanlr.
20- Кальсиюм (Калифорния):
=> lk olarak 1808 Илнда Берцелиус ве Понтин тарафндан, daha sonra saf olarak ilk defa Хамфри Дэви тарафндан эльде эдилмитир.
=> Gm gibi парлак ве беяз ренкли бир катдр.
=> имя, Аль, Кире Гиби Мэдделер Иле Дилерин ве Кемиклерин Япснда Булунур.
21-Gm (Ag):
=> Gm elementinin kefi tam olarak bilinmekle birlikte altn ve bakr elementlerinden sonra kefedilmitir. Gmn M 2500 yllarnda inliler ve Persler tarafndan kullanld belirtilmitir.
=> Парлак, beyaz renkli bir katdr.
=> Ss eyas yapmnda, di dolgusu (амальгама) yapmnda kullanlr.
22- Альтернативный (Au):
=> Тарихте bilinen kaytlara gre Msr hkmdarlar zamannda M 3200 yllarnda, altn darphanelerde eit boyda ubuklar halinde ekilerek para olarak kullanld.
=> Юмуак, парлак сар ренкли бир катдр.
=> Ss eyas yapmnda kullanlr.
23- Cva (Hg):
=> Cva ОК uucu bir element olduu iin oda scaklnda kolayca buharlaabilir.
=> Gmms гри ренкли бир свдр.
=> Зехирли бир elementtir.
=> Херханги бир yzeye cva dkld zaman zerine toz kkrt dklmelidir.
=> Ди долгусу (амальгама) yapmnda ve termometrelerde kullanlr.
24- Бакр (Cu):
=> Тарихте иже с ним по умолчанию 10.000 yl kadar nce Kbrsta rastlanmtr.
=> Турунджу renkli yumuak бир катдр.
=> Мутфак ве ss eyas yapmnda kullanlr.
25- Никель (Ni):
=> Никель elementi ilk olarak 1751 ylnda Axel Фредрик Кронштедт тарафндан кефедилмитир.
=> Gmms parlak renkli bir katdr.
=> Арабаларн kaplamalarnda, musluklarda ve paslanmaz tencere yapmnda nikel kullanlr.
26-йот (И):
=> йот Elementi ilk kez Bernard Courtois tarafndan 1811 ylnda kefedilmitir.
=> Парлак, menekesiyah renkli bir katdr.
=> Дениз rnlerinde ve iyotlu sofra tuzlarnda bol miktarda bulunur.
27-инко (Zn):
=> инко Elementi 1746 ylnda Андреас Маггарт tarafndan kefedilmitir.
=> Мавимси, ак гри ренкте, крлган бир катдр.
=> Мутфак eyalarnn ве пилин yapmnda kullanlr.
28- Демир (Fe):
=> Демир металинин кефи там оларак билинмемектедир.
=> Гримси parlak renkli bir katdr.
=> Элемент halindeki saf demir dvlebilir, ince tel ve levha haline getirilebilir.
=> наат malzemesi ile gnlk hayatta kullanlan baz eyalarn yapmnda kullanlr.
=> Марул ве pekmez gibi besinlerle kann yapsnda bulunur.
29- Калай (Sn):
=> M 3000 yllardan beri kullanlan bir elementtir.
=> Gmms parlak renkli bir katdr.
=> Мутфак Eyas yapmnda ve metallerin kaplanmasnda kullanlr.
30- Курун (Pb):
=> Кефи там olarak bilinmemektedir.
=> Mavimsibeyaz renkte bulunan bir katdr.
=> Юмуак, ар, зехирлейичи, колай двлебилен бир маддедир.
НЕ:
1- Элемент олутуран танециклерин ренклери, элементлерин ренклерил айн олмаябилир.
Танециклерин ренклери йоктур. Танечиклер бир арайя гелерек elementleri oluturduklarnda яни elementler grnr boyuta ulatklarnda renkli grnrler.
2- Farkl maddeler de ayn elementlerden oluabilir yani farkl maddelerde ayn cins elemenler булунабилир.Ispanak ve bezelyede bulunan demir atomlaryla, demir parasnda bulunan demir atomlar ayn atomlardr.
3- Doada bilinen 118 элемент olmasna ramen bu elementler farkl ekillerde bir araya gelerek milyonlarca yeni madde yani bileik elde edilir.
7. DOADA KULLANILAN ELEMENTLERN BENZERL:
Doadaki canl ve cansz varlklarn tamam elementlerden oluur.Канл варлклар олутуран elementlerden bir ksm ayn zamanda yeryznn yapsn da oluturur. Айн elementlerden olutuklar halde canl vcudu, yeryz veya dier (bilgi yelpazesi.net) maddelerin yaps arasnda farkllklarn bulunmasnn nedeni, canl vcudunu, yeryzn veya dier maddeleri oluturan elementlerin farkl say, eit ve ekillerde dizilmesidir.
НЕ:
1- Канл Вчудуну Олутуран Элемент Eitleri ve Bunlarn Oranlar:
=> Оксиджен -> % 65
=> Карбон ->% 18
=> Hidrojen -> % 10
=> Азот ->% 3
=> Кальсиюм -> % 2
=> Фосфор ->% 1,1
=> Потасюм -> % 0,35
=> Ккрт ->% 0,25
=> Sodyum ->% 0,15
2- 70 кг Ктлели нсандаки Элементлерин Миктарлар:
3- Ерызнде Булунан Элементлерин Оранлар:
=> Оксиджен -> % 46,6
=> Силисюм -> % 27,7
=> Альминьюм ->% 8,1
=> Демир ->% 5,0
=> Кальсиюм -> % 3,6
=> Sodyum ->% 2,8
=> Потасюм -> % 2,6
=> Магнезюм ->% 2,1
Элемент, Билейк Ве Кармларн Карлатрлмас
Saf maddelerdir.
Kendine zg z ktlesi vardr.
Физиксель вея кимясал интемлерле басит maddelere ayrmaz.
Homojendir.
Кендилерин zg E.N, K.N vardr.
Yapta atomdur.
Айн цинс атомлардан олуур.
Sembolle gsterilir.
Saf maddelerdir.
Kendine zg z ktlesi vardr.
Kimyasal yntemlerle ayrr. (электролиз, стма)
Homojendir.
Кендилерин zg E.N, K.N vardr.
Yapta Molekldr.
Farkl cins atom, ayn cins Mokllerden олуур.
Formllerle gsterilir.
Elementlerin sabit oranlarda birlemesiyle oluur.
Elementler zelliklerini kaybeder.
Saf deillerdir.
Sabit z ktlesi yoktur.
Fiziksel yntemlerle ayrr. (szme, элеме, дамтма)
Homojen veya heterojendir.
RU, KN belirgin deildir.
Япта атом вея молекулдр.
Farkl cins atom ve molkllerden oluur.
Belli formlleri yoktur.
Карм Олутуран Maddeler arasnda belirli oran yoktur. Ее oranda karabilirler.
Карм Олутуран maddeler zelliklerini kaybetmezler.
.


 3d
3d 