Физические свойства меди и серы таблица: Сравните физические свойства меди и серы
alexxlab | 16.12.1986 | 0 | Разное
Физические свойства меди таблица. Целительная сила меди
Занимает второе по популярности место среди всех цветных металлов. Главным ее , которая добывается во многих месторождениях сланца и песчаника. На протяжении десятков сотен лет используются человеком медные листы и на данный момент они не теряют своего спроса.
Сам металл обладает красно-розовым цветом и имеет высокие показатели тепло- и электропроводности. Если сравнивать с остальными металлами, то медь превышает в 6 раз уровень теплопроводности по сравнению с железом. О том, каковы виды, свойства и области (сферы) применения меди и ее сплавов, какая их роль в строительстве — все это вы узнаете из данной статьи.
Как в чистом виде, так и в сочетании со сплавами медь активно используется в различных промышленных областях.
- Благодаря своим свойствам, она получила широкое распространение в области электротехники. Более половины всего добытого материала уходит на производство всевозможных электроприборов и электропередач.

- Из чистой меди изготавливается кабели для электропередач, различные составляющие для электрических генераторов, медная проволока и прочее.
- В сочетании со сплавами этот материал можно встретить в автомобильной области.
- В результате своей высокой теплопроводности также применяется при производстве теплотрасс и нагревательных устройств.
Сплавы меди получили применение в химическом производстве, отлично зарекомендовав себя.
О применении меди в гальванопластике смотрите видео ниже:
Ее использование в строительстве
Высокие показатели электро- и теплопроводности обусловили для меди активное использование, как в строительстве, так и в автомобиле- и приборостроении. Сам же материал устойчив к негативному воздействию коррозии и ультрафиолетовых лучей, также без деформации и нарушения структуры переносит резкие температурные перепады.
Благодаря таким особенностям, позволяет производить детали и прочие конструкции, которые рассчитаны на длительное воздействие влаги.
Провода
Наибольший спрос медь получила именно в электротехнической области, в частности для производства проводов. С этой целью используется максимально чистый металл, поскольку второстепенные компоненты существенно снижают его токопроводимость. Если в готовом материале присутствует более 0,02% алюминия, то его способность проводить ток снижается на 10%.
Существенно возрастание сопротивления происходит в результате присутствия в сырье примесей неметаллического характера. Сам же металл относится крайне низким сопротивлением, которое уступает лишь серебру. Такая особенность металла также послужила его использованию в силовых трансформаторах и энергосберегающих приводах.
Проволока
Высокий уровень вязкости и пластичности обусловили активное использование меди для производства изделий с различными узорами. Проволока, которая была изготовлена из красной меди, после обжига становится максимально пластичной и мягкой. В таком состоянии она позволяет создавать узоры и орнаменты любой сложности.
Такая проволока активно используется в следующих отраслях:
- Электротехника;
- Электроэнергетика;
- Автомобилестроение;
- Судостроение;
- Производство кабеля и проводов.
Водо- и теплоснабжение
Благодаря своей высокой теплопроводности медь используется в различных теплообменниках и теплоотводных приборах. Иными словами, из нее изготавливают кулера для системных блоков, радиаторы отопления, трубы, кондиционеры и прочие приборы.
Медные трубы обладают абсолютно уникальными характеристиками, которые и обусловили их широкое распространение не смотря на высокую стоимость самого сырья. Такие изделия не бояться ультрафиолетового излучения, устойчивы к возникновению коррозии и температурным перепадам. Эти свойства позволяют производить монтаж медных труб даже при низких температурах воздуха.
Высокий показатель механической прочности, а также возможность механической обработки материала позволяют создавать бесшовные медные трубы, обладающие круглым сечением. Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
О роли медных труб в водоснабжении расскажет данное видео:
Кровля
Одним из первых материалов, используемых в качестве , является медь. Такая кровля отличается длительным сроком службы (до 200 лет), который происходит благодаря ее уникальным особенностям. Кровля из меди спустя некоторое время претерпевает процесс окисления, который заключается в образовании патины.
Таким образом, медная кровля сразу после своего монтажа имеет золотистый оттенок, но уже через 10 лет становится более темной, в некоторых случаях практически черного цвета. Этот процесс образования патины при желании можно искусственно ускорить.
Про иные сфера применения меди читайте ниже.
Прочие сферы использования
- Помимо вышеперечисленных областей, медные сплавы могут использоваться в сочетании с золотом. Это необходимо для придания ювелирным изделиям большей прочности и устойчивости к истиранию.

- Широкое распространение металл получил и в области архитектурного строительства. Кровля, фасады, различные декоративные элементы – все это можно изготовить абсолютно любой формы и уровня сложности.
- Среди новой сферы использования является применение меди в качестве бактерицидной поверхности в лечебных заведениях: перила, ручки, двери, столешницы и многое другое.
Преимущества данного металла послужили не только его широкому распространению, но и расширению сфер применения.
Сегодня применение разных марок меди в промышленности, в быту, в электротехнике и строительстве, медицине считается весьма выгодным и перспективным.
О том, как переделать медь в «золото», расскажет данное видео:
Медь широко используется в чистом виде и в виде сплавов в электротехнической и радиотехнической промышленности, где расходуется около 50% получаемой меди, в машиностроении и приборостроении, и военной технике. Чистая медь – металл розового цвета с плотностью 8,93, температурой плавления 1084° С и температурой кипения 2582° С.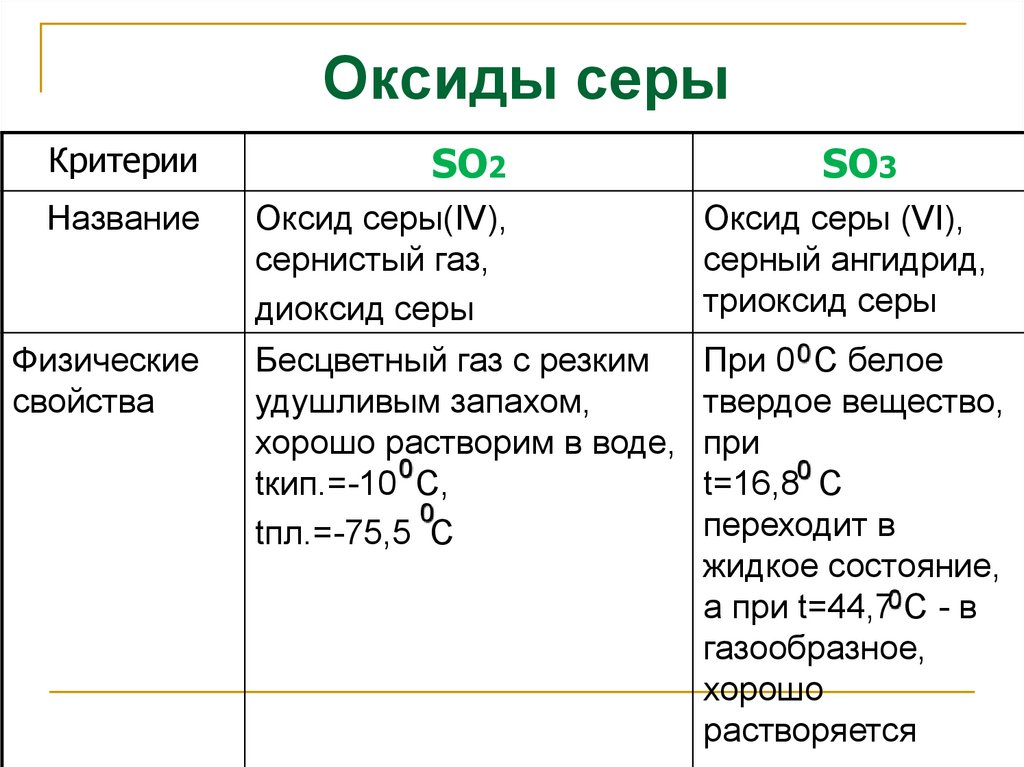 Медь имеет высокую электропроводность и теплопроводность, обладает хорошей ковкостью и тягучестью, легко прокатывается в тонкий лист и вытягивается в проволоку.
Медь имеет высокую электропроводность и теплопроводность, обладает хорошей ковкостью и тягучестью, легко прокатывается в тонкий лист и вытягивается в проволоку.
С давних пор известны и нашли широкое распространение сплавы меди с цинком – латуни и меди с оловом – бронзы. Латунь содержит от 10 до 30% 2п и в ряде случаев небольшие количества олова и свинца. Латуни хорошо обрабатываются, имеют более высокую по сравнению с медью механическую прочность и, кроме того, дешевле чистой меди. Бронза содержит до 20% Бп. Несмотря на относительно высокую твердость, бронзы хорошо обрабатываются и хорошо заполняют форму при литье. Бронзы обладают высокой устойчивостью к износу, небольшим коэффициентом трения и поэтому используются для приготовления вкладышей подшипников, шестерен и других деталей. Бронза используется также в химическом производстве.
Медь очень хорошо проводит электричество и тепло. Удельное сопротивление меди равно 0,018 Ом мм 2 /м, а теплопроводность при 20 °С составляет 385 Вт/(м К). По электропроводности медь лишь немного уступает серебру. Ее электропроводность в 1,7 раза выше, чем у алюминия, и примерно в 6 раз выше, чем у платины и железа. Медь обладает ценными механическими свойствами – ковкостью и тягучестью.
По электропроводности медь лишь немного уступает серебру. Ее электропроводность в 1,7 раза выше, чем у алюминия, и примерно в 6 раз выше, чем у платины и железа. Медь обладает ценными механическими свойствами – ковкостью и тягучестью.
В присутствии воздуха, влаги и сернистого газа медь постепенно покрывается плотной зеленовато-серой пленкой основной серно-кислой соли, предохраняющей металл от дальнейшего окисления. Поэтому медь и ее сплавы находят широкое применение при строительстве линий электропередач и устройстве различного вида связи, в электромашиностроении и приборостроении, в холодильной технике (производство теплообменников охлаждающих устройств) и химическом машиностроении (изготовление вакуум-аппаратов, змеевиков). Около 50 % всей меди расходует электропромышленность. На основе меди создано большое число сплавов с такими металлами, как Zn, Sn, Al, Ве, Ni, Mn, Pb, Ti, Ag, Au и др., и реже с неметаллами P, S, О и др. Область применения этих сплавов очень обширна. Многие из них обладают высокими антифрикционными свойствами.
Например, широко применяют сплавы типа оловянных (4- 33 % Sn), свинцовых (~ 30 % Pb), алюминиевых (5-11 % Al), кремниевых (4-5 % Si) и сурьмяных бронз. Бронзы применяют для изготовления подшипников, теплообменников и других изделий в виде листа, прутков и труб в химической, бумажной и пищевой промышленности.
Сплавы меди с хромом и порошковый сплав с вольфрамом идут на изготовление электродов и электроконтактов.
В химической промышленности и машиностроении также широко применяют латунь – сплав меди с цинком (до 50 % Zn), обычно с добавками небольших количеств других элементов (Al, Si, Ni, Mn). Сплавы меди с фосфором (6-8 %) используют в качестве припоев.
Известны два способа извлечения меди из руд и концентратов: гидрометаллургический и пирометаллургический.
Первый из них не нашел широкого применения. Его используют при переработке бедных окисленных и самородных руд. Этот способ в отличие от пирометаллургического не позвляет извлекать попутно с медью драгоценные металлы.
Большую часть меди (85-90%) производят пирометаллургическим способом из сульфидных руд. Одновременно решается задача извлечения из руд помимо меди других ценных сопутствующих металлов. Пирометаллургический способ производства меди является многостадийным. Основные стадии этого производства: подготовка руд (обогащение и иногда дополнительно обжиг), плавка на штейн (выплавка медного штейна), конвертирование штейна с получением черновой меди, рафинирование черновой меди (сначала огневое, а затем электролитическое).
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь – это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Физические свойства
Медь – это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0 С.
- Плотность составляет 8,9 г/см 3 .
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь – это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь – это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях.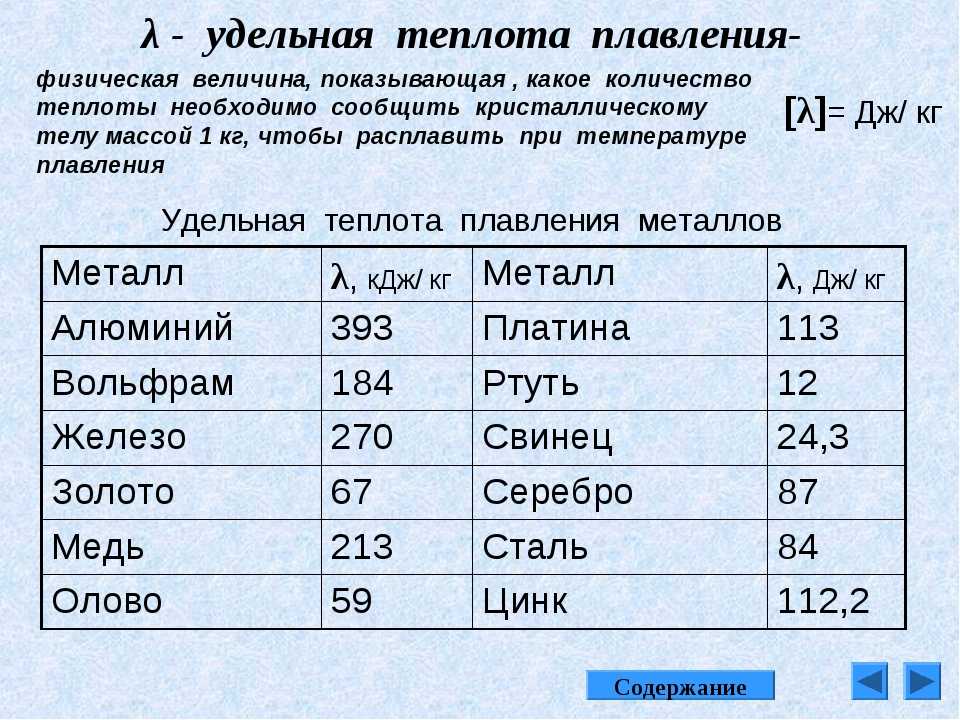 Это:
Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо Практически все сложные соединения данного элемента, кроме оксидов – ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь – это смесь или которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: “Медь – это вещество или физическое тело, когда речь идет о ее сплавах?” Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза – сочетание меди и олова.
- Мельхиор – никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан – сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь – это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.

- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
- орехи, злаки,
- рыба,
- крупы (особенно и ),
- кисломолочные продукты
- , ягоды и
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Которая относиться к цветным металлам, известна с давних пор. Ее производство было изобретено раньше, чем люди начали изготавливать железо. По предположениям произошло в результате ее доступности и достаточно простого извлечения из содержащих медь соединений и сплавов. Итак, давайте рассмотрим сегодня свойства и состав меди, страны мира-лидеры по производству меди, изготовление изделий из нее и особенности этих сфер.
Медь обладает высоким коэффициентом электропроводимости, что послужило росту ее ценности, как электротехнического материала. Если ранее на электропровод тратилось до половины всей произведенной в мире меди, то сейчас с этими целями используется алюминий, как более доступный металл. А сама медь становиться наиболее дефицитным цветным металлом.
В этом видео рассмотрен химический состав меди:
Структура
Структурный состав меди включает в себя множество кристаллов: , золото, кальций, серебро, и многие другие. Все металлы, входящие в ее структуру, отличаются относительной мягкостью, пластичностью и простотой обработки. Большинство таких кристаллов в сочетании с медью образуют твердые растворы с непрерывными рядами.
Все металлы, входящие в ее структуру, отличаются относительной мягкостью, пластичностью и простотой обработки. Большинство таких кристаллов в сочетании с медью образуют твердые растворы с непрерывными рядами.
Элементарная ячейка данного металла представляет собой кубическую форму. На каждую такую ячейку приходится по четыре атома, располагающихся на вершинах и центральной части грани.
Химический состав
Состав меди в процессе ее производства может включать в себя ряд примесей, которые влияют на структуру и характеристики конечного продукта. При этом их содержание должно регулироваться как по отдельным элементам, так и по их суммарному количеству. К примесям, которые встречаются в составе меди, можно отнести:
- Висмут . Этот компонент негативно сказывается как на технологических, так и на механических свойствах металла. Именно поэтому он не должен превышать 0,001% от готового состава.
- Кислород . Считается наиболее нежелательной примесью в составе меди.
 Его предельное содержание в сплаве составляет до 0,008% и стремительно сокращается в процессе воздействия высоких температур. Кислород негативно отражается на пластичности металла, а также на его устойчивости к коррозии.
Его предельное содержание в сплаве составляет до 0,008% и стремительно сокращается в процессе воздействия высоких температур. Кислород негативно отражается на пластичности металла, а также на его устойчивости к коррозии. - Марганец . В случае изготовления проводниковой меди негативно отображается данный компонент на ее токопроводимости. Уже при комнатной температуре быстро растворяется в меди.
- Мышьяк . Этот компонент создает твердый раствор с медью и практически не влияет на ее свойства. Его действие по большей мере направлено на нейтрализацию негативного воздействия от сурьмы, висмута и кислорода.
- . Образует твердый раствор с медью и при этом снижает ее тепло- и электропроводность.
- . Создает твердый раствор и способствует усилению теплопроводности.
- Селен, сера . Эти два компонента имеют одинаковое воздействие на конечный продукт. Они организуют хрупкое соединение с медью и составляют не более 0,001%. При увеличении концентрации резко снижается степень пластичности меди.

- Сурьма . Данный компонент хорошо растворяется в меди, поэтому оказывает минимальное воздействие на ее конечные свойства. Допускается ее не больше 0,05% от общего объема.
- Фосфор . Служит главным раскислителем меди, предельная растворимость которого составляет 1,7% при температуре 714°С. Фосфор, в сочетании с медью, не только способствует ее лучшему свариванию, но и улучшает ее механические свойства.
- . Содержится в небольшом количестве меди, практически не влияет на ее тепло- и электропроводность.
Производство меди
Медь производится из сульфидных руд, которые содержат эту медь в объеме минимум 0,5%. В природе существует около 40 минералов, содержащих данный металл. Наиболее распространенным сульфидным минералом, который активно используется в производстве меди, является халькопирит.
Для производства 1 т меди необходимо взять огромное количество сырья, которое ее содержит. Взять, к примеру, производство чугуна, для получения этого металла в объеме 1 тонны потребуется переработать около 2,5 т железной руды. А для получения такого же количества меди потребуется обработка до 200 т руды ее содержащей.
А для получения такого же количества меди потребуется обработка до 200 т руды ее содержащей.
Видео ниже расскажет о добыче меди:
Технология и необходимое оборудование
Производство меди включает в себя ряд этапов:
- Измельчение руды в специальных дробилках и последующее более тщательное ее измельчение в мельницах шарового типа.
- Флотация. Предварительно измельченное сырье смешивается с малым количеством флотореагента и затем помещается во флотационную машину. В качестве такого добавочного компонента обычно выступает ксантогенат калия и извести, который в камере машины покрывается минералами меди. Роль извести на этом этапе крайне важна, поскольку она предупреждает обволакивание ксантогената частичками других минералов. К медным частичкам прилипают лишь пузырьки воздуха, которые выносят ее на поверхность. В результате этого процесса получается медный концентрат, который направляется удаление из его состава избыточной влаги.
- Обжиг. Руды и их концентраты проходят процесс обжига в моноподовых печах, что необходимо для выведения из них серы.
 В результате получается огарок и серосодержащие газы, которые в дальнейшем используют для получения серной кислоты.
В результате получается огарок и серосодержащие газы, которые в дальнейшем используют для получения серной кислоты. - Плавка шихты в печи отражательного типа. На этом этапе можно брать сырую или уже обожженную шихту и подвергать ее обжигу при температуре 1500°С. Важным условием работы является поддержанием нейтральной атмосферы в печи. В итоге происходит сульфидирование меди и ее преобразование в штейн.
- Конвертирование. Полученная медь в сочетании с кварцевым флюсом продувается в специальном конвекторе на протяжении 15-24 ч. В итоге получается черновая медь в результате полного выгорания серы и выведения газов. В ее состав может входить до 3% различных примесей, которые благодаря электролизу выводятся наружу.
- Рафинирование огнем. Металл предварительно расплавляется и затем рафинируется в специальных печах. На выходе образуется красная медь.
- Электролитическое рафинирование. Этот этап проходит анодная и огневая медь для максимальной очистки.
Про заводы и центры производства меди в России и в мире читайте ниже.
Известные производители
На территории России действует всего четыре наибольших предприятия по добыче и производству меди:
- «Норильский никель»;
- «Уралэлектромедь»;
- Новгородский металлургический завод;
- Кыштымский медеэлектролитный завод.
Первые две компании входят в состав известнейшего холдинга «УГМК», который включает в себя около 40 промышленных предприятий. Он производит более 40% всей меди в нашей стране. Последние два завода принадлежат Русской медной компании.
Видеоролик ниже расскажет о производстве меди:
Оксид меди(II), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
температура плавления, физические свойства, сплавы
Твердый металл медь люди научились плавить еще до нашей эры. Название элемента по таблице Менделеева – Cuprum, в честь первого массового расположения производства меди. Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.
Процесс плавления меди
Изготовление предметов требовало множество усилий при отсутствии технологий. В первых шагах развития цивилизации и поиску новых металлов, люди научились добывать и плавить медную руду. Получение руды происходило в малахитовом, а не в сульфидном состоянии. Получение на выходе свободной меди, из которой можно изготавливать детали, требовало обжига. Для исключения окислов, металл с древесным углем размещалась в сосуд из глины. Поджигался металл в специально подготовленной яме, образующийся в процессе угарный газ способствовал процессу появления свободной меди.
Для точных расчетов использовался график плавления меди. В то время производился точный расчет времени и примерная температура, при которой происходит плавка меди.
Содержание
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым. Уровень температуры задерживается на некоторое время, а затем продолжает рост;
- температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.
Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Этапы и сложность задачи зависят от выбора оборудования.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см3;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы.
 Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением. - Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
- Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.

Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка.
 Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах; - многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях.
Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.
Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.
Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель. Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Как уже говорилось выше, удельный вес меди можно подсмотреть в специализированном справочнике, но если под рукой такого нет, то его можно рассчитать по следующей формуле: вес делим на объем и получаем необходимую нам величину. Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.
Рассмотрим, как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м = 1000 мм) * 2000 мм, что составляет 10 000 000 мм3 или 10 000 см3. Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Это удобно, например, для обработки металла.
Единицы измерения удельного веса
В разных системах измерения используются разные единицы для обозначения удельного веса меди:
- В системе измерения СГС или сантиметр-грамм-секунда используется дин/см3.
- В Международной СИ используются единицы н/м3.
- В системе МКСС или метр-килограмм-секунда-свеча применяется кг/м3.
Первые два показателя равны между собой, а третий при конвертации равен 0,102 кг/м3.
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг. Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Области использования меди
Благодаря физико-механическим свойствам, она широко используется для различных отраслей промышленности. Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
В строительной отрасли она используется, прежде всего, для создания разного рода конструкций, которые получаются гораздо меньше по массе, чем из любых других аналогичным материалов. Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Как уже говорилось выше, основное свое применение она находит в изготовлении электрических и иных токопроводящих кабелей, где она используется для изготовления жил проводов и кабелей. Обладая хорошей электропроводностью, она дает достаточное сопротивление электронам тока.
Широко используются также сплавы меди, например, сплав меди и золота повышает прочность последнего в разы.
На стенках медных прокатов никогда не образуются соляные отложения. Такое качество полезно для транспортировки жидкостей и паров.
На основе оксидов меди получают сверхпроводники, а в чистом виде она идет на изготовление гальванических источников питания.
Схема гальванического источника питания
Она входит в состав бронзы, которая обладает стойкостью к агрессивным средам, как морская вода. Поэтому часто ее используют в навигации. Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
электропроводность, свойства, особенности и использование
Во многих отраслях современной промышленности очень широко используется такой материал, как медь. Электропроводность у этого металла очень высокая. Этим и объясняется целесообразность его применения прежде всего в электротехнике. Из меди получаются проводники с отличными эксплуатационными характеристиками. Конечно же, используется этот металл не только в электротехнике, но и в других отраслях промышленности. Объясняется его востребованность в том числе и такими его качествами, как стойкость к коррозионным разрушениям в ряде агрессивных сред, тугоплавкость, пластичность и т.д.
Историческая справка
Медь является металлом, известным человеку с глубокой древности. Объясняется раннее знакомство людей с эти материалом прежде всего его широкой распространенностью в природе в виде самородков. Многие ученые считают, что именно медь была первым металлом, восстановленным человеком из кислородных соединений. Когда-то горные породы просто нагревали на костре и резко остужали, в результате чего они растрескивались. Позднее восстановление меди начали производить на кострах с добавлением угля и поддувом мехами. Совершенствование этого способа в конечном итоге привело к созданию шахтной печи. Еще позже этот металл начали получать методом окислительной плавки руд.
Многие ученые считают, что именно медь была первым металлом, восстановленным человеком из кислородных соединений. Когда-то горные породы просто нагревали на костре и резко остужали, в результате чего они растрескивались. Позднее восстановление меди начали производить на кострах с добавлением угля и поддувом мехами. Совершенствование этого способа в конечном итоге привело к созданию шахтной печи. Еще позже этот металл начали получать методом окислительной плавки руд.
Медь: электропроводность материала
В спокойном состоянии все свободные электроны любого металла вращаются вокруг ядра. При подключении внешнего источника воздействия они выстраиваются в определенной последовательности и становятся носителями тока. Степень способности металла пропускать сквозь себя последний и называется электропроводностью. Единицей ее измерения в Международной СИ является сименс, определяемый как 1 См = 1 Ом-1.
Электропроводность меди очень высока. По этому показателю она превосходит все известные на сегодня неблагородные металлы. Лучше нее ток пропускает только серебро. Показатель электропроводности меди составляет 57х104 см-1 при температуре в +20 °С. Благодаря такому своему свойству этот металл на данный момент является самым распространенным проводником из всех используемых в производственных и бытовых целях.
Лучше нее ток пропускает только серебро. Показатель электропроводности меди составляет 57х104 см-1 при температуре в +20 °С. Благодаря такому своему свойству этот металл на данный момент является самым распространенным проводником из всех используемых в производственных и бытовых целях.
Медь отлично выдерживает постоянные электрические нагрузки и к тому же отличается надежностью и долговечностью. Помимо всего прочего, этот металл характеризуется и высокой температурой плавления (1083,4 °С). А это, в свою очередь, позволяет меди долгое время работать в нагретом состоянии. По распространенности в качестве проводника тока конкурировать с этим металлом может только алюминий.
Влияние примесей на электропроводность меди
Конечно же, в наше время для выплавки этого красного металла используются гораздо более совершенные методики, чем в древности. Однако и сегодня получить совершенно чистый Cu практически невозможно. В меди всегда присутствуют разного рода примеси. Это могут быть, к примеру, кремний, железо или бериллий. Между тем, чем больше примесей в меди, тем меньше показатель ее электропроводности. Для изготовления проводов, к примеру, подходит только достаточно чистый металл. Согласно нормативам, для этой цели можно использовать медь с количеством примесей, не превышающем 0.1 %.
Это могут быть, к примеру, кремний, железо или бериллий. Между тем, чем больше примесей в меди, тем меньше показатель ее электропроводности. Для изготовления проводов, к примеру, подходит только достаточно чистый металл. Согласно нормативам, для этой цели можно использовать медь с количеством примесей, не превышающем 0.1 %.
Очень часто в этом металле содержится определенный процент серы, мышьяка и сурьмы. Первое вещество значительно снижает пластичность материала. Электропроводность меди и серы сильно различается. Ток эта примесь совершенно не проводит. То есть является хорошим изолятором. Однако на электропроводность меди сера не влияет практически никак. То же самое касается и теплопроводности. С сурьмой и мышьяком наблюдается обратная картина. Эти элементы электропроводность меди способны снижать значительно.
Сплавы
Разного рода добавки могут использоваться и специально для повышения прочности такого пластичного материала, как медь. Электропроводность ее они также снижают. Но зато их применение позволяет значительно продлить срок службы разного рода изделий.
Но зато их применение позволяет значительно продлить срок службы разного рода изделий.
Чаще всего в качестве повышающей прочность меди добавки используется Cd (0.9 %). В результате получается кадмиевая бронза. Ее проводимость составляет 90 % от проводимости меди. Иногда вместо кадмия в качестве добавки используют также алюминий. Проводимость этого металла составляет 65 % от этого же показателя меди. Для повышения прочности проводов в виде добавки могут применяться и другие материалы и вещества — олово, фосфор, хром, бериллий. В результате получается бронза определенной марки. Соединение меди с цинком называется латунью.
Характеристики сплавов
Зависеть электропроводность металлов может не только от количества имеющихся в них примесей, но и от других показателей. К примеру с повышением температуры нагрева способность меди пропускать сквозь себя ток снижается. Оказывает влияние на электропроводность такой проволоки даже способ ее изготовления. В быту и на производстве могут использоваться как мягкие отожженные медные проводники, так и твердотянутые. У первой разновидности способность пропускать сквозь себя ток выше.
У первой разновидности способность пропускать сквозь себя ток выше.
Однако больше всего влияют, конечно же, используемые добавки и их количество на электропроводность меди. Таблица ниже представляет читателю исчерпывающую информацию относительно способности пропускать ток наиболее распространенных сплавов этого металла.
Сплав | Состояние (О — отожженная, Т-твердотянутая) | Электропроводность (%) |
Чистая медь | О | 101 |
Т | 98 | |
Оловянная бронза (0.75 %) | О | 55-60 |
Т | 50-55 | |
Кадмиевая бронза (0.9 %) | О | 95 |
Т | 83-90 | |
Алюминиевая бронза (2,5 % А1, 2 % Sn) | О | 15-18 |
Т | 15-18 | |
Фосфористая бронза (7 % Sn, 0,1 % Ρ) | О | 10-15 |
Т | 10-15 |
Электропроводность латуни и меди сравнима. Однако у первого металла этот показатель, конечно же, немного ниже. Но при этом он и выше, чем у бронз. В качестве проводника латунь используется довольно-таки широко. Ток она пропускает хуже меди, но при этом и стоит дешевле. Чаще всего из латуни делают контакты, зажимы и различные детали для радиоаппаратуры.
Однако у первого металла этот показатель, конечно же, немного ниже. Но при этом он и выше, чем у бронз. В качестве проводника латунь используется довольно-таки широко. Ток она пропускает хуже меди, но при этом и стоит дешевле. Чаще всего из латуни делают контакты, зажимы и различные детали для радиоаппаратуры.
Медные сплавы высокого сопротивления
Такие проводниковые материалы применяют в основном при изготовлении резисторов, реостатов, измерительных приборов и электронагревательных устройств. Чаще всего для этой цели используются медные сплавы константан и манганин. Удельное сопротивление первого (86 % Cu, 12 % Mn, 2 % Ni) составляет 0.42-0.48 мкОм/м, а второго (60 % Cu, 40 % Ni) — 0.48-0.52 мкОм/м.
Связь с коэффициентом теплопроводности
Удельная электропроводность меди – 59 500 000 См/м. Этот показатель, как уже упоминалось, верен, однако только при температуре +20 оС. Между коэффициентом теплопроводности любого металла и удельной проводимостью существует определенная связь. Устанавливает его закон Видемана — Франца. Выполняется он для металлов при высоких температурах и выражается в такой формуле: K/γ = π2 / 3 (k/e)2T, где y — удельная проводимость, k — постоянная Больцмана, e — элементарный заряд.
Устанавливает его закон Видемана — Франца. Выполняется он для металлов при высоких температурах и выражается в такой формуле: K/γ = π2 / 3 (k/e)2T, где y — удельная проводимость, k — постоянная Больцмана, e — элементарный заряд.
Разумеется, существует подобная связь и у такого металла, как медь. Теплопроводность и электропроводность у нее очень высокие. На втором месте после серебра она находится по обоим этим показателям.
Соединение медных и алюминиевых проводов
В последнее время в быту и промышленности начало использоваться электрооборудование все более высокой мощности. Во времена СССР проводка изготавливалась в основном из дешевого алюминия. Новым требованиям ее эксплуатационные характеристики, к сожалению, уже не соответствуют. Поэтому сегодня в быту и в промышленности очень часто алюминиевые провода меняются на медные. Основным преимуществом последних, помимо тугоплавкости, является то, что при окислительном процессе их токопроводящие свойства не уменьшаются.
Часто при модернизации электросетей алюминиевые и медные провода приходится соединять. Делать это напрямую нельзя. Собственно, электропроводность алюминия и меди различается не слишком сильно. Но только у самих этих металлов. Окислительные же пленки у алюминия и меди свойства имеют неодинаковые. Из-за этого значительно снижается проводимость в месте соединения. Окислительная пленка у алюминия отличается гораздо большим сопротивлением, чем у меди. Поэтому соединение этих двух разновидностей проводников должно производиться исключительно через специальные переходники. Это могут быть, к примеру, зажимы, содержащие пасту, защищающую металлы от появления окиси. Данный вариант переходников обычно используется при соединении проводов на улице. В помещениях чаще применяются ответвительные сжимы. В их конструкцию входит специальная пластина, исключающая прямой контакт между алюминием и медью. При отсутствии таких проводников в бытовых условиях вместо скручивания проводов напрямую рекомендуется использовать шайбу и гайку в качестве промежуточного «мостика».
Физические свойства
Таким образом, мы выяснили, какая электропроводность у меди. Показатель этот может меняться в зависимости от входящих в состав этого металла примесей. Однако востребованность меди в промышленности определяется и другими ее полезными физическими свойствами, получить информацию о которых можно из представленной ниже таблицы.
Параметр | Значение |
Решетка | Гранецентрированная кубическая, а=3.6074 Å |
Атомный радиус | 1,28 Å |
Удельная теплоемкость | 385,48 дж/(кг·К) при +20 оС |
Теплопроводность | 394,279 вт/(м·К) при +20 оС |
Электрическое сопротивление | 1,68·10-8 Ом·м |
Коэффициент линейного расширения | 17,0·10-6 |
Твердость | 350 Мн/м2 |
Предел прочности при растяжении | 220 Мн/м2 |
Химические свойства
По таким характеристикам медь, электропроводность и теплопроводность которой очень высокие, занимает промежуточное положение между элементами первой триады восьмой группы и щелочными первой группы таблицы Менделеева. К основным ее химическим свойствам относят:
К основным ее химическим свойствам относят:
Наиболее характерным для меди является двухвалентное состояние. Сходства с щелочными металлами она не имеет практически никакого. Химическая активность ее также невелика. В присутствии СО2 или же влаги на поверхности меди образуется зеленая карбонатная пленка. Все соли меди являются ядовитыми веществами. В одно- и двухвалентном состоянии этот металл образует очень устойчивые комплексные соединения. Наибольшее значение для промышленности имеют аммиачные.
Сфера использования
Высокая тепло- и электропроводность меди определяет ее широкое применение в самых разных отраслях промышленности. Конечно же, чаще всего этот металл используется в электротехнике. Однако это далеко не единственная сфера его применения. Помимо всего прочего, медь может использоваться:
Для изготовления разного рода ювелирных изделий используется в основном сплав меди с золотом. Это позволяет увеличить стойкость украшений к деформациям и истиранию. В архитектуре медь может использоваться при облицовке кровель и фасадов. Основным преимуществом такой отделки является долговечность. К примеру, листами именно этого металла обшита крыша широко известной архитектурной достопримечательности — католического собора в немецком городе Хильдесхайме. Медная кровля этого здания надежно защищает его внутреннее пространство вот уже почти 700 лет.
В архитектуре медь может использоваться при облицовке кровель и фасадов. Основным преимуществом такой отделки является долговечность. К примеру, листами именно этого металла обшита крыша широко известной архитектурной достопримечательности — католического собора в немецком городе Хильдесхайме. Медная кровля этого здания надежно защищает его внутреннее пространство вот уже почти 700 лет.
Инженерные коммуникации
Основными преимуществами медных водопроводов также являются долговечность и надежность. Кроме того, этот металл способен придавать воде особые уникальные свойства, делая ее полезной для организма. Для сборки газопроводов и систем отопления медные трубы также подходят идеально – в основном благодаря своей коррозийной стойкости и пластичности. При аварийном повышении давления такие магистрали способны выдерживать гораздо большую нагрузку, чем стальные. Единственным недостатком медных трубопроводов является их дороговизна.
Автор:
Лазько Наталья
Похожие статьи
температура плавления, физические свойства, сплавы
Самостоятельная выплавка меди
Для многих людей плавка меди и изготовление из нее всевозможных изделий является увлекательным хобби. Тем, кто мечтает посвятить плавлению металла свободное время, нужно приготовить для работы такие приспособления:
Тем, кто мечтает посвятить плавлению металла свободное время, нужно приготовить для работы такие приспособления:
- муфельная печка;
- чистое сырье;
- жаропрочный тигель;
- огнеупорная подставка;
- крюк из стальной проволоки;
- щипцы для извлечения тигля из печки;
- средства индивидуальной защиты: костюм, очки, перчатки.
Действия выполняют согласно инструкции:
- Надевают специальный костюм.
- Исходное сырье измельчают, кладут в тигель.
- Помещают в печь, устанавливают нужный температурный режим. Нельзя допускать, чтобы металл закипал.
- При достижении заданной температуры открывают дверцу, захватывают тигель щипцами, достают из печи, ставят на огнеупорную подставку.
- Стальным крюком к краям емкости сдвигают, образовавшуюся в результате плавления, окисную пленку.
- Жидкую медную массу заливают в специальную емкость, охлаждают.
- В мощных муфельных печах можно подвергать плавлению красную медь и всевозможные сплавы.

Плавление горелкой
Следует помнить, что при плавлении важна азотная среда. Под легкоплавкие медные сплавы, латунь или некоторые марки бронзы можно использовать обычную газовую горелку. Для этого понадобится:
- исходное сырье;
- специальные формы;
- щипцы для извлечения металла с раскаленной рабочей поверхности;
- горелка высокого давления, работающая на газе;
- средства защиты: костюм, очки, перчатки.
Технология плавления сплавов следующая:
- Сырье сильно измельчают. Сделать это можно при помощи напильника, превратив материал в опилки.
- Кладут в специальную форму, сделанную из термостойкого материала.
- Надевают защитный костюм, очки, толстые перчатки.
- Зажигают горелку.
- Нагревательное устройство направляют свободными движениями по корпусу емкости. Для достижения быстрого результата пламя должно касаться поверхности кончиком синего цвета. В этом месте факела – наибольшая температура.

- После того как твердое тело расплавится, тигель захватывают щипцами.
- Жидкую массу выливают в нужную форму.
Если нет газовой горелки, можно использовать обыкновенную паяльную лампу.
Выполняя литье цветных сплавов, каждый мастер должен помнить о технике безопасности:
- В помещении, где ведутся работы, должна быть хорошая вентиляция.
- Во избежание получения ожогов необходимо работать в средствах индивидуальной защиты.
Оптимальная температура воздуха, допустимая влажность воздуха, чистота рабочего места, низкая концентрация вредных веществ атмосферы, хорошая освещенность пространства – факторы, помогающие избежать травматизма.
Главное о меди
В таблице Менделеева этот материал получил название Cuprum. Ему присвоен атомный номер 29. Это пластичный материал, отлично обрабатывающийся в твердом виде шлифовальным и резным оборудованием. Хорошая проводимость напряжения позволяет активно использовать медь в электрике и промышленном оборудовании.
В земной коре материал находится в виде сульфидной руды. Часто встречаемые залежи обнаруживаются в Южной Америке, Казахстане, России. Это медный колчедан и медный блеск. Они образовываются при средней температуре, как геотермальные тоненькие пласты. Находят и чистые самородки, которые не нуждаются в отделении шлака, но требуют плавления для добавки других металлов, т. к. в чистом виде медь обычно не используется.
Красновато-желтый оттенок металл имеет благодаря оксидной пленке, покрывающей поверхность сразу, при взаимодействии с кислородом. Оксид не только придает красивый цвет, но и содействует более высоким антикоррозийным свойствам. Материал без оксидной пленки имеет светло-желтый цвет.
Плавится чистая медь при достижении 1080 градусов. Это относительно невысокая цифра позволяет работать с металлом как в производственных условиях, так и дома. Другие физические свойства материала следующие:
- Плотность меди в чистом виде составляет 8,94 х 103 кг/м квадратный.

- Отличается металл и хорошей электропроводностью, которая при средней температуре в 20 градусов является 55,5 S.
- Медь хорошо передает тепло, и этот показатель составляет 390 Дж/кг.
- Выделение углерода при кипении жидкого материала начинается от 2595 градусов.
- Электрическое сопротивление (удельное) в температурном диапазоне от 20 до 100 градусов — 1,78 х 10 Ом/м.
Область применения
Характеристики сплавов ZAMAK позволяют использовать их в различных областях. Самые явные примеры:
- Из этого материала изготавливают дверную фурнитуру. К ней относятся ручки, замочные окантовки и корпуса, петли, декоративные элементы.
- Детали из ЦАМ присутствуют в конструкциях холодильников и другой бытовой техники.
- Популярны сплавы на основе цинка в автомобилестроения. Из них изготавливаются решётки для радиаторов, детали для гидравлических тормозов, корпуса для насосов и карбюраторов.
- Найти элементы, изготовленные из ЦАМ, можно в военном деле.
 Из этого материала делают спусковые крючки для стрелкового оружия.
Из этого материала делают спусковые крючки для стрелкового оружия. - Часто его применяют при изготовлении подшипников для промышленного оборудования.
- Также этот материал используется для изготовления рыболовных снастей и оснастки. Его можно увидеть в деталях удочек и катушках.
Сплавы из меди, цинка и алюминия используются при производстве механизмов для часов, застёжек-молний, пуговиц. В велосипедных тормозах также можно встретить этот материал.
Из ЦАМ изготавливают декоративные предметы. Например, на полках магазинов можно увидеть наборы металлических солдатиков, которые сделаны из этого материала. Его используют ювелиры для изготовления украшений, статуэток и кулонов. Связано это с тем, что в сплаве нет свинца и никеля. Эти компоненты считаются опасными для человека. При изготовлении декоративных украшений, ювелиры покрывают ЦАМ специальными составами, которые делают его похожим на золото и серебро.
Прежде, чем приобретать изделия из ЦАМ, требуется ознакомиться с его сильными и слабыми сторонами. Преимущества:
Преимущества:
- Материал легко поддаётся обработке. Из него можно изготавливать изделия сложной формы.
- Хорошо поддается шлифовке. Абразивный материал не оставляет заусенцев, шероховатостей.
- При покрытии гальваническим слоем материал приобретает устойчивость к воздействию коррозии.
- Небольшой удельный вес.
К недостаткам можно отнести плохую устойчивость к ударам и воздействию высоких температур. Также ЦАМ теряет свои характеристики при быстром снижении температуры. Из-за этого ограничивается область применения материала. Сплав ZAMAK является неизвестным для большинства потребителей. Однако благодаря характеристикам и внешнему виду материал получил широкое распространение в разных отраслях. ЦАМ используют ювелиры для создания украшений сложной формы. Гладкая поверхность позволяет использовать их без дополнительного покрытия.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование. Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Это интересно: Мартенсит и мартенситные стали: виды, структура, превращение
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Сплавы химического элемента меди
Медь, в соединении с другими металлами, образует сплавы с новыми свойствами. В качестве основных добавок используются олово, никель или свинец. Каждый вид соединения обладает особыми характеристиками. Отдельно медь используется редко, поскольку у нее невысокая твердость.
Немного о бронзе
Бронза — название сплава меди и олова. Также в состав соединения входит кремний, свинец, алюминий, марганец, бериллий. У полученного материала показатели прочности выше, чем у меди. Он обладает антикоррозионными свойствами.
С целью улучшения характеристик в сплав добавляются легирующие элементы: титан, цинк, никель, железо, фосфор.
Существует несколько разновидностей бронзы:
- Деформируемые.
 Количество олова не превышает 6%. Благодаря этому, металл обладает хорошей пластичностью и поддается обработке давлением.
Количество олова не превышает 6%. Благодаря этому, металл обладает хорошей пластичностью и поддается обработке давлением. - Литейные. Высокая прочность позволяет использовать материал для работы в сложных условиях.
Сплав никель и медь
В этом соединении используется медь и никель. Если к этой паре добавляются другие элементы, соединения носят такие названия:
- Куниали. К 6–13% никеля еще добавляется 1,5–3% алюминия. Остальное медь.
- Нейзильбер. Содержит 20% цинка и 15% хрома.
- Мельхиор. Присутствует 1% марганца.
- Копелем. Сплав с содержанием 0,5% марганца.
Латунь
Это сплав меди с цинком. Колебание количественного содержания цинка влечет за собой изменение характеристик и цвета сплава.
Кроме этих 2 основных элементов в сплаве содержатся легирующие добавки. Их показатель составляет небольшой процент.
Латунь обладает высокими прочностными характеристиками, пластичностью и способностью противостоять коррозии. Также характеризуется немагнитными свойствами.
Также характеризуется немагнитными свойствами.
Латунь
Плавка металла и чугуна
Печь для плавки металла представляет собой корпус, изготовленный из шамотного кирпича. Связующим элементом является глина. Топка предназначена для горения угля. Снизу предусматривается отверстие, через которое ведется наддув в пекло. Внизу размещается чугунная решетка, которая называется колосником. На ней выкладывается кокс или уголь. Его можно снять со старой печи. Иногда огнеупорный кирпич, при формировании корпуса, укладывается на ребро. Готовая конструкция скрепляется снаружи металлическим поясом.
Печь для переплавки металлов должна иметь тигель. Это может быть эмалированный или чугунный казанок. Месторасположение тигля — рядом с горящим коксом. С целью улучшения поддува рядом устанавливают вентилятор. Оборудование применяется для выплавки стали, но можно использовать как печь для выплавки чугуна.
Температура плавления меди
При нормальных условиях температура плавления меди составляет 1083 градусов по шкале Цельсия. А во время нагрева происходит ряд превращений на молекулярном уровне, что приводит к изменению свойств вещества. Чтобы разобраться во всех этих изменениях, нужно рассмотреть основные этапы нагрева и расплавления медного слитка. Примерный график плавления меди выглядит так:
А во время нагрева происходит ряд превращений на молекулярном уровне, что приводит к изменению свойств вещества. Чтобы разобраться во всех этих изменениях, нужно рассмотреть основные этапы нагрева и расплавления медного слитка. Примерный график плавления меди выглядит так:
- В нормальном состоянии при температуре от 0 до 100 градусов внутри меди образуется прочная кристаллическая решетка, которая обеспечивает материалу большую устойчивость, упругость, химическую инертность. Решетка является достаточно прочной, однако в случае сильной деформации может происходить пространственное изменение положения атомов в решетке. Этим объясняется ковкость и пластичность медных изделий, которые могут сгибаться и деформироваться (скажем, при кузнечной обработке или в случае пресса).
- В нормальном состоянии при температуре от 0 до 100 градусов на поверхности медного изделия также образуется тонкая оксидная пленка. Наличие такой пленки является большим плюсом для изделия, поскольку она выполняет множество важных функций — минимизирует контакт с внешними веществами, защищает материал от коррозии, немного увеличивает прочность.
 В случае охлаждения материала ниже температуры 0 градусов сама медь сохраняет все свои физические свойства. Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно).
В случае охлаждения материала ниже температуры 0 градусов сама медь сохраняет все свои физические свойства. Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно). - При нагреве материала выше температуры 100 градусов происходит постепенная деструкция оксидной пленки на поверхности металла. Это повышает химическую активность материала, что делает его восприимчивым к воздействию веществ во внешней среде. Одновременно с этим при нагреве происходит насыщение энергией атомов меди, что делает материал более пластичным. По этой причине ковку медных изделий выполняют именно после нагрева, поскольку без нагрева для изменения формы изделия понадобится большое количество физических усилий (это может быть мускульная сила кузнеца, расходы электроэнергии для запуска электрического пресса и так далее).
- При достижении температуры 1083 градусов кристаллическая медная решетка начинается постепенно разрушаться, что превращает твердую медь в жидкую.
 На физическом уровне происходит следующее — из-за избытка энергии атомы начинают двигаться в кристаллической решетке более интенсивно и хаотично, что приводит к частому столкновению атомов между собой. В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу).
На физическом уровне происходит следующее — из-за избытка энергии атомы начинают двигаться в кристаллической решетке более интенсивно и хаотично, что приводит к частому столкновению атомов между собой. В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу). - При остывании медной жидкости ниже температуры 1083 градусов происходит постепенная кристаллизация вещества. Медь вновь обретает твердую форму (чем ниже температура, тем интенсивней происходит затвердение вещества). Однако при необходимости жидкую медь можно и дальше нагревать (на химическом уровне будет происходить дальнейшее насыщение атомов энергией). При достижении температуры 2595 градусов по Цельсию жидкость начнет закипать, а медь начнет принимать газообразную форму.
 На практике длительное удержание вещества в газообразной форме проблематично — при контакте с атмосферным воздухом вещество будет быстро остывать, обратно превращаясь в жидкость. Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
На практике длительное удержание вещества в газообразной форме проблематично — при контакте с атмосферным воздухом вещество будет быстро остывать, обратно превращаясь в жидкость. Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
Чтобы расплавить/испарить медное изделие с помощью высокоточного нагревательного прибора, нагревать рекомендуется до чуть более высокой температуры. Скажем, в случае расплавления нагревать изделие следует до температуры 1100-1200 градусов (а не 1083 градусов). С практической точки зрения объясняется это просто — нагрев вещества происходит неравномерно, поэтому некоторые фрагменты медного изделия будут долго держать свою форму, тогда как другие — быстро расплавятся. К тому же вещество будет постоянно остывать, что может привести к кристаллизации отдельных фрагментов расплава.
Характеристика способов плавления меди
Муфельная печь
Из чего состоит муфельная печь
Литье с использованием лабораторной муфельной печи, в которой имеется регулировка температуры нагрева. Это довольно простой метод. Сырье предварительно измельчают на части. Чем они меньше, тем быстрее будет плавление.
Подготовленный материал кладут в графитовый тигель и помещают в предварительно разогретую печь. Форма для заливки должна иметь температуру плавления больше, чем у меди. Нагревательное устройство серийного производства оборудовано специальным окном, позволяющим следить за технологическим процессом.
Когда медь достигнет жидкого состояния, тигель железными щипцами извлекают из печи. Проволочным крюком с поверхности расплавленного металла к краям тигля убирают оксидную пленку. После проделанных манипуляций жидкую консистенцию аккуратно заливают в заранее приготовленную емкость.
Газовая горелка
Также осуществляется плавка меди с применением газовой горелки. При отсутствии тигельной печи вполне подойдет ручная портативная газовая горелка. Ее нужно разместить под дном емкости с металлом и следить за тем, чтобы пламя полностью охватывало днище.
При отсутствии тигельной печи вполне подойдет ручная портативная газовая горелка. Ее нужно разместить под дном емкости с металлом и следить за тем, чтобы пламя полностью охватывало днище.
Метод позволяет быстро окислять материал, так как предполагает наличие тесного контакта с воздухом. Чтобы не образовывалась толстая оксидная пленка, расплавленную массу присыпают измельченным древесным углем.
Паяльная лампа
Литье меди на основе паяльной лампы происходит так же, как и с газовой горелкой. Способ применим для легкоплавких металлов.
Горн
Растопить медь или её сплавы можно горном. Для этого на хорошо раскаленный древесный уголь помещают тигель с измельченным металлом. Для ускорения процесса используют домашний пылесос, включенный на режиме выдувания.
Труба должна быть небольшого диаметра с железным наконечником, так как пластик расплавится под влиянием высокой температуры. Метод идеально подходит тем людям, кто регулярно занимается литьем металла и в больших объемах.
Микроволновка
Расплавить медь поможет мощная микроволновая печь с измененной конструкцией. Для этого убирают вращающуюся тарелку-поддон. Из огнеупорного кирпича делают муфельную печь, в которую помещают исходный материал. Устройство необходимо для повышения теплосберегающих свойств сырья и защиты элементов техники от перегрева.
Чистую медь трудно плавить, поскольку она в жидком виде обладает плохой текучестью. Специалисты не советуют из такого материала делать мелкие и сложные детали. Для этого подойдут многокомпонентные соединения на основе латуни, олова или цинка, которым высокие температуры не нужны.
Медные сплавы, их свойства, характеристики, марки
Изготовление медных сплавов позволяет улучшить свойства меди, не теряя основных преимуществ данного металла, а также получить дополнительные полезные свойства.
Бронза
Сплав меди с оловом. Однако, с развитием технологий появились также бронзы, в которых вместо олова в состав сплава вводятся алюминий, кремний, бериллий и свинец.
Бронзы твёрже меди. У них более высокие показатели прочности. Они лучше поддаются обработке металла давлением, прежде всего, ковке.
Маркировка бронз производится буквенно-цифровыми кодами, где первыми стоят буквы Бр, означающими собственно бронзу. Добавочные буквы означают легирующие элементы, а цифры после букв показывают процентное содержание таких элементов в сплаве.
Буквенные обозначения легирующих элементов бронз:
- А – алюминий,
- Б – бериллий,
- Ж – железо,
- К – кремний,
- Мц – марганец,
- Н – никель,
- О – олово,
- С – свинец,
- Ц – цинк,
- Ф – фосфор.
Пример маркировки оловянистой бронзы: БрО10С12Н3. Расшифровывается как «бронза оловянистая с содержанием олова до 10%, свинца – до 12%, никеля – до 3%».
Пример расшифровки алюминиевой бронзы: БрАЖ9-4. Расшифровывается как «бронза алюминиевая с содержанием алюминия до 9% и железа до 4%».
Расшифровывается как «бронза алюминиевая с содержанием алюминия до 9% и железа до 4%».
Латунь
Это сплав меди с цинком. Кроме цинка содержит и иные легирующие добавки, также и олово.
Латуни – коррозионно устойчивые сплавы. Обладают антифрикционными свойствами, позволяющими противостоять вибрациям. У них высокие показатели жидкотекучести, что даёт изделиям из них высокую степень устойчивости к тяжёлым нагрузкам. В отливках латуни практически не образуются ликвационные области, поэтому изделия обладают равномерной структурой и плотностью.
Маркируются латуни набором буквенно-цифровых кодов, где первой всегда стоит буква Л, означающая собственно латунь. Далее следует цифровой указатель процентного содержания меди в латуни. Остальные буквы и цифры показывают содержание легирующих элементов в процентном соотношении. В латунях используются те же буквенные обозначения легирующих элементов, что и в бронзах.
Пример маркировки латуни двойной: Л85. Расшифровывается как «латунь с содержанием меди до 85%, остальное – цинк».
Пример маркировки латуни многокомпонентной: ЛМцА57-3-1. Расшифровывается как «латунь с содержанием меди до 57%, марганца – до 3%, алюминия – до 1%, остальное – цинк».
Медно-никелевые сплавы
- Мельхиор – сплав меди и никеля. В качестве добавок в сплаве могут присутствовать железо и марганец. Частные случаи технических сплавов на основе меди и никеля:
- Нейзильбер – дополнительно содержит цинк,
- Константан – дополнительно содержит марганец.
У мельхиора высокая коррозионная устойчивость. Он хорошо поддаётся любым видам механической обработки. Немагнитен. Имеет приятный серебристый цвет.
Благодаря своим свойствам мельхиор является, прежде всего, декоративно-прикладным материалом. Из него изготавливают украшения и сувениры. В декоративных целях является отличным заменителем серебра.
Выпускается 2 марки мельхиора:
- МНЖМц – сплав меди с никелем, железом и марганцем;
- МН19 – сплав меди и никеля.
5 Применение сплавов
Пожалуй, трудно отыскать производственную отрасль, которая бы не использовала изделия из меди или ее сплавов.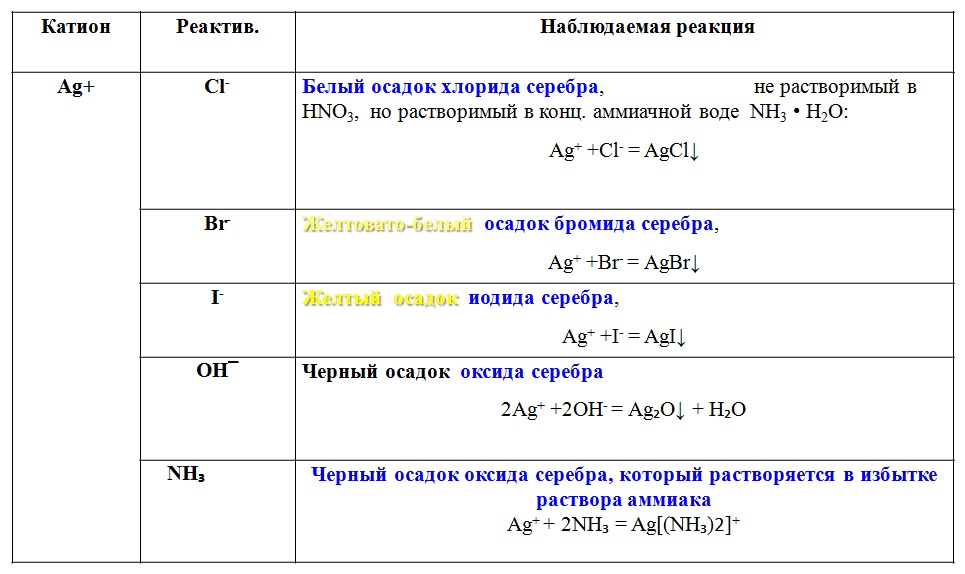 В чистом виде такой металл, как медь, задействован в электротехнических коммуникациях. Электрическая проводка, электродвигатели и кабельные изделия невозможно представить без участия меди.
В чистом виде такой металл, как медь, задействован в электротехнических коммуникациях. Электрическая проводка, электродвигатели и кабельные изделия невозможно представить без участия меди.
Медное кабельное изделие
Трубопроводы, вакуумные машины, теплообменные камеры на 1/3 состоят из меди.
Сплавы благодаря их выверенным свойствам применяют в автомобильной промышленности и сельскохозяйственном машиностроении. Высокая устойчивость к коррозии позволяет медным сплавам участвовать в изготовлении химической аппаратуры, а сплав меди со свинцом используется в производстве сверхпроводниковой техники.
Изделия со сложным узором требуют вязких и пластичных сплавов, например, сплав серебра. Этим запросам отвечает мягкая медь, из которой можно формировать любые шнуры и элементы. Проволоку легко гнуть и паять вместе с такими элементами, как золото и серебро.
Проволоку легко гнуть и паять вместе с такими элементами, как золото и серебро.
До какой температуры можно нагревать мёд? Как и зачем это делать?
Что касается засахаренного продукта, нагревать мёд можно. Иногда это единственный способ его использовать, но делаем все крайне аккуратно
Важно регулярно помешивать, не допускать перегрева отдельных участков. Нагревают обычно до чуть теплого состояния, ориентируются по консистенции, растворение происходит примерно при 40 градусах
Как только кристаллики расплавятся, мёд готов к использованию.
В теплой воде. Поставить банку в миску с жидкостью, подогреть, после расплавления набрать нужное количество;
В микроволновой печи. Каждые 10 секунд нужно доставать и размешивать, так как прогрев происходит неравномерно;
На водяной бане
Важно следить и помешивать, обычно откладывают необходимое количество мёда;
Вблизи отопительного прибора, радиатора. Нужно поставить мёд и дождаться, пока он медленно растопится
Процесс может занять целый день.
Как именно растопить мёд в домашних условиях, читайте в статье: Как правильно растопить мёд дома.
Из всех способов выигрывает водяная баня. Во-первых, разогревается только нужное количество мёда. Во-вторых, легко размешивать и следить за температурой. Как только мёд растает, можно сразу его сразу снять.
Также хороший способ, используемый пчеловодами для нагревания, установить тару с мёдом в теплом помещении вблизи отопительных приборов.
Другие востребованные медные сплавы
Известны и другие сплавы меди с разными металлами, однако у одних шире область применения, чем у других.
Свойства и применение медно-никелевых сплавов.
Сплавы из меди и никеля в основном содержат медную составляющую, а никель добавляется как легирующий элемент. Результатом такого соединения является сплав с повышенными показателями антикоррозионной стойкости, прочности и электросопротивления. Сплавы медно-никелевого состава относят к одному из двух видов: электротехническому или конструкционному.
Конструкционные сплавы – это нейзильбер и мельхиор. Мельхиором называют сочетание, в составе которого медь, никель (5–35 %), цинк (13–45 %). Нейзильбер представляет собой соединение меди и никеля, иногда в смесь добавляются железо и марганец. Мельхиоровые изделия наверняка имеются у многих дома, особая популярность принадлежит знаменитым подстаканникам.
У электротехнических медно-никелевых сплавов высокое электросопротивление. В эту группу входят константан и копель. В составе термостабильного соединения − константана − чуть больше половины, примерно 59 %, занимает медь, никель составляет 39–41 %, марганец всего 1-2 %. Материал отличается высоким удельным электрическим сопротивлением (около 0,5 мкОм-м), минимальным значением термокоэффициента электрического сопротивления, высокой электродвижущей силой в паре с медью, хромом, железом. Копелем называют сплав, в котором никель составляет 43-44 %, железо 2-3 %, остальную часть занимает медь.
Состав и свойства медных сплавов, в данном случае медно-никелевых, подходят для применения в электрических аппаратах и следующих типах изделий: резисторов, реостатов, термопар. Из материалов этого вида изготавливается посуда, медицинский инструмент, художественные изделия и сувениры. Медно-никелевые соединения применяются в строительстве судов. Банк России заказывает из этого сплава монеты достоинством один и два рубля по образцу 1997 г.
Из материалов этого вида изготавливается посуда, медицинский инструмент, художественные изделия и сувениры. Медно-никелевые соединения применяются в строительстве судов. Банк России заказывает из этого сплава монеты достоинством один и два рубля по образцу 1997 г.
Свойства и применение вольфрамово-медных сплавов.
Очень необычные свойства у вольфрамово-медного соединения CuW или WCu. Это сочетание по большому счету назвать полноценным сплавом нельзя. В полученном материале частицы одного металла равномерно распределяются внутри кристаллической решетки второго. В сплаве сочетаются качества и меди, и вольфрама, благодаря чему он отличается термостойкостью, устойчивостью к абляции, высокой тепло- и электропроводностью. К тому же он хорошо поддается обработке. Для изготовления деталей применяется следующая технология: вольфрамовые частицы прессуют и уплотняют, придавая необходимую форму, затем проходит этап инфильтрации медного расплава.
Космическая индустрия, электроэнергетика, металлургия, машиностроение, электроника – вот неполный перечень промышленных областей, где используют сплав меди и вольфрама. Из этого материала изготавливают электроды для сварочных аппаратов – детали из сплава выдерживают высокое и среднее напряжение при дуговой и вакуумной сварке.
Из этого материала изготавливают электроды для сварочных аппаратов – детали из сплава выдерживают высокое и среднее напряжение при дуговой и вакуумной сварке.
Свойства и применение молибденово-медных сплавов.
Сплав из меди и молибдена обладает меньшим весом, чем медно-вольфрамовый. Это преимущество используют там, где нужно уменьшить массу изделия. Заготовки из молибденово-медного сплава – это плоские пластинки, имеющие многослойную структуру. Внутри располагается основной слой чистого молибдена, который с двух сторон покрывают слоями 100%-ной меди или медью с дисперсионно-упрочненными качествами.
Данный вид медных сплавов обладает свойствами обоих видов металлов и отличается хорошими комплексными характеристиками. Вот некоторые качества данного соединения:
— высокая проводимость;
— возможность регулирования коэффициента теплового расширения;
— низкий процент содержания газов;
— сплав не магнитится;
— у материала имеются необходимые вакуумные свойства;
— легко обрабатывается механическим путем, обладает особыми высокотемпературными качествами.
При отсутствии скачков температуры и при средних температурных показателях у молибденово-медного сплава хорошие показатели прочности и пластичности. Когда внешняя температура выше температуры плавления меди, металл сжимается, испаряется и поглощает тепло, он может оказывать охлаждающее воздействие. Данные качества высокотемпературного материала могут использоваться в технологиях изготовления огнеупорных вкладышей горла сопла, электрических контактов и т. д.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Поставка
Вас интересуют техническая и чистая медь? Поставщик «Auremo» предлагает купить техническую и чистую медь сегодня на выгодных условиях. Большой выбор на складе. Полное соответствие ГОСТ и международным стандартам качества, цена — оптимальная от поставщика. Предлагаем купить техническую и чистую медь со специализированных складов с доставкой в любой город. Купить сегодня. Оптовым заказчикам цена — льготная.
Купить, выгодная цена
Техническая и чистая медь от поставщика «Auremo» соответствует ГОСТ и международным стандартам качества, цена — оптимальная. На складе представлен самый широкий выбор продукции. Всегда в наличии техническая и чистая медь, цена — обусловлена технологическими особенностями производства без включения дополнительных затрат. Оптимальная цена от поставщика. Купить сегодня. Ждем ваших заказов. У нас наилучшее соотношение цена-качество на весь ряд продукции. На связи опытные менеджеры — оперативно помогут купить медный прокат оптом или в рассрочку. Постоянные покупатели могут купить медный прокат с дисконтной скидкой.
Ждем ваших заказов. У нас наилучшее соотношение цена-качество на весь ряд продукции. На связи опытные менеджеры — оперативно помогут купить медный прокат оптом или в рассрочку. Постоянные покупатели могут купить медный прокат с дисконтной скидкой.
Производство латуни
Современные способы производства латуни основаны на плавлении халькопирита (медный колчедан) в электрических печах при температуре +1400 °C. Образующийся в процессе плавления силикат всплывает на поверхность и удаляется. Основной металл (штейн) сливается в конвертер и продувается кислородом. В результате окислительных реакций образуется металлическая «черновая» медь с содержанием металла около 91%. Далее происходит электролитическая очистка в подкисленном растворе медного купороса. Образующаяся на катоде электролитическая медь имеет чистоту 99.99% и используется в производстве проводов, электрического оборудования и сплавов.
В расплавленную медь порционно вводят цинк, который придает ей новые свойства — прочность, коррозионную стойкость и пластичность.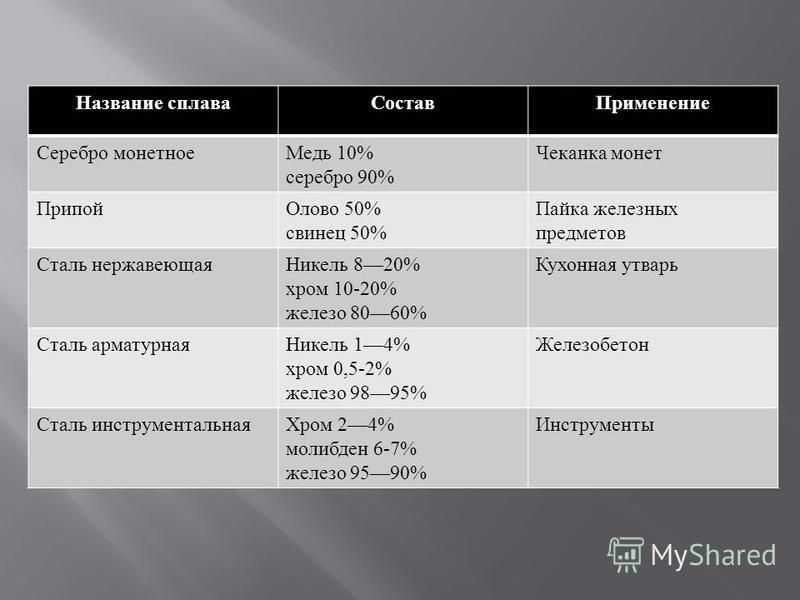 В зависимости от области применения металла могут добавляться и другие добавки: никель, железо, олово, марганец, алюминий. Изготовленный таким способом сплав из меди имеет низкий коэффициент трения и применяется в изготовлении червячных пар и в качестве втулок скольжения в малых бытовых электродвигателях.
В зависимости от области применения металла могут добавляться и другие добавки: никель, железо, олово, марганец, алюминий. Изготовленный таким способом сплав из меди имеет низкий коэффициент трения и применяется в изготовлении червячных пар и в качестве втулок скольжения в малых бытовых электродвигателях.
Одним из видов латуни является томпак (медь — 88–97%, цинк — до 10%), который повторно был открыт лондонским часовщиком Кристофером Пинчбеккером в XVIII веке. Ранее этот сплав был известен перуанской цивилизации Моче. Название его происходит от французского tombak, что в переводе означает медь.
Широкое применение томпак получил в плакировании стали и получении биметаллического соединения сталь-латунь.
Латунь получают путем плавления меди и стали.
Например, внутренняя поверхность ядерного реактора плакирована высоколегированной аустенитной сталью, так как основной металл корпуса подвержен коррозии при воздействии высоких температур.
Томпак применяется для плакирования стали при изготовлении монет достоинством 10 и 50 копеек.
Это интересно: Описание и виды твердосплавных пластин для токарных резцов: рассказываем по порядку
Сварка меди | Сварка и сварщик
Физико-химические свойства меди
Медь – химический элемент I В группы Периодической системы Д. И. Менделеева с порядковым номером 29 и атомной массой 63,54. Медь кристаллизуется в кубической гранецентрированной решетке, полиморфизмом не обладает, относится к тяжелым металлам, плотность меди различна в зависимости от обработки и составляет, г/см3: литой – 8,930, деформированной – 8,940, электролитической – 8,914.
Плотность, г/см3 | ?8,9 |
Температура плавления, °С | 1083 |
Температура кипения, °С | 2595 |
Удельная теплоемкость, Дж×г-1×град-1 | 0,383 |
Коэффициент теплопроводности, Дж×см-1×с-1×град-1 | 3,83 |
Удельное электрическое сопротивление, мкОм×м | 0,0178 |
Предел упругости, МПа: | |
деформированной | 300 |
отожженной | 25 |
Предел текучести, МПа: | |
деформированной | 380 |
отожженной | 70 |
Медь обладает высокой теплопроводностью – в 6,3 раза большей, чем у железа, и в 5,7 раза большей, чем у железа, электропроводностью. Тепло- и электропроводность меди уменьшается при введении примесей.
Тепло- и электропроводность меди уменьшается при введении примесей.
При обычных условиях медь достаточно инертна, но при нагревании она реагирует с кислородом, серой, фосфором, галогенами, водородом, образуя неустойчивый гидрид CuH, с углеродом образует взрывоопасную ацетиленистую медь Cu2C2, с азотом практически не реагирует, что позволяет использовать азот в качестве защитного газа при сварке чистой меди.
Взаимодействие с кислородом. Медь очень чувствительна к кислороду. В условиях сварки она может окисляться за счет газовой атмосферы или за счет обменных реакций с компонентами флюсов и электродных покрытий.
а – общий вид диаграммы, б – верхний левый угол
Рисунок 1 – Диаграмма состояния системы медь-кислород
На рисунке 1 приведена диаграмма состояния медь-кислород. При низких температурах растворимость кислород в твердой меди мала и резко возрастает в жидкой меди за счет образования оксид меди CuO2, которая при затвердевании выделяется в виде эвтектики Cu-Cu2O, располагаясь по границам кристаллитов. При рассмотрении под микроскопом оксид меди Cu2O имеет голубоватую окраску в рассеянном свете и рубиново-красную в поляризованном, что является ее характерной особенностью, Cu2O, как отдельная фаза легко восстанавливается до меди по реакциям:
При рассмотрении под микроскопом оксид меди Cu2O имеет голубоватую окраску в рассеянном свете и рубиново-красную в поляризованном, что является ее характерной особенностью, Cu2O, как отдельная фаза легко восстанавливается до меди по реакциям:
CuO2+2[H] = 2Cu + H2O
Cu2O + CO = 2Cu = CO2
Газы, образующиеся в результате этих реакций, в меди не растворяются и, создавая большие давления, приводят к образованию трещин, возникает так называемая «водородная болезнь» меди.
Кислород, содержащийся в меди, ухудшает ее прочность и пластичность, повышает твердость, уменьшает тепло- и электропроводность.
Если при сварке меди не приняты соответствующие меры предосторожности, следует ожидать процесса окисления меди в местах, где она была подвергнута оплавлению и высокому нагреву. Следовательно, при выполнении электросварочных работ следует принимать специальные меры, предотвращающие доступ кислорода воздуха к расплавленной меди, или делать этот период возможно коротким.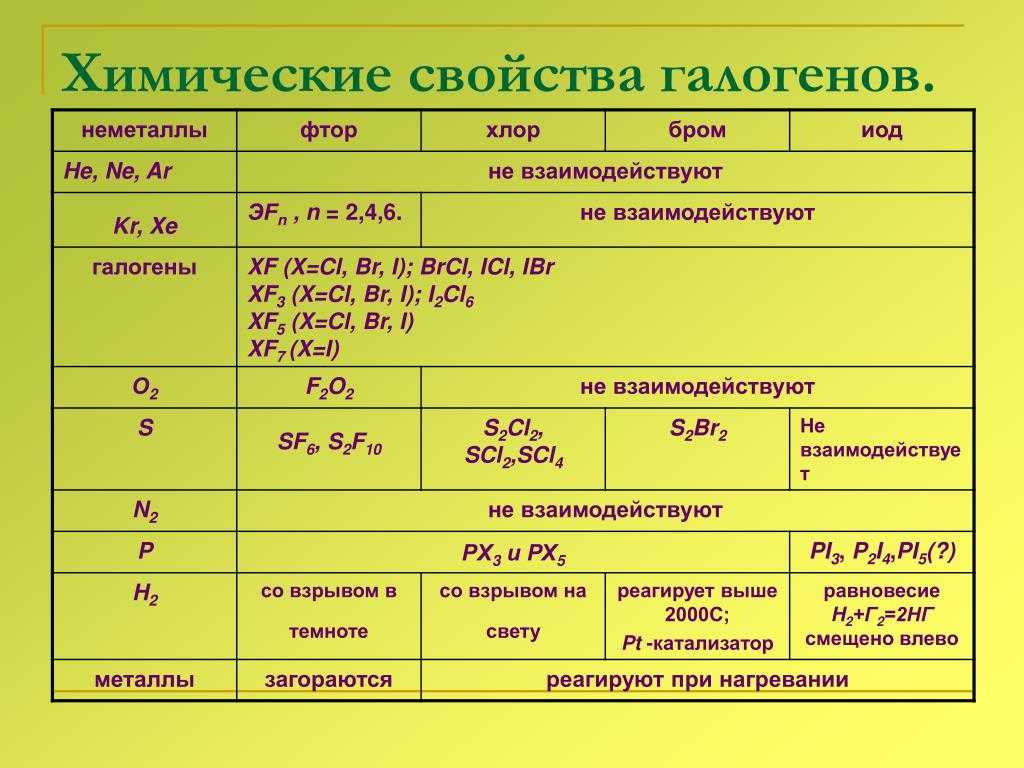
Взаимодействие с серой.Диаграмма состояния Cu-S приведена на рисунке 2. Сера хорошо растворима в жидкой меди и практически не растворима в твердой. Содержание S и Cu регламентируется ГОСТ 859 и ее присутствие в ограниченном количестве до 0,1 % (по массе) существенно не отражается на процессе сварки.
Рисунок 2 – Диаграмма состояния системы медь-сера
Взаимодействие с водородом. Водород влияет на качество сварных соединений из меди и ее сплавов, вызывая пористость в металле шва и образование трещин. Водород растворяется в меди в соответствии с законом Сивертса и его растворимость зависит от температуры и парциального давления в газовой атмосфере. Растворимость водорода в меди в процессе кристаллизации изменяется почти в два раза сильнее, чем в железе (рисунок 3), это приводит к тому, что при высокой скорости кристаллизации сварочной ванны при сварке меди газ не успевает выделяться из металла, образуя поры или концентрируясь в микронесплошностях, создает высокое давление, приводящее к зарождению трещины. При сварке не исключена возможность образования дефектов в результате термической диффузии водорода из основного металла к шву. Концентрируясь вблизи линии сплавления, водород создает пористость в околошовной зоне. Поэтому при сварке ответственных изделий из меди, в которых необходима высокая плотность металла, к основному металлу необходимо предъявлять жесткие требования по содержанию в нем водорода. Электрошлаковый переплав или вакуумная плавка значительно снижают содержание водорода в меди.
При сварке не исключена возможность образования дефектов в результате термической диффузии водорода из основного металла к шву. Концентрируясь вблизи линии сплавления, водород создает пористость в околошовной зоне. Поэтому при сварке ответственных изделий из меди, в которых необходима высокая плотность металла, к основному металлу необходимо предъявлять жесткие требования по содержанию в нем водорода. Электрошлаковый переплав или вакуумная плавка значительно снижают содержание водорода в меди.
Рисунок 3 – Изобары растворимости водорода в меди и железе
Марки литой и деформированной меди в зависимости от химического состава по ГОСТ 859-2001 указаны в таблице 1.
Таблица 1 – Химический состав литой и деформированной меди
Свариваемость меди
Особенности свариваемости
Сварка чистой меди существенно отличается от сварки сталей в силу особенностей теплофизических свойств этих металлов. Большие тепло- и температуропроводности меди создают высокие градиенты температуры и скорости охлаждения, а также определяют малое время существования сварочной ванны, что требует применения повышенной погонной энергии или предварительного подогрева, а это является нежелательным осложнением технологии сварки. Значительный коэффициент линейного расширения и его зависимость от температуры вызывают необходимость сварки при жестком закреплении кромок или по прихваткам. При большой толщине металла следует регулировать величину зазора при сварке. Малое время существования сварочной ванны в жидком состоянии ограничивает возможности ее металлургической обработки. В частности, при раскислении меди требуются более активные раскислители, чем при сварке сталей.
Значительный коэффициент линейного расширения и его зависимость от температуры вызывают необходимость сварки при жестком закреплении кромок или по прихваткам. При большой толщине металла следует регулировать величину зазора при сварке. Малое время существования сварочной ванны в жидком состоянии ограничивает возможности ее металлургической обработки. В частности, при раскислении меди требуются более активные раскислители, чем при сварке сталей.
Сопротивляемость горячим трещинам
Особенностью сварки меди является склонность швов к образованию горячих трещин. Кислород, сурьма, висмут, сера и свинец образуют с медью легкоплавкие эвтектики, которые скапливаются по границам кристаллитов. Это требует ограничения содержания примесей в меди:
- кислород (O2) – до 0,03
- висмут (Bi) – до 0,003
- сурьма (Sb) – до 0,005
- свинец (Pb) – до 0,03% (по массе)
Для ответственных конструкций содержание этих примесей должно быть еще ниже:
- кислород (O2)≤0,01
- висмут (Bi)≤0,0005
- свинец (Pb)≤0,004%
Для особо ответственных изделий содержание кислорода (O2) должно быть значительно ниже – менее 0,003 % (по массе). Содержание серы (S) не должно превышать 0,1 % (по массе).
Содержание серы (S) не должно превышать 0,1 % (по массе).
Склонность к порообразованию
Медь проявляет повышенную склонность к образованию пор в металле шва и околошовной зоне. Причиной образования пор является водород (Н2), водяные пары или образующийся углекислый газ при взаимодействии окиси углерода с закисью меди.
Высокие градиенты температуры способствуют развитию термической диффузии водорода в зоне термического влияния, что приводит к сегрегации водорода вблизи линии сплавления и увеличивает вероятность возникновения дефектов: пор, трещин. Растворимость водорода в меди зависит от содержания в ней кислорода и легирующих компонентов.
Влияние примесей на свариваемость и свойства меди
Свариваемость меди во многом зависит от наличия примесей в меди. Примеси, содержащиеся в меди, оказывают различное влияние на ее свариваемость, механические и технологические свойства: некоторые примеси улучшают эти свойства, а другие ухудшают.
Широко применяемая для изготовления различных конструкций листовая медь марок М1, М2, М3 содержит кислород, висмут, свинец, сурьму, серу, мышьяк и др.
Кислород и водород. Большое влияние на свариваемость меди оказывает содержание кислорода: чем больше кислорода содержит медь, тем хуже ее свариваемость. В марках меди М2 и М3 допускается содержание кислорода до 0,1%. Кислород в меди главным образом находится в виде оксида меди (Cu2O). При сварке в тех местах, где медь была нагрета до высокой температуры, наблюдается увеличение содержания кислорода за счет поглощения его из воздуха.
Особенно резкое увеличение кислорода происходит в зоне расплавления меди и разогрева ее до температуры, близкой к температуре плавления.
Увеличение окиси меди в зоне термического влияния увеличивает хрупкость и часто приводит к образованию трещин при деформации в холодном и горячем состоянии. Во время сварки при нагреве меди, содержащей 0,01% кислорода и больше, в восстановительной газовой атмосфере, которая создана водородом или окисью углерода, газы, диффундируя внутрь твердой меди, восстанавливают ее и образуют одновременно пары воды и углекислый газ, не растворимые в меди. Находясь под большим давлением из-за высокой температуры, пары воды или углекислый газ разрывают металл, образуя крупные и мелкие межкристаллические трещины.
Находясь под большим давлением из-за высокой температуры, пары воды или углекислый газ разрывают металл, образуя крупные и мелкие межкристаллические трещины.
Разрушение меди вследствие «водородной болезни» может происходить в процессе выполнения сварки и при последующих деформациях в холодном или горячем состоянии.
Висмут. Висмут почти не растворим в твердой меди, он образует легкоплавкие и хрупкие оболочки вокруг зерен меди, отчего сварной шов становится хрупким в холодном и горячем состоянии. Содержание висмута в меди допускается не более 0,003%. На электропроводность меди висмут заметного влияния не оказывает.
Свинец. Содержание свинца в меди до десятых долей процента при обычной температуре не оказывает вредного влияния, при повышенной температуре содержание свинца в этой пропорции вызывает красноломкость. Заметного влияния на электропроводность и теплопроводность меди он не оказывает, но значительно улучшает её обрабатываемость резанием.
Сурьма. Сурьма растворима в меди в твёрдом состоянии при температуре эвтектики 645°С до 9,5%. Растворимость её резко уменьшается при понижении температуры. Сурьма значительно понижает электропроводность и теплопроводность меди.
Сера. Сера является вредной примесью в меди, так как она образует сульфид. При большом содержании серы сульфид располагается по границам зерен, вызывая понижение прочности меди и делая ее красноломкой. Во время сварки меди, содержащей серу, в сварочной ванне возникает химическая реакция. В результате этой реакции образуется сернистый газ (SO2), который, выделяясь при остывании, дает пористый шов. Сера незначительно влияет на электропроводность и теплопроводность меди, заметно снижает пластичность. Под влиянием серы улучшается обрабатываемость меди резанием.
Селен. Селен малорастворим в меди в твёрдом состоянии – до 0,1% и выделяется при затвердевании в виде соединения Se2О. Селен незначительно влияет на тепло- и электропроводность меди, заметно снижает пластичность.
Селен незначительно влияет на тепло- и электропроводность меди, заметно снижает пластичность.
Мышьяк. Содержание в меди до 0,05% мышьяка не ухудшает ее свариваемость и способствует получению плотных швов, что улучшает свойства сварного соединения. Мышьяк растворим в меди в твёрдом состоянии до 7,5%. Он значительно понижает электропроводность и теплопроводность, но значительно повышает жаростойкость меди.
Фосфор является одним из лучших раскислителей и содержание его в шве в небольших количествах не только не ухудшает качество сварки, а наоборот, переводя окислы в шлак, повышает прочность сварного соединения. Содержание фосфора в наплавленном металле, однако, не должно превышать 0,1%; при большем его содержании шов становится хрупким, что необходимо учитывать при выборе присадочного металла.
Являясь хорошим раскислителем, фосфор в то же время снижает способность меди поглощать газы и повышает ее жидкотекучесть. Последняя оказывает существенное влияние на качество сварки.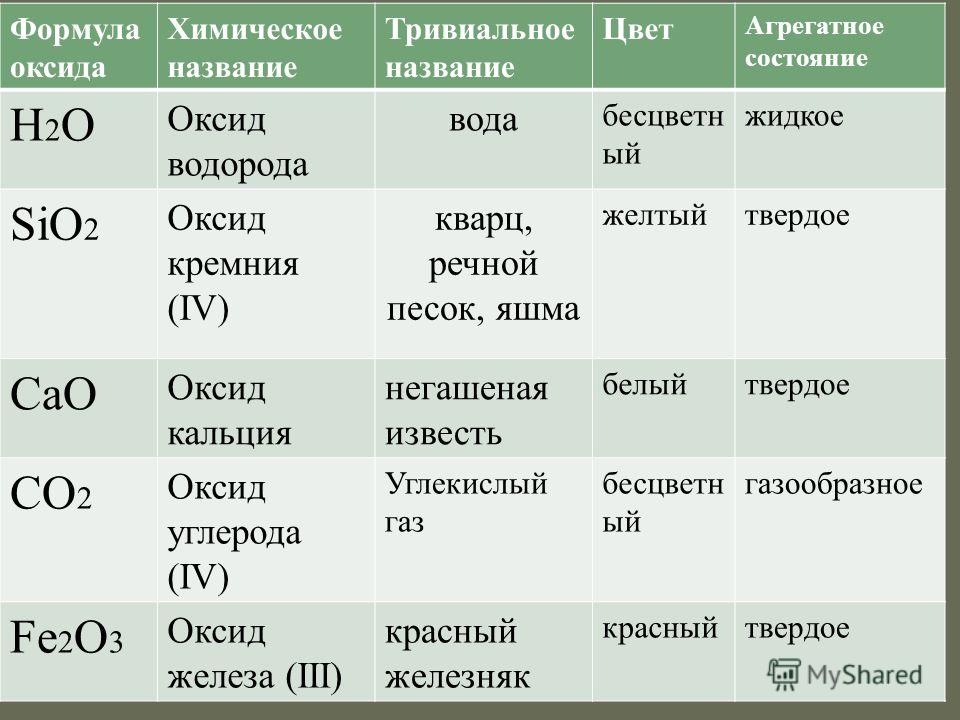 Практикой установлено, что большая жидкотекучесть расплавленного металла разрешает повышать скорость сварки. Это особенно важно для сварки меди, так как качество сварного шва при повышенной скорости сварки выше. Фосфор значительно понижает тепло- и электропроводность меди, но положительно влияет на механические свойства и свариваемость.
Практикой установлено, что большая жидкотекучесть расплавленного металла разрешает повышать скорость сварки. Это особенно важно для сварки меди, так как качество сварного шва при повышенной скорости сварки выше. Фосфор значительно понижает тепло- и электропроводность меди, но положительно влияет на механические свойства и свариваемость.
Алюминий. Алюминий неограниченно растворим в расплавленной меди, в твёрдом состоянии растворимость его равна 9,8%. Алюминий повышает коррозионную стойкость меди, уменьшает окисляемость и понижает электропроводность и теплопроводность меди.
Серебро. Серебро не оказывает влияния на технические свойства меди, мало влияет на её электропроводность и теплопроводность.
Теллур. Теллур растворим в меди в твёрдом состоянии до 0,01%. На электропроводность меди теллур значительного влияния не оказывает.
Бериллий. Бериллий понижает электропроводность меди, повышает механические свойства и резко уменьшает окисляемость меди при повышенных температурах.
Железо. Железо незначительно растворимо в меди в твёрдом состоянии. При 1050°С до 3,50% железа входит в твёрдый раствор, а при 635°С растворимость его падает до 0,15%. Под влиянием железа повышаются механические свойства меди, резко снижаются её электропроводность, теплопроводность и коррозионная стойкость.
Подготовка под сварку металла и электродной проволоки
Проволоки, листы, плиты, трубы и другие полуфабрикаты из меди должны иметь сертификаты, определяющие их марку и химический состав. На заводе работники ОТК проверяют поступившие медь на соответствие свойств и состава сертификатам, ГОСТам или техническим условиям.
Медные листы и плиты в процессе хранения укладывают в горизонтальное положение без провисания с прокладкой между ними алюминия меди или мягких пород дерева, исключающих образование на меди вмятин и других повреждений.
В меди, предназначенной для изготовления ответственных сварных конструкций перед запуском в производство необходимо проконтролировать содержание кислорода, которое не должно превышать 0,01 %. Кроме того, требуется определить содержание висмута и свинца с помощью химического анализа или качественной пробы. Для этого испытывают стандартные образцы на разрыв при температуре 550°С. Если относительное удлинение составляет более 5%, медь можно применять для изготовления сварных конструкций ответственного назначения.
Кроме того, требуется определить содержание висмута и свинца с помощью химического анализа или качественной пробы. Для этого испытывают стандартные образцы на разрыв при температуре 550°С. Если относительное удлинение составляет более 5%, медь можно применять для изготовления сварных конструкций ответственного назначения.
Режут металл на гильотинных ножницах или плазменной дугой, а кромки под сварку разделывают механическим путем на строгальном или фрезерном станке.
Перед сваркой поверхность меди тщательно очищают от загрязнений металлической щеткой (до блеска) или промывают 10%-ным раствором каустической соды. После чего выполняют обезжиривание бензином, уайт-спиритом или другим растворителем.
Сварочную проволоку перед употреблением подвергают очистке травлением. Для этого применяют водный раствор азотной кислоты (75 см3/л) или смесь серной и соляной кислоты в соотношении 100:1 с последующей промывкой в воде, затем в щелочи, после чего снова в чистой проточной воде. После промывки проволоку сушат горячим воздухом. Медные электроды перед сваркой прокаливают, что снижает вероятность проявления водородной болезни.
После промывки проволоку сушат горячим воздухом. Медные электроды перед сваркой прокаливают, что снижает вероятность проявления водородной болезни.
Сборка под сварку. При сборке под сварку тщательно подгоняют стык по всей длине в приспособлениях, обеспечивающих надежное поджатие свариваемых кромок. Однако при этом должен быть исключен натяг, вызывающий дополнительные напряжения в металле. Смещение кромок и зазор между ними для большинства медных конструкций допускается не более 10 % толщины свариваемого металла, но не более 2 мм.
В процессе сборки прихватки производят таким образом, чтобы их высота не превышала 1/3 глубины разделки или катета шва. При сварке по таким прихваткам образуется качественный сварной шов, не требующий подрубки прихваток перед сваркой. Длина прихваток должна равняться толщине свариваемого металла, а расстояние между ними не превышать L = (15…20)δ при толщине свариваемого металла до 10 мм. При сварке меди большей толщины расстояние между прихватками составляет L = (6. ..8)δ. Перед прихваткой свариваемый металл предварительно подогревают. Зависимость температуры подогрева от толщины меди представлена ниже.
..8)δ. Перед прихваткой свариваемый металл предварительно подогревают. Зависимость температуры подогрева от толщины меди представлена ниже.
Толщина меди, мм | 6-10 | 10-20 | 20-40 | 40 и более |
Температура нагрева,- °С | 200-250 | 250-300 | 300-400 | 400-500 |
При охлаждении ниже 200°С и повторном предварительном нагреве свариваемого изделия прихватки могут разрушиться, поэтому в перерывах между технологическими операциями изделие не должно охлаждаться ниже температуры 200-250°С.
Прихватки выполняют ручной дуговой сваркой покрытыми электродами, ручной дуговой сваркой неплавящимся электродом в среде защитных газов или полуавтоматической сваркой плавящимся электродом в среде защитных газов. При ручной дуговой сварке прихватки выполняют на постоянном токе обратной полярности.
Силу сварочного тока выбирают по зависимости:
I=(60…70)dэ
где dэ – диаметр электрода, мм.
Для предупреждения проплавления металла, при необходимости, с обратной стороны стыка устанавливают формирующие графитовые, магнезитовые или медные водоохлаждаемые подкладки. В зависимости от конструктивных особенностей свариваемых деталей можно применять остающиеся подкладки в виде лент, полос или проволоки.
Медь, как металл высокой пластичности, хорошо сваривается всеми видами сварки термомеханического класса, кроме контактной сварки, так как медь обладает малым переходным электрическим сопротивлением. Для приварки выводов из тонких медных проволок в изделиях электронной техники используют термокомпрессионную сварку. Для более крупных изделий сложной конфигурации широко применяют диффузионную сварку в вакууме, позволяющую получать соединения меди не только с медью, но и с другими металлами и даже неметаллическими материалами.
Холодную сварку меди пластической деформацией сдвига или сдавливания используют для сварки медных шин в энергетических установках. В этом случае обеспечивается удовлетворительное электрическое сопротивление сварных соединений.
В этом случае обеспечивается удовлетворительное электрическое сопротивление сварных соединений.
Наиболее известны следующие способы сварки меди:
- механизированная сварка плавящимся электродом (полуавтоматическая сварка)
- автоматическая сварка плавящимся электродом в среде защитных газов
- ручная дуговая сварка неплавящимся (вольфрамовым) электродом
- сварка угольным или графитовым электродом
- ручная дуговая сварка покрытыми электродами
- автоматической сваркой под флюсом
- газовая сварка (сварка газовым (ацетилено-кислородным) пламенем)
- электрошлаковая сварка
Механизированная сварка плавящимся электродом (полуавтоматическая сварка)
При сварке меди и ее сплавов основной трудностью является получение сварных швов без пор, окисных включений и трещин. Образование пор в металле шва может быть представлено зависимостью изменения растворимости водорода в меди от содержания в ней кислорода. Согласно диаграмме взаимной растворимости кислорода и водорода при снижении в металле кислорода меньше определенного значения расплавленный металл склонен к активному поглощению водорода. В этом случае в процессе сварки при высокой влажности защитных газов и окружающего дугу воздуха, повышенном содержании водорода в металле и электродной проволоке или их загрязнении .органическими веществами, металл шва насыщается водородом.
Образование пор в металле шва может быть представлено зависимостью изменения растворимости водорода в меди от содержания в ней кислорода. Согласно диаграмме взаимной растворимости кислорода и водорода при снижении в металле кислорода меньше определенного значения расплавленный металл склонен к активному поглощению водорода. В этом случае в процессе сварки при высокой влажности защитных газов и окружающего дугу воздуха, повышенном содержании водорода в металле и электродной проволоке или их загрязнении .органическими веществами, металл шва насыщается водородом.
Если содержание водорода в металле превышает его растворимость, в процессе кристаллизации сварочной ванны образуется перенасыщенный раствор водорода в меди, который приводит к образованию пор, а при наплавке больших толщин металла и к трещинам. На поры и трещины такого происхождения активные раскислители влияния не оказывают и не предотвращают их образование. В целях борьбы с порами и трещинами такого происхождения в активную зону дуги вводят небольшие доли кислорода.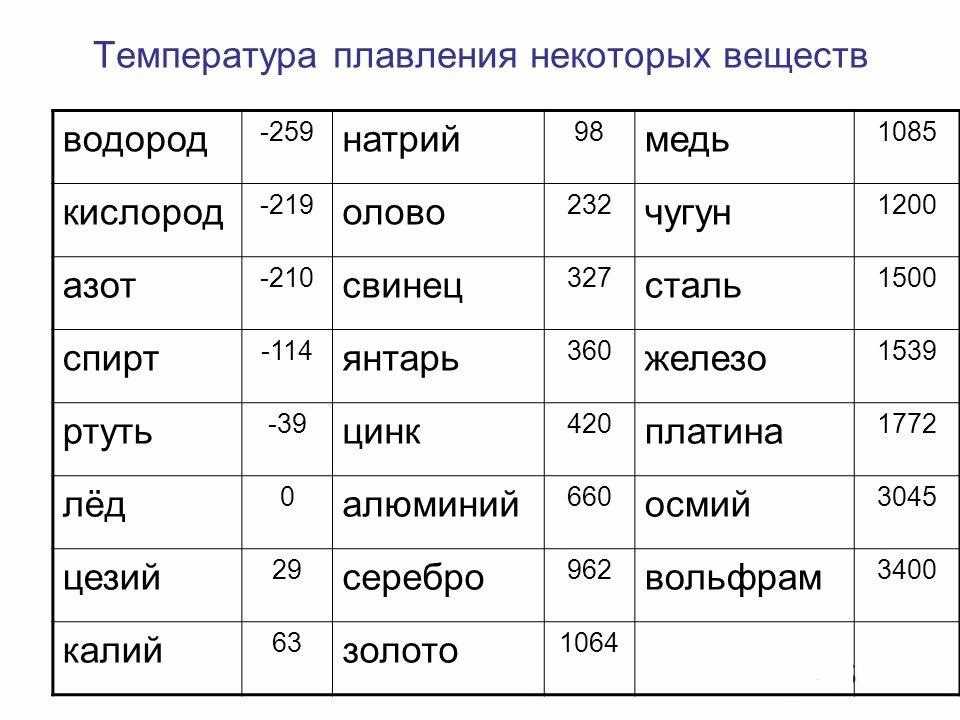
Для получения металла шва высокого качества содержание кислорода в смеси с инертными по отношению к меди газами должно быть достаточным для полного связывания водорода в зоне дуги и предотвращения этим попадания его в сварочную ванну, и недостаточным для образования в шве закиси меди.
В случае если водорода в меди меньше критического значения по диаграмме взаимной растворимости, медь может усваивать кислород в значительных объемах. В этом случае водород, попадающий из зоны дуги в ванну, восстанавливает закись меди. Образующиеся при этом в металле шва пары воды способствуют образованию пор и трещин. В этом случае для борьбы с кислородом в меди применяют активные раскислители: фосфор, марганец, кремний, титан, цирконий и другие активные к кислороду элементы.
Для меди характерно отсутствие внутреннего окисления и весьма интенсивное образование окислов на ее поверхности при высоких температурах. Толщина образуемых окислов тем больше, чем выше температура нагрева и больше при ней время выдержки. Поэтому нагрев меди в процессе сварки и особенно предварительный ее подогрев приводят к окислению поверхности металла с образованием закиси меди значительной толщины.
Поэтому нагрев меди в процессе сварки и особенно предварительный ее подогрев приводят к окислению поверхности металла с образованием закиси меди значительной толщины.
При нарушении технологии сварки расплавленный металл затекает вперед движения дуги, заплавляя окислы меди на свариваемых кромках. В этом случае окислы меди остаются в шве в виде неметаллических включений. В зависимости от массы попавших в наплавленный металл окислов в швах образуются несплавления или черноты, располагающиеся между швом и основным металлом или между отдельными валиками или слоями.
Для предотвращения образования таких дефектов процесс сварки в среде защитных газов выполняется таким образом, чтобы дуга частично горела на расплавленном металле ванны, а часть дуги располагалась на окисленной поверхности свариваемых кромок. Под воздействием температуры дуги окислы меди на свариваемых кромках диссоциируют и в сварочную ванну не попадают.
Такая технология может быть выполнена только при строгом соответствии требованиям силы тока, скорости подачи электродной проволоки, ее диаметра, скорости сварки, напряжения на дуге, наклона электрода и соблюдении других параметров режима и технологических приемов сварки.
В этом случае ручная дуговая сварка неплавящимся электродом в среде защитных газов предпочтительна слева направо, а полуавтоматическая сварка плавящимся электродом в газовой среде – справа налево. При сварке неплавящимся электродом горелка должна располагаться для сварки углом назад на 40-45° от металла, а присадочный металл подаваться с хвостовой части ванны под углом 30-35° к свариваемому металлу. В процессе полуавтоматической сварки угол наклона горелки от металла при расположении углом вперед должен составлять 75-80°.
Так же располагается горелка или электрод при автоматической сварке как в среде защитных газов, так и подслоем флюса. Ввиду высокой тепло- и температуропроводности изделия из меди подвергают предварительному подогреву и повышенной погонной энергии сварки. Температура предварительного подогрева зависит от массы и химического состава свариваемого изделия, условий сварки и ее погонной энергии, выдержки между наплавляемыми валиками, применяемой защитной среды и других факторов. В процессе сварки предварительно нагретое изделие остывает, а теплота, вводимая в процессе сварки, способствует его восстановлению до заданной температуры. Такой оптимальный вариант на практике встречается весьма редко.
В процессе сварки предварительно нагретое изделие остывает, а теплота, вводимая в процессе сварки, способствует его восстановлению до заданной температуры. Такой оптимальный вариант на практике встречается весьма редко.
При сварке изделий большой массы тепла дуги недостаточно для поддержания заданной температуры нагрева. В этом случае основной металл не смачивается наплавленным металлом и образуются несплавления шва. Если температура нагрева изделия будет выше оптимальной, расплавленный металл становится жидкотекучим и затекает вперед дуги. Это снижает глубину проплавления и образует в шве наплывы и непровары. Для поддержания заданной температуры в этом случае процесс сварки периодически прекращают, охлаждая изделие до заданной температуры. Чтобы получить сварные швы высокого качества и обеспечить необходимую производительность процесса, температура изделий при сварке не должна отличаться более чем на ±50°С от оптимального значения. Такие условия обеспечивают угол смачивания 70-90°, что позволяет получать высокое качество сварных швов (см. рисунок 4).
рисунок 4).
Рисунок 4 – Влияние температуры предварительного подогрева на угол смачивания при сварке меди
В зависимости от конструктивных особенностей свариваемого изделия из меди технология сварки должна обеспечивать выполнение всех сварочных операций не более чем за три- четыре предварительных подогрева свариваемого изделия.
Если изделие остыло ниже температуры 100-150°С, очередной предварительный подогрев его считают следующим циклом нагрева. При несоблюдении таких условий в зоне сплавления и в сварных швах возможно появление трещин, заметно снижаются также механические свойства сварных соединений.
Горелки подогрева должны быть направлены на 70-100 мм по обе стороны стыка, а их пламя при перемещении горелок не должно попадать на кромки.
Для металла толщиной более 20 мм сварку начинают и заканчивают на технологических планках размером 100×100 мм с формой разделки и толщиной металла, соответствующей спариваемому металлу. Если предусмотрен припуск на механическую обработку в начале и конце шва, технологические планки можно не применять. При отсутствии технологических планок кратер в конце шва заваривают без перемещения горелки вперед. В случае вынужденных перерывов сварки кратер ранее выполненного шва после предварительной вырубки и зачистки перекрывают на 15-30 мм. Допускается выплавка кратера дугой с последующей беспрерывной его заваркой. Автоматическую и полуавтоматическую сварку меди и ее сплавов в среде защитных газов производят плавящимся электродом, а автоматическую и ручную дуговую сварку – неплавящимся электродом.
При отсутствии технологических планок кратер в конце шва заваривают без перемещения горелки вперед. В случае вынужденных перерывов сварки кратер ранее выполненного шва после предварительной вырубки и зачистки перекрывают на 15-30 мм. Допускается выплавка кратера дугой с последующей беспрерывной его заваркой. Автоматическую и полуавтоматическую сварку меди и ее сплавов в среде защитных газов производят плавящимся электродом, а автоматическую и ручную дуговую сварку – неплавящимся электродом.
Дуговая сварка неплавящимся электродом применяется для сварки меди толщиной до 10 мм. Медь большей толщины сваривают плавящимся электродом автоматической или полуавтоматической сваркой. При автоматической сварке меди и ее сплавов плавящимся электродом для защиты дуги используют аргон, гелий или азот. Полуавтоматическая сварка применяется для сварки мелких узлов, прихватки изделий перед сваркой, приварки технологических планок и ремонта дефектных участков сварных швов.
При неизменном режиме сварки (Iсв = 400. ..450 А, Uд = 32…34 В, Vcв = 14…16 м/ч, температура предварительного подогрева меди 400-450°С) примесь к аргону азота увеличивает глубину провара и массу ванны от 4 г при сварке в аргоне до 9 г при сварке в азоте. Такое изменение состава защитной среды уменьшает удельную энтальпию металла сварочной ванны от 2156×10-3 Дж/кг при сварке в аргоне до 1960х10-8 Дж/кг при сварке в азоте. Добавка к аргону гелия повышает массу ванны до 6 г, а удельная энтальпия ее по сравнению с защитой дуги аргоном уменьшается до 2055×10-3Дж/кг.
..450 А, Uд = 32…34 В, Vcв = 14…16 м/ч, температура предварительного подогрева меди 400-450°С) примесь к аргону азота увеличивает глубину провара и массу ванны от 4 г при сварке в аргоне до 9 г при сварке в азоте. Такое изменение состава защитной среды уменьшает удельную энтальпию металла сварочной ванны от 2156×10-3 Дж/кг при сварке в аргоне до 1960х10-8 Дж/кг при сварке в азоте. Добавка к аргону гелия повышает массу ванны до 6 г, а удельная энтальпия ее по сравнению с защитой дуги аргоном уменьшается до 2055×10-3Дж/кг.
Таким образом, при неизменных параметрах режима тепловложение в металл ванны составляет (Дж) в аргоне 3684,4, в гелии 5275,4 и в азоте 7536,2. Приведенные данные показывают, что с энергетической стороны в качестве защитной среды лучше применять азот, затем гелий и аргон. В результате более высокого тепловложения в металл при сварке меди в среде азота увеличивается глубина провара, что позволяет снизить температуру предварительного подогрева свариваемых изделий и повысить эффективный КПД процесса.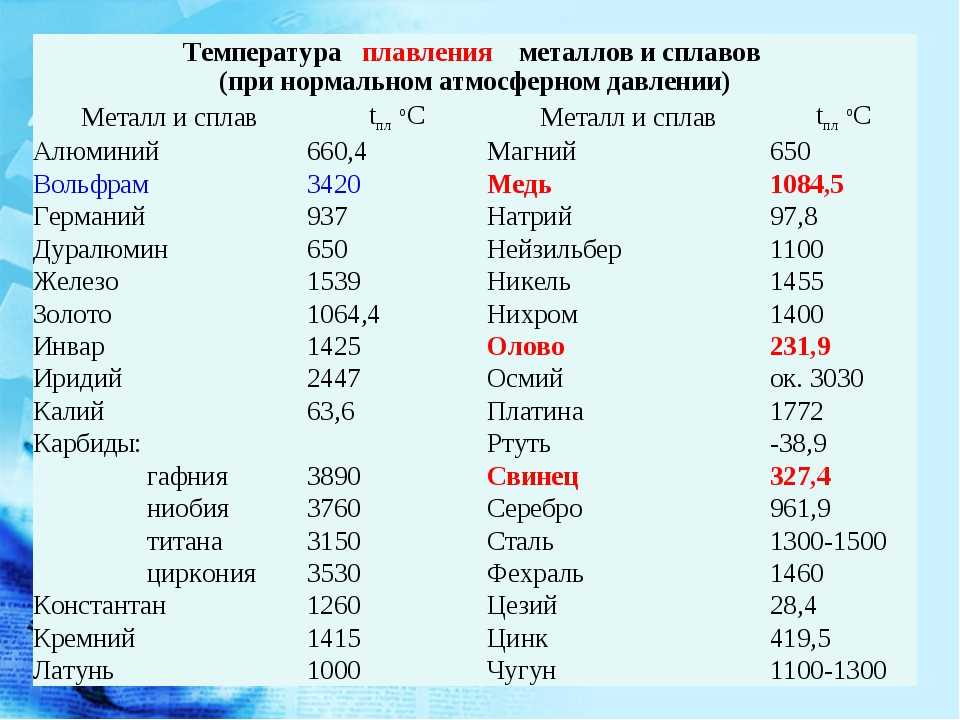
Для получения сварных швов без пор и других дефектов к защитным газам добавляют небольшие доли кислорода. Кислород, поступающий в зону дуги с защитным газом, расходуется на потери в окружающее пространство, на взаимодействие с водородом диссоциации влаги защитного газа и окружающего воздуха, на взаимодействие с водородом, поступающим в зону дуги с электродным и свариваемым металлом, на окисление свариваемого металла и его легирующих добавок, на образование озона и других химических соединений.
Водород, находящийся в атмосфере дуги, взаимодействует с кислородом смеси в первую очередь, а оставшийся после этого кислород затрачивается на окисление металла. Поэтому добавка кислорода, необходимая для взаимодействия с водородом в зоне дуги и устранения этим причин образования пор в металле шва, считается полезной и не должна превышать допустимых норм.
Смеси защитных газов, удовлетворяющие таким требованиям:
Ar + до 2% O2;
N2 + до 4% O2;
He + до 2% O2;
25-35% He + до 4% O2 + Ar остальное;
25-35% N2 + до 4% O2 + Ar остальное.
Механизированная сварка плавящимся электродом (полуавтоматическая сварка) выполняется на постоянном токе обратной полярности. Режимы полуавтоматической сварки приведены в табл /p/pице 2.
Таблица 2 – Режимы механизированной сварки плавящимся электродом (полуавтоматческой сварки) меди
Диаметр сварочной проволоки, мм | Сила сварочного тока, А | Напряжение на дуге, В |
1,2 | 140-160 | 20-22 |
1,6 | 200-240 | 22-24 |
2,0 | 280-340 | 26-28 |
Полуавтоматическую сварку швов длиной 500-700 мм производят без перерыва, а швы большей длины сваривают обратноступенчатым способом. Порядок сварки таврового соединения приведен на рисунке 5, а стыкового соединения на рисунке 6. При сварке горелку наклоняют углом вперед на 10-15° от вертикали. Расстояние от сопла горелки до свариваемого металла 20-25 мм. В процессе сварки шланг с проволокой следует располагать так, чтобы не допустить образования сгибов проволоки.
Расстояние от сопла горелки до свариваемого металла 20-25 мм. В процессе сварки шланг с проволокой следует располагать так, чтобы не допустить образования сгибов проволоки.
Рисунок 5 – Порядок сварки таврового соединения
а – одностороннее; б – двухстороннее
Рисунок 6 – Порядок сварки стыкового соединения
Автоматическая сварка плавящимся электродом в среде защитных газов
Автоматическая сварка плавящимся электродом в среде защитных газов производится на постоянном токе обратной полярности сварочными автоматами, снабженными горелками типа ГУ. Размер горелки выбирается в зависимости от диаметра применяемой сварочной проволоки. Сварка выполняется горелкой, наклоненной углом вперед на 10-15° от вертикали, на режимах, приведенных в таблице 3. Расход защитных газов для сварки металла толщиной 8-16 мм составляет 20-25 л/мин, при большей толщине металла расход возрастает до 25-30 л/мин. Для надежной защиты дуги расстояние от сопла горелки до свариваемого металла должно быть 20-25 мм, а длина дуги должна быть в пределах (1. ..2)dэ.
..2)dэ.
В связи с большой жидкотекучестью расплавленной меди глубина проплавления в значительной степени зависит от угла наклона изделия. Так, при сварке на спуск металл ванны подтекает под дугу. Это уменьшает глубину проплавления, увеличивает ширину сварного шва и снижает высоту его усиления.
Таблица 3 – Режимы автоматической сварки меди и ее сплавов плавящимся электродом в среде защитных газов
Толщина металла, мы | Диаметр электродной проволоки, мм | Сила сварочного тока, А | Напряжение на дуге. В | Скорость сварки, м/ч |
8-10 | 2,5 | 320-360 | 24-26 | 16-22 |
10-16 | 3,0 | 380-450 | 28-30 | 14-18 |
16-22 | 3,0 | 450-550 | 30-34 | 12-16 |
22-28 | 3,0 | 550-600 | 34-36 | 12-16 |
При сварке на подъем увеличивается глубина проплавления, уменьшается ширина и возрастает высота усиления сварного шва, поэтому для увеличения глубины проплавления иногда сварку ведут на подъем с наклоном изделия на 4-6°.
В зависимости от конструкции изделия сварку выполняют на стендах, снабженных флюсовыми подушками, в кантователях или на манипуляторах.
Угловые и нахлесточные соединения сваривают в симметричную лодочку. В этом случае оба листа соединения (при условии их нагрева до одинаковой температуры) проплавляются на одинаковую глубину. Угловой шов, состоящий из медного и стального листов одинаковой толщины, сваривают в несимметричную лодочку, при этом изделие должно располагаться таким образом, чтобы вертикально расположенный электрод образовывал со стальным листом угол З0°С. При такой технологии будет равномерное проплавление как стального, так и медного листа. Если стальной лист по толщине больше медного, применяют сварку в симметричную лодочку. Автоматическая сварка неплавящимся электродом выполняется на постоянном токе прямой полярности или переменном токе в среде аргона, азота, гелия и их смесей горелками ГН или другими, обеспечивающими достаточное качество сварных соединений.
Ручная дуговая сварка неплавящимся (вольфрамовым) электродом
Ручная дуговая сварка неплавящимся (вольфрамовым) электродом в среде защитных газов выполняется на постоянном токе прямой полярности и переменном токе. Медь сваривать лучше постоянным током прямой полярности.
Медь сваривать лучше постоянным током прямой полярности.
Для защиты дуги при сварке используют аргон, гелий, азот или их смеси. Наибольшую глубину проплавления обеспечивает в качестве защитной среды азот, затем гелий и аргон. Однако качество швов лучше при сварке в среде гелия, затем аргона и азота. Рекомендуемые режимы ручной дуговой сварки неплавящимся электродом приведены в таблице 4.
При сварке меди неплавящимся электродом обычно используются источники питания дуги постоянного тока с крутопадающей внешней характеристикой. Возможно применение источников питания дуги с пологопадающей внешней характеристикой.
Таблица 4. Режимы ручной дуговой сварки меди и ее сплавов неплавящимся электродом в среде защитных газов
Тип сварного соединения | Толщина свариваемого металла, мм | Диаметр, мм | Расход аргона, | Сила сварочного , тока, А | Число проходов | |
Вольфрамового электрода | Присадочной проволоки | |||||
Стыковое без скоса кромок | 1 | 2-3 | 1-2 | 4-5 | 75-90 | 1 |
1,5 | 2-3 | 2-3 | 4-5 | 80-100 | 1 | |
2 | 2-3 | 2-3 | 4-5 | 90-120 | 1 | |
3 | 3-4 | 3-4 | 5-6 | 120-140 | 1 | |
4 | 3-4 | 3-4 | 5-6 | 150-200 | 2 | |
То же, со скосом двух кромок | 4 | 3-4 | 3-4 | 9-12 | 120-150 | 2 |
5-6 | 4-5 | 4-5 | 9-12 | 180-200 | 3 | |
8-10 | 4-5 | 4-5 | 9-12 | 250-300 | 3-4 | |
Стыковое двухстороннее со скосом кромок | 20 | 4-5 | 5-6 | 12-14 | 300-400 | 6 |
25 | 4-5 | 5-6 | 12-14 | 350-500 | 6 | |
Нахлесточное и угловое | 1 | 3 | 2 | 5-6 | 100-110 | 1 |
1,5 | 3 | 2-3 | 5-6 | 110-140 | 1 | |
2-3 | 3-4 | 3-4 | 6-8 | 150-200 | 1 | |
3-4 | 4-5 | 4-5 | 8-10 | 200-300 | 1-2 | |
Длину сварочной дуги поддерживают в пределах 1,5-3 мм, а вылет конца электрода – 3-5 мм. Электрод располагают под углом 75-90° к свариваемому изделию, присадочную проволоку – под углом 10-15°. Если защитный газ недостаточно оберегает металл от окисления, присадочный материал применяют с раскислителем.
Электрод располагают под углом 75-90° к свариваемому изделию, присадочную проволоку – под углом 10-15°. Если защитный газ недостаточно оберегает металл от окисления, присадочный материал применяют с раскислителем.
Первые слои сварочного шва накладывают без колебаний электрода, следя за тем, чтобы все прихватки были полностью проварены. Сварку ведут без перерыва, особое внимание уделяя проварке корня шва. В случае вынужденных перерывов необходимо следить за тем, чтобы сечение было заполнено металлом не менее чем на половину стенки. Возобновляют сварку только после зачистки и предварительного подогрева, перекрывая ранее наложенный шов на 10-20 мм.
1 – проволока; 2 – сварочная ванна; 3 – электрод; 4 – сварочный шов
Рисунок 6 – Взаимное расположение присадочной проволоки, горелки и сварочной ванны
После сварки шов проковывают, а затем отжигают при температуре 600-660°С для выравнивания химического состава и получения мелкозернистой структуры шва.
Сварка угольными или графитовыми электродами
Сварку меди угольным или графитовым электродами ведут постоянным током прямой полярности при толщине металла более 0,5 мм. Длина дуги при этом 30-40 мм. Режимы сварки угольным или графитовым электродами приведены в таблице 5. В качестве присадочного металла используют прутки из меди М1, М2 или из меди с повышенным содержанием фосфора (до 0,2%).
Таблица 5 – Ориентировочные режимы сварки меди угольным и графитовым электродами
Толщина свариваемого металла, мм | Диаметр присадочного прутка, мм | Диаметр электрода, мм | Сила тока, А | |
угольного | графитового | |||
до 1,5 | 1,5 | 8 | 6 | 130-180 |
1,5-2,5 | 2,0 | 10 | 8 | 180-230 |
2,5-4,0 | 3,0 | 15 | 10 | 230-300 |
4,0-8,0 | 5,0 | 18 | 15 | 300-400 |
8,0-15,0 | 8,0 | 25 | 18 | 400-600 |
Чтобы уменьшить окисление меди и обеспечить перевод окислов в шлак, нужно применять флюс: 70% буры, 10% борной кислоты и 20% поваренной соли. Предварительно буру прокаливают до получения порошка. Для неответственных работ применяют чистую буру после прокалки. Флюс или буру насыпают на свариваемый металл перед сваркой, а также вводят нагретым концом прутка.
Предварительно буру прокаливают до получения порошка. Для неответственных работ применяют чистую буру после прокалки. Флюс или буру насыпают на свариваемый металл перед сваркой, а также вводят нагретым концом прутка.
При сварке угольным электродом очень важно, чтобы свариваемый металл хорошо смачивался жидким металлом. Если капля жидкого металла, попадая на поверхность свариваемого, не растекается, а принимает шарообразную форму, то сварку вести нельзя. Плохое растекание или смачивание говорит о слабом сцеплении (низкой адгезии) между молекулами жидкого металла и твердой поверхности.
Растеканию жидкого металла могут препятствовать загрязнение поверхности основного металла или его низкая температура. Поэтому до присадки жидкого металла свариваемый металл должен быть очищен от загрязнений и прогрет дугой, а если мощность дуги для этого недостаточна, применить предварительный или сопутствующий подогрев другим источником тепла (газовой горелкой и т. д.).
При односторонней сварке медь толщиной до 4 мм сваривают без разделки кромок, свыше 4 мм – с разделкой. При двусторонней сварке толщина свариваемого изделия без разделки может быть увеличена до 6 мм.
При двусторонней сварке толщина свариваемого изделия без разделки может быть увеличена до 6 мм.
Режимы, условия и техника сварки меди должны тщательно отрабатываться на образцах и технологических пробах и окончательно проверяться на образцах, соответствующих по составу и геометрии свариваемому металлу.
Ручная дуговая сварка покрытыми электродами
Сварку меди ручной дуговой сваркой покрытыми электродами применяют при толщине металла свыше 2 мм. Ток постоянный, обратной полярности. Ориентировочные режимы сварки приведены в таблице 6. Необходимость подогрева, как и при сварке угольным электродом, сохраняется.
Таблица 6 – Ориентировочные режимы ручной однопроходной сварки меди покрытыми электродами
Толщина соединяемой меди, мм | Диаметр электрода, мм | Ток дуги, А | Напряжение, В |
2 | 2-3 | 100-120 | 25-27 |
4 | 4-5 | 160-200 | 25-27 |
6 | 5-7 | 260-340 | 26-28 |
7-8 | 6-7 | 380-400 | 26-28 |
9-10 | 6-8 | 400-420 | 28-30 |
Для сварки меди, содержащей не более 0,01% кислорода, и сварки меди с низкоуглеродистой сталью применяют электроды «Комсомолец-100». В состав покрытия входят следующие компоненты, % (по массе): плавиковый шпат – 10, полевой шпат – 12, ферросилиций – 8, ферромарганец – 50, жидкое стекло – 20. Электроды пригодны для сварки в нижнем положении на постоянном токе обратной полярности. Коэффициент наплавки 14 г/А-ч. Расход электродов па 1 кг наплавленного металла 1,4 кг. Химический состав наплавленного металла, %:
В состав покрытия входят следующие компоненты, % (по массе): плавиковый шпат – 10, полевой шпат – 12, ферросилиций – 8, ферромарганец – 50, жидкое стекло – 20. Электроды пригодны для сварки в нижнем положении на постоянном токе обратной полярности. Коэффициент наплавки 14 г/А-ч. Расход электродов па 1 кг наплавленного металла 1,4 кг. Химический состав наплавленного металла, %:
- марганец – 2,2
- кремний – 0,7
- железо – 1,4
- остальное – медь
Механические свойства наплавленного металла:
- временное сопротивление – 27 кгс/мм2
- относительное удлинение – 23%
- ударная вязкость – 5 кгс×м/см2
- угол загиба (изгиба) – 160°
На 1 мм диаметра электрода принимается ток 60 А. Сварка производится короткой дугой. При сварке листов толщиной до 16 мм требуется подогрев основного металла до 300-400°С, а при большей толщине необходим сопутствующий подогрев.
Теплопроводность и электропроводность металла шва при сварке покрытыми электродами значительно снижаются. В процессе плавления электрода с покрытием в металл шва переходит часть легирующих компонентов и электропроводность шва составляет порядка 20 % от электропроводности меди М1. Механические свойства швов, выполненных дуговой сваркой покрытыми электродами, вполне удовлетворительны: σв= 176-196 МПа, угол загиба 180°.
В процессе плавления электрода с покрытием в металл шва переходит часть легирующих компонентов и электропроводность шва составляет порядка 20 % от электропроводности меди М1. Механические свойства швов, выполненных дуговой сваркой покрытыми электродами, вполне удовлетворительны: σв= 176-196 МПа, угол загиба 180°.
Газовая сварка
При единичном производстве и ремонтных работах рекомендуется использовать газовую сварку, в процессе которой осуществляется подогрев и начальная термическая обработка изделия. Невысокие температурные градиенты уменьшают воздействие сварочного термического цикла на металл в зоне сварки (шов, зона термического влияния). Возможно раскисление и легирование металла через присадочную проволоку.
Газовую сварку меди ведут ацетилено-кислородным пламенем с использованием присадочных прутков из меди М1, М2, М3 и флюсов. При изменении толщины свариваемых деталей от 1 до 15 мм и выше рекомендуются наконечники сварочной горелки от № 1 до 7. Присадочные прутки применяют иногда с повышенным содержанием фосфора (0,2-0,7%) или фосфора (0,2%) и кремния (0,15-0,30%). Простейшим флюсом, который часто применяется при газовой сварке меди, служит бура. Предварительный и сопутствующий подогревы, как и при дуговой сварке, не исключаются.
Простейшим флюсом, который часто применяется при газовой сварке меди, служит бура. Предварительный и сопутствующий подогревы, как и при дуговой сварке, не исключаются.
Для уменьшения окисления меди при сварке применяют только восстановительное пламя.
Избыток ацетилена вызывает реакцию восстановления закиси меди водородом и окисью углерода, содержащихся в пламени. В результате чего в наплавленном металле образуются поры и трещины (“водородная болезнь”).
Раскисление металла сварочной ванны, несмотря на защиту от окружающей среды продуктами сгорания, производится извлечением закиси меди флюсами или введением раскислителей через присадочную проволоку.
Сварочные флюсы для меди содержат соединения бора (борная кислота, борный ангидрид, бура), которые растворяют закись меди, образуя легкоплавкую эвтектику, и выводят ее в шлак. Кроме соединений бора, флюсы могут содержать фосфаты и галиды. Флюсы для сварки меди по номерам приведены в таблице 7. Флюсы наносят на зачищенные и обезжиренные свариваемые кромки по 10-12 мм на сторону.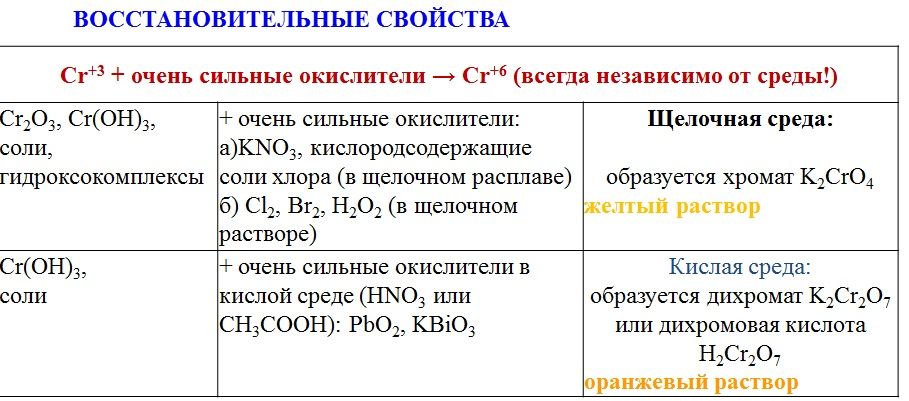 Дополнительно их можно вносить с помощью присадочного металла, на который наносят покрытие из компонентов флюса и жидкого стекла с добавками древесного угля 10-20 % (по массе).
Дополнительно их можно вносить с помощью присадочного металла, на который наносят покрытие из компонентов флюса и жидкого стекла с добавками древесного угля 10-20 % (по массе).
Таблица 7 – Флюсы, применяемые при газовой сварке меди
Наименование компонентов флюса | обозначение стандарта | номер флюса | ||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
Химический состав %, по массе | ||||||||||
бура | ГОСТ 8429-77 | 100 | 25 | 50 | 30 | 50 | 50 | 70 | 56 | 78 |
кислота борная | ГОСТ 18704-78 | – | 75 | 50 | 50 | 35 | – | 10 | – | 4 |
натрий хлористый | ГОСТ 4233-77 | – | – | – | 10 | – | – | 20 | 22 | 13 |
натрий кислый фосфорнокислый | ГОСТ 4172-76 | – | – | – | 10 | 15 | 15 | – | – | – |
песок кварцевый | ГОСТ 4417-75 | – | – | – | – | – | 15 | – | – | – |
калий углекислый | ГОСТ 10690-73 | – | – | – | – | – | – | – | 22 | – |
уголь древесный | ГОСТ 7657-74 | – | – | – | – | – | 20 | – | – | – |
натрий двууглекислый | ГОСТ 4201-79 | – | – | – | – | – | – | – | – | 5 |
Размеры конструктивных элементов кромок стыковых соединений под газовую сварку изделий из меди и бронзы приведены в таблице 8.
Таблица 8 – Размеры конструктивных элементов кромок стыковых соединений под газовую сварку меди
Вид соединения | Условное обозначение | Форма подготовленных кромок | Характер выполнения шва | Конструктивные элементы | Размеры, мм | |||||
подготовленных кромок свариваемых деталей | сварного соединения | S | b | C | e | q | ||||
стыковое | С1 | С отбортовкой двух кромок | Одно сторон ний | рис. А1 | рис. А2 | До 2 | – | – | 3-6 | 11-2 |
С2 | Без скоса кромок | рис. | рис. Б2 | До 4 | 1-2 | – | 6-10 | 11-2 | ||
СЗ | Со скосом двух кромок | рис. В1 | рис. В2 | Св 4 до 10 | 1-2 | 2-3 | 10-25 | 11,5-2,0 | ||
С4 | С двумя симметричными скосами двух кромок | Двусторонний | рис. Г1 | рис. Г2 | Св 10 до 25 | 1-2 | 2-3 | 20-30 | 22-3 | |
Автоматическая сварка под флюсом
Основным преимуществом автоматической сварки меди под флюсом является возможность получения стабильных высоких механических свойств без предварительного подогрева. Поэтому при изготовлении крупногабаритных сварных конструкций из меди больших толщин технологический процесс достаточно прост и почти не отличается от процесса сварки сталей.
Химические составы некоторых флюсов, применяющихся для автоматической сварки меди и ее сплавов плавящимся электродом (ГОСТ 9087), приведены в таблице 9.
Таблица 9 – Химический состав флюсов для автоматической сварки меди и ее сплавов
Марка флюса | SiO2 | MnO | CaO | MgO | Al2O3 | СаF2 | Fe2O3 | K2O, Na2O |
АН-348А | 41-44 | 34-38 | До 6,5 | 5-7,5 | До 4,5 | 4-5,5 | До 2 | – |
ОСЦ-45 | 38-44 | 38 | >6,5 | до 2,5 | >5,0 | 6-9 | >2 | – |
АН-20С | 19-24 | – | 3-9 | 9-13 | 27-32 | 25-33 | >1 | 2-3 |
АН-26С | 29-33 | 44 до 0,5 2,5-4 | 4-8 | 15-18 | 19-23 | 19-23 | >1,5 | – |
При сварке меди под такими кислыми флюсами в металл шва переходят Si и Mn, в результате ухудшаются тепло- и электрофизические свойства соединений по сравнению с основным металлом. Применение бескислородных фторидных флюсов, например марки АН-М1, который содержит, % (по массе), 55 MgF2, 40 NaF, 5BaF2, позволяет получать швы, удельное сопротивление которых в 1,5 раза ниже, а теплопроводность в 2 раза выше по сравнению со швами, выполненными под кислым флюсом АН-348A.
Применение бескислородных фторидных флюсов, например марки АН-М1, который содержит, % (по массе), 55 MgF2, 40 NaF, 5BaF2, позволяет получать швы, удельное сопротивление которых в 1,5 раза ниже, а теплопроводность в 2 раза выше по сравнению со швами, выполненными под кислым флюсом АН-348A.
Сварку ведут на постоянном токе обратной полярности при жестком закреплении на подкладках из охлаждаемой меди (толщиной до 2,5 мм) или на графите (толщиной 5-6 мм).
Электрошлаковая сварка
Электрошлаковая сварка меди применяется для больших толщин 30-55 мм. Легирование шва осуществляют, применяя пластинчатые электроды соответствующего состава. Температура плавления флюса должна быть ниже температуры плавления меди, применяются легкоплавкие флюсы системы NaF-LiF-CaF2, которые обеспечивают устойчивый процесс, подогрев и плавление кромок на требуемую глубину, хорошее формирование шва и легкое удаление шлаковой корки. Особенностью режимов электрошлаковой сварки меди являются повышенные сварочные токи: I = 800-1000 А, Uд = 40-50 В, скорость подачи пластинчатого электрода 12- 15 м/ч. Механические свойства металла шва мало отличаются от свойств основного металла: σв=190-М97 МПа, ?=46 – 47%, KCU = 1559- 1579 кДж/м2, α=180°.
Механические свойства металла шва мало отличаются от свойств основного металла: σв=190-М97 МПа, ?=46 – 47%, KCU = 1559- 1579 кДж/м2, α=180°.
Сравнение элементов периодической таблицы | Сравните медь и серу
Сравните медь и серу
Сравните медь и серу на основе их свойств, атрибутов и фактов периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между медью и серой с самой надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить медь и серу по более чем 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
29 Cu Copper
Swap Sulfur vs Copper
Periodic Table Element Comparison
16 S Sulfur
Facts
| Name | Copper | Sulfur | |||
| Atomic Number | 29 | 16 | |||
| Атомный символ | Cu | S | |||
| Atomic Weight | 63. 546 546 | 32.065 | |||
| Phase at STP | Solid | Solid | |||
| Color | Copper | Yellow | |||
| Metallic Classification | Переходный металл | Другой неметалл | |||
| Группа в периодической таблице | группа 11 | группа 16 | |||
| Название группы | copper family | oxygen family | |||
| Period in Periodic Table | period 4 | period 3 | |||
| Block in Periodic Table | d -block | p -block | |||
| Electronic Configuration | [Ar] 3d10 4s1 | [Ne] 3s2 3p4 | |||
| Структура электронной оболочки (электронов на оболочку) | 2, 8, 18, 1 | 2, 8, 6 | Температура плавления0021 | 1357.77 K | 388.36 K |
| Boiling Point | 3200 K | 717. 87 K 87 K | |||
| CAS Number | CAS7440-50-8 | CAS7704-34-9 | |||
| Neighborhood Elements | Соседние элементы меди | Соседние элементы серы |
История
| История | Элемент Медь был открыт Ближним Востоком в 9 году000 г. до н.э. Медь получила свое название от английского слова (лат. cuprum). | Элемент Сера был открыт китайцами/индейцами за год до 2000 г. до н.э. Сера получила свое название от латинского слова sulphur, «огонь и сера». |
| Discovery | Middle East (9000 BCE) | Chinese/Indians (Before 2000 BCE) |
| Isolated | Anatolia (6000 BCE) | () |
Presence: Abundance in Nature и вокруг нас 9-7 %)
| Обилизация во вселенной | 60 /1 | 500000 /20000 |
Отол.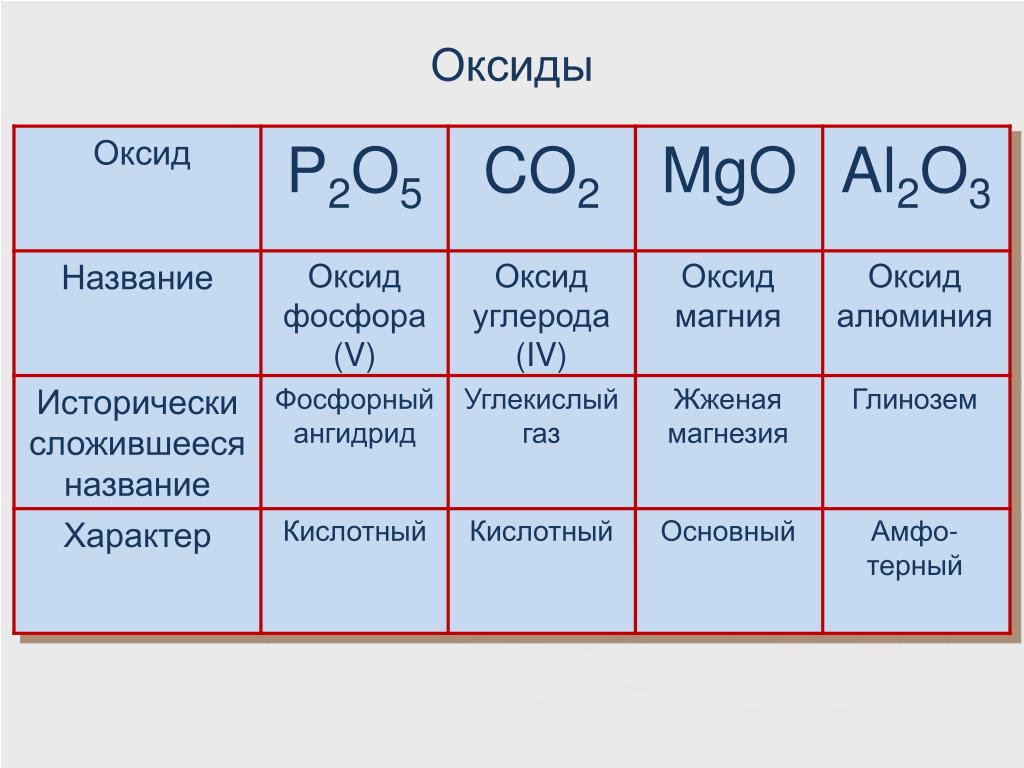 / 31000 / 31000 | 41000000 /22000000 | |
| Изобилие в коре Земли | 68000 /22000 | 420000 /270000 |
| ОБЛАСТЬ В Океанах | 3 / 0,29. | |
| . | ||
| Abundance in Humans | 1000 / 99 | 2000000 / 3 |
Crystal Structure and Atomic Structure
| Atomic Volume | 7.124 cm3/mol | 15.53 cm3 /MOL |
| Атомный радиус | 145 PM | 20 PM |
| Ковалентный радиус | 138 PM | 102 PM |
| VAN DER DER LACLIUS | ||
| VAN DER LAALS | ||
| VAN DER WALS | ||
| VAN DER WALS | ||
| .0021 | 140 pm | 180 pm |
| Atomic Spectrum | ||
| Lattice Constant | 361. 49, 361.49, 361.49 pm 49, 361.49, 361.49 pm | 1043.7, 1284.5, 2436.9 pm |
| Lattice Angle | π/ 2, π/2, π/2 | π/2, π/2, π/2 |
| Наименование космической группы | FM_ 3M | FDDD |
| Космос группы | 225 | |
| Космос | 225 | |
| 225 | ||
| 225 | ||
| 225 | ||
| . | ||
| Crystal Structure | Face Centered Cubic | Face Centered Orthorhombic |
Atomic and Orbital Properties
| Atomic Number | 29 | 16 |
| Number of Electrons (with no заряд) | 29 | 16 |
| Число протонов | 29 | 16 |
| Массовое число | 6,00204 6,00210021 | 32.065 |
| Number of Neutrons | 35 | 16 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 1 | 2, 8, 6 |
| Electron Configuration | [Ar] 3d10 4s1 | [Ne] 3s2 3p4 |
| Valence Electrons | 3d10 4s1 | 3s2 3p4 |
| Oxidation State | 1, 2 | -2, 2, 4, 6 |
| Символ атомного термина (квантовые номера) | 2S1/2 | 3P2 |
| Структура оболочки |
ISOTOPES и Aclerops Artales
. стабильные природные изотопы.
стабильные природные изотопы.| Known Isotopes | 52Cu, 53Cu, 54Cu, 55Cu, 56Cu, 57Cu, 58Cu, 59Cu, 60Cu, 61Cu, 62Cu, 63Cu, 64Cu, 65Cu, 66Cu, 67Cu, 68Cu, 69Cu, 70Cu, 71Cu, 72Cu, 73Cu, 74Cu, 75Cu, 76Cu, 77Cu, 78Cu, 79Cu, 80Cu | 26S, 27S, 28S, 29S, 30S, 31S, 32S, 33S, 35S, 38S, 3 3 , 39S, 40S, 41S, 42S, 43S, 44S, 45S, 46S, 47S, 48S, 49S |
| Стабильные изотопы | Naturally Acderving Stable Isotopes: 63CU, 65CU | 102020202020202020202020202 33S, 34S, 36S|
| Нейтронное сечение | 3,78 | 0,52 |
| Neutron Mass Absorption | 0.0021 | 0.00055 |
Chemical Properties: Ionization Energies and electron affinity
| Valence or Valency | 2 | 6 |
| Electronegativity | 1.9 Pauling Scale | 2.58 Шкала Полинга |
| Сродство к электрону | 118,4 кДж/моль | 200 кДж/моль |
| Энергии ионизации | 1 -й: 745,5 кДж/моль 2 -е: 1957,9 кДж/моль 3 -е: 3555 кДж/моль 4th: 5536 кДж/моль 5th: 7700 кдж/моль 6 -й: 99005 5th: 7700 кдж/моль 6 -й: 99005 . 7th: 13400 кДж/моль 8th: 16000 кДж/моль 9th: 19200 кДж/моль 10th: 22400 кДж/моль 11th: 25600 кДж/моль 12th: 35600 кдж/моль 13 13th. : 38700 кДж/моль 14-я: 42000 кДж/моль 15-я: 46700 кДж/моль 16-я: 50200 кДж/моль 17th: 53700 kJ/mol 18th: 61100 kJ/mol 19th: 64702 kJ/mol 20th: 163700 kJ/mol 21st: 174100 kJ/mol 22nd: 184900 kJ/mol 23 -й: 198800 кДж/моль 24th: 210500 кДж/моль 25th: 222700 кДж/моль 26th: 239100 кДж/моль 27th: 249660 кДж/моль 28th: 1067358 KJ/MOL 9 29 29 29th: 28th: 1067358 KJ/MOL9 29TH: 29TH: 28 -й: 10673587. 1116105 кДж/моль | 1-й: 999,6 кДж/моль 2-й: 2252 кДж/моль 3rd: 3357 kJ/mol 4th: 4556 kJ/mol 5th: 7004.3 kJ/mol 6th: 8495.8 kJ/mol 7th: 27107 kJ/mol 8th: 31719 kJ/mol 9th: 36621 кДж/моль 10th: 43177 кДж/моль 11th: 48710 кДж/моль 12th: 54460 кДж/моль 13th: 62930 кДж/моль 14th: 68216 KJ/MOL 15th 15th: 68216 KJ/MOL 15th 15th: 68216 KJ/MOL 15 -й 15 -й: 68 -й: 68216 KJ/MOL 15 15th: 68216 KJ/MOL 15th 15th: 68216 KJ/MOL 900015th 15th: 68216 KJ/MOL 9000 15th 15th: 68216 KJ/MOL 9000 15th 15th: 68216 KJ/MOL 9000 15th 15 -й: 311048 кДж/моль 16-й: 337138 кДж/моль |
Физические свойства
| Density | 8. 92 g/cm3 92 g/cm3 | 1.96 g/cm3 |
| Molar Volume | 7.124 cm3/mol | 15.53 cm3/mol |
Elastic Properties | ||
| Young Modulus | 130 | – |
| Shear Modulus | 48 GPa | – |
| Bulk Modulus | 140 GPa | 7.7 GPa |
| Коэффициент Пуассона | 0,34 | – |
Твердость – тесты для измерения твердости элемента | ||
| Моо. – | ||
| Твердость по Бринеллю | 874 МПа | – |
Электрические свойства | ||
| 0 Электропроводность0021 | 500 S/m | 1e-15 S/m |
| Resistivity | 1.7e-8 m Ω | 1000000000000000 m Ω |
| Superconducting Point | – | – |
Heat and Conduction Properties | ||
| Thermal Conductivity | 400 W/(m K) | 0. 205 W/(m K) 205 W/(m K) |
| Thermal Expansion | 0.0000165 /K | – |
Magnetic Properties | ||
| Magnetic Type | Diamagnetic | Diamagnetic |
| Curie Point | – | – |
| Mass Magnetic Susceptibility | -1.08e-9 m3/kg | – 6.2e-9 м3/кг |
| Молярная магнитная восприимчивость | -6.86e-11 м3/моль | -1.99e-10 м3/моль |
| Объемная магнитная восприимчивость1 | 020 -0.00000963 | -0.0000122 |
Optical Properties | ||
| Refractive Index | – | 1.001111 |
Acoustic Properties | ||
| Speed of Sound | 3570 m/s | – |
Тепловые свойства – Энтальпии и термодинамика
| Температура плавления | 1357,77 K | 388. 36 K 36 K |
| Boiling Point | 3200 K | 717.87 K |
| Critical Temperature | – | 1314 K |
| Superconducting Point | – | – |
Enthalpies | ||
| Теплота плавления | 13,1 кДж/моль | 1,73 кДж/моль |
| Теплота парообразования | 300 кДж/моль | 9,8020 моль0021|
| Хит сгорания | – | – |
Регуляторный и здоровье параметры и рекомендации по охране здоровья и рекомендации
9444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444н. 9 A, N/A, N/A}
A, N/A, N/A}Compare With Other Elements
Compare Copper with allGroup 11 elementsCopper vs RoentgeniumCopper vs SilverCopper vs Gold Compare Copper with allPeriod 4 elementsCopper vs GermaniumCopper vs NickelCopper vs BromineCopper vs ScandiumCopper vs ArsenicCopper vs CobaltCopper vs CalciumCopper vs ChromiumCopper vs SeleniumCopper vs KryptonCopper vs VanadiumCopper vs ZincCopper vs PotassiumCopper vs TitaniumCopper vs ManganeseCopper против IronCopper против Gallium Compare Copper with allTransition Metal elements Copper vs NickelCopper vs RutheniumCopper vs RhodiumCopper vs ZirconiumCopper vs RoentgeniumCopper vs DarmstadtiumCopper vs DubniumCopper vs SeaborgiumCopper vs CadmiumCopper vs TungstenCopper vs ScandiumCopper vs TantalumCopper vs SilverCopper vs RheniumCopper vs NiobiumCopper vs CobaltCopper vs MolybdenumCopper vs MercuryCopper Медь против хрома, медь, иттрий, медь, иридий, медь, хассий, медь, ванадий, медь, цинк, медь, технеций, медь, платина, медь, мейтнерий, медь, коперниций, медь, титан, медь, марганец, медь, железо, медь, медь, палладий, медь, гафний, медь, осмий, медь, золото, медь, Резерфорд. | Compare Sulfur with allGroup 16 elementsSulfur vs LivermoriumSulfur vs SeleniumSulfur vs TelluriumSulfur vs OxygenSulfur vs Polonium Compare Sulfur with allPeriod 3 elementsSulfur vs SodiumSulfur vs SiliconSulfur vs MagnesiumSulfur vs AluminiumSulfur vs ArgonSulfur vs PhosphorusSulphur vs Chlorine Сравнить серу со всеми элементамиOther NonmetalСера vs водородСера vs углеродСера vs селенSulphur vs азотСера vs кислородСера vs фосфор сера vs сера |
Минерал, природный элемент, питательный элемент. Его использование и свойства.
Главная » Минералы » Сера
Химический элемент. Родной минерал. Необходим для всего живого.
Статья: Хобарт М. Кинг, PhD, RPG
Серный терминал: Груды желтой серы на терминале недалеко от Ванкувера, Британская Колумбия, Канада. Сера доставляется по железной дороге с предприятий по переработке нефти и природного газа в провинции Альберта.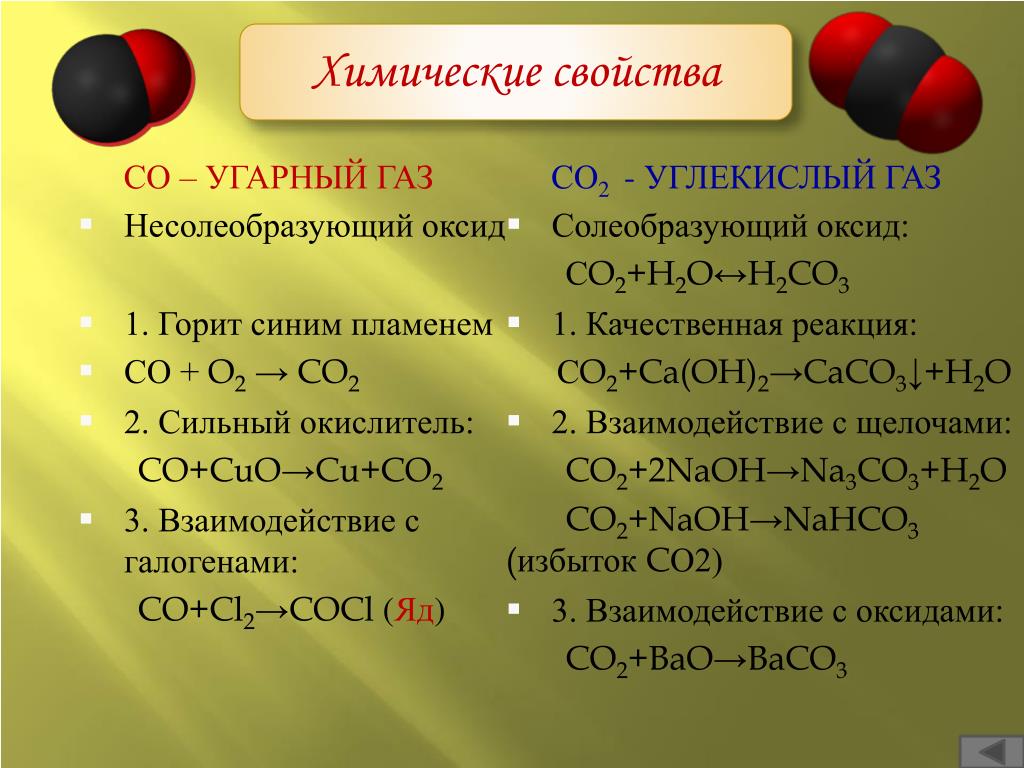 На этом терминале он загружается на баржи и суда для перевозки навалом. Авторское право на фото iStockphoto / teekaygee.
На этом терминале он загружается на баржи и суда для перевозки навалом. Авторское право на фото iStockphoto / teekaygee.
Серная фумарола: Когда горячие вулканические газы, богатые серой, выходят из вулканического жерла, газы охлаждаются, и вокруг жерла откладывается сера в виде желтых кристаллов. У этой фумаролы на острове Кунашир (на Курильских островах, к северо-востоку от японского острова Хоккайдо) значительное скопление ярко-желтой серы. Авторское право на фото iStockphoto / Сергей Дубровский.
| Знаете ли вы? Многие сильные запахи производятся соединениями серы. Запах скунса, спичек, чеснока, грейпфрута и тухлых яиц вызван серой. Правообладатель иллюстрации iStockphoto / Florintt, Gio_banfi, Abomb Industries Design, ivelly и Big_Ryan. |
Что такое сера?
Сера — это химический элемент с атомным номером 16 и атомным символом S. При комнатной температуре это желтое кристаллическое твердое вещество. Несмотря на то, что он нерастворим в воде, он является одним из самых универсальных элементов при образовании соединений. Сера реагирует и образует соединения со всеми элементами, кроме золота, йода, иридия, азота, платины, теллура и инертных газов.
При комнатной температуре это желтое кристаллическое твердое вещество. Несмотря на то, что он нерастворим в воде, он является одним из самых универсальных элементов при образовании соединений. Сера реагирует и образует соединения со всеми элементами, кроме золота, йода, иридия, азота, платины, теллура и инертных газов.
Сера в изобилии встречается во Вселенной, но ее редко можно найти в чистом несвязанном виде на поверхности Земли. Как элемент сера является важным компонентом сульфатных и сульфидных минералов. Встречается в растворенных ионах многих вод. Он является важным компонентом многих атмосферных, подповерхностных и растворенных газов. Это важный элемент всех живых существ и входит в состав органических молекул всех видов ископаемого топлива.
Физические свойства серы | |
| Химическая классификация | Родной элемент |
| Цвет | Желтый. От коричневато-желтого до зеленовато-желтого. Красный в расплавленном состоянии при температуре более 200 градусов Цельсия. Горит пламенем, которое трудно увидеть при дневном свете, но которое в темноте становится голубым. От коричневато-желтого до зеленовато-желтого. Красный в расплавленном состоянии при температуре более 200 градусов Цельсия. Горит пламенем, которое трудно увидеть при дневном свете, но которое в темноте становится голубым. |
| Полоса | Желтый |
| Блеск | Кристаллы от смолистых до жирных. Порошкообразная сера тусклая или землистая. |
| Прозрачность | От прозрачного до полупрозрачного |
| Декольте | Нет |
| Твердость по шкале Мооса | от 1,5 до 2,5 |
| Удельный вес | от 2,0 до 2,1 |
| Диагностические свойства | Желтый цвет, низкая твердость, низкий удельный вес, легковоспламеняющееся горение с голубым пламенем, низкая температура плавления |
| Химический состав | С |
| Кристаллическая система | Ромбическая |
| Применение | Около 90% используется для производства серной кислоты. Остальная часть используется в различных продуктах, включая сероводород, инсектициды, гербициды, фунгициды, фармацевтические препараты, мыло, текстиль, бумагу, переработанную резину, порох, кожу, краски, красители, пищевые консерванты. Остальная часть используется в различных продуктах, включая сероводород, инсектициды, гербициды, фунгициды, фармацевтические препараты, мыло, текстиль, бумагу, переработанную резину, порох, кожу, краски, красители, пищевые консерванты. |
РЕКЛАМА
| Знаете ли вы? Китайцы открыли серу примерно в 2000 г. до н.э., использовали ее для изготовления пороха в 7 веке, а в 10 веке использовали порох для запуска ракет, снарядов и изготовления ручных гранат. |
Мировое производство серы: В 2015 году во всем мире было произведено около 70 миллионов метрических тонн серы. Производство было широко разделено между большим количеством стран. В число 12 ведущих стран-производителей вошли Китай, США, Россия, Канада, Германия, Япония, Саудовская Аравия, Индия, Казахстан, Иран, Объединенные Арабские Эмираты и Мексика. В этих странах сера была отделена от ее геологического исходного материала, а не от первоначального источника серы, поскольку большая часть серы отделяется при переработке ископаемого топлива или плавке сульфидных руд. Данные Геологической службы США. [7]
В этих странах сера была отделена от ее геологического исходного материала, а не от первоначального источника серы, поскольку большая часть серы отделяется при переработке ископаемого топлива или плавке сульфидных руд. Данные Геологической службы США. [7]
РЕКЛАМА
Сера в изобилии и повсюду!
Приведенная ниже информация должна убедить вас в том, что сера чрезвычайно распространена и присутствует повсюду.
- 11-й элемент по распространенности в организме человека [1]
- 6-й элемент по распространенности в морской воде [2]
- 14-й по распространенности элемент в земной коре [3]
- 9-й самый распространенный элемент на всей Земле [4]
- 10-й по распространенности элемент в Солнечной системе [5]
- 10-й по распространенности элемент во Вселенной [6]
Кристаллы серы: Ярко-желтая группа кристаллов серы, демонстрирующая характерную для минерала орторомбическую кристаллическую форму и смолистый блеск. Образец размером примерно 7,3 х 6,6 х 5,3 см был собран в провинции Агридженто, Сицилия, Италия. Образец и фото Arkenstone / www.iRocks.com.
Образец размером примерно 7,3 х 6,6 х 5,3 см был собран в провинции Агридженто, Сицилия, Италия. Образец и фото Arkenstone / www.iRocks.com.
Горящая сера: Кусочки серы, горящие днем и ночью. Фотография Йоханнеса «volty» Хеммерляйна, использована здесь под лицензией GNU Free Documentation License.
| Знаете ли вы? На спутнике Юпитера, Ио, находится более 400 действующих вулканов, которые выбрасывают огромное количество серы — столько серы, что луна имеет желтоватый цвет. |
“Сера” или “Сера”?
Название «сера» использовалось в Соединенном Королевстве и по всей Британской империи на протяжении сотен лет. «Сера» — это написание, используемое в обычном и научном общении в Соединенных Штатах. В 1990 году Международный союз теоретической и прикладной химии определил «сера» как предпочтительное написание. По тому, как пишется это слово, часто можно определить возраст и происхождение публикаций и авторов.
РЕКЛАМА
| Информация о сере |
| [1] Какие элементы содержатся в организме человека? Статья в разделе «Строительные элементы жизни» на веб-сайте Аризонской школы наук о жизни, последний раз по состоянию на август 2022 г. [2] Периодическая таблица элементов в океане, статья на веб-сайте Научно-исследовательского института аквариума Монтерей-Бей, последний раз по состоянию на август 2022 года. [3] Список элементов периодической таблицы, отсортированных по содержанию в земной коре, статья на веб-сайте израильской науки и технологий, последний раз по состоянию на август 2022 г. [4] Состав Земли , Уильям Ф. Макдонаф, Глава 1 в Землетрясение, термодинамика и фазовые превращения в недрах Земли , октябрь 2000 г. Размещено в Google Книгах; последний доступ в августе 2022 г. [5] Изобилие элементов в Солнечной системе и температура конденсации элементов, автор Катарина Лоддерс, статья, опубликованная на веб-сайте The Astrophysical Journal, последний раз по состоянию на август 2022 года. [6] Изобилие во Вселенной Элементов, статья на веб-сайте PeriodicTable.com, последний раз по состоянию на август 2022 г. [7] Сера, Лори Э. Аподака, Геологическая служба США, сводки по минеральным товарам, январь 2016 г. [8] База данных свойств минералов Международной минералогической ассоциации, онлайновая база данных минералов, а также их химических и физических свойств, которую может запрашивать и сортировать любой, у кого есть доступ в Интернет. |
Сера как самородный минерал
Как минерал, сера представляет собой ярко-желтый кристаллический материал. Образуется вблизи вулканических жерл и фумарол, где сублимируется из потока горячих газов. Небольшие количества самородной серы образуются также при выветривании сульфатных и сульфидных минералов.
Наиболее крупные скопления минеральной серы находятся в недрах. Многие из них находятся в трещинах и полостях, связанных с минерализацией сульфидных руд. Наиболее крупные связаны с эвапоритовыми минералами, где гипс и ангидрит дают самородную серу как продукт действия бактерий. Значительное количество серы было получено из покрывающей породы соляных куполов, но сегодня этот тип производства производится редко.
Наиболее крупные связаны с эвапоритовыми минералами, где гипс и ангидрит дают самородную серу как продукт действия бактерий. Значительное количество серы было получено из покрывающей породы соляных куполов, но сегодня этот тип производства производится редко.
| Родственный: Голубое пламя, вызванное горением серы, на этой ночной сцене вулкана Кава Иджен, расположенного на острове Ява, Индонезия. |
Минералы, содержащие серу
Согласно базе данных Международной минералогической ассоциации, более 1000 минералов содержат серу как существенную часть своего состава. [8] Это результат способности серы образовывать соединения со всеми, кроме нескольких других элементов. В таблицах ниже перечислены некоторые сульфидные, сульфарсенидные, сульфосолевые и сульфатные минералы. Многие из наиболее распространенных минералов серы включены в список, но этот список не претендует на полноту.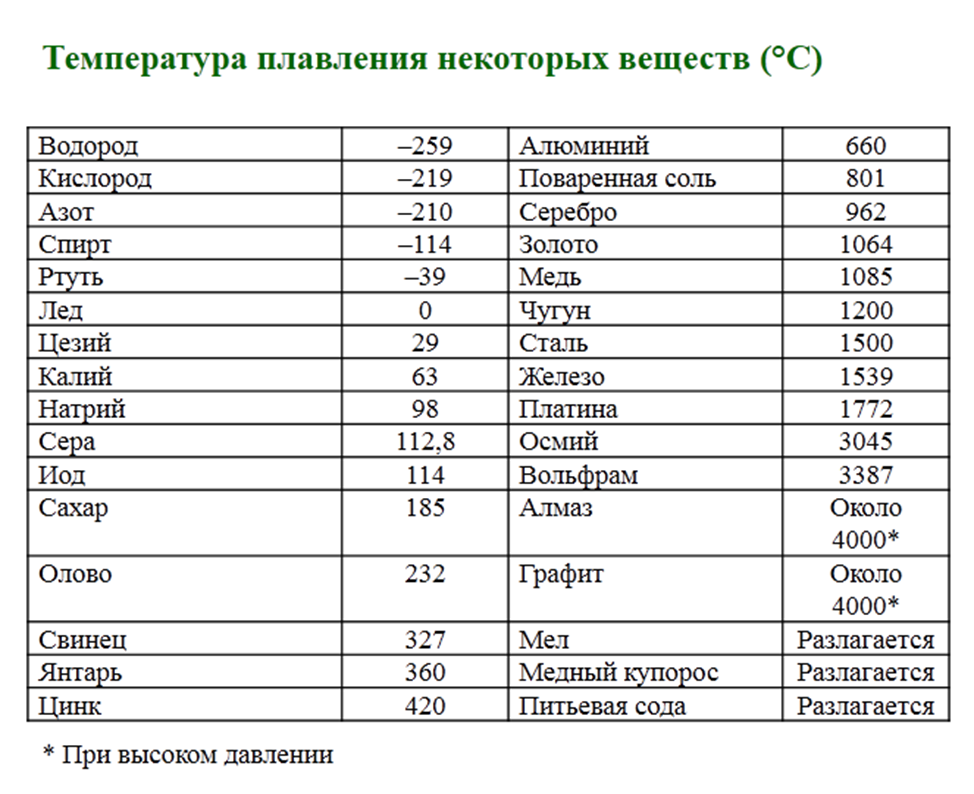
Sulfarsenide Minerals: | |
| Mineral | Composition |
| Cobaltite | (Co,Fe)AsS |
| Arsenopyrite | FeAsS |
| Gersdorffite | NiAsS |
Сульфасоль Минералы: | |
| Минерал | Composition |
| Pyrargyrite | Ag 3 SbS 3 |
| Proustite | Ag 3 AsS 3 |
| Tetrahedrite | Cu 12 Sb 4 S 13 |
| Tennantite | CU 12 AS 4 S 13 |
| ENARGIT0021 | |
| Bournonite | PbCuSbS 3 |
| Jamesonite | Pb 4 FeSb 6 S 14 |
| Cylindrite | Pb 3 Sn 4 FeSb 2 S 14 |
Гидроксид и гидросульфат Минералы: | |
| Минерал | Состав |
| Gypsum | CaSO 4 ·2H 2 O |
| Chalcanthite | CuSO 4 ·5H 2 O |
| Kieserite | MgSO 4 ·H 2 O |
| Starkeyite | MgSO 4 ·4H 2 O |
| Hexahydrite | MgSO 4 ·6H 2 O |
| Epsomite | MgSO 4 ·7H 2 O |
| Meridianiite | MgSO 4 ·11H 2 O |
| Melanterite | FeSO 4 ·7H 2 O |
| Antlerite | Cu 3 SO 4 (OH) 4 |
| Brochantite | Cu 4 SO 4 (OH) 6 |
| Alunite | KAl 3 (SO 4 ) 2 (OH) 6 |
| Jarosite | KFe 3 (SO 4 ) 2 (OH) 6 |
Лучший способ узнать о минералах — изучить коллекцию небольших образцов, которые можно брать в руки, исследовать и наблюдать за их свойствами. Недорогие коллекции минералов доступны в магазине Geology.com. Правообладатель иллюстрации iStockphoto / Анна Усова.
Недорогие коллекции минералов доступны в магазине Geology.com. Правообладатель иллюстрации iStockphoto / Анна Усова.
Anhydrous Sulfate Minerals: | |
| Mineral | Composition |
| Barite | BaSO 4 |
| Celestite | SrSO 4 |
| Anglesite | PbSO 4 |
| Ангидрит | CaSO 4 |
| Хэнксит | Na 9 SO 22 11361) 9 (CO 3 ) 2 Класс |
| Дополнительные минералы |
Найдите другие темы на Geology.
 com:
com:
|
| ||
|
| ||
|
| ||
|
Технический информационный бюллетень по сульфату меди
С 2011 года NPIC прекратил создание технических информационных бюллетеней по пестицидам. Старая коллекция технических информационных бюллетеней останется доступной в этом архиве, но они могут содержать устаревшие материалы. NPIC больше не имеет возможности постоянно обновлять их. Чтобы просмотреть наши общие информационные бюллетени, нажмите здесь. Актуальные технические информационные бюллетени можно найти на веб-странице Агентства по охране окружающей среды.
- Химический класс и тип
- Физические/химические свойства
- Использование
- Способ действия
- Классификация токсичности
- Острая токсичность
- Хроническая токсичность
- Эндокринные нарушения
- Канцерогенность
- Репродуктивные и тератогенные эффекты
- Судьба в теле
- Медицинские тесты и мониторинг
- Экологическая судьба
- Исследования экотоксичности
- Нормативные указания
Молекулярная структура –
Сульфат меди
Химический класс и тип:
- Сульфат меди является альгицидом, бактерицидом и фунгицидом.
 Когда он смешивается с
гидроксид кальция известен как бордоская смесь. 1 Международный союз
Название Pure and Applied Chemistry (IUPAC) для этого активного ингредиента — медь (2+).
сульфат или сульфат меди (II). Другие названия включают меди (2+) тетраоксидосульфат или
меди (II) тетраоксидосульфат. 2
Когда он смешивается с
гидроксид кальция известен как бордоская смесь. 1 Международный союз
Название Pure and Applied Chemistry (IUPAC) для этого активного ингредиента — медь (2+).
сульфат или сульфат меди (II). Другие названия включают меди (2+) тетраоксидосульфат или
меди (II) тетраоксидосульфат. 2 - Составы включают основной сульфат меди, моногидрат сульфата меди, медь пентагидрат сульфата и безводный сульфат меди. Их химические рефераты Регистрационные номера службы (CAS): 1344-73-6, 1332-14-5, 7758-99-8 и 7758-. 98-7 соответственно. Пестициды, содержащие моногидрат сульфата меди и/или безводный сульфат меди был отменен Министерством охраны окружающей среды США. Агентство по защите (Агентство по охране окружающей среды США). 3
- Сульфат меди использовался в Соединенных Штатах с 1700-х годов, и это было первое
зарегистрирован для использования в США в 1956. Агентство по охране окружающей среды США завершило перерегистрацию
сульфата меди в 2009 году.
 3 См. текстовое поле Лабораторные испытания .
3 См. текстовое поле Лабораторные испытания . - Сульфат меди — неорганическая соль, хорошо растворимая в воде. 3,4 Ион меди компонент сульфата меди с токсикологическими последствиями. 3
- Медь является важным минералом, и рекомендуемая диетическая норма меди для взрослых людей была установлена на уровне 900 мкг/день. 5
- Медь также является вездесущим элементом. Его можно найти в окружающей среде, а также в пищевых продуктах и воде. 3
Лабораторные испытания: перед регистрацией пестицидов
Агентства по охране окружающей среды США, они должны пройти лабораторные испытания на
краткосрочные (острые) и долгосрочные (хронические) последствия для здоровья.
Лабораторным животным намеренно вводят достаточно высокие дозы
вызывать токсические эффекты. Эти тесты помогают ученым судить о том, насколько
эти химические вещества могут воздействовать на людей, домашних животных,
и диких животных в случаях чрезмерного воздействия.
Применение:
- Сульфат меди используется в качестве фунгицида, альгицида, средства для уничтожения корней и гербицид как в сельском хозяйстве, так и в несельскохозяйственных условиях. это также используется в качестве противомикробного и моллюскоцида. 3 Использование для индивидуальных продукты, содержащие сульфат меди, сильно различаются. Всегда читайте и следуйте инструкциям на этикетке при применении пестицидов.
- Сульфат меди используется в качестве осушителя в безводной форме, в качестве добавки к удобрениям и продуктам питания, а также в ряде промышленных применения, такие как текстиль, кожа, дерево, батареи, чернила, нефть, краска и металл, среди прочего. 6 Используется также как пищевая добавка для животных. 8
- Некоторые продукты, содержащие сульфат меди, можно использовать в органическом сельском хозяйстве. 3
- Сигнальные слова для продуктов, содержащих сульфат меди, могут варьироваться от «Осторожно» до «Опасно».
 Сигнальное слово отражает комбинированное
токсичность активного ингредиента и других ингредиентов в продукте. См. этикетку пестицида на изделии и см.
информационные бюллетени NPIC по сигнальным словам и инертным или «другим» ингредиентам.
Сигнальное слово отражает комбинированное
токсичность активного ингредиента и других ингредиентов в продукте. См. этикетку пестицида на изделии и см.
информационные бюллетени NPIC по сигнальным словам и инертным или «другим» ингредиентам. - Чтобы найти список продуктов, содержащих сульфат меди, которые зарегистрированы в вашем штате, посетите веб-сайт http://npic.orst.edu/reg/state_agencies.html выберите свой штат, затем щелкните ссылку «Продукты штата».
Физические/химические свойства:
- Пентагидрат сульфата меди и основной сульфат меди являются единственными формами сульфата меди, содержащимися в зарегистрированных в настоящее время пестицидные продукты. 3 Химические свойства этих двух форм приведены в таблице ниже.
| Активный ингредиент | КАСРН 3 | Формула 3 | Медь (%Cu) 3 | Форма 6,7 | Давление пара (мм рт. ст. при 25 °C) 1 ст. при 25 °C) 1 | Молекулярная масса (г/моль) 3 | Удельный вес/плотность 6,7 | Растворимость (вода) 1,7 |
| Пентагидрат сульфата меди | 7758-99-8 | CuSO 4 · 5H 2 O | 25,4 | Синие кристаллы, гранулы или порошок | Энергонезависимый | 249,65 | 2,286 SG (15,6 °C / 4 °C) | 148 г/кг (0 °C), 736 г/кг (100 °C) |
| Сульфат меди основной | 1344-73-6 | 3Cu(OH) 2 · CuSO 4 | 54,2 | светло-голубой / зеленый мелкий порошок | Не найдено | 468,29 | 0,800-0,900 СГ | Нерастворимый (растворимый в кислотах) |
Способ действия:
Организмы-мишени
- Ион меди является компонентом сульфата меди с токсикологическими последствиями.
 Ионы меди связываются с
функциональные группы белковых молекул грибов и водорослей и вызывают денатурацию белков, вызывая повреждение клеток и
утечка. Белковые компоненты, которые действуют как сайты связывания, представляют собой сульфидные группы, фосфаты (тиол), карбоксилы и имидазолы. 3
Ионы меди связываются с
функциональные группы белковых молекул грибов и водорослей и вызывают денатурацию белков, вызывая повреждение клеток и
утечка. Белковые компоненты, которые действуют как сайты связывания, представляют собой сульфидные группы, фосфаты (тиол), карбоксилы и имидазолы. 3 - У моллюсков сульфат меди нарушает функцию поверхностного эпителия и ферментов пероксидазы. 3
Нецелевые организмы
- Медь является важным питательным веществом. Острая токсичность медьсодержащих пестицидов связана не с системной токсичностью, а с усилиям организма по уравновешиванию концентрации меди. 3
- Медь играет роль в окислительном стрессе. Он может действовать как катализатор образования свободных радикалов, но также играет роль в восстановлении активных форм кислорода. 9 Медь в организме в основном связана с белками. 10,11
- Проглатывание сульфата меди раздражает пищеварительную систему и может вызвать рвоту, что снижает токсичность.
 12 Тканевая коррозия,
шок и смерть могут наступить после воздействия больших доз сульфата меди. Повреждение клеток крови, печени и почек
также сообщалось. 13
12 Тканевая коррозия,
шок и смерть могут наступить после воздействия больших доз сульфата меди. Повреждение клеток крови, печени и почек
также сообщалось. 13 - Овцы могут быть особенно чувствительны к продуктам, содержащим сульфат меди, возможно, из-за неэффективного выделения меди. 14
Острая токсичность:
Пероральный
- Острая пероральная ЛД 50 у крыс составляет от 450 до 790 мг/кг. Агентство по охране окружающей среды США считает пентагидрат сульфата меди умеренно опасным. токсичен при приеме внутрь. 3 См. текстовые поля для Классификация токсичности и LD 50 /LC 50 .
- Люди могут подвергаться воздействию меди в питьевой воде. Добровольцы пили очищенную воду с медью в концентрациях
в пределах от 0-12 мг/л. Они сообщили о тошноте, начиная с 4 мг/л, и рвоте, начиная с 6 мг/л. Растворы, содержащие медь
и апельсиновый вкус повысили NOEL до 6 мг/л в отношении тошноты и 12 мг/л в отношении рвоты.
 Следовательно, ароматизированные напитки загрязнены
с медью может привести к более высокому облучению. 15 См. текстовое поле NOEL .
Следовательно, ароматизированные напитки загрязнены
с медью может привести к более высокому облучению. 15 См. текстовое поле NOEL . - Ученые измерили общее количество ионов меди в сыворотке крови людей после приема сульфата меди. Средние уровни меди в крови 287 мкг/л Cu коррелировали с легким токсикозом, а уровни 798 мкг/л Cu — с тяжелым токсикозом. 16
- Токсическая доза медного купороса для крупного рогатого скота составляет 200-880 мг/кг. Овцы в десять раз более чувствительны к токсической дозе 20-110 мг/кг сульфата меди. 17
- взрослых петухов подвергали интубации медному купоросу в дозах 200, 600, 800, 1200 и 1600 мг/кг массы тела. Острая LD 50 составила 693 мг/кг. Обработанный у животных развилась диарея, и они умерли в течение 24–28 часов. Вскрытие показало кровотечение из почек и печени, некроз ткани печени и атрофию яичек. 18
LD 50 /LC 50 : Общий
мерой острой токсичности является смертельная доза (LD 50 ) или
смертельная концентрация (LC 50 ), вызывающая смерть (в результате
от однократного или ограниченного воздействия) у 50 процентов пролеченных
животные. LD 50 обычно выражается как доза в
миллиграммы (мг) химического вещества на килограмм (кг) тела
масса. LC 50 часто выражается в мг химического вещества на
объем (например, литр (л)) среды (например, воздуха или воды) организма
подвергается. Химические вещества считаются высокотоксичными, если
ЛД 50 /LC 50 маленький и практически нетоксичный
когда значение велико. Однако LD 50 /LC 50 не отражает каких-либо последствий длительного воздействия (т. е. рака,
врожденные дефекты или репродуктивная токсичность), которые могут возникать при уровнях ниже
те, которые вызывают смерть.
LD 50 обычно выражается как доза в
миллиграммы (мг) химического вещества на килограмм (кг) тела
масса. LC 50 часто выражается в мг химического вещества на
объем (например, литр (л)) среды (например, воздуха или воды) организма
подвергается. Химические вещества считаются высокотоксичными, если
ЛД 50 /LC 50 маленький и практически нетоксичный
когда значение велико. Однако LD 50 /LC 50 не отражает каких-либо последствий длительного воздействия (т. е. рака,
врожденные дефекты или репродуктивная токсичность), которые могут возникать при уровнях ниже
те, которые вызывают смерть.
Кожный
- Сульфат меди не раздражает кожу. Агентство по охране окружающей среды США классифицировало его как вещество с очень низкой токсичностью для раздражения кожи. кожный ЛД 50 превышала 2000 мг/кг у крыс. 3
- Сульфат меди вызывал сильное раздражение глаз с 1-го дня у кроликов, подвергавшихся воздействию до 21 дня, и был оценен как
Агентство по охране окружающей среды США высокотоксично для первичного раздражения глаз.
 3
3 - Не было обнаружено никаких данных о способности сульфата меди вызывать кожную сенсибилизацию у любых видов животных. 3
Вдыхание
- Вдыхание ЛК 50 для крыс 1,29мг/л. 19
Признаки токсичности – животные
- Признаки, зарегистрированные у кошек и собак после приема внутрь медных монет, включают снижение аппетита, депрессию, рвоту, обезвоживание и боль в животе. 20,21 Некоторые породы собак особенно чувствительны к отравлению медью из-за генетической дефект. К ним относятся далматины, бедлингтоны, вест-хайленд-уайт и скай-терьеры, у которых прием меди приводит к при слабости, анорексии и рвоте. 22 У пожилых собак может развиться повреждение печени и избыток жидкости в брюшной полости. 17
- Признаки отравления скота после острого проглатывания включают боль в животе, диарею, рвоту, шок, снижение массы тела
температура, учащение пульса и смерть.
 Диарея и рвота могут иметь цвет от зеленого до синего. 23
Диарея и рвота могут иметь цвет от зеленого до синего. 23 - После приема внутрь от 20 до 100 мг/кг массы тела сульфата меди у овец наблюдалось снижение аппетита, диарея, слюноотделение, воспаление, коррозия, поражения желудка и кишечника и боль в животе. Эти симптомы могут привести к обезвоживание, шок и смерть. 14,17
- Анорексия, выделения из носа, лежачее положение, желтуха и смерть относятся к признакам, наблюдаемым у коров. 24 Красновато-коричневая моча, также наблюдались учащенное дыхание и повышенные концентрации меди в крови, почках и печени. 25 Признаки у коз включают анорексию и лежачее положение. 26
- Свиньи, получавшие 500 ppm Cu в виде пентагидрата сульфата меди, показали меньший прирост веса, снижение гемоглобина,
более низкий гематокрит, более низкий уровень меди в плазме и повышенное содержание меди в печени. Доза сульфата меди с 250 ppm Cu
вызывал более быстрое увеличение веса и отсутствие изменений в анализируемых параметрах крови.
 27
27
| КЛАССИФИКАЦИЯ ТОКСИЧНОСТИ – СУЛЬФАТ МЕДИ | ||||
|---|---|---|---|---|
| Высокая токсичность | Умеренная токсичность | Низкая токсичность | Очень низкая токсичность | |
| Острая пероральная LD 50 | До 50 мг/кг включительно (≤ 50 мг/кг) | От более 50 до 500 мг/кг (>50-500 мг/кг) | От более 500 до 5000 мг/кг (>500-5000 мг/кг) | Более 5000 мг/кг (>5000 мг/кг) |
| Вдыхание LC 50 | До 0,05 мг/л включительно (≤0,05 мг/л) | От 0,05 до 0,5 мг/л (>0,05-0,5 мг/л) | Более 0,5–2,0 мг/л (>0,5–2,0 мг/л) | Более 2,0 мг/л (>2,0 мг/л) |
| Кожный LD 50 | До 200 мг/кг включительно (≤200 мг/кг) | От более 200 до 2000 мг/кг (>200-2000 мг/кг) | Более 2000 до 5000 мг/кг (>2000-5000 мг/кг) | Более 5000 мг/кг (>5000 мг/кг) |
| Первичное раздражение глаз | Разъедающее (необратимое разрушение тканей глаза) или поражение роговицы или раздражение, сохраняющееся более 21 дня | Поражение роговицы или другое раздражение глаз проходит через 8–21 день | Поражение роговицы или другое раздражение глаз проходит в течение 7 дней или менее | Минимальное устранение эффектов менее чем за 24 часа |
| Первичное раздражение кожи | Разъедающее (разрушение тканей в дерме и/или рубцевание) | Сильное раздражение через 72 часа (сильная эритема или отек) | Умеренное раздражение через 72 часа (умеренная эритема) | Легкое или легкое раздражение через 72 часа (без раздражения или эритемы) |
Выделенные поля отражают значения в разделе «Острая токсичность» данного информационного бюллетеня. По образцу Агентства по охране окружающей среды США, Управления программ по пестицидам, Руководства по проверке этикеток, глава 7: Предупредительная маркировка. https://www.epa.gov/sites/default/files/2018-04/documents/chap-07-mar-2018.pdf По образцу Агентства по охране окружающей среды США, Управления программ по пестицидам, Руководства по проверке этикеток, глава 7: Предупредительная маркировка. https://www.epa.gov/sites/default/files/2018-04/documents/chap-07-mar-2018.pdf | ||||
Признаки токсичности — люди
- Признаки и симптомы перорального воздействия включают металлический привкус, тошноту, рвоту, диарею и боль в верхней части живота. 28 Симптомы зависят от кислотности и содержимого желудка. 3 Зеленая или синяя окраска рвотных масс, стула и слюны сообщил. 29 Может возникнуть коррозия желудочно-кишечного эпителия. 3 Воздействие меди может также вызвать печеночную недостаточность, почек, кровеносной системы. 28
- Дополнительные признаки, включая темно-коричневую или красную мочу, снижение образования мочи, желудочно-кишечное кровотечение, желтуху,
синюшность кожи или слизистых оболочек, делирий и кома были зарегистрированы у пациентов, принявших внутрь до 50 г меди.
 сульфат. 30
сульфат. 30 - Симптомы острого воздействия пыли и порошкообразных составов могут включать раздражение кожи и глаз. Растворимый сульфат меди в глазу может вызвать коррозию роговицы. 28
- Вдыхание может вызвать раздражение дыхательных путей, включая разъедание слизистых оболочек. 28 Прочее признаки и симптомы ингаляционного воздействия солей меди включают гиперемию слизистых оболочек и изъязвление перегородки носа. 31
- Всегда следуйте инструкциям на этикетке и принимайте меры для минимизации воздействия. Если произошло какое-либо воздействие, обязательно следуйте инструкциям по оказанию первой помощи. инструкции на этикетке продукта внимательно. Для получения дополнительных рекомендаций по лечению обратитесь в Центр контроля отравлений по телефону 1-800- 222-1222. Если вы хотите обсудить инцидент с Национальным информационным центром по пестицидам, позвоните по телефону 1-800-858-7378.
Хроническая токсичность:
Животные
- Двенадцать кроликов вдыхали распыляемую бордосскую жидкость в течение 10 минут 3 раза в день в течение 4 месяцев.
 Концентрация была
постепенно увеличивается с 1% до 3%. У всех животных развились воспаление, отложения меди и дегенеративные изменения в
ткань легкого. В отличие от других исследований с более длительным временем воздействия, это исследование не выявило гранулем или фиброза.
в легочной ткани. 32
Концентрация была
постепенно увеличивается с 1% до 3%. У всех животных развились воспаление, отложения меди и дегенеративные изменения в
ткань легкого. В отличие от других исследований с более длительным временем воздействия, это исследование не выявило гранулем или фиброза.
в легочной ткани. 32 - Крыс кормили ad libitum диета, содержащая 0, 500, 1000, 2000 или 4000 ppm меди в виде сульфата меди в течение одного месяца. Содержание меди увеличилось в крови, селезенке и печени во всех группах. Рост и потребление пищи снижались с повышением концентрации. При самой высокой дозе крысы умирали после первой недели. 33
- Самцам крыс вводили через зонд 100 мг/кг/день сульфата меди в течение 20 дней. Признаки включали изменение цвета лап от от розового до белого и снижение массы тела. Дальнейший анализ показал разрушение эритроцитов и отложение меди. некроз ткани печени и почек. 34
- Свиней кормили пентагидратом сульфата меди с концентрацией меди 0, 250 и 425 ppm Cu в течение 48–79 дней.
 При приеме самой высокой дозы наблюдались желудочно-кишечные кровотечения, цирроз печени и желтуха. 35
При приеме самой высокой дозы наблюдались желудочно-кишечные кровотечения, цирроз печени и желтуха. 35 - Шестнадцать ягнят получали корм, содержащий пентагидрат сульфата меди в концентрации 15 ppm Cu в течение 88 дней. Два ягненка умер от желтухи. Печень выживших ягнят содержала высокие концентрации меди. 27
- Смеси для овец, содержащие 5,3–9,9 % пентагидрата сульфата меди, потребляющие 0,645–1,660 г сульфата меди ежедневно в течение 28–28 лет. 113 дней. Признаки включали вялость, желтуху, гемоглобинурию, кровянистые выделения из носа, учащенный пульс, учащенное дыхание, зеленовато-черный цвет. стул и лежачее положение перед смертью. 36
- Кур-несушек кормили сульфатом меди в концентрации 78 ppm Cu и 1437 ppm Cu в течение 2 недель. На самом высоком
концентрации куры производили меньше яиц, потребляли меньше корма и у них появлялись язвы в желудке и ротовой полости. 37 Прочее
исследования цыплят, которых кормили сульфатом меди, выявили поражения ротовой полости, пропорциональные дозе меди, и противоречивые данные.
 влияет на скорость кормления и прибавку в весе. 38,39,40,41
влияет на скорость кормления и прибавку в весе. 38,39,40,41 - Крысы, подвергшиеся ингаляционному воздействию сульфата меди в течение 1 часа в день в течение 10 дней при концентрации 330 г/л спрея, увеличились концентрации меди в печени и плазме. Медь не накапливалась в легочной ткани. 42
NOAEL: Отсутствие наблюдаемых побочных эффектов Уровень
NOEL: Уровень отсутствия наблюдаемого воздействия
LOAEL: Наименьший уровень наблюдаемого неблагоприятного воздействия
LOEL: Наименьший уровень наблюдаемого воздействия
Люди
- Группа из 179 взрослых из Ирландии, Чили и США подвергалась воздействию один раз в неделю раствор медного купороса (0, 2, 4, 6 и 8 мг Cu/л) в течение 5 нед.
Острый LOAEL и NOAEL были определены при 6 и 4 мг Cu/л. Тошнота в течение 15 минут после воздействия была наиболее
общий наблюдаемый эффект. Рвота, диарея и боль в животе
также сообщалось в меньшей степени. 43 Эти результаты были подтверждены
в двух дополнительных независимых экспериментах с участием в общей сложности 1634
люди со всего мира.
 44,45 См. текстовое поле NOAEL, NOEL,
НУНВ и НУНВ .
44,45 См. текстовое поле NOAEL, NOEL,
НУНВ и НУНВ . - Исследователи вводили сульфат меди, растворенный в водопроводной воде, в дозах 0, 1, 3 и 5 мг Cu/л в течение 2 недель группам 15 здоровых взрослых женщин. Испытуемые выпивали в среднем 1,64 л в день. Сообщаемые симптомы включают тошноту, боль в животе, и рвота при воздействии ≥3 мг Cu/л. 46
- «Легкое опрыскивателя виноградников» — состояние, о котором сообщают сельскохозяйственные рабочие после хронического вдыхания бордосской жидкости. которые могут подвергаться сезонному воздействию. 47 Характеризуется особыми изменениями легочной ткани, включая поражения, синюю окраску, рубцы и узелки. 47,48 Симптомы включают слабость, потерю аппетита, снижение массы тела, одышку и в некоторых случаях кашель. 47,48 См. текстовое поле Экспозиция .
Воздействие: воздействие сульфата меди на здоровье человека и окружающую среду зависит от того, насколько
наличие сульфата меди, а также продолжительность и частота воздействия.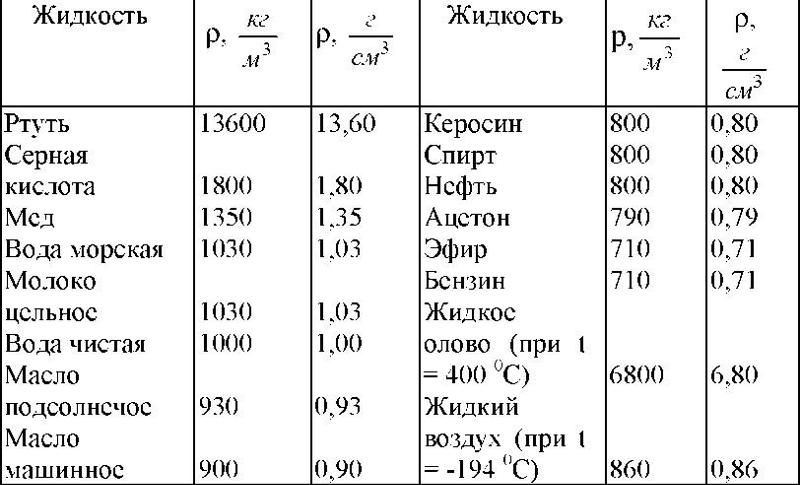 Эффекты также зависят от здоровья
человека и/или определенных факторов окружающей среды.
Эффекты также зависят от здоровья
человека и/или определенных факторов окружающей среды.
Нарушение эндокринной системы:
- Не обнаружено данных, связанных с сульфатом меди и нарушением эндокринной системы. 3
Канцерогенность:
Животные
- Исследователи перорально вводили мышам 1,25, 2,50, 5,00, 7,50, 10,0 или 12,5 мг/кг массы тела сульфата меди. ДНК эритроцитов была повреждена дозозависимым образом.49У мышей, получавших 8,25 мг/кг меди через зонд в виде сульфата меди, наблюдались генотоксические и мутагенные реакции в костном мозге и цельной крови. 50
- Только что вылупившимся цыплятам белых леггорнов перорально вводили сульфат меди в концентрации 10 мг/кг массы тела. Цыплят забивали через 24 часа, и тесты на хромосомные аберрации костного мозга продемонстрировали повышенную частоту микроядер у подвергшихся воздействию цыплят, что указывает на повреждение ДНК. 51
Люди
- Агентство по охране окружающей среды США не оценивало канцерогенные эффекты сульфата меди, поскольку не было убедительных доказательств связи меди или солей меди с развитием рака у животных, которые в норме могут регулировать содержание меди в своем организме.
 3 См. текстовое поле Рак .
3 См. текстовое поле Рак .Рак: правительственные учреждения в Соединенных Штатах и за рубежом разработали программы для оценки способность химического вещества вызывать рак. Рекомендации по тестированию и системы классификации различаются. Узнать больше о значении различных дескрипторов классификации рака, перечисленных в этом информационном бюллетене, пожалуйста, посетите соответствующую ссылку или позвоните в NPIC.
- Высокие уровни меди связаны с канцерогенезом и высоким риском смертности от рака. 9,52 Медь может влиять на рост рака и пролиферацию клеток, а также стимулировать образование кровеносных сосудов. 10,11 Снижение уровня меди может подавлять рост рака. 11
- Повышение заболеваемости почечно-клеточным раком было связано с воздействием сульфата меди при использовании в качестве пестицида на виноградниках. Амбулаторные обследования показали, что люди, сообщившие о хроническом воздействии сульфата меди в течение более 10 лет, имели отношение шансов 2,7 (9).
 5% ДИ: 1,3-5,5) для повышенного риска рака почки. 53 Уровни воздействия не сообщались.
5% ДИ: 1,3-5,5) для повышенного риска рака почки. 53 Уровни воздействия не сообщались. - Рейтинги рака для сульфата меди Международным агентством по изучению рака (IARC) или Национальной токсикологической программой (NTP) не найдены.
Репродуктивные или тератогенные эффекты:
Животные
- Тератогенное действие сульфата меди изучали путем инъекции меди беременным хомячкам на восьмой день жизни. беременности в дозах от 2,13 до 10,0 мг Cu/кг в виде медного купороса. Все концентрации приводили к эмбриоцидное и тератогенное действие. Эмбриональные резорбции, тяжелые пороки сердца, грыжи и другие пороки развития были сообщены. Исследователи пришли к выводу, что плаценты проницаемы для ионов меди. 54
- Мышей кормили сульфатом меди в дозах 0,5, 1,0, 1,5, 2,0, 3,0 и 4,0 г/кг корма в течение месяца, а затем спаривали. Беременные мыши
диету продолжали до 19-го дня. Исследователи отметили большую смертность плода, меньший вес плода и аномалии в
две самые высокие дозы.
 55
55 - Агентство по охране окружающей среды США определило, что хронический NOAEL для репродуктивных эффектов составляет 11,7 мг/кг массы тела меди, а хронический LOAEL для репродуктивных эффектов составил 15,1 мг / кг массы тела меди на основе исследования норок. 3
- Взрослые цыплята подвергались воздействию сульфата меди через зонд в концентрациях 200, 600, 800, 1200 и 1600 мг/кг тела масса. Исследователи отметили атрофию яичек и остановку сперматогенеза, пропорциональные концентрации меди. сульфат. 18
- Подвижность сперматозоидов кроликов снижалась при помещении их в растворы пентагидрата сульфата меди в диапазоне от 1:1 до 1:10 в течение 1-2 часы. 56
Люди
- Исследователи подвергли сперматозоиды человека воздействию 8 x 10 -8 , 8 х 10 -6 и 8 х 10 -5 моль ионов меди в форме CuCl 2 за 30
минут. Сперматозоиды были иммобилизованы после 20-минутного воздействия двух самых высоких концентраций; снижение подвижности
был также отмечен в группе с низкой дозой.
 57
57 - Болезнь Вильсона может дать представление о потенциальном влиянии меди на репродуктивное здоровье. Болезнь Вильсона — редкое генетическое расстройство, при котором организм сохраняет слишком много меди. Последствия включают бесплодие, более высокую частоту выкидышей, потерю менструаций. гормональный дисбаланс у женщин. 58,59 У мужчин яички функционируют неправильно. Воздействие медного купороса не вызывают болезнь Вильсона. 59
Судьба в организме:
Поглощение
- Когда люди употребляют в пищу ионную медь, она всасывается в тонком кишечнике и в меньшей степени в желудке. Может быть поглощается за счет пассивной диффузии или активного транспорта. 5 Уровни меди в кровотоке достигали максимума между 1 и через 3 часа после приема. 29
- Степень усвоения меди частично зависит от потребления меди с пищей. 5
- Поглощение меди может быть усилено присутствием белков и органических кислот, таких как лимонная кислота и уксусная кислота, и
ингибируется фитатом, цинком, железом, молибденом, кальцием и фосфором.
 5
5 - Уровни ионов меди в сыворотке у людей после острого перорального воздействия были максимальными в течение 12 часов после приема внутрь и резко снижается после 12 часов приема. Эти результаты показывают, что медь быстро поглощается и встраивается в нее. в крови. 16
- Женщины в возрасте до 60 лет усваивают больше меди, чем мужчины, но у пожилых людей различий не было. 60
Распределение
- После вдыхания бордоской смеси у работников виноградников были обнаружены отложения меди не только в легочной ткани, но и в печени, селезенки, почек и лимфатических узлов. Вдыхаемая медь поглощается дыхательными путями и переносится кровотоком. и лимфатической системы к другим органам. 61
- В клетках кишечника медь входит в состав белков, связывающих металлы. Он может храниться до трех дней, используется
клетки или транспортироваться плазмой крови в другие органы, будучи связанными с некоторыми белками.
 Затем медь осаждается в
печень. 5
Затем медь осаждается в
печень. 5 - Основным органом-мишенью меди является печень, где медь может накапливаться в связанном с белками состоянии. 5 Медь также распространяется в желчь, кости, мозг, волосы, сердце, кишечник, почки, мышцы, ногти, кожу и селезенку. 5,62
- Медь в организме может находиться в связанном состоянии с церулоплазмином (85-95%) или в виде свободной меди, связанной с альбумином (5-15%). последний отвечает за токсические эффекты. 63
Метаболизм
- После того, как медь абсорбируется и связывается с белками, она транспортируется кровью по всему телу. 5
Выделение
- Избыток меди выводится из организма и редко сохраняется в организме. 64
- Медь в основном выводится с калом через желчь; он также может выделяться в гораздо меньшем количестве с мочой,
пот и нормальное шелушение кожи. Женщины также могут устранить очень небольшое количество меди во время менструации.
 и мужчины могут устранить его в сперме. Небольшие количества также могут выводиться из волос и ногтей. 5
и мужчины могут устранить его в сперме. Небольшие количества также могут выводиться из волос и ногтей. 5 - Субъекты ели пищу, содержащую медь с радиоактивной меткой, и для измерения уровня остаточной меди использовали сканер всего тела. Период полувыведения в организме колебался от 13 до 33 дней. 65
Медицинские тесты и мониторинг:
- Гомеостатическая регуляция меди затрудняет идентификацию биомаркеров для ранних изменений уровня меди, связанных с с недостатком или избытком. 45 Чрезвычайный дисбаланс меди может указывать на повреждение тканей, но из-за гомеостаза, высокий воздействие меди не всегда может быть обнаружено. В настоящее время биомаркеры не могут надежно обнаруживать избыточное воздействие меди. даже в тех случаях, когда у пациентов есть симптомы. 65
- Концентрация меди в сыворотке и активность церулоплазмина являются традиционными индикаторами метаболизма меди, подходящими для обнаружения
дефицит меди.
 На них могут влиять возраст, пол, беременность, уровень гормонов и состояние здоровья. 65 Медный шаперон (CCS),
который реагирует на дефицит и избыток меди, недавно был идентифицирован как потенциальный биомаркер, но его значение
неизвестно. 66 Аминотрансферазы печени традиционно используются в качестве индикатора высокого содержания меди. 65
На них могут влиять возраст, пол, беременность, уровень гормонов и состояние здоровья. 65 Медный шаперон (CCS),
который реагирует на дефицит и избыток меди, недавно был идентифицирован как потенциальный биомаркер, но его значение
неизвестно. 66 Аминотрансферазы печени традиционно используются в качестве индикатора высокого содержания меди. 65 - Ученые использовали атомно-абсорбционную спектрофотометрию для количественного определения меди в волосах головы, крови и моче. 67 Этот метод также использовался для измерения меди в ногтях. 68 Некоторые исследователи постулируют необходимость дополнительных исследований в анализ волос, заявив, что он имеет потенциал в качестве биоиндикатора, потому что волосы можно легко получить, но ученые определили несколько факторов, связанных с ненадежностью минерального анализа волос. 69,70
- Эмиссионная спектроскопия с индуктивно связанной плазмой использовалась для измерения содержания меди в крови, моче и поте.
 Выборка
Сообщалось об ограничениях методологии определения пота. 71
Выборка
Сообщалось об ограничениях методологии определения пота. 71 - Образцы крови можно оценить на наличие индикаторов содержания меди. Эритроцитарная супероксидазадисмутаза (SOD1), тромбоциты цитохром-С-оксидаза (CCO), диаминоксидаза плазмы (DAO) и пептидилглицин-амидирующая монооксигеназа (PAM) активности, все медьсодержащие ферменты в клетках крови считаются хорошими индикаторами дефицита метаболически активная медь и запасы меди. 65
Экологическая судьба:
Почва
- Сульфат меди может диссоциировать или растворяться в окружающей среде с выделением ионов меди. На этот процесс влияет его растворимость,
на который, в свою очередь, влияют pH, окислительно-восстановительный потенциал, растворенный органический углерод и лиганды, присутствующие в почве. Медь в почве
может происходить из природных источников, пестицидов и других антропогенных источников, таких как горнодобывающая промышленность, промышленность, архитектурные сооружения.
 материалов и автомобилей. 3
материалов и автомобилей. 3 - Медь накапливается в основном на поверхности почвы и может сохраняться, поскольку имеет тенденцию связываться с органическим веществом, минералы и некоторые оксиды металлов. Он может выщелачиваться из кислой или песчаной почвы. 72,73
- Чем кислее почва, тем меньше связывание. Исследователи заметили, что 30% меди связывается при рН 3,9 и 99% меди. медь была связана при рН 6,6. 74
- Исследователи внесли эквивалент 18 кг/га/год сульфата меди в поливную воду в экспериментальные колонки почвы для измерить накопление меди в почве. Типы почвы не указаны. Почти вся применяемая медь осталась в топ-3. см почвы. Исследователи пришли к выводу, что оросительная вода, обработанная сульфатом меди в качестве альгицида, может привести к загрязнению почвы. уровни, которые могут повредить урожай. 75
- Исследование, в ходе которого оценивалось выщелачивание меди из песчаной почвы в воду, показало более низкую подвижность при pH 5–7.
 Любой рН снаружи
этого диапазона коррелировало с более высокой мобильностью. Исследователи сообщили, что присутствие ионов кальция уменьшилось.
выщелачивание меди, повышение ее связывающей способности. Присутствие ионов натрия имело противоположный эффект и вызывало более
медь для выщелачивания. 76
Любой рН снаружи
этого диапазона коррелировало с более высокой мобильностью. Исследователи сообщили, что присутствие ионов кальция уменьшилось.
выщелачивание меди, повышение ее связывающей способности. Присутствие ионов натрия имело противоположный эффект и вызывало более
медь для выщелачивания. 76 - Исследователи добавили в образцы супесчаной почвы с ячменного поля 0, 100, 200, 400 и 800 мкмоль/кг меди. Медь стали менее биодоступными в течение 220 дней эксперимента. Почвы, которые оставались влажными, сохраняли больше всего меди. 77
Вода
- Сульфат меди — неорганическая соль, хорошо растворимая в воде. 3 Диссоциированные ионы меди в основном связываются с органическими вещества или остаются растворенными в воде. 78
- В течение 16 недель исследователи добавляли 774 г пентагидрата сульфата меди в канальные пруды для ловли сома. Исследователи обнаружили, что
90 % меди было связано с отложениями в течение нескольких минут после нанесения, а 99 % — через 2 дня.
 Около
вся медь осталась в верхних 16 см осадка. 79
Около
вся медь осталась в верхних 16 см осадка. 79 - Исследователи собрали пробы воды и отложений из озера Мэтьюз, Калифорния, после подачи 2250 кг сульфат меди как альгицид. Концентрация меди на выходе из водохранилища достигла пика через два дня после применения на уровне 17 мкг/л и стабилизировался примерно на уровне 3 мкг/л через две недели. Исследователи подсчитали, что 20% нанесенной меди осталось водохранилище к 70-му дню, и большая часть оставшейся меди оказалась связанной в верхнем слое отложений. Осадок концентрации составляли 10-600 мкг/г. 80
- Сравнимые результаты были получены после изучения состояния сульфата меди, нанесенного на водохранилище Сен-Жермен-ле-Бель. во Франции после применения 50 кг медного купороса. Исследователи подсчитали, что 17% добавленной меди уходит из воды. тела в течение 70 дней. Растворенная медь в толще воды существовала в основном в коллоидной форме. Накопление медь была незначительна. 81
Воздух
- Данных о судьбе сульфата меди в атмосфере не обнаружено.

Растения
- Медь является важным минералом для роста растений, и ее концентрация регулируется гомеостатическими механизмами. Однако, медь может быть токсична для растений, влияя на транспорт электронов при фотосинтезе. 82
- Биодоступность зависит от количества меди, рН почвы, органического углерода, осадков и температуры. 83
- Исследователи изучили токсичность меди для саженцев цитрусовых в трех типах почвы с рН от 5,7 до 8,2. Образцы
добавляли удобрения и пентагидрат сульфата меди и инкубировали в течение 47 дней. Саженцы корнеплодов цитрусовых (Swingle
citrumelo) затем пересаживали в горшки и оставляли расти на 330 дней. В двух из трех почв рассада цитрусовых
снизилась сухая масса листьев, стеблей и корней при более высоких дозах внесения меди. Легко растворимая медь увеличивалась с
снижая pH почвы, но на его долю приходится менее 10% от общего содержания меди. Легкорастворимая медь является наиболее фитотоксичной.
 форма. 84
форма. 84 - Исследователи подвергали луковицы ( Allium cepa ) и семена кресс-салата ( Lepidium sativum ) воздействию растворов меди в виде меди сульфат. Они подсчитали, что концентрации меди, необходимые для ингибирования 50% роста (IC 50 ) после 48 часов воздействия 0,00112 ± 0,00019 ммоль/л (±, стандартное отклонение) для A. cepa и 2,42917 ± 0,25897 ммоль/л для L. sativum . 85
Внутренний
- Сульфат меди не используется внутри помещений. Данных о судьбе сульфата меди в помещении не было.
Остатки пищи
- Сульфат меди не был включен в список остатков пестицидов в пищевых продуктах, подлежащих контролю со стороны Министерства Сельское хозяйство. 86
- Остатки пентагидрата сульфата меди освобождаются от требования о допуске в продуктах крупного рогатого скота, яйцах, козах,
свиней, лошадей, молоко, домашнюю птицу и овец, а также после сбора урожая на сырые сельскохозяйственные товары.
 Остатки можно ожидать
от его использования в качестве фунгицида в сельском хозяйстве и в качестве бактерицида/фунгицида в животноводческих помещениях. 87
Остатки можно ожидать
от его использования в качестве фунгицида в сельском хозяйстве и в качестве бактерицида/фунгицида в животноводческих помещениях. 87
Исследования экотоксичности:
Птицы
- Агентство по охране окружающей среды США классифицировало медь как вещество с умеренной токсичностью для птиц на основании острой LD 50 для белоснежных перепелов ( Colinus virginianus ) 384 мг/кг пентагидрата сульфата меди и 98 мг/кг металлической меди. Хронический LOAEL для bobwhite перепела – 289 мг/кг металлической меди. 3 Острая пероральная LD 50 для бело-рыжих перепелов, подвергшихся воздействию сульфата меди, также была зарегистрирована как 616 мг/кг. Диетический LC 50 для белоснежных перепелов составляет 1369 мг/кг в течение 8 дней. 1
- Исследователи скармливали 450 мг/кг меди из сульфата меди цыплятам мужского пола в течение 21 дня. Они отметили уменьшение количества кормления и меньшее
прибавка в весе у экспонированных птиц.
 40
40 - Стая трехнедельных канадских гусей ( Branta canadensis ) использовала пруд, обработанный сульфатом меди. Десять гусей умер через девять часов после приема примерно 600 мг/кг сульфата меди. 88
- Имеются ограниченные данные о токсичности сульфата меди для диких птиц. 89
Рыба и водные обитатели
Наземные беспозвоночные
- Агентство по охране окружающей среды США считает медь практически нетоксичной для пчел. Острая пероральная ЛД 50 составляет >100 мкг/пчелу. 3
- LD 50 для бордосской смеси у пчел составляет 23,3 мкг/пчелу Cu при приеме внутрь и более 25,2 мкг/пчела Cu при приеме внутрь. контакт. 14-дневный ЛЦ 50 для червей превышает 195,5 мг/кг Cu в почве. 1
Нормативные рекомендации:
Референтная доза (RfD): RfD представляет собой оценку количества
химическое вещество, которому человек может подвергаться каждый день для отдыха
их жизни без заметного риска неблагоприятных последствий для здоровья. референтная доза обычно измеряется в миллиграммах (мг) химического
на килограмм (кг) массы тела в сутки.
референтная доза обычно измеряется в миллиграммах (мг) химического
на килограмм (кг) массы тела в сутки.
Агентство по охране окружающей среды США, Интегрированная система информации о рисках, Глоссарий IRIS, 2009 г.. https://www.epa.gov/iris/iris-glossary#r
Дата пересмотра: декабрь 2012 г.
Пожалуйста, указывайте как: Boone, C.; Жерве, Дж.; Луукинен, Б.; Буль, К .; Stone, D. 2012. Технический бюллетень по сульфату меди ; Национальный пестицид Информационный центр Службы распространения знаний Университета штата Орегон. http://npic.orst.edu/factsheets/archive/cuso4tech.html.
Свойства и характеристики халькогенов
Нравится? Поделись!
Термин халькогены произошел от греческого слова «chalcos», что буквально означает «рудообразующие», поскольку эти элементы группы 16 в периодической таблице обычно встречаются в медных рудах. В этой статье ScienceStruck мы более подробно узнаем об их характеристиках и свойствах.
| Знаете ли вы? Люди знали о сере, общеизвестном халькогене, с древних времен.  Этот элемент упоминается в Библии 15 раз. Его добывали древние римляне и греки для создания зажигательного оружия, подобного греческому огню. Этот элемент упоминается в Библии 15 раз. Его добывали древние римляне и греки для создания зажигательного оружия, подобного греческому огню. |
Халькогены — это название элементов в периодической таблице — группа 16. Элементы этой группы иногда вместе называют «семейством кислорода». Эти элементы включают кислород (O), серу (S), селен (Se), полоний (Po) и теллур (Te). Искусственный элемент ливерморий также считается халькогеном. Соединения этих элементов известны как халькогениды. Из всех элементов этой группы только кислород является газом, а остальные — твердыми веществами, и только кислород и сера обычно встречаются в чистом виде.
Общие свойства группы халькогенов
- Все халькогены очень реагируют с щелочноземельными металлами.
- Все халькогены, обнаруженные в металлических рудах, находятся в форме ионов.
- Более легкие халькогены, такие как сера и кислород, нетоксичны и необходимы для всех видов жизни.
 С другой стороны, более тяжелые халькогены, такие как теллур, селен и полоний, токсичны и весьма вредны.
С другой стороны, более тяжелые халькогены, такие как теллур, селен и полоний, токсичны и весьма вредны. - Халькогены имеют различные размеры атомов. Однако каждый из этих элементов имеет по 6 валентных электронов. Плотность, температуры плавления и кипения, а также атомный радиус увеличиваются с увеличением атомного веса.
- Кислород, сера и селен являются неметаллами, а теллур и полоний являются полуметаллами и могут проводить электричество.
- Обычно степень окисления этих элементов в халькогениде равна -2. Однако в таких рудах, как пирит, степени окисления могут изменяться.
| Элементы | Атомный номер | Число электронов |
| Кислород | 8 | 2, 6 |
| Сера | 16 | 2, 8, 6 |
| Селен | 34 | 2, 8, 18, 6 |
| Теллур | 52 | 2, 8, 18, 18, 6 |
| Полоний | 84 | 2, 8, 18, 32, 18, 6 |
| Элементы | Плотность (г/см 3 ) |
| Кислород | 0,00143 |
| Сера | 2,07 |
| Селен | 4,3 |
| Теллур | 6,24 |
| Полоний | 9,2 |
| Элементы | Температура плавления в градусах Цельсия | Температура кипения в градусах Цельсия |
| Кислород | -219 | -183 |
| Сера | 120 | 445 |
| Селен | 221 | 685 |
| Теллур | 450 | 988 |
| Полоний | 254 | 962 |
Физические и химические свойства халькогенов
Кислород :
- Химическая конфигурация кислорода 1s 2 2с 2 2п 4 .

- Кислород, как известно, реагирует с другими атомами и приводит к образованию ржавчины в результате окисления.
- Наименьшим халькогеном является кислород, который имеет маленькие атомы с 2 и 6 электронами в своих оболочках.
- Он также наименее плотный – 0,00143 г/см 3 .
- Кислород достигает точки кипения при -297,31°F.
- Кислород остается в газообразном, бесцветном, без запаха и без вкуса состоянии при комнатной температуре.
- Он составляет 21% атмосферы, 46% земной коры и 65% тела среднего человека.
- Кислород бывает двух аллотропных форм — O 2 и O 3 .
- Из-за своего небольшого размера кислород редко является центральным атомом соединения, он не может связываться более чем с 4 элементами.
Полоний :
- Атомы полония являются самыми крупными из всех халькогенов и сравнительно велики, с 2, 8, 18, 32, 18 и 6 электронами в оболочках.
 Он имеет электронную конфигурацию 1s 2 2s 2 p 6 3S 2 P 6 D 10 4S 2 P 6 D 10 F 14 5S 2 P 6
Он имеет электронную конфигурацию 1s 2 2s 2 p 6 3S 2 P 6 D 10 4S 2 P 6 D 10 F 14 5S 2 P 68 2 8 2 8 2 8 2 8 2 8 2 8 2 8 2 8 2 8 2 8 2 8. - Полоний имеет самую высокую плотность 9,196 г/см 3 .
- Хотя температура кипения халькогена увеличивается с атомным весом, полоний является исключением из этой тенденции, поскольку его температура кипения ниже, чем у теллура при 1764°F, несмотря на то, что он имеет больший атомный вес.
- Полоний очень радиоактивен, и он растет с голубым сиянием.
- Он встречается только в очень редких следовых количествах в земной коре и образуется в результате радиоактивного распада урана и тория.
- Можно найти и создать 33 изотопа этого элемента, каждый из которых радиоактивен.

Теллур :
- Электронная конфигурация теллура 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 d 10 5s 2 p 4 .
- Его точка кипения является самой высокой среди халькогенов и составляет 1810°F.
- В природе встречающийся в виде металлоида серебра, в кристаллической форме теллур становится очень слабым и хрупким.
- Фотопроводящий элемент.
Селен :
- Электронная конфигурация селена 1s 2 2s 2 стр 6 3с 2 стр 6 д 10 4с 2 стр 4 .
- Селен может проводить электричество, несмотря на то, что он неметалл, с таким же зарядом, как теллур или полоний.
- В естественном состоянии встречается в виде красноватого порошка. Однако после обработки он становится черным.

- Морская вода содержит около 200 частей на триллион селена. Селен
- также обладает фотопроводимостью, что позволяет ему приобретать электрический заряд под воздействием света.
Сера :
- Электронная конфигурация серы 1s 2 2s 2 p 6 3s 2 p
- Сера представляет собой желтое твердое вещество с ужасным запахом — как тухлые яйца при сжигании.
- В следовых количествах содержится в земной коре и в организме человека.
- Этот элемент встречается в большом количестве, например S, S 2 , S 4 , S 6 и S 8 .
- Сера проявляет широкий диапазон степеней окисления, от -2 до +6, и широко встречается в ее обычных оксидах SO 2 и SO 3 .
В настоящее время проводится много исследований супрамолярной химии с халькогенами. Благодаря успеху этой работы мы сможем продвинуться намного дальше в области биологии и нанотехнологий.
Без категорий
Получайте обновления прямо в папку “Входящие”
Подпишитесь, чтобы получать последние и лучшие статьи с нашего сайта автоматически каждую неделю (плюс-минус)… прямо в папку “Входящие”.
Обновления блогаАдрес электронной почты *
открытых учебников | Siyavula
Загрузите наши открытые учебники в различных форматах, чтобы использовать их так, как вам удобно. Нажмите на обложку каждой книги, чтобы увидеть доступные для загрузки файлы на английском и африкаанс. Лучше, чем просто бесплатные, эти книги также имеют открытую лицензию! См. различные открытые лицензии для каждой загрузки и пояснения к лицензиям в нижней части страницы.
Математика
- Читать онлайн
Учебники
Английский
- 7A PDF (CC-BY-ND)
- 7B PDF (CC-BY-ND)
Африкаанс
- 7A PDF (CC-BY-ND)
- 7B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- 8A PDF (CC-BY-ND)
- 8B PDF (CC-BY-ND)
Африкаанс
- 8A PDF (CC-BY-ND)
- 8B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- 9A PDF (CC-BY-ND)
- 9B PDF (CC-BY-ND)
Африкаанс
- 9A PDF (CC-BY-ND)
- 9B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
Наука
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 7А
- PDF (CC-BY-ND)
Класс 7Б
- PDF (CC-BY-ND)
Африкаанс
Граад 7А
- PDF (CC-BY-ND)
Граад 7Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 8А
- PDF (CC-BY-ND)
Класс 8Б
- PDF (CC-BY-ND)
Африкаанс
Граад 8А
- PDF (CC-BY-ND)
Граад 8Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 9А
- PDF (CC-BY-ND)
Класс 9Б
- PDF (CC-BY-ND)
Африкаанс
Граад 9А
- PDF (CC-BY-ND)
Граад 9Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 4А
- PDF (CC-BY-ND)
Класс 4Б
- PDF (CC-BY-ND)
Африкаанс
Граад 4А
- PDF (CC-BY-ND)
Граад 4Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 5А
- PDF (CC-BY-ND)
Класс 5Б
- PDF (CC-BY-ND)
Африкаанс
Граад 5А
- PDF (CC-BY-ND)
Граад 5Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 6А
- PDF (CC-BY-ND)
Класс 6Б
- PDF (CC-BY-ND)
Африкаанс
Граад 6А
- PDF (CC-BY-ND)
Граад 6Б
- PDF (CC-BY-ND)
Лицензирование наших книг
Лучше, чем просто бесплатные, эти книги также имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите сайт Creative Commons Attribution-NoDerivs 3.0 Unported.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите сайт Creative Commons Attribution-NoDerivs 3.0 Unported.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без торговой марки)
Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, изменять или развивать их любым способом, при этом единственным требованием является предоставление соответствующей ссылки на Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
1.3 Физические и химические свойства – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Определение свойств и изменений в материи как физических или химических
- Определите свойства материи как экстенсивные или интенсивные
Характеристики, отличающие одно вещество от другого, называются свойствами. Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Некоторые физические свойства, такие как плотность и цвет, можно наблюдать, не изменяя физического состояния вещества. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок 1,18 (а) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Превращение одного типа материи в другой тип (или неспособность измениться) является химическим имущество. Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рисунок 1.19 а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Рисунок 1,20 а) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи относятся к одной из двух категорий. Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Химия в повседневной жизни
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 1.21, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рисунок 1,21 Алмаз опасности Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы с промежуточной проводимостью).





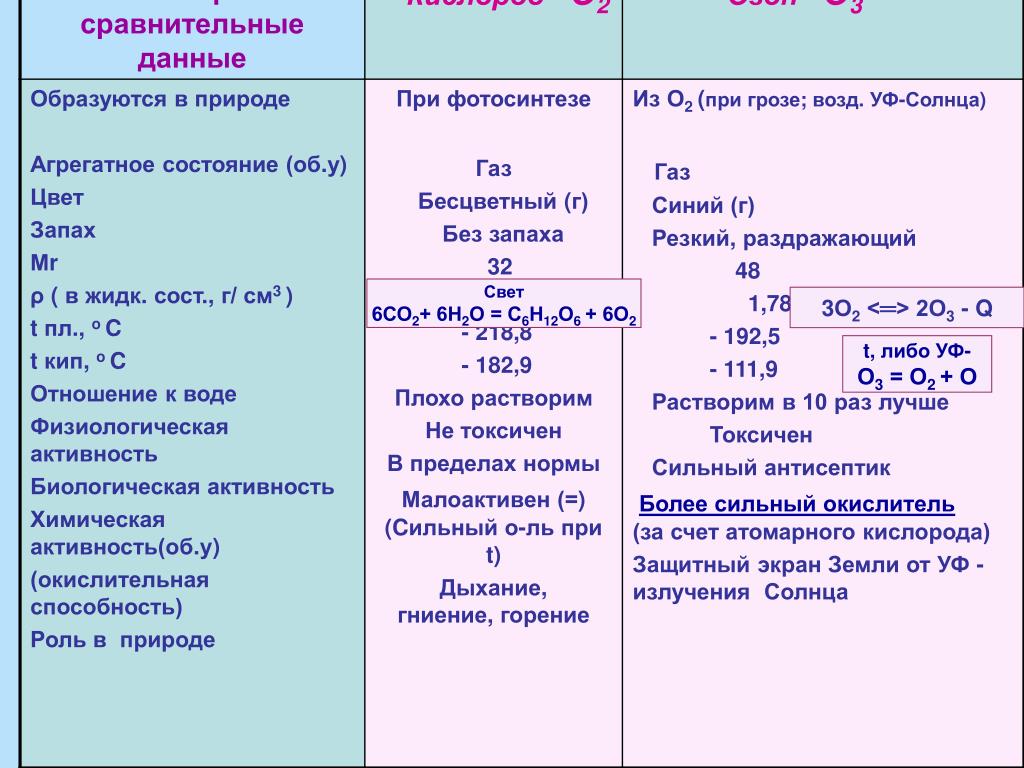 Его предельное содержание в сплаве составляет до 0,008% и стремительно сокращается в процессе воздействия высоких температур. Кислород негативно отражается на пластичности металла, а также на его устойчивости к коррозии.
Его предельное содержание в сплаве составляет до 0,008% и стремительно сокращается в процессе воздействия высоких температур. Кислород негативно отражается на пластичности металла, а также на его устойчивости к коррозии.
 В результате получается огарок и серосодержащие газы, которые в дальнейшем используют для получения серной кислоты.
В результате получается огарок и серосодержащие газы, которые в дальнейшем используют для получения серной кислоты. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
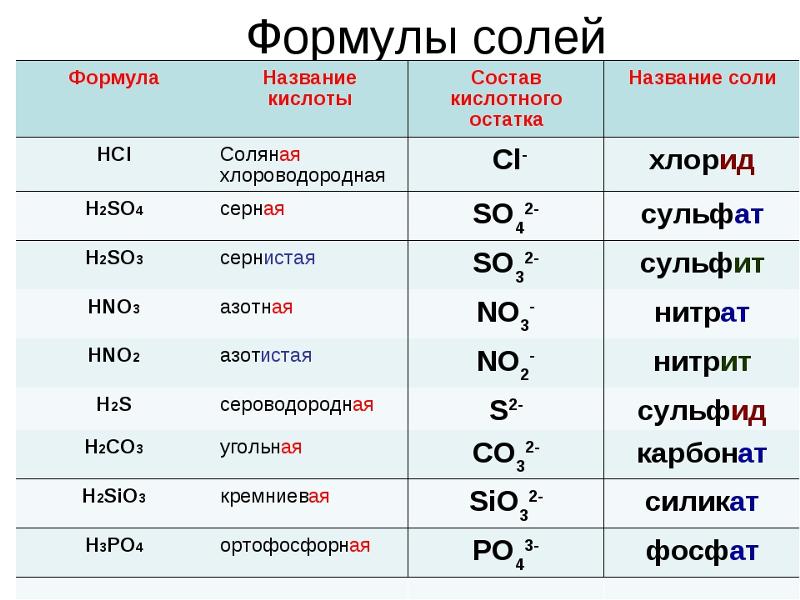 Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;



 Из этого материала делают спусковые крючки для стрелкового оружия.
Из этого материала делают спусковые крючки для стрелкового оружия. Количество олова не превышает 6%. Благодаря этому, металл обладает хорошей пластичностью и поддается обработке давлением.
Количество олова не превышает 6%. Благодаря этому, металл обладает хорошей пластичностью и поддается обработке давлением. В случае охлаждения материала ниже температуры 0 градусов сама медь сохраняет все свои физические свойства. Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно).
В случае охлаждения материала ниже температуры 0 градусов сама медь сохраняет все свои физические свойства. Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно). На физическом уровне происходит следующее — из-за избытка энергии атомы начинают двигаться в кристаллической решетке более интенсивно и хаотично, что приводит к частому столкновению атомов между собой. В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу).
На физическом уровне происходит следующее — из-за избытка энергии атомы начинают двигаться в кристаллической решетке более интенсивно и хаотично, что приводит к частому столкновению атомов между собой. В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу). На практике длительное удержание вещества в газообразной форме проблематично — при контакте с атмосферным воздухом вещество будет быстро остывать, обратно превращаясь в жидкость. Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
На практике длительное удержание вещества в газообразной форме проблематично — при контакте с атмосферным воздухом вещество будет быстро остывать, обратно превращаясь в жидкость. Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.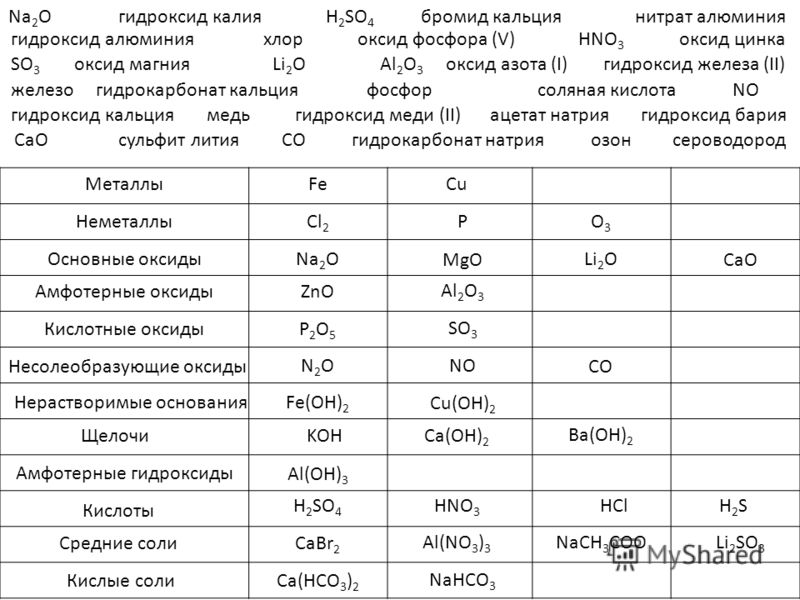 Б1
Б1
 0005
0005

 Когда он смешивается с
гидроксид кальция известен как бордоская смесь. 1 Международный союз
Название Pure and Applied Chemistry (IUPAC) для этого активного ингредиента — медь (2+).
сульфат или сульфат меди (II). Другие названия включают меди (2+) тетраоксидосульфат или
меди (II) тетраоксидосульфат. 2
Когда он смешивается с
гидроксид кальция известен как бордоская смесь. 1 Международный союз
Название Pure and Applied Chemistry (IUPAC) для этого активного ингредиента — медь (2+).
сульфат или сульфат меди (II). Другие названия включают меди (2+) тетраоксидосульфат или
меди (II) тетраоксидосульфат. 2  3 См. текстовое поле Лабораторные испытания .
3 См. текстовое поле Лабораторные испытания . Сигнальное слово отражает комбинированное
токсичность активного ингредиента и других ингредиентов в продукте. См. этикетку пестицида на изделии и см.
информационные бюллетени NPIC по сигнальным словам и инертным или «другим» ингредиентам.
Сигнальное слово отражает комбинированное
токсичность активного ингредиента и других ингредиентов в продукте. См. этикетку пестицида на изделии и см.
информационные бюллетени NPIC по сигнальным словам и инертным или «другим» ингредиентам. Ионы меди связываются с
функциональные группы белковых молекул грибов и водорослей и вызывают денатурацию белков, вызывая повреждение клеток и
утечка. Белковые компоненты, которые действуют как сайты связывания, представляют собой сульфидные группы, фосфаты (тиол), карбоксилы и имидазолы. 3
Ионы меди связываются с
функциональные группы белковых молекул грибов и водорослей и вызывают денатурацию белков, вызывая повреждение клеток и
утечка. Белковые компоненты, которые действуют как сайты связывания, представляют собой сульфидные группы, фосфаты (тиол), карбоксилы и имидазолы. 3  12 Тканевая коррозия,
шок и смерть могут наступить после воздействия больших доз сульфата меди. Повреждение клеток крови, печени и почек
также сообщалось. 13
12 Тканевая коррозия,
шок и смерть могут наступить после воздействия больших доз сульфата меди. Повреждение клеток крови, печени и почек
также сообщалось. 13  Следовательно, ароматизированные напитки загрязнены
с медью может привести к более высокому облучению. 15 См. текстовое поле NOEL .
Следовательно, ароматизированные напитки загрязнены
с медью может привести к более высокому облучению. 15 См. текстовое поле NOEL . 3
3  Диарея и рвота могут иметь цвет от зеленого до синего. 23
Диарея и рвота могут иметь цвет от зеленого до синего. 23  27
27  сульфат. 30
сульфат. 30  Концентрация была
постепенно увеличивается с 1% до 3%. У всех животных развились воспаление, отложения меди и дегенеративные изменения в
ткань легкого. В отличие от других исследований с более длительным временем воздействия, это исследование не выявило гранулем или фиброза.
в легочной ткани. 32
Концентрация была
постепенно увеличивается с 1% до 3%. У всех животных развились воспаление, отложения меди и дегенеративные изменения в
ткань легкого. В отличие от других исследований с более длительным временем воздействия, это исследование не выявило гранулем или фиброза.
в легочной ткани. 32  При приеме самой высокой дозы наблюдались желудочно-кишечные кровотечения, цирроз печени и желтуха. 35
При приеме самой высокой дозы наблюдались желудочно-кишечные кровотечения, цирроз печени и желтуха. 35 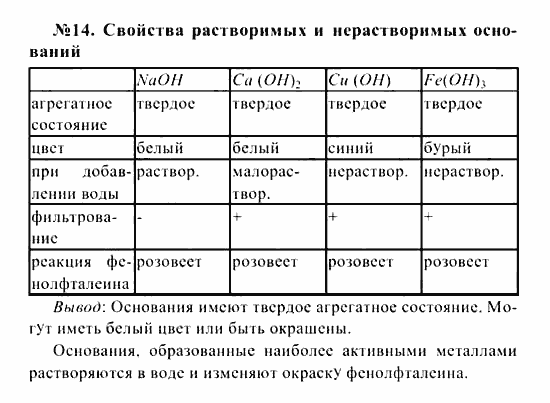 влияет на скорость кормления и прибавку в весе. 38,39,40,41
влияет на скорость кормления и прибавку в весе. 38,39,40,41 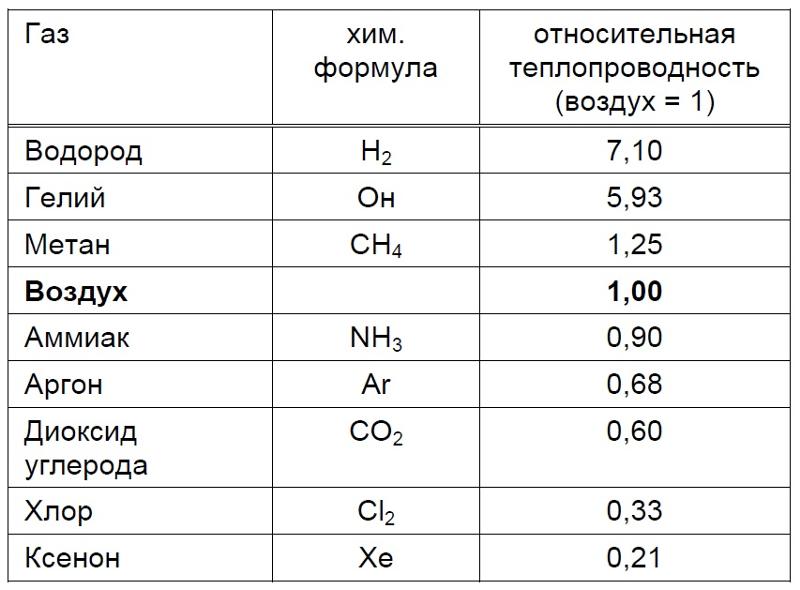 44,45 См. текстовое поле NOAEL, NOEL,
НУНВ и НУНВ .
44,45 См. текстовое поле NOAEL, NOEL,
НУНВ и НУНВ . 3 См. текстовое поле Рак .
3 См. текстовое поле Рак . 5% ДИ: 1,3-5,5) для повышенного риска рака почки. 53 Уровни воздействия не сообщались.
5% ДИ: 1,3-5,5) для повышенного риска рака почки. 53 Уровни воздействия не сообщались. 55
55  57
57  5
5  Затем медь осаждается в
печень. 5
Затем медь осаждается в
печень. 5  и мужчины могут устранить его в сперме. Небольшие количества также могут выводиться из волос и ногтей. 5
и мужчины могут устранить его в сперме. Небольшие количества также могут выводиться из волос и ногтей. 5  На них могут влиять возраст, пол, беременность, уровень гормонов и состояние здоровья. 65 Медный шаперон (CCS),
который реагирует на дефицит и избыток меди, недавно был идентифицирован как потенциальный биомаркер, но его значение
неизвестно. 66 Аминотрансферазы печени традиционно используются в качестве индикатора высокого содержания меди. 65
На них могут влиять возраст, пол, беременность, уровень гормонов и состояние здоровья. 65 Медный шаперон (CCS),
который реагирует на дефицит и избыток меди, недавно был идентифицирован как потенциальный биомаркер, но его значение
неизвестно. 66 Аминотрансферазы печени традиционно используются в качестве индикатора высокого содержания меди. 65  Выборка
Сообщалось об ограничениях методологии определения пота. 71
Выборка
Сообщалось об ограничениях методологии определения пота. 71  материалов и автомобилей. 3
материалов и автомобилей. 3  Любой рН снаружи
этого диапазона коррелировало с более высокой мобильностью. Исследователи сообщили, что присутствие ионов кальция уменьшилось.
выщелачивание меди, повышение ее связывающей способности. Присутствие ионов натрия имело противоположный эффект и вызывало более
медь для выщелачивания. 76
Любой рН снаружи
этого диапазона коррелировало с более высокой мобильностью. Исследователи сообщили, что присутствие ионов кальция уменьшилось.
выщелачивание меди, повышение ее связывающей способности. Присутствие ионов натрия имело противоположный эффект и вызывало более
медь для выщелачивания. 76  Около
вся медь осталась в верхних 16 см осадка. 79
Около
вся медь осталась в верхних 16 см осадка. 79 
 форма. 84
форма. 84  Остатки можно ожидать
от его использования в качестве фунгицида в сельском хозяйстве и в качестве бактерицида/фунгицида в животноводческих помещениях. 87
Остатки можно ожидать
от его использования в качестве фунгицида в сельском хозяйстве и в качестве бактерицида/фунгицида в животноводческих помещениях. 87  40
40  С другой стороны, более тяжелые халькогены, такие как теллур, селен и полоний, токсичны и весьма вредны.
С другой стороны, более тяжелые халькогены, такие как теллур, селен и полоний, токсичны и весьма вредны.
 Он имеет электронную конфигурацию 1s 2 2s 2 p 6 3S 2 P 6 D 10 4S 2 P 6 D 10 F 14 5S 2 P 6
Он имеет электронную конфигурацию 1s 2 2s 2 p 6 3S 2 P 6 D 10 4S 2 P 6 D 10 F 14 5S 2 P 6
