Физические свойства металлической кристаллической решетки: Ошибка 403 — доступ запрещён
alexxlab | 08.03.2023 | 0 | Разное
11 класс. Химия. Типы химических связей.Типы кристаллических решеток – Типы химических связей. Типы кристаллических решеток
Комментарии преподавателяЗависимость агрегатного состояния от дальнего и ближнего порядка расположения
В зависимости от давления и температуры, все вещества могут существовать в различных агрегатных состояниях: твердом, жидком, газообразном или в виде плазмы. При низких температурах и высоком давлении все вещества существуют в твёрдом агрегатном состоянии. Твердое и жидкое состояние вещества называют конденсированным.
В твердых телах частицы располагаются компактно, в определенном порядке. В зависимости от степени упорядоченности частиц в твердых телах определяют 2 фазовых состояния: кристаллическое и аморфное. Если частицы располагаются таким образом, что между соседними частицами есть некоторая упорядоченность в расположении, а именно: постоянное расстояние и углы между ними, такое явление называют наличие ближнего порядка в расположении. Рис. а.
Рис. а.
a b
Рис. 1. Наличие ближнего и дальнего порядка в расположении частиц
Если же частицы расположены таким образом, что упорядоченность наблюдается и между ближайшими соседями, и на гораздо больших расстояниях, это называют наличие дальнего порядка. Рис. б.
Аморфное тело (от греч А – не, morfe – форма) – бесформенные вещества. В них существует только ближний порядок и нет дальнего порядка.
Примеры аморфных тел приведены на рис. 2.
Рис. 2. Аморфные тела
Это воск, стекло, пластилин, смола, шоколад.
Свойства аморфных веществ
- Имеют только ближний порядок (как в жидкостях).
- Твердое агрегатное состояние при нормальных условиях.
- Нет четкой температуры плавления. Плавятся в интервале температур.
В кристаллическом теле существует и ближний, и дальний порядок.
Рис. 3. Кристаллическая решетка
Физические свойства веществ с различными типами кристаллических решеток
|
Тип кристаллической решетки |
Физические свойства веществ |
Тип химической связи в веществах |
Примеры веществ |
|
ионная |
Относительно прочная решетка, достаточно высокие значения Т пл. |
ионная |
Соли, щелочи, оксиды щелочных и щелочноземельных металлов |
|
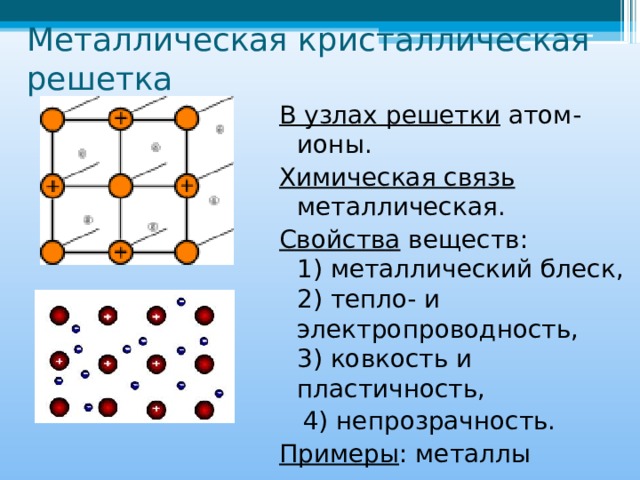
металлическая |
Относительно прочная решетка, достаточно высокие значения Т пл. Ковкие, пластичные, электро-и теплопроводны. |
металлическая |
Металлы и сплавы |
| атомная |
Прочная решетка .Самые высокие значения Т пл., очень твердые, нелетучие, нерастворимые в воде. |
Ковалентная |
Простые вещества неметаллы (графит, алмаз),SiO2,Al2O3 |
|
молекулярная |
Вещества характеризуются низкими Тпл. |
Ковалентная полярная и ковалентная неполярная |
Большинство органических веществ (глюкоза, метан, бензол), сера, йод, твердый углекислый газ |
Табл.1. Физические свойства веществ
Существует несколько подтипов кристаллических решеток, различающихся расположением атомов в пространстве.
В веществах с атомной, ионной, металлической кристаллической решетками нет молекул – это
Полиморфизм – это явление, при котором сложные вещества одинакового состава имеют разные кристаллические решетки.
Например, пирит и марказит. Их формула – FeS2.Но они и выглядят по-разному, и обладают различными физическими свойствами. Аналогично, различными физическими свойствами обладают минералы состава CaCO3: арагонит, мрамор, исландский шпат, мел.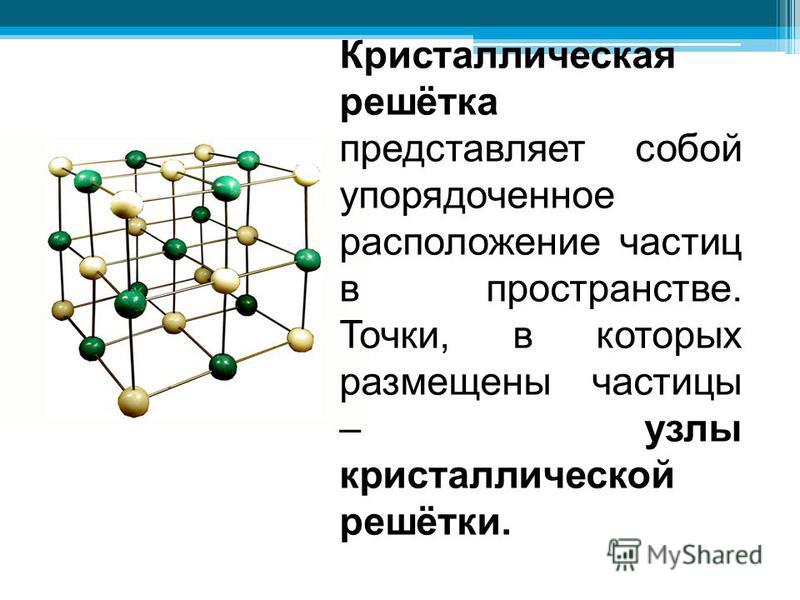
Явление существования химических элементов в виде нескольких простых веществ называется аллотропией, а вещества – аллотропными модификациями. Это объясняется различным составом вещества или различием в их кристаллической решетке. Кислород и озон – аллотропные модификации химического элемента кислорода. Углерод образует графит, алмаз, фуллерен, карбин. Расположение атомов в их кристаллических решетках разное, и поэтому они проявляют разные свойства. У фосфора аллотропные вещества – красный, белый и черный фосфор. Аллотропия характерна и для металлов. Например, железо может существовать в виде α, β, δ, γ.
Текучесть аморфных веществ
Одним из свойств, по которым отличаются аморфные тела от жидких, является их текучесть. Если положить кусочек смолы на нагретую поверхность, то он постепенно растечется по этой поверхности.
Вязкость – это способность сопротивляться перемещению одних частей тела относительно других для жидкостей и газов: чем она выше, тем сложнее изменить форму тела.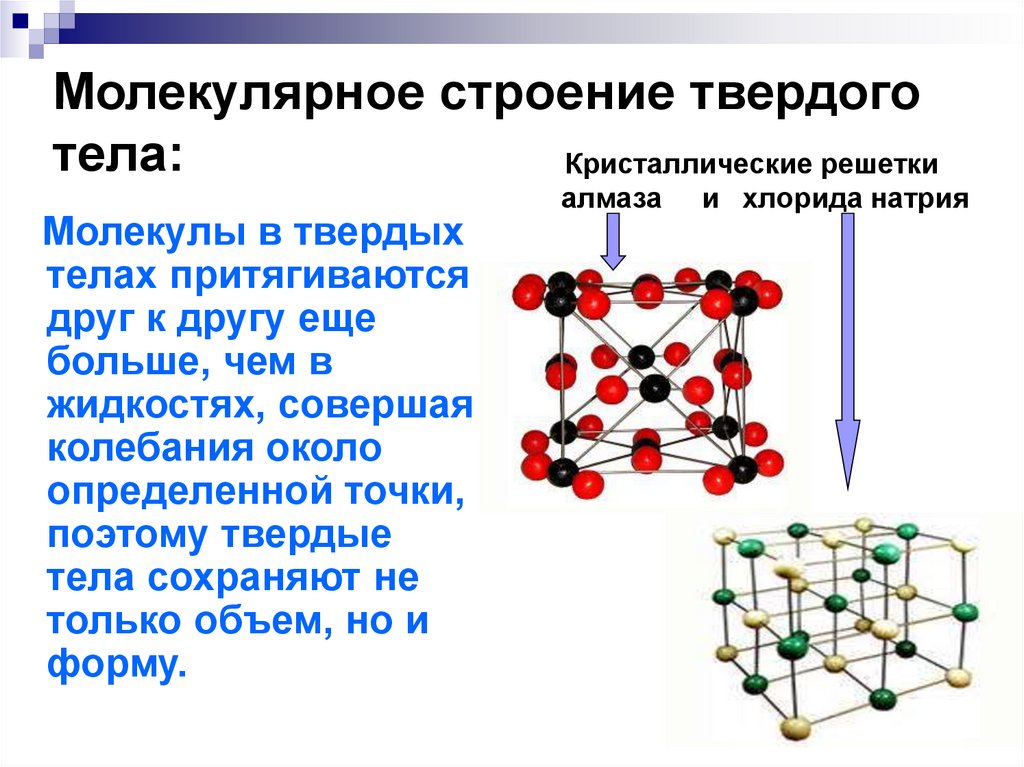 Оконные стекла – это типичные аморфные вещества. Теоретически они должны постепенно стекать вниз. Но вязкость стекла высокая, и его деформацией можно пренебречь. Вязкость стекла примерно в 1000 раз выше вязкости смолы. За год деформация стекла составляет 0,001%. За 1000 лет деформация стекла составляет 1%.
Оконные стекла – это типичные аморфные вещества. Теоретически они должны постепенно стекать вниз. Но вязкость стекла высокая, и его деформацией можно пренебречь. Вязкость стекла примерно в 1000 раз выше вязкости смолы. За год деформация стекла составляет 0,001%. За 1000 лет деформация стекла составляет 1%.
Источники
http://www.youtube.com/watch?t=2&v=p327xXxMKFU
заставка http://www.youtube.com/watch?t=7&v=D2XB8qpTn8k
http://interneturok.ru/ru/school/chemistry/11-klass
источник презентации – http://www.myshared.ru/slide/980548/#
Какая особенность строения металлов определяют их общие физические свойства?
Статьи › Чем отличается › Чем физические свойства неметаллов отличаются от физических свойств металлов охарактеризуйте?
Общие свойства металлов обусловлены металлической связью и строением их кристаллических решёток.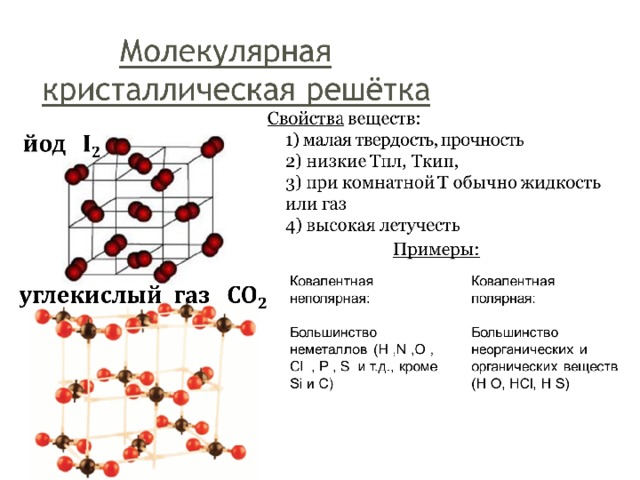
- Какие особенности строения металлов?
- Какие особенности строения атомов металлов определяет их восстановительные свойства?
- Что определяет физические свойства металлов?
- Каковы общие физические свойства металлов?
- Какие общие свойства характерны для металлов?
- Какое свойство характерно именно для металлов?
- Что такое строение металлов?
- Какие общие физические свойства присущи простым веществам?
- Каковы общие физические свойства неметаллов?
- Чем определяется химические свойства металлов?
- Что такое пластичность металла?
- Что такое механические свойства металлов?
- Чем обусловлены различия в физических свойствах металлов?
- Что относится к физическим свойствам металлов и сплавов?
- Каковы общие физические свойства металлов объясните эти свойства основываясь на представлениях о металлической?
- Какие особенности строения атомов металлов вы можете назвать?
- Каковы общие особенности строения атомов D элементов?
- Какие особенности строения металлов объясняют почему металлы являются проводниками?
- Какие из представленных свойств материалов относятся к физическим свойствам?
- Что такое металлический блеск?
- Что относится к щелочным металлам?
- Что относится к металлам?
- Чем объясняется пластичность металлов?
- Какое строение характерно для металлов и сплавов?
- Какие общие физические свойства металлов обусловлены наличием металлической связи?
- В чем особенность строения атомов металлов и неметаллов?
- Что определяют химические свойства металлов?
- Что определяют механические свойства металлов?
- Что является сплавом?
Какие особенности строения металлов?
Атомы металлов характеризуются небольшим числом электронов на внешнем энергетическом уровне (один-три электрона) и большим радиусом атома. Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева.
Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева.
Какие особенности строения атомов металлов определяет их восстановительные свойства?
Ответы1. Для металлов характернны восстановительные свойства за счет их структуры, то есть у них на внешнем энергетическом уровне мало электронов (1-3), которые значительно удалены от ядра и слабо связаны с ним, они могут свободно отдавать электроны окислителям.
Что определяет физические свойства металлов?
Физические свойства металлов определяются их строением — наличием свободных электронов, или электронного газа, которое и определяет высокие электро- и теплопроводность.
Каковы общие физические свойства металлов?
К общим физическим свойствам металлов относят их высокую электропроводность, теплопроводность, пластичность, ковкость, металлический блеск.
Какие общие свойства характерны для металлов?
Металлы Металлы, простые вещества, обладающие в обычных условиях характерными свойствами: высокой электропроводностью и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны (блеск и непрозрачность), пластичностью.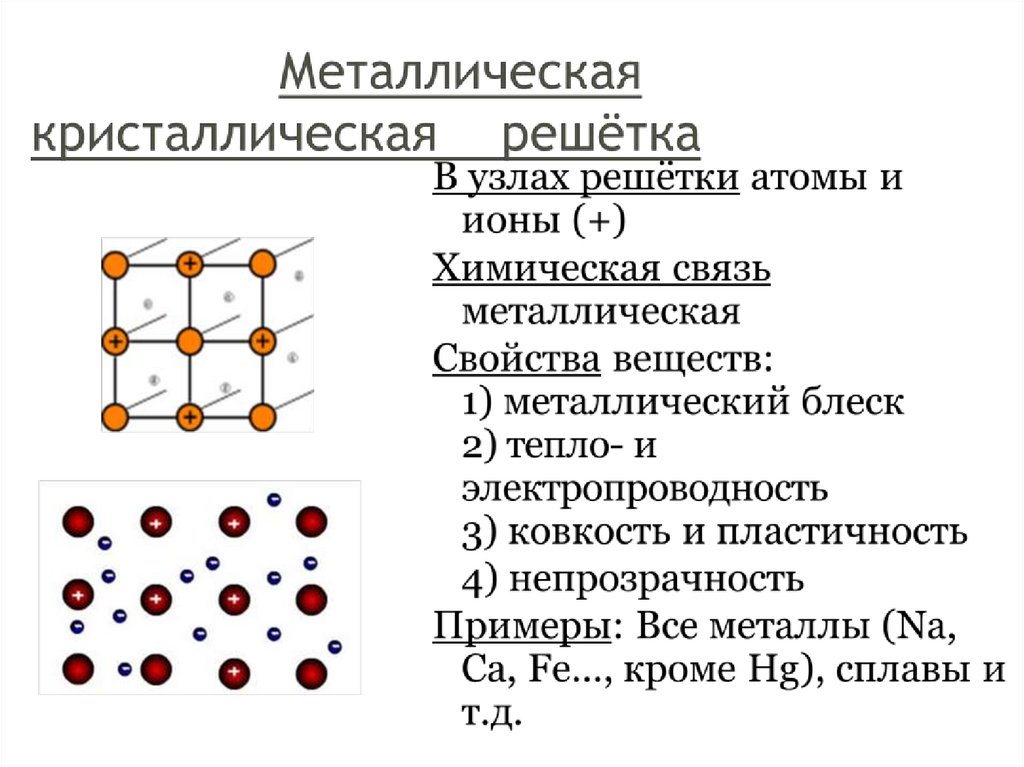
Какое свойство характерно именно для металлов?
Металлы в отличие от неметаллов обладают определенными сходными свойствами: металлический блеск, высокая ковкость, хорошая электропроводность и теплопроводность. Эти свойства определяются металлической связью.
Что такое строение металлов?
Металлы имеют кристаллическое строение. Оно характеризуется закономерным расположением атомов в пространстве и образованием кристаллической решетки. Типы кристаллических решеток. Кристаллическое строение металлов условно можно представить как упорядоченное расположение атомов в пространстве.
Какие общие физические свойства присущи простым веществам?
Общие физические и химические свойства металлов:
- Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
- Металлический блеск и непрозрачность.
- Электропроводность.
- Теплопроводность.
- Твердость.
- Плотность.

- Температуры плавления и кипения.
Каковы общие физические свойства неметаллов?
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность. Большинство неметаллов имеет молекулярное строение.
Чем определяется химические свойства металлов?
Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Что такое пластичность металла?
Другими словами пластичность металлов — это способность металлов перед разрушением претерпевать значительную пластическую деформацию. Пластическая деформация — остаточная деформация без макроскопических нарушений сплошности материала, образовавшаяся в результате воздействия силовых факторов.
Что такое механические свойства металлов?
Механические свойства характеризуют способность материалов сопротивляться действию внешних сил. К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др.
К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др.
Чем обусловлены различия в физических свойствах металлов?
6. Несмотря на одинаковый вид связи, различные металлы обладают характерными для каждого из них свойствами: температурой плавления, плотностью, твердостью. Эти свойства обусловлены строением атомов, зарядностью, размерами ион-атомов в кристаллической решетке, а также плотностью их упаковки.
Что относится к физическим свойствам металлов и сплавов?
Физические свойства металлов и сплавов: блеск, плотность, температура плавления, теплопроводность, теплоемкость, электропроводность, магнитные свойства, расширяемость при нагревании и фазовых превращениях.
Каковы общие физические свойства металлов объясните эти свойства основываясь на представлениях о металлической?
Металлы твердые, пластичные, блестящие электропроводные вещества. Их физические свойства объясняются характером металлической связи.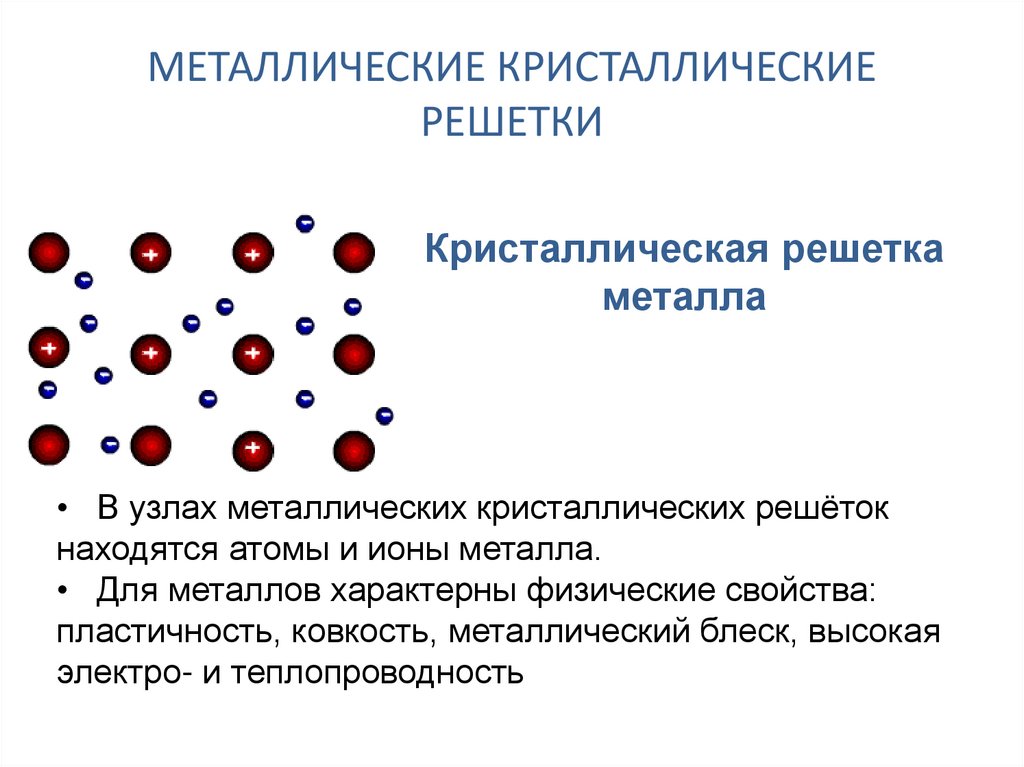 Узлы решетки могут перемещаться относительно «электронного газа» — это объясняет пластичность. Электроны между узлами очень подвижны — поэтому металлы проводят электричество.
Узлы решетки могут перемещаться относительно «электронного газа» — это объясняет пластичность. Электроны между узлами очень подвижны — поэтому металлы проводят электричество.
Какие особенности строения атомов металлов вы можете назвать?
Металлы имеют на внешнем энергетическом уровне 1-3 электрона, а также характеризуются относительно большими атомными радиусами. Это ослабляет связь внешних электронов с ядром и делает металлы сильными восстановителями.
Каковы общие особенности строения атомов D элементов?
Особенность строения атомов d-элементов обусловлена наличием в них избытка валентных орбиталей и недостатком электронов. d-Элементы-металлы, а все металлы имею небольшое количество электронов на внешнем энергетическом уровне, легко их теряют, проявляя восстановительные свойства.
Какие особенности строения металлов объясняют почему металлы являются проводниками?
Все металлы хорошо проводят электрический ток, что обусловлено наличием в кристаллической решётке электронов, которые способны свободно перемещаться.
Какие из представленных свойств материалов относятся к физическим свойствам?
Физи́ческие сво́йства вещества — свойства, присущие веществу вне химического взаимодействия: температура плавления, температура кипения, вязкость, плотность, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, сорбция, цвет, концентрация, эмиссия, текучесть, твёрдость, пластичность.
Что такое металлический блеск?
Металлический блеск — наблюдается у самородных металлов, но некоторые минералы с относительно невысокой электропроводностью, например пирит, халькопирит, галенит также имеют металлический блеск, похожий на блеск металла, что обусловлено наличием в кристаллической решётке этих веществ относительно свободных электронов.
Что относится к щелочным металлам?
Щелочны́е мета́ллы — элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Что относится к металлам?
К металлы относятся как собственно металлы (простые вещества), так и их сплавы, металлические соединения, в том числе интерметаллиды. Иногда металлами называют все вещества, обладающие теми или иными металлическими свойствами, например так называемые «синтетические» металлы, металлы органические.
Чем объясняется пластичность металлов?
В металлах
Пластичность кристалла чистого металла в первую очередь обусловлена двумя режимами деформации кристаллической решетки: скольжением и двойникованием. Скольжение — это деформация сдвига, которая перемещает атомы относительно их начального положения на расстояния существенно большие чем межатомные расстояния.
Какое строение характерно для металлов и сплавов?
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.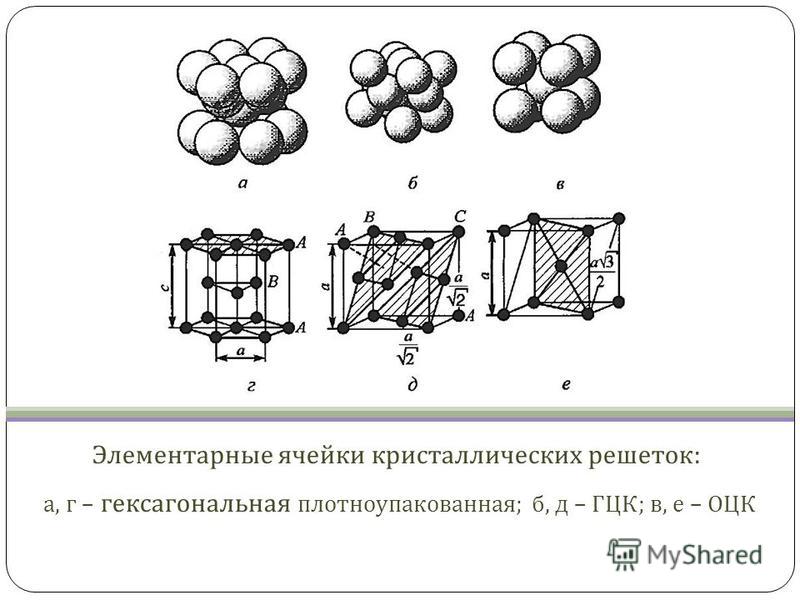
Какие общие физические свойства металлов обусловлены наличием металлической связи?
Металлическая связь описывается многими физическими свойствами металлов, такими как прочность, пластичность, теплопроводность, удельное электрическое сопротивление и проводимость, непрозрачность и блеск.
В чем особенность строения атомов металлов и неметаллов?
Таким образом, атомы неметаллов содержат большее, чем атомы металлов, число электронов на внешнем уровне, имеют более высокие заряды ядер и Page 2 значительно меньшие радиусы, вследствие этого более высокие значения электроотрицательности и большую способность к присоединению электронов (окислительную способность).
Что определяют химические свойства металлов?
Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов.
Что определяют механические свойства металлов?
Механические свойства характеризуют способность материалов сопротивляться действию внешних сил. К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др. Прочность — это способность материала сопротивляться разрушающему воздействию внешних сил.
К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др. Прочность — это способность материала сопротивляться разрушающему воздействию внешних сил.
Что является сплавом?
Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
Металлические кристаллы | Введение в химию |
Цель обучения
- Описать металлические кристаллы.
Ключевые моменты
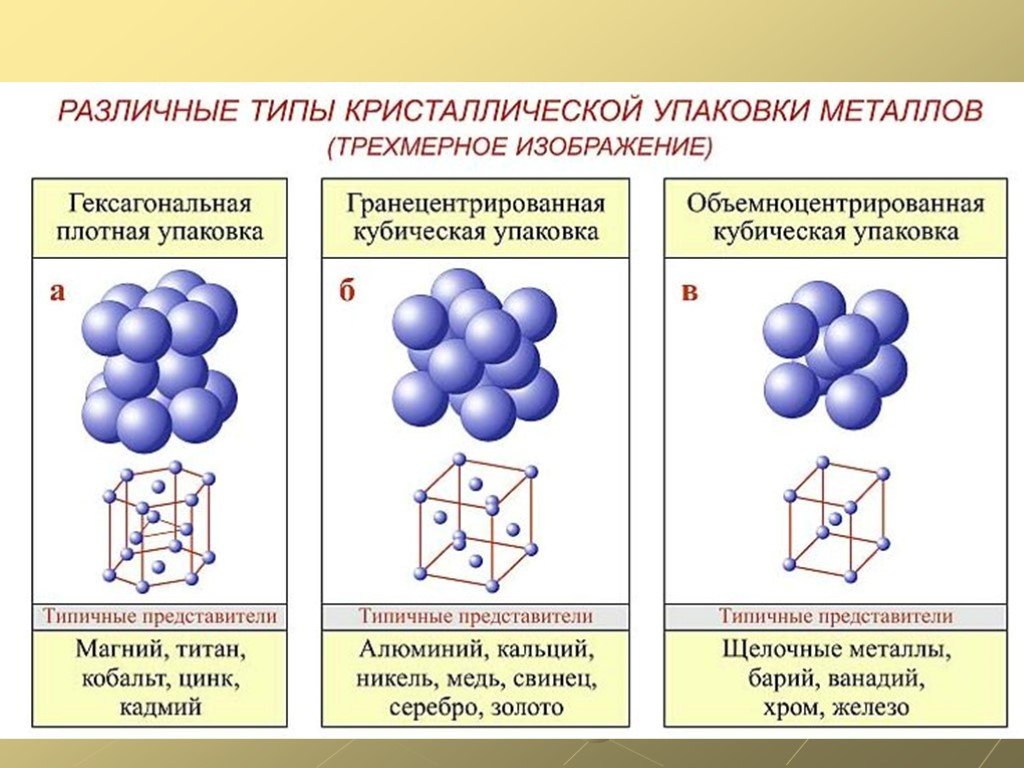
- Атомы в металлах теряют электроны с образованием катионов. Делокализованные электроны окружают ионы. Металлические связи (электростатические взаимодействия между ионами и электронным облаком) удерживают металлическое твердое тело вместе. Атомы расположены как плотно упакованные сферы.
- Поскольку внешние электроны атомов металлов делокализованы и очень подвижны, металлы обладают электро- и теплопроводностью.
- Металлы пластичны или способны к пластической деформации. Закон Гука описывает обратимую упругую деформацию металлов, при которой напряжение линейно пропорционально деформации. Силы, превышающие предел упругости, или тепло, могут вызвать необратимую деформацию объекта.
- В целом металлы более плотные, чем неметаллы. Это связано с плотно упакованной кристаллической решеткой металлической структуры. Чем больше количество делокализованных электронов, тем прочнее металлические связи.
Термины
- металл Любой химический элемент из периодической таблицы, который образует металлическую связь с атомами других металлов. Обычно он блестящий, податливый и является проводником тепла и электричества.
- металлическая связь Химическая связь, при которой подвижные электроны распределяются между многими ядрами; это приводит к электропроводности.
Металлические свойства
В металле атомы легко теряют электроны, образуя положительные ионы (катионы). Эти ионы окружены делокализованными электронами, ответственными за проводимость. Полученное твердое тело удерживается вместе электростатическими взаимодействиями между ионами и электронным облаком. Эти взаимодействия называются металлическими связями. Металлическая связь определяет многие физические свойства металлов, такие как прочность, ковкость, пластичность, тепло- и электропроводность, непрозрачность и блеск.
Металлическая связь Слабо связанные и подвижные электроны окружают положительные ядра атомов металлов.
Металлическую связь, понимаемую как разделение «свободных» электронов в решетке положительно заряженных ионов (катионов), иногда сравнивают со связью расплавленных солей; однако эта упрощенная точка зрения справедлива для очень немногих металлов. С квантово-механической точки зрения проводящие электроны равномерно распределяют свою плотность по всем атомам, функционирующим как нейтральные (незаряженные) объекты.
Атомы в металлах расположены подобно плотно упакованным сферам, и особенно распространены две модели упаковки: объемно-центрированная кубическая, в которой каждый металл окружен восемью эквивалентными металлами, и гранецентрированная кубическая, в которой металлы окружены шестью соседние атомы. Некоторые металлы принимают обе структуры в зависимости от температуры.
Металлы в целом обладают высокой электропроводностью, высокой теплопроводностью и высокой плотностью. Обычно они деформируемы (податливы) под нагрузкой, не скалываясь. Некоторые металлы (щелочные и щелочноземельные металлы) имеют низкую плотность, низкую твердость и низкую температуру плавления. По оптическим свойствам металлы бывают непрозрачными, блестящими и блестящими.
Температура плавления и прочность
Прочность металла обусловлена электростатическим притяжением между решеткой положительных ионов и «морем» валентных электронов, в котором они погружены. Чем больше ядерный заряд (атомный номер) атомного ядра и чем меньше размер атома, тем больше это притяжение. В целом переходные металлы с d-электронами на валентном уровне сильнее и имеют более высокие температуры плавления:
Чем больше ядерный заряд (атомный номер) атомного ядра и чем меньше размер атома, тем больше это притяжение. В целом переходные металлы с d-электронами на валентном уровне сильнее и имеют более высокие температуры плавления:
- Fe, 1539°C
- Re, 3180 °С
- Ос, 2727 °С
- Вт, 3380°С.
Большинство металлов имеют более высокую плотность, чем большинство неметаллов. Тем не менее, плотность металлов сильно различается. Литий (Li) — наименее плотный твердый элемент, а осмий (Os) — самый плотный. Металлы групп IA и IIA называются легкими металлами, потому что они являются исключениями из этого обобщения. Высокая плотность большинства металлов обусловлена плотно упакованной кристаллической решеткой металлической структуры.
Электропроводность: почему металлы являются хорошими проводниками?
Чтобы вещество могло проводить электричество, оно должно содержать заряженные частицы (носители заряда), которые достаточно подвижны, чтобы двигаться в ответ на приложенное электрическое поле. В случае ионных соединений в водных растворах эту функцию выполняют сами ионы. То же самое относится и к ионным соединениям при плавлении. Ионные твердые тела содержат те же носители заряда, но поскольку они зафиксированы на месте, эти твердые тела являются изоляторами.
В случае ионных соединений в водных растворах эту функцию выполняют сами ионы. То же самое относится и к ионным соединениям при плавлении. Ионные твердые тела содержат те же носители заряда, но поскольку они зафиксированы на месте, эти твердые тела являются изоляторами.
В металлах носителями заряда являются электроны, и поскольку они свободно перемещаются в решетке, металлы обладают высокой проводимостью. Очень малая масса и инерция электронов позволяет им проводить высокочастотные переменные токи, чего не могут сделать электролитические растворы.
Электропроводность, а также вклад электронов в теплоемкость и теплопроводность металлов можно рассчитать по модели свободных электронов , которая делает , а не , учитывают подробную структуру ионной решетки.
Механические свойства
К механическим свойствам металлов относятся ковкость и пластичность, то есть способность к пластической деформации. Обратимую упругую деформацию в металлах можно описать законом Гука для восстанавливающих сил, в котором напряжение линейно пропорционально деформации. Приложенное тепло или силы, превышающие предел упругости, могут вызвать необратимую деформацию объекта, известную как пластическая деформация или пластичность.
Приложенное тепло или силы, превышающие предел упругости, могут вызвать необратимую деформацию объекта, известную как пластическая деформация или пластичность.
Металлические твердые тела известны и ценятся за эти качества, которые проистекают из ненаправленной природы притяжения между атомными ядрами и морем электронов. Связь внутри ионных или ковалентных твердых тел может быть более прочной, но она также является направленной, что делает эти твердые тела хрупкими и подверженными разрушению, например, при ударе молотком. Металл, напротив, с большей вероятностью будет просто деформирован или помят.
Хотя металлы имеют черный цвет из-за их способности одинаково поглощать все длины волн, золото (Au) имеет характерный цвет. Согласно специальной теории относительности, увеличение массы электронов внутренних оболочек, имеющих очень большой импульс, заставляет орбитали сокращаться. Поскольку внешние электроны менее подвержены влиянию, увеличивается поглощение синего света, что приводит к усиленному отражению желтого и красного света.
Золото Золото — благородный металл; он устойчив к коррозии и окислению.
Show Sources
Безграничная проверка и отбор высококачественного контента с открытой лицензией со всего Интернета. Данный конкретный ресурс использовал следующие источники:
«Безграничный».
http://www.boundless.com/ Безграничное обучение
CC BY-SA 3.0.
“металлическая связка”.
http://en.wiktionary.org/wiki/metallic_bond
Викисловарь
CC BY-SA 3.0.
«Соединение в металлах и полупроводниках».
http://www.chem1.com/acad/webtext/chembond/cb10.html Стив Лоуэр
CC BY-SA.
“металл”.
http://en.wiktionary.org/wiki/metal
Викисловарь
CC BY-SA 3.0.
«Металлические кристаллы»..jpg)
http://en.wikipedia.org/wiki/Metallic_crystals
Wikipedia
CC BY-SA 3.0.
«Металлическая связка».
http://en.wikipedia.org/wiki/Metallic_bond%23Solubility_and_compound_formation
Wikipedia
CC BY-SA 3.0.
«Металлическое соединение».
http://commons.wikimedia.org/wiki/File:Metallic_bonding.svg
Wikimedia Commons
CC BY-SA 3.0.
«Золотой самородок УСГОВ».
http://en.wikipedia.org/wiki/File:GoldNuggetUSGOV.jpg
Википедия
Общественное достояние.
Лицензии и атрибуты
Лицензионный контент CC, ранее опубликованный
- Boundless Chemistry. Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike
Кристаллическая структура — красивая химия
От макроскопической геометрии к атомному строению
Раннее изучение кристаллографии было в основном сосредоточено на внешней форме и симметрии макроскопических кристаллов.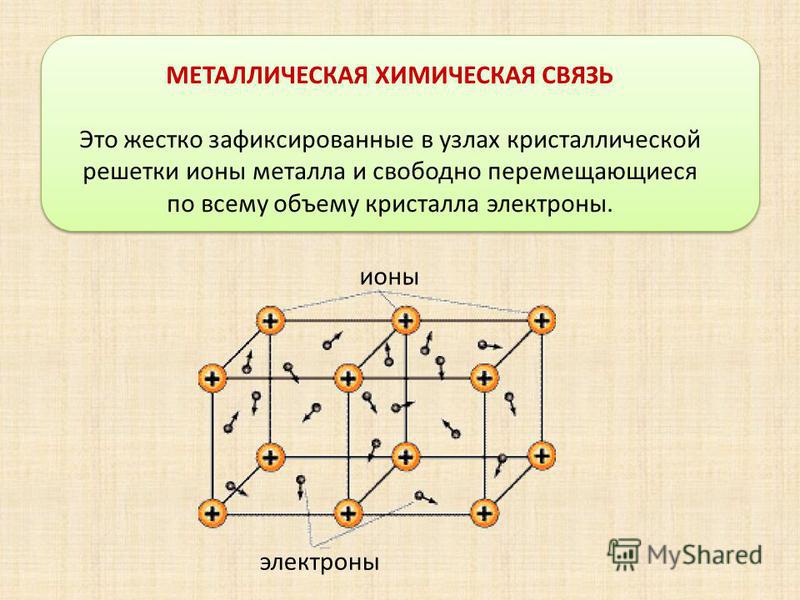 Тщательно измеряя углы между различными поверхностями кристаллов, можно определить симметрию, которая в то время была важной основой для классификации кристаллов.
Тщательно измеряя углы между различными поверхностями кристаллов, можно определить симметрию, которая в то время была важной основой для классификации кристаллов.
В конце 18 века Рене Жюст Гаюи впервые математически связал макроскопическую форму кристалла с его микроскопической периодичностью. В 1781 году Гаюи случайно разбил кусок кристалла карбоната кальция. Удивительно, но он обнаружил неожиданные крошечные ромбоэдры из осколков разбитого кристалла. Из этого несчастного случая и продолжения систематических исследований огранки кристаллов Гаюи пришел к выводу, что «кристалл» представляет собой упорядоченное расположение микросоставляющих молекул, и разработал математическую теорию, чтобы связать их. «Составные молекулы» Гаюи имеют другое понятие, чем современные молекулы. Составляющие молекулы на самом деле представляют собой микрогеометрические формы, такие как параллелепипеды. Различные кристаллы состоят из различных составляющих молекул.
Эксперимент Лауэ по дифракции рентгеновских лучей в 1902 году стал большим прорывом в кристаллографии.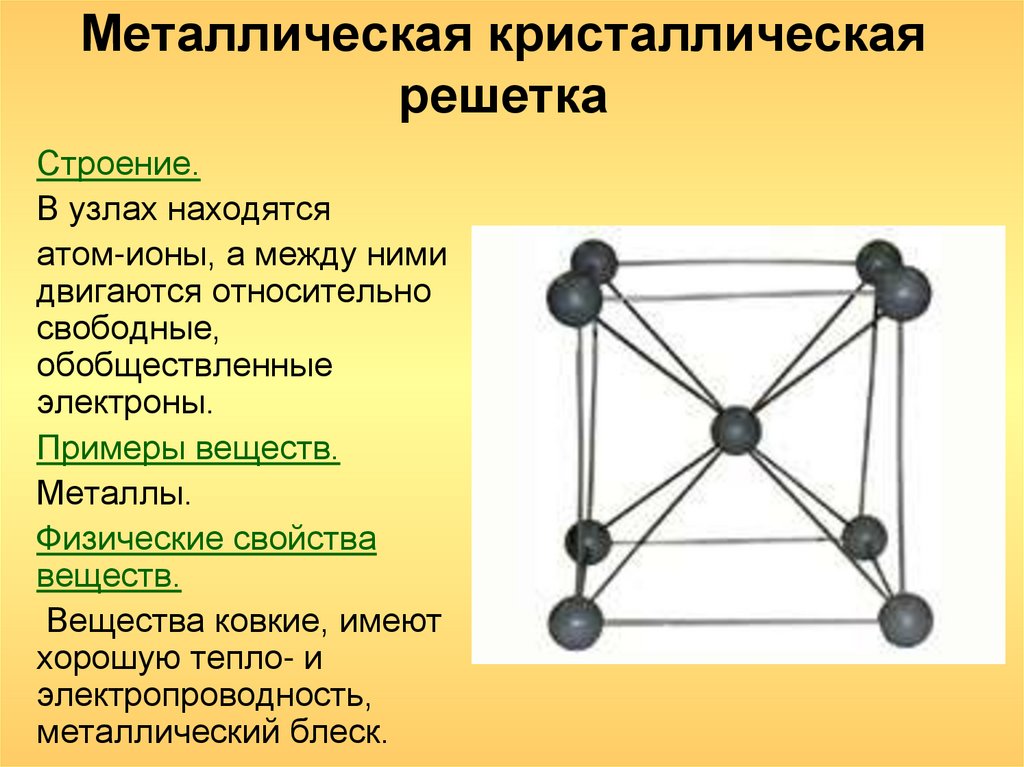 До этого эксперимента ученые могли только догадываться, какова структура внутри кристалла. Сэр Уильям Генри Брэгг и сэр Уильям Генри Брэгг провели точный анализ расположения атомов в кристалле вскоре после работы Лауэ. Определение структуры является необходимым условием для понимания физических и химических свойств материалов. Например, понимание кристаллической структуры полупроводников является основой для изучения их электрических свойств. Теория полупроводников, а также точное управление обработкой полупроводников напрямую привели к рождению компьютерной и информационной революции. Кроме того, структурный анализ малых органических молекул и биомакромолекул с помощью рентгеновской дифракции способствует нашему пониманию трехмерной структуры молекул. В частности, структурное определение биомакромолекул, таких как белки, с помощью технологии рентгеновской дифракции прокладывает возможный путь для ученых к изучению секрета жизни.
До этого эксперимента ученые могли только догадываться, какова структура внутри кристалла. Сэр Уильям Генри Брэгг и сэр Уильям Генри Брэгг провели точный анализ расположения атомов в кристалле вскоре после работы Лауэ. Определение структуры является необходимым условием для понимания физических и химических свойств материалов. Например, понимание кристаллической структуры полупроводников является основой для изучения их электрических свойств. Теория полупроводников, а также точное управление обработкой полупроводников напрямую привели к рождению компьютерной и информационной революции. Кроме того, структурный анализ малых органических молекул и биомакромолекул с помощью рентгеновской дифракции способствует нашему пониманию трехмерной структуры молекул. В частности, структурное определение биомакромолекул, таких как белки, с помощью технологии рентгеновской дифракции прокладывает возможный путь для ученых к изучению секрета жизни.
Верхняя диаграмма: кристаллическая структура кремния.
Корпускулярная теория кристаллов. После того, как Роберт Гук наблюдал под своим микроскопом крошечные кристаллы с гранями правильной формы, он постулировал, что кристаллы состоят из одинаковых сферических корпускул. Упорядоченное расположение этих сфер привело к правильным граням кристаллов. Например, три сферы могут образовывать равнобедренные треугольники, четыре — ромбы, а пять — равнобедренные трапеции. Гук также утверждал, что четыре сферы могут образовывать тетраэдр, но не описывал другие возможные трехмерные структуры. Волластон развил теорию Гука. В статье, опубликованной в 189 г.7 он проанализировал упаковку сферических, эллипсоидальных корпускул и корпускул разного размера (, т.е. структур слева). [Ссылка на рисунок: Hooke, R. Micrographia (1665). Волластон, WH Philos. Транс. Р. Соц. Лонд. 8, 527 (1897)]
Теория кристаллов Гаюи. Гаюи признан отцом современной кристаллографии. Он считает, что кристаллы состоят из упорядоченно расположенных «молекул-интегрантов», и разные кристаллы должны иметь разные «молекулы-интегранты». Интегрантная молекула Гаюи похожа на концепцию элементарной ячейки в кристаллографии. Используя свои законы декремента, он объяснил, почему один и тот же кристалл может иметь разную геометрию. Например, кубический кристалл с кубическими интегрантными молекулами (зеленый цвет на рисунке выше) может быть преобразован в додекаэдрический кристалл с ромбическими гранями. Для этого мы можем добавлять новые слои молекул-интегрантов на каждую поверхность кубического кристалла (серый цвет на рисунке выше), но каждый раз уменьшать по одному ряду молекул с каждой стороны. Если мы просто уменьшим одну молекулу для двух противоположных сторон, а две молекулы для двух других сторон, каждый раз, когда мы накладываем слой интегрантных молекул, кубический кристалл будет трансформироваться в додекаэдрический кристалл с пятиугольными гранями (не ортогональный додекаэдр). На самом деле законы Гаюи были очень продвинуты в то время и тесно связаны с плоскостями решетки в современной кристаллографии. [Ссылка на рисунок: Haüy, RJ Traité de Minéralogie (1801)]
Интегрантная молекула Гаюи похожа на концепцию элементарной ячейки в кристаллографии. Используя свои законы декремента, он объяснил, почему один и тот же кристалл может иметь разную геометрию. Например, кубический кристалл с кубическими интегрантными молекулами (зеленый цвет на рисунке выше) может быть преобразован в додекаэдрический кристалл с ромбическими гранями. Для этого мы можем добавлять новые слои молекул-интегрантов на каждую поверхность кубического кристалла (серый цвет на рисунке выше), но каждый раз уменьшать по одному ряду молекул с каждой стороны. Если мы просто уменьшим одну молекулу для двух противоположных сторон, а две молекулы для двух других сторон, каждый раз, когда мы накладываем слой интегрантных молекул, кубический кристалл будет трансформироваться в додекаэдрический кристалл с пятиугольными гранями (не ортогональный додекаэдр). На самом деле законы Гаюи были очень продвинуты в то время и тесно связаны с плоскостями решетки в современной кристаллографии. [Ссылка на рисунок: Haüy, RJ Traité de Minéralogie (1801)]
Предсказание Барлоу кристаллических структур. Ученые предсказали некоторые возможные кристаллические структуры еще до изобретения метода рентгеновской дифракции. Хорошим примером является серия кристаллических структур, опубликованная Барлоу в 1897 году. Для кристалла, состоящего только из атомов одного типа, он считал все атомы твердыми сферами. В результате кристаллическая структура была эквивалентна плотнейшей упаковке таких твердых сфер. (На самом деле существует два типа плотнейшей упаковки, но на рисунке выше показан только один из них.) Далее Барлоу проанализировал плотнейшую упаковку двух типов сфер и правильно предсказал структуры, подобные NaCl и CsCl. [Ссылка на рисунок: Барлоу, В. Науч. проц. Р. Дублин Soc. 103 , 51 (1897)]
Ученые предсказали некоторые возможные кристаллические структуры еще до изобретения метода рентгеновской дифракции. Хорошим примером является серия кристаллических структур, опубликованная Барлоу в 1897 году. Для кристалла, состоящего только из атомов одного типа, он считал все атомы твердыми сферами. В результате кристаллическая структура была эквивалентна плотнейшей упаковке таких твердых сфер. (На самом деле существует два типа плотнейшей упаковки, но на рисунке выше показан только один из них.) Далее Барлоу проанализировал плотнейшую упаковку двух типов сфер и правильно предсказал структуры, подобные NaCl и CsCl. [Ссылка на рисунок: Барлоу, В. Науч. проц. Р. Дублин Soc. 103 , 51 (1897)]
Эксперимент Лауэ по дифракции кристаллов. В 1912 году, через 17 лет после того, как Рентген открыл рентгеновские лучи, фон Лауэ неожиданно пришла в голову великолепная идея. Он задавался вопросом, будет ли происходить дифракция, когда пучок рентгеновских лучей проходит через кристалл, поскольку характерная длина волны рентгеновского излучения близка к расстоянию между атомами в кристалле. Через пару месяцев он с помощью двух прекрасных экспериментаторов доказал это предположение, и они получили первую фотографию рентгеновской дифракции. Верхнее левое изображение иллюстрирует рентгеновскую дифракционную фотографию сфалерита, сделанную Лауэ и его коллегами в 1912. Эксперимент Лауэ не только подтвердил электромагнитную природу рентгеновского излучения, но и предоставил ученым мощный инструмент для изучения микроскопических структур. Эйнштейн высоко оценил дифракцию рентгеновских лучей как один из величайших физических экспериментов. Благодаря своему большому вкладу в дифракцию рентгеновских лучей Лауэ получил Нобелевскую премию по физике в 1914 году. Хотя эксперимент Лауэ по дифракции рентгеновских лучей вызвал большой интерес в научных кругах, именно У. Х. Брэгг и его сын У. Л. Брэгг успешно объяснили результаты Лауэ и внесли большой вклад в эксперименты по дифракции рентгеновских лучей. Лауэ неправильно интерпретировал дифрагированное рентгеновское излучение как следствие возбуждения, когда падающее рентгеновское излучение взаимодействовало с кристаллом.
Через пару месяцев он с помощью двух прекрасных экспериментаторов доказал это предположение, и они получили первую фотографию рентгеновской дифракции. Верхнее левое изображение иллюстрирует рентгеновскую дифракционную фотографию сфалерита, сделанную Лауэ и его коллегами в 1912. Эксперимент Лауэ не только подтвердил электромагнитную природу рентгеновского излучения, но и предоставил ученым мощный инструмент для изучения микроскопических структур. Эйнштейн высоко оценил дифракцию рентгеновских лучей как один из величайших физических экспериментов. Благодаря своему большому вкладу в дифракцию рентгеновских лучей Лауэ получил Нобелевскую премию по физике в 1914 году. Хотя эксперимент Лауэ по дифракции рентгеновских лучей вызвал большой интерес в научных кругах, именно У. Х. Брэгг и его сын У. Л. Брэгг успешно объяснили результаты Лауэ и внесли большой вклад в эксперименты по дифракции рентгеновских лучей. Лауэ неправильно интерпретировал дифрагированное рентгеновское излучение как следствие возбуждения, когда падающее рентгеновское излучение взаимодействовало с кристаллом. Однако У. Х. Брэгг и У. Л. Брэгг поняли, что дифракция на самом деле была результатом отражения рентгеновских лучей от определенных плоскостей кристалла, и расстояние между этими плоскостями должно удовлетворять знаменитому уравнению Брэгга. По этому принципу меняли конфигурацию аппарата с пропускания на отражение. Таким образом, решение кристаллической структуры, наконец, стало реальностью благодаря их вкладу, и структурный анализ NaCl и алмаза был очень важным результатом в то время. После этого технология дифракции рентгеновских лучей получила быстрое развитие. Теперь ученые могут использовать его для определения структур неорганических материалов, органических молекул, ДНК и белков (далее в этой книге мы увидим соответствующие приложения). Нижний левый рисунок представляет собой иллюстрацию в «Рентгеновских лучах и кристаллической структуре», на которой представлены теоретические положения пятен дифракции Лауэ для кусочка кристалла NaCl. [Ссылка на рисунок: Брэгг, У. Х. и Брэгг, У.
Однако У. Х. Брэгг и У. Л. Брэгг поняли, что дифракция на самом деле была результатом отражения рентгеновских лучей от определенных плоскостей кристалла, и расстояние между этими плоскостями должно удовлетворять знаменитому уравнению Брэгга. По этому принципу меняли конфигурацию аппарата с пропускания на отражение. Таким образом, решение кристаллической структуры, наконец, стало реальностью благодаря их вкладу, и структурный анализ NaCl и алмаза был очень важным результатом в то время. После этого технология дифракции рентгеновских лучей получила быстрое развитие. Теперь ученые могут использовать его для определения структур неорганических материалов, органических молекул, ДНК и белков (далее в этой книге мы увидим соответствующие приложения). Нижний левый рисунок представляет собой иллюстрацию в «Рентгеновских лучах и кристаллической структуре», на которой представлены теоретические положения пятен дифракции Лауэ для кусочка кристалла NaCl. [Ссылка на рисунок: Брэгг, У. Х. и Брэгг, У. Л. Рентгеновские лучи и кристаллическая структура (1915)]
Л. Рентгеновские лучи и кристаллическая структура (1915)]
Дислокация. В кристаллических структурах всегда есть множество дефектов. Введем один тип дефектов — дислокацию, которая включает два основных типа: краевую дислокацию и винтовую дислокацию. Концепция дислокации была впервые предложена Tyler et al. в 1934 г. В 1956 г. Hirsch et al. подтвердил наличие дислокации с помощью просвечивающей электронной микроскопии. Механические свойства металла подвержены дислокациям. При пластической деформации металлов образуются новые дислокации и происходит скольжение дислокаций. Кроме того, винтовые дислокации влияют на рост кристаллов и вызывают спиральную структуру, которую можно наблюдать под микроскопом. [Ссылка на рисунок: Рид, В. Т. Дислокации в кристаллах (1953)]
Квазикристаллы. В 1982 году Д. Шехтман наблюдал дифракционную картину, в которую он с трудом поверил, когда использовал электронную дифракцию для изучения быстрозакаленного сплава Al-Mn (рисунок выше). Пятна были такими же четкими, как дифракционные пятна от кристаллов, но его смущала декагональная симметрия, невозможная для кристаллов. Шехтман сразу понял, что эта картина должна подразумевать совершенно новую твердую структуру, упорядоченную, но не периодическую, и именно поэтому она по-прежнему дает четкие дифракционные картины. Шехтман опубликовал результат в 1984. Ученый назвал этот тип материала «квазикристаллами» и обнаружил его сходство с фигурой Пенроуза (стр. 100). Открытие квазикристаллов вызвало бурные дебаты в научных кругах. Многие ученые, в том числе Л. Полинг, двукратный лауреат Нобелевской премии, отрицали его существование. Он критиковал это за то, что «никаких квазикристаллов, а только квазиученых». Однако открывалось все больше и больше квазикристаллов. В 1992 году Международный союз кристаллографов пересмотрел определение кристаллов и включил в новое определение квазикристалл. В 2011 году Шехтман получил Нобелевскую премию по химии за вклад в квазикристаллы. Создание квазикристалла — типичный пример новой идеи, бросающей вызов старым идеям в истории науки.
Пятна были такими же четкими, как дифракционные пятна от кристаллов, но его смущала декагональная симметрия, невозможная для кристаллов. Шехтман сразу понял, что эта картина должна подразумевать совершенно новую твердую структуру, упорядоченную, но не периодическую, и именно поэтому она по-прежнему дает четкие дифракционные картины. Шехтман опубликовал результат в 1984. Ученый назвал этот тип материала «квазикристаллами» и обнаружил его сходство с фигурой Пенроуза (стр. 100). Открытие квазикристаллов вызвало бурные дебаты в научных кругах. Многие ученые, в том числе Л. Полинг, двукратный лауреат Нобелевской премии, отрицали его существование. Он критиковал это за то, что «никаких квазикристаллов, а только квазиученых». Однако открывалось все больше и больше квазикристаллов. В 1992 году Международный союз кристаллографов пересмотрел определение кристаллов и включил в новое определение квазикристалл. В 2011 году Шехтман получил Нобелевскую премию по химии за вклад в квазикристаллы. Создание квазикристалла — типичный пример новой идеи, бросающей вызов старым идеям в истории науки.


 Довольно твердые нелетучие. Расплавы и растворы проводят электрический ток.
Довольно твердые нелетучие. Расплавы и растворы проводят электрический ток. , летучие, низкая прочность.
, летучие, низкая прочность.