Физические свойства металлов и особенности их кристаллической решетки: Физические свойства металлов и общее применение металлической связи в таблице (9 класс, химия)
alexxlab | 28.02.2023 | 0 | Разное
Кристаллическое строение металлов. Физические свойства металлов
Методическая разработка урока
Пузикова Наталья Ивановна
Цели урока:
Образовательные: организация изучения физических свойств и кристаллического строения металлов, причин особых физических свойств металлов.
Развивающие: формирование умений установления причинно-следственных связей, проведение наблюдений.
Воспитательные: развитие представлений о безграничности познания, продолжение знакомства с категориями диалектики(содержание и форма),их взаимосвязью, формирование интереса к избранной профессии, наблюдательности.
Тип урока: Комбинированный.
Методы:
обучения – диалогический;
преподавания – объяснительно-стимулирующий;
учения – репродуктивный, частично-поисковый.
Оборудование: периодическая система химических элементов, схемы – плакаты: «Влияние деформации на различные кристаллы», «Виды упаковок металлических кристаллов», справочник химика, реактивы:Cu, Fe, Al, Mg, Pb, Na в керосине, вода, химический стакан, пробирки, спиртовка, прибор для определения электропроводности, модели кристаллических решеток, фильм «Общие свойства металлов».
1.Актулизация знаний о строении твердых тел, типах кристаллических решеток.
Самостоятельная работа;
Фронтальная беседа.
2.Формирование новых понятий и способов действия;
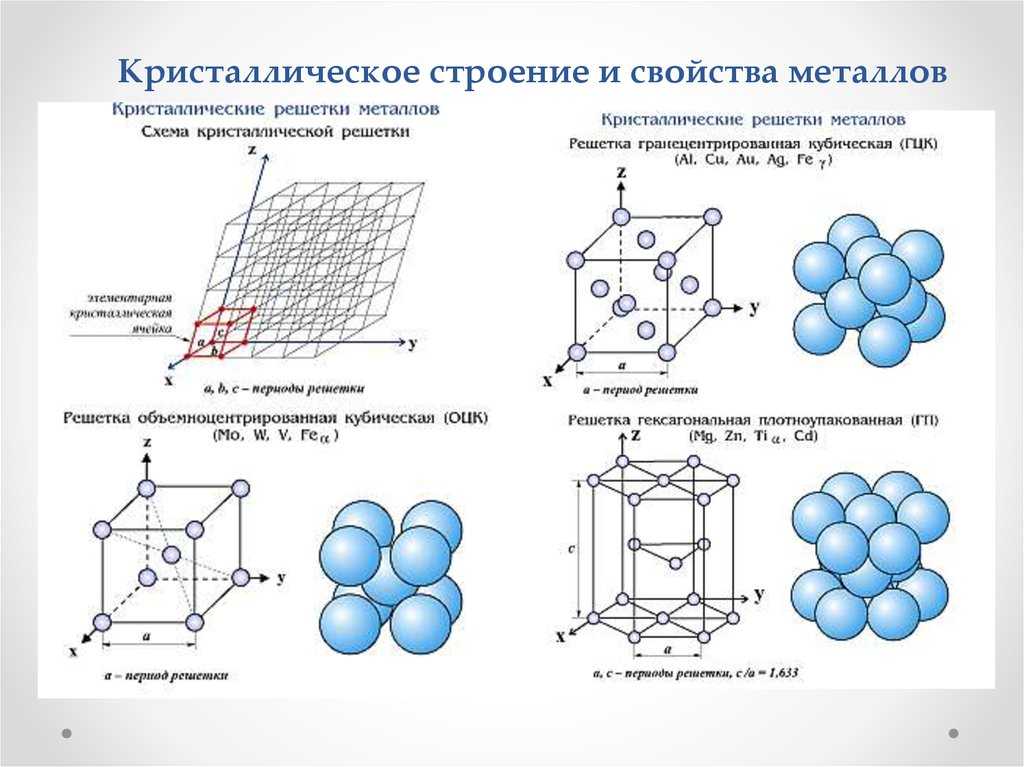
Вновь вводимые понятия – типы упаковок металлических кристаллов: кубическая объемно-центрированная упаковка, кубическая гранецентрированная упаковка, плотнейшая гексагональная упаковка;
Предполагаемые приращения в знаниях – понимание зависимости физических и механических свойств металлов от их кристаллического строения;
Создание проблемной ситуации путем выявления различий в физических свойствах отдельных металлов в ходе эксперимента;
Основная проблема: в чем причина заметного различия физических свойств отдельных металлов.
Способ решения – выводится из строения металлических кристаллов.
3.Формирование умений и навыков при закреплении:
Эвристическая беседа;
Индивидуальные задания с учетом уровня знаний.
4.Задание на дом: Выполнить упр. в тетради, повторить материал по конспекту.
Конспект урока.
1.Актулизация знаний.
Самостоятельная работа на 2 варианта(10-12 мин.)
1 вариант.
1) Ниже приведен порядок распределения электронов по электронным слоям для некоторых элементов:
А)2,8,3. Б)2,8,18,8. В)2,8,14,2. Г)2,8,5. Д)2,7.
Какие из них являются металлами, назовите их.
2)Почему металлы являются проводниками электрического тока?
3)Определите вид химической связи у веществ: O2 ,Ca, Ni, HCl,CO2,H2,Zn.
2 вариант – задания типичные.
Фронтальная беседа по вопросам:
Преподаватель: При изучении новой темы нам понадобятся знания, полученные на уроках физики. Вспомните, на какие группы делятся твердые тела? К какой группе относятся металлы и их сплавы?
2. Изучение нового материала.
Изучение нового материала.
Преподаватель: На столах имеются образцы металлов. Изучите образцы металлов и опишите их физические свойства.
Учащиеся с помощью наводящих вопросов и справочных материалов записывают в тетрадь: твердость, непрозрачность, металлический блеск, проводят электрический ток, тепло, расширяются при нагревании, имеют определенную температуру плавления и кипения и другие.
Преподаватель: Перечислите известные вам механические свойства металлов, одинаковы ли они для всех?
Одинакова электропроводность для металлов?
Создается проблемная ситуация: в чем причина различия физико – механических свойств металлов.
Чтобы ответить на этот вопрос, необходимо знать строение атомов металлов и строение металлических кристаллов.
Преподаватель: Какое влияние оказывает металлическая связь на физико- механические свойства металлов, чем можно объяснить свойство металлов как электропроводность, теплопроводность
Учащиеся: Эти свойства объясняются наличием свободных электронов в металлических кристаллах.
Преподаватель: Запишем в тетрадь вывод «Чем выше концентрация свободных электронов в кристалле металла, тем ярче выражены металлические свойства тепло- и электропроводность.
Затем в совместной беседе учащиеся приходят к следующему выводу «Металлы пластичны, легко деформируются как при холодной, так и особенно при горячей обработке. Причиной пластичности является наличие металлической связи.
Физико – механические свойства металлов определяются:
1.Строением атомов и ионов металла, находящихся в узлах кристаллической решетки, числом свободных электронов, принимающих участие в образовании металлической связи;
2.Типом кристаллической решетки.
3.Закрепление материала.
Очень важно, чтобы учащиеся убедились в практической значимости знаний о свойствах металлов для своей профессии. Закрепление проводится в форме беседы.
Вопрос: Какое значение имеет знание Т плавления металлов.
Ответ: Зная Т пл. металлов, можно выбрать способ изготовления металлических изделий – паяние, сварку, литье. Т пл. определяет области применения легкоплавких и тугоплавких металлов.
Вопрос: Приведите пример, для каких целей необходимо знать теплопроводность металлов.
Ответ: Для правильного выбора металлов при изготовлении режущих инструментов и трущихся деталей машин.
Вопрос: Какое значение имеет знание теплового расширения металлов.
Ответ: Данные о тепловом расширении металлов необходимо знать при проведении работ по горячей ковке и штамповке металлических изделий. Необходимо уметь определять ,насколько изменяются объемные и линейные размеры детали при ее нагревании и охлаждении.
Вопрос: Какое значение имеет знание электропроводности.
Ответ: Зная электропроводность металлов, можно определить выбор их для передачи электроэнергии.
Вопрос: Какое значение имеет знание твердости металлов.
Ответ: Твердость металлов влияет на их обработку. От степени твердости зависит выбор металла для изготовления деталей машин и в особенности инструментов.
Вопрос: Какие свойства металлов называются технологическими. Какое значение имеет их знание для практической деятельности.
Ответ: Технологические свойства металлов представляют собой совокупность физических и механических свойств, которые определяют поведение металлов в процессе обработки.
4.Задание на дом – см. план урока.
Физические свойства металлов.
 9 класс | Методическая разработка по химии (9 класс) на тему:
9 класс | Методическая разработка по химии (9 класс) на тему:Тема урока. « Физические свойства металлов» 9 класс
Учитель химии Иванова Вера Александровна
Цели: сформировать у учащихся представление об особенностях строения атомов металлов, их общих физических свойств и зависимости свойств от типа кристаллической решетки
Задачи:
Образовательные: обобщить сведения о металлической химической связи, и кристаллической решетки металлов,
сформировать представления о характере физических свойств
Развивающие: способность к формированию анализировать, работать с таблицами, текстом,наблюдать, делать выводы
Воспитательные: активизировать познавательную деятельность учащихся, самостоятельность, инициативу
Оборудование: коллекция образцов металлов, таблицы, содержащие материалы по физическим свойствам металлов, карточки с заданиями, периодическая система химических элементов Д.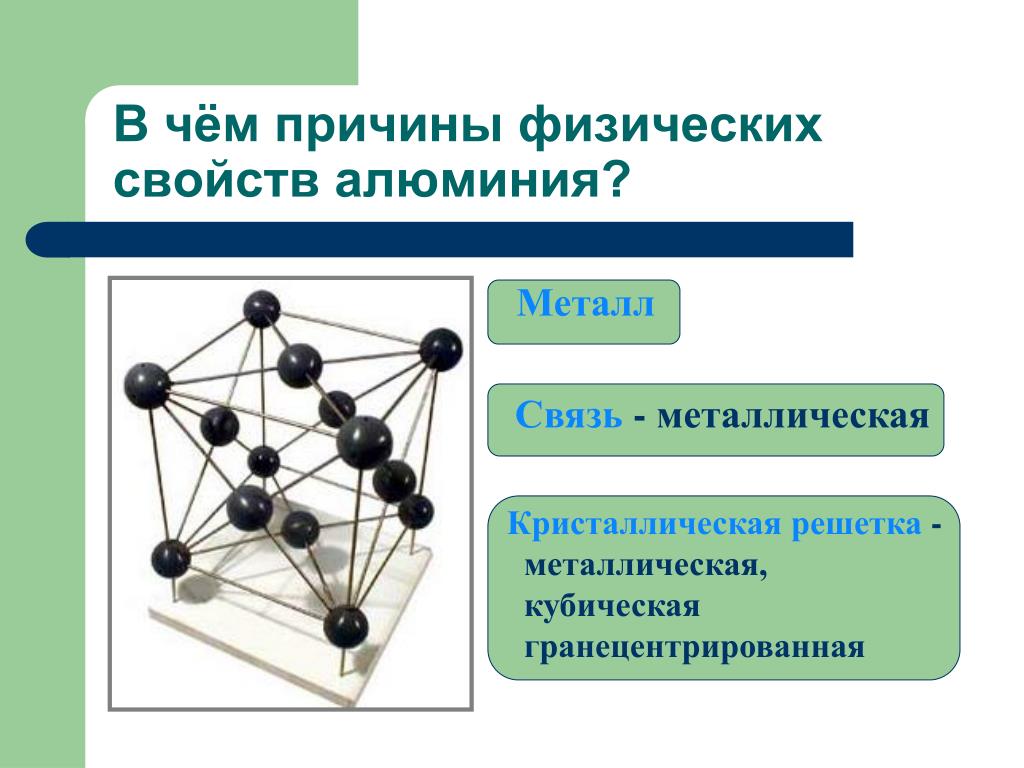 И. Менделеева
И. Менделеева
Формы работы: индивидуальная, парная работа
Тип урока: изучение нового материала
Девиз урока « Прежде всего и как можно внимательнее изучайте химию! Это удивительная наука! Её пронизывающий смелый взгляд проникает в темень земной коры» М. Горький.
Ход урока:
1. Организационный момент
Без каких веществ немыслима современная цивилизация?
Действительно, металлы играют важную роль в жизни человека.
Слово металл в переводе означает шахта, рудник. В земной коре находятся большие запасы металлических и полиметаллических руд, которые используют для получения металлов.
2. Актуализация знаний
Прежде, чем перейти к изучению нового материала, выясним, что мы уже знаем о металлах.
1. Где расположены металлы в периодической системе элементов
2. Как изменяется радиус атомов металлов в группах, в периодах
3. Как изменяются металлические свойства в группах, периодах
4. Каковы особенности строения металлов?
3. Объяснение нового материала
Объяснение нового материала
Учитель.
О природе металлической химической связи рассматривалось ранее в курсе 8 класса.
Какова природа металлической связи?
Каковы особенности кристаллической металлической решетки?
Составить схему металлической кристаллической решетки на доске.
В узлах кристаллической решетки расположены как нейтральные атомы так и катионы металлов, связанные посредством обобществленных электронов (их также называют электронным газом), принадлежащих всему кристаллу. Эти электроны свободно перемещаются по всему и притягивают катионы металлов, которые находятся в узлах кристаллической решетки, обеспечивая ее устойчивость.
Таким образом, металлическая связь – это связь, которая возникает в кристаллах в результате электростатического взаимодействия положительно заряженных ионов металла отрицательно заряженных свободных электронов. Металлическая связь характерна для металлов и их сплавов.
Что мы понимаем под физическими свойствами вещества?
Чем обусловлены физические свойства?
– Важнейшие физические свойства металлов, обусловлены природой металлической связи, строением кристаллической решетки. .
.
Рассмотрим коллекцию образцов металлов. Работа учащихся с образцами металлов.
1. Установите цвет, прозрачность
2. Как выражена способность отражать свет?
3. Как реагируют образцы металлов на действие магнита?
4. Какие физические свойства характерны для металлов?
Назовите общие физические свойства металлов.
Учащиеся отмечают: металлический блеск, твердость, пластичность, электро- и теплопроводность.
Учащиеся изучают таблицу физических свойств металлов, затем, используя данные таблицы отвечают на вопросы и записывают в тетради
Физические свойства металлов
Металл | Хим. | Плотн. | t плав. | Твердость по Моосу |
Алюминий | Al | 2,70 | 660 | 2,9 |
Вольфрам | W | 19,30 | 3400 | 4. |
Железо | Fe | 7,87 | 1540 | 4,5 |
Золото | Au | 19,30 | 1063 | 2,5 |
Медь | Cu | 8,92 | 1083 | 3,0 |
Магний | Mg | 1.7 | 651 | 2,0 |
Ртуть | Hg | 13,50 | – 39 | – |
Свинец | Pb | 11,34 | 327 | 3,9 |
Серебро | Ag | 10,49 | 960,5 | 2,7 |
Титан | Ti | 4,52 | 1670 | 7,3 |
Хром | Cr | 7,19 | 1900 | 9,0 |
Цинк | Zn | 7,14 | 419,5 | 2,5 |
Учащиеся записывают физические свойства в тетрадь, приводят примеры.
Плотность. По плотности металлы делятся на две группы:
легкие, плотность не более 5 г/см3 –
тяжелые, плотность более 5 г/см3 –
Самый легкий – литий, плотность 0,53 г/см3 , самый тяжелый – осмий, плотность 22,6 г/см3
Температура. Металлы в зависимости от температуры плавления подразделяют:
легкоплавкие, температура плавления не выше 1000 °С –
тугоплавкие, температура плавления выше 1000 °С –
Самый легкоплавкий металл – ртуть t = -39°С , самый тугоплавкий – вольфрам
t = 3340 °С
Твердость. Твердость металлов сравнивают с твердостью алмаза и делят на группы:
мягкие –
твердые –
самый твердый металл – хром, царапает стекло, самые мягкие – щелочные металлы, которые режутся ножом
Электропроводность. Электрическая проводимость объясняется присутствием свободных электронов, под действием приложенного электрического напряжения, хаотично движущиеся электроны, в металле приобретают направленное движение, возникает электрический ток.
Высокую электропроводность имеют – серебро, медь, золото, алюминий.
Низкую электропроводность имеют – ртуть, свинец, вольфрам
Теплопроводность. Показатель теплопроводности металлов, как правило, совпадает с показателем электропроводности.
Металлический блеск. Металлы способны отражать световые волны, магний и алюминий способны сохранять металлический блеск даже в порошке.
Цвет – большинство металлов имеет серебристый цвет, исключение золото- желтый, медь – красно-желтый.
Пластичность. Пластичность – способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
Магнитные свойства. Магнитные свойства определяются способностью металлов притягиваются к внешнему магнитному полю и сохранять способность намагничиваться. Наиболее сильными магнитными свойствами обладают: железо, никель, кобальт. Эти металлы называются ферромагнитными (от латинского слова феррум – железо).
4.Закрепление знаний
Учащиеся получают карточки с заданиями и отвечают на поставленные вопросы.
Карточки заданий.
Инструкция к тесту: выбрать один правильный ответ
Вариант 1
Задание | ответы |
1. Выбрать группу элементов, которая содержит только металлы | A) Ba Mg B Fe Б) Ca Al Mn Cl B) Na Zn Pb Li |
2,Указать общее в строении Са и Ва | А) 1 электрон на последнем электронном уровне Б) одинаковое число электронных уровней В) 2 электрона на последнем электронном уровне |
3.Для металлов 2А группы не характерно | А) степень окисления в соединениях -2 Б) степень окисления в соединениях +2 В) общая формула высшего оксида RO |
4. | A) калий Б) алюминий В) железо |
5. К активным металлам относятся | А) K AL Pb Sn Б) Ba Na Ca Li B) Cu Ag Ca Fe |
6.Наимение активные металлы из перечисленных | А) Pb Ag Cu Б) Ca Sr Ba В) Cs Mg K |
Вариант 2
Задание | ответы |
1. Выбрать группу элементов, которая содержит только металлы | A) Cu K Mg C B) Ba Zn Pb Li Б) Na Mn Br Fe |
2,Указать общее в строении Li и K | А) 1 электрон на последнем электронном уровне Б) одинаковое число электронных уровней В) 2 электрона на последнем электронном уровне |
3. | А) степень окисления в соединениях -1 Б) степень окисления в соединениях +1 В) общая формула высшего оксида R2O |
4.Металлические свойства у кальция проявляются, слабее чем | A) калий Б) литий В) железо |
5. К активным металлам относятся | А) Cu Ag Ca Fe Б) Mg K Ba Ca B) Pb Li Zn Sn |
6.К малоактивным металлам относят | А) Hg Ag Cu Б) Ca Sr Ba В) Cs Mg K |
5.Подведение итогов урока
Учитель:
Что нового узнали о физических свойствах металлов?
Как можно объяснить наличие общих физических свойств у такого большого числа простых веществ?
6.Домашнее задание
Подготовить сообщения о роли металлов в нашей жизни.
Структура металлов и сплавов: свойства и примеры
Подсчитано, что ежегодно выбрасываются или теряются пенни на сумму 62 миллиона долларов. Хотя в целом это много, потеря 2 или 3 центов здесь или там не имеет значения для большинства людей. На самом деле, люди пытаются помешать монетному двору производить их, так как мы теряем 70 миллионов долларов в год, производя их. Материал, используемый в копейках, стоит больше, чем сама копейка!
Первоначально монеты изготавливались только из меди, но позже стали изготавливаться из медно-цинкового сплава сплав из-за роста стоимости меди. В этой статье мы узнаем о сплавах, металлах и их структуре.
- Эта статья о структуре металлов и сплавов
- Сначала мы рассмотрим основы металлов и определим сплавов
- Далее мы рассмотрим основную структуру и свойства металлов и сплавов
- Затем мы рассмотрим состав и структуру сплавов
- Мы также рассмотрим атомную структуру каждого
- Наконец, мы рассмотрим три типа кристаллических структур, которые могут быть образованы, и то, как они образуют зернистую структуру .

Введение в металлы и сплавы
Существует три типа элементов:
- металлоиды
- металлы
- неметаллы.
Периодическая таблица, отсортированная по типу элемента. Достояние Викимедиа.
Как вы увидите розовым, существует много металлов, которые сгруппированы на основе общих свойств (которые мы обсудим позже).
Металлы могут образовывать сплавов .
Сплав представляет собой смесь двух или более металлов или смесь металла и неметалла.
Существует два типа сплавов: 1. Сплавы замещения 2. Сплавы внедрения В сплаве замещения некоторые атомы металла замещены атомами другого элемента аналогичного размера. В сплаве внедрения более мелкие атомы другого элемента заполняют «пробелы» в структуре металла.
Структура и свойства металлов и сплавов
Металлы отличаются своими уникальными характеристиками. К ним относятся:
- Высокая температура плавления
- Хорошие проводники тепла и электричества
- Пластичный (легко сгибается/формируется)
- Пластичный (может легко растягиваться без поломки)
- Высокая плотность
вы можете предположить что сплавы имеют характеристики отдельных металлов, из которых они сделаны, вы ошибаетесь. Обычно мы создаем сплавы, чтобы «максимизировать» определенные характеристики. Различия между металлами и сплавами: ~Тверже, чем металлы-компоненты ~Более устойчивы к коррозии, чем чистые металлы~Точка плавления ниже, чем у металлов-компонентов полезнее, чем чистые металлы. Например, сталь (железо + углерод) — распространенный сплав, используемый в строительных материалах. Это имеет смысл, поскольку он может выдерживать больший вес, менее подвержен коррозии и ему легче придать форму, чем железу.
Обычно мы создаем сплавы, чтобы «максимизировать» определенные характеристики. Различия между металлами и сплавами: ~Тверже, чем металлы-компоненты ~Более устойчивы к коррозии, чем чистые металлы~Точка плавления ниже, чем у металлов-компонентов полезнее, чем чистые металлы. Например, сталь (железо + углерод) — распространенный сплав, используемый в строительных материалах. Это имеет смысл, поскольку он может выдерживать больший вес, менее подвержен коррозии и ему легче придать форму, чем железу.
Состав и структура металлических сплавов
Общая структура металлического сплава зависит от его состава. Сплавы могут иметь разное соотношение металлов и могут содержать несколько металлов. Вот таблица с некоторыми распространенными сплавами и их составами.
| Название сплава | Состав | Пример использования | |
| Амальгама | Ртуть (45-55%), остальное (45-55%), медь, цинк, олово, серебро, цинк 55%: и серебро0085 | Стоматологические опилки | |
| Латунь | Медь (65-90%), цинк (10-35%) | Дверные ручки и замки | |
| Бронза 9085-95 % -22%), остаток %: марганец, фосфор, алюминий или кремний | Статуи | ||
| Чугун | Железо (96-98%), углерод (2-4%), остаток %: кремний | Посуда | |
| Пушечная бронза | Медь (80-90%), олово (3-10%), цинк (2-3%), остальное %: фосфор | Ружья | |
| Олово | Олово (80-99%), остальное %: медь, свинец, сурьма | Декоративные элементы | |
| Нержавеющая сталь | Железо (>0085 | %), остальные %: углерод, никель, марганец, молибден и другие металлы. | Ювелирные изделия |
| Серебро | Серебро (92,5%), медь (7,5%) | Медицинские инструменты |
Атомная структура металлов и сплавов
Атомная структура металла довольно проста:
Структура чистого металла. Исследуй умнее Оригинал.
Атомы аккуратно выровнены и имеют одинаковый размер. Они не обязательно должны быть прямоугольной формы, но всегда расположены на равном расстоянии друг от друга и относительно близко друг к другу.
Сплавы разные. Атомная структура зависит от типа сплава: замещения или внедрения.
Вот как выглядит замещающий сплав:
Структура сплава замещения. StudySmarter Original
Как следует из названия, атомы одного металла заменяются атомами другого. Эти новые атомы по размеру аналогичны атомам других металлов.
Далее идут сплавы внедрения:
Структура сплава внедрения. Исследуй умнее Оригинал.
В сплаве внедрения атомы второго металла намного меньше атомов чистого исходного металла. Эти более мелкие атомы помещаются в «дыры» исходной структуры.
Эти более мелкие атомы помещаются в «дыры» исходной структуры.
Эти типы сплавов можно комбинировать, поэтому сплав может иметь структуру, представляющую собой комбинацию двух показанных выше.
Кристаллическая структура металлов и сплавов
Металлы и сплавы обычно имеют кристаллическую структуру. Существуют три основные структуры, которые может иметь кристалл:
- Объемно-центрированная кубическая (ОЦК)
- Гексагональная закрытоупакованная (ГПУ)
- Кубическая закрытоупакованная (ЗЦК)/гранецентрированная кубическая (ГЦК)
Когда мы посмотрите на эти структуры, мы часто ссылаемся на элементарная ячейка .
Элементарная ячейка — это наименьшая часть решетки, которая показывает трехмерную структуру всего кристалла.
По сути, кристалл — это одна и та же элементарная ячейка, повторяющаяся несколько раз.
Эти конструкции образуют металлы и сплавы, так как они наиболее эффективно заполняют пространство.
Первый тип кристалла представляет собой ОЦК-структуру, показанную ниже:
Объемно-центрированная кубическая элементарная ячейка и цельная структура. Исследуй умнее Оригинал.
Общая форма — куб с атомом в каждом углу. В центре «тела» есть еще один атом, отсюда и название.
Далее у нас есть структура ГПУ:
Гексагональная закрыто-упакованная структура и элементарная ячейка. Исследуй умнее Оригинал.
Элементарная ячейка для этого типа намного сложнее. Верхняя и нижняя грани структуры представляют собой шестиугольники с атомом в каждой точке и в центре. В центре клетки находится треугольная форма с атомом в каждой точке.
Наконец, у нас есть структура ccp/fcc:
Кубическая закрыто-упакованная/гранецентрированная кубическая элементарная ячейка и структура. Исследуй умнее Оригинал.
Как и в случае со структурой bcc, основной формой является куб. В каждом углу есть атом и по одному атому в центре каждой грани.
Зернистая структура металлов и сплавов
Отдельные кристаллические структуры группируются вместе, образуя зерен . Эти зерна объединяются, чтобы сформировать зернистую структуру , которую можно рассмотреть в микроскоп. На изображении ниже показана структура зерна нержавеющей стали.
Эти зерна объединяются, чтобы сформировать зернистую структуру , которую можно рассмотреть в микроскоп. На изображении ниже показана структура зерна нержавеющей стали.
Зернистая структура нержавеющей стали под микроскопом. Достояние Викимедиа.
Размер и ориентация зерен зависят от:
- Состав (сплав)
- Химические воздействия (например, коррозия)
- Физические воздействия (например, тепло)
- Механические воздействия (из-за процесса формования, например ковка)
Сами зерна образуются при затвердевании расплавленного материала. Структура зерна адаптирована для применения металлического сплава. Например, структура зерна медно-никелевого сплава устроена таким образом, что металл можно прессовать для изготовления пятицентовых монет.
Глядя на зернистую структуру (также называемую микроструктурой ), можно определить такие свойства материала, как прочность, твердость и пластичность.
Структура металлов и сплавов. Ключевые выводы
- Сплав представляет собой смесь двух или более металлов или смесь металла и неметалла.
- Существует два типа сплавов: 1. Сплавы замещения 2. Сплавы внедрения
- Различия между металлами и сплавами: ~Тверже, чем составные металлы. чем металлы компонентов ~Более долговечны, чем металлы компонентов ~Менее проводимость, чем металлы компонентов
- В сплаве замещения атомы одного металла заменяют некоторые атомы другого. В сплаве внедрения атомы одного металла помещаются в щели в структуре металла.
- Существуют три основные структуры, которые может иметь кристалл:
- объемно-центрированная кубическая (ОЦК)
- гексагональная плотноупакованная (ГЦК)
- кубическая плотноупакованная (кубическая кубическая)/гранецентрированная кубическая (гцк)
- Элементарная ячейка — это наименьшая часть решетки, которая показывает трехмерную структуру всего кристалла.

- Кристаллические структуры объединяются в зерна, которые образуют зернистую структуру. Эта структура изменяется в зависимости от использования металла или сплава.
Кристалл | Определение, типы, структура и факты
кристалл
Посмотреть все средства массовой информации
- Ключевые люди:
- Николаус Стено Ральф Уолтер Грейстоун Вайкофф Макс фон Лауэ Жорж Фридель Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический плеохроизм двойное преломление симметрия полиморфизм
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Узнайте, как форма кристаллов определяет различные минералы в семейства
Посмотреть все видео к этой статье
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела – это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы.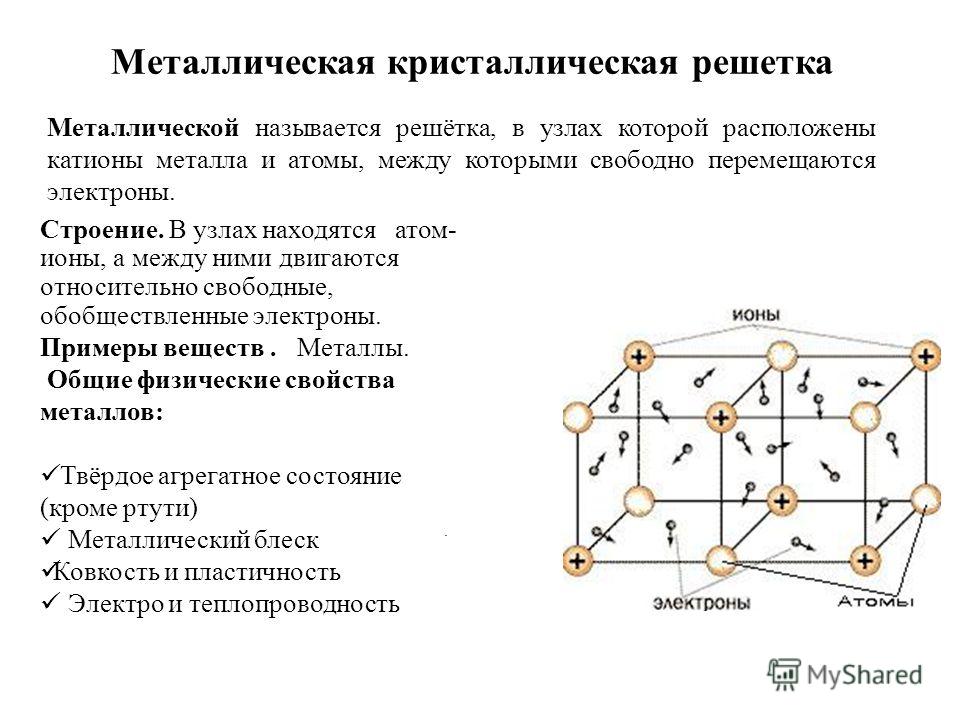 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе. Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.
Викторина “Британника”
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами.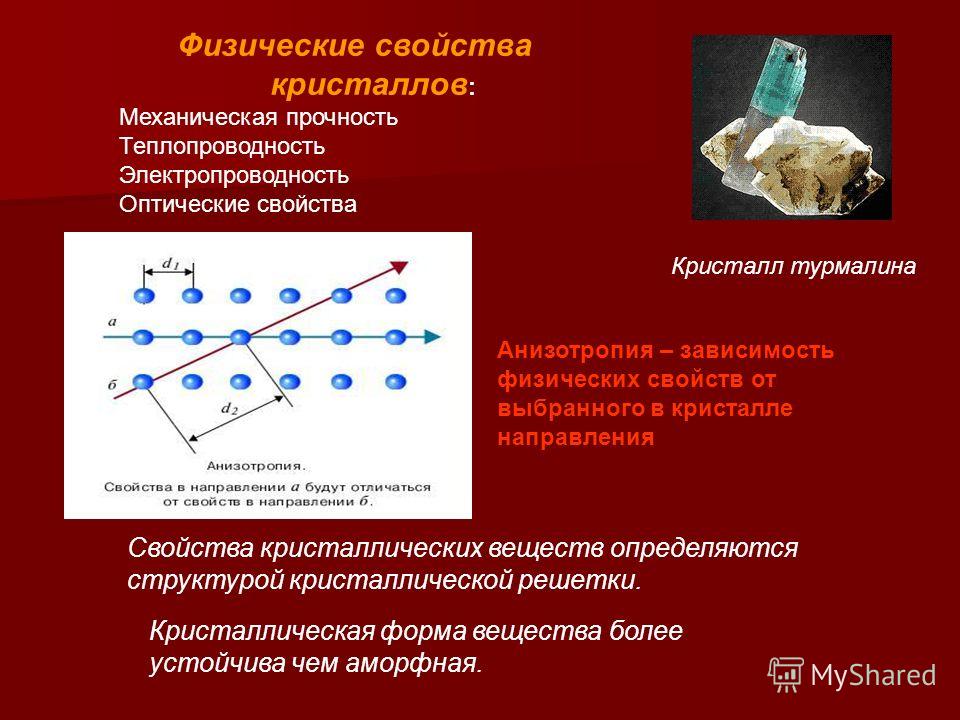 Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние оказывается стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей меняются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества.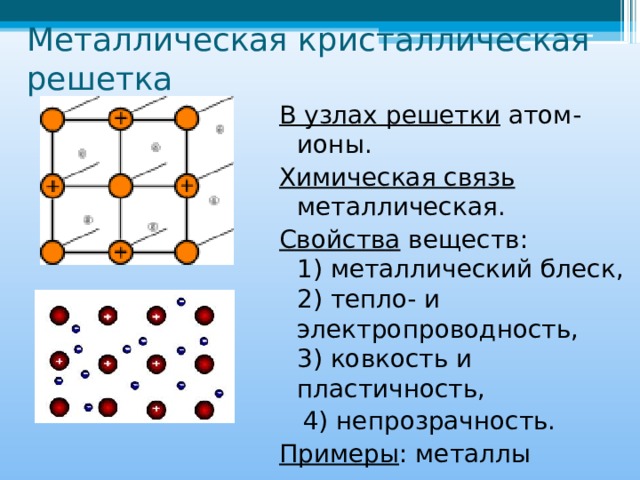


 5
5 Металлические свойства у лития проявляются, слабее чем
Металлические свойства у лития проявляются, слабее чем.jpg) Для металлов 1А группы не характерно
Для металлов 1А группы не характерно
